新鲜蔬菜富含多种营养成分,但由于蔬菜具有季节限制性,且采收后因其贮藏不当、微生物污染和自然损耗等易造成非必要的浪费和经济损失[1]。发酵蔬菜即是一种有效的蔬菜保藏方式,也是全球性的传统发酵食品,其是中国饮食中重要的调味品之一,富含维生素、类胡萝卜素和类黄酮类物质等多种营养成分[2-3],具有提高食欲、抗氧化、防止脂肪堆积和降低血脂水平等保健功效[4-5]。
目前,发酵辣椒有传统自然发酵、高盐腌制和接种发酵三种生产方法。传统自然发酵生产规模难以扩大,且产品质量得不到保障,不能满足日益增长的消费需求[6-7];高盐腌制辣椒发酵不充分,发酵风味不佳,脱盐处理造成大量的营养成分损失,并导致环境污染[8-9],且高食盐含量食品不利于人体健康[10];接种发酵可以稳定产品质量、明显缩短发酵时间[11-12],接种发酵又可分为单一菌种发酵与混和菌种发酵。单一菌种发酵因其仅利用一种微生物发酵,其代谢产物、风味和营养物质也相对有限,导致发酵辣椒的风味和营养成分与自然发酵辣椒差距甚远。相对而言,混和菌种发酵具有明显的优势,可以充分利用不同微生物之间的协同作用,产生更丰富多样的代谢产物和风味物质[13-14],不仅增加了发酵辣椒的口感和香气,还能提供更全面的营养价值。史婷等[15]采用发酵乳杆菌(Lactobacillus fermentium)、嗜酸乳杆菌(Lactobacillus acidophilus)、植物乳植杆菌(Lactiplantibacillus plantarum)3株菌混合发酵辣椒可显著增加总酸、可溶性蛋白、可溶性固形物及总酚含量和香气成分的种类和含量。乳酸菌是辣椒发酵过程的主要微生物[16-17],有研究表明,乳酸菌在提升辣椒品质和安全方面的作用尤为突出[18-19],并且乳酸菌还具有脱臭、抗击癌细胞和改善肠胃微生物菌群等功能[20]。在辣椒加工过程中,乳酸菌的生长及其代谢产物对发酵辣椒品质有着重要影响。但目前,辣椒发酵加工产业中开发的复合专用发酵剂较少、且关于乳酸菌的研究多集中于单一菌株的功效评价,对乳酸菌相互作用、协同增效的研究较少。
为提升发酵辣椒品质,本研究从传统发酵蔬菜中分离筛选优良的产酸、产氨基酸态氮、降亚硝酸盐和产香乳酸菌,并通过16S rDNA序列分析进行菌种鉴定。通过研究筛选菌株的拮抗性和共生性构建混合发酵菌群,并进行辣椒发酵验证。以期开发辣椒专用发酵剂,为生产安全、风味优良和营养丰富的高品质发酵辣椒提供菌种资源和研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
辣椒、藠头、萝卜、红萝卜、芥菜等传统发酵蔬菜样品:采集自湖南不同地市;金黄色葡萄球菌(Staphylococcus aureus)、铜绿假单胞菌(Pseudomonas aeruginosa)、李斯特菌(Listeria monocytogenes)、蜡样芽孢杆菌(Bacillus cereus)和鼠伤寒沙门氏菌(Salmonella typhimurium):美国典型培养物保藏中心;大肠杆菌(Escherichia coli):中国普通微生物菌种保藏管理中心。
1.1.2 培养基
MRS肉汤培养基、MRS固体培养基、LB肉汤培养基、LB固体培养基:广东环凯微生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、琼脂糖(分析纯):北京索莱宝科技有限公司;Dream Taq Green聚合酶链式反应(polymerase chain reaction,PCR)Master Mix:赛默飞世尔科技有限公司;乙偶姻标准品、亚硝酸盐标准品(均为分析纯):上海阿拉丁生化科技股份有限公司;氢氧化钠、肌酸、萘酚、亚铁氰化钾、对氨基苯磺酸、乙酸锌、盐酸萘乙二胺、硼砂和酚酞等(均为分析纯):国药集团化学试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Bante920 pH计:上海般特仪器制造有限公司;SPL250生化培养箱:天津市莱玻特瑞仪器设备有限公司;Heraeus MultifugeX1R高速冷冻离心机:赛默飞世尔科技有限公司;SQ810C自动高压蒸汽灭菌器:重庆雅玛拓科技有限公司;HCB-1300V超净工作台:青岛海尔生物医疗股份有限公司;UV-1801紫外/可见光分光光度计:北京北分瑞利分析仪器有限责任公司;Tecan Spark多功能酶标仪:西安纵横仪器科技有限公司;MNT-150游标卡尺:上海美耐特实业有限公司;78-2双向磁力搅拌器:常州华普教学仪器有限公司。
1.3 方法
1.3.1 发酵蔬菜中乳酸菌的分离
参照赵海霞等[21]的方法分离发酵蔬菜中的乳酸菌,稍有改动。发酵蔬菜用无菌生理盐水按10倍梯度稀释至10-5,分别吸取10-3、10-4和10-5梯度稀释液100 μL涂布于含1%碳酸钙的MRS固体培养基平板上,37 ℃条件下静置培养48 h。挑取具有明显溶钙圈的单菌落,反复划线纯化,直至镜检视野下菌株形态一致,从而得到纯化的菌株,经形态学观察和生理生化试验(革兰氏染色、过氧化氢酶、溶血性和生物胺)[22-24]筛选出与乳酸菌形态学及生化特性一致的菌株。将纯化后的乳酸菌菌株接种至MRS肉汤培养基中,37 ℃条件下静置培养18 h后,与40%甘油以1∶1(V/V)混合,放置于-80 ℃冰箱保藏备用。
1.3.2 优良乳酸菌的筛选
初筛:将分离得到的乳酸菌菌株接种至MRS肉汤培养基中,37 ℃条件下发酵24 h。通过测定发酵液的pH值考察产酸情况,选择pH值<3.8的菌株;采用感官嗅闻法考察菌株的产香情况;通过测定氨基酸态氮含量考察菌株的产鲜的情况,选择氨基酸态氮含量>0.25 g/100 mL的菌株。将分离得到的乳酸菌菌株接种至含有200 μg/mL亚硝酸钠的MRS肉汤培养基中,37 ℃条件下发酵24 h,采用盐酸萘乙二胺法考察亚硫酸盐残留情况[25]。
复筛:取超低温冰箱中甘油保存的分离乳酸菌菌株,解冻后,按1%(V/V)的接种量接种于MRS肉汤培养基中,混匀,静置于厌氧培养箱中,在37 ℃条件下培养18 h得到1代活化菌液,重复活化至3代备用。将活化好的菌株以1%(V/V)的接种量接种于含有2%、4%、6%、8%、10%无碘食盐的MRS肉汤培养基中,37 ℃静置培养48 h,测定发酵液中总酸、氨基酸态氮含量及乙偶姻含量;将活化好的菌株以1%(V/V)的接种量接种于含有2%、4%、6%、8%、10%无碘食盐的MRS肉汤培养基中,加入200 μg/mL亚硝酸钠,37 ℃静置培养48 h,测定菌株的亚硝酸盐降解率;评价菌株的产酸、产氨基酸态氮、降解亚硝酸盐及产香能力。
1.3.3 乳酸菌的鉴定[26]
使用细菌基因组DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板,采用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rDNA基因序列。PCR扩增体系:Mix预混液25 μL、引物27F和1492R各2 μL、基因组DNA模板1 μL和双蒸馏水(ddH2O)20 μL。PCR扩增条件:98 ℃预变性2 min;98 ℃变性10 s、57 ℃退火10 s、72 ℃延伸30 s,共35个循环;72 ℃再延伸5 min。使用1%琼脂糖凝胶对PCR扩增产物进行电泳检测,将检测合格的PCR扩增产物委托武汉自然之力生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA-X-10.1.8软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.4 乳酸菌菌株拮抗性及共生性分析
拮抗性:将活化好的乳酸菌菌株接种至MRS固体培养基中,37 ℃静置培养24 h,采用牛津杯平板扩散法进行拮抗性试验[27]。
共生性:将活化好的乳酸菌菌株接种于MRS肉汤培养基中,单独培养时乳酸菌接种量为2%(V/V),混合培养时,各菌株以相同比例接种,总接种量为2%(V/V),37 ℃静置培养24 h。培养结束后,分别取2 mL单独培养的乳酸菌培养液和混合培养的乳酸菌培养液测定OD600nm值;单独培养后,取1 mL各单独培养的乳酸菌培养液混合,然后取2 mL混合培养液测OD600nm值。
1.3.5 乳酸菌菌株生长曲线的绘制
采用比浊法绘制菌株的生长曲线[28],将活化好的乳酸菌菌株分别以1%(V/V)的接种量接种至MRS肉汤培养基中,混合培养时,各菌株以相同的比例,总接种量为1%(V/V)接种至MRS肉汤培养基中,37 ℃静置培养,每隔1 h取适量菌液测定OD600 nm值,以培养时间(x)为横坐标,OD600 nm值(y)为纵坐标,绘制生长曲线。
1.3.6 乳酸菌混合培养时各菌种相对丰度的测定
将活化后的4株乳酸菌菌株以相同的比例,总接种量为1%接种至MRS肉汤培养基中,37 ℃混合培养24 h,分别在培养0、4 h、8 h、16 h和24 h时取样。按照细菌基因组DNA提取试剂盒提取不同培养时间的样本DNA,利用带Barcode的特异性引物对16S rDNA全长进行PCR扩增[29],PCR扩增产物经1%琼脂糖电泳检测后切胶回收,委托上海美吉生物医药科技有限公司的PacBio平台进行测序。测序完成后,利用自带SMRTLINK软件获取CCS序列,对获得的CCS序列过滤长度和去除嵌合体,最后,通过序列间比对确定发酵剂配伍菌种的相对丰度。
1.3.7 乳酸菌对食源性致病菌抑菌能力的测定
采用牛津杯平板扩散法测定乳酸菌菌株的抑菌活性[30]。指示菌为大肠杆菌、鼠伤寒沙门氏菌、李斯特菌、金黄色葡萄球菌、蜡样芽孢杆菌和铜绿假单胞菌。将培养好的指示菌液和灭菌冷却到45 ℃左右的LB固体培养基混匀(指示菌终浓度为1.0×106 CFU/mL)后倒平板,冷却凝固,向牛津杯孔中加入200 μL待测菌株菌悬液,并以MRS肉汤培养基作为空白对照。将平板放置4 ℃冰箱中扩散2 h,转移到37 ℃恒温培养箱中培养24 h,采用游标卡尺测定牛津杯周围抑菌圈直径。
1.3.8 乳酸菌混合发酵辣椒接种比例的确定
将菌株H3D、206、T244和T216分别接种于MRS液体培养基中,37 ℃静置培养24 h,发酵液在8 000 r/min条件下离心10 min,弃上清液,加入生理盐水洗涤沉淀3次,再加生理盐水溶解摇匀,使制得菌悬液菌浓度达到109 CFU/mL,即为种子液。将菌株H3D、206、T244和T216的种子液分别按1∶1∶1∶1、1∶2∶1∶2、1∶2∶2∶1、1∶1∶1∶2、1∶1∶2∶2、1∶2∶1∶1、1∶2∶2∶2、1∶2∶2∶3、1∶2∶3∶1、2∶1∶2∶1、2∶2∶3∶1和2∶1∶1∶1不同比例进行组合。将新鲜辣椒去柄去蒂、洗净、晾干切分,加入8%的食盐,接种1%的混合乳酸菌,室温发酵7 d[31],发酵结束后,分别测定不同比例乳酸菌发酵辣椒中的总酸和氨基酸态氮含量,并进行感官评价,综合总酸、氨基酸态氮含量及感官评分确定最佳接种比例。
1.3.9 混合乳酸菌发酵辣椒品质分析
以自然发酵辣椒作为对照组,按照混合乳酸菌最佳接种比例接种发酵辣椒,发酵结束后,测定发酵辣椒中的总酸含量、氨基酸态氮含量、亚硝酸盐含量、乙偶姻含量以及感官品质。
1.3.10 测定方法
总酸含量(以乳酸计)的测定:根据国标GB 12456—2021《食品安全国家标准食品中总酸的测定》。
氨基酸态氮含量的测定:根据国标GB 5009.235—2016《食品安全国家标准食品中氨基酸态氮的测定》。
降亚硝酸盐能力的测定:参考国标GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐与硝酸盐的测定》和文献[25]采用盐酸萘乙二胺法测定亚硝酸盐含量(以亚硝酸钠计),并计算亚硝酸盐降解率(Y),其计算公式如下:
乙偶姻含量的测定:使用肌酸比色法[32]。
感官评价:选取10名食品专业的人员从色泽、香气、脆度和滋味四个方面对发酵辣椒进行感官评价,满分100分,感官评分标准参考文献[33]并作修改,具体评分标准见表1。
表1 发酵辣椒感官评分标准
Table 1 Sensory scoring standards for fermented pepper

色泽(20分) 香气(30分) 脆度(20分) 滋味(30分)色泽自然鲜红,不发暗(16~20分)色泽相对较红,不发暗(11~15分)色泽相对较红,稍暗(5~10分)色泽暗红(0~5分)发酵香味浓厚,无异味,气味协调性较好(24~30分)发酵香味较浓,无异味,气味协调性较好(16~23分)发酵香味淡,有异味,气味协调性较差(8~15分)基本无发酵香味,有异味,气味协调性差(0~7分)质地脆嫩,咀嚼性较好,没皮肉分离现象(16~20分)质地较脆嫩,咀嚼性较好,没皮肉分离现象(11~15分)质地稍有脆感,咀嚼性一般,稍有皮肉分离的现象(5~10分)质地无脆感,咀嚼性差,有皮肉分离的现象(0~5分)鲜、酸、辣各味协调适中,味道纯正(24~30分)鲜、酸、辣各味比较协调,味道较纯正(16~23分)鲜、酸、辣各味过重或过淡,味道不协调(8~15分)鲜、酸、辣各味不协调,风味失衡,有杂味(0~7分)
1.3.11 数据分析
每组实验重复3次,使用Excel 2023整理试验数据并计算统计参数,结果用“平均值±标准差”表示。实验数据显著性差异分析采用SPSS Statistics 26.0软件进行分析。使用GraphPad Prism 8.3.0软件进行制图。
2 结果与分析
2.1 发酵蔬菜中乳酸菌的分离及初筛
发酵蔬菜中乳酸菌的分离及初筛结果见表2。由表2可知,从传统发酵蔬菜样品中共初筛得到29株有溶钙圈、革兰氏阳性、过氧化氢酶阴性、不溶血和不产生物胺的优良乳酸菌菌株,其中,6株菌株产酸较快,7株有鲜味,9株亚硝酸盐残留较少,7株有香味。所有菌株的菌落呈圆形,不透明且正面呈现乳白色,背面呈现淡黄色,边缘完整,表面形态大部分平滑且有一定程度的隆起,大部分菌株的细胞呈杆状或短杆状,仅有2株菌株的细胞呈球状。
表2 不同来源乳酸菌菌株的形态学特征及发酵特性
Table 2 Cell morphology and fermentation characteristics of lactic acid bacteria strains from different sources
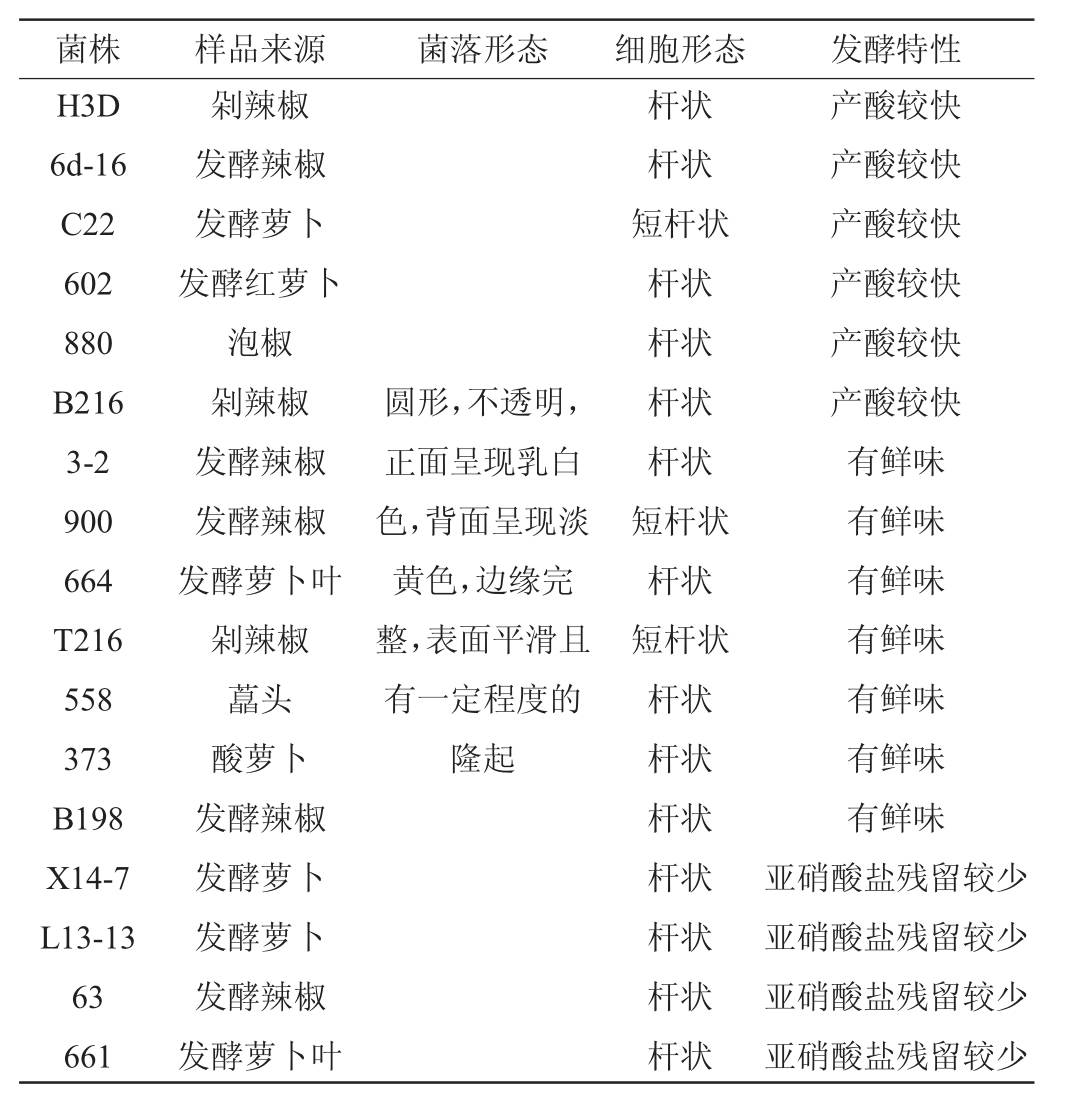
菌株 样品来源 菌落形态 细胞形态 发酵特性H3D 6d-16 C22 602 880 B216 3-2 900 664 T216 558 373 B198 X14-7 L13-13 63 661剁辣椒发酵辣椒发酵萝卜发酵红萝卜泡椒剁辣椒发酵辣椒发酵辣椒发酵萝卜叶剁辣椒藠头酸萝卜发酵辣椒发酵萝卜发酵萝卜发酵辣椒发酵萝卜叶圆形,不透明,正面呈现乳白色,背面呈现淡黄色,边缘完整,表面平滑且有一定程度的隆起杆状杆状短杆状杆状杆状杆状杆状短杆状杆状短杆状杆状杆状杆状杆状杆状杆状杆状产酸较快产酸较快产酸较快产酸较快产酸较快产酸较快有鲜味有鲜味有鲜味有鲜味有鲜味有鲜味有鲜味亚硝酸盐残留较少亚硝酸盐残留较少亚硝酸盐残留较少亚硝酸盐残留较少
续表
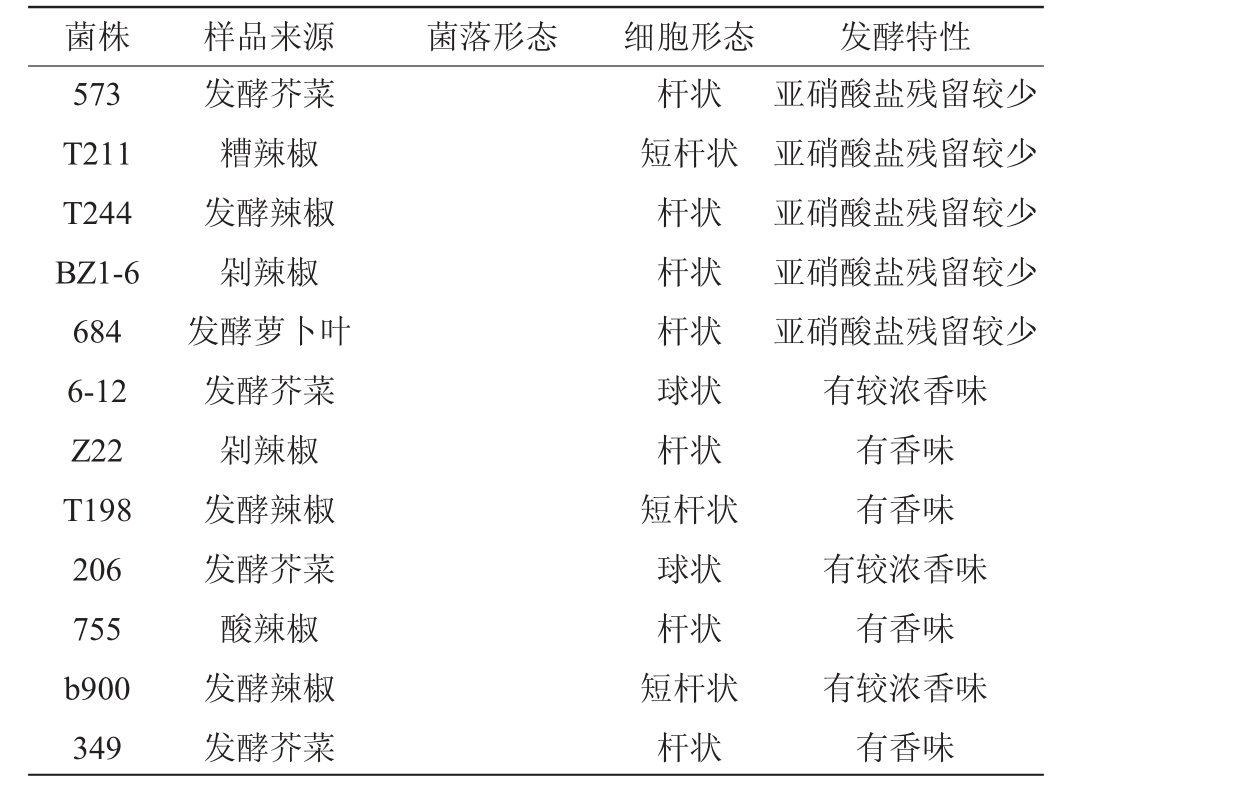
菌株 样品来源 菌落形态 细胞形态 发酵特性573 T211 T244 BZ1-6 684 6-12 Z22 T198 206 755 b900 349发酵芥菜糟辣椒发酵辣椒剁辣椒发酵萝卜叶发酵芥菜剁辣椒发酵辣椒发酵芥菜酸辣椒发酵辣椒发酵芥菜杆状短杆状杆状杆状杆状球状杆状短杆状球状杆状短杆状杆状亚硝酸盐残留较少亚硝酸盐残留较少亚硝酸盐残留较少亚硝酸盐残留较少亚硝酸盐残留较少有较浓香味有香味有香味有较浓香味有香味有较浓香味有香味
2.2 发酵蔬菜中乳酸菌的复筛
2.2.1 产酸能力的评价
产酸能力强的乳酸菌不仅可以保证发酵过程中产生足够的酸度,从而确保产品质量和安全性[34-35],还可以降低肠道内的pH值,抑制有害菌的生长,促进有益菌的繁殖,从而改善肠道健康[36]。各乳酸菌在添加食盐的MRS肉汤培养基中培养后,其产酸能力见图1。
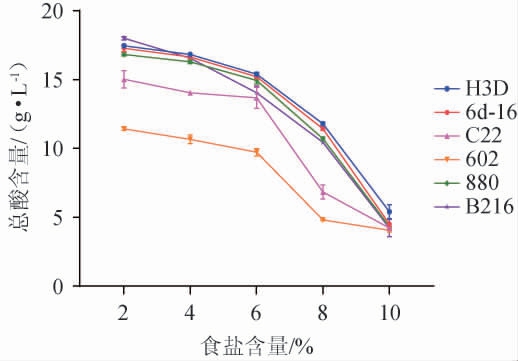
图1 乳酸菌在不同食盐含量下的产酸性能
Fig.1 Acid production performance of lactic acid bacteria under different salt contents
由图1可知,随食盐含量的提高6株乳酸菌菌株的产酸量总体呈现下降的趋势,表明食盐可抑制乳酸菌的活性和产酸能力。其中,菌株602和C22在各食盐含量环境中的产酸能力均较弱;菌株B216在食盐含量为2%时产酸量最高,总酸含量为18.00 g/L,但随着食盐含量的升高产酸量呈直线下降;而菌株H3D、6d-16和880随着食盐含量的增加产酸量的下降相对缓慢,特别是菌株H3D和6d-16,当食盐含量为10%时,菌株H3D、6d-16和880的总酸含量分别为5.40 g/L、4.50 g/L和4.32 g/L。辣椒的食盐含量一般为8%~10%,故选择产酸能力较好的H3D和6d-16菌株进行后续试验。
2.2.2 产氨基酸态氮能力的评价
氨基酸态氮是判定发酵产品发酵程度的重要指标之一,氨基酸含量越高,说明发酵辣椒鲜味和品质越好[37]。乳酸菌发酵蔬菜过程中,将葡萄糖、乳糖等转化为氨基酸和其他代谢产物,不同类型的乳酸菌可能会产生不同种类的氨基酸[38]。各乳酸菌在添加食盐的MRS肉汤培养基培养后,其产氨基酸态氮能力见图2。由图2可知,随着食盐含量的升高,7株乳酸菌菌株所产氨基酸态氮含量逐渐下降,其中,菌株T216和3-2在2%~8%食盐含量下所产氨基酸态氮含量均高于其他菌株,当食盐含量为10%时,其所产氨基酸态氮含量分别为0.22 g/100 mL和0.18 g/100 mL,因此,选择产氨基酸态氮较强的菌株T216和3-2进行后续试验。
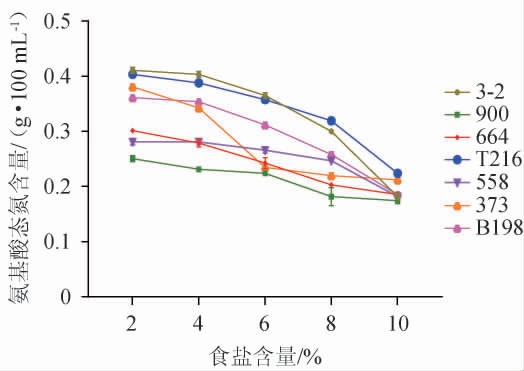
图2 乳酸菌在不同食盐含量下的产氨基酸态氮性能
Fig.2 Amino acid nitrogen production performance of lactic acid bacteria under different salt contents
2.2.3 降亚硝酸盐能力的评价
硝酸盐在蔬菜种植、施肥、制作和发酵等过程中积累,被硝酸盐还原细菌及其酶还原为亚硝酸盐进而可能转化为对人体有害的亚硝胺[39]。通过筛选能够降解亚硝酸盐的乳酸菌,可以在蔬菜发酵过程中减少亚硝酸盐的形成,这有助于提高食品的安全性。各乳酸菌在添加食盐的MRS肉汤培养基中培养后,其亚硝酸盐降解能力见图3。由图3可知,9株乳酸菌菌株均具有降解亚硝酸盐的能力,随着食盐含量的增加,乳酸菌菌株降解亚硝酸盐能力降低;当食盐含量>6%时,菌株T211、684、X14-7和661的亚硝酸盐降解能力迅速下降,亚硝酸盐降解率下降到18%以下;当食盐含量为2%~6%时,菌株573的亚硝酸盐降解率最弱,在食盐含量为8%和10%时,其亚硝酸盐降解率也较低;当食盐含量<8%时,菌株63、T244、L13-13和BZ106的亚硝酸盐降解率均>79%,当食盐含量为10%时,亚硝酸盐降解率稍有下降,但均>63%,其中菌株63和T244的亚硝酸盐降解能力最强,亚硝酸盐降解率>67%。故选择亚硝酸盐降解率较好的菌株63和T244进行后续试验。
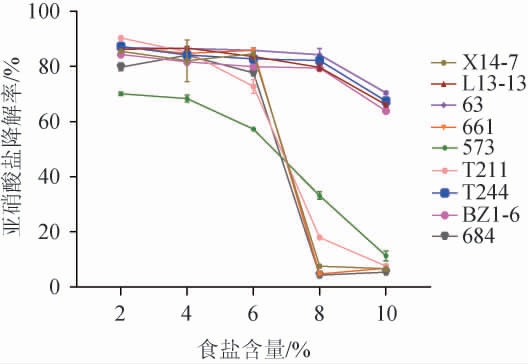
图3 乳酸菌在不同食盐含量下的亚硝酸盐降解率
Fig.3 Degradation rates of nitrite of lactic acid bacteria under different salt contents
2.2.4 产香能力的评价结果
产香乳酸菌在发酵过程中产生特殊的香气化合物,能够赋予发酵产品独特的香味。因此,通过筛选产香乳酸菌,选择具有良好香味的菌株,可以提高产品的口感和风味。乙偶姻是微生物和植物的一种代谢产物,具有令人愉悦的香味[40],研究表明,乙偶姻与双乙酰、乙醛、2,3-丁二醇、四甲基吡嗪、丙酮酸和丁二酮等风味物质转化有关,因此,乙偶姻含量一定程度上反映了其他风味物质的代谢与积累[41-45]。各乳酸菌在添加食盐的MRS肉汤培养基中培养后,其所产乙偶姻含量见图4。
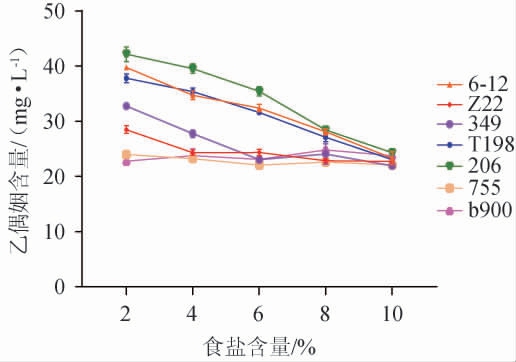
图4 乳酸菌在不同食盐含量下的产乙偶姻的能力
Fig.4 Acetoin production ability of lactic acid bacteria under different salt contents
由图4可知,菌株206是各食盐含量下所产乙偶姻含量最高的菌株,其次是菌株6-12和T198,当食盐含量为10%时,乙偶姻含量分别为24.30 mg/L、23.32 mg/L和23.08 mg/L;菌株Z22、b900、661和755在各食盐含量环境中的乙偶姻含量均较少;当食盐含量为2%~6%时,菌株349的乙偶姻含量迅速下降,之后保持在21.93 mg/L左右。故选择产乙偶姻能力较好的菌株206和6-12进行后续试验。
2.3 优良乳酸菌菌株的分子生物学鉴定结果
基于16S rDNA基因序列构建8株优良乳酸菌菌株的系统发育树,结果见图5。由图5可知,菌株63、H3D、6d-16和3-2均与植物乳植杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最近;菌株206和6-12均与戊糖片球菌(Pediococcus pentosaceus)聚于一支,亲缘关系最近;菌株T244、T216分别与食窦魏斯氏菌(Weissella cibaria)、短乳杆菌(Lactobacillusbrevis)聚于一支,亲缘关系最近。因此,鉴定菌株63、H3D、6d-16和3-2为植物乳植杆菌(Lactiplantibacillus plantarum),鉴定菌株206和6-12为戊糖片球菌(Pediococcus pentosaceus),鉴定菌株T244为食窦魏斯氏菌(Weissella cibaria),鉴定菌株T216为短乳杆菌(Lactobacillus brevis)。

图5 基于16S rDNA基因序列的筛选乳酸菌菌株的系统发育树
Fig.5 Phylogenetic tree of screening lactic acid bacteria strains based on 16S rDNA gene sequences
2.4 乳酸菌菌株间的拮抗性及共生性试验
2.4.1 拮抗性试验
采用牛津杯平板扩散法对8株菌株两两之间的拮抗性进行研究,结果发现,牛津杯外部无抑菌圈的出现,也没有出现越靠近牛津杯部位菌落越稀少的情况,说明8株菌株两两之间无拮抗反应,二者适宜作为复配菌株。综合考虑菌种及其特性差异,再结合16S rDNA鉴定结果,选择植物乳杆菌H3D、短乳杆菌T216、魏斯氏菌T244和戊糖片球菌206作为复配菌株。
2.4.2 共生性试验
将筛选的4株乳酸菌菌株接种至MRS肉汤培养基中,进行单独培养和混合培养,各组合培养后菌液的OD600 nm值见表3。由表3可知,4株乳酸菌菌株中2株组合、3株组合或者是4株组合进行混合培养,其OD600nm值均显著高于4株乳酸菌菌株单独培养后再混合的乳酸菌(P<0.05),表明4株乳酸菌菌株具有显著的共生关系,进一步说明4株乳酸菌菌株适宜作为复配菌株。
表3 4株乳酸菌菌株在MRS肉汤培养基上单独或共培养时的生长情况
Table 3 Growth situation of 4 strains of lactic acid bacteria alone or in co-culture in MRS broth medium
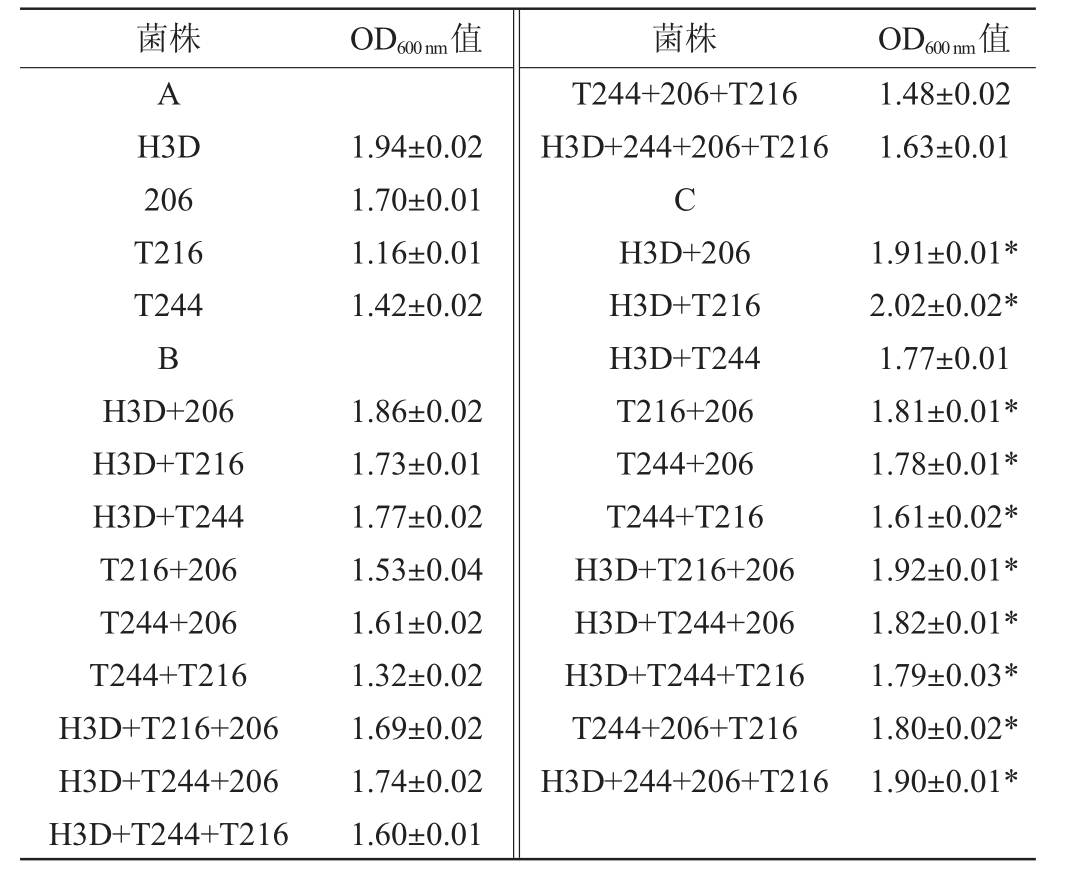
注:A表示乳酸菌菌株在MRS肉汤培养基中单独培养时的OD600 nm值;B表示单独培养后以相同比例混合测定的OD600 nm值;C表示以相同比例接种混合培养时测定的OD600 nm值。“*”表示与单独培养后混合相比差异显著(P<0.05)。
菌株 OD600 nm值 菌株 OD600 nm值A H3D 206 T216 T244 B H3D+206 H3D+T216 H3D+T244 T216+206 T244+206 T244+T216 H3D+T216+206 H3D+T244+206 H3D+T244+T216 1.94±0.02 1.70±0.01 1.16±0.01 1.42±0.02 1.48±0.02 1.63±0.01 1.86±0.02 1.73±0.01 1.77±0.02 1.53±0.04 1.61±0.02 1.32±0.02 1.69±0.02 1.74±0.02 1.60±0.01 T244+206+T216 H3D+244+206+T216 C H3D+206 H3D+T216 H3D+T244 T216+206 T244+206 T244+T216 H3D+T216+206 H3D+T244+206 H3D+T244+T216 T244+206+T216 H3D+244+206+T216 1.91±0.01*2.02±0.02*1.77±0.01 1.81±0.01*1.78±0.01*1.61±0.02*1.92±0.01*1.82±0.01*1.79±0.03*1.80±0.02*1.90±0.01*
2.5 乳酸菌菌株的生长曲线
4株乳酸菌菌株进行单独培养和混合培养(1∶1∶1∶1)时的生长曲线见图6。由图6可知,4株乳酸菌和混合菌的生长曲线均呈典型“S”形,有着明显的三个时期,培养0~2 h为延滞期,OD600nm值增长相对缓慢,菌株T216、H3D和混合菌株在培养2~14 h进入对数生长期,菌株206和T244在培养2~12 h进入对数生长期,此时乳酸菌生长迅速,呈对数生长;培养14~24 h为稳定期,OD600nm值达到最高。4株乳酸菌菌株混合培养的变化趋势与单独培养的变化趋势相比,没有明显变化,表明4株乳酸菌菌株之间无拮抗作用,更进一步说明这4株菌适宜作为复配菌株。
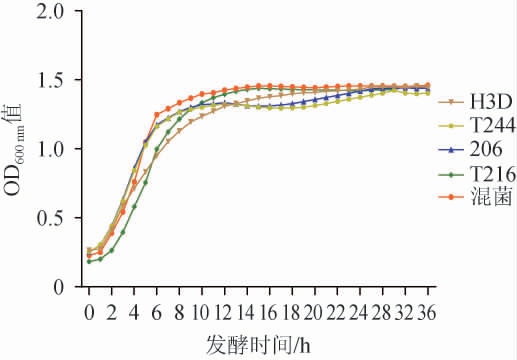
图6 乳酸菌菌株单独培养及混合培养时的生长曲线
Fig.6 Growth curves of lactic acid bacteria strains in single and mixed culture
2.6 乳酸菌混合培养时各菌种相对丰度分析
4株乳酸菌菌株混合培养时,不同培养时间各菌株相对丰度的变化情况见图7。
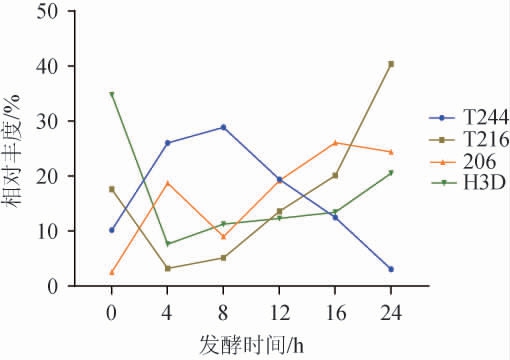
图7 混合培养时4株乳酸菌菌株相对丰度的变化
Fig.7 Changes of relative abundance of 4 strains of lactic acid bacteria during mixed culture
由图7可知,4株乳酸菌菌株混合培养时,菌株H3D和T244相对丰度的变化呈相反趋势。菌株T244在培养0~8 h内,快速增长,相对丰度于8 h达到最大值28.86%,培养8~24 h内相对丰度呈现下降趋势。菌株T216和H3D在培养0~4 h内呈下降趋势,相对丰度于4 h达到最小值,分别为3.22%和7.65%,随后在4~24 h内均呈上升趋势。菌株206作为主要的产香菌种,在整个培养过程中呈波动式上升,在培养16 h时达到最大值26.08%,结果表明,在24 h内4株乳酸菌菌株均有生长,能共存。乳酸菌能通过糖酵解途径优先利用乳糖及其他营养物质,发酵产生乳酸等代谢物,为其他菌种创造酸性环境和营养条件[46]。
2.7 乳酸菌对食源性致病菌的抑菌效果
蔬菜发酵食品会受到多种潜在污染,会通过食物链直接危害到人的健康,食源性致病菌是其中一类重要的污染源[47]。筛选具有抑制腐败菌和致病菌的菌株也成为发酵剂的关键。沙门氏菌、大肠杆菌、金黄色葡萄球菌和李斯特菌等是较为常见的食源性致病菌[48]。4株乳酸菌菌株单独培养及混合培养(1∶1∶1∶1)时对大肠杆菌、鼠伤寒沙门氏菌、李斯特菌、金黄色葡萄球菌、铜绿假单胞菌和蜡样芽孢杆菌的抑菌圈直径大小见表4。由表4可知,所选菌株及混合菌对6株食源性致病菌均有良好的抑制作用,且混合菌对大肠杆菌、李斯特菌和沙门氏菌的抑菌效果相比单一菌株的抑菌效果更好,抑菌圈直径分别为20.58 mm、19.56 mm和20.00 mm;混合菌对金黄色葡萄球菌和蜡样芽孢杆菌的抑菌效果相比单一菌株的抑菌效果相当,抑菌圈直径分别为20.47 mm、22.45 mm。分析原因可能是,乳酸菌能分泌有机酸、过氧化氢、蛋白质类以及小分子肽类等抑菌物质来抑制病原菌的生长[49-51]。
表4 乳酸菌菌株对食源性致病菌的抑菌圈直径
Table 4 Inhibition zone diameters of the lactic acid bacteria strain against foodborne pathogens
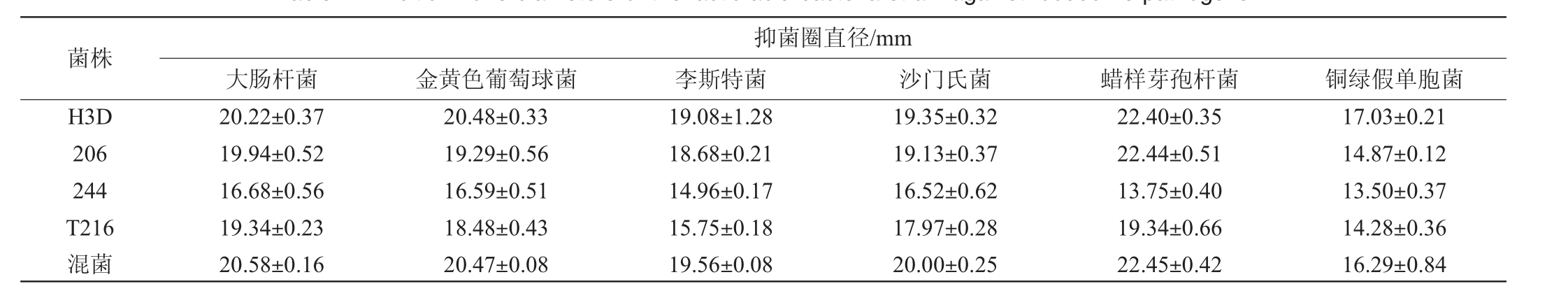
菌株H3D 206 244 T216混菌抑菌圈直径/mm大肠杆菌 金黄色葡萄球菌 李斯特菌 沙门氏菌 蜡样芽孢杆菌 铜绿假单胞菌20.22±0.37 19.94±0.52 16.68±0.56 19.34±0.23 20.58±0.16 20.48±0.33 19.29±0.56 16.59±0.51 18.48±0.43 20.47±0.08 19.08±1.28 18.68±0.21 14.96±0.17 15.75±0.18 19.56±0.08 19.35±0.32 19.13±0.37 16.52±0.62 17.97±0.28 20.00±0.25 22.40±0.35 22.44±0.51 13.75±0.40 19.34±0.66 22.45±0.42 17.03±0.21 14.87±0.12 13.50±0.37 14.28±0.36 16.29±0.84
2.8 不同比例组合的乳酸菌菌株对发酵辣椒的影响
不同比例的乳酸菌组合可能导致发酵效率的差异,同时,乳酸菌的种类和比例会直接影响发酵辣椒的风味和口感。通过调整乳酸菌的比例,可以优化发酵辣椒的风味和口感,使其更符合消费者的喜好。不同比例组合的乳酸菌接种发酵辣椒的结果见图8。由图8可知,当菌株H3D∶206∶T244∶T216为1∶1∶1∶1时,发酵辣椒的总酸、氨基酸态氮含量和感官评分分别为0.44 g/100 g、0.23 g/100 g和87.5分,都略高于其他试验组,因此,确定菌株H3D、206、T244和T216的最佳接种比例为1∶1∶1∶1。
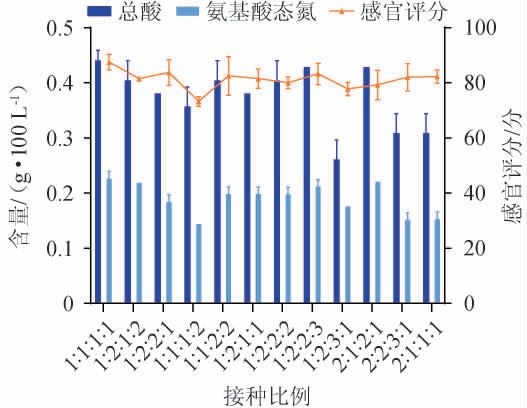
图8 不同比例组合的乳酸菌菌株接种发酵辣椒的品质指标
Fig.8 Quality indexes of fermented pepper inoculated with different proportions of lactic acid bacteria strains
2.9 混合乳酸菌发酵辣椒的品质分析
混合乳酸菌发酵辣椒及自然发酵辣椒的品质见表5。由表5可知,混合乳酸菌发酵组发酵辣椒的总酸(0.59g/100g)、氨基酸态氮(0.24 g/100 g)和乙偶姻含量(38.71 mg/kg)及感官评分(90.00分)极显著高于自然发酵组(P<0.01),亚硝酸盐含量(0.83mg/kg)极显著低于自然发酵组(P<0.01)。其中,混合乳酸菌发酵辣椒的总酸、氨基酸态氮和乙偶姻含量比自然发酵组分别提高36.11%、33.33%和107.12%,而亚硝酸盐含量降低84.49%。表明混合乳酸菌接种发酵能明显缩短辣椒的发酵周期,提高产品的风味及降低产品的亚硝酸盐含量。
表5 混合乳酸菌发酵辣椒品质分析结果
Table 5 Quality analysis results of mixed lactic acid bacteria fermented pepper

注:“**”表示与自然发酵组相比差异极显著(P<0.01)。
发酵辣椒 总酸含量/(g·100 g-1) 氨基酸态氮含量/(g·100 g-1) 亚硝酸盐/(mg·kg-1) 乙偶姻含量/(mg·kg-1) 感官评分/分自然发酵辣椒混合乳酸菌菌株发酵辣椒80.00±1.18 90.00±0.83**0.43±0.01 0.59±0.21**0.18±0.02 0.24±0.01**5.35±0.26 0.83±0.05**18.69±0.95 38.71±0.96**
3 结论
本研究以湖南各地的发酵蔬菜为分离源,初步分离出29株具有一定发酵特性的乳酸菌,进一步通过复筛,得到8株优良乳酸菌菌株,包括优良产酸乳酸菌H3D和6d-6,其在添加10%食盐的MRS培养基中产酸能力分别为5.40 g/L和4.50 g/L;优良产氨基酸态氮乳酸菌T216和3-2,其产氨基酸态氮能力分别为0.22 g/100 mL和0.18 g/100 mL;优良降亚硝酸盐乳酸菌63和T244,其亚硝酸盐降解率均>67%;优良产香乳酸菌206和6-12,乙偶姻产量分别为24.30 mg/L和23.32 mg/L。通过形态观察及分子生物学技术鉴定菌株63、H3D、6d-16和3-2为植物乳植杆菌(Lactiplantibacillus plantarum),菌株206和6-12为戊糖片球菌(Pediococcus pentosaceus),菌株T244为食窦魏斯氏菌(Weissella cibaria),菌株T216为短乳杆菌(Lactobacillus brevis)。通过拮抗性和共生性研究发现,8株菌株两两混合培养时均无拮抗性。最终选择植物乳杆菌H3D、戊糖片球菌206、短乳杆菌T216和魏斯氏菌T244四株菌进行复配,4株菌株之间可以共生,且对食源性致病菌具有良好的抑制作用。当这4株菌株以1∶1∶1∶1混合发酵辣椒时,发酵辣椒的品质最好,比自然发酵辣椒的总酸、氨基酸态氮和乙偶姻含量分别提高36.11%、33.33%和107.12%,亚硝酸盐含量降低84.49%。结果表明,所选的4株菌可用于辣椒专用发酵剂的复配菌株,提高了产品的品质和风味,可为发酵辣椒品质改良和优质菌种资源开发提供参考依据和技术支撑。
[1]包雨情,陈云鹏,韩颖颖.黄瓜采后生理变化及贮藏保鲜技术研究进展[J].中国农学通报,2023,39(3):35-41.
[2]SUN B M,CHEN C M,SONG J L,et al.The Capsicum MYB31 regulates capsaicinoid biosynthesis in the pepper pericarp[J].Plant Physiol Bioch,2022,176:21-30.
[3]BAENAS N,BELOVIC′ M,ILIC N,et al.Industrial use of pepper (Capsicum annum L.)derived products:Technological benefits and biological advantages[J].Food Chem,2019,274:872-885.
[4]KRZYKOWSKI A, DZIKI D, RUDY S, et al.Effect of pre-treatment conditions and freeze-drying temperature on the process kinetics and physicochemical properties of pepper[J].LWT-Food Sci Technol,2018,98:25-30.
[5]CASTRO-MUÑOZ R, GONTAREK-CASTRO E, JAFARI S M.Up-todate strategies and future trends towards the extraction and purification of capsaicin: A comprehensive review[J].Trends Food Sci Tech, 2022,123:161-171.
[6]赵杰,唐琴丽.发酵蔬菜研究进展[J].食品工业,2023,44(8):225-230.
[7]汪铃,王亮.传统发酵蔬菜制作工艺、品质特征及影响因素研究概况[J].中国酿造,2022,41(7):21-25.
[8]罗凤莲,夏延斌,王燕,等.脱盐盐渍辣椒发酵工艺优化及风味品质研究[J].湖南农业大学学报(自然科学版),2017,43(1):71-78.
[9]陈晟,罗佳瑶,蒋立文,等.我国腌渍蔬菜产业现状分析及改进对策[J].中国酿造,2018,37(7):6-10.
[10]LI X,ALU A,WEI Y Q,et al.The modulatory effect of high salt on immune cells and related diseases[J].Cell Proliferat,2022,55(9):13250.
[11]WANG Y R,ZHOU H,DING S H,et al.Changes in free amino acids of fermented minced peppers during natural and inoculated fermentation process based on HPLC-MS/MS[J].J Food Sci,2020,85(9):2803-2811.
[12]许弯,刘伟,胡小琴,等.湖南剁辣椒中优良乳酸菌的筛选鉴定及其发酵辣椒汁风味研究[J].食品工业科技,2020,41(8):96-103.
[13]周瑶,李娟,贾凤霞,等.单一及混合乳酸菌发酵对番木瓜汁品质的影响[J].食品与机械,2024,40(1):175-182,225.
[14]苏敬红,武彬.混菌发酵对无盐酸菜品质特性的影响[J].食品与机械,2023,39(2):188-197.
[15]史婷,高甜甜,刘伟,等.不同发酵剂对剁辣椒品质的影响[J].食品与发酵工业,2022,48(15):144-153.
[16]SHI Q,TANG X,LIU B Q,et al.Correlation between microbial communities and key odourants in fermented capsicum inoculated with Pediococcus pentosaceus and Cyberlindnera rhodanensis[J].J Sci Food Agr,2023,103(3):1139-1151.
[17]KNEZ E,KADAC-CZAPSKA K,GREMBECKA M.Effect of fermentation on the nutritional quality of the selected vegetables and legumes and their health effects[J].Life,2023,13(3):655.
[18]ASHAOLU T J,REALE A.A holistic review on Euro-Asian lactic acid bacteria fermented cereals and vegetables[J].Microorganisms,2020,8(8):1176.
[19]WOUTERS D,GROSU-TUDOR S,ZAMFIR M,et al.Applicability of Lactobacillus plantarum IMDO 788 as a starter culture to control vegetable fermentations[J].J Sci Food Agr,2013,93(13):3352-3361.
[20]SOLIMAN N R, EFFAT B A M, MEHANNA N S, et al.Activity of probiotics from food origin for oxalate degradation[J].Arch Microbiol,2021,203(8):5017-5028.
[21]赵海霞,吴丹,王晓蕾,等.降解亚硝酸盐乳酸菌的筛选及其在菜用枸杞浆水发酵中的应用[J].中国酿造,2022,41(11):113-119.
[22]吴凤玉,郑喆,李柳,等.宫廷奶酪中优良乳酸菌菌株的分离与鉴定[J].食品科学技术学报,2019,37(3):55-60,85.
[23]达菊庆,武运,吴聪,等.新疆昌吉奶疙瘩中乳酸菌的分离鉴定及发酵杏酱性能分析[J].食品与发酵工业,2024,50(12):84-91.
[24]杨埔,孔文涛,孙芝兰,等.食源性乳酸菌安全性的评价[J].食品科学,2014,35(19):169-173.
[25]陈正培,蒋潮,夏娴润,等.柳州酸笋中降亚硝酸盐乳酸菌的筛选及鉴定[J].中国酿造,2020,39(3):26-31.
[26]YANG Z Z,NI L,TIAN W,et al.Screening and identification of Goat-Milk-Derived lactic acid bacteria with bacteriocin-like activity and probiotic potentials[J].Microorganisms,2023,11(4):849.
[27]ZHANG F F,ZHOU K,ZHAO Q,et al.Screening and identification of lactic acid bacteria with antimicrobial abilities for aquaculture pathogens in vitro[J].Arch Microbiol,2022,204(12):689.
[28]KWOJI I D,OKPEKU M,ADELEKE M A,et al.Formulation of chemically defined media and growth evaluation of Ligilactobacillus salivarius ZJ614 and Limosilactobacillus reuteri ZJ625[J].Front Microbiol,2022,13:1450.
[29]张亦.开菲尔粒中乳酸菌的分离、筛选与酸乳直投式发酵剂的研制[D].镇江:江苏大学,2022.
[30]GE J P,SUN Y Y,XIN X,et al.Purification and partial characterization of a novel bacteriocin synthesized by Lactobacillus paracasei HD1-7 isolated from Chinese sauerkraut juice[J].Sci Rep,2016,6:19366.
[31]赵玲艳,邓放明,杨抚林.乳酸菌Lact.1、Lact.2和Lact.3在发酵碎鲜辣椒中的应用研究[J].食品科学,2008,29(2):257-260.
[32]王家旺,邓利廷,孙健,等.产2,3-丁二醇的酿酒酵母菌的筛选及其鉴定[J].中国酿造,2020,39(1):21-25.
[33]贺子玉,黄娇丽,易有金,等.低盐接种发酵辣椒对其风味品质的提升作用[J].现代食品科技,2024,40(2):273-283.
[34]ADESULU-DAHUNSI A T,DAHUNSI S O,AJAYEOBA T A.Co-occurrence of Lactobacillus species during fermentation of African indigenous foods:Impact on food safety and shelf-life extension[J].Front Microbiol,2022,13:684730.
[35]孙熙浛,崔承弼,齐仕博,等.低盐泡菜中耐酸性乳酸菌的筛选、鉴定及特性研究[J].食品与机械,2022,38(1):24-31,37.
[36]HANG S T,ZENG L Z,HAN J R,et al.Lactobacillus plantarum ZJ316 improves the quality of Stachys sieboldii Miq.pickle by inhibiting harmful bacteria growth,degrading nitrite and promoting the gut microbiota health in vitro[J].Food Function,2022,13(3):1551-1562.
[37]夏学超,于金换,曲桂武.强化发酵对辣椒中生物胺及理化指标影响的研究[J].食品科技,2021,46(10):13-18.
[38]CANON F, BRIARD-BION V, JARDIN J, et al.Positive interactions between lactic acid bacteria could be mediated by peptides containing Branched-chain amino acids[J].Front Microbiol,2022,12:793136.
[39]YU Y Y,YU Y S,XU Z L.Evaluation of nitrite, ethyl carbamate, and biogenic amines in four types of fermented vegetables[J].Foods,2021,10(12):3150.
[40]张诗瑶,孙钰薇,刘志佳,等.中华传统发酵蔬菜风味轮廓及风味形成研究进展[J].中国食品学报,2022,22(12):373-388.
[41]侯小艺,王建辉,邓娜,等.乳酸菌对发酵蔬菜风味影响研究进展[J].食品与机械,2023,39(4):232-240.
[42]CHENG H F.Volatile flavor compounds in yogurt: A review[J].Crit Rev Food Sci Nutr,2010,50(10):938-950.
[43]YI S H, HONG S P.Characteristics of bacterial strains with desirable flavor compounds from Korean traditional fermented soybean paste(Doenjang)[J].Molecules,2021,26(16):5067.
[44]刘卓非,陆震鸣,张晓娟,等.陈酿温度和乙偶姻含量对镇江香醋川芎嗪含量变化的影响[J].中国调味品,2023,48(1):69-74,79.
[45]XIE S Q,LI Z X,ZHU G D,et al.Cleaner production and downstream processing of bio-based 2,3-butanediol:A review[J].J Clean Prod,2022,343:131033.
[46]胡勇.乳酸菌在食品工程中的应用[J].青海畜牧兽医杂志,2013,43(6):46-48.
[47]LIANG T T,XIE X Q,WU L,et al.Microbial communities and physiochemical properties of four distinctive traditionally fermented vegetables from north China and their influence on quality and safety[J].Foods,2022,11(1):21.
[48]SALAMANDANE A, MALFEITO-FERREIRA M, BRITO L.The socioeconomic factors of street food vending in developing countries and its implications for public health:A systematic review[J].Foods,2023,12(20):3774.
[49]WANG G C,ZENG H.Antibacterial effect of cell-free supernatant from Lactobacillus pentosus L-36 against Staphylococcus aureus from bovine mastitis[J].Molecules,2022,27(21):7627.
[50]FUOCHI V,EMMA R,FURNERI P M.Bacteriocins,a natural weapon against bacterial contamination for greater safety and preservation of food:a review[J].Curr Pharm Biot,2021,22(2):216-231.
[51]蒋立文,石聪,覃业优,等.高盐辣椒坯的品质研究[J].食品与生物技术学报,2020,39(7):91-98.