白酒是我国传统发酵酒精饮品,是以高粱、小麦等粮食谷物为原料,以酒曲为糖化发酵剂酿造而成[1]。酒曲中包含多种酿酒微生物,这些微生物在白酒发酵过程中分别起到水解淀粉、生成乙醇和各种风味物质的作用,因此酒曲中的酿酒微生物直接影响到白酒最终的出酒率及风味品质[2-3]。
酒曲分为大曲、小曲和麸曲。大曲是在开放环境中通过自然接种的方式生产,其中的微生物结构易受到环境温度、湿度、地域和气候条件等影响,导致大曲的质量良莠不齐,这制约了我国白酒的标准化生产[4]。小曲中的微生物以根霉(Rhizopus)和酵母菌为主,虽生产工艺简单,生产周期短,但存在酿酒微生物单一,酿制白酒中杂醇油含量过高,白酒口味寡淡的问题[5]。麸曲则以麸皮为原料,接入一种或多种纯种微生物,通过人为控制制曲条件制作而成,具有发酵周期短、出酒率高、酿酒微生物可控、酿造性能稳定的优点,因此被广泛应用到白酒生产中[6]。酵母菌在白酒发酵中有着举足轻重的作用,作为酿酒微生物,其可在白酒的发酵过程中利用可发酵性糖产乙醇;通过自身代谢产生各种风味物质[7];一些酵母还具有产酶能力,可以水解原料,提高原料利用率[8-10]。已有许多研究使用纯种酵母菌制作麸曲,以便于酵母菌在酿酒过程中的应用[11-13],因此分离筛选出性能优良的酵母菌,探究其发酵性能对推动白酒行业的发展具有重要意义[14]。
伊力特白酒是新疆浓香型白酒的典型代表,被称作是“圣水酿造的美酒”、“新疆第一酒”,其浓香型大曲中含有丰富的酿酒微生物。因此,本研究以伊力特浓香型大曲为筛选原料,采用传统培养分离法及产乙醇性能分析从中分离筛选优良酵母菌,并通过形态学观察及分子生物学技术对其进行菌种鉴定。利用筛选菌株制作纯菌种麸曲,并以乙醇含量为响应值,采用单因素试验及响应面试验对制曲工艺进行优化,以期为伊力特大曲中优良酵母菌的筛选及麸曲制作提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
伊力特浓香型大曲:由新疆伊力特实业股份有限公司提供,用无菌袋包装后于4 ℃冰箱中保存;麸皮、高粱:新疆昌吉呼图壁县金葵花粮油加工厂;黄豆芽:新疆石河子市绿珠九鼎批发市场。
1.1.2 试剂
葡萄糖、氯化铵、磷酸氢二钾、硫酸镁、氯化钙、酚酞、无水乙酸钠、酒石酸钾钠、可溶性淀粉、磷酸二氢钠:天津市盛奥化学试剂有限公司;2,3,5-氯化三苯基四氮唑、α-淀粉酶(>3 700 U/g)、糖化酶(>10 000 U/g):北京酷来搏科技有限公司;酵母膏:北京奥博星生物技术有限责任公司;蛋白胨:英国OXOID公司;氢氧化钠、无水乙醇、硫酸、冰乙酸:天津市鑫铂特化工有限公司;TIANamp Bacteria脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit试剂盒:北京天根生化科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物:上海派森诺生物科技股份有限公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、TaKaRa LA Taq聚合酶:日本TaKaRa公司;琼脂糖:上海生工生物工程股份有限公司;以上试剂均为分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:蛋白胨10 g/L,葡萄糖20 g/L,酵母浸出粉5 g/L。YPD固体培养基:YPD液体培养基中添加琼脂14 g/L。
豆芽汁葡萄糖培养基[15]:黄豆芽200 g/L,葡萄糖30 g/L。
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)显色培养基[15]:2,3,5-氯化三苯基四氮唑0.05 g/L,葡萄糖0.5 g/L,琼脂3 g/L。
淀粉透明圈培养基[15]:可溶性淀粉10 g/L,蛋白胨10 g/L,葡萄糖5 g/L,氯化钠5 g/L,牛肉膏5 g/L,琼脂20 g/L。
基础发酵培养基[15]:葡萄糖200 g/L,酵母膏5 g/L,蛋白胨5 g/L,氯化铵1.5 g/L,磷酸氢二钾1.5 g/L,硫酸镁1 g/L,氯化钙2.8 g/L。
高粱液发酵培养基[15]:称取500 g高粱,用90 ℃热水浸润12 h,按料液比1∶6(g∶L)加入蒸馏水煮至粘稠,之后转入90 ℃恒温水浴锅糊化90 min,每10 min搅拌一次,糊化完成的液体转入60 ℃恒温水浴锅,加入10 g α-淀粉酶液化60 min后加入5 g糖化酶糖化60 min,得到的糖化液使用纱布过滤。
以上培养基均在115 ℃条件下高压蒸汽灭菌20 min。
1.2 仪器与设备
SPX-250B生化培养箱:常州诺基仪器有限公司;MQL-61R摇床:上海程造仪器设备有限公司;DGG-9053A电热恒温鼓风干燥箱:上海森信实验仪器有限公司;IMJ-54A高压蒸汽灭菌锅:施都凯仪器设备(上海)有限公司;SWCJ-2FD净化工作台:上海博迅医疗生物仪器股份有限公司;UV-2600紫外可见分光光度计:岛津仪器(中国)有限公司;S500T-T310生物显微镜:苏州倍特嘉光电科技有限公司;ABI-2720 PCR仪、ABI 3730XL测序仪:美国Applied Biosystems公司;NanoDrop 2000微量分光光度计:美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 酵母菌的分离
酵母菌的富集:准确称取10 g粉碎后的伊力特浓香型大曲于250 mL锥形瓶中,加入90 mL无菌水,30 ℃、150 r/min条件下振荡20 min后,静置5 min,取5 mL上清液置于100 mL豆芽汁葡萄糖培养基中,30 ℃、150 r/min条件下培养2 d,制成酵母菌富集培养液,备用。
稀释涂布平板法:取1mL酵母菌富集培养液于装有9mL无菌水的试管中,制成10-1的稀释液,以此方法梯度稀释,分别制成10-2、10-3、10-4、10-5、10-6和10-7的稀释样液。分别吸取0.1 mL的10-4、10-5、10-6、10-7梯度稀释液,均匀涂布于YPD固体培养基上,在30 ℃恒温培养箱中培养3 d后进行初步分离。
平板划线法:根据稀释涂布平板法分离得到的单菌落特征(菌落大小,有无菌丝,颜色气味等),挑取具有典型酵母菌落特征的菌株在YPD固体培养基平板上划线纯化3~4次,挑取单菌落接种于YPD固体培养基上,在30 ℃恒温培养箱中培养3 d后,于4 ℃冰箱保藏备用。
1.3.2 优良酵母菌的筛选
一级筛选:将分离纯化得到的酵母菌株接种于YPD固体培养基上,于30 ℃恒温培养箱中培养2 d后,在菌落上覆盖一层TTC显色培养基,继续置于培养箱中避光培养2~3 h,根据TTC培养基红色的深浅程度,初步筛选出具有较强产乙醇能力的酵母菌株进行二级筛选实验。
二级筛选:将初筛得到的产乙醇能力较强的酵母菌株按5%(V/V)的接种量接种于基础发酵培养基,以不接种菌的基础发酵培养基作为对照组,置于摇床中30 ℃、150 r/min条件下发酵3 d。发酵结束后测定发酵体系CO2质量损失、乙醇含量和还原糖残留量,并以产乙醇能力为主要筛选标准,筛选出产乙醇能力较强的菌株进行三级筛选。
三级筛选:将二级筛选获得的酵母菌株按5%(V/V)的接种量接种于高粱液发酵培养基,置于摇床中30 ℃、150 r/min条件下发酵7 d,发酵结束后测定发酵液中的乙醇、总酸和总酯含量,并以产乙醇、产酸和产酯能力为筛选标准,筛选出一株发酵性能较好的优良酵母菌。
1.3.3 优良酵母菌的鉴定
形态学观察:将优良酵母菌株划线接种于YPD固体培养基平板上,置于30 ℃恒温培养箱中培养2 d后观察其菌落特征。在载玻片上滴加一滴蒸馏水,用无菌接种环挑取在YPD固体培养基上培养2 d后的酵母菌体至蒸馏水中,盖上盖玻片于显微镜下观察其细胞形态。
分子生物学鉴定:使用TIANamp Bacteria DNA Kit试剂盒提取分离筛选所得的酵母菌的基因组DNA,以其为模板,采用引物26Sf(5'-GCATATCGGTAAGCGGAGGAAAAG-3')和26Sr(5'-GGTCCGTGTTTCAAGACGG-3')对菌株的26S rDNA进行PCR扩增。PCR扩增体系:基因组DNA1.0 μL,10×Buffer(Mg2+Plus)5.0 μL,Taq聚合酶(5 U/L)1.0 μL,脱氧核糖核苷三磷酸(dNTP)(10 mmol/L)1.0μL,正向和反向引物分别1.5 μL,双蒸水(ddH2O)39.0 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min;72 ℃终延伸7 min,35个循环。采用1%琼脂糖凝胶电泳对PCR扩增产物检测合格后委托上海派森诺生物科技有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源序列对比,获取同源性较高的模式菌株的26S rDNA基因序列,利用MEGA7.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 酵母菌生长曲线的绘制
用无菌接种环挑取一环在YPD固体培养基上培养2 d后的酵母菌至装有10 mL YPD培养基的试管中,30 ℃、150 r/min条件下培养16 h,即为种子液。吸取5 mL种子液接种到装液量为100 mL/250 mL YPD液体培养基中,30 ℃、150 r/min条件下培养48 h,每隔4 h取一次样,以未接菌的YPD液体培养基做空白,在波长660 nm处测定培养液的吸光度值。以培养时间(x)为横坐标,吸光度值(y)为纵坐标,绘制酵母菌生长曲线。
1.3.5 酵母菌纯种麸曲的制曲工艺
取15 g麸皮置于250 mL锥形瓶中,添加50%的蒸馏水,在121 ℃条件下高压蒸汽灭菌20 min后冷却至室温。在无菌条件下,接种9%的酵母菌种子液并搅拌均匀,于恒温培养箱中30 ℃条件下培养72 h,每隔12 h进行一次无菌搅拌。培养完成后将锥形瓶中的麸曲在40 ℃恒温干燥箱中干燥3 h,得到酵母菌纯种麸曲。
1.3.6 酵母菌纯种麸曲制曲工艺优化
(1)单因素试验
在1.3.5工艺的基础上,只改变单一因素,分别考察接种量(3%、6%、9%、12%、15%)、发酵温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、发酵时间(24 h、48 h、72 h、96 h、120 h)及水分添加量(45%、50%、55%、60%、65%)对酵母菌纯种麸曲乙醇含量的影响。
(2)Box-Behnken响应面试验
根据单因素试验结果,剔除影响不显著的因素,选择接种量(A)、发酵温度(B)和发酵时间(C)作为试验因素,以发酵液中乙醇含量(Y)为响应值,使用Design Expert 13.0软件设计3因素3水平的响应面试验,优化酵母菌纯菌麸曲制曲工艺。响应面试验因素与水平见表1。
表1 酵母菌纯种麸曲制备工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for optimization of pure yeast Fuqu-making process
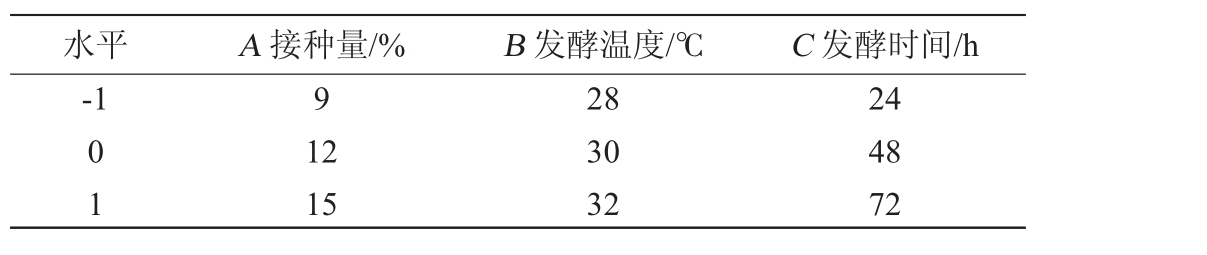
水平 A 接种量/% B 发酵温度/℃ C 发酵时间/h-1 9 01 12 15 28 30 32 24 48 72
1.3.7 测定方法
乙醇含量的测定:参照GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》中的酒精计法;残还原糖含量的测定:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[16];总酸含量的测定:参照GB 12456—2021《食品安全国家标准食品中总酸的测定》中酸碱指示剂滴定法;总酯含量的测定:参照GB/T 10345—2022《白酒分析方法》中指示剂法测定;糖化酶和液化酶活力的测定:参考赵恒山[17]的方法。
1.3.8 数据处理
每组试验做3次平行,结果用“平均值±标准差”表示;使用SPSS Statistics 24.0软件对数据进行统计分析。采用Duncan多重比较法进行显著性分析。使用Origin 2018软件作图。
2 结果与分析
2.1 酵母菌的分离筛选
2.1.1 酵母菌的初步分离结果
通过豆芽汁葡萄糖培养基富集培养、稀释涂布分离和平板划线后初步挑选出8株酵母菌,编号分别为LX-1、LX-2、LX-3、YZ-1、YZ-2、TL-1、TL-2、TL-3。
2.1.2 酵母菌的一级筛选结果
TTC是一种显色剂,能够与酵母菌的呼吸酶发生反应,呈现出不同程度的红色,因此可以通过红色的深浅来初步判断酵母菌呼吸的强弱,进而判断其产乙醇的能力[15]。8株酵母菌在覆盖TTC显色培养基培养3 h后的显色结果见图1。
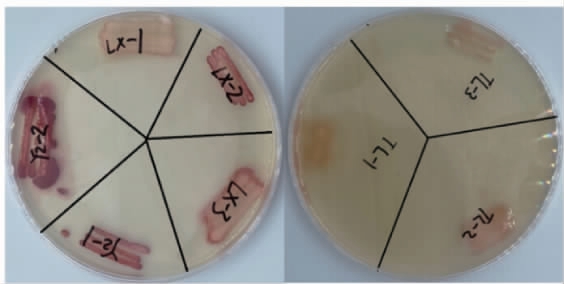
图1 8株酵母菌菌株在TTC培养基上的显色结果
Fig.1 Chromogenic results of 8 yeast strains on TTC medium
由图1可知,菌株YZ-1、YZ-2和LX-2的显色反应呈现深红色,说明这3株菌均具有较好的产乙醇能力;菌株LX-3的显色反应呈粉红色,说明该菌株产乙醇能力一般;而菌株LX-1、TL-1、TL-2和TL-3的显色反应呈微红色,说明这几株菌产乙醇能力较弱。为了进一步验证酵母菌的产乙醇能力,将初筛得到的具有较好产乙醇能力的菌株YZ-2、YZ-1和LX-2进行二级筛选。
2.1.3 酵母菌的二级筛选结果
酵母菌在无氧发酵过程中会通过自身代谢反应产生乙醇和CO2。乙醇的生成量和CO2的生成量呈正相关,CO2会以气体的形式散失,导致发酵体系总质量降低,因此可以通过测定发酵体系的质量损失情况间接反映出菌株的发酵性能[15]。3株一级筛选酵母菌株在基础发酵培养基中的发酵性能见表2。
表2 一级筛选酵母菌株在基础发酵培养基中的发酵性能
Table 2 Fermentation performance of primary screening yeast strains in basic fermentation medium
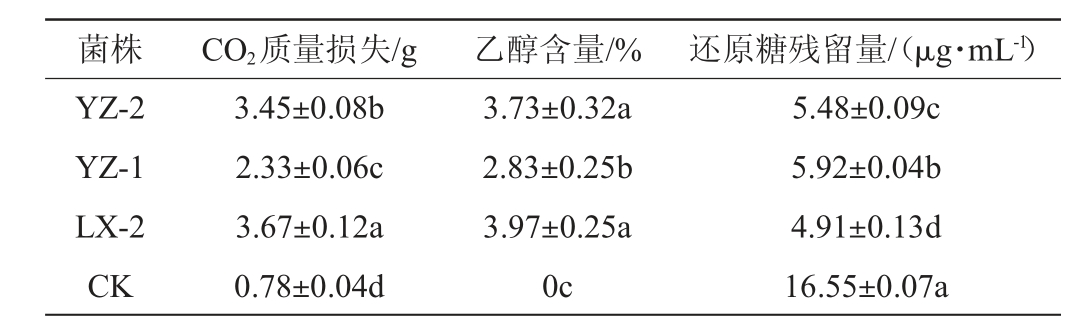
注:同列不同小写字母表示差异显著(P<0.05)。
菌株 CO2质量损失/g 乙醇含量/% 还原糖残留量/(μg·mL-1)YZ-2 YZ-1 LX-2 CK 5.48±0.09c 5.92±0.04b 4.91±0.13d 16.55±0.07a 3.45±0.08b 2.33±0.06c 3.67±0.12a 0.78±0.04d 3.73±0.32a 2.83±0.25b 3.97±0.25a 0c
由表2可知,菌株YZ-2和LX-2的发酵性能较好,其培养3 d后乙醇含量均>3.50%,还原糖残留量均<5.50 μg/mL,CO2质量损失均>3.00 g。以筛得具有高产乙醇能力的酵母菌为目标,选定菌株YZ-2和LX-2进行三级筛选。
2.1.4 酵母菌的三级筛选结果
2株二级筛选酵母在高粱液发酵培养基中的发酵性能见表3。
表3 二级筛选菌株在高粱液发酵培养基中的发酵性能
Table 3 Fermentation performance of secondary screened strains in sorghum liquid fermentation medium

菌株 乙醇含量/% 总酯含量/(g·L-1) 总酸含量/(g·L-1)YZ-2 LX-2 3.53±0.15 5.40±0.10 0.151±0.008 0.174±0.029 0.108±0.012 0.068±0.006
由表3可知,菌株LX-2在高粱液发酵培养基中发酵7d时,乙醇、总酯和总酸含量分别为5.40%、0.174 g/L和0.068 g/L;菌株YZ-2在高粱液发酵培养基中发酵7 d时,乙醇、总酯和总酸含量分别为3.53%、0.151 g/L和0.108 g/L。菌株LX-2发酵液中的乙醇和总酯含量比菌株YZ-2的发酵液高52.97%和15.23%,总酸含量低37.04%。以筛得具有高产乙醇能力的酵母菌为目标,综合考虑选择菌株LX-2为目标筛选菌株。
2.2 酵母菌LX-2的鉴定结果
2.2.1 形态学观察
酵母菌LX-2在YPD固体培养基上于30 ℃条件下培养2 d后的形态学特征见图2。
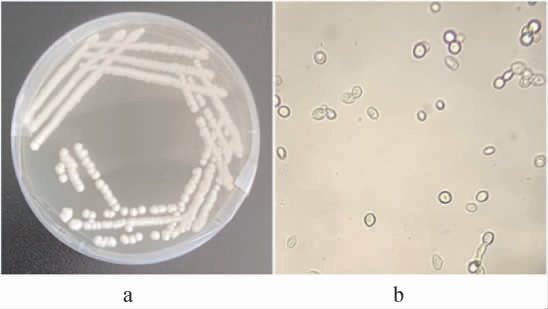
图2 菌株LX-2的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain LX-2
由图2a可知,菌株LX-2在YPD固体培养基上的菌落呈圆形,乳白色,表面粗糙且有细小绒毛,不易挑取,具有清淡的酒酿香味。由图2b可知,菌株LX-2的细胞形态呈球形和椭圆形,以出芽方式进行繁殖,且为多端出芽。
2.2.2 分子生物学鉴定
基于26S rDNA基因序列构建菌株LX-2的系统发育树,结果见图3。

图3 基于26S rDNA基因序列菌株LX-2的系统发育树
Fig.3 Phylogenetic tree of strain LX-2 based on 26S rDNA gene sequence
由图3可知,菌株LX-2与扣囊复膜酵母菌株(Saccharomycopsis fibuligera)MN648848.1聚于一支,亲缘关系最近,相似度达100%,结合菌株LX-2的形态学特征,最终将菌株LX-2鉴定为扣囊复膜酵母(Saccharomycopsis fibuligera)。
2.3 酵母菌LX-2的生长曲线
扣囊复膜酵母LX-2的生长曲线见图4。由图4可知,扣囊复膜酵母LX-2在培养4 h后进入对数生长期,16 h后进入稳定期,OD660 nm值趋于稳定。因此,选择培养16 h后的扣囊复膜酵母LX-2种子液进行后续研究。
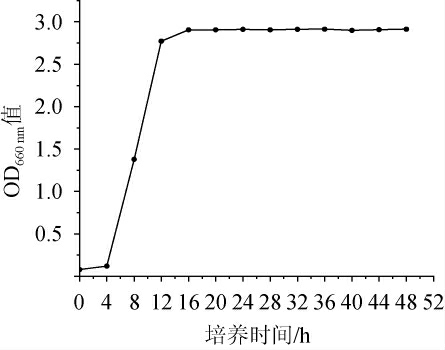
图4 扣囊复膜酵母LX-2的生长曲线
Fig.4 Growth curve of Saccharomycopsis fibuligera LX-2
2.4 酵母菌纯种麸曲制备工艺优化
2.4.1 单因素试验
不同培养条件对酵母菌纯种麸曲产乙醇能力的影响见图5。
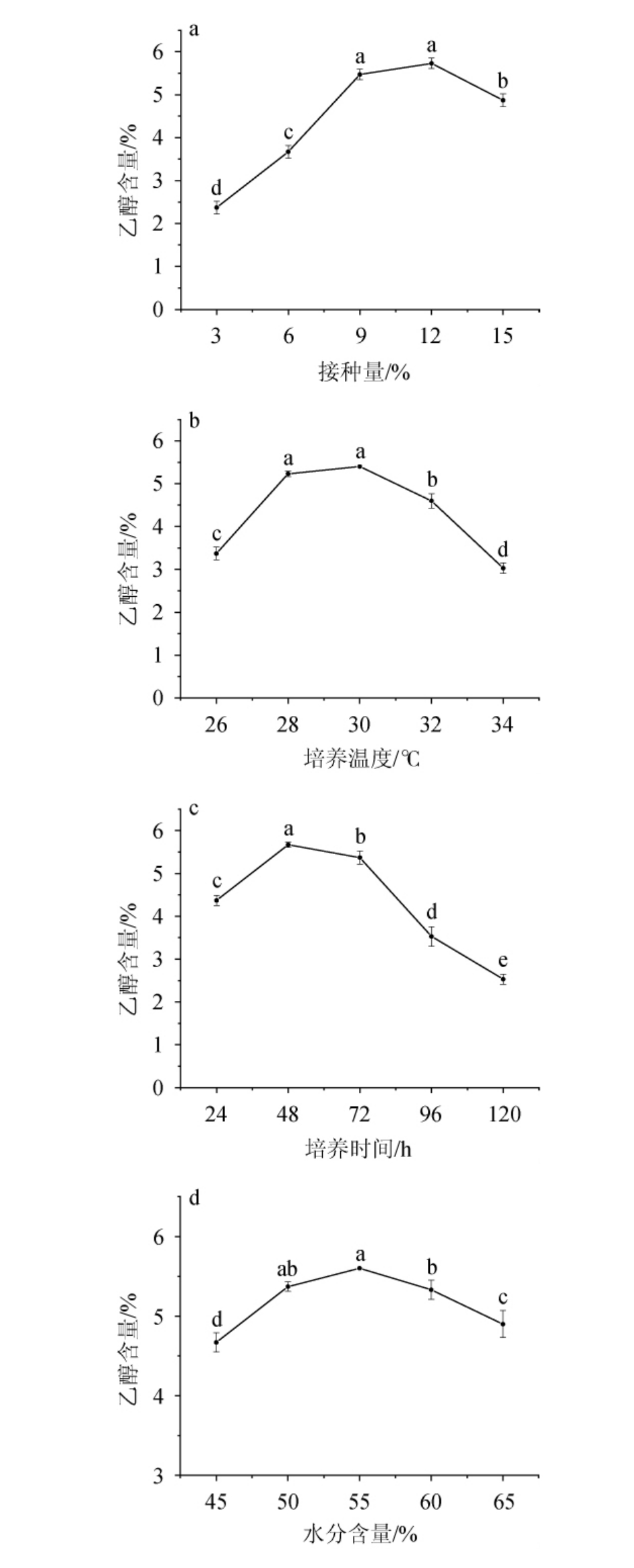
图5 接种量(a)、发酵温度(b)、发酵时间(c)和水分添加量(d)对扣囊复膜酵母LX-2纯种麸曲产乙醇能力的影响
Fig.5 Effects of inoculum (a), fermentation temperature (b), time (c),and water addition (d) on the ethanol-producing capacity of Saccharomycopsis fibuligera LX-2 pure yeast Fuqu
不同小写字母表示差异显著(P<0.05)。
通常较大的接种量能够使微生物的迟滞期缩短,减少制曲时间,但是当接种量过大时,微生物在生长繁殖过程中消耗营养物质过快,使得培养基在发酵中后期营养成分不足[18];接种量过小,会使得菌体繁殖能力不足,进而造成麸曲中的活菌数较低,导致制曲时间延长。由图5a可知,随着接种量的增加,乙醇含量呈现先上升后下降的变化趋势。当接种量为12%时,乙醇含量达到最高值,为5.73%。因此,选择12%作为最佳接种量。
温度是微生物正常生长和产物合成的关键条件,温度过高会对微生物的蛋白质、酶、核酸和其他成分造成不可逆的损害;而温度过低会使微生物的生长速度降低,甚至完全停止生长[19];因此制曲温度在适宜的范围内,更有利于微生物的生长繁殖和产物积累。由图5b可知,随着发酵温度的升高,乙醇含量呈现先上升后下降的变化趋势,当发酵温度为30 ℃时,乙醇含量最高,达到5.30%。因此,选择30 ℃作为最佳培养温度。
由图5c可知,随着发酵时间的增加,乙醇含量呈先升高后下降的趋势,当发酵时间为48 h时,乙醇含量达到最大值,为5.67%。在适宜条件下,微生物的数量会随着发酵时间的延长而增多,然而,随着发酵时间的延长,麸皮中的营养物质及水分含量都在不断减少,微生物因得不到足够的营养物质及水分而凋亡,导致麸曲中的活菌数量减少,致使麸曲的性能下降[20]。因此,合适的发酵时间可以使麸曲具有较高的活菌数,对维持麸曲的性能有重要意义。选择48 h作为最佳发酵时间。
水是微生物生长所必须的营养成分,当麸皮中水分含量不足时,培养后期麸皮表面会逐渐干燥失水,导致微生物缺少生长必需的水分;水分含量过高,会导致麸皮黏连,透气性差,麸曲内部的热量不易散失和麸曲内部氧气含量的不足;过高或过低的水分含量都不利于微生物的生长繁殖及产酶[21]。由图5d可知,随着水分添加量的增加,乙醇含量呈现先上升后下降的变化趋势,当水分含量为55%时,乙醇含量最高,为5.60%。因此,选择55%为最佳水分含量。
2.4.2 响应面试验
根据单因素试验结果,剔除影响不显著的因素,固定水分添加量为55%,选择接种量(A)、发酵温度(B)和发酵时间(C)3个因素为考察因素,以乙醇含量(Y)为响应值,使用Design-Expert 13.0软件设计3因素3水平的Box-Behnken响应面试验,试验设计及结果见表4,方差分析见表5。
表4 扣囊复膜酵母LX-2纯种麸曲制备工艺优化响应面试验设计及结果
Table 4 Design and results of response surface experiments for optimization of Saccharomycopsis fibuligera LX-2 pure yeast Fuqu-making process
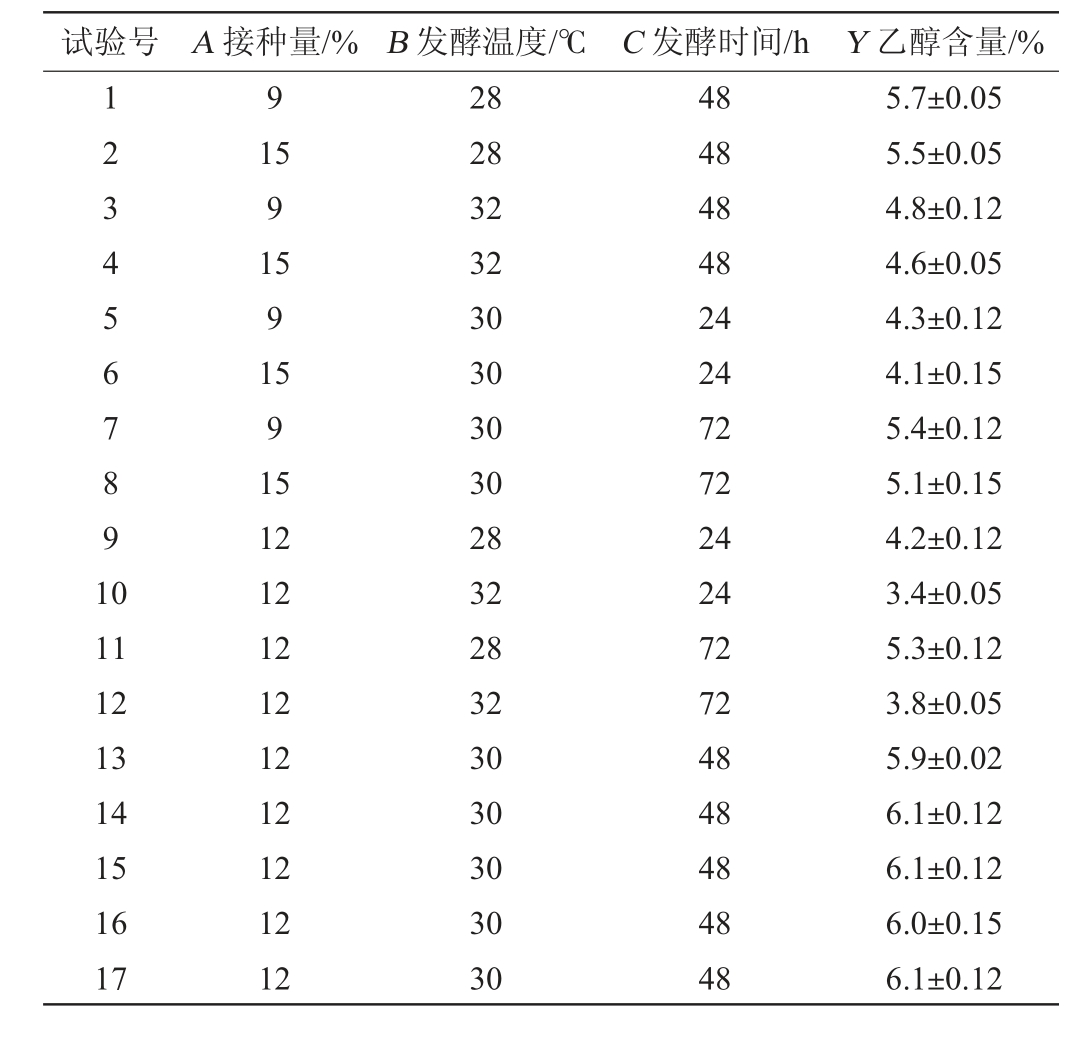
试验号 A 接种量/% B 发酵温度/℃ C 发酵时间/h Y 乙醇含量/%1234567891 0 9 11 12 13 14 15 16 17 15 9 15 9 15 9 15 12 12 12 12 12 12 12 12 12 28 28 32 32 30 30 30 30 28 32 28 32 30 30 30 30 30 48 48 48 48 24 24 72 72 24 24 72 72 48 48 48 48 48 5.7±0.05 5.5±0.05 4.8±0.12 4.6±0.05 4.3±0.12 4.1±0.15 5.4±0.12 5.1±0.15 4.2±0.12 3.4±0.05 5.3±0.12 3.8±0.05 5.9±0.02 6.1±0.12 6.1±0.12 6.0±0.15 6.1±0.12
表5 回归模型方差分析
Table 5 Variance analysis of regression model
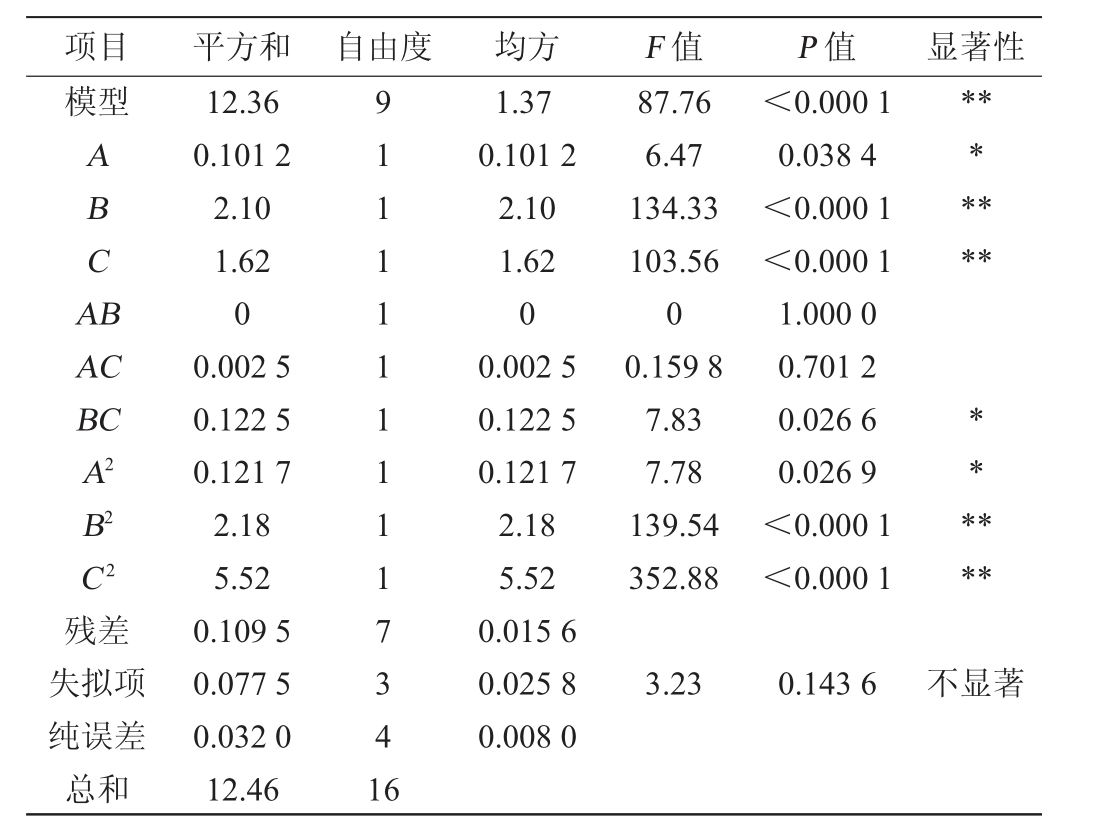
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。
项目 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B*******AC BC A2 B2****C2 87.76 6.47 134.33 103.56 0 0.159 8 7.83 7.78 139.54 352.88<0.000 1 0.038 4<0.000 1<0.000 1 1.000 0 0.701 2 0.026 6 0.026 9<0.000 1<0.000 1**残差失拟项纯误差总和12.36 0.101 2 2.10 1.62 0 0.002 5 0.122 5 0.121 7 2.18 5.52 0.109 5 0.077 5 0.032 0 12.46 91111111117341 6 1.37 0.101 2 2.10 1.62 0 0.002 5 0.122 5 0.121 7 2.18 5.52 0.015 6 0.025 8 0.008 0 3.23 0.143 6不显著
通过Design-Expert 13.0软件对表3试验结果进行多元回归拟合,得到乙醇含量对接种量、发酵温度和发酵时间的二次多项回归方程:

由表5可知,回归模型P<0.000 1,极显著,失拟项P=0.143 6>0.05,不显著,说明模型可靠。决定系数R2=0.991 2,说明拟合程度较好,试验误差小,该回归模型可以对扣囊复膜酵母LX-2纯种麸曲的制曲工艺进行分析和预测。根据F值可知,3个因素对扣囊复膜酵母LX-2纯种麸曲液态发酵液中乙醇含量的影响从大到小依次为B(发酵温度)、C(发酵时间)、A(接种量)。由P值可知,一次项B、C及二次项B2、C2对结果影响极显著(P<0.01),一次项A、交互项BC及二次项A2对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
发酵温度及发酵时间间交互作用对乙醇含量影响的响应面及等高线见图6。两变量之间的响应面及等高线可以用来判断二者之间的交互作用是否显著,响应面越陡峭、等高线趋于椭圆形表明两因素之间交互作用显著;响应面越平缓、等高线趋于圆形表明两因素之间交互作用不显著[22]。

图6 发酵温度及发酵时间间交互作用对乙醇含量影响的响应面及等高线图
Fig.6 Response surface plots and contour lines of effect of interaction between fermentation temperature and time on ethanol content
由图6可知,发酵温度及发酵时间间交互作用的响应面陡峭、等高线趋于椭圆形,说明对结果影响显著,这与方差分析结果一致。
采用Design-Expert 13.0软件对回归方程进行求解,得到最佳制曲工艺为:接种量10.80%,培养温度29.24 ℃,培养时间53.82 h,此时预测的乙醇产量为6.21%。为考虑实际操作的可行性,将最佳制曲条件调整为接种量11%,培养温度29 ℃,培养时间54 h,水分添加量55%。在此优化条件下进行3次平行验证试验,得到的乙醇含量实际值为(6.17±0.632)%,与预测值接近,说明模型可靠,可以用于发酵液乙醇含量的预测。
2.5 扣囊复膜酵母LX-2纯种麸曲产酯、产酸能力及酶活力测定
在最佳制曲条件下得到的扣囊复膜酵母LX-2纯种麸曲的总酸、总酯含量分别为0.223 g/L和0.078 g/L,相较于优化前分别提高了28.16%和14.71%。
已有研究证明扣囊复膜酵母具有产糖化酶和液化酶的能力[23-25]。因此,本实验对LX-2麸曲的糖化酶和液化酶活力进行测定,结果显示,扣囊复膜酵母LX-2纯种麸曲的糖化酶、液化酶活力分别为370.00 U/g和530.40 U/g,说明LX-2麸曲具有一定的糖化酶、液化酶活力。糖化酶和液化酶能够分解酿酒原料中的淀粉,对原料利用率、白酒出酒率及风味物质的形成有重要影响[18],目前,对扣囊复膜酵母酵母的研究多为研究其某一功能特性,例如产乙醇能力、产淀粉酶能力或者产香能力,本研究较为全面地对菌株LX-2的发酵性能进行了测定,与其他研究[26-28]相比,菌株LX-2发酵性能较为均衡,兼具产乙醇、产酯、产酸和产淀粉酶能力,在纯菌种酿制酒中具有极大的应用潜力。
3 结论
采用传统培养分离法及产乙醇性能分析从伊力特浓香型大曲中分离筛选得到一株产乙醇性能优良的酵母菌,编号为LX-2,通过形态学观察及分子生物学技术鉴定该菌株为扣囊复膜酵母(Saccharomycopsis fibuligera)。通过单因素试验及响应面试验确定利用菌株LX-2制作纯种麸曲的最佳制曲工艺为接种量11%,培养温度29 ℃,培养时间54 h,水分添加量55%。在此优化条件下,扣囊复膜酵母LX-2纯种麸曲中的乙醇产量为6.17%,总酯和总酸含量分别为0.223 g/L和0.078 g/L,糖化酶、液化酶活力分别为370.00 U/g和530.40 U/g,说明该菌株同时具有产乙醇和水解淀粉的能力且性能优良,本实验对伊力特浓香型大曲中优良酵母菌的筛选利用具有积极意义,并可为该酵母的麸曲制作工艺提供理论依据。
[1]肖冬光.白酒生产技术[M].北京:化学工业出版社,2005:4.
[2]程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):1-4.
[3]王志山,陈文浩,刘洋.芝麻香型白酒酿酒微生物研究进展[J].中国酿造,2019,38(12):9-13.
[4]HE X, GACA A, JELEN′ H H.Determination of volatile compounds in Baijiu using simultaneous chromatographic analysis on two columns[J].J I Brewing,2020,126(2):206-212.
[5]苏畅.浓香型白酒酒醅中功能酵母的筛选及在川法小曲酿造中的应用[D].自贡:四川轻化工大学,2019.
[6]HONG L X,FU G M,LIU T,et al.Functional microbial agents enhance ethanol contents and regulate the volatile compounds in Chinese Baijiu[J].Food Biosci,2021,44:101411.
[7]管健.大曲清香型白酒功能菌的筛选与应用[D].武汉:湖北工业大学,2018.
[8]FU Z L,SUN B G,LI X T,et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotechnol Biotec Eq,2018,32(5):1218-1227.
[9]王乃军,马美荣.扣囊复膜酵母在白酒生产中的应用研究进展[J].酿酒科技,2023(3):115-119.
[10]王居伟,韩培杰,王雪薇,等.白酒发酵过程中常见酵母菌扣囊复膜酵母的研究进展[J].广西科学,2020,27(1):1-9.
[11]孙露露,贾军全,高志远,等.高产酒精酵母Y7的筛选及其制曲工艺优化[J].酿酒,2023,50(2):52-57.
[12]李洪媛,马美荣,周林艳,等.根霉酵母混合麸曲在清香型白酒生产中的应用[J].酿酒科技,2021(9):123-130.
[13]郭燕,钟迟迪,董晓山,等.中高温大曲中酵母菌的分离及其在小曲酒中发酵性能初探[J].食品与发酵工业,2020,46(8):78-84.
[14]王耀,张龙云,张春林,等.有益功能微生物在强化大曲生产中的应用[J].酿酒科技,2014(12):53-59,62.
[15]赵群丽.酱香大曲中酿酒微生物的筛选及发酵工艺研究[D].贵阳:贵州大学,2016.
[16]詹梦涛,娄水珠,刘仙花,等.3,5-二硝基水杨酸法测定液体糖中总糖含量[J].云南民族大学学报(自然科学版),2020,29(4):317-321.
[17]赵恒山.产糖化酶、液化酶菌株的筛选及麸曲的制备[D].晋中:山西农业大学,2017.
[18]黄凯.Bacillus subtilis KLDS1.17培养条件的优化与菌剂的制备研究[D].哈尔滨:东北农业大学,2022.
[19]WU Z Y, YANG S Q, XU L, et al.Screening and identifying microorganisms with feruloyl esterase activity in Chinese sesame-flavor Baijiu fermentation materials (Jiupei)[J].J Food Compos Anal, 2021, 102:104069.
[20]刘茗铭,周阳子,袁乐梅,等.酒曲中高产糖化酶霉菌的筛选及其固态发酵产酶条件优化[J].食品与发酵工业,2018,44(10):118-123.
[21]刘茗铭.高温大曲中产香功能微生物的筛选及其应用研究[D].自贡:四川轻化工大学,2019.
[22]金子亿.酵母菌-乳酸菌联合发酵大豆酒的工艺优化及品质分析[D].淮安:淮阴工学院,2022.
[23]孙思佳,翟磊,白秀彬,等.一株高产淀粉酶扣囊复膜孢酵母的产酶条件优化及酶学性质研究[J].食品与发酵工业,2019,45(21):31-37.
[24]庾昌文,薛栋升,郭威,等.酒醅中高产淀粉酶酵母的分离鉴定及产酶条件研究[J].酿酒,2015,42(5):71-75.
[25]马美荣,刘小改,李洪媛,等.两种扣囊复膜酵母在清香型麸曲白酒生产中的应用[J].食品工业科技,2021,42(21):133-139.
[26]龙亚飞,唐佳代,王帅,等.酱香堆积酒醅中扣囊复膜酵母的分离鉴定及酒精发酵性能研究[J].酿酒科技,2022(5):35-39.
[27]雷炎,刘梦琦,易秦振,等.扣囊复膜酵母在红枣酒中的应用[J].食品研究与开发,2021,42(5):131-136.
[28]黄昊,哈祖德,顾京赛,等.西藏传统青稞酒酿造用藏曲中主要酵母菌的分离及酿造特性研究[J].食品与发酵工业,2021,47(2):8-14.