大豆糖蜜是醇法生产大豆浓缩蛋白时产生的一种副产物,呈黄棕色粘稠状[1-2]。据统计,每生产3 t大豆浓缩蛋白,就会有1 t大豆糖蜜副产物产生[3]。研究表明,大豆糖蜜含大豆异黄酮、大豆低聚糖、大豆蛋白及矿物元素等,是酵母发酵的优良营养物质,也可用来提取大豆异黄酮、大豆低聚糖等,其中大豆低聚糖既包含功能性低聚糖(如棉子糖和水苏糖),也包含非功能性低聚糖(如蔗糖)[2,4-6]。棉子糖和水苏糖等功能性大豆低聚糖具有多种生理功能,如选择性增殖双歧杆菌、乳酸杆菌等益生菌,改善机体免疫力,预防疾病和抗衰老、降血脂降血压、护肝排毒、抗肿瘤等作用,备受科研人员和生产企业的重视[7-11]。因此,从大豆糖蜜中纯化分离获得功能性大豆低聚糖能够实现变废为宝,提高其利用价值。
然而,直接从大豆糖蜜中提取分离棉子糖和水苏糖等功能性大豆低聚糖存在一定困难,这是因为大豆糖蜜中往往含有较高含量的蔗糖(一般为18.5%~65.0%),需要经过多步的色谱层析等精细纯化过程才能获得相对高纯度的功能性大豆低聚糖,这增加了其生产成本,限制了其应用[2,12-16]。
众所周知,不同的微生物利用不同糖源的顺序、速度和程度有所不同,基于不同微生物对糖源利用程度会有所不同的特性,可以选用合适的微生物处理大豆糖蜜,尽可能的保留功能性低聚糖而除去非功能性糖,从而实现大豆糖蜜的生物净化[17-19]。通过筛选获得能优先利用大豆糖蜜中蔗糖等非功能性低聚糖,而很少或几乎不利用大豆糖蜜中棉子糖和水苏糖等功能性低聚糖的微生物,通过这些微生物选择性利用大豆糖蜜中糖组分的能力实现大豆糖蜜中功能性低聚糖的分离纯化,这不仅成本低廉而且有效,是十分可行的采用生物方法净化大豆糖蜜中功能性低聚糖的方法[20]。刘玉兰等[21]利用啤酒酵母发酵去除大豆糖蜜中的蔗糖,在最优条件下,蔗糖保留率低于10%,而棉子糖和水苏糖的保留率都较高,分别达到85.7%和94.3%;刘飞等[22]从5种酵母中优选出啤酒酵母103作为发酵菌种去除大豆糖蜜中的蔗糖,在最佳处理条件下,蔗糖保留率为10%左右,棉子糖和水苏糖的保留率分别为81.0%和92.5%;崔希庆等[23]分别采用3种酵母菌、1种乳酸菌和1种曲霉处理大豆糖蜜,结果发现,7号酵母菌生物净化大豆糖蜜制备功能性大豆低聚糖效果最佳,在最优条件下处理大豆糖蜜,蔗糖、棉子糖和水苏糖的保留率分别为8.76%、99.61%和95.72%。由此可见,采用生物净化方法从大豆糖蜜中制备功能性大豆低聚糖行之有效。
本研究利用大豆糖蜜制备功能性大豆低聚糖,采用液体发酵方法对从白酒酿造环境中筛选获得的210株菌株(酵母46株,细菌45株和霉菌119株)生物净化大豆糖蜜中功能性低聚糖特性进行研究,通过测定大豆糖蜜中蔗糖保留率、棉子糖保留率、水苏糖保留率等考察指标对菌株进行初筛和复筛,并对复筛菌株进行聚类分析。期望从中获得能用于大豆糖蜜生物净化制备功能性低聚糖的菌株,从而降低从大豆糖蜜中提取分离功能性大豆低聚糖的难度,增加大豆糖蜜的附加值。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
大豆糖蜜:山东荣正化工有限公司;210株菌株(酵母46株,细菌45株和霉菌119株):实验室前期从不同白酒酿造环境中筛选获得。
1.1.2 化学试剂
蔗糖、棉子糖、水苏糖、甘露三糖(纯度均>98%):美国Sigma公司;其他试剂均为国产生化试剂或分析纯。
1.1.3 培养基酵母浸出粉胨葡萄糖(yeast extract peptone-dextrose,YPD)液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,自然pH,115 ℃条件下灭菌20 min。
发酵培养基:用蒸馏水将大豆糖蜜稀释8倍,混匀,每瓶(250 mL)分装30 mL大豆糖蜜稀释液,于110 ℃条件下灭菌10 min[24]。
1.2 仪器与设备
BL-2200H型电子分析天平:岛津国际贸易(上海)有限公司;PHS-3C pH计:上海精密科学仪器有限公司;DLCJ-2ND I 超净工作台:北京东联哈尔仪器制造有限公司;TENSUC 恒温摇床:上海天呈实验仪器制造有限公司;YQX-SG46-280S高压蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;LHS-100CL恒温恒湿培养箱:上海一恒科学仪器有限公司;Microfuge 2R离心机:北京田林恒泰科技有限公司;LC-20AT高效液相色谱(high performance liquid chromatography,HPLC)仪:岛津国际贸易(上海)有限公司。
1.3 实验方法
1.3.1 菌株活化
将实验室保藏菌种分别接种到YPD液体培养基中,于30 ℃、200 r/min条件下活化36 h,每种菌活化两次。
1.3.2 生物净化大豆糖蜜菌株的初筛
将上述活化好的菌种种子液按照0.1%的接种量接种到发酵培养基中,在180 r/min、30 ℃条件下培养24 h,然后将发酵液于10 000 r/min条件下离心10 min,取上清液,经0.22 μm滤膜过滤后装入液相瓶中进行高效液相色谱检测,分析蔗糖、棉子糖、水苏糖保留率和甘露三糖含量,依据三种糖的保留率及甘露三糖含量确定生物净化大豆糖蜜制备功能性大豆低聚糖的优良菌株。
1.3.3 生物净化大豆糖蜜菌株的复筛
基于初筛结果,采用1.3.2方法对作用效果优良的菌株进行复筛,由于复筛菌株都为酵母,其生长迅速,所以复筛发酵时间缩短至14 h,发酵结束后按照1.3.2方法处理样品,检测蔗糖、棉子糖、水苏糖和甘露三糖含量,计算三种糖的保留率及甘露三糖含量,筛选生物净化制备大豆低聚糖菌株。
1.3.4 蔗糖、棉子糖、水苏糖和甘露三糖测定
采用高效液相色谱检测方法测定上述处理后样品中蔗糖、棉子糖、水苏糖和甘露三糖的含量[25]。HPLC色谱条件:COSMOSIL Packed 色谱柱(4.6 mm×250 mm),柱温30 ℃,流动相为体积分数70%乙腈溶液,SHIMADZU REFRACTIVE INDEX检测器(RID-10A),流速为0.5 mL/min。用蔗糖标准品配制1 mg/mL、2 mg/mL、3 mg/mL、4 mg/mL和5 mg/mL的标准品溶液,采用上述高效液相色谱检测方法测定各个质量浓度蔗糖标准品溶液的峰面积,绘制蔗糖标准曲线;同样方法分别绘制棉子糖、水苏糖和甘露三糖的标准曲线。按照不同糖的标准曲线回归方程分别计算样品中4种糖含量。
蔗糖、棉子糖、水苏糖保留率计算公式如下:
式中:S为蔗糖、棉子糖或水苏糖保留率,%;C1为经发酵后大豆糖蜜(为已稀释8倍大豆糖蜜)中蔗糖、棉子糖或水苏糖质量浓度,mg/mL;C2为未发酵大豆糖蜜(为已稀释8倍大豆糖蜜)中蔗糖、棉子糖或水苏糖质量浓度,mg/mL。
1.3.5 数据处理
(1)初筛菌株类别分析
为了对初筛菌株大样本数据进行可视化分析,将每株初筛菌株发酵后大豆糖蜜培养基中蔗糖保留率、棉子糖保留率、水苏糖保留率以及甘露三糖含量(因大豆糖蜜中甘露三糖含量为0,无法用甘露三糖保留率作为指标,故采用甘露三糖含量作为指标进行统计)为考察指标,按照菌株类别用绘图软件Graphpad Prism 5分别绘制箱线图和散点图,分析不同菌株类别对大豆糖蜜的发酵能力,从而筛选出生物净化大豆糖蜜的最优菌株类别。
(2)复筛菌株聚类分析
对生物净化后的蔗糖保留率、棉子糖保留率、水苏糖保留率以及甘露三糖含量等实验指标数据用SPSS18.0统计软件进行系统聚类分析,从而将生物净化能力相同或相近的菌株归为同一聚类簇,以达到综合考察各个聚类簇菌株对大豆糖蜜的发酵能力,从而寻找到相对最佳发酵菌株。
菌株聚类簇发酵能力分析相关指标计算公式如下:
(a)菌株聚类簇蔗糖保留率的确定
若菌株第n聚类簇有j株菌,分别为1、2、3……j,各菌株对应的蔗糖保留率Z(i),i=1、2、3……j,则菌株第n聚类簇的蔗糖保留率Z(n)计算公式如下:
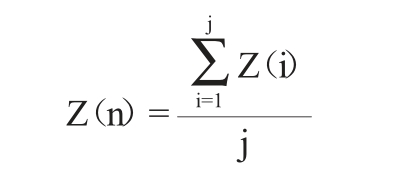
(b)菌株聚类簇棉子糖保留率的确定
若菌株第n聚类簇有j株菌,分别编号为1、2、3……j,各菌株对应的棉子糖保留率M(i),i=1、2、3……j,则菌株第n聚类簇的棉子糖保留率M(n)计算公式如下:
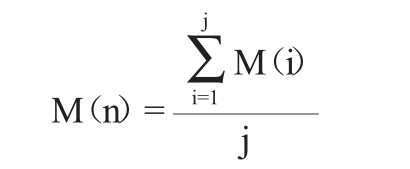
(c)菌株聚类簇水苏糖保留率的确定
若菌株第n聚类簇有j株菌,分别编号为1、2、3……j,各菌株对应的水苏糖保留率Y(i),i=1、2、3……j,则菌株第n聚类簇的水苏糖保留率Y(n)计算公式如下:
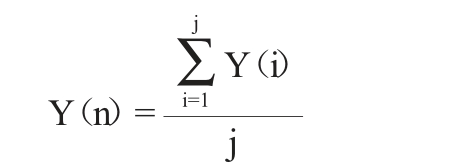
(d)菌株聚类簇甘露三糖含量极差化值的确定
甘露三糖虽然是水苏糖经菌株发酵降解的产物,也属于大豆功能性低聚糖,但本研究的主要目的是保留高含量的水苏糖而不被降解,为此,在菌株筛选过程中通过检测和分析甘露三糖含量间接表征水苏糖降解情况。为求菌株聚类簇甘露三糖含量的极差化值,应先求得各个菌株的甘露三糖含量极差化值,对于甘露三糖含量g,第t菌株试验中测得的指标值记为gt(t=1、2、3…、n),其中最小值记作g(min),最大值记为g(max),则其极差R4计算公式如下:
R4=g(max)-g(min)
定义:对于甘露三糖含量的每次测量值gt的“极差化”值σ计算公式如下:
若菌株第n聚类簇有j株菌,分别编号为1、2、3……j,各菌株对应的甘露三糖含量极差化值为σ(i),i=1、2、3……j,则菌株第n聚类簇的甘露三糖含量H(n)计算公式如下:
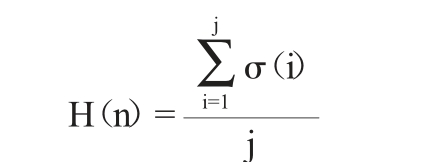
每组试验进行3个平行,利用Excel 2016、SPSS 25.0处理试验数据。
2 结果与分析
2.1 大豆糖蜜中蔗糖、棉子糖、水苏糖和甘露糖分析
2.1.1 大豆糖蜜中四种糖的定性分析
按照方法1.3.4对蔗糖、棉子糖、水苏糖和甘露三糖四种标准品进行高效液相色谱分析,结果见图1。由图1可知,四种糖的保留时间分别为14.0 min、22.5 min、30.0 min和26.5 min,在此色谱条件下,蔗糖、棉子糖、水苏糖和甘露三糖能够很好的进行分离和检测。
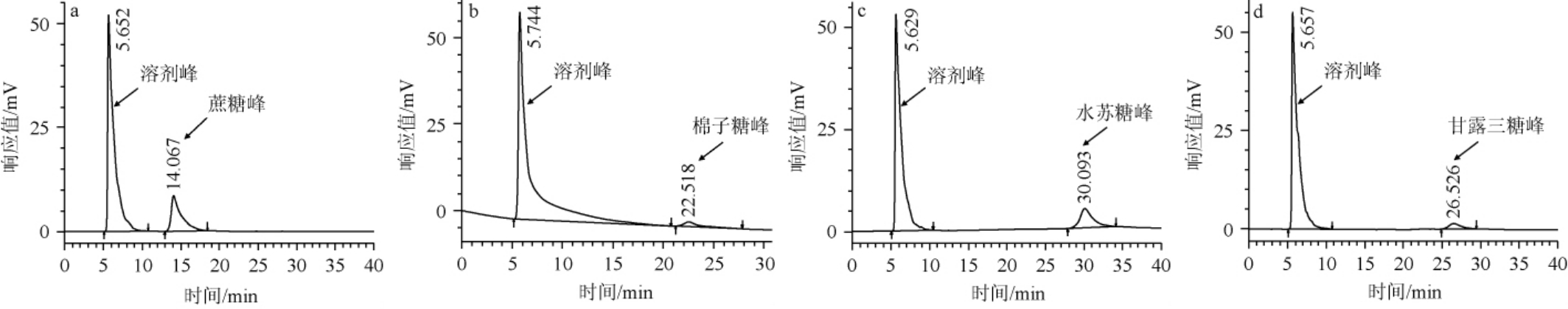
图1 蔗糖(a)、棉子糖(b)、水苏糖(c)和甘露三糖(d)标准品的高效液相色谱图
Fig.1 High performance liquid chromatogram of sucrose (a), raffinose (b), stachyose (c) and manninotriose (d) standards
在相同条件下,对稀释8倍后的大豆糖蜜上清液进行检测,结果如图2所示,根据四种糖的标准品色谱峰的出峰时间,可以确定大豆糖蜜上清液中A峰为蔗糖,B峰为棉子糖,C峰为水苏糖,而未检测到甘露三糖。
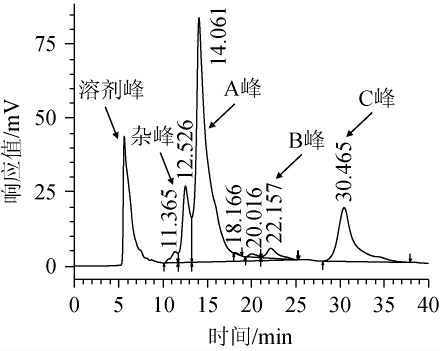
图2 稀释8倍后的大豆糖蜜上清液高效液相色谱图
Fig.2 High performance liquid chromatogram of soybean molasses supernatant after 8 times dilution
2.1.2 大豆糖蜜中四种糖的定量分析
采用高效液相色谱方法分别对不同质量浓度的蔗糖、棉子糖、水苏糖以及甘露三糖标准溶液进行检测,以测定的峰面积(y)为纵坐标,对应质量浓度(x)为横坐标,分别绘制四种糖的标准曲线,结果见图3。由图3可知,由四种糖标准溶液绘制的标准曲线相关系数R2均>0.99,表明四种糖的标准曲线拟合程度高,由其标准曲线回归方程计算四种糖的质量浓度是可行的。
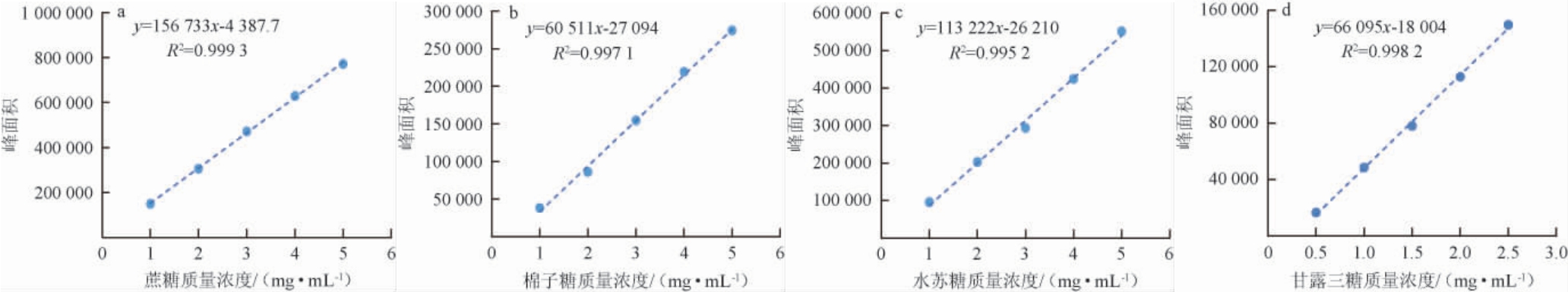
图3 蔗糖(a)、棉子糖(b)、水苏糖(c)及甘露三糖(d)标准曲线
Fig.3 Standard curves of sucrose (a), raffinose (b), stachyose (c) and manninotriose (d)
依据四种糖标准曲线的回归方程,按照图2中检测到的大豆糖蜜中不同糖的峰面积,计算获得本研究所用大豆糖蜜中蔗糖、棉子糖和水苏糖的含量分别为435.9 mg/mL、46.6 mg/mL和186.5 mg/mL,由此可见,在本研究所用大豆糖蜜中蔗糖为主要糖组成成分,占比高达65.2%,其次为水苏糖,占比为27.8%,棉子糖含量最少,占比为7.0%,这与刘飞等[22]研究所用大豆糖蜜中各糖组成相近。大豆糖蜜中高含量的非功能性蔗糖,大大降低了大豆糖蜜的功能性,这为获得高纯度的功能性大豆低聚糖带来了困难。虽然有采用膜分离、色谱层析对其进行分离,但由于蔗糖、棉子糖和水苏糖分子质量比较接近,且蔗糖含量高,而两种功能性低聚糖含量较低,所以不仅难获得高纯度的功能性低聚糖,而且成本较高,难以工业化生产[15]。生物净化法是一种基于微生物能将生存环境中某一种或某些物质转化生成其他易于处理或者直接完全被利用消耗而没有任何存留的特性,通过该种微生物的作用将某种或某些物质从其生存环境中除去。本研究后续主要目的就是获得一种或几种具有这种特性的微生物菌种。
2.2 生物净化大豆糖蜜菌株的初筛
对研究团队前期从白酒酿造环境中筛选获得的210株菌株(酵母46株,细菌45株和霉菌119株)进行了生物净化大豆糖蜜制备功能性低聚糖的研究。
采用统计学的方法对这些菌株处理大豆糖蜜后,大豆糖蜜中蔗糖保留率、棉子糖保留率、水苏糖保留率和甘露三糖含量进行了大数据分析,绘制各个指标的箱线图和散点图,从而从菌种大类上分析不同类别的微生物生物净化大豆糖蜜制备功能性大豆低聚糖的效果,结果见图4。
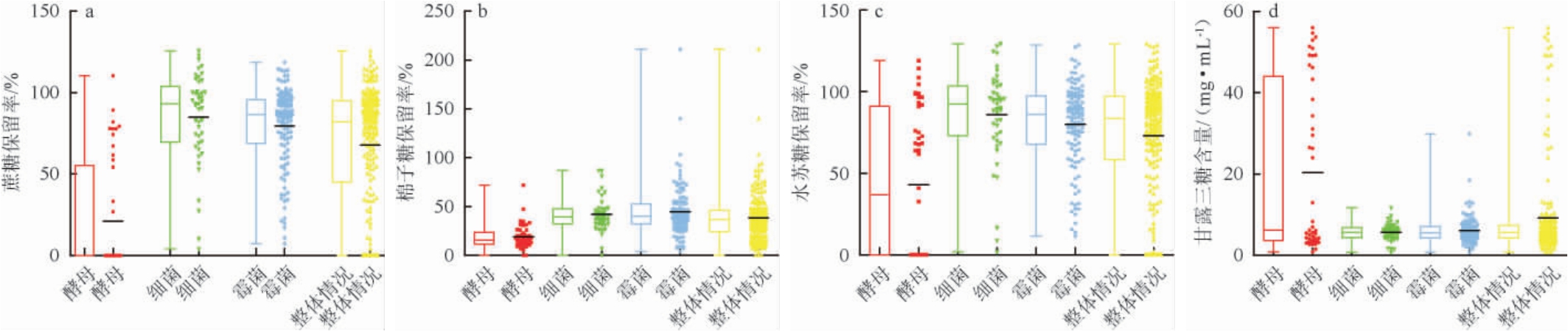
图4 不同菌株对大豆糖蜜中蔗糖保留率(a)、棉子糖保留率(b)、水苏糖保留率(c)以及甘露三糖含量(d)的影响
Fig.4 Effects of different strains on sucrose retention rate (a), raffinose retention rate (b), stachyose retention rate (c) and manninotriose content (d) of soybean molasses
由图4a可知,酵母类别的whisker下限、第一四分位以及中位数都重合于0处,说明在培养24 h的情况下,有大于或者等于一半的酵母能完全利用蔗糖;酵母类别的第三四分位相比整体情况的第三四分位偏低,其甚至都低于整体情况的中位数,说明酵母类别的菌株对蔗糖的利用比其他类别的菌株更加充分;酵母类别的whisker上限略低于整体情况且酵母类别的散点图中的极端点比整体情况的少。分析细菌类别的箱线散点情况可知,细菌类别的whisker下限略大于0,说明细菌中并没有出现将蔗糖全部利用的菌株;细菌类别的第一四分位、中位数以及第三四分位都高于整体情况对应值,且细菌类别的四分位间距框高度比整体情况高,说明半数的细菌对蔗糖的利用效率低于平均水平;细菌类别的whisker上限与整体情况大致相同。分析霉菌类别的箱线散点情况可知,霉菌类别的whisker下限略大于0,说明霉菌中并没有出现将蔗糖全部利用的菌株;霉菌类别的第一四分位、中位数以及第三四分位都高于整体情况的,霉菌类别的四分位间距框高度比整体情况高,说明半数的霉菌对蔗糖的利用效率低于平均水平;霉菌类别的whisker上限与整体情况大致相同。综上所述,酵母对大豆糖蜜中蔗糖的利用更加完全。
由图4b可知,酵母类别的whisker下限在0处,说明酵母类别中有个别菌株能够在24 h内充分利用棉子糖;酵母类别的第一四分位、中位数、第三四分位分别与整体情况的相比略低但差距微小,说明酵母类别的大多数菌株对棉子糖的利用比其他类别的菌株更快但差距微小,这可能是部分酵母在将原有蔗糖消耗殆尽后已经开始将棉子糖作为糖源进行利用,因此在后续复筛时需要缩短发酵时间;酵母类别的whisker上限幅度略窄且处于whisker上限幅度区间的散点数较少,说明酵母类别对棉子糖利用的极端异常点较少。分析细菌类别的箱线散点情况可知,细菌类别的whisker下限在0处,说明细菌类别中有个别菌株能够在24 h内充分利用棉子糖;细菌类别的第一四分位、中位数、第三四分位分别与整体情况的相比差距微小,说明细菌类别的大多数菌株对棉子糖的利用与其他类别的菌株相比差距微小;细菌类别的whisker上限幅度略窄且处于whisker上限幅度区间的散点数较少,说明细菌类别对棉子糖利用的极端异常点较少。分析霉菌类别的箱线散点情况可知,霉菌类别的whisker上限略高于0,说明霉菌类别的菌株中没有能够在24 h内将棉子糖全部消耗的菌株个体;霉菌类别的第一四分位、中位数、第三四分位与整体情况相比差距微小,说明霉菌类别的大多数菌株对棉子糖的利用与其他类别的菌株相比差距微小;霉菌类别的whisker上限幅度极大,说明霉菌类别对棉子糖利用情况较为复杂,出现较多极端异常点。综上所述,酵母、细菌、霉菌三种类别的菌株分别对棉子糖的平均利用情况相差不大,但霉菌类别的菌株具有较多的离群点以及部分的极端异常点。
由图4c可知,酵母类别的whisker下限和第一四分位重合于0,表明可能部分已经耗尽蔗糖的酵母菌将水苏糖作为糖源并且充分消耗水苏糖;酵母类别的第一四分位、中位数、第三四分位都低于整体情况,但酵母的四分位间距框却宽于整体情况,说明大部分酵母在24 h的培养时间内对水苏糖的消耗比较充分但个体之间存在较大的差异导致数据不集中,将这些能尽可能消耗大豆糖蜜中蔗糖且几乎不消耗水苏糖的酵母筛选出来即是本研究的主要目的;酵母类别的whisker上限略低于整体情况但差距微小,说明酵母类别对水苏糖利用的极端异常点较少。分析细菌类别的箱线散点情况可知,细菌类别的whisker下限略高于0,说明细菌类别的菌株在24 h的培养时间内不能完全耗尽水苏糖;细菌类别的第一四分位、中位数、第三四分位都略高于整体情况且细菌类别的四分位间距框略窄,说明细菌类别的菌株对水苏糖的利用效率较低,且细菌类别的菌株对水苏糖的利用能力相近导致数据较集中;细菌类别的whisker上限与整体情况差距微小,说明细菌类别对水苏糖利用的极端异常点较少。分析霉菌类别的箱线散点情况可知,霉菌类别的whisker下限高于0,说明酶解类别的菌株在24 h的培养时间内不能完全耗尽水苏糖;霉菌类别的第一四分位、中位数、第三四分位都略高于整体情况且霉菌类别的四分位间距框略窄,说明霉菌类别的菌株与细菌类别的菌株类似,对水苏糖的利用效率较低且利用能力相近导致数据较集中;霉菌类别的whisker上限与整体情况差距微小,说明霉菌类别对水苏糖利用的极端异常点较少。综上所述,酵母类别中各个菌株间对水苏糖的利用能力存在较大差异,虽然部分酵母在24 h内对水苏糖的消耗较为充分,但依然存在大部分对水苏糖消耗效率低的酵母菌,且可以通过调整发酵时间实现水苏糖高保留率。
由图4d可知,酵母类别的whisker下限略高于0,说明所有酵母菌株经过24 h发酵均伴有甘露三糖产生;酵母类别的第一四分位和中位数的间距高度与整体情况的中位数高度差距微小,说明具有不少于半数的酵母产生甘露三糖的能力处于平均水平;酵母类别的第三四分位高度高于整体情况的,说明约有1/4数量的酵母转化甘露三糖的能力高于平均水平;酵母类别的whisker上限与整体情况的差距微小,说明酵母类别对甘露三糖的产生无极端异常点。分析细菌类别的箱线散点情况可知,细菌类别的whisker下限略高于0,同样表明所有细菌菌株经过24 h发酵均伴有甘露三糖产生;细菌的四分位间距框较狭窄并且高度与整体情况的差距微小,说明在24 h的培养时间下不少于半数细菌产生甘露三糖的能力与平均水平基本相同;细菌类别的whisker上限低于整体情况,表明细菌类别对甘露三糖的产生无极端异常点。分析霉菌类别的箱线散点情况可知,霉菌类别的whisker下限略高于0,也表明所有霉菌菌株经过24 h发酵均伴有甘露三糖产生;霉菌的四分位间距框较狭窄并且高度与整体情况的差距微小,说明在24 h的培养时间下不少于半数霉菌产生甘露三糖的能力与平均水平基本相同;霉菌类别的whisker上限低于整体情况的,说明霉菌类别对甘露三糖的产生无极端异常点。综上所述,虽然酵母菌株产生甘露三糖的能力比较突出,但是依然具有不少于半数的酵母产生甘露三糖的能力处于平均水平。
综合上述四个指标的统计分布情况可知,酵母类别的菌株更符合生物净化大豆糖蜜菌株的要求,从酵母类别中进行筛选能更大概率得到生物净化大豆糖蜜的优良菌株,这与已报道有关生物净化大豆糖蜜所用菌株都为酵母结果一致[22,26]。
2.3 生物净化大豆糖蜜菌株的复筛
依据初筛结果并调整酵母培养时间,对初筛中46株酵母进行14 h培养后,分别检测并计算其蔗糖保留率、水苏糖保留率、棉子糖保留率和甘露三糖含量,为便于比较各菌株的性能,将甘露三糖含量转化成百分比的形式即甘露三糖极差化值,复筛阶段各酵母菌株对大豆糖蜜糖成分影响的结果见表1。
表1 复筛阶段各酵母菌株对大豆糖蜜糖成分影响
Table 1 Effects of various yeast strains on the sugar components of soybean molasses in the rescreening stage

菌株名称蔗糖保留率/%棉子糖保留率/%水苏糖保留率/%甘露三糖含量/(mg·mL-1)甘露三糖极差化值/%YS121 YT321 YT131 YA281 YT231 YT253 YS354 YT385 YS385 YS221 YA244 YS214 YS146 YT141 YT344 YT232 YT312 YA133 YS284 YT154 YA382 YT253 77.4 0.0 89.2 15.2 97.2 66.6 94.5 80.7 48.1 90.7 89.9 28.6 81.7 28.7 0.0 96.1 0.0 0.2 92.2 88.0 0.0 0.0 77.7 96.2 81.6 94.1 74.8 61.1 78.1 78.6 57.0 76.6 68.8 87.0 71.3 93.8 88.2 82.3 85.1 73.1 91.8 50.6 97.6 94.0 88.5 43.7 97.8 88.6 99.9 95.8 98.4 92.3 81.2 95.0 94.8 97.7 69.6 84.6 84.6 93.8 72.4 95.4 87.6 91.0 78.0 33.0 14.2 191.4 2.2 69.7 6.6 4.4 4.1 3.2 15.0 4.8 5.2 8.0 25.0 42.6 166.3 8.3 63.2 8.1 2.2 2.2 65.7 185.8 5.0 78.6 0.0 28.1 1.8 0.9 0.8 0.4 5.3 1.1 1.2 2.4 9.5 16.8 68.2 2.5 25.4 2.5 0.0 0.0 26.4 76.3
续表
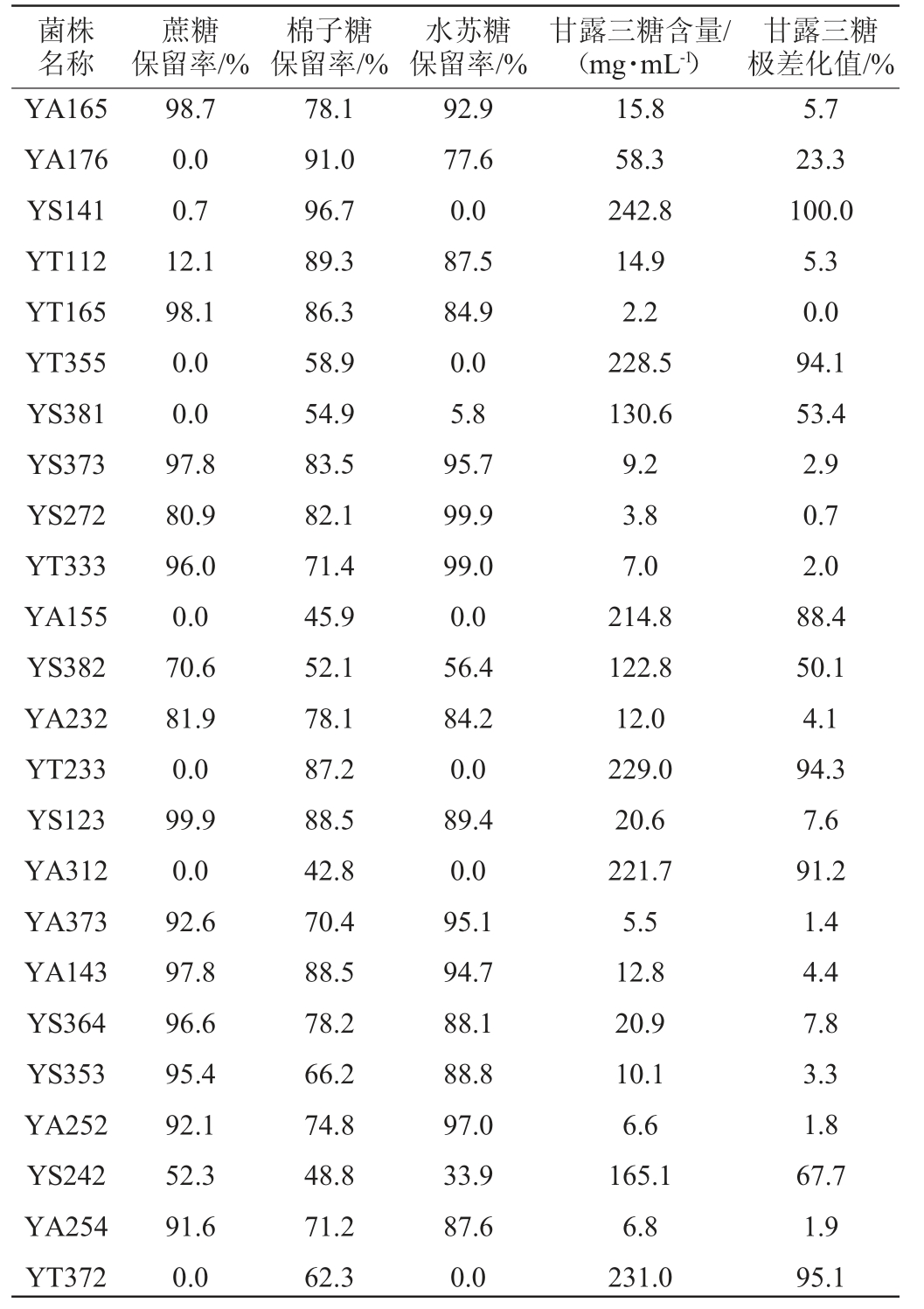
菌株名称蔗糖保留率/%棉子糖保留率/%水苏糖保留率/%甘露三糖含量/(mg·mL-1)甘露三糖极差化值/%YA165 YA176 YS141 YT112 YT165 YT355 YS381 YS373 YS272 YT333 YA155 YS382 YA232 YT233 YS123 YA312 YA373 YA143 YS364 YS353 YA252 YS242 YA254 YT372 98.7 0.0 0.7 12.1 98.1 0.0 0.0 97.8 80.9 96.0 0.0 70.6 81.9 0.0 99.9 0.0 92.6 97.8 96.6 95.4 92.1 52.3 91.6 0.0 78.1 91.0 96.7 89.3 86.3 58.9 54.9 83.5 82.1 71.4 45.9 52.1 78.1 87.2 88.5 42.8 70.4 88.5 78.2 66.2 74.8 48.8 71.2 62.3 92.9 77.6 0.0 87.5 84.9 0.0 5.8 95.7 99.9 99.0 0.0 56.4 84.2 0.0 89.4 0.0 95.1 94.7 88.1 88.8 97.0 33.9 87.6 0.0 15.8 58.3 242.8 14.9 2.2 228.5 130.6 9.2 3.8 7.0 214.8 122.8 12.0 229.0 20.6 221.7 5.5 12.8 20.9 10.1 6.6 165.1 6.8 231.0 5.7 23.3 100.0 5.3 0.0 94.1 53.4 2.9 0.7 2.0 88.4 50.1 4.1 94.3 7.6 91.2 1.4 4.4 7.8 3.3 1.8 67.7 1.9 95.1
由表1可知,不同酵母对大豆糖蜜中蔗糖、棉子糖和水苏糖的利用程度不同,如酵母YS121和YA232等对三种糖的利用程度相近,且在发酵14 h后,三种糖的保留率都比较高,此类酵母菌株不适合大豆糖蜜中功能性低聚糖的生物净化,酵母YA281和YS214等酵母则能优先利用蔗糖而能保留较高含量的棉子糖和水苏糖,是适合生物净化大豆糖蜜制备功能性低聚糖的酵母菌株,酵母YT321和YT253等酵母则在利用蔗糖的同时将水苏糖转化为甘露三糖,虽然水苏糖保留率较低,但因棉子糖保留率较高且生成的甘露三糖也为功能性大豆低聚糖,因此,该类酵母菌株也可作为一类备选用于生物净化大豆糖蜜制备功能性低聚糖酵母,而酵母YT132和YS354等酵母则是一类优先利用棉子糖的酵母,不适合生物净化大豆糖蜜制备功能性低聚糖。
采用SPSS18.0软件将酵母对大豆糖蜜糖成分影响的相关数据进行系统聚类分析,将发酵能力相同或相似的酵母聚为一类,得到聚类结果见图5。由图5可知,这些酵母被明显的聚成五大聚类簇,15小类,表明虽然这些酵母菌对大豆糖蜜中各糖成分利用程度不同,但也存在着相同性,如酵母YT232、YS373、YT131等所在聚类簇主要表现为对大豆糖蜜中三种糖的利用能力都较差,而酵母YS214、YT112、YT312等所在聚类簇则适合大豆糖蜜的生物净化制备功能性低聚糖,其主要体现为优先利用蔗糖,而保留更多的棉子糖和水苏糖。
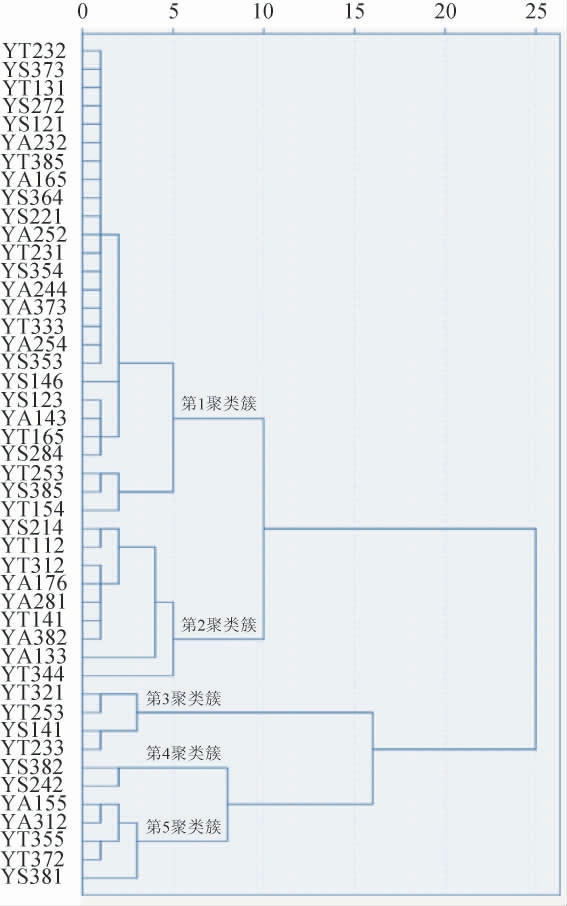
图5 各酵母菌株对大豆糖蜜糖成分利用能力聚类分析结果
Fig.5 Cluster analysis results of the utilization ability of various yeast strains on sugar components in soybean molasses
为了进一步缩小范围,优中选优,挑选出最佳的生物净化大豆糖蜜菌株,在系统聚类分析结果的基础上,选择聚类簇数为k=5,对不同酵母聚类簇的平均发酵能力进行计算,分析绘制得到不同酵母聚类簇发酵能力雷达图见图6。由图6可知,第1聚类簇酵母菌株中其蔗糖保留率、棉子糖保留率和水苏糖保留率均较高,分别为89.4%、75.6%和91.8%,甘露三糖极差化值为3.6%,这表明该类酵母基本不利用大豆糖蜜中的寡糖,其蔗糖几乎没有被利用,起不到生物净化大豆糖蜜的作用,因此,第1聚类簇酵母不适合用来生物净化大豆糖蜜,结果发现,该类菌株数量众多,占了所测试菌株的50%以上。第2聚类簇酵母菌株的蔗糖保留率较低为9.4%,甘露三糖极差化值也较低为22.9%,而棉子糖保留率和水苏糖保留率均较高分别为88.8%和85.2%,由此可见,第2聚类簇酵母是理想的生物净化大豆糖蜜制备功能性大豆低聚糖的菌株。第3聚类簇酵母和第5聚类簇酵母都拥有较低的蔗糖保留率和水苏糖保留率,但却有较高的棉子糖保留率和甘露三糖极差化值,该聚类簇酵母拥有优先利用蔗糖和水苏糖的能力,并且很可能具有将水苏糖降解为甘露三糖的能力,虽然该类菌株水苏糖保留率低,但其基本转化为甘露三糖这种功能性低聚糖,从实际效果上来看,也比较适合用于生物净化大豆糖蜜制备功能性大豆低聚糖的菌株。第4聚类簇酵母则表现为蔗糖保留率、棉子糖保留率、水苏糖保留率和甘露三糖极差化值均处于中等水平,对各种糖利用性能没有差异化,也不是很适合作为生物净化大豆糖蜜制备功能性大豆低聚糖的菌株,从菌株数量占比上来看,该类酵母所占比例较少,仅有酵母YS382和YS242。综上所述,可以优先考虑第2聚类簇酵母菌株进行生物净化大豆糖蜜,这类菌株包括酵母YS214、YT112、YT312、YA176、YA281、YT141、YA382、YA133 和YT344。其次可以考虑第3聚类簇和第5聚类簇酵母,这类菌株分别包 括 酵 母YT321、YT253、YS141 和YT233 以 及YA155、YA312、YT355、YT372和YS381。后续将优先在第2聚类簇酵母实验结果基础上进一步挑选出优异的菌株进行大豆糖蜜的生物净化研究。
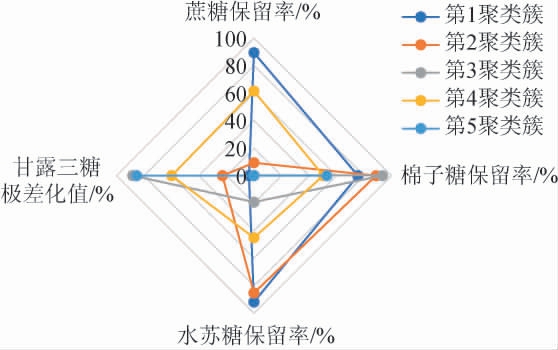
图6 不同酵母聚类簇对大豆糖蜜发酵能力雷达图
Fig.6 Radar diagram of fermentation ability of different yeasts clusters on soybean molasses
3 结论
本研究首先对研究团队筛选保存的210株菌生物净化大豆糖蜜制备功能性大豆低聚糖进行了初步筛选,通过对蔗糖保留率、棉子糖保留率、蔗糖保留率及甘露三糖含量四个指标进行了统计学数据分析,结果表明,酵母类微生物相比其他类别的菌株更适合用于生物净化大豆糖蜜;然后对46株酵母菌进行了复筛,通过对酵母菌处理大豆糖蜜后的各项试验指标进行聚类分析,将这些酵母菌聚为5个聚类簇,其中第2聚类簇酵母YS214、YT112、YT312、YA176、YA281、YT141、YA382、YA133和YT344最符合对大豆糖蜜生物净化制备功能性大豆糖蜜的要求。
[1]SANTO C M D E,PINHEIRO I C,DE JESUS G F A,et al.Soybean molasses as an organic carbon source in the farming of Litopenaeus vannamei(Boone,1931)in a biofloc system[J].Aquac Res,2017,48(4):1827-1835.
[2]RAKITA S,BANJAC V,DJURAGIC O,et al.Soybean molasses in animal nutrition[J].Animals,2021,11(2):514.
[3]SIQUEIRA P F,KARP S G,CARVALHO J C, et al.Production of bioethanol from soybean molasses by Saccharomyces cerevisiae at laboratory,pilot and industrial scales[J].Bioresource Technol,2008,99(17):8156-8163.
[4]LIMA F A, ROLA J C, DE FREITAS M M G, et al.Acid phosphatase immobilization and production study by Trichoderma spp.in soybean molasses[J].Chem Eng Technol,2022,45(5):979-984.
[5]SANCHETI A,THOMPSON E R,JU L K.Factors influencing the enzymatic hydrolysis of soy molasses into fermentation feedstock[J].Enzyme Microb Tech,2023,170:110302.
[6]RODRIGUES M S,MOREIRA F S,CARDOSO V L,et al.Soy molasses as a fermentation substrate for the production of biosurfactant using Pseudomonas aeruginosa ATCC 10145[J].Environ Sci Pollut R,2017,24(22):18699-18709.
[7]LI T,LU X S,YANG X B.Evaluation of clinical safety and beneficial effects of stachyose-enriched alpha-galacto-oligosaccharides on gut microbiota and bowel function in humans[J].Food Funct,2017,8:262-269.
[8]QIAN Y,ZHAO X,SONG J L,et al.Inhibitory effects of resistant starch(RS3)as a carrier for stachyose on dextran sulfate sodium-induced ulcerative colitis in C57BL/6 mice[J].Exp Ther Med,2013,6(5):1312-1316.
[9]HUANG Y,LI D,WANG C,et al.Stachyose alleviates corticosterone-induced long-term potentiation impairment via the gut-brain axis[J].Front Pharmacol,2022,13:799244.
[10]ZHU S Y,LI X P,SONG L Q,et al.Stachyose inhibits vancomycin-resistant Enterococcus colonization and affects gut microbiota in mice[J].Microb Pathogenesis,2021,159:105094.
[11]ASKI H S,HOSEINIFAR S H,BAYANI M,et al.The effects of dietary stachyose as prebiotic on immunity and anti-oxidant related genes′ expression and lipid metabolism in zebrafish(Danio rerio)[J].Ann Anim Sci,2022,22(3):1097-1104.
[12]LONG C C,GIBBONS W R.Conversion of soy molasses,soy solubles,and dried soybean carbohydrates into ethanol[J].Int J Agr Biol Eng,2013,6(1):62-68.
[13]侯越,李振江,王立东.大豆低聚糖的分离纯化研究进展[J].农产品加工,2023(16):79-83.
[14]石云.大豆糖蜜中低聚糖纯化工艺及机理的研究[D].无锡:江南大学,2015.
[15]陈洪生,刁静静,李洪飞,等.模拟移动色谱连续分离大豆低聚糖技术研究[J].中国食品学报,2016,16(10):87-92.
[16]乔威杰,孙延平,王雨,等.树脂在功能性低聚糖分离纯化中的应用进展[J].化学工程师,2022,36(7):59-62.
[17]FAN G S, LIU P X, CHANG X, et al.Isolation and identification of a high-yield ethyl caproate-producing yeast from Daqu and optimization of its fermentation[J].Front Microbiol,2021,12:663744.
[18]FAN G S,CHENG L J,FU Z L,et al.Screening of yeasts isolated from Baijiu environments for 2-phenylethanol production and optimization of production conditions[J].3 Biotech,2020,10:275.
[19]MA J H, CHENG L J, ZHANG Y J, et al.Screening of yeasts isolated from Baijiu environments for producing 3-methylthio-1-propanol and optimizing production conditions[J].Foods,2022,11(22):3616.
[20]陆薇帏,汪立平.纯化功能性大豆低聚糖酵母菌的筛选及发酵特性初步应用[J].食品与发酵工业,2016,42(3):168-171.
[21]刘玉兰,田原,鲍丹青.大豆糖蜜发酵制备功能性大豆低聚糖的研究[J].河南工业大学学报(自然科学版),2010,31(2):1-5.
[22]刘飞,李相昕,葛洪如,等.发酵法精制大豆糖蜜中功能性低聚糖工艺的研究[J].食品工业,2016,37(1):93-98.
[23]崔希庆,刘畅,董银卯,等.发酵法分离提纯大豆糖蜜中低聚糖的研究[J].食品科学,2009,30(23):343-346.
[24]崔希庆,黄鹏,董银卯,等.精化糖蜜中大豆低聚糖的酵母菌株筛选[J].中国食品学报,2010,10(3):58-63.
[25]ZHOU R L,REN ZQ,YE J,et al.Fermented soybean dregs by Neurospora crassa: a traditional prebiotic food[J].Appl Biochem Biotech, 2019,189(2):608-625.
[26]赵华,段盛林,何聪芬,等.发酵法提纯大豆糖蜜中低聚糖的菌株筛选[J].科技导报,2011,29(19):24-28.