白酒是我国传统发酵食品,其酿造历史悠久,文化底蕴深厚,酿制工艺繁复,制得酒体风格多样,自古至今深受大众喜爱。白酒因其酒体风味特征差异而被划分为不同香型,即为清香型、浓香型、酱香型、米香型等[1],其中,清香型白酒所具备的“清香纯正,绵甜爽净,醇甜柔和”典型风格备受消费者青睐,使其销售量在众多香型白酒中名列前茅[2]。清香型白酒的主体呈香物质为乙酸乙酯[3],该物质为酒体提供了苹果和菠萝的水果香气,国标GB/T 10781.2—2022《白酒质量要求第2部分:清香型白酒》中明确规定清香型白酒中的乙酸乙酯含量需≥0.65 g/L(特级),其含量占比直接决定了清香型白酒的整体品质与风格[4],分析影响其原酒中乙酸乙酯含量的因素,并通过主动干预手段是提升原酒质量的重要途径之一[5]。白酒中的乙酸乙酯主要来源于酿酒体系中功能微生物的代谢过程,范光森等[6]在牛栏山酒厂的酿酒菌种库中筛选出1株白地霉(Geotrichum candidum)菌株,该菌株的主要代谢产物为乙酸乙酯、乙酸等,这些风味化合物与清香型白酒的风格特点体现具有密切联系。
产酯酵母作为酿酒体系中的关键微生物之一,主要属于产膜酵母或假丝酵母(Candida),此类酵母能够在生长繁殖过程中利用葡萄糖为底物进一步代谢产生乙醇和乙酸,并且由酯化酶催化生成乙酸乙酯[7-8]等风味酯类化合物,为白酒酿制中乙酸乙酯的生成提供重要贡献[9]。产酯酵母因其菌株功能特点而常被应用在白酒酿造的发酵过程中,是用于强化白酒主体风味物质的有效途径之一。杨强等[10]将从清香型白酒酒曲中筛选获得的4株高产乙酸乙酯的产酯酵母,并将其应用于白酒酿造过程,酿制所得白酒中乙酸乙酯含量显著增加,风味更优,品质明显得以提升;余伟民等[11]在入窖前的糟醅中添加产酯酵母,结果酒体中总酯、四大乙酯类物质等呈味成分含量均有较大幅度的增加,说明在发酵体系中加入产酯酵母可在保持酿制白酒酒体风格的同时,增加酒体的醇厚感,提高原酒酒质。其中,异常威克汉姆酵母(Wickerhamomyces anomalus)作为重要的产香酵母成员,在乙酸乙酯合成方面发挥着显著作用,对中国白酒风味的形成有着特殊的贡献。有研究表明,白酒酿造阶段的第10~30天是微生物产生乙酯类化合物的关键时期,在第10~20天,添加异常威克汉姆酵母NCUF304.1的强化酒醅样品中乙酸乙酯含量显著高于对照组[12],证实了异常威克汉姆酵母是具高产乙酸乙酯性能的优良菌种。
鉴于清香型白酒中乙酸乙酯对其风格和品质影响的重要性,筛选具有高产乙酸乙酯特性的产香酵母,依据菌株生物学特性分析其在发酵体系中合成乙酸乙酯的潜在能力,并对其应用于酿造过程中提升清香型白酒中乙酸乙酯含量具有重要参考意义。因此,本研究利用传统培养分离方法及乙酸乙酯产量测定从清香型白酒大曲中分离筛选高产乙酸乙酯酵母,通过形态学观察及分子生物学技术对其进行菌种鉴定,考察其耐受性,并通过单因素试验及响应面试验优化其产乙酸乙酯的发酵条件,以期为提高清香型白酒品质提供优质的微生物种质资源,在白酒酿造方面具有广阔的应用前景。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
清香型白酒大曲:河北省某酒厂;高粱:山东省临沂市。
1.1.2 试剂
葡萄糖(分析纯)、酵母浸粉、蛋白胨、胰蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;氯化钠(分析纯):福晨(天津)化学试剂有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;乙酸乙酯(色谱纯):美国默克公司;正庚烷(色谱纯):上海麦克林生化科技股份有限公司;耐高温α-淀粉酶(20 000 U/mL)、糖化酶(1×105 U/g):上海源叶生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:胰蛋白胨20 g/L、葡萄糖20 g/L、酵母浸粉10 g/L,115 ℃高压蒸汽灭菌20 min。LB固体培养基:LB液体培养基中添加琼脂粉20 g/L。
马铃薯葡萄糖液体(potatodextrose broth,PDB)培养基:葡萄糖20 g/L;马铃薯200 g/L,115 ℃高压蒸汽灭菌20 min。
LB液体培养基:胰蛋白胨20 g/L、氯化钠10 g/L、酵母浸粉5 g/L,115 ℃高压蒸汽灭菌20 min。固体培养基中添加琼脂粉20 g/L。
高粱酶解培养基[12]:250 g高粱粉碎样品,加入1 L去离子水搅拌均匀,煮沸糊化,加入200 μL耐高温α-淀粉酶,90 ℃液化1 h,冷却后加入0.125 g糖化酶,60 ℃糖化2 h;冷却至室温,用4 层纱布过滤,将滤液以10 000 r/min离心10 min,取上清,调糖度至8°Bx,初始pH为6.0,115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
JY2002电子天平:上海浦春计量仪器有限公司;PHS-3C型pH计:上海精密科学仪器有限公司;TENSUC恒温摇床:上海天呈实验仪器制造有限公司;LHS-100CL恒温恒湿培养箱:上海一恒科学仪器有限公司;TU-19紫外可见分光光度计:北京普析通用仪器有限责任公司;CKX41-F32FL倒置荧光显微镜:日本OLYMPUS公司;Tanon-1600R凝胶成像仪:北京原平皓生物技术有限公司;T100TM Thermal Cycler型梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;YXQ-LS-50SII立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;DYY-2C型电泳仪、EPS301琼脂糖凝胶电泳仪:北京六一仪器厂;1260 Infinity型高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 产乙酸乙酯菌株的分离及筛选
称取清香型白酒大曲1 g,将其重悬于100 mL无菌水中,以10倍递增稀释法稀释至10-7,吸取各稀释菌液0.1 mL分别涂布于YPD固体培养基、PDB培养基和LB固体培养基,在30 ℃条件下培养48 h;依据形态学观察,确定初筛菌株,而后经划线分离纯化后分别斜面低温保藏备用。
将保存的菌株分别接种到YPD液体培养基中,30 ℃、180 r/min条件下活化24 h,然后按2%(V/V)的接种量接种于高粱酶解培养基中,在28 ℃、180 r/min条件下振荡培养24 h(第1阶段为细胞积累阶段),然后加入2%(V/V)的无水乙醇和0.04%(V/V)的乙酸,继续发酵36 h(第2阶段为酯化阶段)。培养结束后,通过检测发酵液中的乙酸乙酯含量筛选出高产乙酸乙酯的菌株。
1.3.2 乙酸乙酯含量的测定
将发酵液于12000r/min离心5min,取上清液,经0.22 μm有机系微孔滤膜过滤后,利用HPLC法(外标法)进行乙酸乙酯含量检测[13]。
1.3.3 高产乙酸乙酯菌株的鉴定
形态学观察:将筛选菌株接种于YPD固体培养基进行活化,30 ℃培养24~48 h后转接至YPD固体培养基,30 ℃条件下培养5 d后,进行菌落形态观察。取微量菌体均匀地涂在载玻片上的无菌水中,固定后用美蓝染色液染色,采用显微镜观察细胞形态。
分子生物学鉴定:将筛选菌株接种于20 mL YPD液体培养基中,在30 ℃、180 r/min条件下培养18 h,吸取1.5 mL培养液,12 000 r/min离心10 min,弃去上清液,利用酵母基因组DNA提取试剂盒提取菌体DNA。以其为模板,采用真菌ITS的通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,PCR扩增体系:Premix Taq DNA聚合酶12.5 μL,引物ITS1和ITS4各0.5 μL,双蒸水(ddH2O)11 μL,DNA模板0.5 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性15 s,50 ℃退火,72 ℃延伸2 min,29个循环;72 ℃再延伸5 min。PCR扩增产物用1.0%琼脂糖凝胶电泳检测合格后委托北京华大基因公司进行测序。将获得的ITS序列提交至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对搜索,选取具有高度相似性的序列,利用MEGA 6.0软件中的邻接(neighbor-joning,NJ)法构建菌株的系统发育树。
1.3.4 高产乙酸乙酯菌株生长曲线的测定
将筛选菌株接种于YPD液体培养基中,30 ℃活化24 h,以2%(V/V)的接种量再次接种于YPD液体培养基中,在30℃、180r/min条件下培养,每小时取样测定OD600 nm值。以培养时间(x)为横坐标,以OD600nm值(y)为纵坐标绘制生长曲线。
1.3.5 高产乙酸乙酯菌株的生物学特性分析
参照文献[13]的方法分别考察筛选菌株对pH(1、2、3、4、5、6、7、8、9、10、11、12)、温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)、葡萄糖含量(0、10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L)、NaCl含量(0、50 g/L、100 g/L、150 g/L、200 g/L、250 g/L、300 g/L)、乙酸含量(0、0.02%、0.04%、0.06%、0.08%、0.10%)、乙醇体积分数(0、2%、4%、6%、8%、10%、12%、14%、16%)、乙酸乙酯含量(0、5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)的耐受性。
1.3.6 高产乙酸乙酯菌株产乙酸乙酯条件优化试验
单因素试验:在方法1.3.1的基础上,只改变单一变量,分别考察乙醇体积分数(0、2%、4%、6%、8%、10%)、乙酸添加量(0、0.01%、0.02%、0.03%、0.04%、0.06%)、接种量(2%、4%、6%、8%、10%、12%)、初始糖度(2°Bx、4°Bx、6°Bx、8°Bx、10°Bx、12°Bx)、初始pH值(2、3、4、5、6、7)、转速(0 r/min、120r/min、150r/min、180r/min、210r/min、240r/min)、发酵温度(18℃、20℃、22℃、24℃、26℃、28℃)、第2阶段发酵时间(12h、24 h、36 h、48 h、60 h、72 h)对筛选菌株产乙酸乙酯的影响。
响应面试验:基于单因素试验结果,确定影响筛选菌株合成乙酸乙酯的3个显著因素,即以发酵温度(A)、初始pH值(B)、初始糖度(C)为考察因素,以乙酸乙酯含量(Y)为响应值,采用Design Expert 8.0.6软件设计3因素3水平的Box-Behnken中心组合试验,试验因素与水平见表1。
表1 发酵条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken tests for fermentation conditions optimization
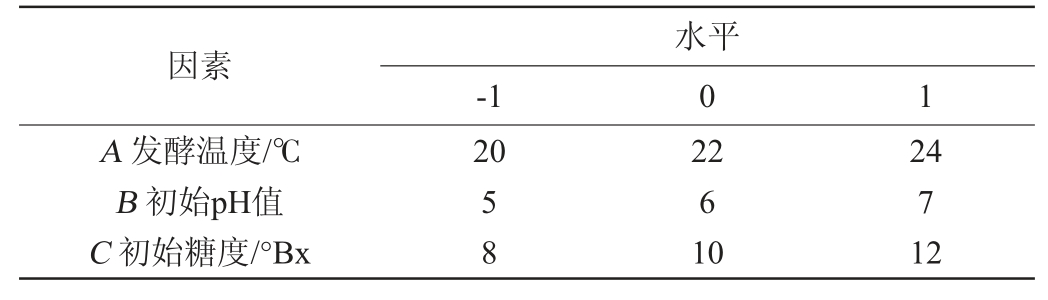
因素A 发酵温度/℃B 初始pH值C 初始糖度/°Bx-1水平0 1 20 58 22 6 10 24 7 12
1.3.7 数据处理
每组试验设置3个生物学重复,利用IBM SPSS Statistics 21软件对数据进行处理和差异显著性分析,结果用“平均值±标准差”形式表示;利用Origin 2022软件进行绘图。
2 结果与分析
2.1 高产乙酸乙酯酵母菌株的筛选
从清香型白酒大曲中共分离筛选到18株具有合成乙酸乙酯能力的菌株,其乙酸乙酯产量见图1。由图1可知,18株酵母菌株的乙酸乙酯产量在0.29~11.87 g/L范围内,其中酵母菌株YM001的乙酸乙酯产量最高,为11.87 g/L。因此,将酵母菌株YM001视为高产乙酸乙酯的目标菌株。

图1 不同酵母菌株的乙酸乙酯产量测定结果
Fig.1 Determination results of ethyl acetate yields of different yeast strains
2.2 菌株YM001的鉴定
2.2.1 形态学观察
菌株YM001在YPD固体培养基上的生长特征见图2。由图2a可知,菌株YM001的菌落表面呈突起的乳白色圆形,光滑干燥且容易挑起;由图2b可知,菌株YM001的细胞呈椭圆形,无菌丝体。依据菌株的菌落形态和显微结构初步鉴定其为酵母菌。
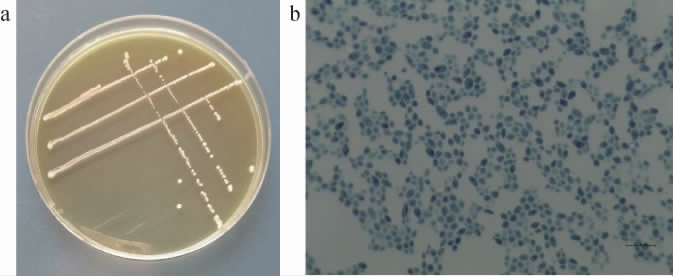
图2 菌株YM001的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphologies of strain YM001
2.2.2 分子生物学鉴定
基于ITS基因序列构建菌株YM001的系统发育树,结果见图3。由图3可知,菌株YM001与异常威克汉姆酵母(Wickerhamomyces anomalus)MG773345.1聚于一支,亲缘关系最近。结合形态学特征,最终鉴定菌株YM001为异常威克汉姆酵母(Wickerhamomyces anomalus)。
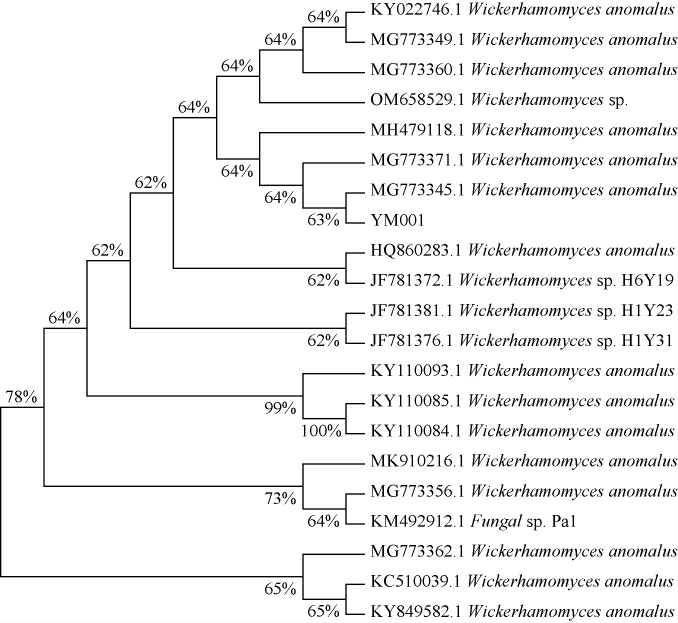
图3 基于ITS基因序列菌株YM001的系统发育树
Fig.3 Phylogenetic tree of strain YM001 constructed based on ITS gene sequences
2.3 异常威克汉姆酵母YM001的生物学特性
白酒酿造过程中环境十分复杂,因此,对环境具有较高耐受性的微生物可在发酵过程中发挥决定性作用。异常威克汉姆酵母YM001对各环境因素的耐受性见表2。
表2 异常威克汉姆酵母YM001的耐受性实验结果
Table 2 Test results of tolerance of Wickerhamomyces anomalus YM001
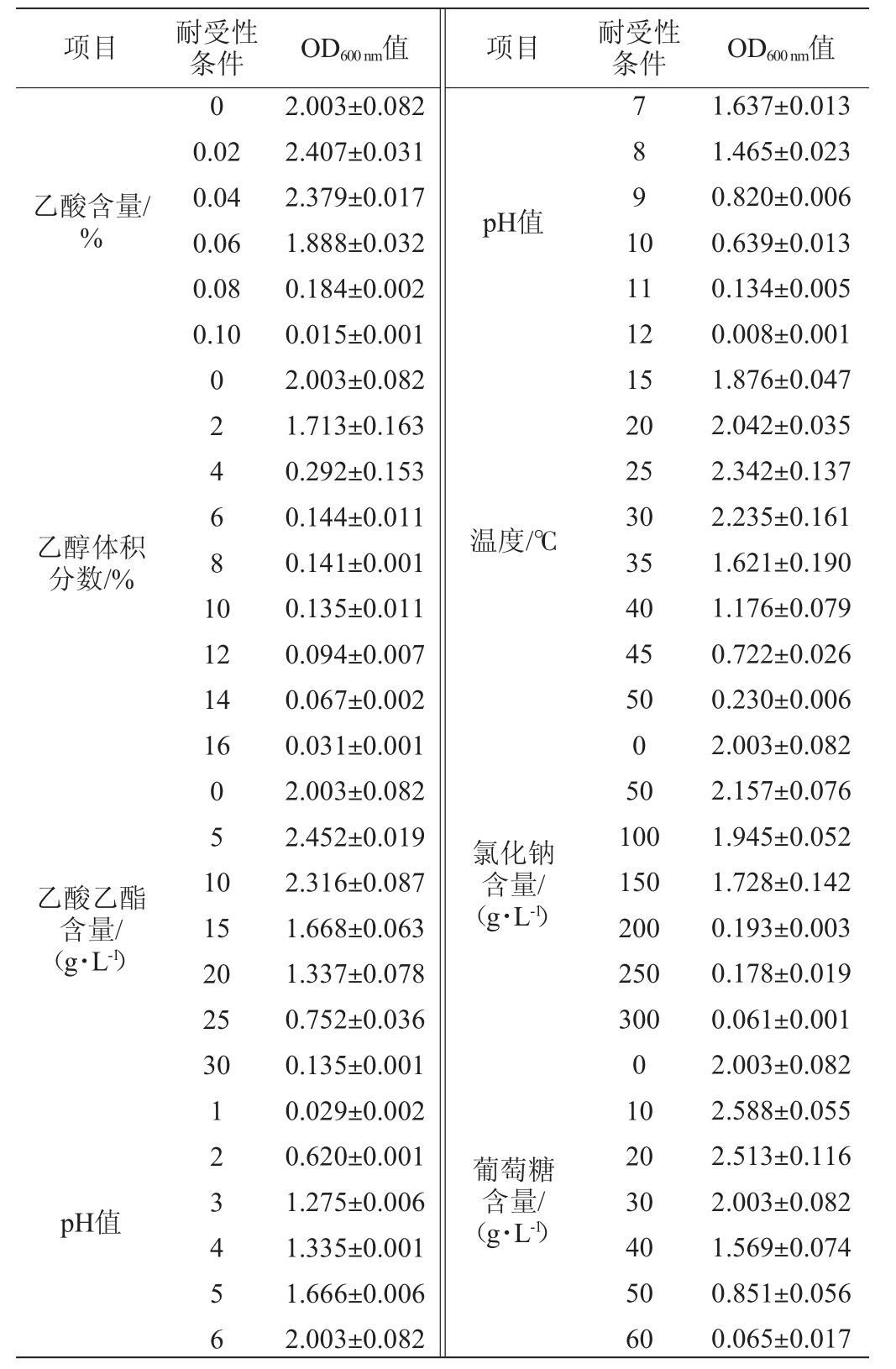
项目 耐受性乙酸含量/%条件 OD600 nm值 项目 耐受性条件 OD600 nm值0 0.02 0.04 0.06 0.08 0.10 pH值7891 0乙醇体积分数/%024681 0温度/℃12 14 16乙酸乙酯含量/(g·L-1)051 0 15 20 25 30氯化钠含量/(g·L-1)pH值123456 2.003±0.082 2.407±0.031 2.379±0.017 1.888±0.032 0.184±0.002 0.015±0.001 2.003±0.082 1.713±0.163 0.292±0.153 0.144±0.011 0.141±0.001 0.135±0.011 0.094±0.007 0.067±0.002 0.031±0.001 2.003±0.082 2.452±0.019 2.316±0.087 1.668±0.063 1.337±0.078 0.752±0.036 0.135±0.001 0.029±0.002 0.620±0.001 1.275±0.006 1.335±0.001 1.666±0.006 2.003±0.082葡萄糖含量/(g·L-1)11 12 15 20 25 30 35 40 45 50 0 50 100 150 200 250 300 0 10 20 30 40 50 60 1.637±0.013 1.465±0.023 0.820±0.006 0.639±0.013 0.134±0.005 0.008±0.001 1.876±0.047 2.042±0.035 2.342±0.137 2.235±0.161 1.621±0.190 1.176±0.079 0.722±0.026 0.230±0.006 2.003±0.082 2.157±0.076 1.945±0.052 1.728±0.142 0.193±0.003 0.178±0.019 0.061±0.001 2.003±0.082 2.588±0.055 2.513±0.116 2.003±0.082 1.569±0.074 0.851±0.056 0.065±0.017
由表2可知,随着乙醇体积分数的增加,菌株YM001的生长逐渐受到抑制,当乙醇体积分数>10%之后,菌株YM001只能微弱生长,因此,其最高可耐受体积分数10%的乙醇,属于高乙醇耐受性菌株[13],这一特性有利于其在实际生产应用中应对高乙醇体积分数的白酒酿造环境。菌株YM001对乙酸的耐受性较低,当乙酸含量>0.08%之后,生长几乎停滞,但其可耐受30 g/L的乙酸乙酯,高于已有研究结果的22 g/L[14-15]。同时,菌株YM001还具较宽广的pH适应性,在pH 2~12范围内的培养条件下均可生长,其在pH为3~10时生长旺盛,最适pH为6,略高于一般酵母的最适生长pH(4~5.5)[16]。菌株YM001在温度为15~50 ℃范围内均能生长,且在25~30 ℃时生长较为旺盛,与大多数酵母生长最适温度范围一致。此外,菌株YM001对NaCl和葡萄糖均有一定的耐受性,当NaCl质量浓度≤150 g/L之前,菌株YM001能生长,而当NaCl质量浓度>150 g/L之后,菌株YM001的生长受到抑制;当葡萄糖质量浓度≤50 g/L之前仍具有生长能力,当葡萄糖质量浓度>50 g/L之后只能微弱生长。综上,菌株YM001具有较强的耐受性,在乙醇体积分数10%,乙酸含量0.08%、温度50 ℃、pH 2、乙酸乙酯含量30 g/L、NaCl含量150 g/L、葡萄糖含量50 g/L的条件下仍能生长,能够较好地适应白酒酿造环境具备潜在的生产应用优势。
2.4 异常威克汉姆酵母YM001产乙酸乙酯发酵条件优化单因素试验
2.4.1 乙醇体积分数对菌株YM001产乙酸乙酯的影响
乙醇作为酵母合成乙酸乙酯的必要前体,是决定乙酸乙酯产量的重要因素之一[13]。因此,考察乙醇体积分数对菌株YM001产乙酸乙酯的影响,结果见图4。由图4可知,乙醇对菌株YM001产乙酸乙酯有促进作用。不添加乙醇时,菌株YM001的乙酸乙酯产量仅为0.33 g/L;当添加适量的乙醇时(<4%),菌株的乙酸乙酯产量随乙醇体积分数的增加而显著提高,但过高的乙醇体积分数(>4%)会抑制菌株YM001的正常生长,导致乙酸乙酯产量大幅下降。当乙醇体积分数为4%时,菌株YM001的乙酸乙酯产量最高,达到12.23 g/L。因此,确定最佳乙醇体积分数为4%。
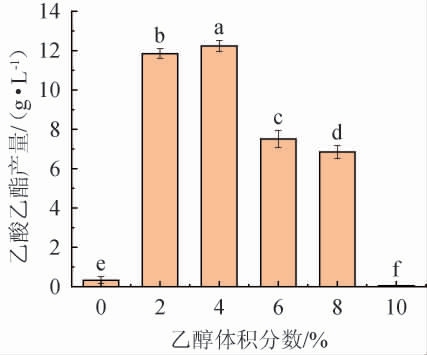
图4 乙醇添加量对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.4 Effect of ethanol addition on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
不同小写字母表示差异显著(P<0.05)。下同。
2.4.2 乙酸添加量对菌株YM001产乙酸乙酯的影响
乙酸作为酵母合成乙酸乙酯的另一重要前体,其对乙酸乙酯产量的影响与乙醇类似。因此,考察不同乙酸添加量对菌株YM001产乙酸乙酯的影响,结果见图5。
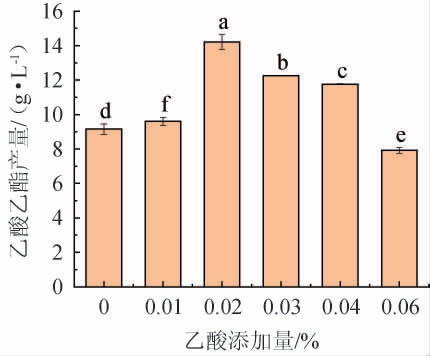
图5 乙酸添加量对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.5 Effect of acetic acid addition on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
由图5可知,不添加乙酸时,菌株YM001也可产生一定量的乙酸乙酯,这与乙醇对于乙酸乙酯形成的重要作用存在明显不同。当添加适量的乙酸时(<0.02%),随着乙酸添加量的增加,乙酸乙酯产量升高,但过高的乙酸添加量(>0.02%)不利于乙酸乙酯合成。当乙酸添加量为0.02%时,菌株YM001的乙酸乙酯产量最高,为14.21 g/L。因此,确定最佳乙酸添加量为0.02%。
2.4.3 接种量对菌株YM001产乙酸乙酯的影响
接种量对菌株YM001产乙酸乙酯的影响见图6。由图6可知,随着接种量的升高,乙酸乙酯含量呈先升高后下降的趋势,分析原因可能是,接种量过低,菌株YM001产乙酸乙酯能力受限;接种量过高会消耗更多营养物质或产生菌株之间的相互竞争,从而影响菌株YM001的生长状态,抑制其合成乙酸乙酯的能力。当接种量为4%时,酵母YM001的乙酸乙酯产量最高,达到14.61 g/L。因此,确定最佳接种量为4%。
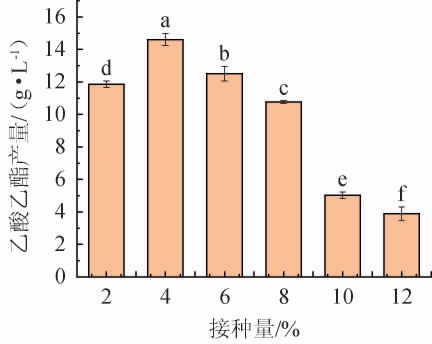
图6 接种量对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.6 Effect of inoculum on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
2.4.4 初始糖度对菌株YM001产乙酸乙酯的影响
不同初始糖度对菌株YM001产乙酸乙酯的影响见图7。
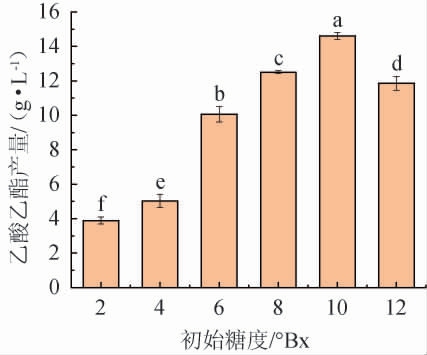
图7 初始糖度对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.7 Effect of initial sugar content on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
由图7可知,随着初始糖度的升高,菌株YM001的乙酸乙酯产量呈先升高后下降的趋势,当初始糖度为10°Bx时,菌株YM001的乙酸乙酯产量最高,为14.97 g/L。分析原因可能是,高粱酶解液初始糖度较低时,酵母生长繁殖所需碳水化合物含量不足,影响其所产乙酸乙酯含量;随初始糖度的增加,酵母生长繁殖所需能源得到补充,代谢活动变得活跃,从而促进了乙酸乙酯的合成;然而初始糖度过高时,渗透压增加,影响菌株正常生长,进而抑制菌株产乙酸乙酯的能力[13]。因此,确定最佳初始糖度为10°Bx。
2.4.5 初始pH对菌株YM001产乙酸乙酯的影响
发酵是一个复杂的动态过程,pH是影响发酵过程的重要参数之一,对酵母中与新陈代谢有关的酶的活性和培养环境中营养物质的状态有一定影响,从而影响酵母对营养物质的吸收和利用,进而影响其生长和新陈代谢[17]。已有研究表明,在偏酸性条件下更有利于菌株合成酯类物质[18],因此,选取了初始pH为2~7的范围考察pH对菌株YM001合成乙酸乙酯能力的影响,结果见图8。
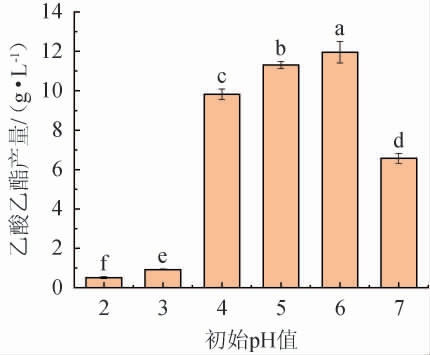
图8 初始pH对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.8 Effect of initial pH on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
由图8可知,随着初始pH的增加,乙酸乙酯产量呈先升高后下降的趋势;当初始pH到达6时,乙酸乙酯产量达到最高,为11.99 g/L。因此,确定最佳初始pH值为6。
2.4.6 转速对菌株YM001产乙酸乙酯的影响
振荡培养转速与发酵体系中溶氧量密切相关,而氧气对菌株合成乙酸乙酯至关重要[13]。因此,考察转速对菌株YM001产乙酸乙酯的影响,结果见图9。

图9 转速对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.9 Effect of rotation speed on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
由图9可知,静置培养时,菌株YM001几乎不能产生乙酸乙酯。当振荡培养转速增加时,培养基中溶氧量增加,乙酸乙酯产量显著提升,表明酵母YM001合成乙酸乙酯是一个需氧过程,这与以往的研究结论一致[19]。当转速达到210 r/min时,菌株YM001的乙酸乙酯产量达到最高,为16.01 g/L,因此,确定最佳转速为210 r/min。
2.4.7 发酵温度对菌株YM001产乙酸乙酯的影响
发酵温度对菌株YM001产乙酸乙酯的影响见图10。由图10可知,随着发酵温度的升高,菌株YM001的乙酸乙酯产量呈先升高后下降的趋势,当发酵温度为22 ℃时,菌株YM001的乙酸乙酯产量最高,为16.92 g/L,说明较低的温度更利于菌株YM001合成乙酸乙酯,这与黄光建等[20]的研究结论一致,而且该菌株的最适产酯温度比前人的研究结果更低[21]。分析原因可能是在低温状态下,乙酸乙酯挥发性损失较小,且不易分解,发酵体系中能够积累更高浓度的产物[22-23]。因此,确定最佳发酵温度为22 ℃。
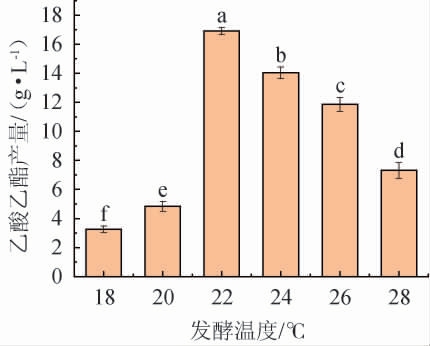
图10 发酵温度对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.10 Effect of fermentation temperature on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
2.4.8 发酵时间对菌株YM001产乙酸乙酯的影响
对菌株培养第2阶段的发酵时间进行研究,结果见图11。

图11 发酵时间对异常威克汉姆酵母YM001产乙酸乙酯的影响
Fig.11 Effect of fermentation time on the yield of ethyl acetate produced by Wickerhamomyces anomalus YM001
由图11可知,在发酵前期(<36 h),菌株YM001的乙酸乙酯产量呈线性增加;当发酵时间为36 h时,乙酸乙酯产量最高,为11.89 g/L;继续随着发酵时间的延长,乙酸乙酯产量开始呈下降趋势,这与钟姝霞等[24]的研究结果一致。因此,确定第2阶段最佳发酵时间为36 h。
2.5 异常威克汉姆酵母YM001产乙酸乙酯发酵条件优化响应面试验
以单因素试验结果为基础,固定接种量4%、乙醇体积分数4%、乙酸添加量0.02%、转速210 r/min、第2阶段发酵时间36 h,选择对乙酸乙酯产量影响显著的3个因素发酵温度(A)、初始pH值(B)、初始糖度(C)作为考察指标,以乙酸乙酯产量(Y)为响应值,采用Design Expert 8.0.6设计3因素3水平的Box-Behnken中心组合试验,试验设计及结果见表3,方差分析见表4。
表3 发酵条件优化Box-Behnken中心组合试验设计及结果
Table 3 Design and results of Box-Behnken center combination tests for fermentation conditions optimization
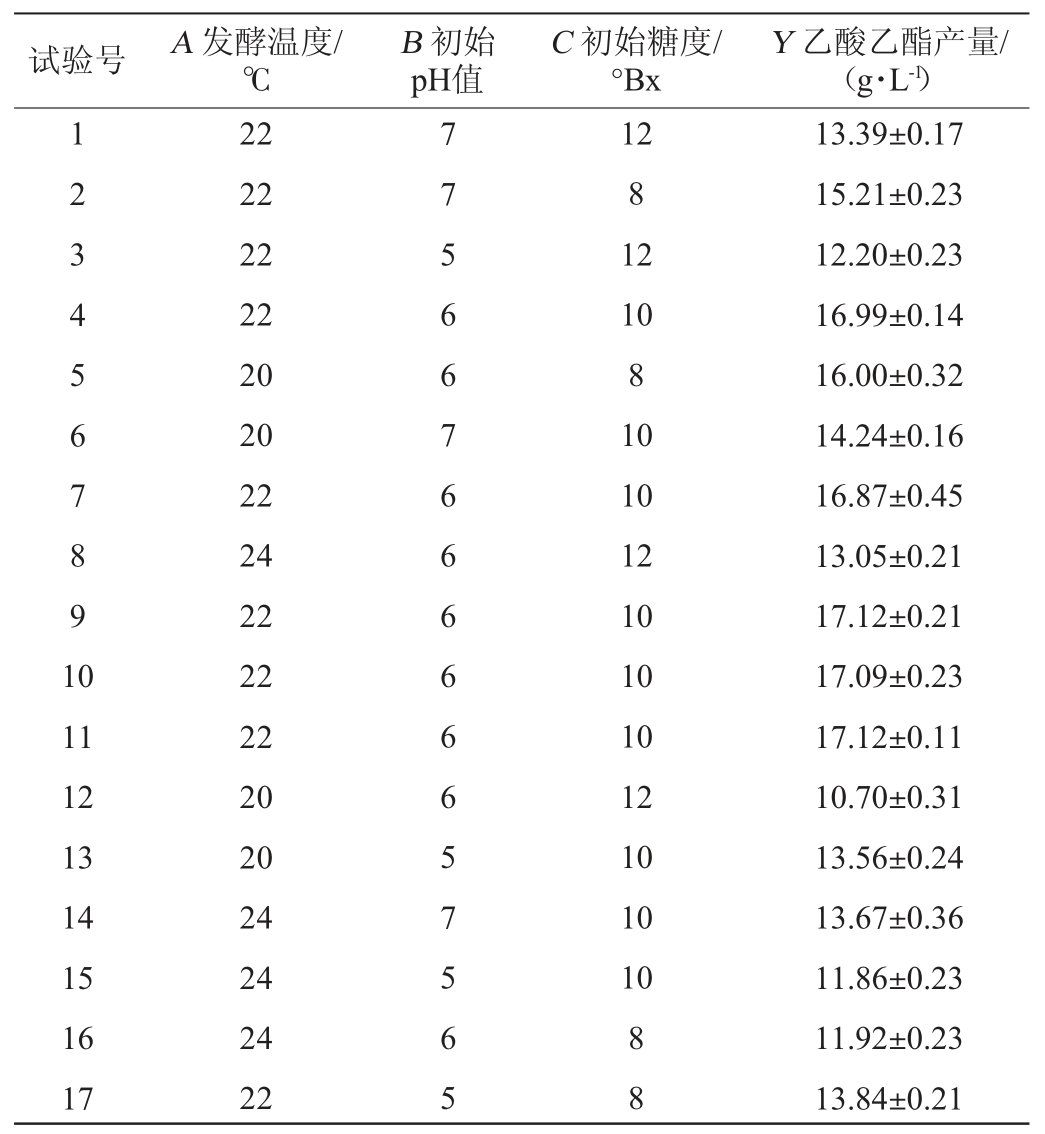
试验号 A 发酵℃温度/B p H初值始C 初°始Bx糖度/Y 1 22712 2 2278乙酸乙酯产量/(g·L-1)34567891 0 11 12 13 14 15 16 17 22 22 20 20 22 24 22 22 22 20 20 24 24 24 22 566766666657565 12 10 8 10 10 12 10 10 10 12 10 10 10 8 8 13.39±0.17 15.21±0.23 12.20±0.23 16.99±0.14 16.00±0.32 14.24±0.16 16.87±0.45 13.05±0.21 17.12±0.21 17.09±0.23 17.12±0.11 10.70±0.31 13.56±0.24 13.67±0.36 11.86±0.23 11.92±0.23 13.84±0.21
表4 回归模型方差分析
Table 4 Variance analysis of regression model
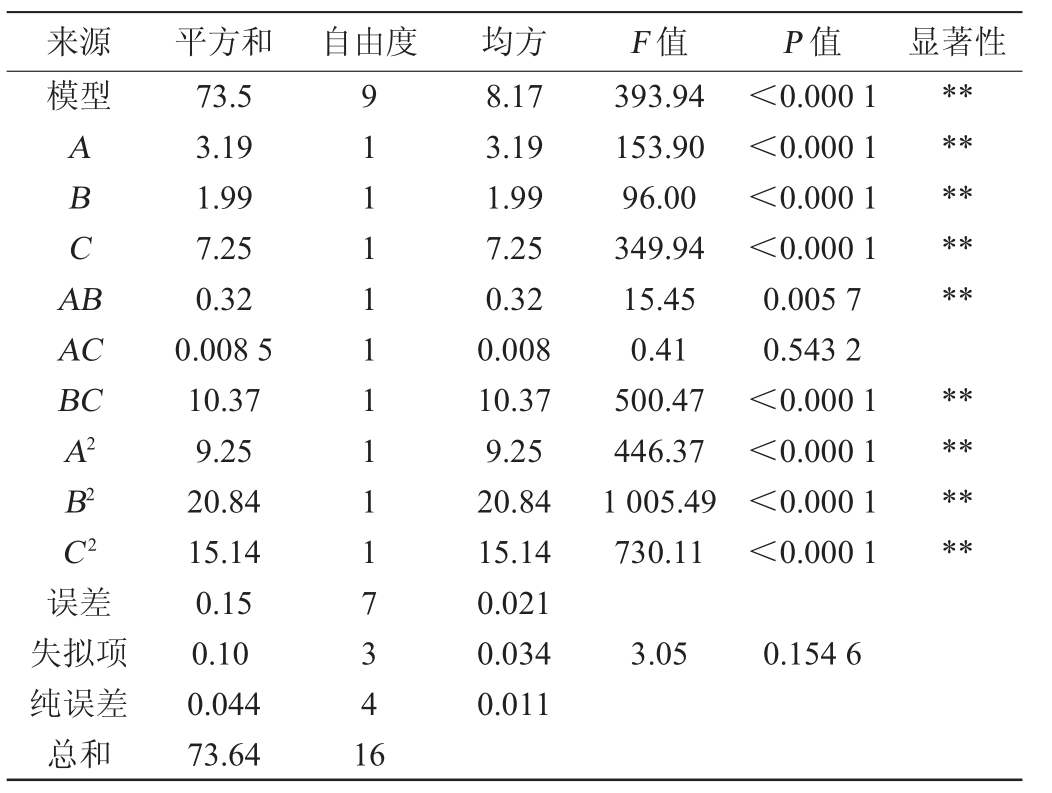
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B**********AC BC A2 B2 C2误差失拟项纯误差总和73.5 3.19 1.99 7.25 0.32 0.008 5 10.37 9.25 20.84 15.14 0.15 0.10 0.044 73.64 91111111117341 6 8.17 3.19 1.99 7.25 0.32 0.008 10.37 9.25 20.84 15.14 0.021 0.034 0.011 393.94 153.90 96.00 349.94 15.45 0.41 500.47 446.37 1 005.49 730.11<0.000 1<0.000 1<0.000 1<0.000 1 0.005 7 0.543 2<0.000 1<0.000 1<0.000 1<0.000 1********3.05 0.154 6
使用Design Expert 8.0.6软件对表3结果进行二次多项式回归拟合,得到回归方程:Y=17.04+0.63A-10.50B-0.95C+0.28AB-0.046AC+1.61BC-1.48A2-2.22B2-1.90C2。
由表4可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明模型可靠。决定系数R2=0.998 0,校正决定系数R2Adj=0.995 5,说明该回归方程拟合程度高,能较好地预测乙酸乙酯产量随发酵温度、初始pH值和初始糖度的变化规律。由P值可知,各因素对乙酸乙酯产量的影响程度存在差异,一次项A、B、C,交互相AB、BC及二次项A2、B2、C2对乙酸乙酯产量影响极显著(P<0.01)。由F值可知,各因素对结果影响顺序为初始糖度(C)>发酵温度(A)>初始pH值(B)。
通过绘制三维响应曲面图探究两因素间交互作用对菌株YM001产乙酸乙酯的影响,结果见图12。响应曲面坡度越陡,等高线越密集,说明两个因素之间的交互作用越明显。由图12可知,各因素间交互作用的响应面均呈抛物面,存在极大值点,其中交互相AB、BC的响应曲面坡度较越陡,说明对结果影响较大,这与方差分析结果一致。
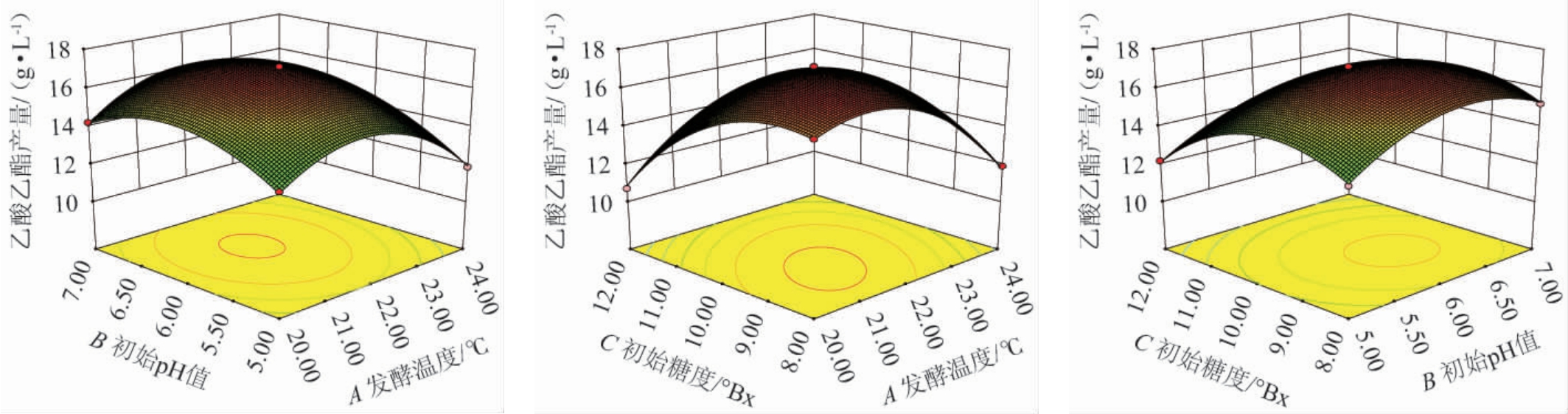
图12 发酵温度、初始pH值和初始糖度间交互作用对乙酸乙酯产量影响的响应曲面及等高线
Fig.12 Response surface plots and contour lines of effect of interaction between fermentation temperature, initial pH and initial sugar content on the ethyl acetate yield
采用Design Expert 8.0.6软件对回归方程进行最优求解,得出菌株YM001产乙酸乙酯的最优发酵条件为发酵温度21.67 ℃、初始pH 6.20、初始糖度9.25°Bx,在此条件下乙酸乙酯产量预测值为17.31 g/L。为便于实际操作,将最优条件修正为发酵温度22 ℃,初始pH值6,初始糖度9°Bx,在此条件下进行3次平行验证试验,菌株YM001的乙酸乙酯产量实际值为(17.39±0.362)g/L,与预测值接近,说明该模型可较准确的预测菌株YM001合成乙酸乙酯的最优发酵条件。重要的是,酵母YM001的乙酸乙酯最终合成量高于同类研究所有相关报道[25],处于国内外绝对领先水平。
3 结论
本研究从清香型白酒大曲中分离筛选得到1株高产乙酸乙酯的酵母YM001,通过形态观察及分子生物学技术鉴定其为异常威克汉姆酵母(Wickerhamomyces anomalus)。该菌株具有较强的耐受性,在乙醇体积分数10%,乙酸含量0.08%、温度50 ℃、pH 2、乙酸乙酯含量30 g/L、NaCl含量150 g/L、葡萄糖含量50 g/L的条件下仍能生长,能够较好地适应白酒酿造环境。通过单因素试验及响应面试验确定异常威克汉姆酵母YM001产乙酸乙酯的最优发酵条件为接种量4%、乙醇体积分数4%、乙酸添加量0.02%、初始糖度9°Bx、初始pH值6、转速210 r/min、发酵温度22 ℃、第2阶段发酵时间36 h。在此优化条件下,乙酸乙酯产量高达(17.39±0.362)g/L,为其应用于实际生产中提供了优异的种质资源和理论保障。
[1]孙宝国.国酒[M].北京:化学工业出版社,2019:4-25.
[2]ZHANG H M,MENG Y J, WANG Y L, et al.Prokaryotic communities in multidimensional bottom-pit-mud from old and young pits used for the production of Chinese strong-flavor Baijiu[J].Food Chem, 2020, 312:126084.
[3]任金玫,陈君平,李志健,等.十二种香型白酒相关研究概况[J].中国酿造,2022,41(4):13-19.
[4]国家市场监督管理总局,国家标准化管理委员会.10781.2—2022《白酒质量要求第2部分:清香型白酒》[S].北京:中国标准出版社,2022.
[5]高文静,甄攀,李惠源,等.基于响应面法优化高产乙酸乙酯清香型白酒大米查酒醅发酵工艺[J].中国酿造,2023,42(1):155-159.
[6]范光森,王允中,刘朋肖,等.醇酰基转移酶催化合成白酒中的乙酸乙酯研究进展[J].中国食品学报,2020,20(11):294-304.
[7]王若帆,侯茂,谢梦忆,等.酒糟粗提物对肝癌细胞HepG2增殖的抑制作用[J].食品工业科技,2021,42(21):392-399.
[8]LI W, WANG J H, ZHANG C Y, et al.Regulation of Saccharomyces cerevisiae genetic engineering on the production of acetate esters and higher alcohols during Chinese Baijiu fer-mentation[J].J Ind Microbiol Biot,2017,4:949-960.
[9]田德雨,闫子茹,危晶晶,等.清香型白酒酿造微生物和风味物质的研究进展[J].中国酿造,2021,40(4):20-25.
[10]杨强,唐洁,杨生智,等.清香型小曲白酒产酯酵母的筛选及应用[J].酿酒科技,2016(1):78-80.
[11]余伟民,徐小明,林培,等.生香酵母对特香型白酒风味风格的影响研究[J].酿酒科技,2012(1):24-27.
[12]秦立芹,马景浩,李二浩,等.一株源于北派酱香白酒酿造环境中产淀粉酶细菌的筛选、鉴定及其特性研究[J].中国酿造,2021,40(11):154-160.
[13]FAN G S, SUN B G, XU D, et al.Isolation and identification of high yield ethyl acetate-producing yeast from Gujinggong Daqu and its fer mentation characteristics[J].J Am Soc Brew Chem,2018,76(2):117-124.
[14]王金龙,程平言,陆伦维,等.基于DB-WAX UI色谱柱气相色谱法检测5种香型白酒中45种挥发性风味物质[J].中国酿造,2023,42(4):238-243.
[15]DING X F, WU C D, HUANG J, et al.Characterization of interphase volatile compounds in Chinese Luzhou-flavor liquor fermentation cellar analyzed by head space-solid phase micro extraction coupled with gas chromatography mass spectrometry(HS-SPME/GC/MS)[J].LWT-Food Sci Technol,2016,66:124-133.
[16]LOSER C,URIT T,BLEY T.Perspectives for the biotechnological production of ethyl acetate by yeasts[J].Appl Microbiol Biotechnol,2014,98(12):5397-5415.
[17]杨小冲,陈忠军,赵洁,等.紫外诱变选育耐酸酵母菌株及其特性研究[J].中国酿造,2017,36(10):109-113.
[18]侯建光,郭富祥,樊建辉,等.陶香型窖池中1株高产乙酸乙酯酵母的筛选与鉴定[J].酿酒科技,2016(11):56-59.
[19]HASHEM M,ALAMRI S A,ASSERI T A Y,et al.On the optimization of fermentation conditions for enhanced bioethanol yields from starchy biowaste via yeast co-cultures[J].Sustainability,2021,13(4):1890.
[20]黄光建,徐学锋,郭梅君,等.豉香型白酒酒饼中高产乙酸乙酯酵母菌的分离鉴定及发酵性能研究[J].食品工业科技,2015,36(11):153-158.
[21]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021:40(8):76-80.
[22]LÖSER C,URIT T,STUKERT A,et al.Formation of ethyl acetate from whey by Kluyveromyces marxianus on a pilot scale[J].J Biotechnol,2013,163(1):17.
[23]赵蒙,孙安,陈龙.发酵酒中高级醇的研究进展[J].中国酿造,2023,42(5):9-14.
[24]钟姝霞,万世旅,边名鸿,等.一株高产乙酸乙酯酵母的鉴定及产酯条件的研究[J].中国酿造,2017,36(2):75-79.
[25]刘薇,栾春光,王德良,等.高产酯酵母的筛选、鉴定及其发酵特性研究[J].食品与发酵工业,2021,47(23):311-318.