受全球气候变暖等众多因素的影响,我国西部葡萄酒产区葡萄原料糖分过高、酸度过低的现象愈发突出,导致葡萄酒中乙醇浓度过高,使葡萄酒在口感上失去平衡的同时也易被微生物污染[1]。目前,关于葡萄酒增酸的方法主要包括直接添加酸类物质(酒石酸或柠檬酸等)、通过电膜处理、葡萄园管理或使用酸化剂微生物等[2]。葡萄酒的酸度主要受酒石酸、苹果酸、柠檬酸和乳酸的影响,其中,酒石酸能与K+结合产生酒石酸盐,形成沉淀;苹果酸和柠檬酸不稳定,可能会引起不良的再发酵、浑浊和挥发性酸高等问题;然而乳酸具有稳定性高、口感柔和等优点,成为理想的增酸方法[3-4]。近年来,随着对非酿酒酵母(non-Saccharomyces)研究的不断深入,发现葡萄酒在发酵过程中可利用非酿酒酵母产生乳酸,使其口感柔和,性质稳定[5-6]。因此,非酿酒酵母用于葡萄酒生物增酸具有极大潜力,逐渐成为近年来的研究热点。
耐热克鲁维酵母(Lachancea thermotolerans)以前被称为Kluyveromyces thermotolerans,其形态与酿酒酵母(Saccharomyces cerevisiae)相似,因其在酒精发酵过程中能够高产L-乳酸而被广泛应用于葡萄酒及果酒的生物增酸中[2]。然而不同L.thermotolerans菌株在葡萄酒酿造过程中产乳酸的能力(生物增酸能力)存在很大的差异,HRANILOVIC′A等[7]研究发现,94株不同的L.thermotolerans菌株在相同的葡萄汁中发酵产生的乳酸含量在1.8~12 g/L之间,显著影响葡萄酒的pH值(3.2~3.8)。据报道,目前L.thermotolerans在发酵过程中最多能代谢产生16.6 g/L的乳酸[8],因此,L.thermotolerans产生的乳酸对葡萄酒微生物的稳定性以及感官平衡产生积极地影响。此外,与其他非酿酒酵母一样,L.thermotolerans不仅能够改善葡萄酒的香气轮廓及组成,还能够有效提高葡萄酒的生物稳定性和颜色稳定性等[9-12]。因此,筛选到能够有效增酸且具有优良发酵性状的L.thermotolerans对于提高葡萄酒酸度及感官品质具有重要意义。
本研究以16株本土L.thermotolerans为研究对象,通过测定菌株在灭菌葡萄汁中的产乳酸能力及耐受性筛选优良的增酸菌株,并利用筛选菌株分别与商业S.cerevisiae对霞多丽葡萄汁进行共发酵,通过测定霞多丽葡萄酒的理化指标、乳酸含量、挥发性风味化合物等参数筛选能够有效增加葡萄酒酸度并对葡萄酒香气产生积极影响的优良本土L.thermotolerans,以期为L.thermotolerans在葡萄酒发酵中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
16株L.thermotolerans菌株:均从甘肃河西走廊产区的酿酒葡萄表皮中分离获得,保存于武威职业学院微生物实验室;商业酿酒酵母EC1118:法国拉曼(Lallemand)公司。
霞多丽葡萄汁:新疆张裕巴堡男爵酒庄低温澄清后的清汁,总糖含量为227.3 g/L,总酸含量为5.86 g/L,pH为3.53。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[1]:20 g/L葡萄糖,20 g/L蛋白胨,10 g/L酵母浸粉。YPD固体培养基:YPD液体培养基中添加20 g/L琼脂粉。121 ℃高压蒸汽灭菌15 min。
沃勒斯坦实验室营养(Wallerstein laboratory nutrient,WLN)培养基:上海哈灵生物科技有限公司。使用时添加100 mg/L的氯霉素,以抑制细菌的生长。
1.1.3 试剂
儿茶素、橡黄素、咖啡酸和没食子酸等标准品(纯度均>98%):上海源叶生物科技有限公司;挥发性风味物质标准品(均为色谱纯):美国Sigma-Aldrich公司。其他试剂均为国产分析纯。
1.2 仪器与设备
HP1020凝胶成像系统:美国Bio-Rad公司;CX43双目显微镜:奥林巴斯(中国)有限公司;LS-50LD立式高压灭菌锅:武汉科尔达医疗科技有限公司;AUY120电子天平、LC-16高效液相色谱(high performance liquid chromatography,HPLC)仪、QP2020气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)仪:日本岛津公司;PB-10 pH计:德国Sartorius公司;Cary 60紫外可见分光光度计:美国安捷伦公司;KQ-300DE超声波清洗仪:昆山超声仪器公司。
1.3 方法
1.3.1 高产乳酸耐热克鲁维酵母菌株的筛选
将甘油管保藏的热克鲁维酵母菌株划线接种于YPD固体培养基上,28 ℃条件下培养48 h;挑取平板上的单菌落接种于YPD液体培养基中,在28 ℃、140 r/min条件下振荡培养24 h作为种子液,备用。
霞多丽葡萄汁中添加400 μL/L的焦碳酸二甲酯(dimethyl dicarbonate,DMPC),4 ℃低温静置12 h。
将耐热克鲁维酵母菌株的种子液接种于装有100 mL霞多丽葡萄汁的250 mL锥形瓶中(每组重复3次),使酵母活菌数终浓度为1×106 CFU/mL,置于25 ℃条件下进行静置发酵,每隔24 h取样测定还原糖的含量,当还原糖含量连续3 d不变则视为发酵结束,测定发酵液中的乳酸含量。
1.3.2 高产乳酸耐热克鲁维酵母菌株的耐受性分析
乙醇耐受性:使用无水乙醇调节YPD培养基中的乙醇体积分数分别为6%、8%、10%、12%和14%。将高产乳酸耐热克鲁维酵母的种子液以1×105 CFU/mL的接种量接种到100 mL培养基中,28 ℃条件下静置培养48 h后,测定发酵液在波长600 nm处的吸光度值。
SO2耐受性:使用亚硫酸调节YPD培养基中的SO2质量浓度分别为50 mg/L、80 mg/L、100 mg/L、120 mg/L和150 mg/L。将高产乳酸耐热克鲁维酵母的种子液以1×105CFU/mL的接种量接种到100 mL培养基中,28 ℃条件下静置培养48 h后,测定发酵液在波长600 nm处的吸光度值。
pH耐受性:使用磷酸-柠檬酸缓冲溶液调节YPD培养基中的pH值分别为3.2、3.4、3.6、3.8和4.0。将高产乳酸耐热克鲁维酵母的种子液以1×105CFU/mL的接种量接种到100 mL培养基中,28 ℃条件下静置培养48 h后,测定发酵液在波长600 nm处的吸光度值。
温度耐受性:将高产乳酸耐热克鲁维酵母的种子液以1×105 CFU/mL的接种量接种到100 mL的YPD培养基中,分别在18 ℃、22 ℃、25 ℃、28 ℃条件下静置培养48 h后,测定发酵液在波长600 nm处的吸光度值。
1.3.3 霞多丽葡萄酒的酿造
在霞多丽葡萄汁中添加60 mg/L SO2,以商业酿酒酵母EC1118的单独接种作为对照组,接种量为2×106 CFU/mL;将高产乳酸的L.thermotolerans菌株按照1×106 CFU/mL的接种量接种于1 L霞多丽葡萄汁中,同时按照1×106 CFU/mL的接种量接种商业酿酒酵母EC1118以完成酒精发酵,在20 ℃条件下进行控温发酵,作为实验组。测定发酵过程中还原糖含量的变化,当还原糖含量<4 g/L或还原糖含量连续3 d不变则视为发酵结束,测定霞多丽葡萄酒的基本理化指标及挥发性风味成分。
1.3.4 测定方法
还原糖含量的测定:采用3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS)[10];葡萄糖、果糖、甘油、乙醇、有机酸含量的测定:采用HPLC法[11];可滴定酸、挥发酸含量及pH的测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;挥发性风味成分的测定:采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合GC-MS法[13]。
1.3.5 数据分析
利用Excel 2019、SPSS 2018、Origin 2021等软件对数据进行分析处理,结果用“平均值±标准差”表示;采用SIMCA 14.1进行主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 高产乳酸耐热克鲁维酵母菌株的筛选
将不同L.thermotolerans菌株接种于霞多丽葡萄汁中进行发酵,发酵液中残糖含量的变化以及发酵结束后乙醇、总酸、乳酸的含量见图1。由图1可知,16株L.thermotolerans菌株发酵液中的残糖含量均>30 g/L,乙醇体积分数为3.97%~10.87%。残糖含量反映了酵母菌对糖的转化能力,发酵能力越强,残糖含量越低[6],说明16株L.thermotolerans菌株均无法独立完成酒精发酵,这与大多数研究得出的结果非酿酒酵母的糖转化能力较弱一致[14],所以大部分非酿酒酵母均需要和酿酒酵母混合发酵。由图1亦可知,16株L.thermotolerans菌株发酵代谢产酸及乳酸的能力存在差异,其中,菌株LT-ZX03的产酸能力最强,总酸含量为10.86 g/L;菌 株LT-XJ17、LT-XJ23、LT-XJ24、LT-XJ59、LT-ZX03 与LT-GS27的产乳酸能力较强,乳酸含量分别为5.46 g/L、6.55 g/L、6.41 g/L、6.52 g/L、7.89 g/L、6.21 g/L。
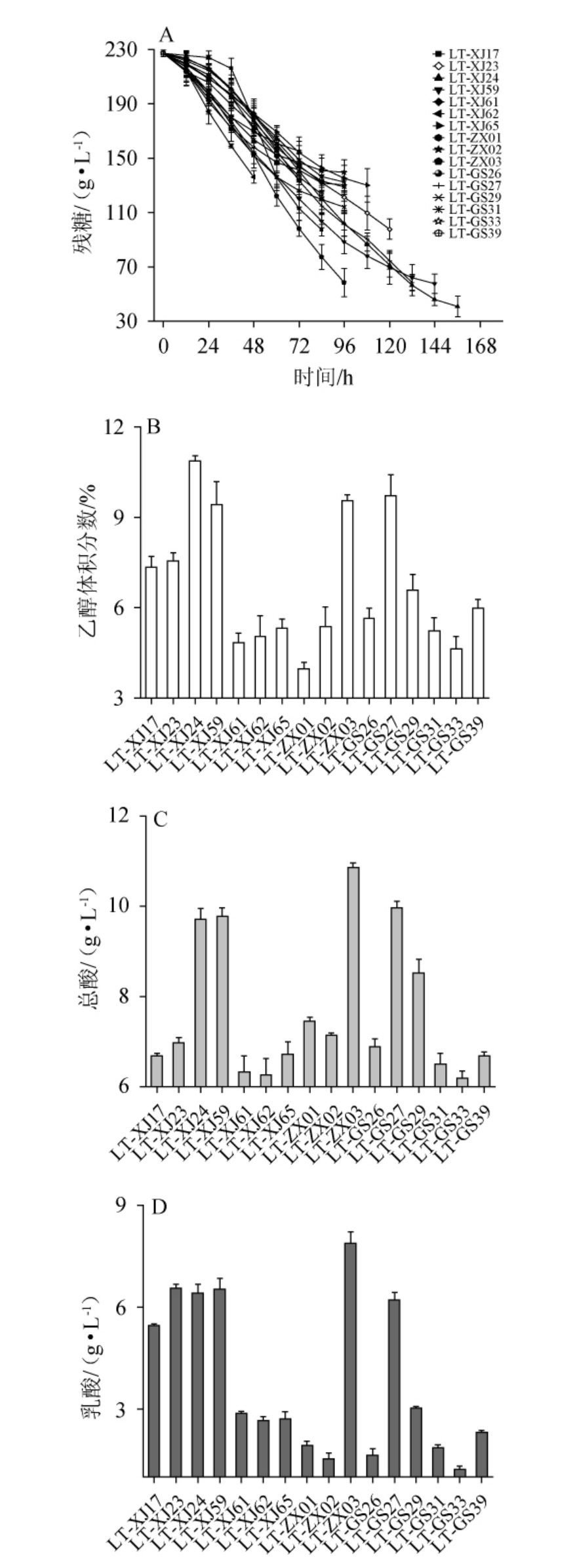
图1 接种不同耐热克鲁维酵母菌株发酵霞多丽葡萄汁残糖含量的变化(A)及发酵结束后的乙醇体积分数(B)、总酸(C)、乳酸(D)含量
Fig.1 Changes in the residual sugar content(A)of Chardonnay grape juice fermented with different Lachancea thermotolerans strains and the contents of ethanol volume fraction(B),total acid(C)and lactic acid(D)contents after fermentation
2.2 高产乳酸耐热克鲁维酵母菌株的耐受性分析
6株高产乳酸L.thermotolerans菌株的耐受性见图2。
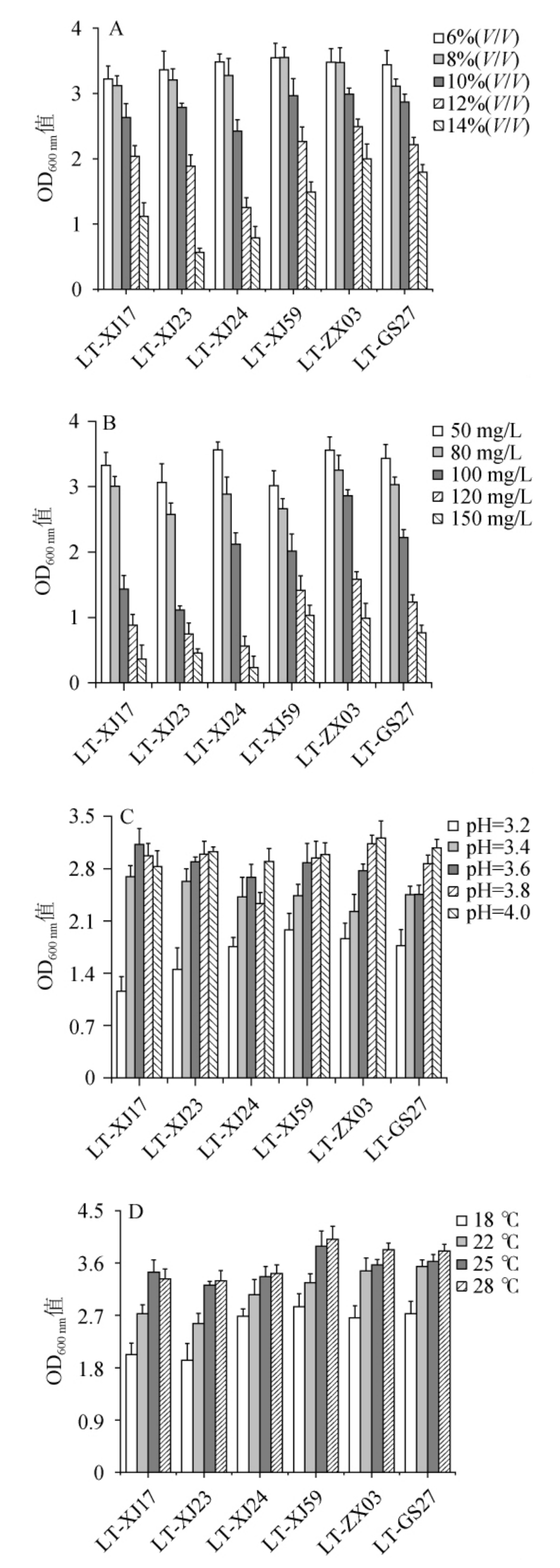
图2 不同高产乳酸耐热克鲁维酵母菌株的乙醇(A)、二氧化硫(B)、pH(C)及温度(D)耐受性分析结果
Fig.2 Results of ethanol (A), sulfur dioxide (B), pH (C) and temperature (D) tolerance analysis of different high-yield lactic acid Lachancea thermotolerans strains
由图2A可知,6株L.thermotolerans菌株的OD600 nm值均随着乙醇体积分数的升高而降低,表明高体积分数的乙醇会抑制L.thermotolerans的生长。当乙醇体积分数为14%时,6株L.thermotolerans菌株均能够生长,但菌株LT-ZX03对乙醇的耐受性更强,表明本土L.thermotolerans菌株具有良好的抗乙醇胁迫能力。在葡萄酒的酿造过程中,通常需添加一定含量的SO2抑制有害细菌生长、防止葡萄汁氧化及护色[15],但这有可能导致酵母菌的生长和发酵受到抑制。由图2B可知,6株L.thermotolerans菌株在SO2质量浓度为50~150 mg/L的范围内均能够生长,且菌株LT-ZX03对SO2的耐受性最好。此外,由图2C和2D可知,不同L.thermotolerans菌株对发酵环境中pH和温度波动的生理响应差异较大,但6株L.thermotolerans菌株均能在pH 3.2~4.0和温度18~28 ℃范围内生长。其中,菌株LT-XJ17在pH为3.6、25 ℃时生长最好,其余5株菌株均在pH为4.0、28 ℃时生长最好。综上,6株L.thermotolerans菌株均可耐受乙醇体积分数14%、SO2质量浓度50~150 mg/L、pH 3.2~4.0、温度18~28 ℃,但就整体而言,菌株LT-XJ24、LT-XJ59、LT-ZX03以及LT-GS27对于乙醇、SO2、pH以及温度的耐受性较好,故选用这4株菌株进行发酵实验。
2.3 霞多丽葡萄酒品质分析
2.3.1 理化指标分析
霞多丽葡萄酒发酵过程中残糖含量的变化见图3,发酵结束时霞多丽葡萄酒的其他理化指标见表1。
表1 不同霞多丽葡萄酒样品的基础理化指标
Table 1 Basic physicochemical indexes of different Chardonnay wine samples
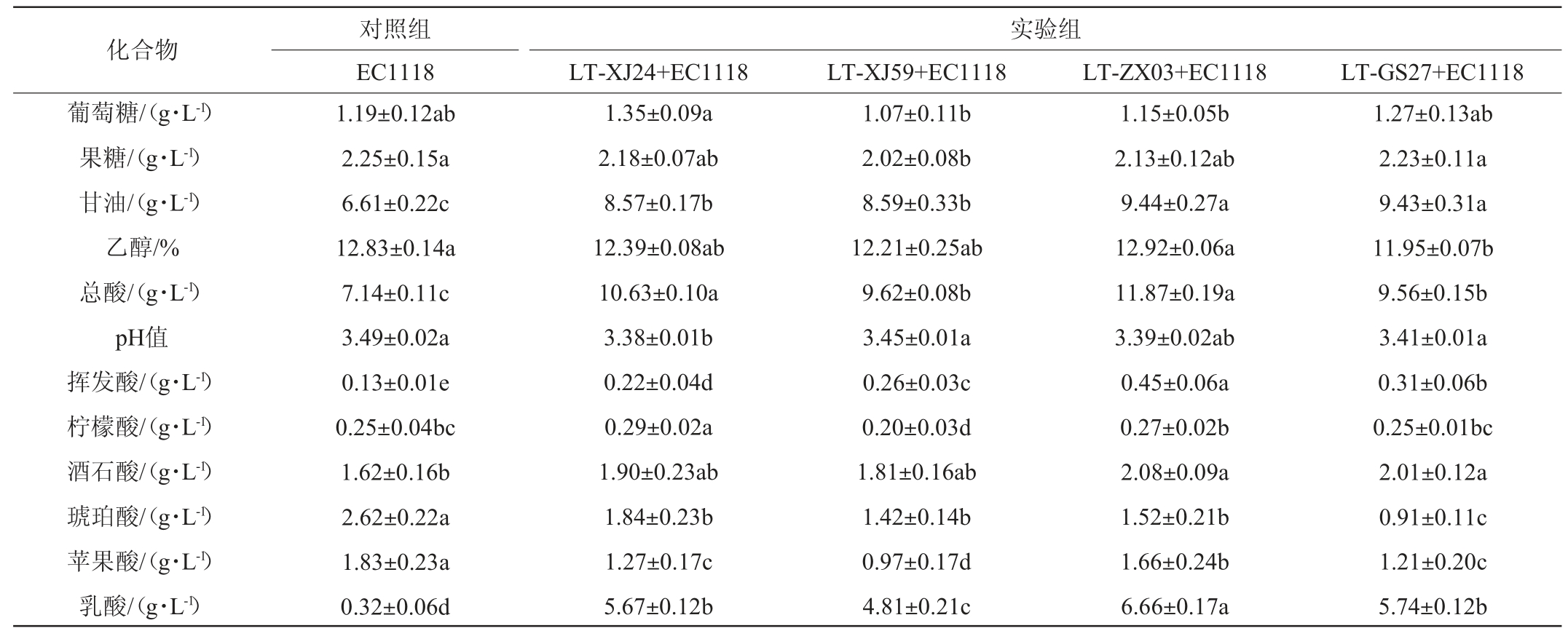
注:同行不同字母表示差异显著(P<0.05)。下同。
化合物葡萄糖/(g·L-1)果糖/(g·L-1)甘油/(g·L-1)乙醇/%总酸/(g·L-1)pH值挥发酸/(g·L-1)柠檬酸/(g·L-1)酒石酸/(g·L-1)琥珀酸/(g·L-1)苹果酸/(g·L-1)乳酸/(g·L-1)对照组EC1118 1.19±0.12ab 2.25±0.15a 6.61±0.22c 12.83±0.14a 7.14±0.11c 3.49±0.02a 0.13±0.01e 0.25±0.04bc 1.62±0.16b 2.62±0.22a 1.83±0.23a 0.32±0.06d实验组LT-XJ24+EC1118 LT-XJ59+EC1118 LT-ZX03+EC1118 LT-GS27+EC1118 1.35±0.09a 2.18±0.07ab 8.57±0.17b 12.39±0.08ab 10.63±0.10a 3.38±0.01b 0.22±0.04d 0.29±0.02a 1.90±0.23ab 1.84±0.23b 1.27±0.17c 5.67±0.12b 1.07±0.11b 2.02±0.08b 8.59±0.33b 12.21±0.25ab 9.62±0.08b 3.45±0.01a 0.26±0.03c 0.20±0.03d 1.81±0.16ab 1.42±0.14b 0.97±0.17d 4.81±0.21c 1.15±0.05b 2.13±0.12ab 9.44±0.27a 12.92±0.06a 11.87±0.19a 3.39±0.02ab 0.45±0.06a 0.27±0.02b 2.08±0.09a 1.52±0.21b 1.66±0.24b 6.66±0.17a 1.27±0.13ab 2.23±0.11a 9.43±0.31a 11.95±0.07b 9.56±0.15b 3.41±0.01a 0.31±0.06b 0.25±0.01bc 2.01±0.12a 0.91±0.11c 1.21±0.20c 5.74±0.12b
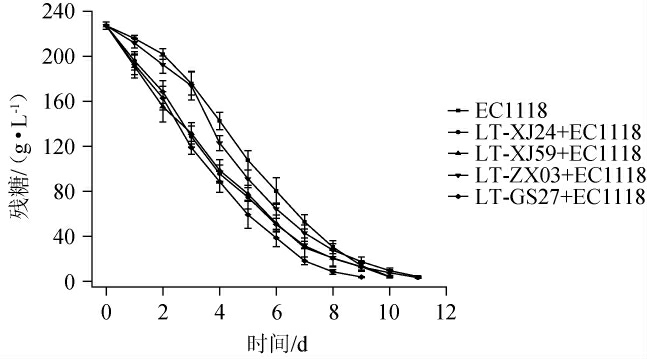
图3 不同霞多丽葡萄酒样品发酵过程中残糖含量的变化
Fig.3 Changes in residual sugar content in different Chardonnay wine samples during fermentation
由图3可知,对照组与所有实验组均在11 d内完成了酒精发酵,残糖含量均<4 g/L,且在整个酒精发酵过程中,实验组葡萄酒残糖含量均高于对照组。由表1可知,各实验组和对照组葡萄酒中的葡萄糖和果糖含量接近,这两种己糖是酵母菌生长的必需营养物质,也是酒精发酵过程的重要底物[16-18]。就pH和总酸而言,各实验组葡萄酒的pH均低于对照组,总酸含量则相反,这归因于4株耐热克鲁维酵母菌株的产酸能力,表明4个菌株与酿酒酵母混合发酵霞多丽葡萄酒具有增酸能力,较低的pH也有利于葡萄酒在储藏期间避免有害微生物的污染[12],说明这种增酸的葡萄酒在长期储藏方面具有优势。与对照组相比,各实验组葡萄酒中的甘油和挥发酸含量显著升高(P<0.05),其中实验组LT-ZX03+EC1118葡萄酒提高效果最好,甘油、挥发酸含量分别9.44g/L、0.45 g/L。有研究发现,较高含量的甘油可以为葡萄酒提供甜润的口感,在中和过高含量乳酸带来的‘尖酸’口感方面具有重要作用[7-9],因此菌株LT-ZX03+EC1118混合发酵的霞多丽在口感方面可能更加圆润。虽然实验组葡萄酒中挥发酸含量有所升高,但是仍然符合GB/T 15037—2006《葡萄酒》要求(≤1.2 g/L)。在有机酸含量方面,各处理组葡萄酒中的柠檬酸、酒石酸含量较为接近,分别在0.20~0.29 g/L、1.62~2.08 g/L,但与对照组相比,各实验组葡萄酒苹果酸、琥珀酸含量均显著偏低(P<0.05),乳酸含量均显著偏高(P<0.05)。乳酸是本研究中评价L.thermotolerans生物增酸特性的重要指标,对照组葡萄酒中乳酸含量最低(0.32 g/L),这与目前大多数研究报道的结果一致,酿酒酵母的产乳酸能力较弱[7]。实验组LT-ZX03+EC1118葡萄酒中乳酸含量最高,达6.66 g/L,是对照组乳酸含量的20.8倍。
2.3.2 挥发性香气化合物分析
香气是葡萄酒最重要的感官品质之一,有研究表明,具有优良酿造特性的非酿酒酵母与酿酒酵母混合发酵后,能够为葡萄酒带来令人愉悦的香气,如花香、果香和坚果等发酵香气,提高葡萄酒的芳香复杂性[15-17]。因此,采用HS-SPME-GC-MS法对霞多丽葡萄酒的挥发性香气进行分析,并进一步对酒样中香气活度值(odor activity value,OAV)>1.0的主要香气化合物进行筛选,结果见图4。
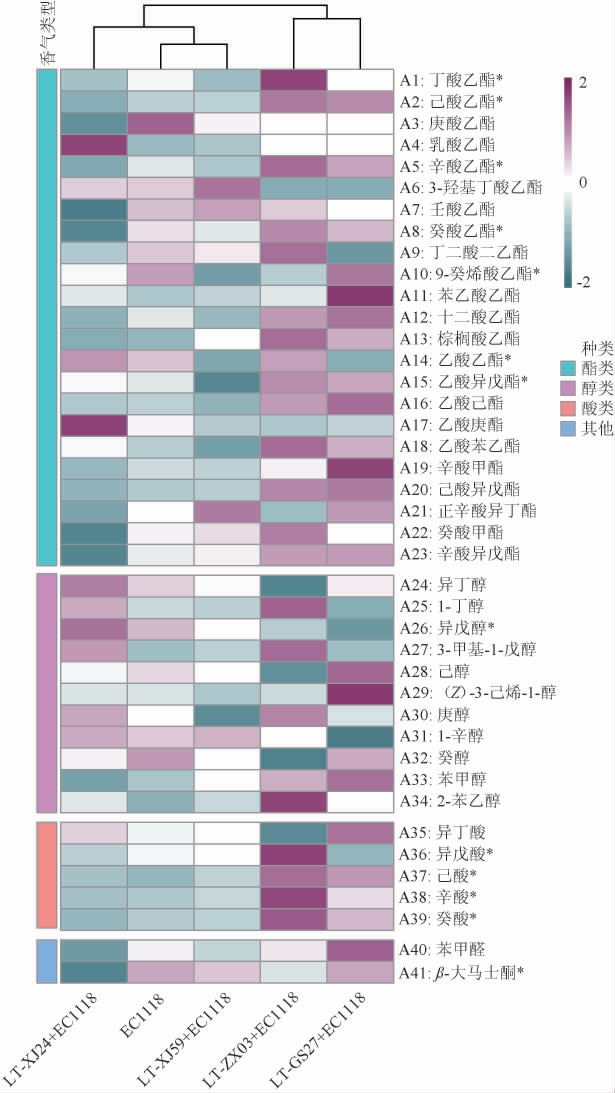
图4 不同霞多丽葡萄酒样品中挥发性香气成分GC-MS分析结果
Fig.4 Results of volatile aroma substances in different Chardonnay wine samples analysis by GC-MS
“*”表示OAV>1.0的挥发性香气化合物。
由图4可知,从霞多丽葡萄酒中共检出41种香气物质,包括23种酯类、11种醇类、5种酸类以及2种其他类化合物,其中共有13种香气物质的OAV>1。霞多丽葡萄酒中检测出的酯类物质最丰富,为葡萄酒中‘果香’和‘花香’风味属性的呈现提供重要作用[17]。实验组LT-ZX03+EC1118及LT-GS27+EC1118葡萄酒中乙基酯及乙酸酯类化合物的含量高于对照组,主要包括丁酸乙酯(香蕉味、草莓味)[19]、己酸乙酯(香蕉味、青苹果味)[20]、乙酸乙酯(菠萝味)[21]、乙酸异戊酯(香蕉味)[22]等,这些酯类物质的OAV>1.0,表明混合发酵有助于提高葡萄酒的果香和绿色水果香气[18],但是不同L.thermotolerans的提升效率和酯类物质的种类具有很大差异性,这与菌种特异性高度相关[23-26]。此外,各实验组葡萄酒中的乳酸乙酯含量均高于对照组,说明L.thermotol erans能够促进乳酸乙酯(具有水果和奶油的香气)的形成,对于葡萄酒的香气具有积极的贡献[9],这可能与L.thermotolerans具有高产乳酸的性质有关。
醇类物质对葡萄酒最终的风味也起到重要作用,当醇类化合物的含量<300 mg/L时,能够显著提高葡萄酒中花、蜂蜜和水果等香气属性[13]。与对照组相比,实验组LT-ZX03+EC1118和LT-GS27+EC1118葡萄酒中的异戊醇、1-辛醇等醇类化合物的含量较低,而2-苯乙醇、苯甲醇含量则较高,2-苯乙醇、苯甲醇具有玫瑰、花香等气味[17],表明菌株LT-ZX03和LT-GS27在提升葡萄酒的这些香气方面具有积极作用。然而,实验组LT-XJ24+EC1118葡萄酒中异戊醇含量升高,异戊醇是葡萄酒香气中最重要的醇类化合物之一,具有花、香蕉等气味,能够给酒的风味提供积极影响[17],这是唯一OAV>1.0的醇类化合物,说明菌株LT-XJ24除了高产乳酸外,在提高葡萄酒花香、果香等愉悦风味方面也具有较高的潜力。
相较于酯类和醇类化合物,霞多丽葡萄酒中检测出的酸类物质大多数会呈现脂肪、奶酪等不良气味[19-21],对葡萄酒香气属性的有一定的负面影响。4株L.thermotolerans菌株在具有高产乳酸能力的同时,也会导致葡萄酒中部分酸类化合物含量的升高,主要包括己酸、辛酸以及癸酸,这3种物质的OAV>1,表明3种物质对葡萄酒香气的较高贡献,但具体作用机制可能需要进一步的研究。
此外,在最终的霞多丽葡萄酒中还检测到两种其他类化合物,其中苯甲醛(杏仁、坚果气味)是一种醛酮化合物[18],而β-大马士酮(果香)是一种在葡萄酒普遍常见的萜烯化合物[19]。这两种化合物在菌株LT-GS27+EC1118混合发酵的葡萄酒中含量最高,表明LT-GS27能够为葡萄酒带来新鲜水果和坚果香气。
综上所述,不同的L.thermotolerans高产乳酸菌株对霞多丽葡萄酒的香气成分影响较大,且具有一定的差异,其中高产乳酸菌株LT-ZX03和LT-GS27与酿酒酵母EC1118混合发酵时,能够提高葡萄酒中丁酸乙酯、己酸乙酯、乙酸乙酯、乙酸异戊酯及2-苯乙醇、苯甲醇的含量;菌株LT-XJ24与酿酒酵母EC1118混合发酵时,能够提高葡萄酒中异戊醇的含量,这些菌株对提高葡萄酒花果香气风味方面具有较高的应用前景。
为了量化各处理组霞多丽葡萄酒之间挥发性香气化合物组成上的差异,进一步进行主成分分析,结果见图5。由图5可知,前两个主成分共解释了61.7%的总方差,说明前两个主成分可以很好的反应原始数据的变异信息。除了实验组LT-XJ59+EC1118葡萄酒样品外,其他3个实验组葡萄酒样品与对照组均能够明显分离,且实验组LT-GS27+EC1118和LT-ZX03+EC1118葡萄酒样品与对照组的距离最远,其中,实验组LT-GS27+EC1118葡萄酒样品的分离主要与苯乙酸乙酯(A11)、(Z)-3-己烯-1-醇(A29)、苯甲醛(A40)等化合物相关,LT-ZX03+EC1118葡萄酒样品则与2-苯乙醇(A34)、异戊酸(A36)相关,LT-XJ24+EC1118葡萄酒样品与乳酸乙酯(A4)、乙酸庚酯(A17)有关。结果表明,不同L.thermotolerans菌株对霞多丽葡萄酒中挥发性香气物质的影响存在差异,其中L.thermotolerans LT-GS27和LT-ZX03影响较大,L.thermotolerans LT-XJ59影响较小。
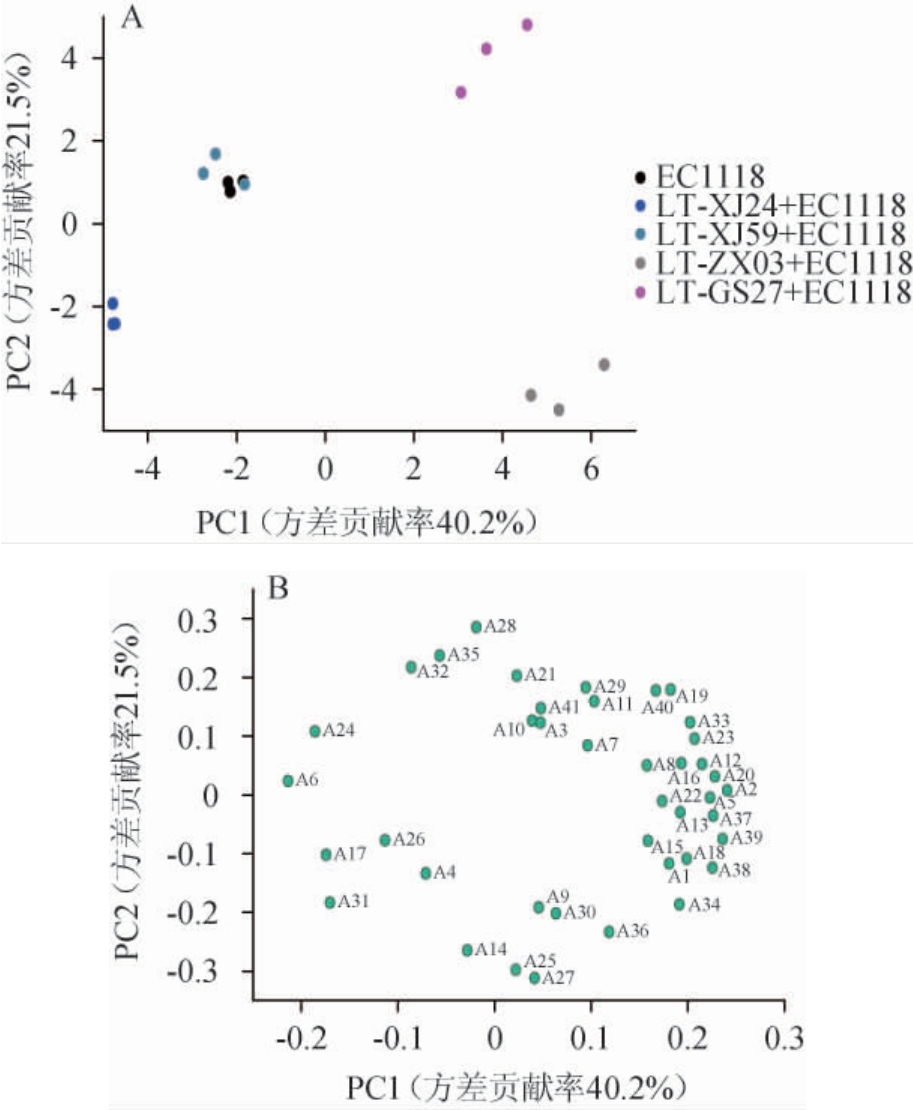
图5 基于挥发性化合物不同霞多丽葡萄酒的主成分分析得分图(A)及载荷图(B)
Fig.5 Score chart (A) and load chart (B) of principal component analysis of different Chardonnay wine samples based on volatile compounds
3 结论
本研究以前期筛选到的16株L.thermotolerans菌株为研究对象,通过在霞多丽葡萄汁中进行单一接种发酵并进行耐受性分析,筛选出4株高产乳酸且具有较好耐受性的L.thermotolerans菌株,编号分别为菌株LT-XJ24、LT-XJ59、LT-ZX03与LT-GS27,其乳酸产量分别为6.41 g/L、6.52 g/L、7.89 g/L和6.21 g/L。通过将这4株L.thermotolerans菌株分别与商业酿酒酵母EC1118(1∶1)进行共发酵制备霞多丽葡萄酒,结果发现,优选的4株L.thermotolerans菌株与商业酿酒酵母共发酵均能完成霞多丽葡萄酒的酒精发酵,残糖含量均<4 g/L,且在葡萄酒的酿造环境下均具有良好的生物增酸能力,其中菌株LT-ZX03+EC1118混合发酵的葡萄酒中的乳酸产量最高,达6.66 g/L。尽管混合发酵组提高了葡萄酒的挥发酸含量,但仍然符合相关标准要求(≤1.2 g/L)。从霞多丽葡萄酒样品中共检出41种香气物质,包括23种酯类、11种醇类、5种酸类以及2种其他类化合物,其中13种物质的香气活度值(OAV)>1。不同耐热克鲁维酵母对霞多丽葡萄酒中挥发性香气物质的影响存在差异,其中菌株LT-GS27和LT-ZX03影响较大,能够提高葡萄酒中具有花果香气的丁酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯等物质含量,具有较好的应用前景,为推动非酿酒酵母在葡萄酒增酸酿造的实际生产酿造工艺奠定理论基础。
[1]金红,张小燕,路宏科,等.耐高渗酵母选育及其在葡萄酒中的应用研究[J].中国酿造,2021,40(6):192-195.
[2]唐冲,成池芳,许引虎,等.耐热克鲁维酵母在葡萄酒发酵中的研究和应用进展[J].食品科学,2023,44(3):323-331.
[3]BELLON J, FORD C M, BORNEMAN A R, et al.A novel approach to isolating improved industrial interspecific wine yeasts using chromosomal mutations as potential markers for increased fitness[J].Front Microbiol,2018,9:1442.
[4]VION C, MURO M E, BERNARD M, et al.New malic acid producer strains of Saccharomyces cerevisiae for preserving wine acidity during alcoholic fermentation[J].Food Microbiol,2022,112:104209.
[5]ALFONZO A,FRANCESCA N,MERCURIO V,et al.Use of grape racemes from Grillo cultivar to increase the acidity level of sparkling base wines produced with different Saccharomyces cerevisiae strains[J].Yeast, 2020,37:475-486.
[6]VILELA-MOURA A, SCHULLER D E, MENDES-FAIA A, et al.The impact of acetate metabolism on yeast fermentative performance and wine quality: reduction of volatile acidity of grape musts and wines[J].Appl Microbiol Biot,2010,89:271-280.
[7]HRANILOVIC′ A, GAMBETTA J M, SCHMIDTKE L M, et al.Oenological traits of Lachancea thermotolerans show signs of domestication and allopatric differentiation[J].Sci Rep,2018,8:14812.
[8]BANILAS G,SGOUROS G A,NISIOTOU A.Development of microsatellite markers for Lachancea thermotolerans typing and population structure of wine-associated isolates[J].Microbiol Res,2016,193:1-10.
[9]HRANILOVIC′ A, ALBERTIN W, CAPONE D L, et al.Impact of Lachancea thermotolerans on chemical composition and sensory profiles of viognier wines[J].J Fungi,2022,8(5):474.
[10]王春晓,江璐,刘延琳.DNS法监控葡萄酒发酵进程的应用研究[J].中国酿造,2012,31(9):24-27.
[11]杨舒雅.葡萄酒中有机酸及测定方法的探讨[J].食品安全导刊,2021(29):187-188.
[12]VICENTE J,KELANNE N,RODRIGO-BURGOS L,et al.Influence of different Lachancea thermotolerans strains in the wine profile in the era of climate challenge[J].FEMS Yeast Res,2022,23:129015.
[13]CHEN Y,LEI X,JIANG J,et al.Microbial diversity on grape epidermis and wine volatile aroma in spontaneous fermentation comprehensively driven by geography,subregion,and variety[J].Int J Food Microbiol,2023,404:110315.
[14]ZHAO H, LI Y, LIU L, et al.Effects of inoculation timing and mixed fermentation with Pichia fermentans on Oenococcus oeni viability, fermentation duration and aroma production during wine malolactic fermentation[J].Food Res Int,2022,159:111604.
[15]RUIZ-DE-VILLA C, POBLET M, BORDONS A, et al.Comparative study of inoculation strategies of Torulaspora delbrueckii and Saccharomyces cerevisiae on the performance of alcoholic and malolactic fermentations in an optimized synthetic grape must[J].Int J Food Microbiol,2023,404:110367.
[16]WANG J J,ZHANG W W,GUAN Z,et al.Exploring the effects of the fermentation method on the quality of Lycium barbarum and Polygonatum cyrtonema compound wine based on LC-MS metabolomics[J].Food Chem,2023,428:136770.
[17]WANG X,FAN G,PENG Y,et al.Mechanisms and effects of non-Saccharomyces yeast fermentation on the aromatic profile of wine[J].J Food Compos Anal,2023,124:105660.
[18]ANTALICK G, PERELLO M C, DE REVEL G.Esters in wines: New insight through the establishment of a database of french wines[J].Am J Enol Viticult,2014,65:293-304.
[19]WANG Y B,ZHANG Q,CUI M Y,et al.Aroma enhancement of blueberry wine by postharvest partial dehydration of blueberries[J].Food Chem,2023,426:136593.
[20]WILSON A,CHARNOCK H M,XU S,et al.Influence of cane and beet sugar for second fermentation on"fruity"aromas in Auxerrois sparkling wines[J].OENO One,2022,56(2):4864.
[21]ZHANG B, SHI X, ZHANG Y, et al.The implication of phenolic acid matrix effect on the volatility of ethyl acetate in alcohol-free wine model:Investigations with experimental and theoretical methods[J].Food Chem,2022,378:132114.
[22]LIN M M-H,BOSS P K,WALKER M E,et al.Influence of Kazachstania spp.on the chemical and sensory profile of red wines[J].Int J Food Microbiol,2021,362:109496.
[23]CAI J, ZHU B, WANG Y H, et al.Influence of pre-fermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J].Food Chem,2014,154:217-229.
[24]LIAO J,ZHANG S,ZHANG X.Effects of mixed adding crude extracts of β-glucosidases from three different non-Saccharomyces yeast strains on the quality of Cabernet Sauvignon wines[J].J Fungi,2022,8:710.
[25]ZHU W, ZHANG W, QIN T, et al.Effects of purified β-glucosidases from Issatchenkia terricola,Pichia kudriavzevii,Metschnikowia pulcherrima on the flavor complexity and typicality of wines[J].J Fungi,2022,8:1057.
[26]SHERMAN E, COE M, GROSE C, et al.A metabolomics approach to assessing the relative contributions of the volatile and non-volatile composition to expert quality ratings of Pinot Noir wine quality[J].J Agr Food Chem,2020,68(47):13380-13396.