风土是一个地区特有自然环境和人文环境的总称[1]。狭义风土可以分为大、中、小三个层次:大风土通常指产区风土,主要聚焦于气候、土壤和地形这三大产区自然特征[2-3];中风土是大产区内各地点的区域风土,概括为各酒庄内部的风土,即在大风土基础上又细划出土壤特性[4]、地形地貌[5]和单一葡园气候[6-7]等;小风土可理解为某特定葡萄园内的地块风土[8-9],即葡萄植株或果际的风土,可精细到叶幕与行间管理以及土壤微生物[10]等因子。不同的风土条件造就了风格各异的酿酒葡萄果实,从而影响所酿造葡萄酒的风味与品质[11]。
贺兰山东麓产区风土条件优良,属于典型的温带大陆性季风气候,冬寒且长、夏热且短[12]。产区西靠山脉、东邻河流、南高北低,具有多样的风土条件,因其独特的地理、气候和土壤优势,成为我国酿酒葡萄极佳种植区[13],有极大的发展潜力[14]。宁夏贺兰山东麓产区根据酿酒葡萄种植区域和现已建成酒庄地理位置进一步划分为六个子产区,由北至南分别为石嘴山(Shizuishan,SZS)、贺兰(Helan,HL)、西夏(Xixia,XX)、永宁(Yongning,YN)、青铜峡(Qingtongxia,QTX)和红寺堡(Hongsipu,HSP)。产区风土条件差异主要是受到山脉影响,因此南部没有山体遮挡且地势较高的青铜峡和红寺堡子产区日照时数较长、有效积温较高,位于山体末端的西夏子产区以及有河流经过的永宁子产区降水量偏高,最北部的石嘴山产区由于较高的山体缓冲挡雨保温而使得降水偏少有效积温偏高;土壤特征更是与地形紧密联系,距离山体较近的石嘴山、贺兰、西夏和永宁子产区主要以砾石土壤为主,这些子产区的东部区域的部分地区则表现为风沙土壤,而南部的青铜峡和红寺堡等地以灰钙土为主[15-16]。
葡萄果实中的酚类物质在酿造过程中通过浸渍进入到葡萄酒,构成了红葡萄酒的“骨架”成分,其含量对酒体的颜色和口感起着决定性的作用。一些田间实验结果表明,果实中酚类物质对光照、温度和降水等生态因子有着极强的响应:例如较长的日照时数有利于酚类物质的积累,强光可促进果实黄酮醇合成[17],弱光则会降低原花色素含量[18];此外,早期摘叶能够增加葡萄果实及其对应葡萄酒中黄烷醇[19]和花色苷总量,进而提升酒体颜色强度[20]。强光引起的光损伤和高温有利于原花色素积累,但会导致花色苷含量降低,不同品种对光响应的敏感度不同,因此只有在合适的光照强度和照射时间下才能够使酚类物质有效积累[21]。有研究证明,温度影响葡萄果实中类黄酮的代谢流向:F3′H途径比F3′5′H途径更耐高温,因此在高温条件下,后者路径上类黄酮合成受阻,花青素与槲皮素类物质大量积累[22];而在低温条件下,葡萄果实中更易生成花翠素与杨梅酮类物质[21],葡萄浆果表皮着色加深[23],种子和果皮中原花色素含量明显增加[24]。除此之外,较少的降水也有利于果实中酚类物质积累,适度缺水则能够提升葡萄的风味:例如葡萄生长季适度缺水可促进花色苷生成[25],改善葡萄酒颜色[26-27],也能有效提高果实中单宁聚合度,增强酒体涩感[26-28]。也有研究表明,花色苷含量一定程度上随海拔升高而增加,但低海拔所带来的高温高湿气候有利于形成较高含量的儿茶素类单体(如儿茶素、表儿茶素、表儿茶素没食子酸酯)、原花青素二聚体和三聚体等低分子质量聚合体,葡萄果皮中可提取的原花色素总量也会增加[29]。总的来说,酚类物质的生成与积累都会受到风土条件的影响,优良的风土条件可获得高品质的酿酒葡萄原料,为葡萄酒带来丰富的风味与鲜明的风格,这是酿造高质量葡萄酒的重要前提。
贺兰山东麓新鲜的红葡萄酒呈现紫红色色调[30],但颜色稳定性较差[31]。红葡萄酒中总花色苷含量较高,与L*值呈显著负相关,而与a*值和颜色饱和度呈显著正相关。然而也有研究表明,贺兰山东麓不同子产区酒样的色度色调差异显著,各子产区不同品种之间存在较大色差[32]。对口感而言,贺兰山东麓‘马瑟兰’红葡萄酒单宁柔和、酒体圆润饱满,整体表现较好[33];而‘赤霞珠’红葡萄酒在陈酿过程中干涩感减弱,绒涩感增强,且涩感品质与其单宁总含量并没有显著相关性[34]。为揭示风土条件对红葡萄酒酚类组成轮廓及感官特征的影响,本研究以贺兰山东麓三个不同子产区(西夏、永宁和青铜峡)单品种‘赤霞珠’和‘马瑟兰’红葡萄酒为研究对象,利用高效液相色谱-三重串联四极杆质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)技术解析葡萄酒酚类物质组成轮廓,尤其是不同形式呈色花色苷的占比及不同聚合度缩合单宁的含量及占比,并结合CIELAB颜色参数和人工唾液沉淀指数(artificial saliva precipitation index,ASPI)表征不同红葡萄酒酒样的颜色与涩感特征差异,以期为贺兰山东麓不同风土条件下葡萄酒的高品质酿造提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
本研究选用了来自贺兰山东麓3个子产区2021年采收并酿造的‘赤霞珠’和‘马瑟兰’红葡萄酒(共计10款),其编号及风土信息见表1,理化指标见表2。
表1 实验所用红葡萄酒样品的编号及风土信息
Table 1 Serial number and terroir information of red wine samples used in the experiment
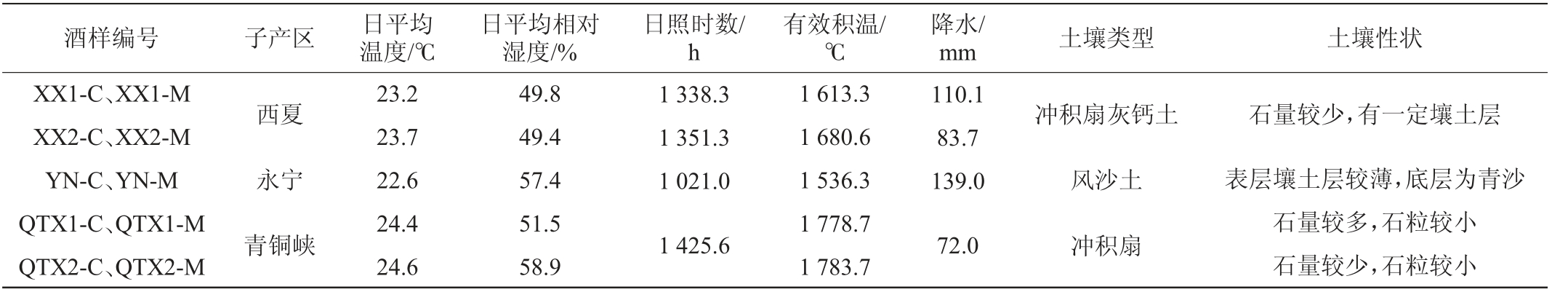
注:编号中C代表‘赤霞珠’红葡萄酒,M代表‘马瑟兰’红葡萄酒;风土数据均来自2021年各采样点气象站获取的资料。
酒样编号 子产区 日平均温度/℃日平均相对湿度/%日照时数/h有效积温/℃降水/mm 土壤类型 土壤性状XX1-C、XX1-M XX2-C、XX2-M YN-C、YN-M QTX1-C、QTX1-M QTX2-C、QTX2-M西夏永宁青铜峡23.2 23.7 22.6 24.4 24.6 49.8 49.4 57.4 51.5 58.9 1 338.3 1 351.3 1 021.0 1 425.6 1 613.3 1 680.6 1 536.3 1 778.7 1 783.7 110.1 83.7 139.0 72.0石量较少,有一定壤土层表层壤土层较薄,底层为青沙石量较多,石粒较小石量较少,石粒较小冲积扇灰钙土风沙土冲积扇
表2 实验所用红葡萄酒样品的基础理化指标
Table 2 Basic physicochemical indicators of red wine samples used in the experiment
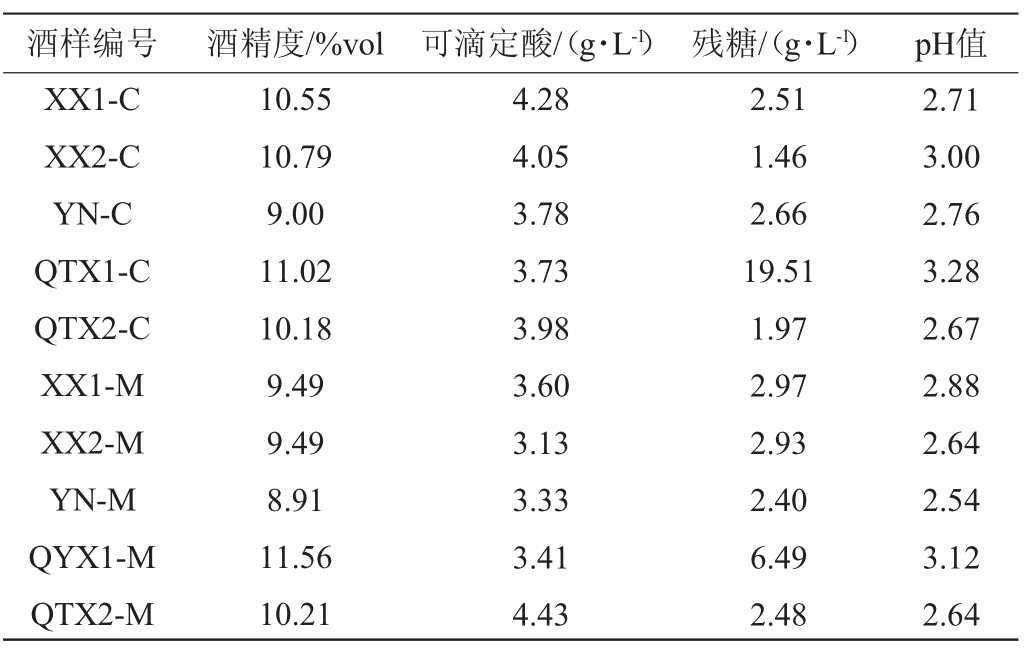
酒样编号 酒精度/%vol 可滴定酸/(g·L-1) 残糖/(g·L-1) pH值XX1-C XX2-C YN-C QTX1-C QTX2-C XX1-M XX2-M YN-M QYX1-M QTX2-M 10.55 10.79 9.00 11.02 10.18 9.49 9.49 8.91 11.56 10.21 4.28 4.05 3.78 3.73 3.98 3.60 3.13 3.33 3.41 4.43 2.51 1.46 2.66 19.51 1.97 2.97 2.93 2.40 6.49 2.48 2.71 3.00 2.76 3.28 2.67 2.88 2.64 2.54 3.12 2.64
1.1.2 化学试剂
用于酚类物质定量的花色苷、非花色苷酚类物质标准品及聚-L-脯氨酸和α-淀粉酶:美国Sigma-Aldrich公司;溶菌酶(≥20 000 U/mg)、牛血清白蛋白(纯度>98%):上海生工生物试剂公司;酒石酸、氯化钠(均为分析纯)、乳铁蛋白(纯度>95%):上海麦克林试剂公司;预制胶(12%):北京索莱宝科技有限公司;Oasis HLB固相萃取小柱3cc(60 mg):美国Waters公司;甲醇、乙腈(均为色谱纯):美国Honeywell公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Agilent 1200-6410B高效液相色谱-三重四级杆串联质谱联用(HPLC-MS/MS)、Agilent Poroshell 120EC-C18色谱柱(2.1 mm×150 mm,2.7 μm)、Agilent 1100系列高效液相色谱-离子阱质谱联用仪、Agilent Zorbax 300SB-C18色谱柱(4.6 mm×250 mm,5 μm):美国安捷伦科技有限公司;Fotecor plus高通量全自动固相萃取仪:厦门睿科集团股份有限公司;Mini-Protean Tetra小型蛋白垂直电泳槽:美国Bio-Rad Laboratories公司;CM-3700A分光测色计:日本Konica Minolta公司;PB-10型pH计:德国赛多利斯公司;SpectraMax 190型酶标仪:美国Molecular Device公司。
1.3 方法
1.3.1 酚类物质的测定
酚类物质的测定采用高效液相色谱-三重四极杆串联质谱法。样品经0.22 μm水系滤膜过滤后上样,进样量为5 μL,流动相流速0.4 mL/min,A相为0.1%甲酸水溶液,B相为含0.1%甲酸的甲醇乙腈溶液(50∶50,V/V)。质谱采用电喷雾离子(electrospray ionization,ESI)源,喷雾电压4 kV,雾化器压力35 psi。利用Qualitative Analysis of Masshunter软件和Quant-My-Way软件对质谱图进行分析,定性定量方法具体参考LI S Y等[35-38]。每个样品做两个重复。
1.3.2 不同形式呈色花色苷含量的测定
游离花色苷(free anthocyanins,FA)、辅色花色苷(copigmented anthocyanins,CA)和聚合花色苷(polymeric anthocyanins,PA)含量的测定参考张宁等[39]的方法:首先将样品pH调至3.6,经0.22 μm水系滤膜过滤后,分别测定其在不同反应条件下波长520 nm处的吸光度值。
具体条件如下:取2 mL过滤后的样品加入20 μL乙醛溶液,室温条件下反应45 min后测定其吸光度值;取2 mL过滤后的样品,用模拟酒溶液(由体积分数为12%乙醇、5 g/L酒石酸和0.2 mol/L氯化钠构成,pH为3.6)稀释20倍后测定其吸光度值;另取2 mL过滤后的样品加入160 μL亚硫酸溶液(SO2>6%),室温条件下反应10 min后测定其吸光度值。每个样品做3个独立重复。
不同形式花色苷的含量占比计算参考BIMPILAS A等[40]的方法,其计算公式如下:

1.3.3 CIELAB颜色参数的测定
样品经0.22 μm水系滤膜过滤后加入光径为2 mm的石英比色皿中,利用分光测色计(仪器设定条件:透射率模式,D65观测光源,观察者角度为10°)分析样品颜色参数,其中L*值代表葡萄酒的深浅程度,该值越小,酒样颜色越深;a*值和b*值分别代表红、黄色调,值越大,表明该色调越明显;C*ab值代表葡萄酒的明暗程度(色度),该值越大,饱和度越高;hab值则代表葡萄酒色调,根据其值的大小可以进行色相的划分。每个样品做两个独立重复。
1.3.4 不同聚合度缩合单宁组成轮廓的测定
不同聚合度缩合单宁组成轮廓的测定具体参考JEFFERY D W等[41]的方法,红葡萄酒样品经4 000 r/min离心5 min后,用0.1 mol/L HCl等比稀释。稀释酒样加入用甲醇和水活化后的固相萃取柱,待样品完全被柱填料吸附后,氮气干燥5 min。用40 mL的洗脱液(乙腈/0.01 mol/L HCl,95∶5,V/V)洗脱寡聚单宁,之后依次用5 mL甲醇水(含0.1%甲酸)、300 μL纯甲酸和2.7 mL体积分数为95%的甲醇水洗脱多聚单宁。洗脱液在旋转蒸发器中以30 ℃蒸干后,复溶于1 mL含有0.1%甲酸的10%乙醇水中待测。
HPLC分析的进样量为20 μL,在波长280 nm、320 nm、353 nm、370 nm和520 nm处采集二极管阵列检测器(diode array detector,DAD)信号。流动相流速0.3 mL/min,A相为甲酸/水溶液(5∶95,V/V);B相为甲酸/水/乙腈溶液(5∶15∶80,V/V)(B相洗脱梯度:0 min,0%;5 min,0%;30 min,90%;40 min,90%)。每个样品做两个平行试验。
1.3.5 人工唾液沉淀指数法
红葡萄酒的涩感强度使用人工唾液沉淀指数表征,该指数基于单宁与唾液蛋白相互作用后形成沉淀的原理,通过对反应后各唾液蛋白损失率的计算而获得,具体的人工唾液沉淀指数法计算参考QI M Y等[42]的研究,将模拟唾液(145.7 mg/L的乳铁蛋白、19.3 mg/L的溶菌酶、425.8 mg/L的α-淀粉酶、103.2 mg/L的牛血清蛋白和233.6 mg/L的聚-L-脯氨酸,并将pH值调整为6.6)与葡萄酒样品以8∶1的体积比进行混合,混合物在37 ℃下孵育5 min,随后以10 000×g离心2.5 min,取上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和HPLC分析。SDS-PAGE用于分析乳铁蛋白、溶菌酶、淀粉酶和牛血清白蛋白的损失率,上样量为30 μL,电压设置140 V,凝胶使用考马斯亮蓝(R-250)染色30 min,在10%的醋酸溶液中脱色12 h。HPLC用于分析聚-L-脯氨酸的蛋白损失率,A相为含0.2%的三氟乙酸水溶液,B相由甲醇/乙腈(70∶30,V/V)和0.2%的三氟乙酸组成。梯度洗脱程序如下:0~10 min,10%~22%B;10~15 min,22%B;15~23 min,22%~28%B;23~25 min,28%B;25~40 min,28%~60%B;40~40.1 min,60%~100%B;40.1~50 min,100%B;后运行时间为10 min。流速0.4 mL/min,柱温为40 ℃,紫外检测波长为214 nm,进样体积80 μL。
人工唾液沉淀指数计算公式如下:
式中:YASPI表示人工唾液沉淀指数;X1、X2、X3和X4分别是乳铁蛋白、白蛋白、α-淀粉酶和溶菌酶的蛋白条带灰度损失率,%;X5代表聚-L-脯氨酸的峰面积损失率,%。
1.3.6 数据处理与统计分析
酚类物质检测结果利用Quant-My-Way和Qualitative Analysis of Masshunter定量分析软件进行分析;模拟色板参考分光测色计形成的仿真颜色及各颜色参数,利用Color Tell颜色工具进行绘制;人工唾液沉淀指数法的结果利用软件Image J 1.8.0进行分析;柱形图利用GraphPad Prism 8.0软件进行绘制;单因素方差分析(analysis of variance,ANOVA)和Duncan多重比较利用SPSS 24.0软件进行计算。
2 结果与分析
2.1 酚类物质组成轮廓分析
2.1.1‘赤霞珠’红葡萄酒中酚类物质的组成轮廓
‘赤霞珠’红葡萄酒的酚类物质组成及含量如表3所示,各子产区总单体花色苷和总黄酮醇的平均含量由高至低依次为青铜峡子产区>永宁子产区>西夏子产区,花色苷衍生物、黄烷醇和酚酸的平均含量由高至低的顺序为青铜峡子产区>西夏子产区>永宁子产区。总体来看,‘赤霞珠’红葡萄酒中酚类物质含量存在由北至南逐渐上升的趋势。
表3 ‘赤霞珠’红葡萄酒样中酚类物质组成及含量
Table 3 Composition and contents of phenolic substance in the 'Cabernet Sauvignon' red wine samples
mg/L
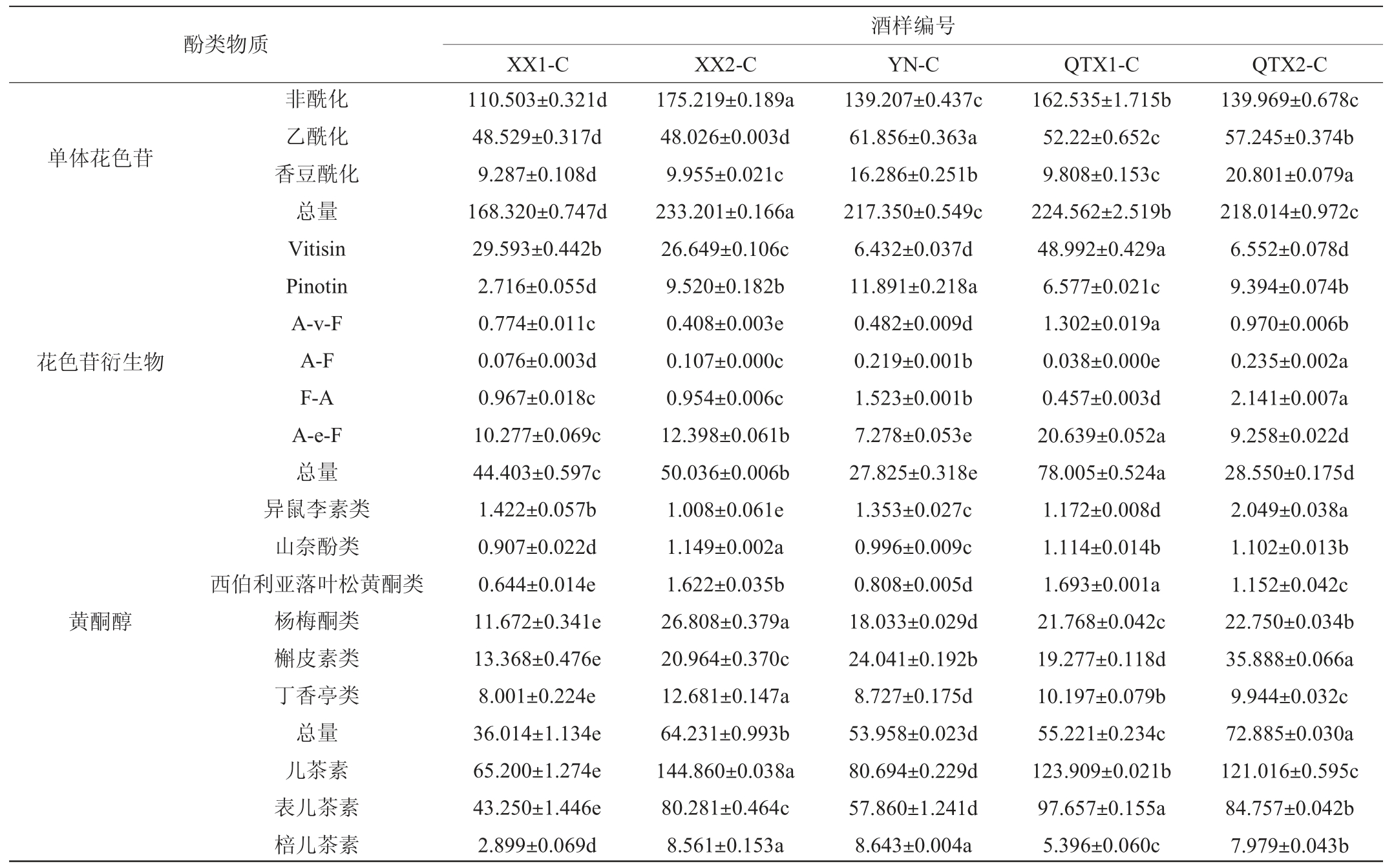
单体花色苷花色苷衍生物黄酮醇酚类物质非酰化乙酰化香豆酰化总量Vitisin Pinotin A-v-F A-F F-A A-e-F总量异鼠李素类山奈酚类西伯利亚落叶松黄酮类杨梅酮类槲皮素类丁香亭类总量儿茶素表儿茶素棓儿茶素XX1-C XX2-C 110.503±0.321d 48.529±0.317d 9.287±0.108d 168.320±0.747d 29.593±0.442b 2.716±0.055d 0.774±0.011c 0.076±0.003d 0.967±0.018c 10.277±0.069c 44.403±0.597c 1.422±0.057b 0.907±0.022d 0.644±0.014e 11.672±0.341e 13.368±0.476e 8.001±0.224e 36.014±1.134e 65.200±1.274e 43.250±1.446e 2.899±0.069d 175.219±0.189a 48.026±0.003d 9.955±0.021c 233.201±0.166a 26.649±0.106c 9.520±0.182b 0.408±0.003e 0.107±0.000c 0.954±0.006c 12.398±0.061b 50.036±0.006b 1.008±0.061e 1.149±0.002a 1.622±0.035b 26.808±0.379a 20.964±0.370c 12.681±0.147a 64.231±0.993b 144.860±0.038a 80.281±0.464c 8.561±0.153a酒样编号YN-C QTX1-C QTX2-C 139.207±0.437c 61.856±0.363a 16.286±0.251b 217.350±0.549c 6.432±0.037d 11.891±0.218a 0.482±0.009d 0.219±0.001b 1.523±0.001b 7.278±0.053e 27.825±0.318e 1.353±0.027c 0.996±0.009c 0.808±0.005d 18.033±0.029d 24.041±0.192b 8.727±0.175d 53.958±0.023d 80.694±0.229d 57.860±1.241d 8.643±0.004a 162.535±1.715b 52.22±0.652c 9.808±0.153c 224.562±2.519b 48.992±0.429a 6.577±0.021c 1.302±0.019a 0.038±0.000e 0.457±0.003d 20.639±0.052a 78.005±0.524a 1.172±0.008d 1.114±0.014b 1.693±0.001a 21.768±0.042c 19.277±0.118d 10.197±0.079b 55.221±0.234c 123.909±0.021b 97.657±0.155a 5.396±0.060c 139.969±0.678c 57.245±0.374b 20.801±0.079a 218.014±0.972c 6.552±0.078d 9.394±0.074b 0.970±0.006b 0.235±0.002a 2.141±0.007a 9.258±0.022d 28.550±0.175d 2.049±0.038a 1.102±0.013b 1.152±0.042c 22.750±0.034b 35.888±0.066a 9.944±0.032c 72.885±0.030a 121.016±0.595c 84.757±0.042b 7.979±0.043b
续表

注:同行不同小写字母表示数据间差异显著(P<0.05)。Vitisin为Vitisin A(丙酮吡喃化花色苷)与Vitisin B(乙醛吡喃化花色苷)含量之和;Pinotin为酚基型吡喃花色苷;A-v-F为乙烯基儿茶醇吡喃化花色苷;A-F和F-A为直连型聚合花色苷,其中A代表花色苷类物质,F代表黄烷醇类物质,顺序在前代表在具体结构中位置在上;A-e-F为乙醛桥连型聚合花色苷。下同。
酚类物质XX1-C XX2-C酒样编号YN-C QTX1-C QTX2-C酚酸表棓儿茶素表儿茶素没食子酸酯表棓儿茶素没食子酸酯原花色素B1原花色素B2原花色素C1总量羟基苯甲酸羟基肉桂酸总量1.083±0.041d 0.529±0.004b 0.248±0.001b 79.712±2.416e 54.640±1.058e 34.334±1.765d 113.208±2.833e 44.034±2.778c 5.443±0.379e 49.478±3.157e 4.594±0.149a 0.469±0.004c 0.249±0.000b 138.389±3.152b 92.801±1.018c 63.032±1.054b 239.016±0.510a 80.283±0.743b 59.162±0.976a 139.445±1.719a 3.542±0.067c 0.438±0.007d 0.246±0.001c 113.958±0.959c 71.271±1.278d 41.842±3.067c 151.421±1.076d 43.404±1.658c 19.049±0.487d 62.453±2.145d 3.517±0.040c 0.436±0.006d 0.245±0.001c 109.492±0.769d 97.423±0.973b 68.643±0.568a 231.161±0.071b 83.583±1.921a 37.573±0.909b 121.156±2.83b 4.336±0.013b 0.607±0.010a 0.260±0.002a 172.94±0.100a 109.299±0.668a 68.027±1.445a 218.956±0.485c 85.524±0.938a 32.074±0.016c 117.599±0.922c
南部青铜峡子产区红葡萄酒中丰富的酚类物质源于酿酒葡萄果实,果实品质受该产区诸多风土因子的共同调控。青铜峡子产区地处较为平坦的冲击平原,其较少的降水量(72.0 mm,见表1)可促进果实中酚类物质的合成[43],尤其可以促进花色苷的有效积累[25]。因此,青铜峡子产区的‘赤霞珠’红葡萄酒能从其对应的原料果实中获得更多的单体花色苷类物质,也有助于葡萄酒发酵过程中花色苷衍生物的合成与积累。此外,青铜峡子产区原花色素低聚体平均含量偏高,其中酒样QTX1-C表儿茶素含量较高,酒样QTX2-C原花青素二聚体和三聚体含量较高,这可能与该子产区日照时间长、有效积温高有关。研究表明,日照和高温等风土因子不仅有助于提升葡萄浆果中花色苷的含量,对黄烷醇的积累也存在促进作用[17,19]。与此同时,高温条件也将影响了浆果中黄酮醇的代谢流向,使二氢山奈酚更多地合成槲皮素类物质,因此,青铜峡子产区‘赤霞珠’红葡萄酒中槲皮素平均含量较高。
西夏子产区红葡萄酒酚类物质的平均含量较低,两款红葡萄酒的酚类组成轮廓也存在一定差异,这可能是子产区内部降水量差异较大导致的:较少的降水和较高的有效积温是提升果实酚类化合物和可溶性固形物含量的主要因素[2],因此酒样XX2-C中积累了较多的风味物质,如非酰化的二甲花翠素-3-O-葡萄糖苷等。此外,‘赤霞珠’红葡萄酒中羟基苯甲酸含量整体高于羟基肉桂酸,且子产区气温较高的酒样XX2-C、QTX1-C和QTX2-C的酚酸总量偏高,这表明温度可能是影响酚酸积累的重要风土因子。
‘赤霞珠’红葡萄酒呈色花色苷的含量占比分析结果如图1所示,非游离形式的花色苷是‘赤霞珠’酒样中最主要的呈色形式,FA在三个子产区中占比较少,且其所占比例存在一定北低南高的趋势,而PA也存在此趋势,这一结果与花色苷类物质组成的实际含量表现一致。
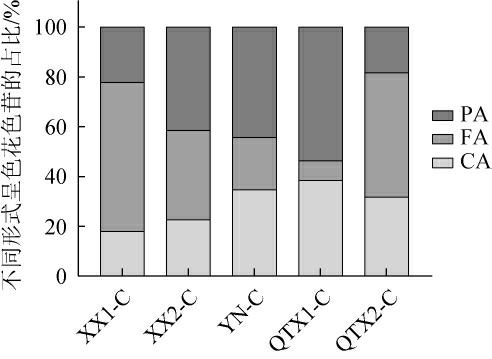
图1 ‘赤霞珠’红葡萄酒样中不同形式花色苷的占比
Fig.1 Proportion of different forms of anthocyanins in the 'Cabernet Sauvignon' red wine samples
2.1.2‘马瑟兰’红葡萄酒中酚类物质的组成轮廓
‘马瑟兰’红葡萄酒的酚类物质组成及含量如表4所示,其中花色苷衍生物、黄酮醇和酚酸总量由高到低的顺序为青铜峡子产区>西夏子产区>永宁子产区,整体上也有一定北低南高的趋势,这与‘赤霞珠’红葡萄酒中的表现一致;然而,‘马瑟兰’红葡萄酒中单体花色苷总量由高到低的顺序为西夏子产区>青铜峡子产区>永宁子产区,黄烷醇含量与之相反,此趋势与‘赤霞珠’差异较大。
表4 ‘马瑟兰’红葡萄酒样中酚类物质组成及含量
Table 4 Composition and contents of phenols in the 'Marselan' red wine samples mg/L

单体花色苷花色苷衍生物黄酮醇黄烷醇酚酸酚类物质非酰化乙酰化香豆酰化总量Vitisin Pinotin A-v-F A-F F-A A-e-F Portisin总量异鼠李素类山奈酚类西伯利亚落叶松黄酮类杨梅黄酮类槲皮素类丁香亭类总量儿茶素表儿茶素棓儿茶素表棓儿茶素表儿茶素没食子酸酯表棓儿茶素没食子酸酯原花色素B1原花色素B2原花色素C1总量羟基苯甲酸羟基肉桂酸总量XX1-M XX2-M 189.257±2.012c 81.893±0.371b 24.438±0.035c 295.588±2.348b 5.397±0.047e 5.556±0.002e 0.139±0.000e 0.072±0.001c 1.204±0.001c 2.044±0.024e 0.000±0.000c 14.398±0.072e 0.510±0.001d 0.835±0.004d 0.421±0.005e 13.869±0.155e 7.694±0.134e 9.307±0.221e 32.637±0.520e 52.797±0.838e 40.964±0.208e 3.256±0.060e 2.260±0.009e 0.421±0.002e 0.245±0.001d 45.284±0.691d 33.956±0.170e 17.770±0.261e 99.942±1.115e 36.416±1.611e 13.659±0.803e 50.075±2.413e 239.592±2.944a 93.356±0.914a 44.075±0.117a 377.023±3.974a 61.745±0.052a 30.557±0.541a 0.573±0.018d 0.039±0.001e 1.151±0.004d 13.064±0.230d 0.008±0.001b 107.137±0.847a 2.604±0.062a 1.667±0.002a 0.796±0.020c 51.305±0.700a 28.330±0.047b 20.058±0.081a 104.760±0.532a 106.911±0.054d 81.575±0.026d 6.133±0.004b 5.398±0.108a 0.756±0.005b 0.276±0.003b 100.645±0.128c 77.467±1.118d 49.247±1.101d 201.049±0.125d 61.990±0.491c 78.890±0.165a 140.88±0.325b酒样编号YN-M QTX1-M QTX2-M 175.015±1.285d 68.733±0.137c 20.756±0.018e 264.504±1.439c 12.510±0.337d 9.135±0.280d 2.313±0.026a 0.397±0.007a 2.677±0.009b 24.346±0.122a 0.011±0.004b 51.389±0.762c 1.134±0.002c 1.332±0.017b 0.674±0.005d 30.393±0.191b 22.489±0.040c 10.940±0.041d 66.963±0.201c 124.456±1.336b 101.148±0.488a 6.323±0.145a 4.261±0.112b 0.531±0.010c 0.250±0.001c 186.708±0.513a 127.195±0.297a 92.417±0.047a 236.968±2.092a 52.448±2.348d 34.137±2.143d 86.585±4.491d 208.131±0.035b 64.664±0.322d 22.902±0.160d 295.697±0.447b 51.311±0.669b 15.306±0.010b 1.752±0.009c 0.058±0.002d 0.825±0.001e 17.266±0.073c 0.015±0.001a 86.533±0.725b 1.355±0.009b 1.320±0.013b 0.845±0.013b 24.377±0.024d 20.852±0.035d 13.794±0.003c 62.543±0.002d 142.229±0.399a 84.932±0.839c 4.022±0.084d 2.468±0.019d 0.452±0.002d 0.245±0.001d 112.808±1.866b 84.026±0.528c 52.827±1.587c 234.348±0.340b 74.253±0.707b 59.175±1.193c 133.428±1.899c 166.228±0.912e 62.647±0.150e 29.15±0.260b 258.026±0.802d 13.097±0.003c 11.306±0.129c 2.168±0.006b 0.317±0.000b 3.705±0.010a 17.854±0.081b 0.000±0.000c 48.447±0.223d 1.313±0.001b 1.275±0.020c 1.458±0.010a 29.626±0.099c 30.281±0.265a 18.616±0.326b 82.569±0.680b 121.113±2.083c 86.719±2.285b 5.010±0.001c 3.209±0.003c 1.286±0.014a 0.294±0.001a 187.675±0.340a 121.754±2.099b 80.817±0.651b 217.631±0.187c 80.536±0.864a 71.604±0.818b 152.141±1.682a
对于西夏和青铜峡子产区的‘马瑟兰’葡萄果实,低降水量可促进其单体花色苷与原花色素的积累,同时在青铜峡子产区较高有效积温的作用下,果实中的类黄酮更多地流向F3′H途径,进一步促进了原花色素的合成[22],而西夏子产区相对较低的温度更有利于加深葡萄浆果表皮着色[23]。因此青铜峡子产区‘马瑟兰’红葡萄酒中的黄烷醇含量显著高于西夏子产区,而单体花色苷总量显著低于西夏子产区。此外,北部西夏子产区的酒样XX2-M中杨梅酮类物质含量高,而南部的青铜峡子产区酒样中槲皮素类物质的平均含量较高。此现象与‘赤霞珠’一致,可能是温度这一风土因子影响了‘马瑟兰’葡萄果实中黄酮醇的代谢流向:高温使二氢山奈酚更多地生成槲皮素,低温则会使其积累为杨梅酮[21]。与此同时,‘马瑟兰’红葡萄酒中羟基苯甲酸含量整体略高于羟基肉桂酸,其差异虽不如‘赤霞珠’明显,但来自气温较高子产区的酒样,如酒样XX2-C、QTX1-C和QTX2-C,其酚酸总量较高,这与‘赤霞珠’在各子产区的表现完全一致,也进一步说明果实中酚酸的含量可能更易受到温度的影响。
贺兰山东麓各子产区的风土条件(如温度和降水等)调控了‘马瑟兰’葡萄果实中的类黄酮代谢流向,进而影响其红葡萄酒中的酚类物质组成,这与‘赤霞珠’红葡萄酒在各子产区的酚类变化趋势基本相同。然而,一些风土因子对不同葡萄品种中黄烷醇的积累具有不同的影响:永宁子产区‘马瑟兰’红葡萄酒的黄烷醇类物质含量最高,尤其是原花青素二聚体和三聚体,而该子产区‘赤霞珠’红葡萄酒的黄烷醇类物质含量在三个子产区中相对较低。永宁子产区降水量最高,湿度较大,这些风土因素不利于‘赤霞珠’和‘西拉’等品种中黄烷醇类物质的积累[28-29],而孟宪宸等[44]的研究表明,在高湿度强降雨的条件下反而减少了植物的蒸腾作用,提高了光合产物的积累,有效增加了‘马瑟兰’中籽单宁的含量。
对呈色花色苷的占比作进一步分析,结果如图2所示,PA是‘马瑟兰’酒样中最主要的呈色形式,且其所占比例也存在北低南高的趋势。对于西夏子产区的两款酒样来说,酒样XX1-M中FA占比较高,而酒样XX2-M中PA的占比大;在青铜峡子产区,酒样QTX1-M中PA占比更高,酒样QTX2-M中FA占比大。花色苷衍生物含量的差异可能是此现象出现的原因,这与‘赤霞珠’红葡萄酒在两种风土条件下表现完全一致。
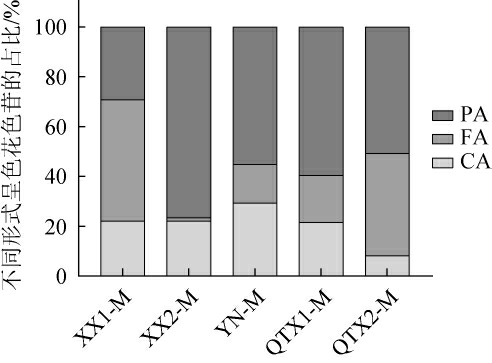
图2 ‘马瑟兰’红葡萄酒样中不同形式花色苷的占比
Fig.2 Proportion of different forms of anthocyanins in 'Marselan' red wine samples
2.2 颜色特征分析
2.2.1‘赤霞珠’红葡萄酒颜色特征
由表5可知,永宁子产区‘赤霞珠’红葡萄酒的红色调最为突出,西夏子产区酒样的红、黄色调均处于中间水平。5款酒样的L*值从低至高的顺序为酒样QTX1-C>XX2-C>YN-C>XX1-C>QTX2-C,同属于青铜峡子产区的两款红葡萄酒呈现较大的颜色差异:其中酒样QTX2-C的颜色较浅,这可能是酒样中花色苷衍生物含量低导致的;而酒样QTX1-C中Vitisin和A-v-F的含量远高于酒样QTX2-C,有研究表明[45],这些花色苷衍生物对红葡萄酒颜色强度有较大的贡献,因此酒样QTX1-C的颜色更深。花色苷衍生物作为红葡萄酒中重要的呈色物质,其含量不仅受果实中单体花色苷和非花色苷酚等反应底物含量的影响,也受到发酵工艺的调控[46-47]。
表5 ‘赤霞珠’红葡萄酒样的颜色特征
Table 5 Color characteristics of the 'Cabernet Sauvignon' red wine samples
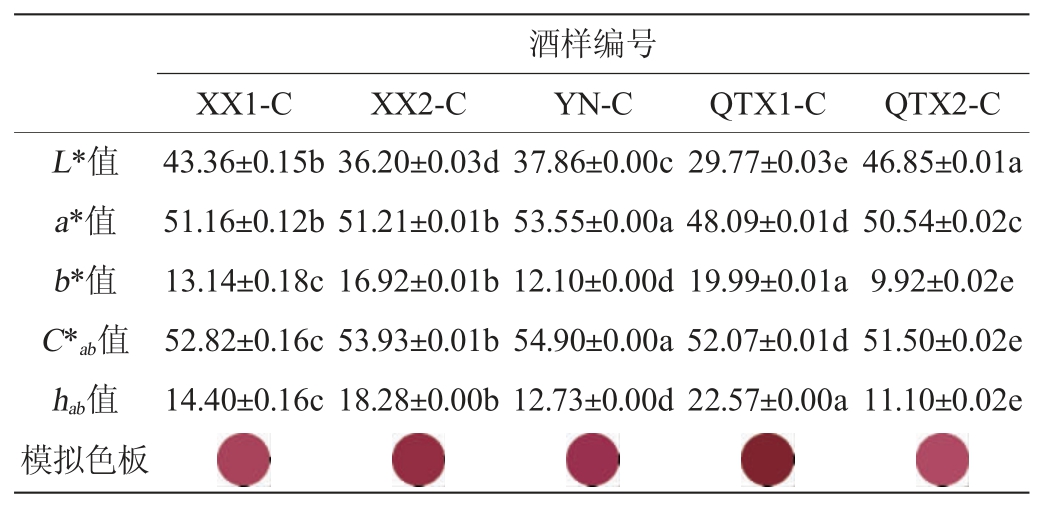
XX1-C XX2-C酒样编号YN-C QTX1-C QTX2-C L*值a*值b*值C*ab值hab值模拟色板43.36±0.15b 51.16±0.12b 13.14±0.18c 52.82±0.16c 14.40±0.16c 36.20±0.03d 51.21±0.01b 16.92±0.01b 53.93±0.01b 18.28±0.00b 37.86±0.00c 53.55±0.00a 12.10±0.00d 54.90±0.00a 12.73±0.00d 29.77±0.03e 48.09±0.01d 19.99±0.01a 52.07±0.01d 22.57±0.00a 46.85±0.01a 50.54±0.02c 9.92±0.02e 51.50±0.02e 11.10±0.02eimages/BZ_53_391_2638_443_2691.pngimages/BZ_53_565_2638_618_2691.pngimages/BZ_53_740_2638_792_2691.pngimages/BZ_53_914_2638_967_2691.pngimages/BZ_53_1089_2638_1142_2691.png
2.2.2‘马瑟兰’红葡萄酒颜色特征
‘马瑟兰’红葡萄酒的颜色特征如表6所示,除酒样QTX1-M外,‘马瑟兰’红葡萄酒的颜色均深于对应子产区的‘赤霞珠’葡萄酒,红色色调也更为突出,饱和度更高,这与‘马瑟兰’中丰富的花色苷含量有关。酒样YN-M和XX2-M酒体的黄色色调较高,这可能是酒样中Pinotin和A-v-F等花色苷衍生物含量较高而影响其颜色表现[45]。而在酒样XX1-M中,花色苷衍生物含量低,以单体花色苷为主的游离态花色苷对酒体颜色贡献较大,黄色色调较少,这与该酒样中呈色花色苷占比结果一致。酒样XX2-M和QTX2-M的红色色调突出,其酒样中黄酮醇等辅色能力强的酚类物质含量高,可有效保护花色苷呈色基团,提升酒体颜色品质[48]。此外,与‘赤霞珠’红葡萄酒类似的,西夏子产区的两款‘马瑟兰’红葡萄酒颜色差异较大,酒样XX2-M的b*值远高于XX1-M,这可能是由于降水等风土因子影响了‘马瑟兰’葡萄果实花色苷含量,使单体花色苷在前者中大量积累,并在发酵过程中更多的生成具有黄色色调的花色苷衍生物类物质,从而影响酒体呈色。结果表明,花色苷衍生物虽然含量在酚类物质总量中占比较小,但可能是影响贺兰山东麓产区红葡萄酒黄色调的关键物质。
表6 ‘马瑟兰’红葡萄酒样的颜色特征
Table 6 Color characteristics of the 'Marselan' red wine samples
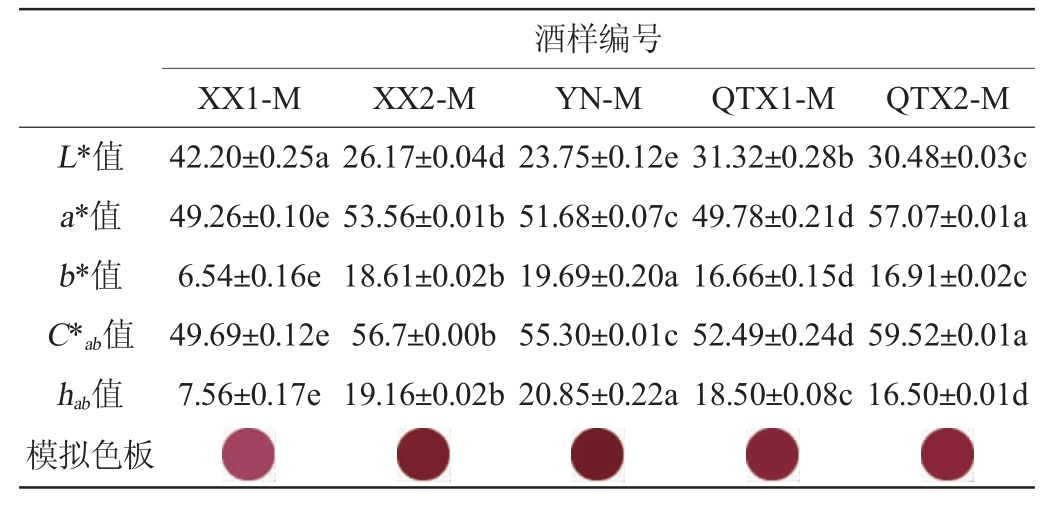
XX1-M XX2-M酒样编号YN-M QTX1-M QTX2-M L*值a*值b*值C*ab值hab值模拟色板42.20±0.25a 49.26±0.10e 6.54±0.16e 49.69±0.12e 7.56±0.17e 26.17±0.04d 53.56±0.01b 18.61±0.02b 56.7±0.00b 19.16±0.02b 23.75±0.12e 51.68±0.07c 19.69±0.20a 55.30±0.01c 20.85±0.22a 31.32±0.28b 49.78±0.21d 16.66±0.15d 52.49±0.24d 18.50±0.08c 30.48±0.03c 57.07±0.01a 16.91±0.02c 59.52±0.01a 16.50±0.01dimages/BZ_53_1501_2493_1554_2546.pngimages/BZ_53_1675_2493_1728_2546.pngimages/BZ_53_1850_2493_1903_2546.pngimages/BZ_53_2025_2493_2077_2546.pngimages/BZ_53_2199_2493_2252_2546.png
2.3 缩合单宁的组成轮廓
2.3.1‘赤霞珠’红葡萄酒不同聚合度缩合单宁组成轮廓
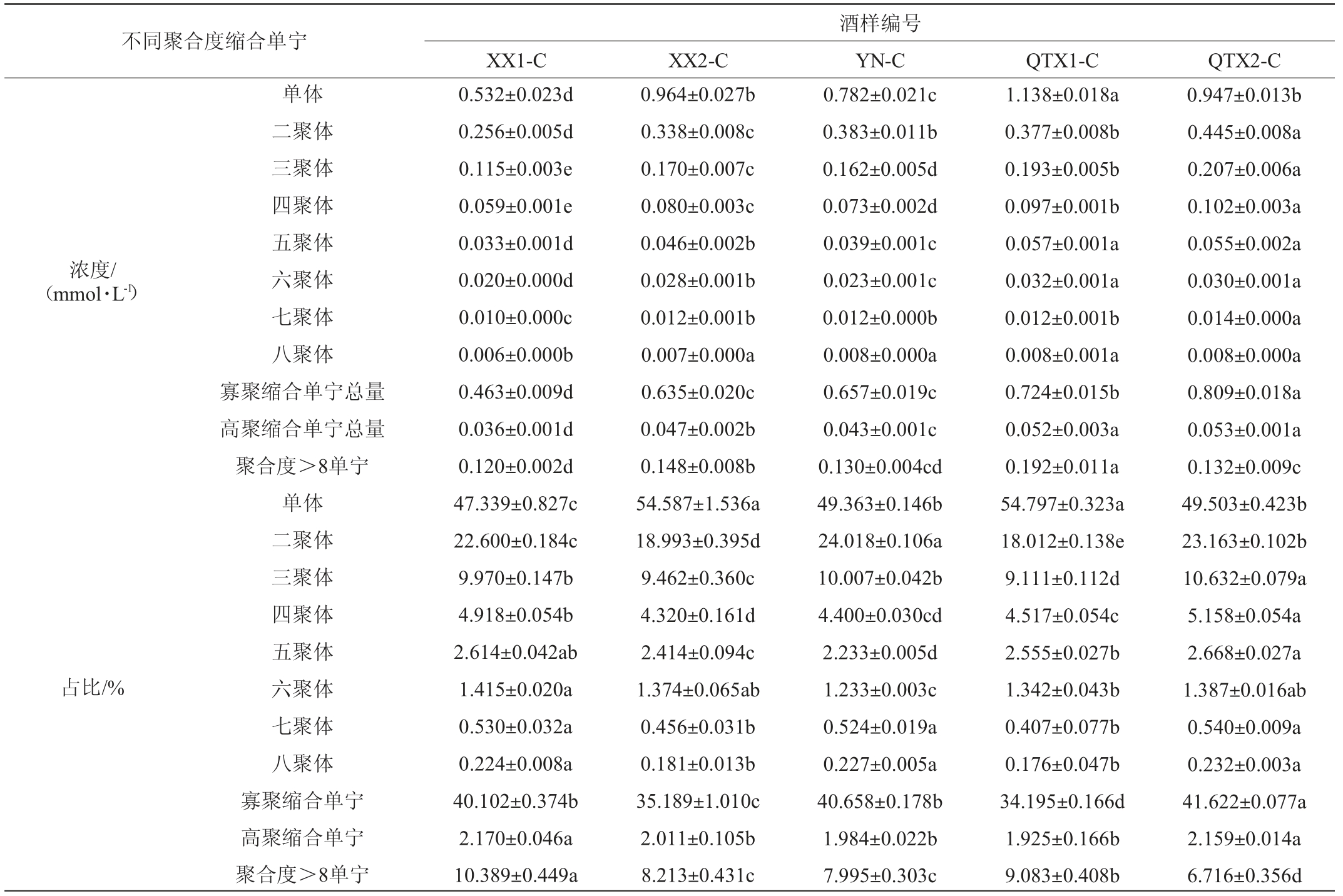
‘赤霞珠’红葡萄酒不同聚合度缩合单宁组成轮廓结果如表7所示,各聚合度(degree of polymerization,DP)缩合单宁的含量整体呈现北低南高的趋势。其中,西夏子产区缩合单宁总量偏低,但高聚缩合单宁占比较高,且产区内部存在较为明显的差异,酒样XX1-C缩合单宁含量相对较少。西夏子产区由于其较低的日照时数和温度条件,不利于黄烷醇类物质的积累与生物合成[19,24],而酒样XX2-C所在地区由于降水量低,在一定程度上提升了单宁的聚合程度[28],因此其高聚缩合单宁含量明显高于酒样XX1-C。青铜峡子产区酒样缩合单宁总量最高,该产区拥有较多的日照时数、较高的有效积温以及较少的降水,这些风土因素均使得产区‘赤霞珠’果实中缩合单宁得到有效积累[21,24,26,28],进而提升该区域红葡萄酒的缩合单宁含量。但其子产区内部物质组成轮廓仍存在差异,酒样QTX1-C的高聚缩合单宁含量及占比都较高;酒样QTX2-C除黄烷-3-醇单体外的缩合单宁均为最高含量,这可能是由于其较高的温度和较强的日照促使原花色素生成更多聚合度更大的物质,从而减少单体含量,这也会使得葡萄酒的苦味降低而涩感增强[49]。
表7 ‘赤霞珠’红葡萄酒样中不同聚合度缩合单宁的含量及占比
Table 7 Contents and proportion of different polymerization degrees of condensed tannins in the 'Cabernet Sauvignon' red wine samples
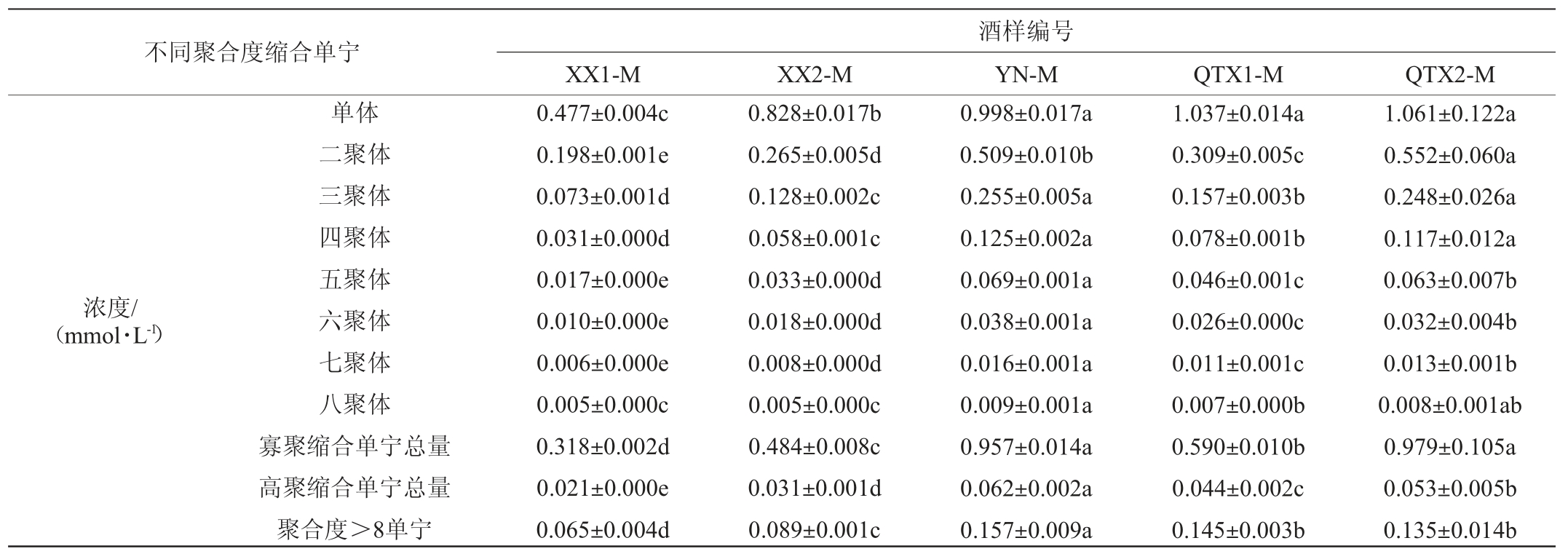
2.3.2‘马瑟兰’红葡萄酒不同聚合度缩合单宁组成轮廓
浓度/(mmol·L-1)占比/%不同聚合度缩合单宁单体二聚体三聚体四聚体五聚体六聚体七聚体八聚体寡聚缩合单宁总量高聚缩合单宁总量聚合度>8单宁单体二聚体三聚体四聚体五聚体六聚体七聚体八聚体寡聚缩合单宁高聚缩合单宁聚合度>8单宁XX1-C XX2-C 0.532±0.023d 0.256±0.005d 0.115±0.003e 0.059±0.001e 0.033±0.001d 0.020±0.000d 0.010±0.000c 0.006±0.000b 0.463±0.009d 0.036±0.001d 0.120±0.002d 47.339±0.827c 22.600±0.184c 9.970±0.147b 4.918±0.054b 2.614±0.042ab 1.415±0.020a 0.530±0.032a 0.224±0.008a 40.102±0.374b 2.170±0.046a 10.389±0.449a 0.964±0.027b 0.338±0.008c 0.170±0.007c 0.080±0.003c 0.046±0.002b 0.028±0.001b 0.012±0.001b 0.007±0.000a 0.635±0.020c 0.047±0.002b 0.148±0.008b 54.587±1.536a 18.993±0.395d 9.462±0.360c 4.320±0.161d 2.414±0.094c 1.374±0.065ab 0.456±0.031b 0.181±0.013b 35.189±1.010c 2.011±0.105b 8.213±0.431c酒样编号YN-C QTX1-C QTX2-C 0.782±0.021c 0.383±0.011b 0.162±0.005d 0.073±0.002d 0.039±0.001c 0.023±0.001c 0.012±0.000b 0.008±0.000a 0.657±0.019c 0.043±0.001c 0.130±0.004cd 49.363±0.146b 24.018±0.106a 10.007±0.042b 4.400±0.030cd 2.233±0.005d 1.233±0.003c 0.524±0.019a 0.227±0.005a 40.658±0.178b 1.984±0.022b 7.995±0.303c 1.138±0.018a 0.377±0.008b 0.193±0.005b 0.097±0.001b 0.057±0.001a 0.032±0.001a 0.012±0.001b 0.008±0.001a 0.724±0.015b 0.052±0.003a 0.192±0.011a 54.797±0.323a 18.012±0.138e 9.111±0.112d 4.517±0.054c 2.555±0.027b 1.342±0.043b 0.407±0.077b 0.176±0.047b 34.195±0.166d 1.925±0.166b 9.083±0.408b 0.947±0.013b 0.445±0.008a 0.207±0.006a 0.102±0.003a 0.055±0.002a 0.030±0.001a 0.014±0.000a 0.008±0.000a 0.809±0.018a 0.053±0.001a 0.132±0.009c 49.503±0.423b 23.163±0.102b 10.632±0.079a 5.158±0.054a 2.668±0.027a 1.387±0.016ab 0.540±0.009a 0.232±0.003a 41.622±0.077a 2.159±0.014a 6.716±0.356d
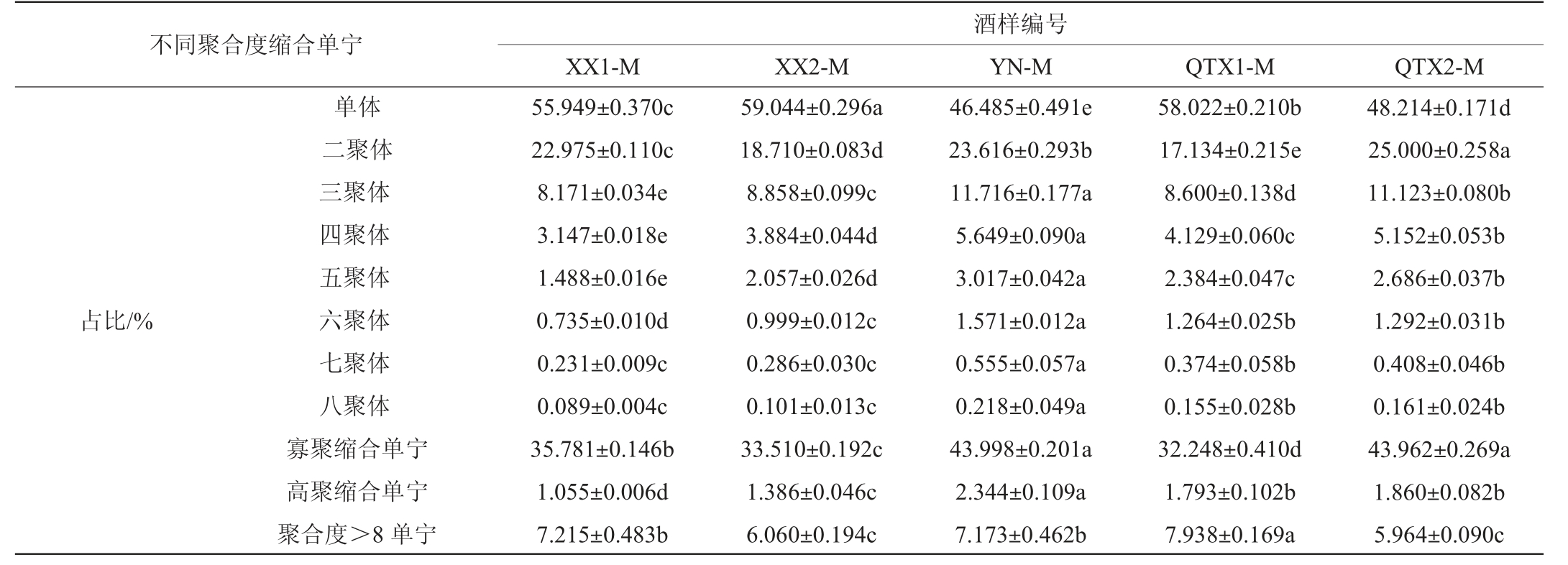
由表8可知,西夏子产区‘马瑟兰’红葡萄酒的酒样缩合单宁含量最低,尤其是酒样XX1-M;永宁子产区除黄烷醇单体和二聚体外,其余各聚合度缩合单宁含量均为最高;青铜峡子产区酒样缩合单宁含量偏高,其中酒样QTX2-M中黄烷醇单体和二聚体含量最高,其余各聚合度缩合单宁含量均仅次于永宁子产区。这一结果与‘马瑟兰’红葡萄酒酚类物质组成轮廓的变化趋势一致,表明在温度和降水等风土因素的调控下,‘马瑟兰’果实中类黄酮代谢流向F3′H途径,黄烷醇类物质大量积累,并促进高聚缩合单宁的生物合成[17],因此酒样中缩合单宁含量突出。但与‘赤霞珠’中结果不同的是,‘马瑟兰’红葡萄酒中永宁子产区的缩合单宁含量显著高于其他子产区(P<0.05),可能是由于该子产区为风沙土,该土壤表面含沙而多孔,下层土质精密、松软,上沙下黏,通透性良好,但保肥性较差,矿物质含量低,因而‘马瑟兰’生长势较强、耐瘠薄的特性使得其葡萄皮籽单宁有效积累,造就了其与‘赤霞珠’不同的缩合单宁组成轮廓[50-51]。
表8 ‘马瑟兰’红葡萄酒样中不同聚合度缩合单宁的含量及占比
Table 8 Content and proportion of different polymerization degrees of condensed tannins in the 'Marselan' red wine samples
浓度/(mmol·L-1)不同聚合度缩合单宁单体二聚体三聚体四聚体五聚体六聚体七聚体八聚体寡聚缩合单宁总量高聚缩合单宁总量聚合度>8单宁XX1-M XX2-M 0.477±0.004c 0.198±0.001e 0.073±0.001d 0.031±0.000d 0.017±0.000e 0.010±0.000e 0.006±0.000e 0.005±0.000c 0.318±0.002d 0.021±0.000e 0.065±0.004d 0.828±0.017b 0.265±0.005d 0.128±0.002c 0.058±0.001c 0.033±0.000d 0.018±0.000d 0.008±0.000d 0.005±0.000c 0.484±0.008c 0.031±0.001d 0.089±0.001c酒样编号YN-M QTX1-M QTX2-M 0.998±0.017a 0.509±0.010b 0.255±0.005a 0.125±0.002a 0.069±0.001a 0.038±0.001a 0.016±0.001a 0.009±0.001a 0.957±0.014a 0.062±0.002a 0.157±0.009a 1.037±0.014a 0.309±0.005c 0.157±0.003b 0.078±0.001b 0.046±0.001c 0.026±0.000c 0.011±0.001c 0.007±0.000b 0.590±0.010b 0.044±0.002c 0.145±0.003b 1.061±0.122a 0.552±0.060a 0.248±0.026a 0.117±0.012a 0.063±0.007b 0.032±0.004b 0.013±0.001b 0.008±0.001ab 0.979±0.105a 0.053±0.005b 0.135±0.014b
续表
占比/%不同聚合度缩合单宁单体二聚体三聚体四聚体五聚体六聚体七聚体八聚体寡聚缩合单宁高聚缩合单宁聚合度>8 单宁XX1-M XX2-M 55.949±0.370c 22.975±0.110c 8.171±0.034e 3.147±0.018e 1.488±0.016e 0.735±0.010d 0.231±0.009c 0.089±0.004c 35.781±0.146b 1.055±0.006d 7.215±0.483b 59.044±0.296a 18.710±0.083d 8.858±0.099c 3.884±0.044d 2.057±0.026d 0.999±0.012c 0.286±0.030c 0.101±0.013c 33.510±0.192c 1.386±0.046c 6.060±0.194c酒样编号YN-M QTX1-M QTX2-M 46.485±0.491e 23.616±0.293b 11.716±0.177a 5.649±0.090a 3.017±0.042a 1.571±0.012a 0.555±0.057a 0.218±0.049a 43.998±0.201a 2.344±0.109a 7.173±0.462b 58.022±0.210b 17.134±0.215e 8.600±0.138d 4.129±0.060c 2.384±0.047c 1.264±0.025b 0.374±0.058b 0.155±0.028b 32.248±0.410d 1.793±0.102b 7.938±0.169a 48.214±0.171d 25.000±0.258a 11.123±0.080b 5.152±0.053b 2.686±0.037b 1.292±0.031b 0.408±0.046b 0.161±0.024b 43.962±0.269a 1.860±0.082b 5.964±0.090c
2.4‘赤霞珠’及‘马瑟兰’红葡萄酒涩感特征分析
由图3a可知,三个子产区‘赤霞珠’红葡萄酒的ASPI值呈现从北至南的上升趋势,即葡萄酒涩感强度由北至南逐渐增大,其中西夏子产区酒样涩感较弱,酒样XX2-C的涩感最弱;青铜峡子产区葡萄酒涩感较强,以酒样QTX2-C的涩感最为突出。红葡萄酒涩感强度的差异受到缩合单宁含量及各聚合度单宁占比的影响,当缩合单宁含量较高时,葡萄酒具有较为明显的涩感,而对于缩合单宁含量相近的酒样,除含量外偏高聚的缩合单宁占比也对酒样涩感强度有较大贡献,这与以往研究中高聚缩合单宁产生更强的涩感的结果一致[52]。
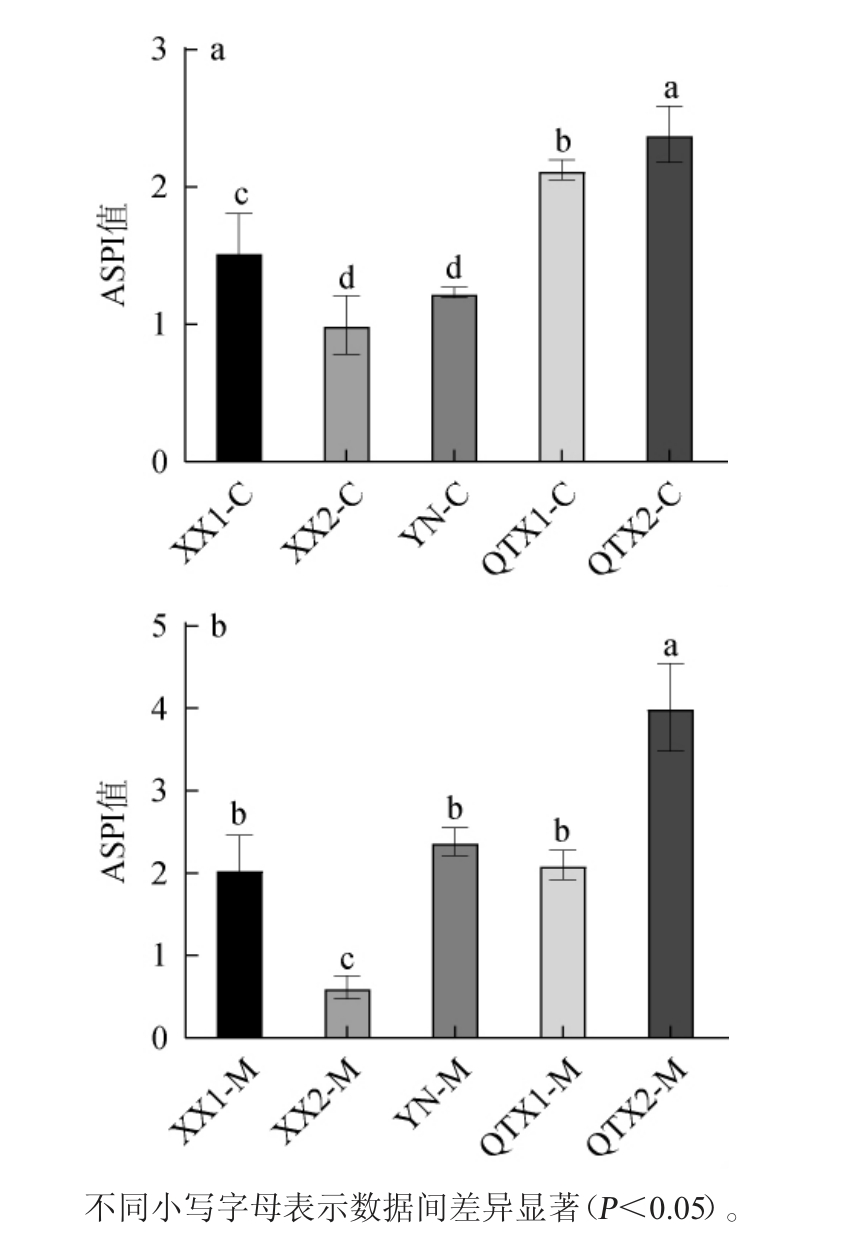
图3 ‘赤霞珠’和‘马瑟兰’红葡萄酒样人工唾液沉淀指数
Fig.3 Artificial saliva precipitation indexes of the 'Cabernet Sauvignon' and 'Marselan' red wine samples
由图3b可知,与‘赤霞珠’红葡萄酒结果类似,‘马瑟兰’红葡萄酒的ASPI值从北至南逐渐上升,其涩感强度亦逐渐增强,但同一产区的样品间仍存在差异。西夏子产区酒样涩感强度较弱,其中酒样XX2-M的涩感最弱;青铜峡子产区酒样涩感较强,且酒样QTX2-M的涩感最强,此结果与‘赤霞珠’红葡萄酒完全一致。西夏子产区酒样中缩合单宁总量较低,高聚缩合单宁占比较小,因此酒样涩感强度相对较弱,而青铜峡子产区酒样中缩合单宁总量相对较高,贡献了更强的涩感,这与‘赤霞珠’中的结果一致。此外,与‘赤霞珠’红葡萄酒相比,‘马瑟兰’红葡萄酒整体涩感更强。
2.5 宁夏贺兰山东麓不同风土条件下产区红葡萄酒的特征及差异
从颜色参数来看,贺兰山东麓各子产区红葡萄酒整体呈现较高的红色色调,某些子产区酒样的黄色色调(b*值)较为突出,这与酒样中花色苷衍生物的含量密切相关;且与‘赤霞珠’红葡萄酒相比,‘马瑟兰’红葡萄酒酒体颜色更深,饱和度(Cab*)更高。对于涩感强度而言,贺兰山东麓各子产区红葡萄酒的ASPI存在从北至南逐渐增强的趋势,且总是表现为酒样XX2涩感最弱而酒样QTX2涩感最强,这与葡萄酒中高聚缩合单宁的占比、黄烷醇单体和低聚缩合单宁的含量有较为明显的关联,较高的高聚缩合单宁占比及较高的低聚缩合单宁含量对涩感都有一定增强的作用。
从酚类物质组成轮廓来看,贺兰山东麓葡萄酒酚类物质含量总体呈现北低南高的趋势,这与酒样感官特征结果相对应。其中,西夏子产区酒样酚类物质和缩合单宁整体含量偏低,这与该产区靠近山体有关,与山体之间距离越短,果实受到的光照越少;而且山体对冷空气和降水都有一定程度阻挡,此种风土条件使葡萄果实中积累较少的酚类物质,因此所酿造的红葡萄酒的酚类物质含量相应较低。酒样XX1酚类物质含量总是低于酒样XX2,其较少的日照时数和较多的降水可能是造成此差异的重要原因。
永宁子产区酒样的花色苷、黄酮醇和酚酸等酚类物质含量处于三个子产区的中间水平。该产区降水量较高,有效积温较低,对酚类物质的积累无显著正向作用。但值得注意的是,该子产区的风土对于不同葡萄品种中黄烷醇的积累可能具有不同的调控作用:‘马瑟兰’更易在高湿度条件下积累儿茶素和表儿茶素等黄烷醇单体,同时各聚合度缩合单宁的含量也显著提升;而对于‘赤霞珠’中的黄烷醇类物质,上述风土因子则难以起到正向调控作用。
青铜峡子产区日照时数较多且降水较少,这一风土条件有利于酚类物质的积累,且酒样QTX2所在区域内土壤中较少的小石粒使其水分蒸发更快,容易形成更为强烈的水分胁迫,还能够在一定程度上增强反射光,从而促进黄烷醇积累与原花色素的合成。并且各聚合度缩合单宁含量高,占比大,使红葡萄酒具有更强的涩感。
3 结论
宁夏贺兰山东麓产区‘赤霞珠’和‘马瑟兰’红葡萄酒的涩感强度及其酚类物质总量均呈现从北至南逐渐上升的趋势,同一子产区的‘马瑟兰’红葡萄酒感官特征表现更强。高聚缩合单宁占比及低聚缩合单宁含量对红葡萄酒的涩感强度具有较大贡献;非游离形式花色苷是各子产区红葡萄酒中花色苷的最主要呈色方式。此外,红葡萄酒中的花色苷衍生物含量及聚合花色苷的占比对酒体黄色色调(b*值)的影响最大。
综上所述,宁夏贺兰山东麓产区不同风土条件影响着酿酒葡萄果实的类黄酮代谢与酚类物质积累,从而造就其对应葡萄酒不同的酚类物质组成轮廓及感官特征,来自同一子产区的两个酒庄的葡萄酒也会因小风土差异而表现出不同的风格。然而,风土因子对不同酿酒品种葡萄的影响可能存在差异,‘马瑟兰’比‘赤霞珠’更易在湿度高、降水量大的风土条件下积累黄烷醇类物质。因此,把握好不同风土条件所带来的正向影响,对于宁夏贺兰山东麓葡萄酒产业的发展有着极为重要的生产实践意义。
[1]BONFANTE A, BRILLANTE L.Terroir analysis and its complexity[J].Oeno One,2022,56(2):375-388.
[2]BRANT L A C,DE SOUZA C R,DA MOTA R V,et al.Macro scale analysis of Syrah vineyards under winter growing cycles: Agronomical and ecophysiological responses[J].Sci Agricola,2021,78(6):e20200055.
[3]KARAPETSAS N, ALEXANDRIDIS T K, BILAS G, et al.Delineating natural terroir units in wine regions using geoinformatics[J].Agriculture-Basel,2023,13(3):629.
[4]LU H C,TIAN M B,HAN X,et al.Vineyard soil heterogeneity and harvest date affect volatolomics and sensory attributes of Cabernet Sauvignon wines on a meso-terroir scale[J].Food Res Int,2023,174(Part 1):113508.
[5]MANIA E,PETRELLA F,GIOVANNOZZI M,et al.Managing vineyard topography and seasonal variability to improve grape quality and vineyard sustainability[J].Agronomy-Basel,2021,11(6):1142.
[6]DULEY G.The impact of temperature on ′Pinot Noir′ berry and wine quality in a steeply sloping cool climate vineyard in South Australia[J].Vitis-Geilweilerhof,2021,60(4):169-178.
[7]VAN LEEUWEN C, BARBE J C, DARRIET P, et al.Recent advancements in understanding the terroir effect on aromas in grapes and wines[J].Oeno One,2020,54(4):985-1006.
[8]BILLET K, SALVADOR-BLANES S, DE BERNONVILLE T D, et al.Terroir influence on polyphenol metabolism from grape canes: a spatial metabolomic study at parcel scale[J].Molecules,2023,28(11):4555.
[9]DA SILVA J R M,BLANCO J,TERRÓN J M,et al.Micro-terroir,proceedings of the 7th Iberian Congress of Agricultural Engineering and Horticultural Sciences[C].Madrid:2014:739-744.
[10]LIKAR M,STRES B,RUSJAN D,et al.Grapevine leaf ionome is shaped by soil factors and plant age[J].Plant Soil Environ,2022,68(9):415-423.
[11]BRAMLEY R G V,OUZMAN J,TROUGHT M C T.Making sense of a sense of place:precision viticulture approaches to the analysis of terroir at different scales[J].Oeno One,2020,54(4):903-917.
[12]刘松涛,李茜,吕雯,等.中国葡萄酒产业现状及发展趋势——以宁夏贺兰山东麓产区为例[J].现代农业科技,2019(9):241-243.
[13]王银川,汪泽鹏,刘效义.宁夏贺兰山东麓气候条件及品种区划[J].宁夏科技,2002(1):36-47.
[14]崔萍,李甲贵,穆海彬,等.宁夏贺兰山东麓葡萄酒产业可持续发展建议[J].中国果树,2023(4):122-125.
[15]SONG X X, LING M Q, LI D M, et al.Volatile profiles and sensory characteristics of cabernet sauvignon dry red wines in the sub-regions of the eastern foothills of Ningxia Helan Mountain in China[J].Molecules,2022,27(24):8817.
[16]ZHAO B Y,ZHANG X K,LAN Y B,et al.Sub-regional variation and characteristics of Cabernet Sauvignon wines in the eastern foothills of the Helan mountain:a perspective from phenolics,visual properties and mouthfeel[J].Foods,2023,12(5):1081.
[17]AZUMA A, YAKUSHIJI H, KOSHITA Y, et al.Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J].Planta,2012,236(4):1067-1080.
[18]KENNEDY J A,HAYASAKA Y,VIDAL S,et al.Composition of grape skin proanthocyanidins at different stages of berry development[J].J Agr Food Chem,2001,49(11):5348-5355.
[19]STEFANOVIC D,NIKOLIC N,KOSTIC L,et al.Early leaf removal increases berry and wine phenolics in cabernet sauvignon grown in eastern serbia[J].Agronomy-Basel,2021,11(2):238.
[20]GAMBACORTA G,FACCIA M,NATRELLA G,et al.Early basal leaf removal at different sides of the canopy improves the quality of aglianico wine[J].Foods,2022,11(19):3140.
[21]卢素文,郑暄昂,王佳洋,等.葡萄类黄酮代谢研究进展[J].园艺学报,2021,48(12):2506-2524.
[22]MORI K,GOTO-YAMAMOTO N,KITAYAMA M,et al.Effect of high temperature on anthocyanin composition and transcription of flavonoid hydroxylase genes in′Pinot noir′grapes(Vitis vinifera)[J].J Hortic Sci Biotechnol,2007,82(2):199-206.
[23]SPAYD S E,TARARA J M,MEE D L,et al.Separation of sunlight and temperature effects on the composition of Vitis vinifera cv.Merlot berries[J].Am J Enol Viticult,2002,53(3):171-182.
[24]POUDEL P R,MOCHIOKA R,BEPPU K,et al.Influence of temperature on berry composition of interspecific hybrid wine grape ′Kadainou R-1′(Vitis ficifolia var.ganebu×V.vinifera′Muscat of Alexandria′)[J].J Jpn Soc Hortic Sci,2009,78(2):169-174.
[25]CASTELLARIN S D,PFEIFFER A,SIVILOTTI P,et al.Transcriptional regulation of anthocyanin biosynthesis in ripening fruits of grapevine under seasonal water deficit[J].Plant Cell Environ,2007,30(11):1381-1399.
[26]ZHANG X K,JEFFERY D W,LI D M,et al.Red wine coloration:A review of pigmented molecules,reactions,and applications[J].Compr Rev Food Sci Food S,2022,21(5):3834-3866.
[27]DELUC L G, QUILICI D R, DECENDIT A, et al.Water deficit alters differentially metabolic pathways affecting important flavor and quality traits in grape berries of Cabernet Sauvignon and Chardonnay[J].Bmc Genomics,2009,10:212.
[28]OJEDA H, ANDARY C, KRAEVA E, et al.Influence of pre- and postveraison water deficit on synthesis and concentration of skin phenolic compounds during berry growth of Vitis vinifera cv.Shiraz[J].Am J Enol Viticult,2002,53(4):261-267.
[29]MATEUS N,MARQUES S,GONÇALVES A C,et al.Proanthocyanidin composition of red Vitis vinifera varieties from the Douro valley during ripening:Influence of cultivation altitude[J].Am J Enol Viticult,2001,52(2):115-121.
[30]王宏,陈晓艺,张军翔.贺兰山东麓年轻红葡萄酒的CIELab颜色空间特征[J].食品科学,2014,35(9):20-23.
[31]李伟,席晓敏,李辉,等.贺兰山东麓赤霞珠红葡萄酒陈酿过程中颜色变化研究[J].食品科学技术学报,2020,38(2):41-47.
[32]黄小晶,李阿波,沈甜,等.贺兰山东麓红葡萄酒颜色差异分析[J].食品与发酵工业,2024,50(10):180-186.
[33]孙佳莹,刘晓晖,李超,等.贺兰山东麓产区“马瑟兰”葡萄的酿酒特性[J].北方园艺,2017(18):69-73.
[34]李辉,张静,李超,等.贺兰山东麓不同陈酿年份赤霞珠红葡萄酒中酚类物质对涩感质量的影响[J].食品与发酵工业,2018,44(10):38-44.
[35]LI S Y,HE F,ZHU B Q,et al.A systematic analysis strategy for accurate detection of anthocyanin pigments in red wines[J].Rapid Commun Mass Sp,2016,30(13):1619-1626.
[36]LI S Y, HE F, ZHU B Q, et al.Comparison of phenolic and chromatic characteristics of dry red wines made from native Chinese grape species and Vitis vinifera[J].Int J Food Prop,2017,20(9):2134-2146.
[37]ZHAO X, HE F, ZHANG X K, et al.Impact of three phenolic copigments on the stability and color evolution of five basic anthocyanins in model wine systems[J].Food Chem,2022,375:131670.
[38]ZHANG X K, LI S Y, ZHAO X, et al.HPLC-MS/MS-based targeted metabolomic method for profiling of malvidin derivatives in dry red wines[J].Food Res Int,2020,134:109226.
[39]张宁,赵旭,兰义宾,等.中国东亚种红葡萄酒的颜色特征及酚类组成研究[J].中国酿造,2022,41(5):34-41.
[40]BIMPILAS A, PANAGOPOULOU M, TSIMOGIANNIS D, et al.Anthocyanin copigmentation and color of wine:The effect of naturally obtained hydroxycinnamic acids as cofactors[J].Food Chem, 2016, 197(Part A):39-46.
[41]JEFFERY D W,MERCURIO M D,HERDERICH M J,et al.Rapid isolation of red wine polymeric polyphenols by solid-phase extraction[J].J Agr Food Chem,2008,56(8):2571-2580.
[42]QI M Y,HUANG Y C,SONG X X,et al.Artificial saliva precipitation index (ASPI): An efficient evaluation method of wine astringency[J].Food Chem,2023,413:135628.
[43]VAN LEEUWEN C, DESTRAC-IRVINE A.Modified grape composition under climate change conditions requires adaptations in the vineyard[J].Oeno One,2017,51(2):147-154.
[44]孟宪宸,崔彦志,李星宇,等.成熟期降水对碣石山产区‘马瑟兰’果实品质的影响[J].中外葡萄与葡萄酒,2023(3):24-31.
[45]ZHANG X K, LAN Y B, HUANG Y, et al.Targeted metabolomics of anthocyanin derivatives during prolonged wine aging: Evolution, color contribution and aging prediction[J].Food Chem,2021,339:127795.
[46]VARO M A,SERRATOSA M P,MARTÍN-GÓMEZ J,et al.Influence of fermentation time on the phenolic compounds, vitamin c, color and antioxidant activity in the winemaking process of blueberry(Vaccinium corymbosum)wine obtained by maceration[J].Molecules,2022,27(22):7744.
[47]BERRUETA L A,RASINES-PEREA Z,PRIETO-PEREA N,et al.Formation and evolution profiles of anthocyanin derivatives and tannins during fermentations and aging of red wines[J].Eur Food Res Technol,2020,246(1):149-165.
[48]王晓月,张珊珊,张欣珂,等.发酵前添加黄酮醇类辅色素对‘赤霞珠’红葡萄酒颜色品质及多酚组成的影响[J].食品科学,2020,41(18):188-195.
[49]TORRES N,MARTÍNEZ-LÜSCHER J,PORTE E,et al.Impacts of leaf removal and shoot thinning on cumulative daily light intensity and thermal time and their cascading effects of grapevine(Vitis vinifera L.)berry and wine chemistry in warm climates[J].Food Chem,2021,343:128447.
[50]李文超,孙盼,王振平.不同土壤条件对酿酒葡萄生理及果实品质的影响[J].果树学报,2012,29(5):837-842.
[51]校诺娅,张艳霞,苏旺春,等.宁夏贺兰山东麓‘马瑟兰’葡萄栽培技术[J].北方园艺,2020(8):160-163.
[52]MA W,GUO A Q,ZHANG Y L,et al.A review on astringency and bitterness perception of tannins in wine[J].Trends Food Sci Technol,2014,40(1):6-19.