氰化物为剧毒物质,可经呼吸道、消化道及皮肤等途径进入人体,中毒者轻则流涎、呕吐、腹泻,严重时可导致呼吸困难、全身抽搐、昏迷、甚至死亡[1-4]。目前,氰化物的定量分析方法主要可以分为以下几类:以GB 5009.36—2023《食品安全国家标准食品中氰化物的测定》为主的比色法及在其基础上进行改进与优化的各种比色检测方法[5]、色谱法[6-9]、电化学法[10-12]、光谱法等[13-18]。虽然检测方法更新迭代较快,且各有所长,但这些检测方法在适用性等方面参差不齐,仍具有一定优化提升空间。
白酒作为我国特有的传统酒种,具有独特的工艺和风格,以其优异的色、香、味、格受到广大饮用者的喜爱[19-21]。GB 2757—2012《食品安全国家标准蒸馏酒及其配制酒》规定了白酒中氰化物含量不得高于8.0 mg/L。研究表明,白酒中氰化物主要来源于高粱、酒醅、大曲等物料[22-25],这些固态物料的成分十分复杂,给氰化物的检测带来了较大的挑战。目前关于白酒酿造过程固态物料中氰化物含量检测的报道较少,陈双等[26]建立了一种QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)前处理技术并结合分光光度比色法测定酒醅中的氰化物,但该方法存在前处理成本较高,分光光度法测定氰化物对人员的要求较高等问题[27-29],不利于白酒酿造过程氰化物的快速监测。
为提升白酒酿造过程中对氰化物的精准监控能力,本研究建立了一种高粱、大曲、酒醅中氰化物的快检方法,该方法通过蒸馏能够有效提取样品中的氰化物,全自动流动注射测定技术能够在密闭系统中自动完成蒸馏收集液中氰化物的衍生以及吸光度值的快速测定。该方法的开发将为白酒生产企业提供一个快速、可靠的氰化物监测手段,有助于保障白酒质量和消费者健康,同时为食品行业发展和法规制定提供科学依据,增强公众对食品安全的信心。
1 材料与方法
1.1 材料与试剂
高粱、大曲、酒醅样品:取自贵州某酱香酒生产企业、四川某浓香酒生产企业。
氰化物标准品溶液(质量浓度为50 mg/L):中国计量科学研究院;氢氧化钠、乙酸锌、酒石酸、磷酸二氢钾、氯胺T、异烟酸、乙二胺四乙酸二钠(ethylene diaminete traacetic acid disodium salt,EDTA-2Na)、磷酸、硫酸等(分析纯):国药集团化学试剂有限公司;1,3-二甲基巴比妥酸(纯度≥98%):北京百灵威科技有限公司。
实验用水均为无氰超纯水:若存在少量氰化物,可通过煮沸方式去除,冷却后即得。
1.2 仪器与设备
FF-QHWL08型全自动流动注射分析仪(配有AS-90F自动进样器及15 mL玻璃进样管若干):北京吉天仪器有限公司;FA2004型千分之一电子天平:梅特勒-托利多仪器有限公司;VXMNFS型定速涡旋混合器:奥豪斯仪器有限公司;EH45C型数显控温加热板:莱伯泰科公司;SK8200LHC型超声波提取仪:上海科导超声仪器有限公司。
1.3 方法
1.3.1 标准溶液配制
氰化物标准使用溶液(1.0 mg/L):准确吸取2.00 mL氰化物标准溶液(50.00 mg/L),用氢氧化钠溶液(2.00 g/L)定容至100 mL。
系列标准工作溶液的配制:分别吸取氰化物标准使用溶液(1.00 mg/L)50 μL、100 μL、200 μL、500 μL、1 000 μL、2 000 μL,用1 g/L的氢氧化钠溶液定容至10 mL,得到质量浓度为5.00 μg/L、10.00 μg/L、20.00 μg/L、50.00 μg/L、100.00 μg/L、200.00 μg/L的氰化物系列标准工作溶液。
1.3.2 流动相溶液配制
蒸馏试剂:称取13.2g酒石酸,用超纯水定容至1000 mL,于4 ℃冰箱中保存。
缓冲溶液:称取97.0 g磷酸二氢钾,用超纯水定容至1 000 mL,有效期1个月。
氯胺T溶液:称取2.0 g氯胺T,超纯水定容于500 mL棕色玻璃瓶中,临用现配,使用前必须脱气。
异烟酸/巴比妥酸显色剂:称取12.0g氢氧化钠,加500mL超纯水溶解,加入待完全溶解后,称取16.8 g 1,3-二甲基巴比妥酸加入其中,待完全溶解后,再加入13.6 g异烟酸,用超纯水定容至1 000 mL,储存在棕色玻璃瓶中,有效期1个月,使用前必须脱气。
载流溶液:称取1.0 g氢氧化钠,超纯水定容至1 000 mL,使用时需先脱气。
1.3.3 样品前处理优化
不同蒸馏体系的选择:分别考察乙酸锌-酒石酸(2g-2g)、乙酸锌-磷酸(2 g-5 mL)、乙酸锌-硫酸(2 g-5 mL)、EDTA-2Na-酒石酸(2 g-2 g)、EDTA-2Na-磷酸(2 g-5 mL)、EDTA-2Na-硫酸(2 g-5 mL)6种蒸馏提取体系对高粱、大曲、酒醅中氰化物提取效果的影响。
磷酸添加量的优化:在高粱、酒醅、大曲前处理过程中分别添加1.00 mL、3.00 mL、5.00 mL、7.00 mL、9.00 mL磷酸,考察不同磷酸添加量对氰化物提取效果的影响。
EDTA-2Na添加量的优化:在高粱、酒醅、大曲前处理过程中分别添加0.50 g、1.00 g、2.00 g、4.00 g、8.00 g EDTA-2Na,考察不同EDTA-2Na添加量对氰化物提取效果的影响。
优化后样品前处理步骤:准确称取5.00 g样品(高粱、大曲样品需-20 ℃冷冻30 min后粉碎,酒醅样品无需粉碎)于50 mL塑料离心管中,加入2.00 g EDTA-2Na和数颗沸石后立即加入25 mL超纯水,盖紧瓶盖,涡旋振荡5 min,超声提取20 min,用200 mL超纯水将样品全部转移至蒸馏烧瓶中,加入5 mL磷酸摇匀。蒸馏装置[30](参考HJ 484—2009《水质氰化物的测定容量法和分光光度法》中的氰化物蒸馏装置图)馏出下端插入装有20.00 mL 20.00 g/L氢氧化钠溶液的200 mL容量瓶中,待馏出液达到190~195 mL时停止蒸馏,用超纯水定容至200 mL,摇匀移取10 mL馏出液待上机分析。
1.3.4 分析检测
全自动流动注射分析仪参数设置:蠕动泵泵速20 r/min、到达阀时间300 s、注射时间80 s、样品周期220 s、进样时间140 s、清洗时间30 s、进样针清洗时间10 s、加热模块1温度118 ℃、加热模块2温度85 ℃、前端采集增益100 K。
样品蒸馏液中氰化物含量检测:分别取10 mL氰化物系列标准工作溶液和样品蒸馏液于进样管中,样品中氰化物在全自动流动注射分析仪密闭系统中自动完成衍生与吸光度值的测定,以氰化物质量浓度为横坐标,氰化物衍生物的吸光度值峰面积为纵坐标,绘制标准曲线,蒸馏提取液中氰化物检测结果则通过仪器检测的吸光度值峰面积,带入标准曲线回归方程获得。
1.3.5 计算公式
高粱、大曲、酒醅中氰化物含量(以CN-计)计算公式:
式中:W为固态样品中氰化物含量,μg/kg;C为蒸馏提取液中氰化物含量,μg/L;M为称取固态样品的质量,g;200为蒸馏提取液中氰化物的稀释倍数。
1.3.6 精密度及重复性实验
分别选取高粱、大曲、酒醅样品蒸馏提取液作为精密度及重复性实验的供试样品,其中精密度实验方法为将各样品提取液分别重复进样6次,根据检测结果计算相对标准偏差(relative standard deviation,RSD);重复性实验方法为将选取的高粱、大曲、酒醅样品在不同时间段按照1.3.3的方法分别重复处理6次,共开展了2次独立重复实验,并将处理后的样品进行检测,最终根据样品中氰化物平均结果计算得到重复性实验RSD值。
1.3.7 稳定性实验
选取2.4.2中同一批高粱、大曲、酒醅样品按照1.3.3的方法处理,在1.3.4的方法下分别于0、0.5 h、1.0 h、1.5 h、2.0 h、3.0 h进样分析,根据检测结果计算RSD值。
1.3.8 加标回收率实验
分别选取高粱、大曲、酒醅样品作为回收率实验供试样品,样品经粉碎称量后分别加低、中、高浓度的氰化物标准溶液,按照1.3.3的方法进行样品前处理,计算结果及回收率。
1.3.9 数据处理
使用Excel软件对不同蒸馏体系实验组、不同磷酸添加实验组、不同EDTA-2Na添加实验组的氰化物检测数据进行统计、处理与作图分析。
2 结果与分析
2.1 不同蒸馏体系的选择
2.1.1 不同蒸馏体系对高粱、大曲、酒醅样品中氰化物提取效果的影响
由图1可知,不同蒸馏体系对高粱、大曲、酒醅中氰化物分析结果影响较大,使用EDTA-2Na的蒸馏体系检测同一高粱、大曲、酒醅样品氰化物含量比使用乙酸锌的蒸馏体系所检测氰化物含量高2~4倍,其原因可能是氰化物可与样品溶解出的金属离子(如镍、铁、铜等)形成结合态物质,阻碍了氰化物与氢根离子形成氢氰酸这一反应过程,而EDTA-2Na溶解于水中可电离出EDTA离子和Na离子,EDTA离子与金属离子结合能力强于氰化物与金属离子的结合能力[31],致使氰化物在酸性环境中能够更多的形成挥发性极强的氢氰酸,蒸馏出的氢氰酸被氢氧化钠溶液吸收后进行分析检测。同时还发现使用EDTA-2Na的蒸馏体系检测氰化物的稳定性要优于乙酸锌蒸馏体系,因此选用EDTA-2Na作为样品前处理的添加物质。分别使用EDTA-2Na-酒石酸、EDTA-2Na-磷酸、EDTA-2Na-硫酸蒸馏体系对同一高粱样品中氰化物进行提取测定,结果分别为(378.70±6.02)μg/kg、(379.94±3.74)μg/kg、(350.40±3.11)μg/kg;对同一大曲样品中氰化物进行提取测定,结果分别为(472.46±14.81)μg/kg、(474.73±10.38)μg/kg、(477.88±12.25)μg/kg;对同一酒醅样品中氰化物进行提取测定,结果分别为(89.77±5.98)μg/kg、(92.53±3.84)μg/kg、(86.50±2.84)μg/kg,可见不同的酸对高粱、大曲、酒醅中氰化物检测影响较小。使用酒石酸作为氢离子供体时,在蒸馏过程中很容易形成大量泡沫,会溢出至馏出液收集瓶中导致馏出液污染,只能通过温度控制进行调节,会大大增加蒸馏提取的时长,检测效率较低;使用硫酸作为氢离子供体时,因硫酸遇水会释放出大量热量,会促使氢氰酸快速挥发,对蒸馏装置搭建效率要求较高,不利于方法的实际应用;选用磷酸作为氢离子供体可解决泡沫溢出和氢氰酸快速挥发等问题,且磷酸是一种中强酸,具有不易挥发、不易分解等优点,适用于样品中氰化物的蒸馏提取。因此,选用EDTA-2Na-磷酸这一蒸馏体系进行样品中氰化物的蒸馏提取。

图1 不同蒸馏体系对高粱、大曲、酒醅样品中氰化物含量的影响
Fig.1 Effect of different distillation systems on cyanide contents in sorghum, Daqu and fermented grains
2.1.2 不同磷酸添加量对高粱、大曲、酒醅样品中氰化物提取效果的影响
由图2可知,不同磷酸添加量对高粱、大曲中氰化物检测结果影响较大,磷酸添加量为1~5 mL时,随着磷酸添加量的增多氰化物含量呈现增加趋势,其中高粱样品中氰化物平均含量由171.81 μg/kg增至379.94 μg/kg,大曲样品中氰化物平均含量由202.18 μg/kg增至474.13 μg/kg,增幅分别为121.14%、134.51%;在磷酸添加量>5.00 mL后,氰化物含量趋于稳定。酒醅中氰化物受磷酸添加量影响较小,可能是由于所选取的发酵酒醅中存在大量由微生物代谢产生的有机酸为氰化物转化为氢氰酸提供大量氢离子。考虑到不同酒醅样品中有机酸含量参差不齐,在不影响检测结果准确性的前提下,为增加方法的通用性和统一性,选择磷酸添加量为5.00 mL。
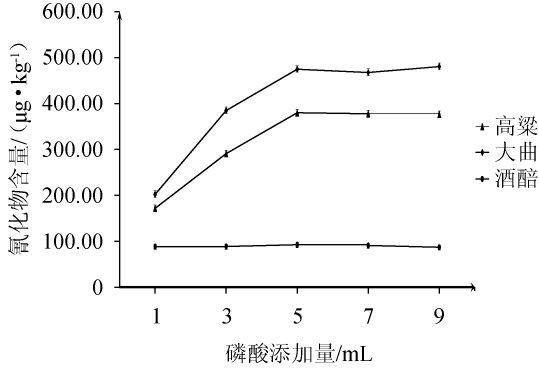
图2 不同磷酸添加量对高粱、大曲、酒醅中氰化物含量的影响
Fig.2 Effect of different phosphoric acid addition on cyanide contents in sorghum, daqu, and fermented grains
2.1.3 EDTA-2Na添加量对高粱、大曲、酒醅样品中氰化物提取效果的影响
由图3可知,高粱、大曲、酒醅中氰化物含量随着EDTA-2Na添加量的增加,氰化物含量呈先增加后稳定的趋势。当EDTA-2Na添加量为0.50~2.00 g时,高粱样品中氰化物含量由301.67 μg/kg增至379.94 μg/kg,大曲样品中氰化物含量由379.17 μg/kg增至474.73 μg/kg,酒醅样品中氰化物含量由48.15 μg/kg增至92.53 μg/kg,增幅分别为25.95%、25.20%、2.17%;可能是因为样品中溶解出的可与氰化物结合的金属离子数量有限,当EDTA-2Na添加量达到2.00 g时就可以将这些金属离子鳌合完毕,因此在前处理过程中选择EDTA-2Na添加量为2.00 g。
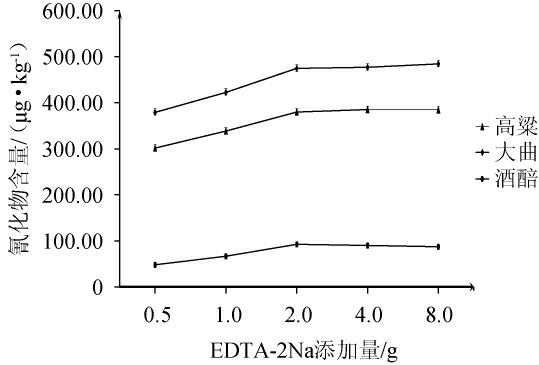
图3 不同EDTA-2Na添加量对高粱、大曲、酒醅中氰化物含量的影响
Fig.3 Effect of different EDTA-2Na addition on cyanide contents in sorghum, Daqu and fermented grains
2.2 方法学验证
2.2.1 方法线性范围、检出限和定量限
将1.3.1系列标准溶液按照1.3.4的条件进行流动注射分析检测,得到氰化物的标准曲线图谱。以氰化物质量浓度(X)为横坐标,相应的吸光度值峰面积(Y)为纵坐标绘制标准曲线,得到氰化物的标准曲线回归方程为Y=0.001 5X-0.002 9,R2=0.999 6,氰化物在5~200 μg/L范围内线性良好。将高粱、大曲、酒醅馏出液分别进行逐级稀释后进样分析,得到本方法的检出限(limit of detection,LOD)为8.10 μg/kg,定量限(limit of quantitation,LOQ)为25.00 μg/kg。
2.2.2 方法精密度及重复性验证
精密度与重复性试验结果见表1。由表1可知,方法的精密度及重复性试验的RSD值均<10%,符合GB 5009.36—2023《食品安全国家标准食品中氰化物的测定》的要求,表明本方法能较好的满足高粱等固体样品中氰化物含量的检测分析工作。
表1 精密度及重复性试验结果
Table 1 Results of precision and repeatability tests

样品 氰化物含量/(μg·kg-1)平均检测结果/(μg·kg-1)RSD/%精密度 重复性388.28 369.50 368.95 372.64 384.83 376.66 381.81 381.10 381.61 380.13 398.61 382.42 478.51 464.32 461.32 466.58 462.22 478.71 488.62 468.27 469.16 472.69 465.04 471.52 94.36 97.02 98.05 99.21 96.28 98.46 91.31 88.29 87.74 85.74 87.99 88.01 376.81 5.13高粱1.96 384.28 4.81 468.61 3.71大曲0.84 472.55 4.99 97.23 5.34酒醅9.76 88.18 6.32
2.2.3 方法稳定性考察
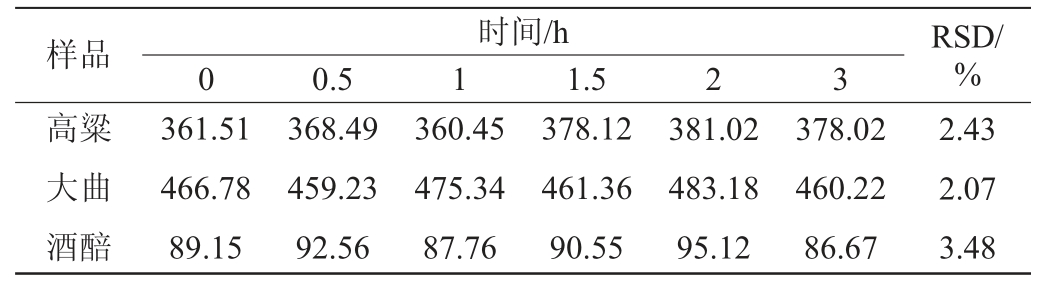
稳定性试验结果见表2。
表2 稳定性试验结果
Table 2 Results of stability tests
样品 RSD/%时间/h 0 0.5 1 1.5 2 3高粱大曲酒醅361.51 466.78 89.15 368.49 459.23 92.56 360.45 475.34 87.76 378.12 461.36 90.55 381.02 483.18 95.12 378.02 460.22 86.67 2.43 2.07 3.48
由表2可知,稳定性试验结果的RSD为2.07%~3.48%,说明该方法稳定性好。
2.2.4 方法加标回收率考察
加标回收试验结果见表3。
表3 加标回收率试验结果
Table 3 Results of standard recovery rates tests
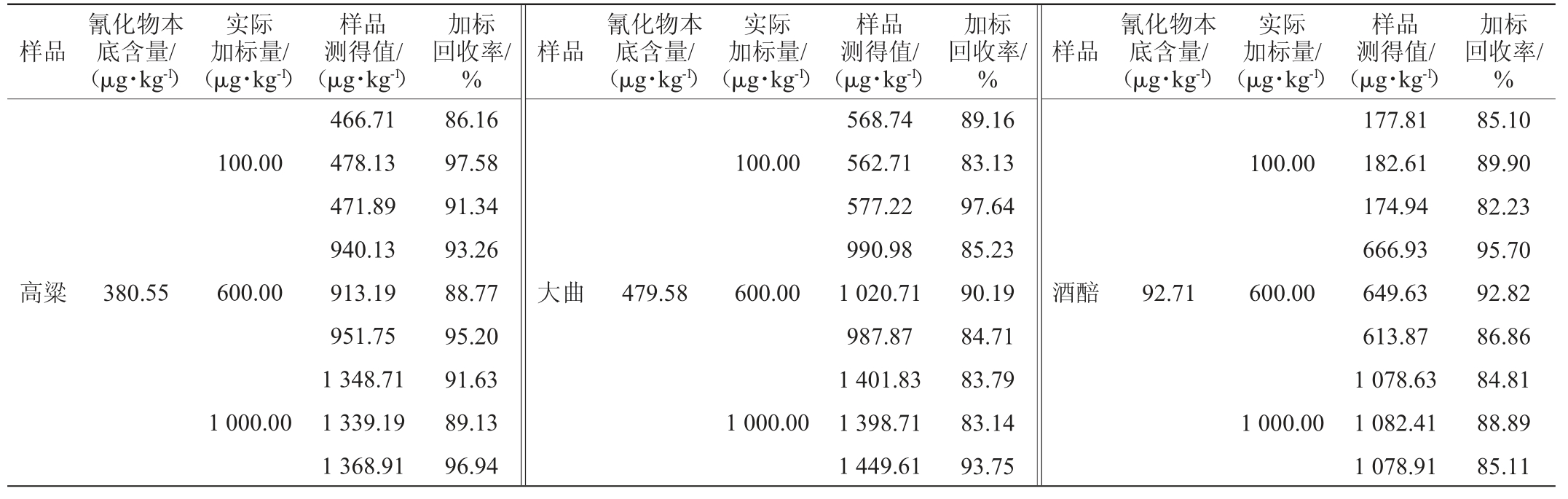
样品氰化物本底含量/(μg·kg-1)实际加标量/(μg·kg-1)样品测得值/(μg·kg-1)100.00高粱 380.55 600.00 1 000.00 466.71 478.13 471.89 940.13 913.19 951.75 1 348.71 1 339.19 1 368.91加标回收率/%86.16 97.58 91.34 93.26 88.77 95.20 91.63 89.13 96.94样品氰化物本底含量/(μg·kg-1)实际加标量/(μg·kg-1)样品测得值/(μg·kg-1)100.00大曲 479.58 600.00 1 000.00 568.74 562.71 577.22 990.98 1 020.71 987.87 1 401.83 1 398.71 1 449.61加标回收率/%89.16 83.13 97.64 85.23 90.19 84.71 83.79 83.14 93.75样品氰化物本底含量/(μg·kg-1)实际加标量/(μg·kg-1)样品测得值/(μg·kg-1)100.00酒醅 92.71 600.00 1 000.00 177.81 182.61 174.94 666.93 649.63 613.87 1 078.63 1 082.41 1 078.91加标回收率/%85.10 89.90 82.23 95.70 92.82 86.86 84.81 88.89 85.11
由表3可知,方法的加标回收率均在82.23%~97.64%范围内,满足方法学考察要求,准确性良好。
2.3 实际样品测定
分别选取不同产地高粱样品、高温大曲、浓香酒醅、酱香酒醅各3批次样品,同时采用GB 5009.36—2023《食品安全国家标准食品中氰化物的测定》第二法和本方法进行氰化物含量测定,结果见表4。由表4可知,与国标方法相比,高粱、大曲、酒醅中氰化物含量检测偏差均<10%。不同产地高粱中氰化物含量存在较大差异,白酒生产企业可选取低氰原料进行酿造,进而降低白酒中氰化物含量。高温大曲中氰化物含量也不尽相同,说明在制曲过程中可通过寻找工艺过程关键控制点,优化工艺参数,可实现大曲中氰化物减控的目的。浓香酒醅中氰化物含量普遍高于酱香酒醅,这也解释了浓香酒中氰化物含量高于酱香酒这一现象。
表4 高粱、大曲、酒醅中氰化物含量检测结果
Table 4 Detection results of cyanide contents in sorghum, Daqu and fermented grains
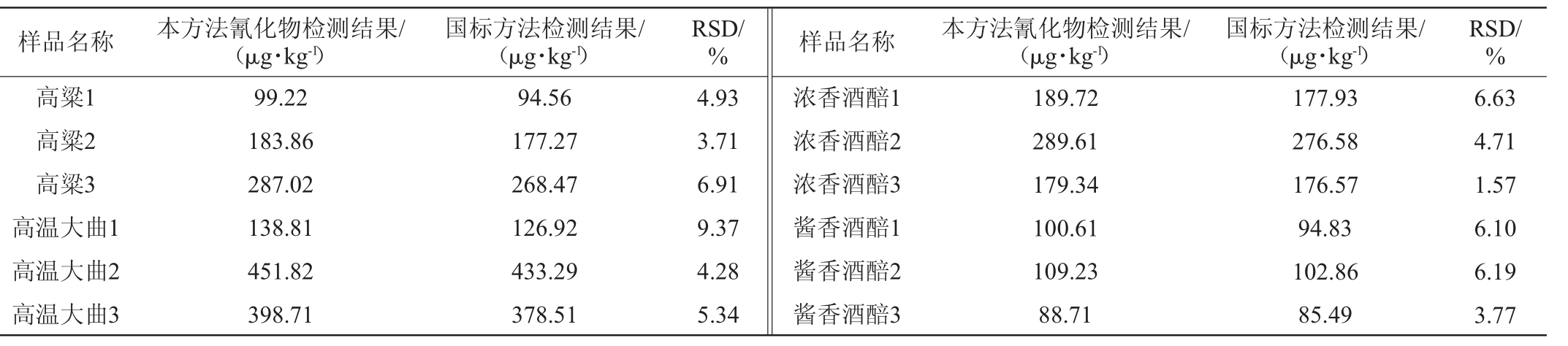
样品名称 本方法氰化物检测结果/(μg·kg-1)国标方法检测结果/(μg·kg-1)RSD/% 样品名称 本方法氰化物检测结果/(μg·kg-1)国标方法检测结果/(μg·kg-1)RSD/%高粱1高粱2高粱3高温大曲1高温大曲2高温大曲3 99.22 183.86 287.02 138.81 451.82 398.71 94.56 177.27 268.47 126.92 433.29 378.51 4.93 3.71 6.91 9.37 4.28 5.34浓香酒醅1浓香酒醅2浓香酒醅3酱香酒醅1酱香酒醅2酱香酒醅3 189.72 289.61 179.34 100.61 109.23 88.71 177.93 276.58 176.57 94.83 102.86 85.49 6.63 4.71 1.57 6.10 6.19 3.77
3 结论
本研究运用EDTA与金属离子的鳌合能力强于氰化物与金属离子的鳌和能力这一原理,并结合流动注射快检分析技术,开发了一种创新性的白酒酿造过程中高粱、大曲以及酒醅中氰化物含量检测方法。该方法通过优选EDTA-2Na—磷酸这一蒸馏体系能够有效提取高粱、大曲和酒醅中的氰化物,极大程度避免了样品基质干扰,同时馏出液在流动注射全密闭系统中自动完成氰化物含量分析,最大限度减少了分析过程氰化物的损失,方法的精密度、重复性及稳定性实验结果的RSD值均<10%,检测结果准确可靠;检出限(LOD)为8.10 μg/kg,定量限(LOQ)为25.00 μg/kg;加标回收率均在82.23%~97.64%范围内;适用于白酒酿造企业对高粱、大曲、酒醅样品中氰化物含量进行精准监控。
[1]ODOEMELAM C S, PERCIVAL B, AHMAD Z, et al.Characterization of yellow root cassava and food products: Investigation of cyanide and β-carotene concentrations[J].BMC Res Notes,2020,13:1-7.
[2]KIRMAN C R, BELKNAP A M, WEBSTER A F, et al.Biomonitoring equivalents for cyanide[J].Regul Toxicol Pharm,2018,97:71-81.
[3]LOGUE B A,HINKENS D M,BASKIN S I,et al.The analysis of cyanide and its break down products in biological samples[J].Crit Rev Anal Chem,2010,40(2):122-147.
[4]COOPERCE,BROWN G C.The inhibition of mitochondrial cytochrome oxidase by the gases carbon monoxide,nitric oxide,hydrogen cyanide and hydrogen sulfide:Chemical mechanism and physiological significance[J].J Bioenerg Biomembr,2008,40(5):533-539.
[5]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.36—2023 食品安全国家标准食品中氰化物的测定[S].北京:中国标准出版社,2023.
[6]李晓森,黄桂兰,吴姬娜,等.固相萃取-固相辅助衍生-气相色谱-串联质谱对水样和尿液中氰化的分析检测[J].分析化学,2023,51(4):611-622.
[7]王潇,陈小丽,王辉,等.柱前衍生化顶空-气相色谱-质谱法测定坚果和梅类食品中氰化物的含量[J].理化检验-化学分册,2023,59(6):656-661.
[8]MATEUS F H, LEPERA J S, LANCHOTE V L.Determination of acetonitrile and cyanide in rat blood:application to an experimental study[J].J Anal Toxicol,2005,29(2):105-109.
[9]TRACQUI A, RAUL J S, GÉRAUT A, et al.Determination of blood cyanide by HPLC-MS[J].J Anal Toxicol,2002,26(3):144-148.
[10]姜磊,朱世亮.微量扩散-离子色谱/脉冲安培电化学检测法快速分析工业废水中的氰化物[J].分析仪器,2021(1):152-156.
[11]ABBASPOUR A, ASADI M, GHAFFARINEJAD A, et al.A selective modified carbon paste electrode for determination of cyanide using tetra-3,4-pyridinoporphyrazinatocobalt(II)[J].Talanta,2005,66(4):931.
[12]吴敦虎,孙其志,张英.示差脉冲伏安法测定水及酒中的氰化物[J].分析化学,1990,18(6):557-559.
[13]叶春常,陈桂云,黎颖欣,等.分光光度法测定配制酒中氰化物的不确定度评定[J].酿酒科技,2023(3):125-130.
[14]董伟博.流动注射-异烟酸-巴比妥酸法分光光度法测定氰化物的测量不确定度评定[J].食品安全导刊,2023(7):89-92.
[15]卜全民,于爽,张苗苗.表面增强拉曼光谱快速检测食品基质中毒物[J].刑事技术,2021,46(1):52-57.
[16]武建军,池新民.酒中和空气中氰化物的荧光测定[J].分析化学,1989(3):290.
[17]汪明礼,许真树.水中氰化物的间接石墨炉原子吸收法测定仪器[J].仪表与分析监测,2005,2(2):34.
[18]LV J G,ZHANG Z J, LI J D, et al.A micro-chemiluminescence determination of cyanide in whole blood[J].Forensic Sci Int,2005,148(1):15.
[19]徐美霞,高飞,姚桂红,等.顶空固相微萃取-气相色谱串联质谱分析不同香型白酒的挥发性成分[J].质量安全与检验检测,2023,33(2):17-23,52.
[20]李根,张军翔.固态法蒸馏酒与液态法蒸馏酒产品风味研究进展——以中国白酒与葡萄白兰地为例[J].中国酿造,2020,39(5):13-16.
[21]孙宝国,黄明泉,王娟.白酒风味化学与健康功效研究进展[J].中国食品学报,2021,21(5):1-13.
[22]周韩玲,安明哲,赵东,等.高粱中蜀黍氰苷与浓香型白酒中氰化物及氨基甲酸乙酯关系的研究[J].中国酿造,2022,41(10):25-29.
[23]崔战友,钟其顶,李国辉,等.酒醅中氰化物的测定方法研究[J].酿酒科技,2015(5):101-103,106.
[24]朱晓春,陈双,徐岩.浓香型白酒酿造过程中不同形态氰化物的含量分布规律[J].食品与发酵工业,2022,48(24):239-244,251.
[25]许萍,王春华,刘晓丹,等.分光光度法测定不同食品基质中氰化物的方法验证[J].现代食品,2021(15):141-143.
[26]陈双,徐岩,朱晓春.一种白酒酿造酒醅中氰化物含量的快速检测方法:CN113866109B[P].2022-10-11.
[27]肖克.基于分光光度法的氰化物在线监测仪校准方法[J].化学分析计量,2021,30(8):67-70.
[28]都芸,王开宇,左惠君,等.分光光度法测定白酒中氰化物含量的不确定度评定[J].食品与发酵工业,2020,46(8):273-279.
[29]MENG L,LIU X,WANG B,et al.Simultaneous derivatization and extraction of free cyanide in biological samples with home-made hollow fiber-protected headspace liquid-phase micro extraction followed by capillary electrophoresis with UV detection[J].J Chromatrogr B,2009,877(29):3645-3651.
[30]环境保护部.HJ 484—2009 水质氰化物的测定容量法和分光光度法[S].北京:中国环境科学出版社,2009
[31]于高磊.氰化物检测中的样品前处理方法分析[J].科技资讯,2015,13(19):138-139.