黄精(Polygonatum)是百合科(Liliaceae)黄精属(Polygonatum)多年生草本植物[1],研究表明,黄精最主要的活性成分为多糖,还含有皂苷类、黄酮类、生物碱类等化学成分,且黄精多糖具有抗肿瘤、抗病毒、延缓衰老、降血糖、免疫调节以及抗氧化等作用[2-10],其中,抗氧化活性是黄精多糖生物学特性的重要指标[11]。黄精作为药食妆同源药材,除了具有抗肿瘤、延缓衰老等的生物学功能外,还有吸湿与保湿的功效,可用于添加至化妆品、护肤品等。刘红辉等[12]测定紫球藻多糖的吸湿保湿性表明,在相对湿度(relative humidity,RH)为70%的条件下,吸湿率大小为甘油>紫球藻多糖>壳聚糖>透明质酸;孙菁雯[13]对海藻多糖不同截留分子质量片段进行吸湿保湿活性研究发现,海藻多糖截留分子质量<3 000 Da片段的吸湿率最好;安星亮等[14]在干燥硅胶环境中研究了银耳纯化多糖的保湿性,在48 h时的保湿率为42.15%。目前对黄精多糖不同截留分子质量片段进行吸湿保湿性的研究较少,而黄精多糖的提取工艺优化与生物活性仍是当前研究的前提与关键。
植物多糖的提取中较常用且最简单的提取方法就是普通水提法,它的操作简单、应用范围广,但同时存在一些缺点,包括提取时间比较长、提取率低,需要添加较多的提取溶剂,且长时间高温处理会破坏多糖的结构等。其他辅助提取法包括超声辅助提取法、闪式提取法、酶辅助提取法、超声波辅助酶法、超声-微波提取法和微波辅助提取法等[15-17]。与普通水提法相比,辅助提取法均能显著提高多糖提取率[18]。黄精多糖的提取方法包括普通水提法及其他辅助提取法,不同的提取方法对多糖提取、结构、单糖组成及生物活性均存在显著差异[19]。目前,对于黄精多糖的研究主要集中于辅助提取法。其中酶辅助提取法则能有效分解细胞中的蛋白,使浸提过程更加温和,提取速度加快,环境友好,提取效率高等特点[20-21]。
本研究采用酶辅助法提取黄精多糖。采用单因素、正交试验设计优化多糖提取工艺,通过透析获得不同分子质量的多糖片段,对比不同多糖片段的吸湿保湿性,并研究了最佳保湿片段的抗氧化性及结构表征,旨在为黄精多糖的深加工提供参考依据和数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜黄精:由陇东学院提供(甘肃,庆阳)。取若干新鲜黄精根茎,去除根须和表面杂质,洗净,沥干表面大部分水分,切片,置于75℃干燥箱中干燥至质量恒定后用于本试验。
1.1.2 化学试剂
HybloomTM低分子透明质酸钠(HA-TLM20-40,分子质量10 kDa~10 MDa)、熙敏修TM超活透明质酸(分子质量≤5 000 Da):华熙生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS):上海阿拉丁生化科技股份有限公司;复合酶(木瓜蛋白酶∶纤维素酶∶半纤维素酶=5∶4∶3,木瓜蛋白酶(酶活力≥1 200 000 U/g)、半纤维素酶(酶活力≥100 000 U/g)、纤维素酶(酶活力≥30 000 U/g))、甘油、碳酸钾、氯化亚铜、无水硫酸钠、葡萄糖、苯酚、浓硫酸、抗坏血酸(vitamin C,VC)、无水乙醇、盐酸、硫酸亚铁、水杨酸、过氧化氢:甘肃艾尔维科学仪器有限公司。以上试剂均为分析纯。
1.2 仪器与设备
FA-2104电子天平:上海良单仪器仪表有限公司;SYG-2-4电热恒温水浴锅:北京科伟永兴仪器有限公司;SCIENTZ-12N冷冻干燥机:宁波新芝生物科技股份有限公司;JR52S-U打浆机:苏泊尔智火电器有限公司;N-1100旋转蒸发仪:上海爱朗仪器股份有限公司;TWCL-B17型磁力调温搅拌器:河南爱博特科技发展有限公司;TDL-5A台式离心机:上海安亭科学仪器厂;HR-500D高速剪切均质乳化机:上海闯博生物科技有限公司;752N紫外可见分光光度计:上海仪电分析仪器有限公司;透析袋(截留分子质量分别为500 Da、3500 Da、8 000 Da):甘肃艾尔维科学仪器有限公司。
1.3 方法
1.3.1 酶辅助法提取黄精多工艺
准确称取干黄精片5 g于不同的烧杯中,加一定体积蒸馏水作为提取溶剂,在打浆机打浆5 min后取出,以10 000 r/min高速剪切5 min后加入一定量的复合酶(木瓜蛋白酶∶纤维素酶∶半纤维素酶=5∶4∶3),在相应pH值、酶解温度条件下浸提一定时间,沸水浴灭酶10 min,冷却至4 ℃,5 000 r/min离心10 min得上清液,将上清液浓缩至20 mL体积,得到黄精多糖提取液。将黄精多糖提取液加入4倍体积无水乙醇,4 ℃静置过夜12 h,8 000 r/min离心10 min,收集沉淀,并加入适量蒸馏水溶解。之后加入1/3体积的Sevage试剂(氯仿与正丁醇体积比为4∶1),充分振摇25 min,4 ℃、8 000 r/min离心10 min,收集上清液,重复操作3~4次,至多糖相与下层氯仿-正丁醇相中间无明显蛋白质为止。将脱蛋白后的溶液装入截留分子质量3 500 Da的透析袋中透析2 d,收集多糖溶液并冷冻干燥得到黄精多糖。
1.3.2 酶辅助法提取黄精多糖条件优化
(1)酶辅助法提取黄精多糖条件优化单因素试验
按照1.3.1的方法提取黄精多糖,以黄精多糖得率为评价指标,分别考察复合酶添加量(1%、2%、3%、4%、5%、6%、7%)、酶解温度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃)、酶解pH(4.5、5.0、5.5、6.0、6.5)、酶解时间(30 min、60 min、90 min、120 min、150 min)、料液比(1∶15、1∶20、1∶25、1∶30、1∶35(g∶mL))对酶辅助法提取黄精多糖得率的影响。
(2)酶辅助法提取黄精多糖条件优化正交试验
在单因素试验的基础上,选择对黄精多糖得率影响较大的4个因素复合酶添加量(A)、酶解温度(B)、酶解时间(C)、料液比(D),每个因素选择3个水平,设计4因素3水平L9(34)正交试验对酶辅助法提取黄精多糖条件进行优化,正交试验因素与水平见表1。
表1 酶辅助法提取黄精多糖条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for extraction conditions optimization of Polygonatum sibiricum polysaccharide by enzyme assisted method
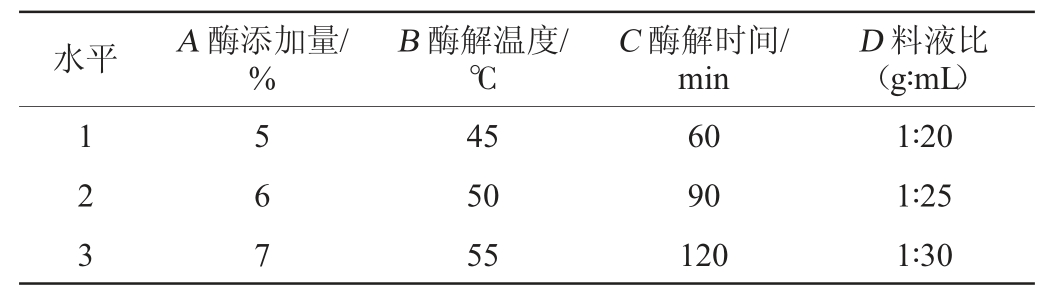
水平 A 酶添加量/%B 酶解温度/℃C 酶解时间/min D 料液比(g∶mL)1 2 3 5 6 7 45 50 55 60 90 120 1∶20 1∶25 1∶30
1.3.3 黄精多糖得率的测定方法
采用苯酚-硫酸法[22-23]测定多糖含量,得到葡萄糖含量标准曲线回归方程:y=0.007 6x+0.055 5,相关系数R2=0.999 8。按下式计算黄精多糖得率:
式中:W为黄精多糖得率,%;M1为浓缩前上清液中多糖含量,g;M2为原料质量,g。
1.3.4 黄精多糖中不同分子质量片段的吸湿保湿性分析
将黄精多糖溶液依次放入截留分子质量分别为8 kDa、3.5 kDa和500 Da的透析袋中透析72 h,获得不同分子质量的多糖片段。根据参考文献[24-26]的方法,在RH为43%、68%、93%的条件下,分别测定样品在3 h、6 h、12 h、24 h、48 h、96 h时的吸湿率与保湿率。
1.3.5 最佳保湿片段的抗氧化活性分析
按照参考文献[27-29]的方法并稍作修改,分别配制质量浓度为1.0 mg/mL、2.0 mg/mL、3.0 mg/mL、4.0 mg/mL、5.0 mg/mL、6.0 mg/mL的黄精多糖溶液,以VC作为阳性对照,对黄精多糖最佳保湿片段的DPPH自由基(DPPH·)、ABTS自由基(ABTS+·)、羟基自由基(·OH)清除率进行分析。
1.3.6 最佳保湿片段的结构表征分析
根据参考文献[30]的方法,称一定量充分干燥的黄精多糖样品放入离子溅射仪中进行喷金,使其具有导电性,并在扫描电镜(scanning electron microscope,SEM)下分析。采用KBr压片法对多糖进行红外光谱分析[31]。
1.3.7 数据处理与统计分析
试验数据采用Microsoft Excel 2016进行处理,试验图形采用Origin8.0进行绘制,使用正交试验设计助手进行正交试验与方差分析,所有试验重复3次。
2 结果与分析
2.1 酶辅助提取法提取黄精多糖条件优化
2.1.1 单因素试验
由图1A可知,在料液比为1∶20(g∶mL),酶解时间为90 min,酶解温度50 ℃,pH值为5条件下,当复合酶添加量较低时,黄精多糖得率随复合酶添加量的增加而升高;当复合酶添加量为6%时,黄精多糖得率最高为21.31%;再增加复合酶的添加量,过量的复合酶降解多糖,并起到竞争性抑制作用,导致酶解效率不高,黄精多糖得率降低;因此选择复合酶添加量为6%进行后续试验。由图1B可知,在料液比1∶20(g∶mL),酶解时间为90 min,pH值为5,复合酶添加量6%条件下,当酶解温度较低时,分子运动弱,黄精多糖得率较低;当酶解温度升高至50 ℃时,黄精多糖得率最高为22%;而持续提高酶解温度时,会超过最适酶解温度范围,黄精多糖得率下降;因此选择酶解温度50 ℃进行后续试验。由图1C可知,在料液比1∶20(g∶mL),酶解温度50 ℃,酶解时间90 min,复合酶添加量6%条件下,随着酶解pH值的升高,黄精多糖得率先增加后快速下降,可知黄精多糖的提取更适合于偏酸性条件;当酶解pH值为5.0时,黄精多糖得率最高为21.07%;因此选择酶解pH值为5.0进行后续试验。由图1D可知,在料液比1∶20(g∶mL),酶解温度50 ℃,酶解pH值为5,复合酶添加量6%条件下,随着酶解时间的延长,黄精多糖得率先升高后降低;酶解时间为90 min时,黄精多糖得率最高为22.2%;因此选择酶解时间90 min进行后续试验。由图1E可知,在酶解温度50 ℃,酶解时间为90 min,pH值为5,复合酶添加量6%条件下,随着料液比的变化,黄精多糖得率先升高后降低;料液比为1∶25(g∶mL)时,黄精多糖得率最高为24.06%;因此选择料液比为1∶25(g∶mL)进行后续试验。

图1 复合酶添加量(A)、酶解温度(B)、酶解pH(C)、酶解时间(D)及料液比(E)对黄精多糖得率的影响
Fig.1 Effects of compound enzyme addition (A), enzymolysis temperature (B), enzymolysis pH (C), enzymolysis time (D) and ratio of material and liquid (E) on the yield of Polygonatum sibiricum polysaccharide
2.1.2 正交试验
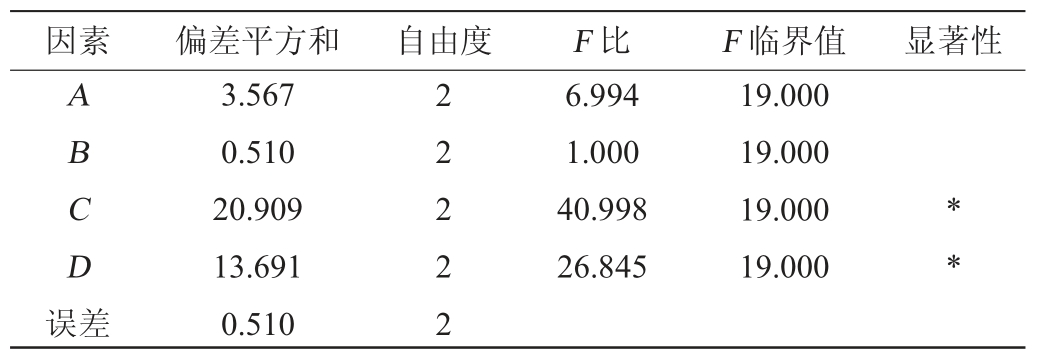
酶辅助法提取黄精多糖条件优化正交试验结果与分析见表2,方差分析见表3。
表2 酶辅助法提取黄精多糖条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for extraction conditions optimization of Polygonatum sibiricum polysaccharide by enzyme assisted method

试验号 A B C D 黄精多糖得率/%1 2 3 4 5 6 7 8 9 k1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 17.14 21.89 23.90 24.16 22.78 20.35 23.60 21.88 20.97 k2 k3R 20.977 22.430 22.150 1.453 21.633 22.183 21.740 0.550 19.790 23.427 22.340 3.637 20.297 21.947 23.313 3.016
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
注:“*”表示对结果影响显著(P<0.05)。
因素 偏差平方和 自由度 F 比 F 临界值 显著性ABCD误差3.567 0.510 20.909 13.691 0.510 22222 6.994 1.000 40.998 26.845 19.000 19.000 19.000 19.000**
由表2可知,4个因素对黄精多糖得率的影响从小到大依次为酶解温度(B)<酶添加量(A)<料液比(D)<酶解时间(C),最优组合条件是A2B2C2D3,即复合酶添加量6%、酶解温度50 ℃、酶解时间90 min、料液比1∶30(g∶mL),在此条件下进行3组验证试验,得到黄精多糖得率平均值为24.18%。通过表3方差分析可以看出,酶解时间和料液比对黄精多糖得率显著(P<0.05),提取温度和酶添加量对黄精多糖得率影响不显著(P>0.05)。
2.2 黄精多糖中不同分子质量片段的吸湿保湿性分析
不同截留分子质量的黄精多糖组分得率如表4所示。
表4 不同截留分子质量的黄精多糖组分得率
Table 4 Separation rates of Polygonatum sibiricum polysaccharide with different molecular weight
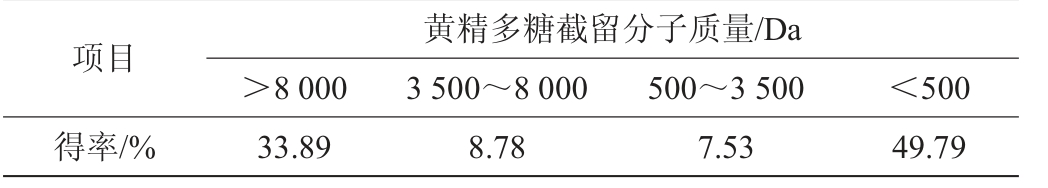
黄精多糖截留分子质量/Da>8 000 3 500~8 000 500~3 500 <500项目得率/% 33.89 8.78 7.53 49.79
2.2.1 吸湿性分析
在不同的相对湿度条件下,甘油、低分子透明质酸钠和黄精多糖样品的吸湿性结果见图2。
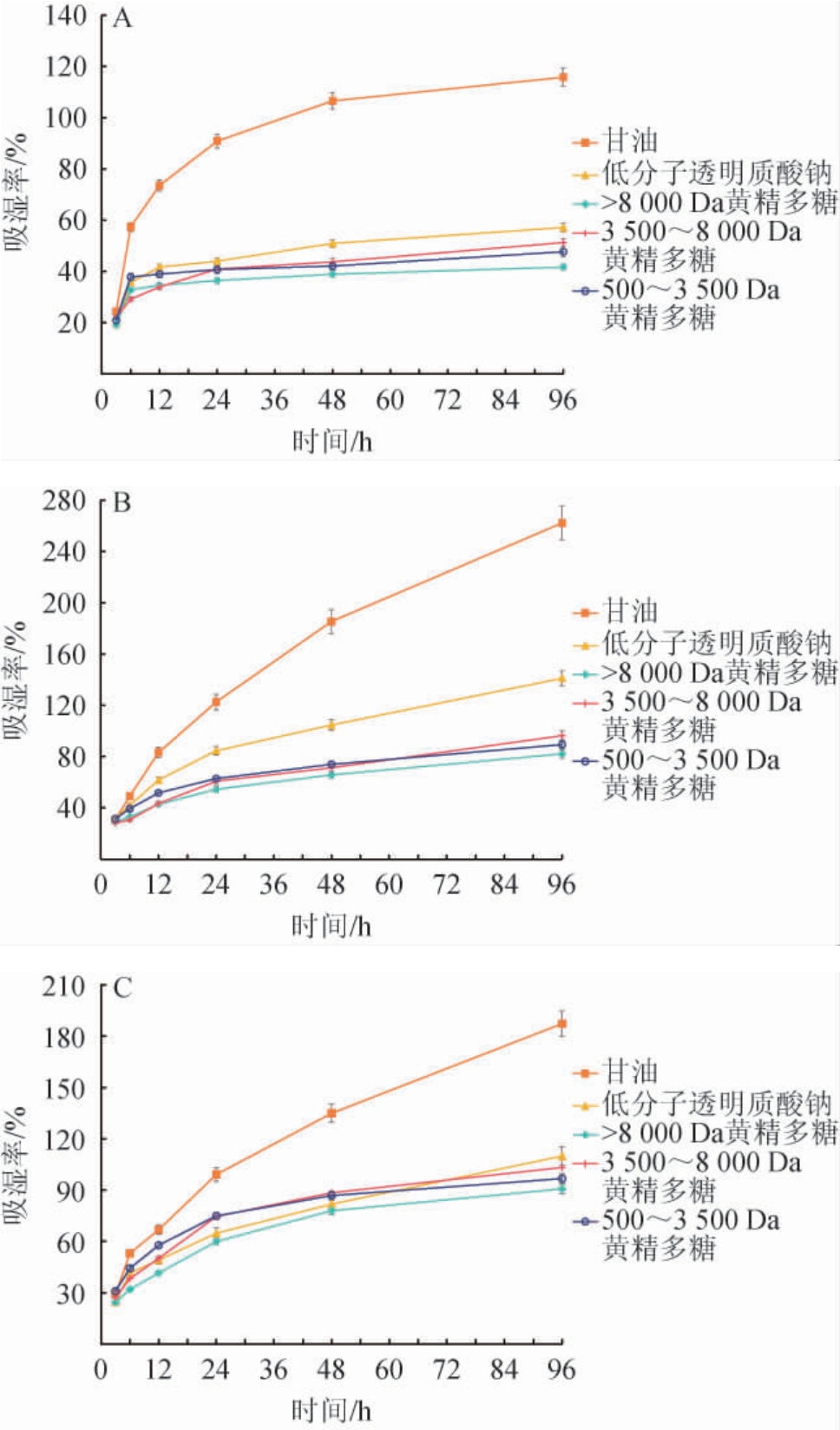
图2 相对湿度为43%(A)、68%(B)及93%(C)条件下甘油、低分子透明质酸钠、黄精多糖样品的吸湿率变化
Fig.2 Changes of moisture absorption rates of glycerin, low molecular weight sodium hyaluronate and Polygonatum sibiricum polysaccharide samples under the relative humidity of 43%(A), 68%(B) and 93%(C)
由图2可知,在相对湿度43%条件下,低分子透明质酸钠及分子质量3 500~8 000 Da、500~3 500 Da、>8 000 Da的黄精多糖片段吸湿速度较慢,且在48 h左右几乎不再吸水,甘油的吸湿效果最好;在96 h时,甘油、低分子透明质酸钠及分子质量>8 000 Da、3 500~8 000 Da、500~3 500 Da的黄精多糖片段吸湿率分别为115.83%、57.19%、41.74%、51.33%、47.75%。在相对湿度68%条件下,分子质量>8000Da、3 500~8 000 Da、500~3 500 Da的黄精多糖片段吸湿率较低,在96 h时吸湿率分别为82.19%、96.36%、89.35%。在相对湿度93%条件下,除了甘油具有较高的吸湿率(187.23%)外,其他样品的吸湿率很接近。分子质量>8 000 Da、3 500~8 000 Da、500~3 500 Da的黄精多糖片段吸湿率缓慢增长,96 h时的吸湿率分别为90.77%、103.27%、96.74%。综上所述,RH分别为43%、68%、93%的条件下,以上样品均有一定的吸湿性,其中吸湿性最佳的黄精多糖片段分子质量为3 500~8 000 Da。
2.2.2 保湿性分析
在不同的相对湿度条件下,甘油、超活透明质酸和黄精多糖样品的保湿性结果见图3。

图3 相对湿度为43%(A)、68%(B)及93%(C)条件下甘油、超活透明质酸和黄精多糖样品的保湿率变化
Fig.3 Changes of moisture retention rates of glycerin, hyperactive hyaluronic acid and Polygonatum sibiricum polysaccharide samples under the relative humidity of 43%(A), 68%(B) and 93%(C)
由图3可知,在相对湿度为43%条件下,超活透明质酸和甘油的水分含量缓慢降低,随着时间的延长不再大幅度的散失水分,一直维持着较高的保湿率,超活透明质酸的保湿效果最好。而分子质量>8 000 Da、3 500~8 000 Da、500~3 500 Da的黄精多糖片段的保湿性相对较弱,96 h时的保湿率分别为95.79%、94.15%、94.39%。在相对湿度为68%条件下,96 h时,甘油、超活透明质酸及分子质量>8 000 Da、3 500~8 000 Da、500~3 500 Da的黄精多糖片段的保湿率分别为99.35%、99.46%、98.07%、97.93%、97.22%。在相对湿度为93%条件下,在96 h时,超活透明质酸和甘油的保湿效果比较好,保湿率分别为98.83%和98.69%。分子质量>8 000 Da、3 500~8 000 Da、500~3 500 Da的黄精多糖片段的保湿效果比较接近,96 h时的保湿率分别为96.98%、96.45%、96.78%。综上所述,RH分别为43%、68%、93%的条件下,以上样品均有一定的保湿性,其中保湿性最佳的黄精多糖片段分子质量>8 000 Da。
2.3 最佳保湿片段的抗氧化活性分析
采用3种方式评价保湿性最佳的黄精多糖片段(分子质量>8 000 Da)的体外抗氧化能力,结果见图4。由图4可知,黄精多糖片段对DPPH·、ABTS+·、羟基自由基的清除率均随多糖溶液质量浓度的增加而增加。黄精多糖溶液质量浓度为6 mg/mL时,对DPPH·、ABTS+·、羟基自由基的清除率分别为50.54%、48.65%、26.41%,均低于对照(VC)。

图4 最佳保湿黄精多糖片段对DPPH(A)、ABTS+(B)、羟基(C)自由基清除率的影响
Fig.4 Effects of Polygonatum sibiricum polysaccharide fragment with optimal moisture retention on the scavenging rates of DPPH (A),ABTS (B) and hydroxyl (C) radicals
2.4 最佳保湿片段的结构表征分析
2.4.1 扫描电镜分析
多糖的立体形状通常比蛋白质和核酸更为复杂,其结构形态与膨胀、溶解、释放和黏附特性等性质有关。黄精多糖的扫描电镜分析结果见图5。由图5可以观察到,黄精多糖由自由分布的不规则薄片组成,薄片表面基本平滑,结构比较紧密,上面散落着直径约为1 μm的卵形微粒。

图5 最佳保湿黄精多糖片段扫描电镜图
Fig.5 Scanning electron microscopy of the Polygonatum sibiricum polysaccharide fragment with optimal moisture retention
2.4.2 红外光谱分析
最佳保湿黄精多糖片段的红外吸收光谱见图6。由图6可知,黄精多糖具有与一般植物多糖相似的结构,在波数3 388 cm-1附近的强而宽的吸收峰和波数2 930 cm-1处比较弱的吸收峰分别是由-OH与C-H拉伸振动引起的;波数1 626 cm-1附近的条带是由CHO的羰基C=O所引起,说明有糖醛酸存在[32],波数1 416 cm-1处是糖环上的C-O吸收峰;波数1 127cm-1和1 025 cm-1处吸收峰表示由呋喃糖的C-O-C所引起[33],波数927 cm-1处出现的吸收峰表示黄精多糖中有β-型糖苷键。
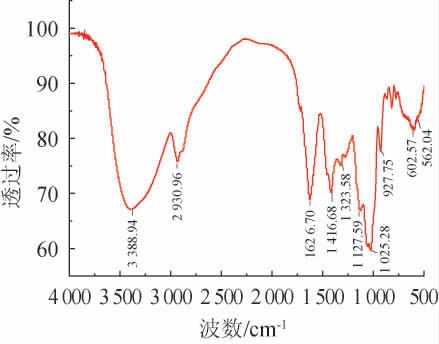
图6 最佳保湿黄精多糖片段红外吸收光谱图
Fig.6 Infrared absorption spectra of the Polygonatum sibiricum polysaccharide fragment with optimal moisture retention
3 结论
当复合酶配比固定为木瓜蛋白酶∶纤维素酶∶半纤维素酶=5∶4∶3条件下,通过单因素及正交试验优化确定的酶辅助法提取黄精多糖的最佳提取条件为复合酶添加量6%、酶解温度50 ℃、酶解时间90 min、料液比1∶30(g∶mL)。在此优化条件下,黄精多糖的得率达到24.18%。在相对湿度分别为43%、68%和93%环境下测定不同分子质量黄精多糖片段(>8 000 Da、3 500~8 000 Da和500~3 500 Da)的吸湿保湿性发现,分子质量3 500~8 000 Da的黄精多糖片段的吸湿性能最佳,分子质量>8 000多糖片段的保湿性能最佳;最佳保湿黄精多糖片段表现出一定的抗氧化活性,该片段具有与一般植物多糖相似的形态结构。黄精多糖是一种的天然产物资源,可作为吸湿保湿剂和抗氧化剂在食品、药品、化妆品等各个领域具有广泛的应用前景。
[1]张文武,童金凤,彭甫蕾,等.基于非靶代谢组学的多花黄精沙藏种子萌发过程差异代谢物分析[J].生物资源,2023,45(2):164-176.
[2]江华.黄精多糖的抗肿瘤活性研究[J].南京中医药大学学报,2010,26(6):479-480.
[3]曾立,向荣,张运良,等.黄精多糖对糖尿病小鼠的降血糖作用及机制[J].中成药,2022,44(9):2989-2994.
[4]罗婷,罗丹.黄精多糖的现代药理作用研究进展[J].临床合理用药,2023,16(2):177-180.
[5]张雪,赵苑伶,陈林珍,等.基于斑马鱼模型探究多花黄精多糖的免疫调节作用[J].世界中医药,2023,18(6):761-765,772.
[6]李旭鸿,冯源源,黄月,等.3种黄精多糖含量及抗氧化活性的差异分析[J].食品工业,2023,44(4):171-175.
[7]WANG S,CUI X,CAO H,et al.A review:the bioactivities and pharmacological applications of Polygonatum sibiricum polysaccharides[J].Molecules,2018,23(5):1170.
[8]LONG T T,LIU Z J,SHANG J C,et al.Polygonatum sibiricum polysaccharides play anti-cancer effect through TLR4-MAPK/NF-KB signaling pathways[J].Int J Biol Macromol,2018,111:813-821.
[9]WANG G J,LI J J,HE L F,et al.Study on the preventive effect of Polygonatum polysaccharide on glucose and lipid metabolism disorder in mice[J].J Food Saf Qual Inspection,2020,11(21):189-196.
[10]WANG Y J,LIU N,XUE X,et al.Purification,structural characterization and in vivo immunoregulatory activity of a novel polysaccharide from Polygonatum sibiricum[J].Int J Biol Macromol,2020,160:688-694.
[11]LI L,KIRAN T,LIAO B Y,et al.Antioxidant and antimicrobial potential of polysaccharides sequentially extracted from Polygonatum cyrtonema Hua[J].Int J Biol Macromol,2018:317-323.
[12]刘红辉,李敏,汲红丽,等.紫球藻胞外多糖抗氧化和保湿性能的研究[J].食品研究与开发,2014,35(5):1-6.
[13]孙菁雯.发酵酶解法制备两种海藻多糖及其保湿抗氧化活性研究[D].烟台:烟台大学,2021.
[14]安星亮,赵永亮,王欢,等.银耳多糖提取工艺的响应面法优化及抗氧化和保湿性研究[J].食品研究与开发,2022,43(15):123-130.
[15]方嘉沁,郑青松,文雨欣,等.不同提取方法的莲子心多糖结构与理化性质比较[J].现代食品科技,2023,39(1):1-12.
[16]廖登未,黄德春,程抒劼,等.姜多糖提取方法工艺优化及分析[J].食品与机械,2018,34(9):152-156.
[17]杨茂会,周欣,谯政文,等.黄精多糖提取、分离纯化及生物活性研究进展[J].食品工业科技,2022,43(12):407-416.
[18]张梓原,徐伟,王鑫,等.黄精多糖的提取工艺对比研究[J].包装工程,2020,423(9):60-67.
[19]唐萍,朱艳,孟文潮,等.黄精多糖的提取方法及活性研究进展[J].山东化工,2023,52(7):70-72.
[20]李瑶,韦宇燕,黄银燕,等.微波辅助酶法提取食用藻多糖的工艺优化及抗氧化活性研究[J].食品科技,2023,48(5):191-197.
[21]苑璐,冷凯良,周余航,等.复合酶解法优化黄精多糖提取工艺[J].食品与生物技术学报,2017(9):106-111.
[22]楚冬海.响应面分析法优化黄精多糖提取工艺及含量测定[J].辽宁中医杂志,2020,513(2):162-165.
[23]李明,陶洪玲,高玉梅,等.辣木仁中多糖的提取与表征[J].食品科技,2022,47(12):180-185.
[24]高丽伟,赵新杰,赵祥忠.纤细裸藻多糖提取工艺优化及其吸湿性、保湿性[J].食品研究与开发,2022,43(20):110-116.
[25]朱彬娜,孙佳颖,胡国盼,等.黄秋葵多糖的吸湿保湿性能研究[J].湖南农业科学,2018(11):98-100.
[26]陈政,高友君,邓芳飞,等.微波提取桂花叶多糖及其吸湿保湿性和抗氧化性研究[J].化工新型材料,2022,50(S01):337-340.
[27]徐娟,付晓娜,周海,等.黄精多糖提取、单糖组成及抗氧化活性分析[J].粮食与油脂,2022,35(7):141-146.
[28]程亚楠,张金华,田胜兰,等.不同来源多花黄精多糖的结构特性及抗氧化活性比较[J].现代食品科技,2023,39(7):145-153.
[29]巫永华,刘恩岐,张建萍,等.超声微波协同酶法提取黄精多糖与抗氧化特性分析[J].食品工业,2019,40(5):171-176.
[30]XU J K,HOU H J,HU J P,et al.Optimized microwave extraction,characterization and antioxidant capacity of biological polysaccharides from Eucommia ulmoides oliver leaf[J].Sci Rep,2018,8(1):6561.
[31]LI R S, TAO A, YANG R M, et al.Structural characterization, hypoglycemic effects and antidiabetic mechanism of a novel polysaccharides from Polygonatum kingianum Coll.et Hemsl[J].Biomed Pharmacother,2020,131:110687.
[32]ZHAO P, ZHOU H F, ZHAO C C, et al.Purification, characterization and immunomodulatory activity of fructans from Polygonatum odoratum and P.cyrtonema[J].Carbohydr Polym,2019,214:44-52.
[33]ZHANG J Y,CHEN H L,LUO L,et al.Structures of fructan and galactan from Polygonatum cyrtonema and their utilization by probiotic bacteria[J].Carbohydr Polym,2021,267:118219.