我国农业的历史悠久,农作物秸秆产量巨大、品种繁多,合理开发利用秸秆类生物资源具有重要的现实意义[1-2]。绝大部分农作物秸秆含有大量纤维素营养物质[3]及木质素、半纤维素、矿物质[4-5],不同秸秆的营养成分种类与含量也不同,但都是绿色、可再生的生物资源[6]。目前物理、化学的处理方法均不能有效降解纤维素从而释放其中的营养成分,并会带来成本和环境问题[7-8]。
纤维素是可再利用型糖类资源。纤维素类物质经过生物处理后,可转化为各种各样的产品[9-11]。真菌是目前已知的产纤维素酶能力较强的微生物,主要在于真菌可以分泌胞外纤维素酶[12-13],真菌的菌丝可以穿透植物的角质层,破坏木质纤维素的结构从而暴露出纤维素,分泌胞外纤维素酶直接与纤维素结合进行酶解,从而提高降解纤维素的效率[14-16]。目前为止对产纤维素酶的真菌中研究较多的有木霉属(Trichoderma)、青霉属(Penicillium)和曲霉属(Aspergillus)等[17-19]。但选育的产酶菌株都存在产酶量不高、酶活性较低等问题,从而导致造价成本高,不能应用于工业生产中[20-21]。越来越多的研究表明,采用微生物处理秸秆可以有效降解纤维素类物质,利用生物酶技术将纤维材料转化为饲料、堆肥、栽培基质、化工原料等[22-23]。因其本身具有耗能低、反应条件温和、无毒无腐蚀性化学物质的优势[24],在降解纤维素类物质方面将发挥巨大潜力、具有广阔应用前景,所以为实现微生物高效处理秸秆技术,首先要筛选到能够有效分解纤维素的微生物菌种[25-26]。
本研究利用前期分离鉴定得到的2株高产纤维素酶的真菌菌株[27],从混合菌液发酵的角度出发,进行真菌之间的混合发酵试验,确定最佳混合菌组合。在上述试验基础上,利用单因素试验与响应面法优化培养基组成与发酵条件,以期为后续解决农业废弃物降解提供实验资源,进而促进“碳中和”的生物能源发展。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
白耙齿菌(Irpex lacteus)J2、栓孔菌(Trametes junipericola)J6:北京农学院植物病理学实验室分离鉴定并保藏[27]。
1.1.2 试剂
羧甲基纤维素钠(carboxymethyl cellulose sodium,CMCNa)(分析纯)、乳糖(生化试剂):国药集团化学试剂有限公司;牛肉膏、葡萄糖、MgSO4、MnSO4、Tween-80(均为分析纯):北京索莱宝科技有限公司;KH2PO4(分析纯):上海麦克林生化科技股份有限公司。
1.1.3 培养基
初始产酶培养基[27]:CMC-Na 10 g/L,NH4NO3 3 g/L,NaH2PO4 4 g/L,MgSO4 0.3 g/L,MnSO4 0.3 g/L,Tween-80 1.5 mL/L,pH自然,121 ℃灭菌20 min。
活化培养基[27]:采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基。
种子液培养基[27]:采用马铃薯葡萄糖液体培养基。
1.2 仪器与设备
MLS-3750高压蒸汽灭菌锅:三洋集团有限公司;BSD-150恒温振荡培养箱:上海博讯实业有限公司医疗设备厂;HH35L2018081酶标仪:上海铂金埃尔默企业管理有限公司;DL-CJ-1ND超级洁净工作台:北京东联哈尔仪器制造有限公司;5417R台式高速冷冻离心机:德国Eppendorf公司;XMTD-6000智能恒温水浴锅:北京市长风仪器仪表公司。
1.3 方法
1.3.1 纤维素酶发酵液的制备
将保藏的菌种挑取菌丝在PDA培养基上进行活化培养,待菌丝长满整个平板使用7 mm打孔器在平板边缘打取3个菌饼接种到种子液培养基中,28 ℃、180 r/min恒温摇床培养4 d制成种子液。将种子液按5%(V/V)的接种量(菌株接种比例为1∶1)接种到含100 mL初始产酶培养基的250 mL锥形瓶中,于28 ℃、180 r/min恒温摇床培养4 d,将培养液6 000 r/min离心10 min,取上清液即为粗酶液。
1.3.2 产酶培养基优化单因素试验
采用单因素轮换法,在初始产酶培养基的基础上,依次考察碳源种类(羧甲基纤维素钠、乳糖、淀粉、麸皮、玉米杆)(碳源添加量为10 g/L)、氮源种类(硫酸铵、亚硝酸钠、乳糖、蛋白胨、牛肉膏)(氮源添加量为3 g/L)对混合菌液产纤维素酶酶活的影响。
1.3.3 产酶培养基优化响应面试验
(1)Plackett-Burman(PB)试验设计
在单因素试验的基础上,设计产酶培养基的6个变量分别为乳糖(A)、牛肉膏(B)、KH2PO4(C)、MgSO4(D)、MnSO4(E)和Tween-80(F),使用Design-Expert 10.0软件从这6个变量中筛选出对纤维素酶酶活(Y)具有较大影响的因素,每个因素测试2个水平,PB试验设计因素与水平见表1。
表1 产纤维素酶培养基优化PB试验设计因素与水平
Table 1 Factors and levels of PB experiments design for optimization of cellulase-producing medium
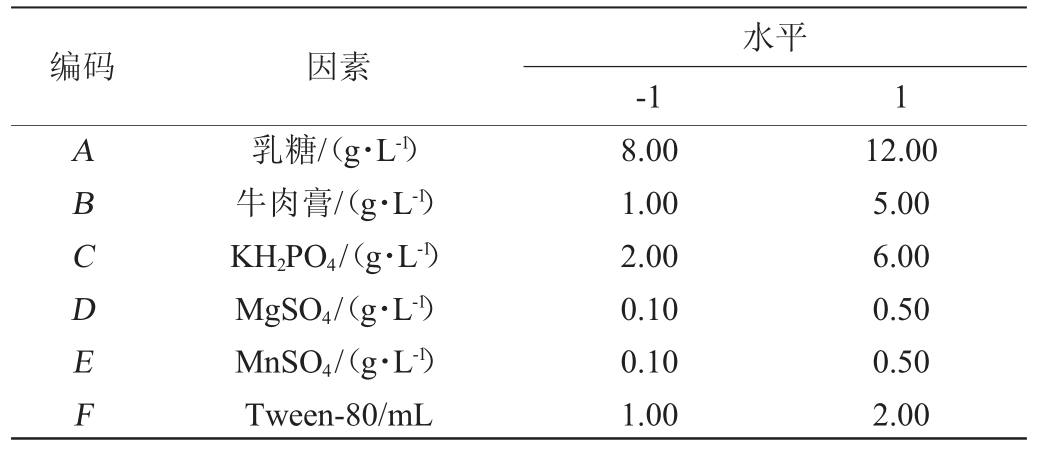
编码 因素水平-1 1 ABCDEF乳糖/(g·L-1)牛肉膏/(g·L-1)KH2PO4/(g·L-1)MgSO4/(g·L-1)MnSO4/(g·L-1)Tween-80/mL 8.00 1.00 2.00 0.10 0.10 1.00 12.00 5.00 6.00 0.50 0.50 2.00
(2)最陡爬坡试验
根据上述PB试验设计筛选出对纤维素酶影响显著的因素,使用最陡爬坡试验根据响应值的变化梯度,确定爬坡方向,进一步分析和优化具有显著影响的因素对纤维素酶酶活力的影响,爬坡试验的目的是找到拐点,为下一步响应面法试验设计做准备。
(3)响应面法优化培养基
根据最陡爬坡试验初步得到乳糖(A)、KH2PO4(B)和MgSO4(C)合适浓度范围,然后利用Box-Behnken(BB)进行3因素3水平试验优化培养基配方,BB试验设计因素与水平见表2。
表2 产纤维素酶培养基优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design for optimization of cellulose-producing medium
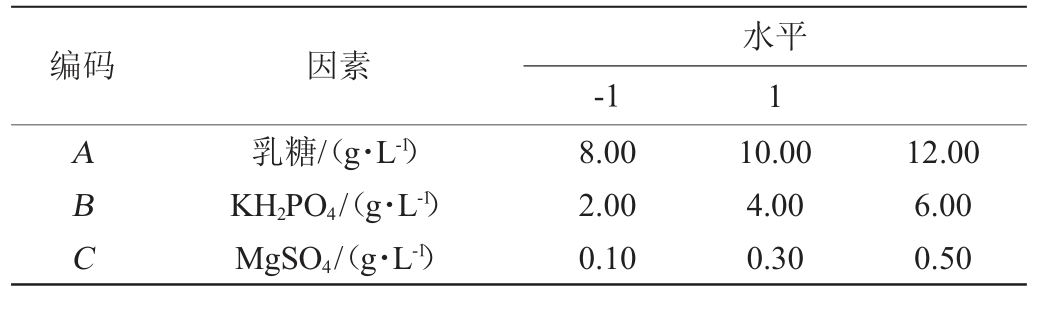
编码 因素1 ABC乳糖/(g·L-1)KH2PO4/(g·L-1)MgSO4/(g·L-1)8.00 2.00 0.10水平-1 10.00 4.00 0.30 12.00 6.00 0.50
1.3.4 发酵培养条件优化单因素试验
将混合菌株的种子液按5%(V/V)的接种量接种到含100mL优化后液体产酶培养基的250 mL锥形瓶中,于28 ℃、180 r/min恒温摇床培养4 d,测定发酵液中纤维素酶酶活。分别考察菌株J2∶J6的接种比(1∶1、1∶2、2∶1)、培养温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)、发酵初始pH(4、5、6、7、8)、摇床转速(160 r/min、170 r/min、180 r/min、190 r/min、200 r/min)对纤维素酶酶活的影响。
1.3.5 纤维素酶酶活的测定
根据3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色法测定纤维素酶活性[28]。在25 mL刻度具塞试管中,加入1 mL CMC-Na溶液、0.5 mL酶液、2 mL柠檬酸盐缓冲溶,电磁振荡3 s,置于50 ℃水浴中,反应30 min,然后加入2 mL DNS试剂,放入沸水浴中加热5 min,冷却至室温,用水定容至25 mL。于波长540 nm处测量吸光度值。根据葡萄糖标准曲线回归方程计算还原糖含量,求得纤维素酶酶活。
纤维素酶酶活定义[29]:在50 ℃、pH4.8的条件下,1 mL粗酶液每分钟从质量浓度为10 mg/mL的CMC-Na溶液中产出相当于1 μg葡萄糖的还原糖量,为一个酶活力单位(U/mL)。
2 结果与分析
2.1 产酶培养基优化单因素试验
2.1.1 培养基碳源对混合菌液产酶的影响
由图1可知,以乳糖为培养基碳源时,混合菌液产纤维素酶活力最高,与羧甲基纤维素钠(对照)、淀粉作为碳源时差异不显著(P>0.05),且乳糖的成本较低[31-32]。综上选择乳糖为培养基碳源进行下一步优化。
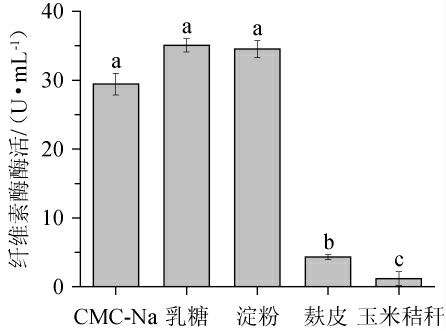
图1 碳源对混合菌液产纤维素酶的影响
Fig.1 Effect of carbon source on cellulose production by mixed fungal liquid
不同小字字母表示差异显著(P<0.05)。下同。
2.1.2 培养基氮源对混合菌液产酶的影响
由图2可知,以蛋白胨为培养基氮源时,混合菌液产纤维素酶活力最高,但与牛肉膏作为氮源时差异不显著(P>0.05),且牛肉膏比蛋白胨的成本低,产酶能力更稳定[33]。综上选择牛肉膏为培养基氮源进行下一步优化。
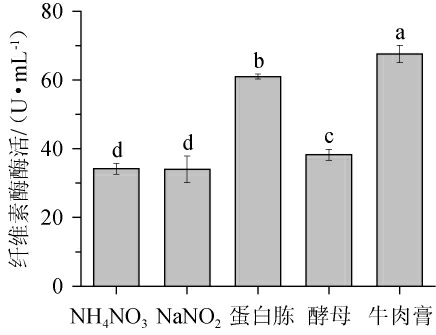
图2 氮源对混合菌液产纤维素酶的影响
Fig.2 Effect of nitrogen source on cellulose production by mixed fungal liquid
2.2 产酶培养基优化响应面试验
2.2.1 Plackett-Burman试验结果分析
确定最佳的碳源和氮源后,选定乳糖(A)、牛肉膏(B)、KH2PO4(C)、MgSO4(D)、MnSO4(E)、Tween-80(F)共6个因素进行考察,试验设计及结果见表3,方差分析见表4。
表3 产纤维素酶培养基优化Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman experiments for optimization of cellulose-producing medium
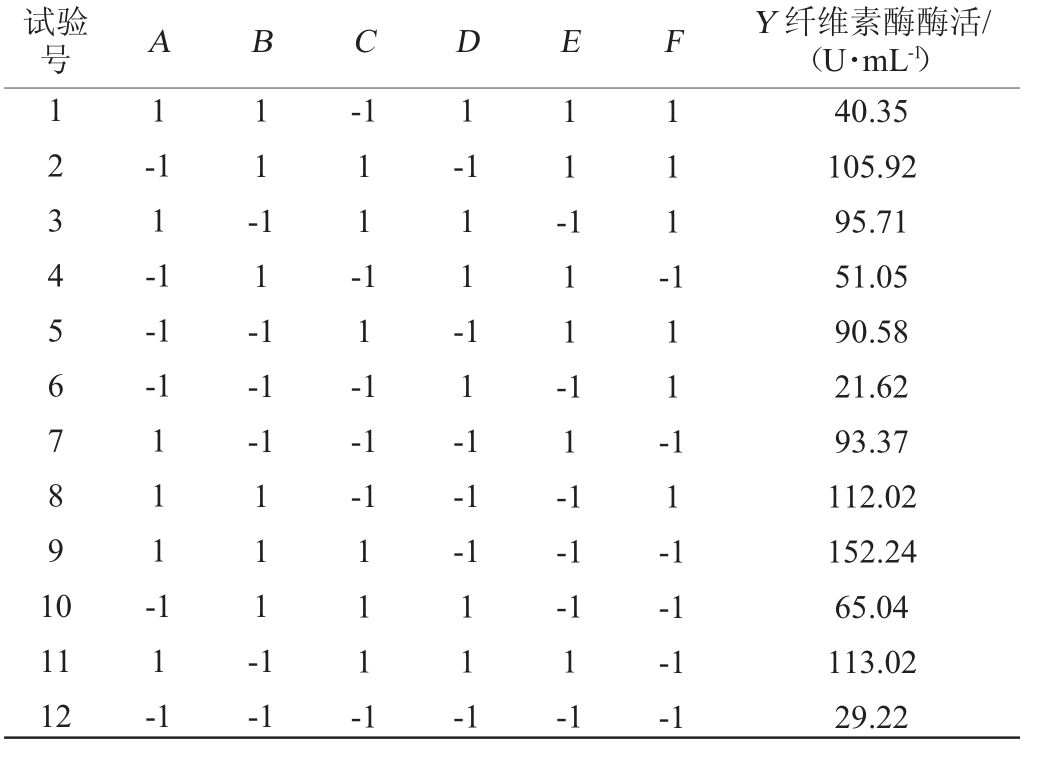
试验号 A B C D E F Y 纤维素酶酶活/(U·mL-1)1234567891 0 1-1 1-1 1-1-1-1 11--1 11-1 11-1 1-1 1 -111-11-1 111-111--1-1-1-1 11-1 111-111-1 11-1 11-1-1-1 11 12 11-1-1 111-1 1 1 -1-1-1 1-1-1-1-1 40.35 105.92 95.71 51.05 90.58 21.62 93.37 112.02 152.24 65.04 113.02 29.22
表4 Plackett-Burman试验结果方差分析
Table 4 Variance analysis of Plackett-Burman tests results
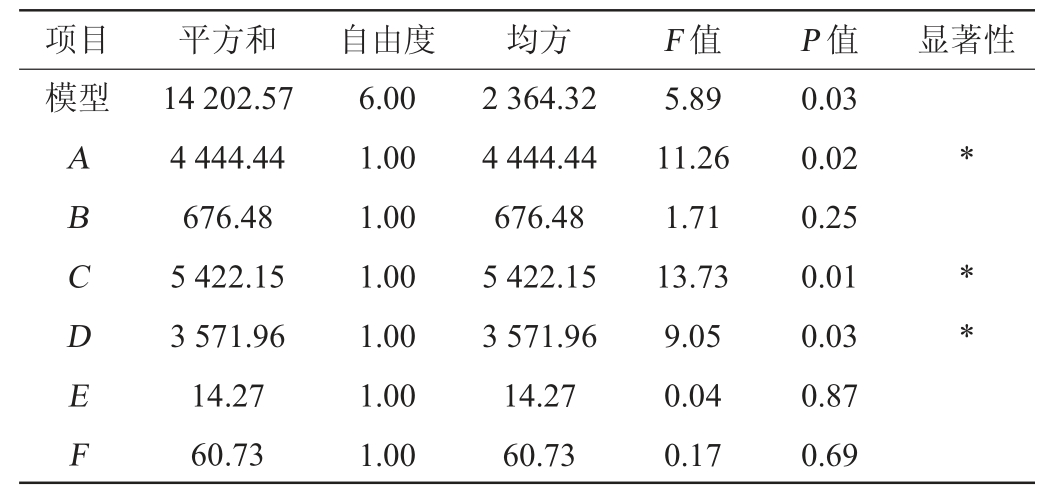
注:“*”表示对结果影响显著(P<0.05)。
项目 平方和 自由度 均方 F 值 P 值 显著性模型ABCDEF 14 202.57 4 444.44 676.48 5 422.15 3 571.96 14.27 60.73 6.00 1.00 1.00 1.00 1.00 1.00 1.00 2 364.32 4 444.44 676.48 5 422.15 3 571.96 14.27 60.73 5.89 11.26 1.71 13.73 9.05 0.04 0.17 0.03 0.02 0.25 0.01 0.03 0.87 0.69** *
由表3及表4可知,对纤维素酶酶活(Y)影响最显著的3个因素为:KH2PO4(C)>乳糖(A)>MgSO4(D),将这3个因素作为发酵优化的主要因素进行响应面设计分析。得到最优一阶方程为:Y=81.13+19.25A+7.51B+22.31C-18.19D+1.09E-2.32F,由方程可知,这3个因素都为正效应。
2.2.2 最陡爬坡试验结果分析
根据上述回归分析选择的3个影响显著的因素,通过梯度增加乳糖、KH2PO4和MgSO4的添加量,采用最陡爬坡试验的上升试验确定3个因素的最佳水平范围,最陡爬坡试验设计及结果见表5。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of steepest climbing tests
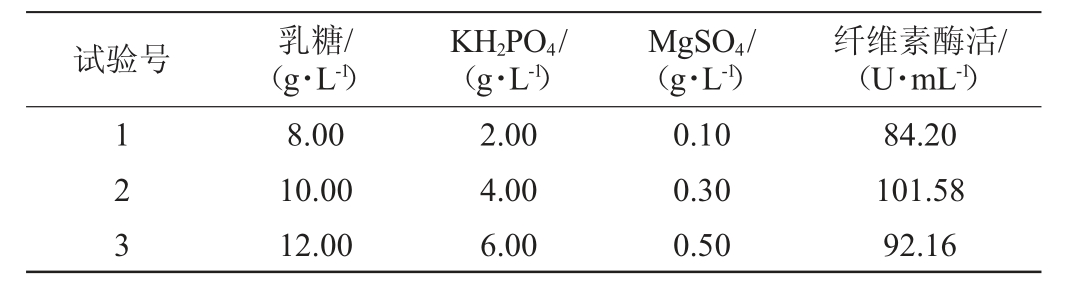
试验号 乳糖/(g·L-1)KH2PO4/(g·L-1)MgSO4/(g·L-1)纤维素酶活/(U·mL-1)123 8.00 10.00 12.00 2.00 4.00 6.00 0.10 0.30 0.50 84.20 101.58 92.16
由表5可知,在第2组试验时纤维素酶酶活达到最大,为101.58 U/mL,因此选择第2组试验作为Box-Behnken响应面试验的中心水平点。
2.2.3 Box-Behnken响应面试验设计结果分析
使用Design Expert10.0软件,对表6结果进行响应面回归分析,得到纤维素酶酶活(Y)与3个因素之间的3元2次回归方程:Y=105.50+3.12A+3.34B-6.46C+1.84AB+18.55AC-10.15BC-15.85A2-12.68B2-30.18C2。
表6 产纤维素酶培养基优化Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken experiments for optimization of cellulose-producing medium
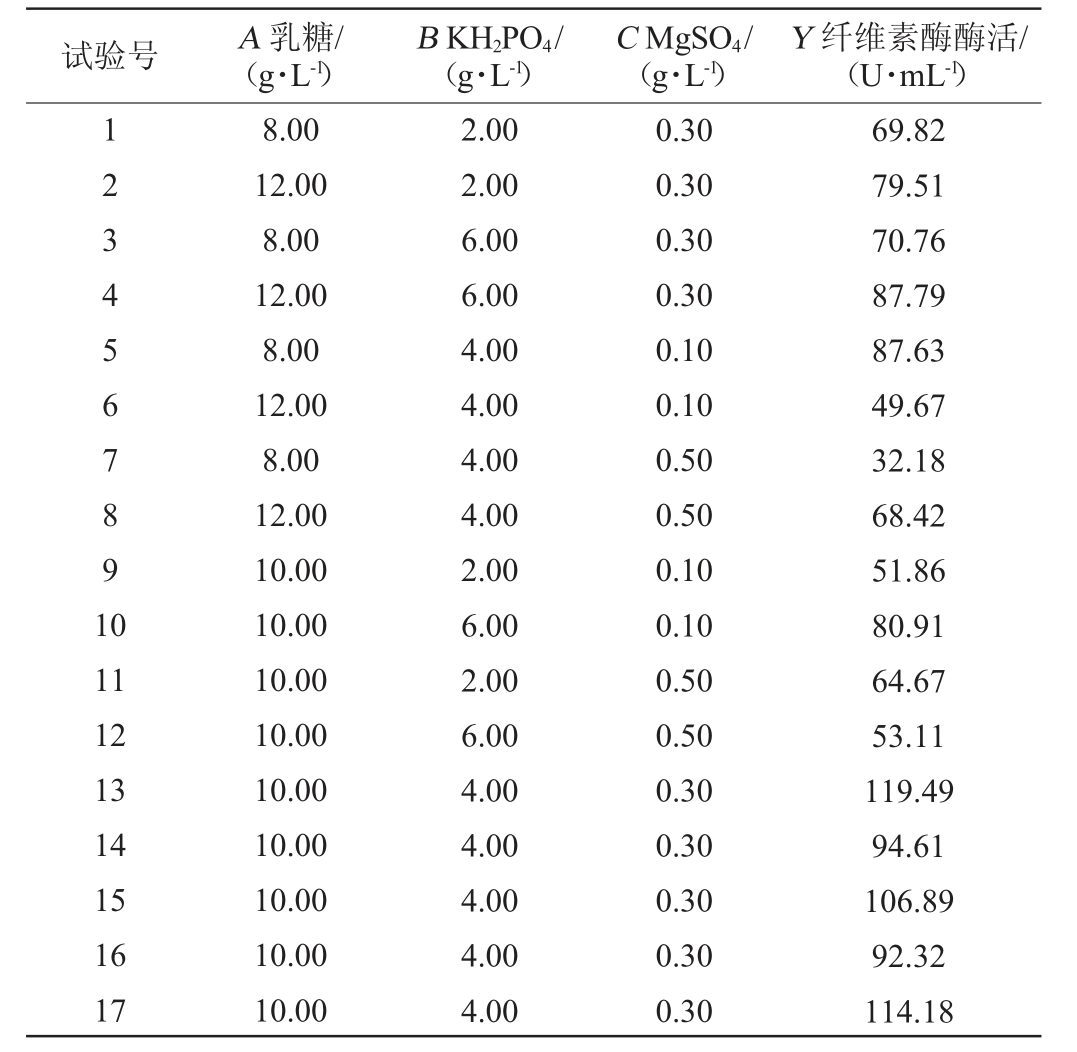
试验号 A 乳糖/(g·L-1)B KH2PO4/(g·L-1)C MgSO4/(g·L-1)Y 纤维素酶酶活/(U·mL-1)1234567891 0 11 12 13 14 15 16 17 8.00 12.00 8.00 12.00 8.00 12.00 8.00 12.00 10.00 10.00 10.00 10.00 10.00 10.00 10.00 10.00 10.00 2.00 2.00 6.00 6.00 4.00 4.00 4.00 4.00 2.00 6.00 2.00 6.00 4.00 4.00 4.00 4.00 4.00 0.30 0.30 0.30 0.30 0.10 0.10 0.50 0.50 0.10 0.10 0.50 0.50 0.30 0.30 0.30 0.30 0.30 69.82 79.51 70.76 87.79 87.63 49.67 32.18 68.42 51.86 80.91 64.67 53.11 119.49 94.61 106.89 92.32 114.18
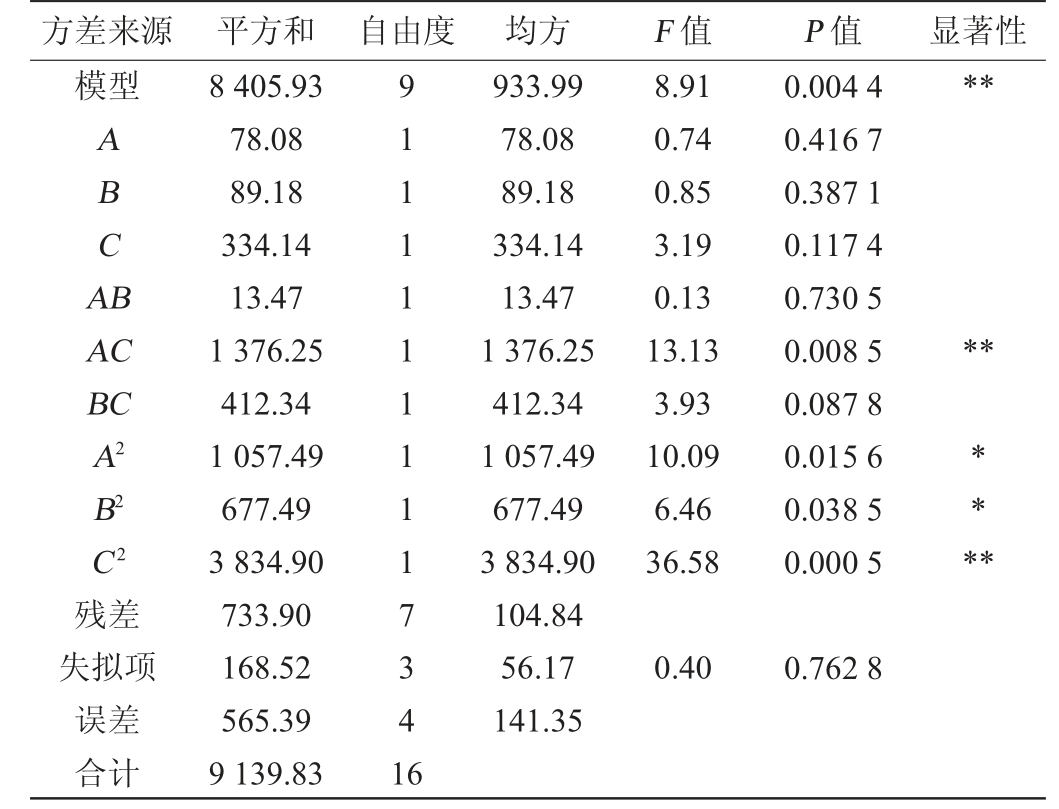
由表7可知,试验所用模型P<0.01达到极显著,说明方程拟合良好;失拟项P值为0.762 8>0.05,不显著。失拟项是评估方程可靠性的重要指标,失拟项检验不显著也说明方程模拟较好。方程决定系数R2=0.919 7,说明拟合良好、试验误差较小。在该模型中,二次项C2和交互项AC对纤维素酶酶活影响极显著(P<0.01),二次项A2和B2对纤维素酶酶活影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
表7 响应面试验结果方差分析
Table 7 Variance analysis of response surface tests results
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型**ABCA B AC BC A2 B2 C2残差失拟项误差合计8 405.93 78.08 89.18 334.14 13.47 1 376.25 412.34 1 057.49 677.49 3 834.90 733.90 168.52 565.39 9 139.83 91111111117341 6 933.99 78.08 89.18 334.14 13.47 1 376.25 412.34 1 057.49 677.49 3 834.90 104.84 56.17 141.35 8.91 0.74 0.85 3.19 0.13 13.13 3.93 10.09 6.46 36.58 0.004 4 0.416 7 0.387 1 0.117 4 0.730 5 0.008 5 0.087 8 0.015 6 0.038 5 0.000 5******0.40 0.762 8
使用Dsign Expert 10.0软件对回归方程求解,得到最佳的培养基组成为乳糖10.07 g/L、KH2PO4 4.37 g/L、MgSO4 0.27 g/L。在此条件下试验模型预测酶活为106.89 U/mL。为便于实际操作,修正产酶培养基组成为乳糖10.1 g/L、牛肉膏3 g/L、KH2PO4 4.4 g/L、MgSO4 0.3 g/L、MnSO4 0.3 g/L、Tween-80 1.5 mL/L,在此条件下进行3组平行培养,测得混合菌液产纤维素酶酶活为106.28 U/mL,与预测值相差不大,较优化前(72.01 U/mL)提升了47.6%。
2.2.4 响应面分析
利用Dsign Expert10.0软件绘制各因素交互作用对纤维素酶酶活影响的响应曲面与等高线,结果见图4。
各因素之间的交互作用对纤维素酶酶活影响的响应面曲线呈现抛物线状,说明所拟合的回归模型有极大值点。响应面的立体曲面图能反映因素对响应值的影响程度,立体曲面倾斜度越高,说明两因素的交互作用越明显[31]。从图3可以看出,乳糖与MgSO4交互作用极显著,与表7结果一致。
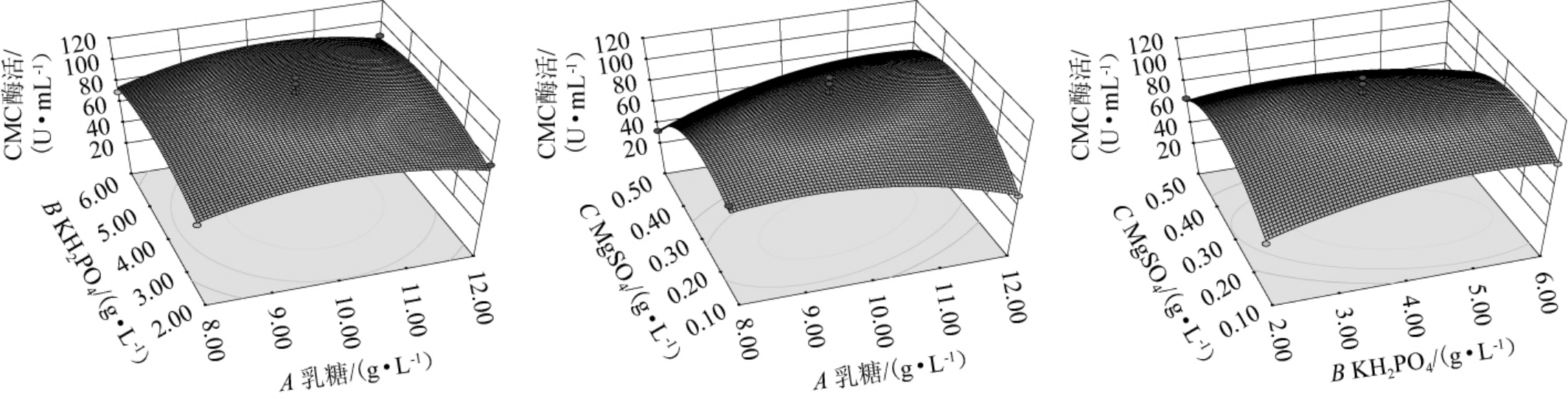
图3 各因素间交互作用对产纤维素酶影响的响应曲面及等高线
Fig.3 Response surfaces plots and contour lines of effect of interaction between various factors on cellulase production
2.3 产酶培养条件优化
2.3.1 混合菌液比例对产酶的影响
由图4可知,混合菌液在菌株J2与J6接种比为1∶1时产纤维素酶酶活最高,为105.58 U/mL,因此选择菌株J2∶J6=1∶1作为最佳的混合菌液比例。

图4 混合菌液比例对产纤维素酶的影响
Fig.4 Effect of ratio of mixed fungal liquid on cellulase production
2.3.2 培养温度对产酶的影响
由图5可知,培养温度对产酶影响较明显。培养温度低于28 ℃时,菌株的产酶能力随培养温度的升高而升高;培养温度为28 ℃时菌株产酶能力最好,纤维素酶酶活最高为101.94 U/mL;之后随着培养温度的上升菌株产酶能力减弱。菌株J2、J6均为真菌,真菌的最适培养温度多为25~28 ℃。菌株体内酶活受温度影响较大,在不适宜温度条件下菌株的生长也会受到明显影响[34]。因此选择28 ℃为最佳的培养温度。
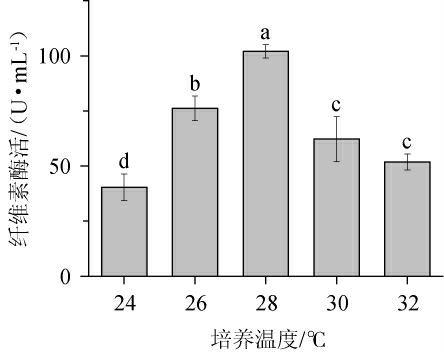
图5 培养温度对产纤维素酶的影响
Fig.5 Effect of culture temperature on cellulase production
2.3.3 初始pH对产酶的影响
pH对微生物吸收营养物质和产生新陈代谢过程中所需要的酶存在不容忽视的影响,所以适中的pH值对菌种发酵起促进作用[35]。由图6可知,初始pH为4~6时,纤维素酶酶活随初始pH升高而升高;初始pH为6时产酶能力最好,纤维素酶酶活最高为108.81 U/mL;之后随着初始pH的上升菌株产酶能力减弱。因此选择最佳初始pH为6。
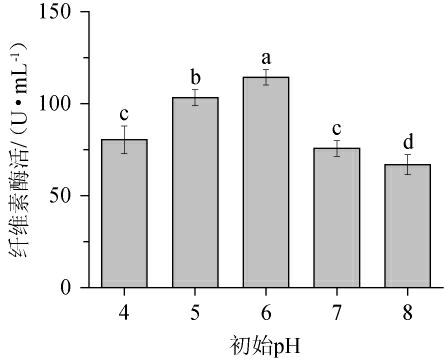
图6 初始pH对产纤维素酶的影响
Fig.6 Effect of initial pH on cellulase production
2.3.4 摇床转速对产酶的影响
由图7可知,随摇床转速的增加,菌株产酶能力呈先升高后降低的趋势。摇床转速为170 r/min时产酶能力最好,纤维素酶酶活最高为111.75 U/mL;之后随摇床转速的增加产酶能力下降。摇床转速升高能影响培养基中的氧含量,但当摇床转速过大时,菌株在培养基中受到的冲力也会过大,这会影响菌株的生长使菌株生长受到阻碍从而影响产酶[31]。因此选择最佳摇床转速为170 r/min。
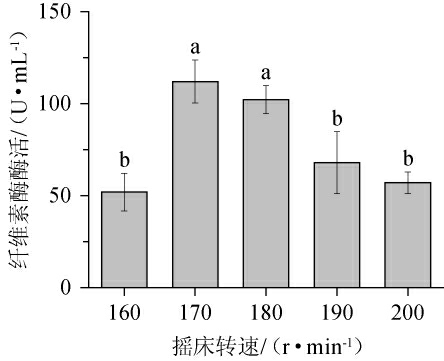
图7 摇床转速对产纤维素酶的影响
Fig.7 Effect of rotation speed on cellulase production
经单因素试验法优化得到最佳培养条件为初始pH为6.0,菌株J2∶J6为1∶1,在28 ℃、170 r/min恒温摇床培养4 d,在此条件下进行3次平行试验,得到的纤维素酶酶活为112.1 U/mL,较优化前(29.83 U/mL)提高了275.8%,菌株产酶能力得到较大提高。
3 结论
本试验使用2株真菌白耙齿菌(Irpex lacteus)J2、栓孔菌(Trametes junipericola)J6作为混合菌株进行动态发酵,以纤维素酶活力为响应值,通过单因素及响应面试验对产酶培养基组成、培养条件进行优化。结果表明,最佳产酶培养基组成为乳糖10.1 g/L、牛肉膏3 g/L、KH2PO4 4.4 g/L、MgSO4 0.3 g/L、MnSO4 0.3 g/L、Tween-80 1.5 mL/L;最佳培养条件为调节培养基初始pH为6.0、混合菌液比例为菌株J2∶J6=1∶1、28 ℃、170 r/min摇床培养4 d,在此条件下得到纤维素酶酶活最高为112.1 U/mL,较优化前(29.83 U/mL)提升了275.8%。为菌株J2、J6混合发酵进一步应用于纤维素酶生产提供一定支持,为工业化生产提供了基础数据,也为绿色、安全、高效处理农业废弃物奠定了基础。
[1]李韬,曹雅淇,邹伟,等.以水稻秸秆为基质里氏木霉产酶条件优化[J].中国酿造,2022,41(10):146-152.
[2]王伟英,柯叶鑫,李鸿浩,等.米根霉菌纤维素酶活性及其对农田废弃物的降解效果[J].福建农业学报,2023,38(1):75-80.
[3]王丰园,金海炎,丁凌飞,等.纤维素酶及其活性提升研究进展[J].现代农村科技,2022(3):65-68.
[4]李强,吴晓青,张新建.微生物降解秸秆木质素的研究进展[J].微生物学报,2023,63(11):4118-4132.
[5]李红琼,赵永飞,刘蒙龙,等.秸秆类和秕壳类粗饲料营养成分及饲用价值的比较研究[J].饲料工业,2023(7):1-12.
[6]段伟伟.纤维素酶在饲用膳食纤维制备中的应用进展[J].饲料研究,2022,45(17):156-159.
[7]刘睿.油料秸秆多菌共发酵降解体系的建立及初步应用[D].北京:中国农业科学院,2009.
[8]薛颖昊,徐志宇,张明明,等.我国蔬菜秸秆无害化处理技术优化探讨[J].中国农业资源与区划,2021,42(10):75-83.
[9]孙喆,鲍男,王涛.纤维素酶来源的研究进展[J].吉林畜牧兽医,2014,35(9):22-25.
[10]张开平,刘燕丽,涂绵亮,等.烟曲霉A-16产纤维素酶工艺优化及酶学特性[J].生物技术通报,2022,38(9):215-225.
[11]李江琴,姚凯利,胡天丁,等.纤维素基膜材料的应用研究进展[J].功能材料,2023,54(6):6080-6087.
[12]SADHU S,SADHU S,MAITI T K.Cellulase production by bacteria:a review[J].British Microbiol Res J,2013,3(3):235-258.
[13]MAKI M,LEUNG K T,QIN W S.The prospects of cellulase-producing bacteria for the bioconversion of lignocellulosic biomass[J].Int J Biol Sci,2009,5(5):500-516.
[14]IRFAN M,SAFDAR A,SYED Q.Isolation and screening of cellulolytic bacteria from soil and optimization of cellulase production and activity[J].Turk J Biochem,2012,37(3):287-293.
[15]李文兵,毕江涛,惠治兵,等.一株纤维素降解菌的分离、鉴定及发酵优化[J].安徽农业大学学报,2021,48(3):458-466.
[16]刘晓晶,李田,翟增强.纤维素酶的研究现状及应用前景[J].安徽农业科学,2011,39(4):1920-1921,1924.
[17]SARAVANAKUMAR K,FAN L L,FU K,et al.Cellulase from Trichoderma harzianum interacts with roots and triggers induced systemic resistance to foliar disease in maize[J].Sci Rep,2016,6(4):35543.
[18]贾贺雪.草酸青霉纤维素酶系水解木质纤维素能力的增强策略研究[D].济南:山东大学,2022.
[19]SUI M, RONG J C, ZHANG Y.Study on enzymatic characteristics of cellulose produced by Aspergillus fumigatus and optimization of enzyme production medium[J].J Physics: Conf Ser,2020,1549(3):032066.
[20]张英,侯红萍.黑曲霉和芽孢杆菌混合菌产纤维素酶的研究[J].中国酿造,2010,29(12):91-94.
[21]杨盛,侯红萍.高效降解纤维素混合菌的筛选及其产酶条件的研究[J].中国酿造,2008,27(21):20-23.
[22]宁露佳,刘倩楠,景雯,等.白酒糟纤维素降解菌的分离筛选及发酵条件优化[J].中国酿造,2021,40(5):119-123.
[23]白春艳,魏如腾,侯红萍.多菌混合发酵产纤维素酶及生物法预处理秸秆的研究[J].中国酿造,2016,35(1):57-61.
[24]罗艳青,张丹,冯海玮,等.DNS法检测灰略红链霉菌JSD-1产纤维素酶的CMC酶活条件的优化[J].食品工业科技,2015,36(3):156-162.
[25]贾洪柏,许超,刘军,等.种龄及接种量协同作用对纤维素酶活性的影响[J].安徽农业科学,2023,51(6):1-3,10.
[26]罗奉奉,付跃,黄秀艳,等.一株纤维素酶真菌的筛选鉴定及产酶条件优化[J].中国酿造,2021,40(2):133-139.
[27]王志.北京地区古树健康调查及木腐菌鉴定[D].北京:北京农学院,2023.
[28]张静静,聂犇,杨江科.造纸废液氧化塘纤维素酶产生菌群的分析与产酶菌株的筛选[J].微生物学通报,2014,41(10):1985-1993.
[29]孙以新.产纤维素酶菌株的筛选及其降解秸秆的研究[D].哈尔滨:东北农业大学,2019.
[30]付强,王琪,周巧丽,等.罗汉果内生菌中乙醇降解菌株的筛选及其发酵条件优化[J].中国酿造,2021,40(6):187-191.
[31]李豪.高产纤维素酶菌株选育、发酵产酶优化与初步应用研究[D].宜宾:四川轻化工大学,2019.
[32]庄磊,郭旭欣,于松涛.一株野生白耙齿菌菌株ITS序列鉴定及培养基优化[J].食用菌,2022,44(6):27-29,32.
[33]董雪丽,季静,张松皓,等.一株耐低温纤维素降解菌的发酵条件优化和秸秆降解研究[J].农业生物技术学报,2022,30(5):978-989.
[34]于海鑫,杨闯,魏丽娜,等.双菌混合发酵中温度对菌体生长及产纤维素酶的影响研究[J].产业与科技论坛,2014,13(19):58,97.
[35]舒林,郑佳,李丽,等.复合益生菌固态发酵酒糟条件的研究[J].中国酿造,2024,43(1):154-158.