中药是中华民族传统医学的瑰宝,其所含成分是其发挥疗效的物质基础,包括黄酮、生物碱、甾体、萜类、醌类、苯丙素等多种类型的化学成分[1]。有的中药本身就含有丰富的蛋白质、维生素和矿物元素,兼有药效和营养双重功能[2]。为了达到提高中药利用率、降低中药的毒副作用,改变药性、扩大适应症、产生新的活性成分的目的,融合着中药炮制和现代生物工程技术理念的中药发酵法随之出现[3]。中药发酵法是指经净制或处理后的药物,在一定的温度和湿度条件下,由于真菌和酶的催化分解作用,使药物发泡、生衣的方法[4]。真菌发酵中药历史悠久,最早可以追溯到4 000多年前,最早出现的发酵中药为曲类中药,如红曲、六神曲、建曲、半夏曲等[5]。目前,对于真菌发酵中药的研究主要集中在中草药添加剂、发酵饲料、抗生素替代等方面[6]。常用的发酵真菌有黑曲霉(Aspergillus niger)、酿酒酵母菌(Saccharomyces cerevisiae)、红曲霉(Monascus purpureus Went)、灵芝(Ganoderma lucidum(Curtis)P.Karst.)、短刺小克银汉霉(Cunninghamella blakesleeana)、米曲霉(Aspergillus oryzae)、青霉菌(Penicillium)等。人参[7]、马钱子[8]等中药采用真菌发酵转化其化学成分一直是研究热点。
真菌发酵转化中药成分具有效率高、条件温和、选择性强、不污染环境、反应类型多等优势,已用于转化黄酮、生物碱、甾体、萜类、醌类、苯丙素等多种类型的化学成分[9],而发酵过程的稳定性和可控性一直是一个难题,随着微生物学、基因组学、合成生物学和信息技术等的整合与应用,可以从科学的角度探索发酵机制及其工艺[10]。
本研究概述了发酵技术及常用于发酵中药的真菌,并综述了中药化学成分(黄酮、生物碱、甾体、萜类、醌类、苯丙素)的转化机制,并总结了真菌发酵中药常见菌种在中药成分转化中的应用,以期进一步提高中药成分转化效果,为精准调控真菌发酵过程提供参考依据。
1 发酵技术及常用发酵中药的真菌
根据基质的不同,中药发酵技术主要分为液体发酵、固体发酵及双向发酵。固体发酵是指在几乎没有自由水存在的固态湿培养基(通常利用农副产品作为营养基质)进行发酵;液体发酵是将菌种接入含有中药材粉末或者中药化学成分的液体培养基中进行发酵;双向发酵是在液体发酵、固体发酵的基础上以含活性成分的中药为营养基质,提供真菌生长所需的碳、氮等养分,真菌的生长活动促使中药结构、成分发生改变,二者相互作用形成了新型“双向发酵”。此外,真菌发酵还可以根据培养基成分不同可分为单一基质发酵、添加培养剂发酵;根据物料添加方式不同又分为一次性添加、逐步添加;根据发酵容器不同又有摇瓶、发酵罐等,不同发酵技术的优缺点比较见表1。
表1 中药发酵技术的优缺点及发酵效果
Table 1 Advantages and disadvantages of Chinese medicine fermentation technology and fermentation effect

发酵方法 特征 优势 劣势 发酵效果固体发酵液体发酵双向发酵固态基质液态基质药性或全性基质发酵条件容易操作、产生废水少、容易处理;无需对营养基质灭菌、培养基原料多为天然基质或废渣,广泛易得,价格低廉;能源消耗量低,设备和技术较简易,投资较低[11]生产条件可量化;物质传递效率高;生产成本低;机械自动化程度高,可规模化生产将药用真菌与中药有机结合,产生大量的发酵组合,应用前景广阔培养周期长,体系开放而易污染其他杂菌;缺乏科学的发酵终点判断指标和质控指标,难以实现工业化生产成本高,技术能耗大,设备构造复杂;后期污染较多;转化率为5%[12]目前发酵机理不够明确,真菌和药性基质之间的相互作用缺乏科学完整的理论支撑转化率为20%~30%[12];产物分离提取困难[11]发酵产物稳定性高;可量化[13]常产生大量新的具有生物活性的发酵代谢产物[14]
发酵中药的真菌主要分为自然真菌、药用真菌和内生真菌。自然真菌大约有25万种,真菌内含丰富的酶,自身还可以产生多种次生代谢产物,具有提高机体抗氧化能力等功效。黑曲霉含有淀粉酶、酸性蛋白酶、果胶酶、纤维素酶、葡萄糖氧化酶、β-葡萄糖苷酶等,代谢产物有柠檬酸、葡糖酸及没食子酸等。此外,还有与酵母结构功能类似的白地霉[15]、导致柑橘类水果发生绿霉病的指状青霉(Penicillium digitatum)[16]以及波兰青霉[17](Penicillium polonicum)、短刺小克银汉霉[18]等,黑曲霉[19]、酵母菌[20]广泛应用于中药发酵。本身对疾病有防治或保健功效的真菌如灵芝、茯苓(Poria)、雷丸(Omphalia)、冬虫夏草(Ophiocordyceps sinensis)等被称为药用真菌,据统计我国正式入药的药用真菌总数约50种左右。以药用真菌为出发菌株、中药材为药性基质进行双向发酵从而获得更强活性的成分的研究报道较多,比如经红曲发酵后的金银花具有较强的自由基清除能力,其2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS+)自由基清除能力提高61.39%,1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力提高59.28%[21]。经灵芝发酵的刺五加提取物抗氧化活性显著增强[22]。朱红栓菌(Trametes cinnabarina(Jacq.)Fr.)发酵马钱子得到4个发酵新增成分,并推测与马钱子“减毒存效”有关[23]。内生真菌是一类生活在植物体内不引起可见病害,甚至有益植物生长的共生微生物[24]。内生真菌与植物之间存在微生态关系,与植物共同进化从而合成与宿主植物相同或类似的代谢产物,还可以利用内生真菌发酵生产中药活性物质。刘德柱等[25]研究内生真菌Fusarium-C39生物转化滇重楼使重楼总皂苷、重楼皂苷I、重楼皂苷II和重楼皂苷VII的含量分别提高60.01%、86.36%、75.60%、52.07%。BAI Y等[26]以抗氧化和降血糖活性为导向,从植物内生真菌布雷正青霉菌(Penicillium brefeldianum)F4a的发酵提取物中成功分离鉴定了3个新化合物,命名为peniorcinols A-C(1-3)。
2 真菌发酵中药成分转化机制
2.1 黄酮
黄酮类化合物以2-苯基色原酮为母核,多与糖结合成苷,苯环上常有羟基或甲氧基取代。不同真菌发酵生成的多种酶可以使黄酮发生脱糖基或糖基化反应,还可以发生选择性强的羟基化、去甲基化以及去羟基化反应。比如葡萄糖苷酶可将黄酮苷的葡萄糖基水解,反之,糖苷转移酶则使黄酮发生糖基化即苷化反应。红曲霉、黑曲霉、短刺小克银汉霉等真菌转化以黄酮为主要活性成分的中药,如葛根、陈皮[27]、淫羊藿已有报道。宋艳秋等[28]研究表明,葛根中的3′-甲氧基葛根素、3′-羟基葛根素、葛根素-4′-O-葡萄糖苷等异黄酮类物质被红曲霉YM3207在代谢过程中产生的葡萄糖苷酶等多种酶催化,分别发生了去甲基化、去羟基化以及去糖基化反应转化为葛根素。短刺小克银汉霉菌、柱孢梨头霉菌(Absidia cylindrospora)可将淫羊藿黄酮苷类化合物母核C7位上的葡萄糖基水解代谢,生成含有鼠李糖基的次级苷类化合物[29]。6-甲氧基黄酮在黑曲霉菌株KB、MB作用下,C6位脱甲基生成6-羟基黄酮,继而在C4′位羟基化生成6,4′-二羟基黄酮[30]。陈箐筠等[31]利用黑曲霉产生的葡萄糖苷酶和鼠李糖苷酶对芦丁进行生物转化,水解脱去葡萄糖和鼠李糖,获得苷元槲皮素的转化产率可达54.36%。早期黄酮的真菌发酵研究主要集中于利用糖苷酶定向修饰各类糖苷键,实现由糖苷向次级苷、苷元的转化。近年来,黄酮类化合物的生物合成途径的解析取得了巨大进展,利用酵母内源代谢系统提供原料和辅助因子,黄芩素、槲皮素、山奈酚异甘草素、甘草素及其糖苷化产物异甘草苷和甘草苷等具有显著药理活性的黄酮化合物的完整生物合成途径已经在酿酒酵母中重建[32]。
2.2 生物碱
生物碱是存在于生物体中的一类含负氧化态氮的碱性成分,真菌发酵产生的酯酶常选择性地催化部分酯键或酰基水解,羟化酶使生物碱的特定位置发生羟基化,氧化酶可以使其形成N-氧化物。常见中药有喜树碱、川乌、马钱子等,常用于转化生物碱的真菌有朱红栓菌、黑曲霉、短刺小克银汉霉等,苏建树等[33]用黑曲霉发酵川乌、附子,将乌头碱、新乌头碱及次乌头碱等剧毒性的双酯型二萜类生物碱中的酯键水解为毒性较小的单酯型生物碱。王磊等[34]研究表明,青霉菌能使喜树碱发生羟基化转化为10-羟基喜树碱,转化率为7.37%。潘扬等[23]从马钱子朱红栓菌(Trametes cinnabarina(Jacq.)Fr.)发酵品中分离得到16-甲氧基士的宁、士的宁氮氧化物、马钱子碱氮氧化物。目前,已经不仅仅局限于直接利用真菌发酵生物碱,已经发展到从植物内生菌中提纯重要的酶、克隆酶的基因进行定向发酵。
2.3 甾体
甾体是一类结构中具有环戊烷骈多氢菲母核的天然成分,真菌发酵可使该类化合物发生氧化、羟基化、脱糖基等反应,其中羟基化是甾体应用最多、最重要的微生物转化反应。真菌羟化酶利用分子态氧进行羟基化,而甾体母核及侧链结构中存在多个羟基化位点,比如C9、C11、C16、C17、C19和C26位均可以利用微生物进行羟基化修饰。常用于甾体类化合物转化的真菌有烟曲霉菌、灰色链霉菌等[35]。中药洋地黄、薯蓣的转化已有报道。徐银等[36]用雅致小克银汉霉对16α,17α-环氧黄体酮进行C11 α-羟基化。刘增兵等[37]用新月弯孢霉KA-91发酵将异羟基洋地黄毒苷元中3位羟基氧化成羰基从而转化为3-羰基异羟基洋地黄毒苷元。刘琳[38]利用哈茨木霉(Trichoderma harzianum)将薯蓣皂苷和盾叶新苷转化成薯蓣皂苷元,盾叶新苷在葡萄糖淀粉酶作用下先脱掉鼠李糖基,然后被胞外β-葡萄糖苷酶水解掉葡萄糖得延龄草次苷,延龄草次苷进入菌体胞内促使哈茨木霉产生胞内β-葡萄糖苷酶,进而水解脱去延龄草次苷末端的葡萄二糖,最终生成薯蓣皂苷元。目前,甾体化合物的真菌转化主要集中在A环C1,2位脱氢、11α-羟基化、11β-羟基化等传统化学合成难或者无法进行的反应[35]。特别是A环C1,2位脱氢反应不仅是甾体母核结构早期降解的重要步骤,且甾体化合物A环C1,2位引入双键后,其抗炎活性成倍增加。
2.4 萜类
萜类化合物在真菌作用下通常发生脱糖基、糖基化、羟基化、羰基化、乙酰化、酯化、环氧化反应。苷键结构会被糖苷酶水解脱去糖基,双键结构容易氧化生成相应的环氧结构,也容易生成邻二醇结构,羟基常被氧化成羰基。真菌如短刺小克银汉霉、溜曲霉、指状青霉等转化主要活性成分为萜类的中药如青蒿素、紫杉醇、人参已有报道。赵子璇等[39]利用筛选的一株产β-葡萄糖醛酸酶的黄曲霉HC-12对甘草进行了液体发酵,使甘草中甘草酸中的苷键水解转化为苷元即甘草次酸。甘草次酸经真菌如新月弯孢霉、华根霉、蝇卷霉、短刺小克银汉霉、假柱孢梨头霉、绿色粘帚霉、无根根霉、多型孢毛霉、短刺小克银汉霉转化,在C1、C6、C7、C15、C24、C27位发生羟基化反应,在C3和C7位发生羰基化反应,在C3和C30位上主要出现糖基化,乙酰化发生在C3位,酯化发生在C7与C27位之间并成环[40-45]。人体胃肠道对常量人参皂苷Rb1、Rb2、Rc、Rd、Re、Rf和Rg1的吸收差,而对人参皂苷的次级代谢产物稀有人参皂苷F1、F2、Rg3、Rh1、Rh2、Rh3、CY、CM和CK更容易吸收并发挥作用[46],张丽娜等[47]用溜曲霉将西洋参提取物中的常量人参皂苷脱去一分子鼠李糖和一分子葡萄糖转化为稀有人参皂苷Rh1。指状青霉可以转化单萜柠檬烯使其羟基化生成香气更浓、应用更为广泛、商业价值更高的香料α-松油醇[48-49]。黑曲霉将青蒿素转化为仍然具有完整过氧化桥的3,13-环氧青蒿素[50]。随着合成生物学和代谢工程的快速发展,越来越多的萜类化合物合成途径得以解析并重新构建于工程菌株中,近年来代谢改造酿酒酵母生产萜类化合物备受关注[51]。
2.5 醌类
醌类化合物具有调血脂、缓泻、利尿、抗肿瘤、保肝等功效。通过不同的真菌发酵可以使醌类化合物脱糖苷、糖苷化及羟基化。真菌如酵母菌、刺囊毛霉等转化以主要活性成分为醌类的中药如大黄已有报道。大黄中结合型蒽醌苷为泻下的主要有效成分,游离型蒽醌为抗菌、抗肿瘤等的主要有效成分,高洁等[52-53]研究表明,酵母菌可有效地将生大黄中结合型蒽醌苷去糖苷化转化成为游离型蒽醌,从而缓解大黄的泻下作用。蓝色梨头霉(Absidia coerutea)和刺囊毛霉(Mucor coerulea)对大黄酚、大黄素甲醚、大黄素、芦荟大黄素分别进行转化,在1,6,8位糖苷化得到相应的β-D-吡喃葡萄糖苷衍生物,刺囊毛霉还可以使大黄素的甲基转化成羟甲基生成羟基大黄素[54]。目前,中国科学院科学家团队利用土曲霉发酵大黄素-8-甲醚,对关键基因GedF和GedK进行展开研究,发现了一类双酶催化的蒽醌双加氧开环新机制[55],得出GedF基因首先催化还原大黄素-8-甲醚产生大黄素-8-甲醚氢醌,进而大黄素-8-甲醚氢醌在GedK基因的作用下开环产生desmethylsulochrin,这意味着醌类化合物的结构变化规律有新发现。
2.6 苯丙素
苯丙素类包含香豆素、木脂素,具有抗血小板凝集、抗血栓、护肝和调节睡眠等多种活性。真菌发酵可以使简单苯丙素类的羧基和羟基脱水发生内酯化从而生成香豆素,在羟化酶、氢化酶、氧化酶、糖基转移酶等的催化作用下发生羟基化、氢化、羰基化和糖基化反应。赵晨晖[56]通过在酿酒酵母中表达欧芹来源的4-香豆酰辅酶A连接酶(4CL)和拟南芥来源的阿魏酰辅酶A6′-羟化酶(F6′H1)实现了由阿魏酸发生内酯化生成东莨菪亭,F6′H1还可以羟基化东莨菪亭生成秦皮素。王鸿等[57]利用海洋毛霉属菌Mucor sp.MNP801将6,7-二甲氧基香豆素转化得到新产物即2-乙酰-4-乙酰氨基-5-硝基苯酚。苯丙素类化合物生物合成途径已经在酿酒酵母中重建,定向合成的研究理念也有了研究。
3 真菌在发酵中药的应用及其功效
真菌发酵中药的应用及其功效见表2。由表2可知,真菌常用黑曲霉、红曲霉、酵母菌等;真菌发酵可以使黄酮、生物碱、甾体、萜类、醌类、苯丙素等成分发生糖基化、羟基化、甲基化、氧化、还原、水解以及去甲基化、去羟基化、去糖基化等多种化学反应;在医药、食品、畜牧业具有广阔的应用前景。
表2 真菌发酵中药的应用及其功效
Table 2 Application and effect of traditional Chinese medicine by fungal fermentation
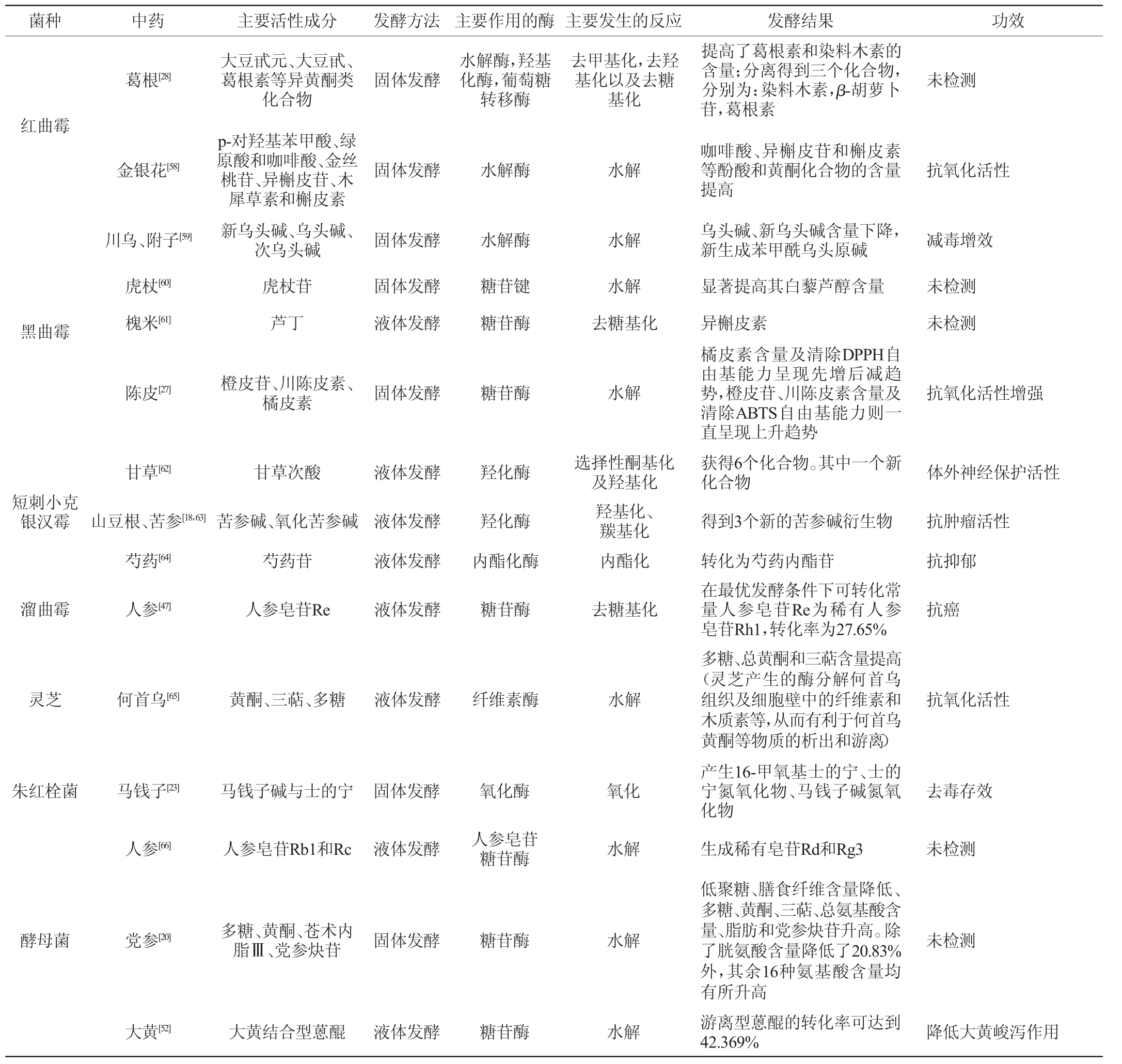
菌种 中药 主要活性成分 发酵方法 主要作用的酶 主要发生的反应 发酵结果 功效红曲霉黑曲霉短刺小克银汉霉溜曲霉灵芝葛根[28]大豆甙元、大豆甙、葛根素等异黄酮类化合物金银花[58]川乌、附子[59]虎杖[60]槐米[61]p-对羟基苯甲酸、绿原酸和咖啡酸、金丝桃苷、异槲皮苷、木犀草素和槲皮素新乌头碱、乌头碱、次乌头碱虎杖苷芦丁陈皮[27]橙皮苷、川陈皮素、橘皮素甘草[62]甘草次酸山豆根、苦参[18,63]芍药[64]苦参碱、氧化苦参碱芍药苷人参[47]人参皂苷Re何首乌[65]黄酮、三萜、多糖固体发酵固体发酵固体发酵固体发酵液体发酵固体发酵液体发酵液体发酵液体发酵液体发酵液体发酵水解酶,羟基化酶,葡萄糖转移酶水解酶水解酶糖苷键糖苷酶糖苷酶羟化酶羟化酶内酯化酶糖苷酶纤维素酶去甲基化,去羟基化以及去糖基化水解水解水解去糖基化水解选择性酮基化及羟基化羟基化、羰基化内酯化去糖基化水解提高了葛根素和染料木素的含量;分离得到三个化合物,分别为:染料木素,β-胡萝卜苷,葛根素咖啡酸、异槲皮苷和槲皮素等酚酸和黄酮化合物的含量提高乌头碱、新乌头碱含量下降,新生成苯甲酰乌头原碱显著提高其白藜芦醇含量异槲皮素橘皮素含量及清除DPPH自由基能力呈现先增后减趋势,橙皮苷、川陈皮素含量及清除ABTS自由基能力则一直呈现上升趋势获得6个化合物。其中一个新化合物得到3个新的苦参碱衍生物转化为芍药内酯苷在最优发酵条件下可转化常量人参皂苷Re为稀有人参皂苷Rh1,转化率为27.65%多糖、总黄酮和三萜含量提高(灵芝产生的酶分解何首乌组织及细胞壁中的纤维素和木质素等,从而有利于何首乌黄酮等物质的析出和游离)未检测抗氧化活性减毒增效未检测未检测抗氧化活性增强体外神经保护活性抗肿瘤活性抗抑郁抗癌抗氧化活性朱红栓菌 马钱子[23]人参[66]酵母菌 党参[20]大黄[52]马钱子碱与士的宁人参皂苷Rb1和Rc多糖、黄酮、苍术内脂Ⅲ、党参炔苷大黄结合型蒽醌固体发酵液体发酵固体发酵液体发酵氧化酶人参皂苷糖苷酶糖苷酶糖苷酶氧化水解水解水解产生16-甲氧基士的宁、士的宁氮氧化物、马钱子碱氮氧化物生成稀有皂苷Rd和Rg3低聚糖、膳食纤维含量降低、多糖、黄酮、三萜、总氨基酸含量、脂肪和党参炔苷升高。除了胱氨酸含量降低了20.83%外,其余16种氨基酸含量均有所升高游离型蒽醌的转化率可达到42.369%去毒存效未检测未检测降低大黄峻泻作用
续表

菌种 中药 主要活性成分 发酵方法 主要作用的酶 主要发生的反应 发酵结果 功效青霉菌米曲霉三七[67]淡豆豉[68]三七皂苷大豆异黄酮固体发酵固体发酵糖苷酶糖苷酶水解水解原生苷R1、Rg1、Re以及Rb1的含量均有不同程度的降低,而极性较低的稀有皂苷含量均有大幅度的提高大豆苷元和糖类未检测增加其发汗解表、开胃消食的功效
4 结语
目前真菌发酵中药的主要方式有固体发酵、液体发酵和双向发酵;常用的真菌有黑曲霉、红曲霉、酵母菌等;真菌发酵可以使黄酮、生物碱、甾体、萜类、醌类、苯丙素等成分发生糖基化、羟基化、甲基化、氧化、还原、水解以及去甲基化、去羟基化、去糖基化等多种化学反应。然而,目前尚存在一些问题,自然界的真菌种类较多,发酵条件各异,部分真菌对成分的转化机制和转化规律并不完全明确,转化程度及转化产物的有效性评价需要更为科学的标准,以利于对优良菌株的选育和应用,此外,中药生态环境包含着一个复杂的微生态系统,目前研究大多集中于采用单一真菌转化中药,后期还有待加强混合菌发酵中药的相关研究和应用。为了提高真菌发酵中药的可控性、稳定性,可以通过微生物组学技术分析真菌并筛选出合适菌种,经过代谢工程技术的改造为中草药发酵提供更有效的酶或真菌,优化发酵过程以提高生物活性成分产率。对发酵机制进行深入研究有利于筛选用于中草药发酵的高效酶和益生菌株,有助于优化发酵工艺条件,进一步提高真菌发酵中药的可控性、稳定性。
[1]刘玉峰,胡延喜,王志萍,等.肠道菌群对中药有效成分的生物转化研究进展[J].辽宁大学学报(自然科学版),2017,44(4):325-332.
[2]明文森,黄微,曾刚元,等.抗生素替代品——中草药饲料添加剂的应用研究[J].畜禽业,2010(6):18-19.
[3]王静涵,张斯童,滕利荣,等.益生菌发酵中药的研究现状及产品开发[J].食品工业科技,2020,41(14):337-343,348.
[4]李艳凤,翟梦颖,李雨昕,等.发酵法在中药研究中的应用[J].医学综述,2020,26(4):753-757.
[5]李秋月,林连兵,杨雪娇,等.微生物发酵中草药的研究现状[J].微生物学通报,2021,48(6):2232-2244.
[6]牛迪,刘华云,葛丛丛,等.不同中草药饲料添加剂对银狐毛皮品质及血液生化指标的影响[J].黑龙江畜牧兽医,2021(6):124-128.
[7]袁松竹,王斌,周旋,等.稀有人参皂苷生物转化的研究进展[J].食品工业科技,2023,44(12):480-489.
[8]李璐,亓正良,刘新利.生物碱类中药成分微生物转化研究进展[J].齐鲁工业大学学报,2022,36(2):6-12.
[9]罗建伟,武琪琪,郭雨悦,等.中药活性成分的药用真菌生物转化研究进展[J].化学与生物工程,2023,40(6):1-7.
[10]马定财,王毛毛,王哲,等.补益类中药发酵方面研究进展[J/OL].中成药,1-6[2023-12-24]http://kns.cnki.net/kcms/detail/31.1368.R.20230927.1032.002.html.
[11]谷军,张小彦.固态发酵技术应用及进展[J].中国调味品,2019,44(10):197-200.
[12]ZHANG X L,MIAO Q,PAN C X,et al.Research advances in probiotic fermentation of Chinese herbal medicines[J].Imeta,2023,2(2):93.
[13]张蕊多,刘焕焕,郭枫,等.不同诱导因子对灵芝菌液体发酵的影响研究进展[J].中国酿造,2017,36(11):15-19.
[14]许彬,尹圣化,王振泉,等.不同有机氮源对山药-食药用真菌“双向发酵”的影响[J].中国酿造,2019,38(8):108-113.
[15]武月冉,包暄,尹鑫涛,等.开菲尔源白地霉包埋姜黄素工艺及稳定性研究[J].食品与发酵工业,2021,47(18):237-242.
[16]MOLINA G,PINHWEIRO D M,PIMENTEL M R,et al.Monoterpene bioconversion for the production of aroma compounds by fungi isolated from Brazilian fruits[J].Food Sci Biotech,2013,22(4):999-1006.
[17]XU X Y,HAO R X,XU H,et al.Removal mechanism of Pb(II)by Penicillium polonicum:immobilization,adsorption,and bioaccumulation[J].Sci Rep,2020,10(1):9079.
[18]孙莉,钱生勇,冒小平,等.苦参碱衍生物的生物转化制备及其抗肿瘤活性研究[J].药学与临床研究,2017,25(1):24-26.
[19]吴德超,赵正权,李运芝,等.黑曲霉转化中药化学成分研究进展[J].中国药学杂志,2022,57(14):1153-1160.
[20]王燕萍,贾旭森,牛伟霞,等.新鲜党参酵母菌固体发酵工艺优化及其有效成分、抗氧化活性研究[J].中成药,2022,44(11):3428-3433.
[21]王懿文,谢纯良,朱作华,等.黑曲霉固态发酵对金银花多酚类物质释放及增效作用[J].食品研究与开发,2023,44(22):23-29.
[22]孙琳,井长欣,邹睿,等.刺五加-灵芝双向固体发酵工艺优化及抗氧化活性评价[J].科学技术与工程,2023,23(21):9004-9014.
[23]潘扬,张弦,刘亮镜,等.马钱子发酵品中生物碱化学成分研究[J].中草药,2012,43(3):452-457.
[24]殷子喻,施桂萍,马莉,等.滇重楼内生菌研究进展[J].中药材,2022,45(12):3031-3036.
[25]刘德柱,陈艺扬,张蒙,等.内生真菌生物转化提高滇重楼皂苷含量及抗肿瘤作用研究[J].中草药,2022,53(14):4486-4492.
[26]BAI Y,YI P,ZHANG S Y,et al.Novel antioxidants and α-glycosidase and protein tyrosine phosphatase 1B inhibitors from an endophytic fungus Penicillium brefeldianum F4a[J].J Fungi,2021,7(11):913.
[27]杨丹,杨放晴,燕娜娜,等.黑曲霉发酵对陈皮黄酮类成分及抗氧化活性的影响[J].食品科技,2019,44(12):23-27.
[28]宋艳秋,陈有为.葛根的红曲霉转化产物化学成分分析[J].天然产物研究与开发,2013,25(11):1525-1528.
[29]张宇航,陈旺,冯自立,等.淫羊藿黄酮苷类化合物生物转化的研究进展[J].中国药房,2022,33(12):1525-1529.
[30]KOSTRZEWA-SUSLOW E,DMOCHOWSKA-GLADYSZ J,JANECZKO T, et al.Microbial transformations of 6-and 7-methoxyflavones in Aspergillus niger and Penicillium chermesinum cultures[J].Z Naturforsch C,2012,67(7-8):411-417.
[31]陈箐筠,张迎庆,干信,等.黑曲霉As3.4309发酵转化芦丁的研究[J].生物技术,2009,19(2):88-91.
[32]李妍芃.甘草主要黄酮成分生物合成途径完整解析及在酵母中的从头合成研究[D].北京:北京中医药大学,2019.
[33]苏建树,刘白宁,田平芳,等.微生物发酵对川乌、附子中生物碱含量的影响[J].北京化工大学学报(自然科学版),2010,37(3):97-101.
[34]王磊,龙秀锋,肖青,等.一株10-羟基喜树碱转化内生菌的筛选及鉴定[J].生物技术,2014,24(1):80-85.
[35]贾红晨,李芳,郑鑫铃,等.甾体微生物转化反应关键酶3-甾酮-Δ~1-脱氢酶的研究进展[J].微生物学通报,2020,47(7):2218-2235.
[36]徐银,陈小龙,郑裕国.雅致小克银汉霉对16α,17α-环氧黄体酮的C11α-羟基化的工艺研究[J].中国生化药物杂志,2009,30(4):239-242.
[37]刘增兵,孙华,和朝军,等.新月弯孢霉KA-91转化异羟基洋地黄毒苷元的研究[J].化学与生物工程,2010,27(4):57-60.
[38]刘琳.哈茨木霉生物转化盾叶薯蓣中的皂苷及其产物提取分离[D].大连:大连理工大学,2010.
[39]赵子璇,李春峰,杨洪旺,等.五环三萜类化合物微生物转化研究进展[J].天然产物研究与开发,2021,33(8):1415-1426.
[40]MA Y,LIU J M,CHEN R D,et al.Microbial transformation of glycyrrhetinic acid and potent neural anti-inflammatory activity of the metabolites[J].Chinese Chem Lett,2017,28(6):1200-1204.
[41]和朝军,孙华,李鹏举,等.新月弯孢霉KA-91对甘草次酸的转化研究[J].药物生物技术,2011,18(3):238-241.
[42]FAN B Y, JIANG B C, YAN S S, et al.Anti-inflammatory 18β-glycyrrhetinin acid derivatives produced by biocatalysis[J].Planta Med,2019,85(1):56-61.
[43]XIU X L,YANG G W,GOU Z P,et al.Structural determination of two new triterpenoids biotransformed from glycyrrhetinic acid by Mucor polymorphosporus[J].Magn Reson Chem,2010,48(2):164-167.
[44]XU S H,CHEN H L,FAN Y,et al.Application of tandem biotransformation for biosynthesis of new pentacyclic triterpenoid derivatives with neuroprotective effect[J].Bioorg Med Chem Lett,2020,30(4):126947.
[46]章沙沙,张海玲,叶静,等.稀有人参皂苷微生物转化研究进展[J].特产研究,2021,43(2):91-96.
[47]张丽娜,明有山,曲波权,等.微生物转化人参皂苷Re为人参皂苷Rh1的研究[J].中国酿造,2017,36(11):114-117.
[48]张璐璐,范刚,李晓,等.指状青霉DSM62840生物转化柠檬烯生产α-松油醇过程中关键酶的分离纯化及质谱鉴定[J].食品科学,2022,43(4):88-94.
[49]张璐璐,范刚,何进,等.柠檬烯微生物转化及其相关酶的研究进展[J].食品工业科技,2019,40(12):317-325,330.
[50]LUO J E, MOBLEY R, WOODFINE S, et al.Biotransformation of artemisinin to a novel derivative via ring rearrangement by Aspergillus niger[J].Appl Microbiol Biot,2022,106(7):2433-2444.
[51]陈明凯,叶丽丹,于洪巍.代谢改造酿酒酵母合成萜类化合物的研究进展[J].生物工程学报,2021,37(6):2085-2104.
[52]高洁,董文宾,王勇,等.陕产大黄结合型蒽醌转化游离型蒽醌的发酵条件优化[J].中医药导报,2017,23(9):59-61,65.
[53]马超,胡珊,李学如,等.酵母转化大黄结合型蒽醌研究[J].世界科学技术-中医药现代化,2013(6):1333-1337.
[54]ZHANG W, YE M, ZHAN J X, et al.Microbial glycosylation of four free anthraquinones by Absidia coerulea[J].Biotechnol lett, 2004, 26:127-131.
[55]QI F F,ZHANG W,XUE Y Y,et al.Bienzyme-catalytic and dioxygenation-mediated anthraquinone ring opening[J].J Am Chem Soc, 2021,143(40):16326-16331.
[56]赵晨晖.设计构建酿酒酵母转化木质素生产香豆素类化合物[D].天津:天津大学,2020.
[57]王鸿,倪建良,曹小吉,等.海洋毛霉属真菌Mucor sp.MNP801转化天然香豆素后的挥发性成分研究[J].中国海洋药物,2010,29(5):6-9.
[58]徐文流,贝琦,梁诗雅,等.红曲霉发酵提高金银花的抗氧化活性[J].现代食品科技,2020,36(9):47-53,163.
[59]孙鹏,李玲,吴丽,等.基于生物转化的附子减毒增效考察[J].中国实验方剂学杂志,2012,18(22):16-19.
[60]王卫,李小沛,曾柏全,等.虎杖固体发酵生产白藜芦醇工艺条件优化研究[J].林产化学与工业,2011,31(6):91-94.
[61]邬子彬,刘科梅,胡基志,等.黑曲霉所产α-L-鼠李糖苷酶酶学性质及其在异槲皮素制备上应用[J].食品工业科技,2018,39(1):107-111,116.
[62]马媛,谢丹,王照华,等.短刺小克银汉霉对甘草次酸的微生物转化[J].中国中药杂志,2015,40(21):4212-4217.
[63]顾湘,倪美鑫,冒小平,等.氧化苦参碱衍生物的生物转化制备及其抗肿瘤活性研究[J].西北药学杂志,2017,32(6):711-714.
[64]施敏,马晓彤,曹学丽,等.基于短刺小克银汉霉的芍药苷转化芍药内酯苷研究[J].中国医药生物技术,2018,13(2):178-184.
[65]辛燕花,张铁丹,张建华,等.灵芝-何首乌双向液体发酵菌质抗氧化活性研究[J].食用菌学报,2018,25(3):63-71.
[66]李东霄,邓小莉,王改霞,等.酵母菌对高含量人参皂苷的转化及其分子鉴定[J].江苏农业学报,2013,29(1):33-38.
[67]许文迪,闫炳雄,邱智东,等.青霉菌固体发酵对三七药材活性成分的影响[J].长春中医药大学学报,2015,31(6):1123-1124.
[68]陈小林,赵敏,邵丽芳,等.米曲霉TJTSW001及其在中药淡豆豉发酵中的应用:CN201410166284.1[P].2016-06-29.