随着畜禽养殖集约化、抗生素无节制使用,引起了细菌耐药性[1]、药物残留[2]等问题,还可能向人体转移,引发生殖障碍、癌症等疾病[3],造成普通大众对畜禽产品安全的恐慌。瑞典、欧盟、美国等发达国家早已出台法律禁止抗生素在畜禽养殖中添加[4]。2020年,中国也全面实行畜禽养殖禁止抗生素添加政策。随着各国禁抗政策的出台,各种代替抗生素产品也迎来了机遇,益生菌微生态制剂作为一种新兴的新型畜禽养殖添加剂[5],能够有效地平衡胃肠道微生态,提高畜禽机体健康[6],并且无残留、无公害的优点[7],逐渐成为替代产品中的优质选择。
酿酒酵母(Saccharomyces cerevisiae)是人类利用最早的微生物[8],含有丰富的蛋白质、人体必需的8种氨基酸、多种维生素、矿物元素、微量元素和生理活性物质等[9],由于其生长繁殖快、容易进行大规模培养[10]等优点,被广泛应用于食品[11]、医药[12]、畜禽养殖[13]等领域。提高菌体产量是酿酒酵母微生态制剂应用的基础,优化酿酒酵母发酵培养基,对于其产品的大范围应用具有重大意义。国内外对酿酒酵母培养基优化已有较多的报道。PARK B G等[14]在内置膜过滤反应器内连续培养酿酒酵母,得到的细胞干质量(dry cell mass,DCM)为13 g/(L·h)。张蕾等[15]优化酿酒酵母培养基后获得酿酒酵母的菌体干质量达到17.5 g/L,李俊杰等[16]优化富硒产肮假丝酵母培养基后的酵母生物量为11.21 g/L,陈雪等[17]通过优化以糖蜜为碳源的酿酒酵母培养基后菌体干质量达7.67 g/L。这对提高酿酒酵母菌体产量,降低其作为微生态制剂的应用成本,达到普通大众对畜禽产品安全感的需求具有重要意义。
本研究以酿酒酵母常用的酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基为基础培养基,采用单因素试验筛选酿酒酵母培养基的基础上,以酿酒酵母菌体干质量(DCM)为响应值,基于响应面法对其培养基成分进行优化,以期提高酿酒酵母菌体产量,为酿酒酵母大规模使用提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌种
酿酒酵母(Saccharomyces cerevisiae):由本试验室筛选保藏。
1.1.2 试剂
葡萄糖、蔗糖、红糖、蛋白胨、牛肉膏、酵母膏、尿素、硫酸铵、硝酸铵、氯化铵、磷酸二氢钠、磷酸氢二钾、氯化钙、硫酸镁、硫酸锌、硫酸锰、硫酸铜、维生素B1(vitamin B1,VB1)、VB2、VB3、VB5、VB6、VB7、VB9:国药集团化学试剂有限公司;糖蜜、酵母粉、酵母抽提物:安琪酵母股份有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
种子培养基和发酵基础培养基均采用酵母浸出粉胨葡萄糖(YPD)培养基[18]:葡萄糖20 g/L、蛋白胨20 g/L、酵母粉10 g/L,121 ℃灭菌30 min。
1.2 仪器与设备
BX-240H电子天平:日本岛津公司;PHS-3C型精密pH计:上海雷磁仪器厂;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-1D型超净工作台:苏州苏净净化有限公司;HZQ-X100型振荡培养箱:哈尔滨市东联电子技术开发有限公司;HC-2518R高速冷冻离心机:科大创新有限公司中佳分公司。
1.3 方法
1.3.1 发酵液的制备
种子液:从斜面培养基挑取1环酿酒酵母菌株接种于装液量为100 mL/500 mL的YPD培养基中,28 ℃、180 r/min条件下振荡培养16 h,至OD600nm值=1.2~1.4。
发酵液:将上述活化种子液按照5%(V/V)接种量接种于装液量为100 mL/500 mLpH 7.0发酵培养基中,在28 ℃、180 r/min条件下振荡培养48 h,检测酵母菌体干质量。
1.3.2 酿酒酵母培养基组分优化
(1)单因素试验
分别考察碳源种类(葡萄糖、蔗糖、红糖、糖蜜)及添加量(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L)、有机氮源种类(蛋白胨、酵母抽提物、牛肉膏、酵母膏)及添加量(5 g/L、10 g/L、20 g/L、30 g/L、40 g/L)、无机氮源种类(尿素、硫酸铵、硝酸铵、氯化铵)及添加量(1 g/L、2 g/L、3 g/L、4 g/L、5 g/L)、0.1 g/L无机盐种类(磷酸二氢钠、磷酸氢二钾、氯化钙、硫酸镁、硫酸锌、硫酸锰、硫酸铜)、维生素种类(VB1、VB2、VB3、VB5、VB6、VB7、VB9)(添加量均为0.1 g/L)对酵母菌体干质量的影响。
(2)Plackett-Burman试验
将初始发酵培养基中的9个组分作为影响因素进行全面考察[19],试验因素为葡萄糖(A)、酵母抽提物(B)、硫酸铵(C)、磷酸氢二钾(D)、氯化钙(E)、硫酸锌(F)、硫酸锰(G)、VB1(H)、VB7(I),每个因素取高低2个水平,选择n=17的Plackett-Burman的试验设计,Plackett-Burman试验设计因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman tests
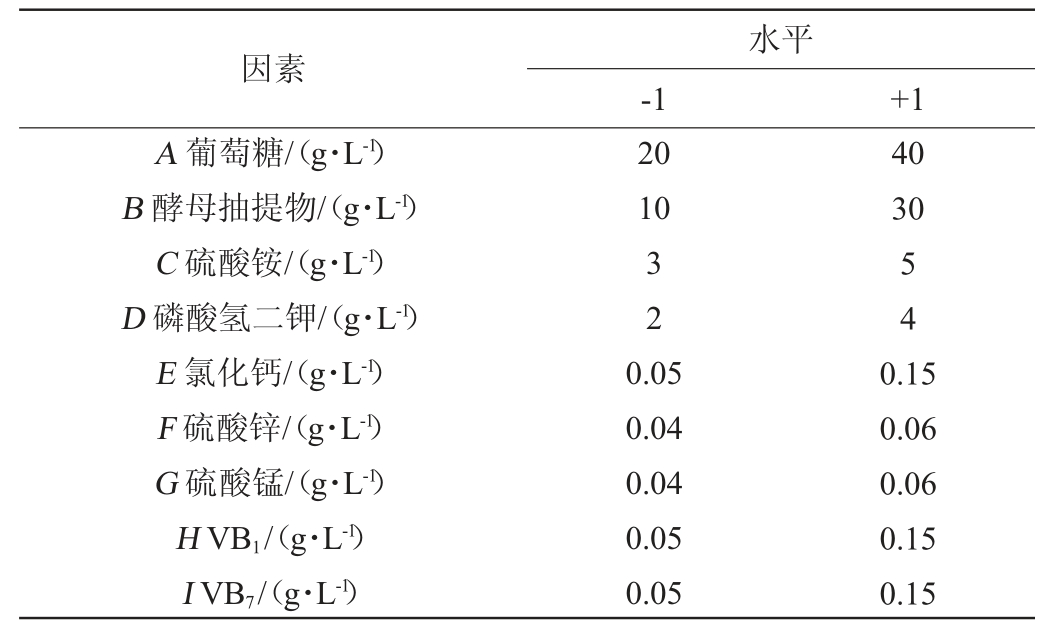
因素A 葡萄糖/(g·L-1)B 酵母抽提物/(g·L-1)C 硫酸铵/(g·L-1)D 磷酸氢二钾/(g·L-1)E 氯化钙/(g·L-1)F 硫酸锌/(g·L-1)G 硫酸锰/(g·L-1)H VB1/(g·L-1)I VB7/(g·L-1)水平-1 +1 20 10 40 30 32 54 0.05 0.04 0.04 0.05 0.05 0.15 0.06 0.06 0.15 0.15
(3)最陡爬坡试验
根据Plackett-Burman筛选结果,按照显著影响因素效应的大小及其与响应值之间的相关系数确定各影响因素的步长和变化方向,从而以最快的速度靠近最佳区域[20]。根据最陡爬坡试验结果找到酿酒酵母菌体干质量最高的组合,为响应面分析的中心点。
(4)Box-Behnken试验
根据Plackett-Burman试验结果,以菌体干质量(Y)为响应值,以葡萄糖添加量(A)、酵母抽提物添加量(B)、硫酸铵添加量(C)为自变量,将最陡爬坡试验中所获得的各影响因素的最佳值作为中心点,利用中心组合设计方法设计Box-Behnken试验[21],Box-Behnken试验设计因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken tests

因素A 葡萄糖添加量/(g·L-1)B 酵母抽提物添加量/(g·L-1)C 硫酸铵添加量/(g·L-1)-1水平0 1 45 35 2 47.5 37.5 2.25 50 40 2.5
1.3.3 分析检测
菌体干质量的检测:将酵母发酵液6000r/min离心5min,用蒸馏水洗涤菌体2次,105℃烘干至质量恒定[22]。
1.3.4 数据处理与分析
采用Design-Expert8.0进行数据处理与分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 碳源的确定
碳源对酵母菌体干质量的影响见图1。由图1可知,不同碳源对酵母菌体干质量的影响顺序为葡萄糖>红糖>糖蜜>蔗糖,葡萄糖为发酵培养基碳源时可促进酵母菌体干质量的提高,为5.25 g/L。因此,碳源选择葡萄糖。碳源添加量对酵母菌体干质量的影响见图2。由图2可知,随着葡萄糖添加量在10~50 g/L范围内的增加,酵母菌体干质量均呈先上升后下降的趋势,葡萄糖添加量为30 g/L时,酵母菌体干质量达到最高值,为6.67 g/L。因此,选择发酵培养基碳源为葡萄糖30 g/L进行后续试验。
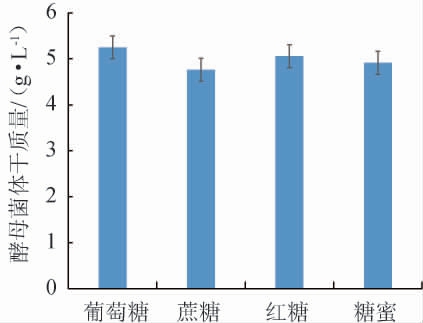
图1 碳源种类对酵母菌体干质量的影响
Fig.1 Effects of carbon source types on the dry mass of yeast
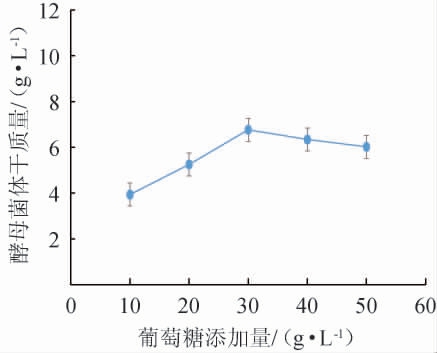
图2 碳源添加量对酵母菌体干质量的影响
Fig.2 Effects of carbon source addition on the dry mass of yeast
2.1.2 氮源的确定
不同氮源对酵母菌体干质量的影响见图3。由图3可知,不同有机氮源对酵母菌体干质量的影响为酵母抽提物>蛋白胨>牛肉膏>酵母膏,以酵母抽提物为发酵培养基唯一氮源时,酵母菌体干质量最高为10.96 g/L;不同无机氮源对酵母菌体干质量的影响为硫酸铵>硝酸铵>尿素>氯化铵,以硫酸铵为发酵培养基唯一氮源时,酵母菌体干质量最高为11.83 g/L。因此,氮源选择酵母抽提物和硫酸铵。氮源添加量对酵母菌体干质量的影响见图4。由图4可知,随着酵母抽提物和硫酸铵添加量的增加,酵母菌体干质量均呈先上升后下降的趋势,酵母抽提物添加量为20 g/L时,酵母菌体干质量最高为10.96 g/L;硫酸铵添加量为4 g/L时,酵母菌体干质量最高为12.54 g/L。因此,选择发酵培养基氮源为酵母抽提物20 g/L、硫酸铵4 g/L进行后续试验。
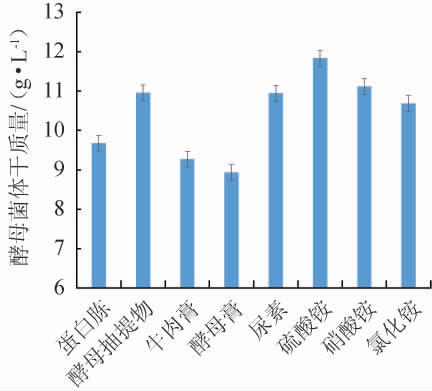
图3 氮源种类对酵母菌体干质量的影响
Fig.3 Effects of nitrogen source types on the dry mass of yeast
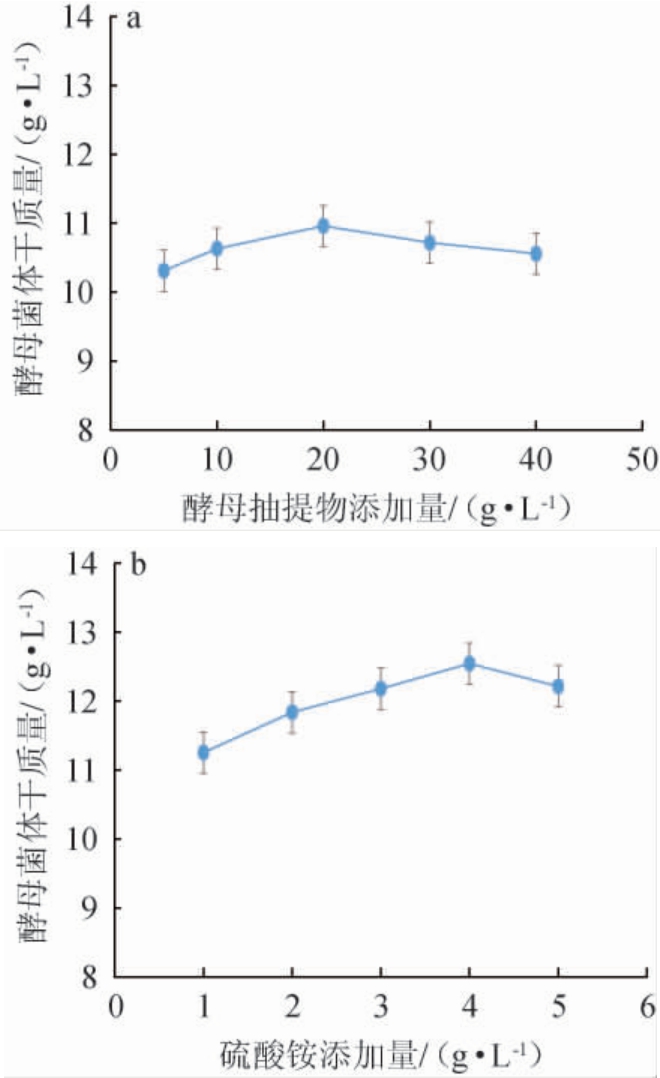
图4 酵母抽提物(a)及硫酸铵(b)添加量对酵母菌体干质量的影响
Fig.4 Effects of yeast extract (a) and ammonium sulfate addition (b)on dry quality of yeast
2.1.3 无机盐的确定
不同无机盐对酵母菌体干质量的影响见图5。
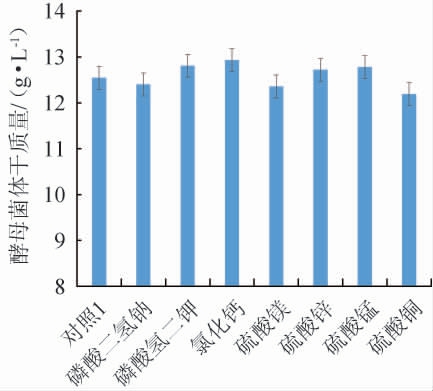
图5 无机盐种类对酵母菌体干质量的影响
Fig.5 Effects of inorganic salt types on the dry mass of yeast
由图5可知,磷酸氢二钾、氯化钙、硫酸锌、硫酸锰促进了酵母菌体干质量的增加,磷酸二氢钠、硫酸镁、硫酸铜对酵母菌体干质量的增加没有明显作用。选择对酵母菌体干质量有促进作用的无机盐添加量逐一进行试验,结果见如图6。由图6可知,随着各种无机盐添加量的增加,菌体干质量均呈先上升后下降的趋势。因此,最佳发酵培养基中各无机盐添加量为磷酸氢二钾3 g/L、氯化钙0.1 g/L、硫酸锌0.05 g/L、硫酸锰0.05 g/L。
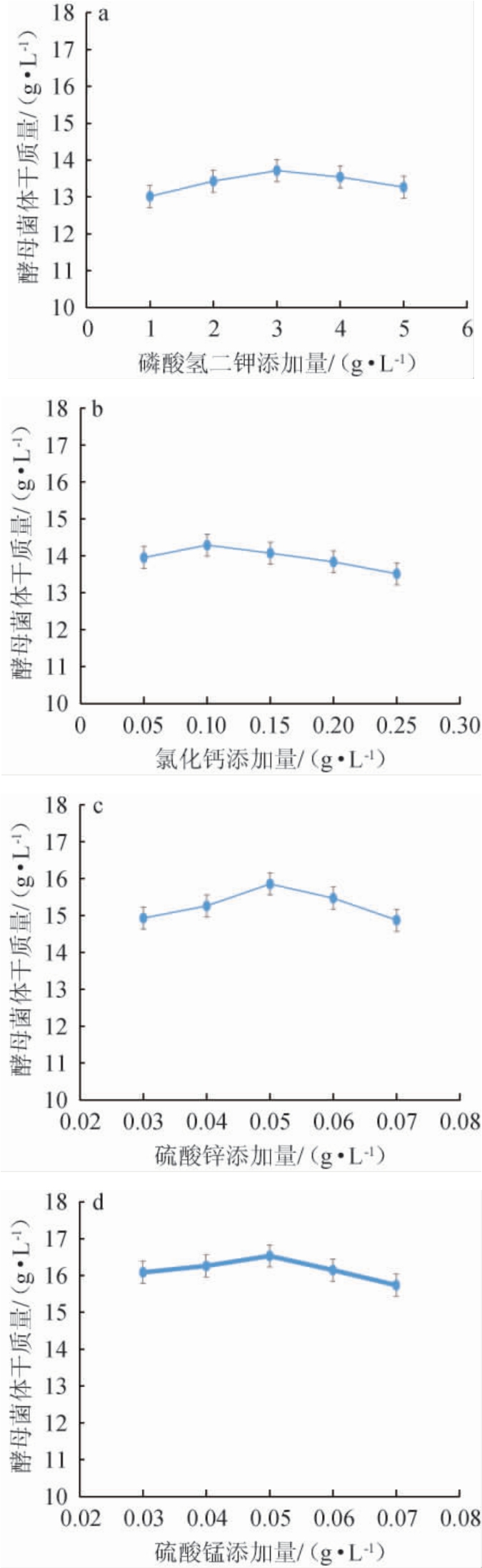
图6 无机盐添加量对酵母菌体干质量的影响
Fig.6 Effects of inorganic salt addition on the dry mass of yeast
2.1.4 维生素的确定
不同维生素对酵母菌体干质量的影响见图7。由图7可知,维生素VB1、VB7促进了酵母菌体干质量的升高,分别为17.45 g/L和17.63 g/L,维生素VB2、VB3、VB5、VB6、VB9对酵母菌体干质量的增加没有明显作用,所以发酵培养基添加维生素VB1和VB7。随着维生素VB1、VB7添加量的增加,菌体干质量呈先上升后下降的趋势,VB1添加量为0.1 g/L时,酵母菌体干质量最高为17.45 g/L;在VB1添加0.1 g/L的基础上,VB7添加量为0.1 g/L时,酵母菌体干质量最高为19.26 g/L。因此,发酵培养基维生素添加量为VB10.1 g/L和VB70.1 g/L。
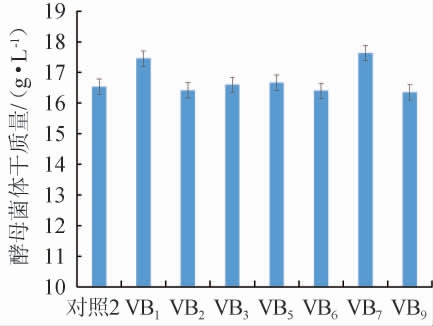
图7 维生素种类对酵母菌体干质量的影响
Fig.7 Effect of vitamin types on the dry mass of yeast
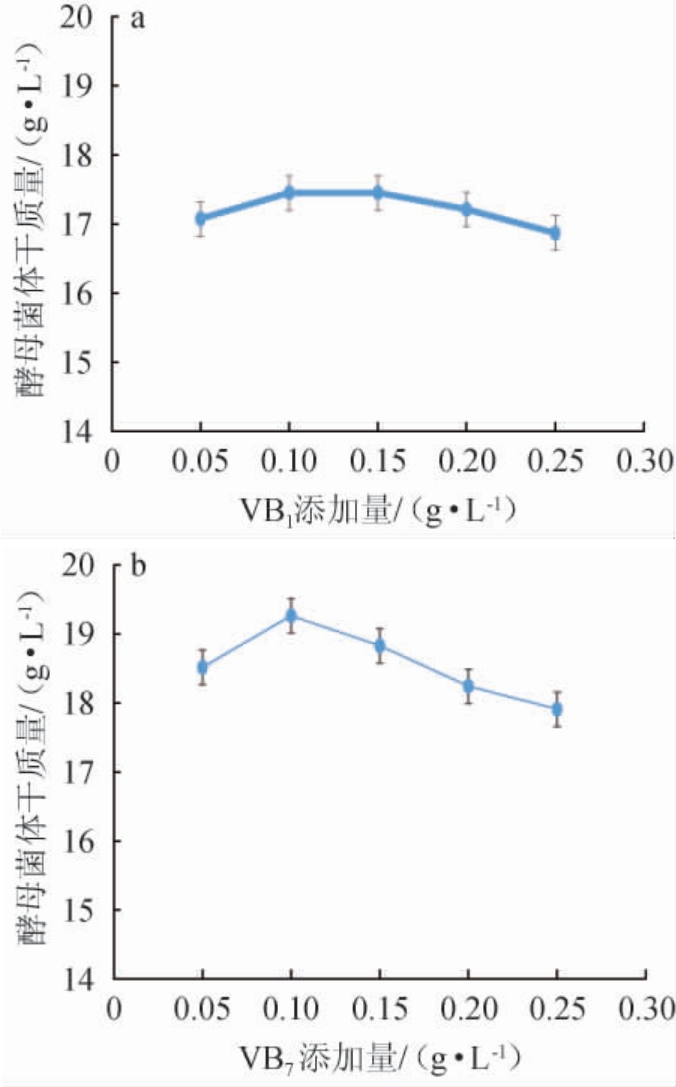
图8 维生素VB1(a)和VB7(b)添加量对酵母菌体干质量的影响
Fig.8 Effects of vitamin VB1(a) and VB7(b) addition on the dry mass of yeast
2.2 Plackett-Burman试验设计结果与分析
以葡萄糖(A)、酵母抽提物(B)、硫酸铵(C)、磷酸氢二钾(D)、氯化钙(E)、硫酸锌(F)、硫酸锰(G)、VB1(H)、VB7(I)为考察因素,Plackett-Burman试验设计及结果见表3,方差分析见表4。
表3 Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman tests
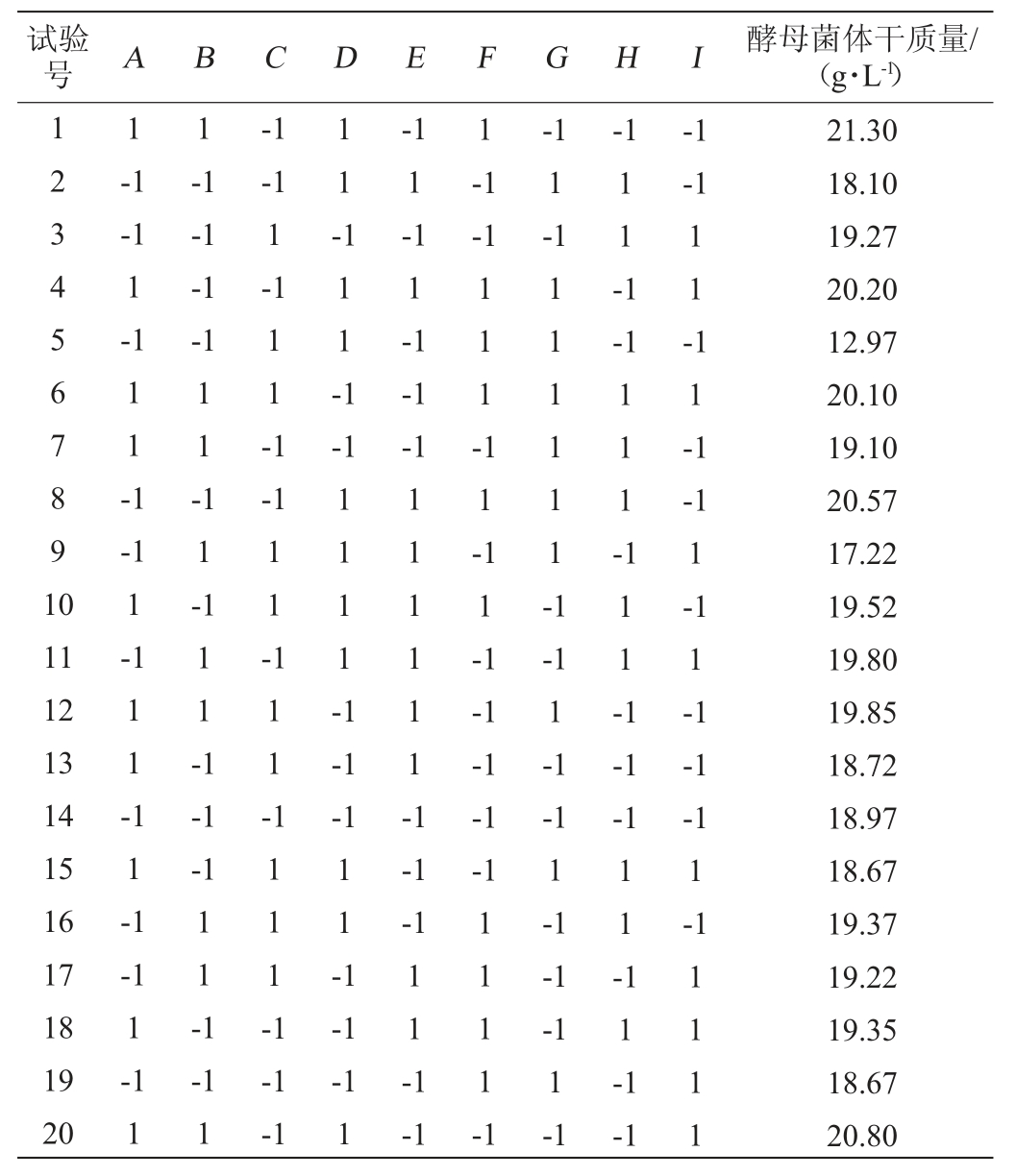
试验号 A B C D E F G H I 酵母菌体干质量/(g·L-1)1234567891 0 1 1 1-1-1-1 1-1-1-1-1-1-1-1 1-1 1 1--1-1-1 1-1 1 1 -1-1-1 11-1 111-1-1 1-1 1-1-1-1 111-111111-1-1 1 1 -1 1 -1 11--1 11-1 11--1 11-111-11 12 13 14 15 16 17 18 19 20-1 1-1 1 1-11-1 1 1 -111-1 1111-1 111-1 11-1-1-1 111--1-1 111111-1-1-1-1-1-1-1-1 1-1 1-1-1-1 1-1 1111-1 11-1 11-1-1-1-1 1-1 1 1 1 --1 1-1-1-1-1 1 11-1 11-1-1 1111-1-1 1-1-1 1-1-1-1 1-1-1 1111 21.30 18.10 19.27 20.20 12.97 20.10 19.10 20.57 17.22 19.52 19.80 19.85 18.72 18.97 18.67 19.37 19.22 19.35 18.67 20.80
表4 Plackett-Burman试验方差分析结果
Table 4 Variance analysis results of Plackett-Burman tests
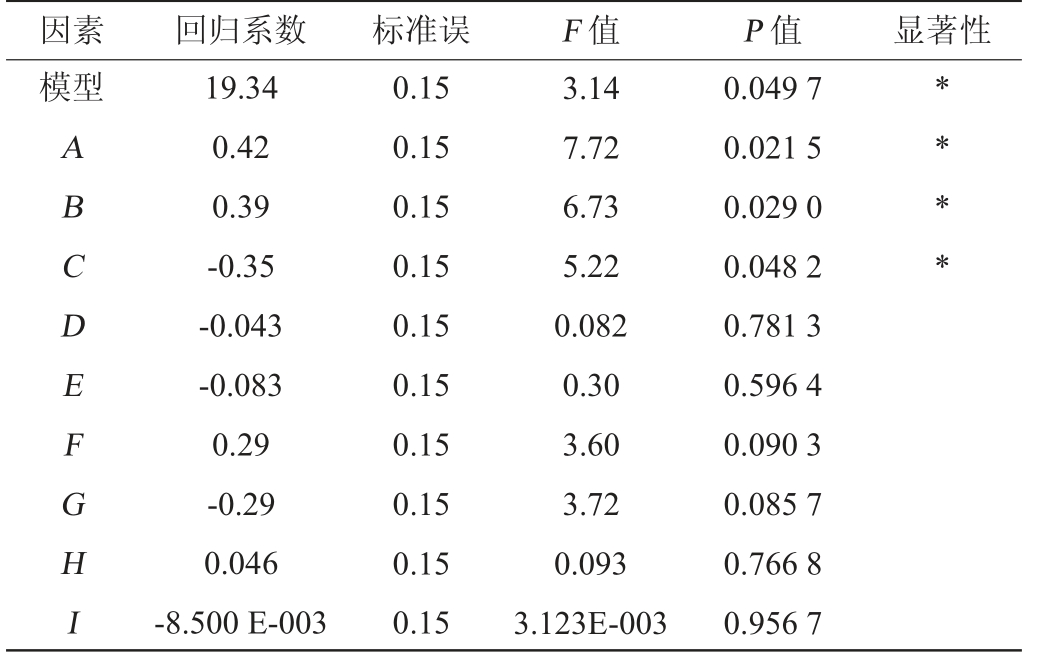
注:“*”表示对结果影响显著(P<0.05)。下同。
因素 回归系数 标准误 F 值 P 值 显著性模型ABCDEFGHI 19.34 0.42 0.39-0.35-0.043-0.083 0.29-0.29 0.046-8.500 E-003 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.15 3.14 7.72 6.73 5.22 0.082 0.30 3.60 3.72 0.093 3.123E-003 0.049 7 0.021 5 0.029 0 0.048 2 0.781 3 0.596 4 0.090 3 0.085 7 0.766 8 0.956 7** * *
由表4可知,主效应显著(P值=0.049 7<0.05),决定系数R2为0.877 5,说明模型能解释试验选取的9个因素。其中,葡萄糖添加量、酵母抽提物添加量、硫酸铵添加量,其余各因素不显著(P>0.05),因此,葡萄糖添加量、酵母抽提物添加量、硫酸铵添加量是影响酿酒酵母菌体干质量发酵培养基中的关键因素。葡萄糖添加量、酵母抽提物添加量对酵母菌体干质量的影响为正效应,硫酸铵添加量为负效应。
2.3 最陡爬坡试验
根据Plackett-Burman试验筛选的3个影响显著因素,通过梯度增加葡萄糖添加量、酵母抽提物添加量,梯度减少硫酸铵添加量,采用最陡爬坡试验确定3个因素的最佳水平,最陡爬坡试验设计及结果见表5。
表5 最陡爬坡试验结果
Table 5 Results of the steepest climbing tests
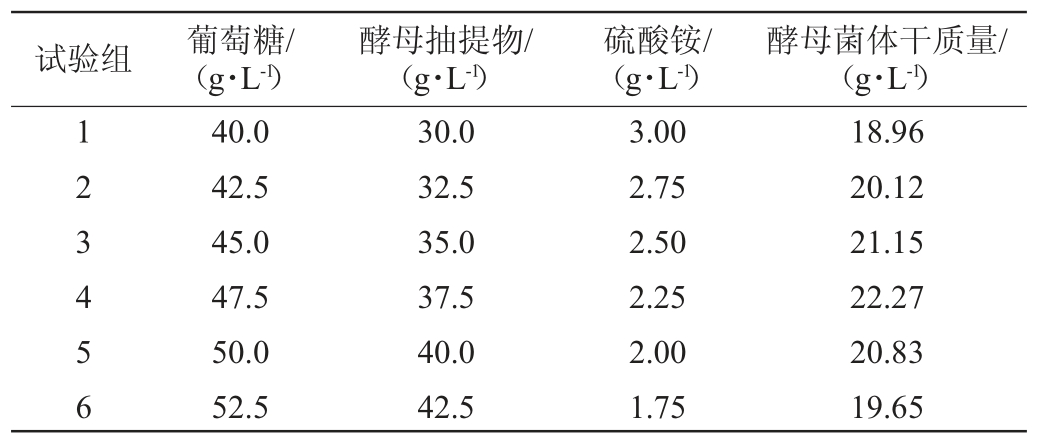
试验组 葡萄糖/(g·L-1)酵母抽提物/(g·L-1)硫酸铵/(g·L-1)酵母菌体干质量/(g·L-1)123456 40.0 42.5 45.0 47.5 50.0 52.5 30.0 32.5 35.0 37.5 40.0 42.5 3.00 2.75 2.50 2.25 2.00 1.75 18.96 20.12 21.15 22.27 20.83 19.65
由表5可知,菌体干质量呈先上升后下降趋势,第4组菌体干质量最高,即发酵培养基中葡萄糖47.5 g/L、酵母抽提物37.5 g/L、硫酸铵2.25 g/L。在此条件下,酵母菌体干质量为22.27 g/L。因此,选择第4组试验设计值为中心点进行Box-Behnken中心组合试验。
2.4 Box-Behnken试验结果与分析
以菌体干质量(Y)为响应值,葡萄糖(A)、酵母抽提物(B)、硫酸铵(C)添加量为自变量,利用Design-Expert 8.0软件设计3因素3水平的Box-Behnken中心组合试验[23],Box-Behnken试验设计及结果见表6,回归模型方差分析见表7。
表6 Box-Behnken试验结果
Table 6 Results of Box-Behnken tests
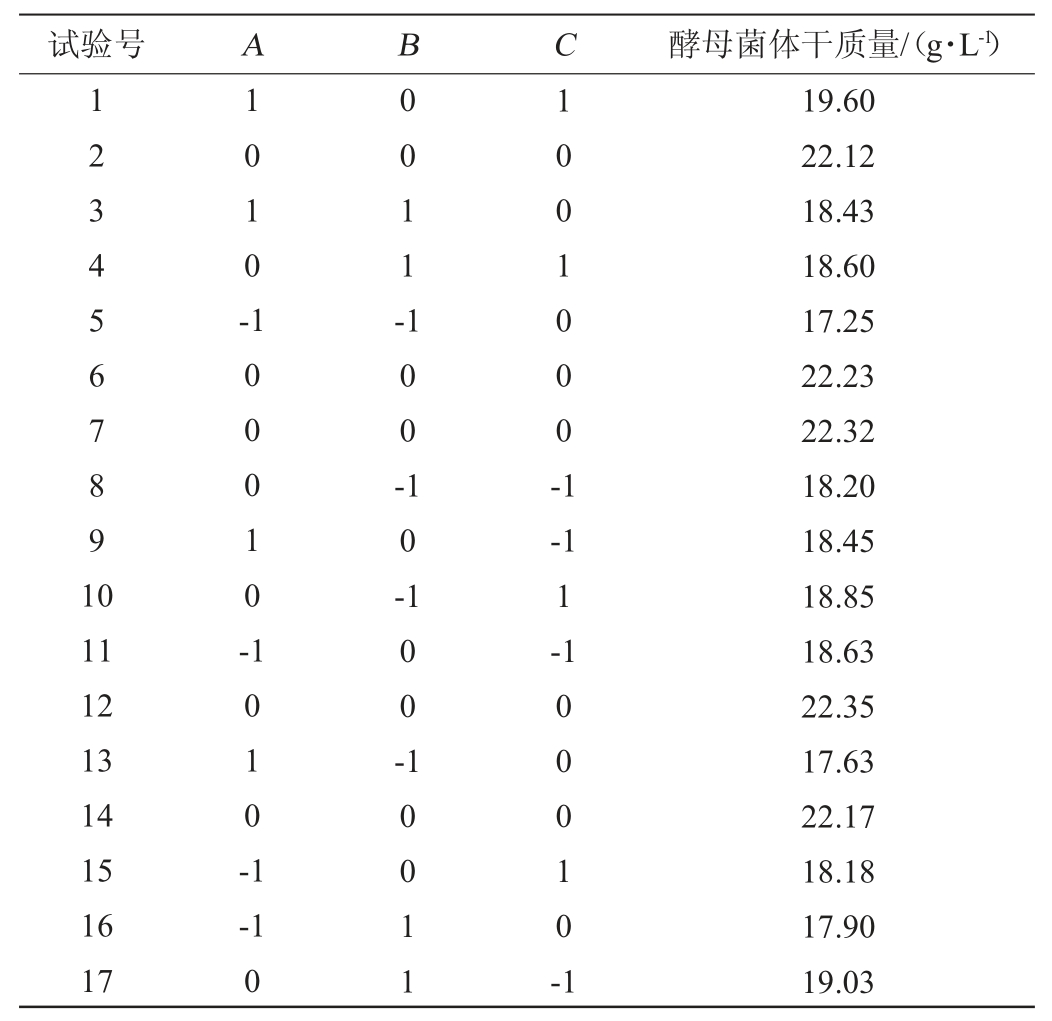
试验号 A B C 酵母菌体干质量/(g·L-1)1234567891 0 1010-0 011-100-10-1001000-1 11 12 13 14 15 16 17 100010-1010-1 100--1 1-1-1 0 10011 00010-1 19.60 22.12 18.43 18.60 17.25 22.23 22.32 18.20 18.45 18.85 18.63 22.35 17.63 22.17 18.18 17.90 19.03
表7 回归模型方差分析
Table 7 Variance analysis of regression model

注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B******AC BC A2 B2 C2残差失拟项纯误差总离差56.35 0.58 0.52 0.11 5.625 E-003 0.64 0.29 20.29 21.13 7.42 0.17 0.14 0.038 56.53 9111111111731 4 6.26 0.58 0.52 0.11 5.625 E-003 0.64 0.29 20.29 21.13 7.42 0.025 0.046 9.470E-003 250.60 23.13 20.62 4.23 0.23 25.61 11.67 812.08 845.72 297.07<0.000 1 0.001 9 0.002 7 0.078 6 0.649 6 0.001 5 0.011 2<0.000 1<0.000 1<0.000 1*********4.82 0.081 3 16
利用Design-Expert 8.0 软件对中心组合试验结果进行响应面分析,得到酵母菌体干质量(Y)对葡萄糖(A)、酵母抽提物(B)、硫酸铵(C)的多元二次回归方程:
Y=22.24+0.27A+0.25B+0.12C+0.037AB+0.40AC-0.27BC-2.20A2-2.24B2-1.33C2
由表7可知,模型P值<0.000 1,模型显著;失拟项P值0.081 3>0.05,失拟项不显著,表明模型可用于酿酒酵母的培养基优化[24]。模型决定系数R2=0.996 9,调整决定系数R2Adj=0.992 9,表明模型拟合程度良好,可信度高,可用于分析预测培养基成分对酵母菌体干质量的影响。由P值可知,一次项A、B,交互项AC及二次项A2、B2、C2对结果影响极显著(P<0.01),交互项BC对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,3个因素对酵母菌体干质量影响由大到小顺序为:葡萄糖添加量(A)>酵母抽提物添加量(B)>硫酸铵添加量(C)。
响应曲面坡度越陡,等高线呈椭圆形,则表示两者交互作用显著。各因素间交互作用对酵母菌体干质量影响的响应曲面及等高线见图9。由图9可知,葡萄糖(A)与硫酸铵(C)交互作用响应曲面图陡峭,等高线呈椭圆形,因此交互作用极显著;酵母抽提物(B)与硫酸铵(C)响应曲面图较陡峭,交互作用显著。这与方差分析结果一致。

图9 各因素间交互作用对酵母菌体干质量影响的响应曲面及等高线
Fig.9 Response surfaces plots and contour lines of effect of interaction between various factors on the dry mass of yeast
2.5 模型验证
通过Design-Expert 8.0 软件预测得到最佳发酵培养基中葡萄糖、酵母抽提物、硫酸铵添加量分别为47.66 g/L、37.63 g/L、2.26 g/L。在此条件下,发酵酵母菌体干质量预测值为22.26 g/L。为了验证酿酒酵母培养基模型的有效性及实际操作可控,将发酵培养基条件修正为:葡萄糖添加量48 g/L,酵母抽提物添加量38 g/L,硫酸铵添加量2 g/L,在此优化条件下进行3次平行验证试验,酵母菌体干质量实际值为22.31 g/L,与预测值基本一致,说明模型可以较好地反映出酵母菌体干质量与因素变化关系的趋势[25];采用基础培养基(YPD培养基)发酵酿酒酵母菌体干质量为5.25 g/L,利用最优发酵培养基发酵是优化前的3.31倍。
3 结论
通过单因素试验、Plackett-Burman试验、最陡爬坡试验、Box-Behnken试验得出最优发酵培养基组合:葡萄糖48 g/L、酵母抽提物38 g/L、硫酸铵2 g/L、磷酸氢二钾3 g/L、氯化钙0.1 g/L、硫酸锌0.05 g/L、硫酸锰0.05 g/L、VB1 0.1 g/L、VB7 0.1 g/L,在最优培养基组合条件下,酿酒酵母菌体干质量达到22.31 g/L,是优化前的3.31倍。
[1]靳纯嘏,叶耿坪,唐新仁.反刍动物饲用抗生素替代物研究进展[J].中国畜牧兽医,2018,45(1):77-85.
[2]工何中.养殖业抗生素使用现状及应对措施[J].现代农业科技,2019(22):164-166.
[3]BACANLI M,BAS,ARAN N.Importance of antibiotic residues in animal food[J].Food Chem Toxicol,2019,125:462-466.
[4]赵梦娇.我国抗生素滥用规制分析[J].中州大学学报,2017,34(1):73-75.
[5]卢晨阳.复合益生菌制剂对羔羊球虫感染、肠道菌群及免疫的影响[D].郑州:河南农业大学,2023.
[6]周淑芹.酵母培养物对肉仔鸡的作用[D].哈尔滨:东北农业大学,2003.
[7]JOUANY J P.Optimizing rumen functions in the close-up transition period and early lactation to drive dry matter intake and energy balance in cows[J].Anim Reprod Sci,2006,96(3-4):250-264.
[8]TITI H H, DMOUR R O, ABDULLAH A Y.Growth performance and carcass characteristics of Awassi lambs and Shami goat kids fed yeast culture in their finishing diet[J].Anim Feed Sci Tech,2008, 142(1-2):33-43.
[9]XIAO J X,ALUGONGO G M,CHUNG R,et al.Effects of Saccharomyces cerevisiae fermentation products on dairy calves: Ruminal fermentation,gastrointestinal morphology, and microbial community[J].J Dairy Sci,2016,99(7):5401-5412.
[10]周东年,姚琨,谢申猛,等.酿酒酵母培养物对泌乳奶牛生产性能、营养物质表观消化率及血清指标的影响[J].动物营养学报,2018,30(7):310-317.
[11]LI Y,SHEN Y Z,NIU J K,et al.Effect of active dry yeast on lactation performance,methane production,and ruminal fermentation patterns in early-lactating Holstein cows[J].J Dairy Sci,2020,104(1):381-390.
[12]BREWER M T, ANDERSON K L, YOON I, et al.Amelioration of salmonellosis in preweaned dairy calves fed Saccharomyces cerevisiae fermentation products in feed and milkreplacer[J].Vet Microbiol,2014,172(1-2):248-255.
[13]KNOBLOCK C E, SHI W, YOON I, et al.Effects of supplementing a Saccharomyces cerevisiae fermentation product during the periparturient period on the immune response of dairy cows fed fresh diets differing in starch content[J].J Dairy Sci,2019,102(7):6199-6209.
[14]PARK B G,LEE W G,CHANG Y K,et al.Long-term operation of continuous high cell density culture of Saccharomyces cerevisiae with membrane filtration and online cell concentration monitoring[J].Bioprocess Eng,1999,21:97-100.
[15]张蕾,黄荣凯,胡喜贵,等.酿酒酵母培养基的优化[J].河南科技学院学报,2015,43(4):18-23.
[16]李俊杰,管轶男,管斌,等.高生物量富硒产肮假丝酵母培养基优化[J].中国酿造,2018,37(1):74-78.
[17]陈雪,甄玉国,赵小丽.以糖蜜为碳源的酿酒酵母培养基的优化[J].中国酿造,2014,33(4):35-38.
[18]徐速,孙立斌,赵清霞,等.替代抗生素枯草芽孢杆菌菌剂固态发酵工艺优化[J].中国食品学报,2016,16(8):132-139.
[19]MONTGOMERY D C.Design and analysis of experiments[M].New York:John Wiley&Sons,2021:25.
[20]褚金磊,李欣,王志,等.富含琉基化合物酿酒酵母的筛选及发酵培养基优化[J].湖北上业大学学报,2019,34(5):32-36.
[21]CELLI G B, GHANEM A, BROOKS M S L.Optimization of ultrasoundassisted extraction of anthocyanins from haskap berries(Lonicera caerulea L.)using response surface methodology[J].Ultrasonic Sonochem,2015,27:449-455.
[22]汤二将,邓朝霞,张晓敏,等.响应面法优化酿酒酵母产孢培养基及单倍体的鉴定[J].酿酒科技,2012(6):36-40.
[23]王大红,韦兰兰,张帅滢,等.基于响应面法的纳他霉素生产菌株发酵培养基优化[J].精细化工,2017,34(11):1233-1238,1245.
[24]KOWALSKI J.Optimal estimation in rotation patterns[J].J Stat Plan Infer,2009,139(4):1405-1420.
[25]李莉,张赛,何强,等.响应面法在试验设计与优化中的应用[J].实验室研究与探索,2015,34(8):41-45.