黄泡(Rubus pectinellus Maxim.)又名栽秧泡、锁地风、黄茨果、黄藨,为蔷薇科悬钩子属植物[1],分布于中国云南、福建、台湾、江西、湖南、四川、贵州等地海拔约300~2 000 m的山地林中[2]。黄泡是一种季节性山间野生小浆果,成熟后颜色多呈黄色,口感酸甜多汁,富含黄酮、维生素、果酸、多糖、氨基酸以及多种生物活性成分[3],具有抗氧化、抗衰老、抗炎、抗癌以及保护心脑血管的功效[4-5]。黄泡以采食鲜果为主,不易保藏,难以运输,产品开发利用率低,将黄泡酿制成果酒可提高其附加值。
黄泡果酒是以黄泡为原料,经微生物发酵酿制而成的低度果酒[5]。果酒中的风味物质主要是在酵母相关酶的作用下,解离出游离态风味物质,如酯类、醇类、有机酸类、醛酮类、含硫化合物以及萜烯类等,赋予果酒独特的风味[6]。因此,筛选优良酵母菌是提高果酒品质的关键。目前,关于果酒优良酵母菌的筛选是近年来的研究热点。杜沁岭等[7]为了获得优良特性的青梅果酒酿造专用酵母菌,从糖渍青梅液和青梅果皮中分离到10株酵母菌,并对其发酵特性进行研究。赵雪平等[8]为筛选本土优良酿酒酵母菌种,从内蒙古乌海地区的果园土壤、葡萄表皮及发酵醪液中分离筛选得到1株优良酿酒酵母(Saccharomyces cerevisiae)KX3。黄泡果酒工艺研究大多采用葡萄酒果酒专用酵母或酿酒高活性果酒酵母,导致黄泡果酒风味不足、口感单一、缺乏代表性[2,5]。目前,关于黄泡果酒专用酵母的筛选鲜见报道。
本研究采用传统培养分离法结合形态观察从黄泡发酵液中分离纯化野生酵母菌,通过研究分离菌株的产酯、产乙醇、产H2S等发酵性能及分子生物学技术鉴定筛选优良酵母菌,并探讨其对乙醇、温度、SO2、pH、葡萄糖的耐受性,以期获得优良黄泡专用酵母菌,为黄泡果酒生产提供酵母资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料及菌株
野生黄泡:2022年4月采自云南省曲靖市师宗县高良乡落雪村山坡上,无病虫害,成熟度高。商业酿酒酵母菌ADT:安琪酵母股份有限公司;酿酒酵母NX11424 1296:西北农林科技大学惠赠。
1.1.2 试剂
2,3,5-三苯基氯化四氮唑(triphenyltetrazolium chloride,TTC)、葡萄糖、无水乙醇、甘油、焦亚硫酸钾、三丁酸甘油酯、MgSO4、KH2PO4、蛋白胨、酵母浸出粉、琼脂等(均为分析纯或生化试剂):昆明品美科技有限公司;引物、2×Taq酶(5 U/mL):昆明擎科生物科技有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
沃勒斯坦实验室(Wallerstein laboratory,WL)营养琼脂鉴别培养基:青岛日水生物技术有限公司。
TTC上层培养基[9]:TTC 0.5 g/L,葡萄糖0.5 g/L,琼脂15 g/L。115 ℃高压蒸汽灭菌20 min。
TTC下层培养基[9]:MgSO4 0.4 g/L,KH2PO4 1 g/L,酵母浸出粉1.5 g/L,蛋白胨2 g/L,葡萄糖10 g/L,琼脂20 g/L。115 ℃高压蒸汽灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extracts peptone glucose,YPD)液体培养基[10]:酵母浸出粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L。115 ℃高压蒸汽灭菌20 min。
YPD固体培养基:YPD液体培养基中添加琼脂20 g/L。115 ℃高压蒸汽灭菌20 min。
麦芽汁固体培养基[11]:麦芽汁10 g/L,琼脂20 g/L。121 ℃高压蒸汽灭菌20 min。
产酯筛选培养基[12]:在YPD固体培养基中添加三丁酸甘油酯4 g/L。115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
UV755B可见紫外分光光度计:上海分析仪器总厂;Veriti 96-Well聚合酶链式反应(polymerase chain reaction,PCR)仪、WD-9413B凝胶成像仪:伯乐生命医学有限公司;PHX-280H生化培养箱:宁波莱福科技有限公司;上海博迅实业有限公司医疗设备厂;PowerPacTM HC十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)仪:美国BIO-RAD公司;YXQ-100G立式压力蒸气灭菌器、ZD-85AB多功能冷冻气浴恒温振荡器:常州润华电器有限公司。
1.3 方法
1.3.1 酵母菌的分离纯化及初筛
称取约100 g成熟新鲜、无腐烂、无病虫害、色泽好的黄泡,用榨汁机破碎后装入锥形瓶,在25 ℃条件下自然发酵2~4 d。当黄泡发酵液出现大量气泡时,将发酵液用纱布过滤。取1 mL滤液,以10倍梯度稀释法稀释至10-6、10-7、10-8,各取0.2 mL稀释液涂布在含有抗生素(卡那霉素100 mg/mL、制霉菌素100 mg/mL)的麦芽汁固体培养基和YPD固体培养基上,25 ℃条件下培养24~48 h。观察菌落生长情况,挑取具有典型酵母菌特征的单菌落划线于YPD平板上,并置于显微镜下观察酵母菌细胞形态及繁殖方式。
1.3.2 酵母菌的复筛
产气性能测试:采用杜氏管发酵法[13],取-20 ℃甘油保藏的分离酵母菌菌液100 μL接种于装有5 mL YPD液体培养基的试管中,在30 ℃、180 r/min条件下活化培养24 h,得到菌体浓度为105 CFU/mL的种子液。以2%的接种量将种子液接种到装有YPD液体培养基的试管中,然后放入杜氏小管。分别在30 ℃条件下培养24 h和48 h,观察酵母菌的产气情况。
产酯性能测试[14]:将分离酵母菌的种子液点样于产酯培养基,在28 ℃条件下培养4 d,观察并记录显色情况。
产乙醇性能测试[15]:将分离酵母菌的种子液接种于TTC下层培养基,在28 ℃条件培养至酵母长势良好后,覆盖TTC上层培养基,避光培养24 h后,观察并记录显色情况。
嗜杀性测试[16]:将敏感菌株NX11424 1296与分离酵母菌种子液以2%的接种量分别涂布在YPD固体培养基上,在28 ℃条件培养48 h,观察酵母菌周围的蓝色死菌带和透明抑菌圈的大小。
1.3.3 酵母菌的分子生物学鉴定
将分离酵母菌种子液在12 000 r/min条件下离心5 min,收集菌体,参照GOODWIN D C等[17]的方法提取基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用通用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)PCR扩增26S rDNA D1/D2区基因序列。PCR扩增体系:DNA模板1 μL,NL1和NL4各0.5 μL,Taq PCR Master Mix 11 μL,双蒸水(ddH2O)12 μL;PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火40 s,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托昆明擎科生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中与已知序列进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,选取同源性较高的模式菌株的26S rDNA D1/D2区基因序列,采用MEGA X软件中的邻接(neighbor-joining,NJ)法构建系统发育树[18]。
1.3.4 酵母菌的耐受性研究
以商业酿酒酵母ADT为对照,参照熊荣园等[19]的方法,考察筛选菌株的耐受性。将筛选菌株的种子液以2%的接种量分别接种至不同pH值(pH 2.5、pH 3.0、pH 3.5、pH 4.0)、含不同体积分数乙醇(3%、6%、9%、12%)、不同质量浓度SO2(以H2SO3计)(60 mg/L、180 mg/L、300 mg/L、400 mg/L、500 mg/L)、不同质量浓度葡萄糖(200 g/L、300 g/L、400 g/L)的YPD液体培养基中,于30 ℃条件下培养48 h,测定发酵液的OD600 nm值;将筛选菌株的种子液以2%的接种量接种于YPD液体培养基中,分别在不同温度(4℃、15 ℃、25 ℃、35℃、40 ℃)下培养48 h,测定发酵液的OD600 nm值;考察不同菌株对pH、乙醇、SO2、葡萄糖及温度的耐受性。
1.3.5 数据处理
采用Microsoft Excel 2010、MEGA X软件进行数据分析处理,每组实验平行测定3次,结果采用“平均值±标准差”表示。采用Graphpad Prism 9.0软件进行绘图。
2 结果与分析
2.1 酵母菌的分离纯化及初筛
从黄泡发酵液中共分离纯化到79株酵母菌,通过形态观察及显微镜镜检,去除形态特征相似的菌株,共筛选出18株酵母菌,编号为WQ-1~WQ-4、WQ-8~WQ-12、WQ-14、WQ-17~WQ-23、WQ-26,其菌落形态和细胞形态见图1及表1。由图1及表1可知,18株酵母菌菌落形态边缘多为不规则、奶油色、白色或绿色,细胞形态多数为圆形、球形、椭圆形,繁殖方式以裂殖和出芽繁殖为主。
表1 18株酵母菌的形态学特征
Table 1 Morphological characteristics of 18 yeasts strains

菌株编号 形态描述 形态描述及繁殖方式菌株WQ-1菌株WQ-2菌株WQ-3菌株WQ-4菌株WQ-8菌株WQ-9菌株WQ-10菌株WQ-11菌株WQ-12菌株WQ-14菌株WQ-17菌株WQ-18菌株WQ-19菌株WQ-20菌株WQ-21菌株WQ-22菌株WQ-23菌株WQ-26边缘毛状不规则、中间呈浅绿色、表面不光滑边缘毛状不规则、中间呈深绿色、表面不光滑边缘毛状规则、中间呈深绿色、表面不光滑边缘乳青色整齐、表面似火山状突起边缘不规则、中间呈浅黄色、表面不光滑边缘毛绒毛状、中间呈淡绿色、表面似火山状突起边缘乳白色毛状不规则、中间呈深绿色、表面不光滑边缘整齐、菌落小呈乳白色且光滑边缘整齐、菌落呈乳白色不光滑边缘整齐、菌落呈淡绿色不光滑边缘不规则、中间呈浅绿色、表面似火山状突起边缘毛绒毛状、中间呈淡蓝色、表面似火山状突起边缘不规则、乳白色、表面似火山状突起边缘不规则云朵状、淡青色、表面似火山状突起边缘规则、中间呈淡绿色、表面不光滑边缘整齐、菌落大呈乳白色且不光滑奶油质地、乳白色、表面不光滑边缘规则、中间呈浅黄绿色、表面不光滑椭圆形、出芽繁殖椭圆形、出芽繁殖椭圆形、出芽繁殖椭圆形、出芽繁殖圆球形、裂殖椭圆形、出芽繁殖椭圆形、出芽繁殖椭圆形、出芽繁殖圆球形、裂殖圆球形、裂殖椭圆形、出芽繁殖半椭圆形、出芽繁殖椭圆形、出芽繁殖椭圆形、出芽繁殖半椭圆形、出芽繁殖圆球形、裂殖半椭圆形、出芽繁殖半椭圆形、出芽繁殖

图1 18株酵母菌的菌落形态和细胞形态
Fig.1 Colony and cell morphology of 18 yeasts strains
2.2 酵母菌的复筛
2.2.1 产气性能分析
18株酵母菌的产气能力见表2。由表2可知,除菌株WQ-12、WQ-14、WQ-23外,其余菌株产气能力较好,且其中4株酵母菌(WQ-3、WQ-11、WQ-17、WQ-26)产气速度最快,菌体沉淀主要呈白色松散沉淀和白色紧密沉淀。
表2 18株酵母菌的产气能力测定结果
Table 2 Gas production capacities determination results of 18 yeast strains
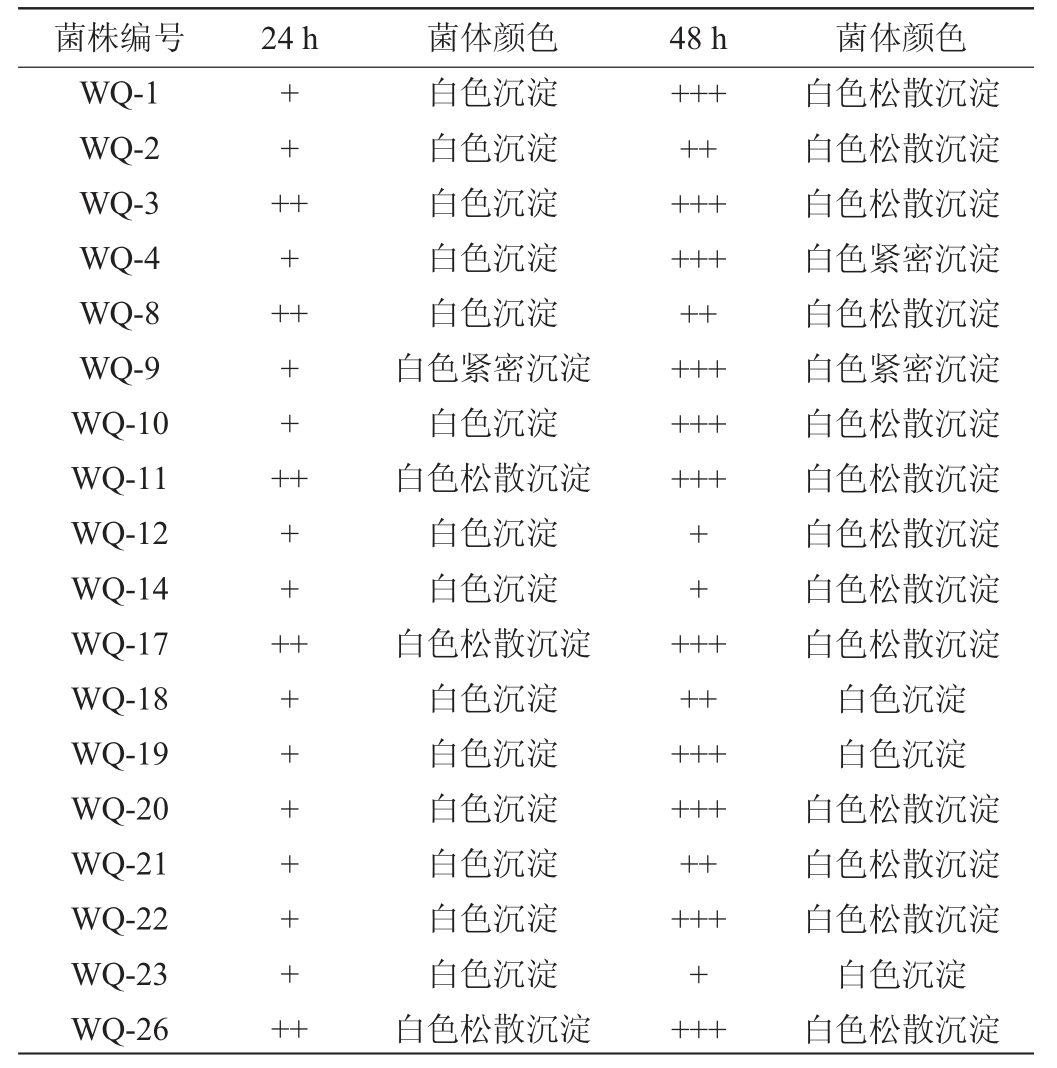
注:“+、++、+++”分别表示产气达到杜氏小管体积的1/3、2/3、全部。
菌株编号 24 h 菌体颜色 48 h 菌体颜色WQ-1 WQ-2 WQ-3 WQ-4 WQ-8 WQ-9 WQ-10 WQ-11 WQ-12 WQ-14 WQ-17 WQ-18 WQ-19 WQ-20 WQ-21 WQ-22 WQ-23 WQ-26++++++++++++++++++++++++++++++++++++白色松散沉淀白色松散沉淀白色松散沉淀白色紧密沉淀白色松散沉淀白色紧密沉淀白色松散沉淀白色松散沉淀白色松散沉淀白色松散沉淀白色松散沉淀白色沉淀白色沉淀白色松散沉淀白色松散沉淀白色松散沉淀白色沉淀白色松散沉淀+++++++++++白色沉淀白色沉淀白色沉淀白色沉淀白色沉淀白色紧密沉淀白色沉淀白色松散沉淀白色沉淀白色沉淀白色松散沉淀白色沉淀白色沉淀白色沉淀白色沉淀白色沉淀白色沉淀白色松散沉淀++++++++++++++++++++
2.2.2 产乙醇能力分析
将18株酵母菌菌株接种于TTC培养基上进行产乙醇能力筛选,观察各菌株显色情况,根据显色情况判定酵母菌产乙醇能力的大小[20],结果见图2。
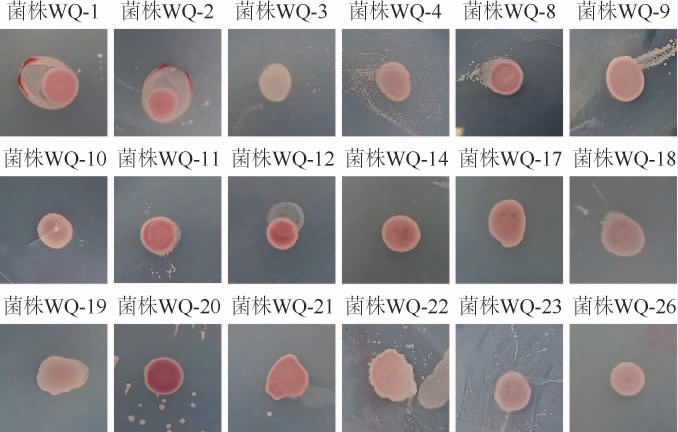
图2 18株酵母菌产乙醇能力测定结果
Fig.2 Alcohol production capacities determination results of 18 yeast strains
由图2可知,18株酵母菌菌株均有一定的产乙醇能力,菌落呈深红色的有三株(WQ-11、WQ-12、WQ-20),初步判断菌株WQ-11、WQ-12、WQ-20产乙醇能力相对较强。
2.2.3 产酯能力分析
将18株酵母菌菌株接种到产酯筛选培养基上,根据透明圈的大小判定酵母菌产酯量的高低[21]。18株酵母菌菌株的产酯能力见表3。由表3可知,18株酵母菌菌株均具有一定的产酯能力,且其中菌株WQ-8、WQ-9、WQ-20、WQ-21、WQ-22、WQ-23的D/d值最大,分别为2.43、2.55、2.12、2.02、2.14、2.09,说明其产酯能力最强。
表3 18株酵母菌的产酯能力测定结果
Table 3 Ester production capacities determination results of 18 yeast strains

菌株编号 菌株透明圈直径(D)/cm 菌落直径(d)/cm D/d值WQ-1 WQ-2 WQ-3 WQ-4 WQ-8 WQ-9 WQ-10 WQ-11 WQ-12 WQ-14 WQ-17 WQ-18 WQ-19 WQ-20 WQ-21 WQ-22 WQ-23 WQ-26 0.82±0.12 0.73±0.01 0.77±0.11 0.96±0.05 1.65±0.05 1.86±0.13 0.73±0.09 0.88±0.06 0.76±0.04 0.68±0.11 0.96±0.02 0.59±0.03 0.79±0.03 1.89±0.13 1.88±0.16 1.73±0.04 1.65±0.13 0.89±0.05 0.50±0.05 0.66±0.01 0.76±0.07 0.53±0.12 0.68±0.05 0.73±0.07 0.68±0.08 0.65±0.06 0.56±0.02 0.52±0.04 0.75±0.11 0.56±0.05 0.55±0.08 0.89±0.12 0.93±0.04 0.81±0.02 0.79±0.01 0.63±0.09 1.64 1.11 1.01 1.81 2.43 2.55 1.07 1.35 1.36 1.31 1.28 1.05 1.44 2.12 2.02 2.14 2.09 1.41
2.2.4 嗜杀性能分析
在果酒酿造过程中,具有嗜杀性的酵母菌可以抑制腐败微生物对果酒的影响[22]。将18株酵母菌接种到含有敏感菌株的培养基上,根据D/d值判断酵母菌的嗜杀能力[16],18株酵母菌菌株的嗜杀性见表4。由表4可知,18株酵母菌菌株均具有一定的嗜杀性能,且其中菌株WQ-3、WQ-4、WQ-8、WQ-11、WQ-23的D/d值较大,分别为2.93、2.27、2.68、2.85、2.92,说明其嗜杀能力较强。
表4 18株酵母菌嗜杀能力测定结果
Table 4 Killing ability determination results of 18 yeast strains
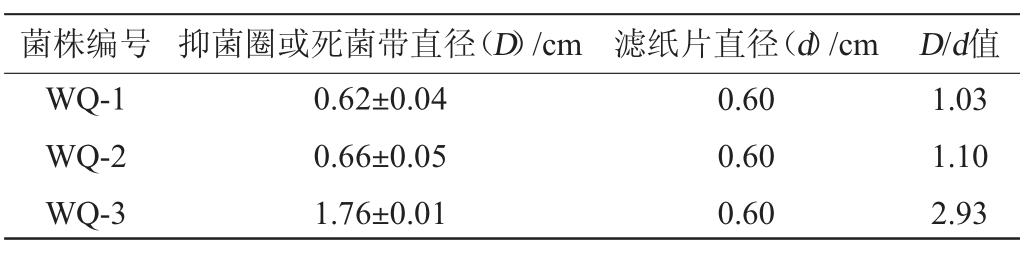
菌株编号 抑菌圈或死菌带直径(D)/cm 滤纸片直径(d)/cm D/d值WQ-1 WQ-2 WQ-3 0.62±0.04 0.66±0.05 1.76±0.01 0.60 0.60 0.60 1.03 1.10 2.93
续表
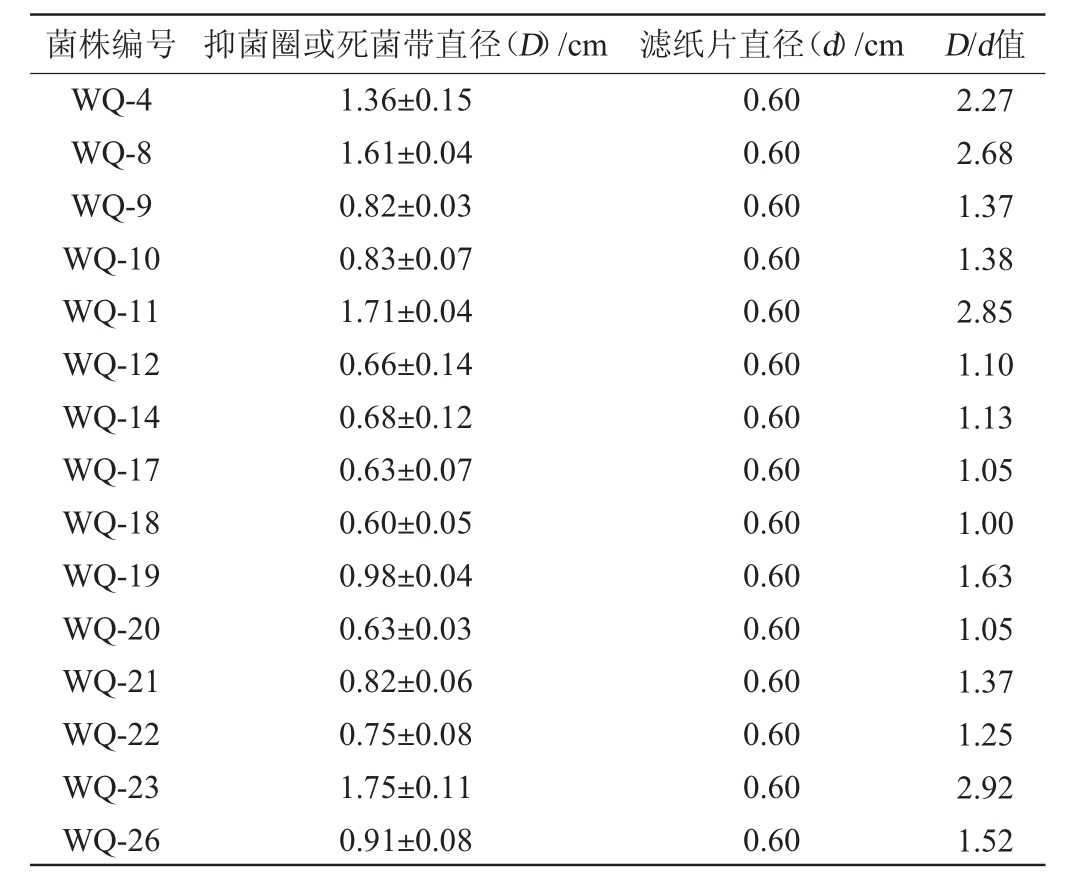
菌株编号 抑菌圈或死菌带直径(D)/cm 滤纸片直径(d)/cm D/d值WQ-4 WQ-8 WQ-9 WQ-10 WQ-11 WQ-12 WQ-14 WQ-17 WQ-18 WQ-19 WQ-20 WQ-21 WQ-22 WQ-23 WQ-26 1.36±0.15 1.61±0.04 0.82±0.03 0.83±0.07 1.71±0.04 0.66±0.14 0.68±0.12 0.63±0.07 0.60±0.05 0.98±0.04 0.63±0.03 0.82±0.06 0.75±0.08 1.75±0.11 0.91±0.08 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 0.60 2.27 2.68 1.37 1.38 2.85 1.10 1.13 1.05 1.00 1.63 1.05 1.37 1.25 2.92 1.52
2.3 酵母菌的分子生物学鉴定
基于26S rDNA D1/D2区基因序列构建18株酵母菌株的系统发育树,结果见图3。
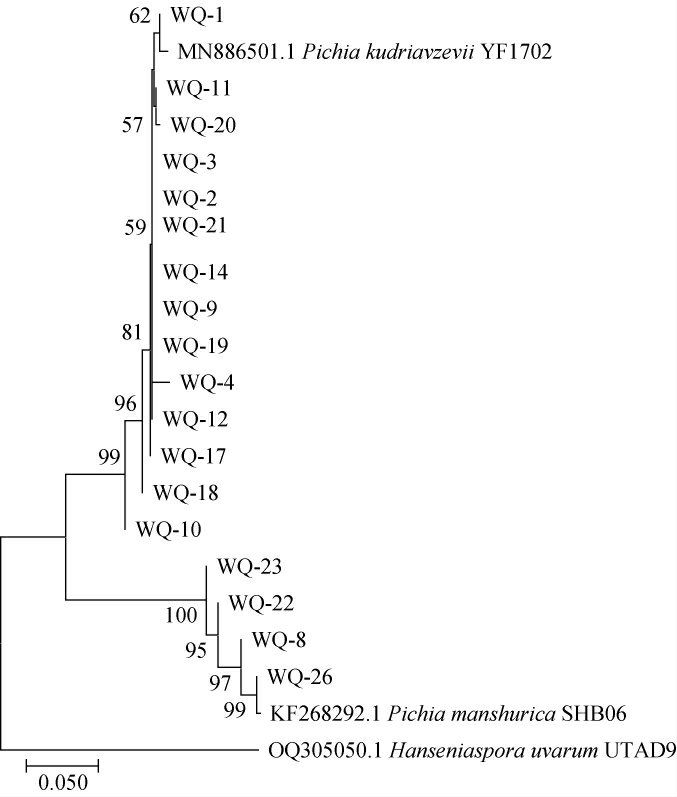
图3 基于26S rDNA D1/D2区基因序列18株酵母菌的系统发育树
Fig.3 Phylogenetic tree of 18 yeast strains based on 26S rDNA D1/D2 region gene sequences
由图3可知,菌株WQ-8、WQ-22、WQ-23、WQ-26均与盔形毕赤酵母(Pichia manshurica)SHB06聚于同一分支,剩下14株菌株均与库德毕赤酵母(Pichia kudriavzevii)YF1702聚于同一分支。结合形态观察结果,最终将菌株WQ-8、WQ-22、WQ-23、WQ-26鉴定为盔形毕赤酵母(Pichia manshurica),另外14株菌株鉴定为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)。
综上,菌株WQ-3在所分离的库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)中产气、产酯和产乙醇能力相对较强;而菌株WQ-8是盔形毕赤酵母(Pichia manshurica)中产气、产酯和产乙醇能力相对较强的酵母菌。因此,选择菌株WQ-3和WQ-8为目标菌株。
2.4 酵母菌的耐受性分析
2.4.1 乙醇耐受性
果酒发酵过程中的乙醇体积分数范围一般是4%~12%,乙醇的不断积累对酵母菌细胞有毒害作用,抑制其生长[23]。因此,以商业酿酒酵母ADT为对照,考察酵母菌WQ-3、WQ-8的乙醇耐受性,结果见图4。由图4可知,随着乙醇体积分数的增加,3株酵母菌的OD600 nm值均呈下降趋势,且菌株ADT的生长能力最好,菌株WQ-8的生长能力最差,但均能在乙醇体积分数为12%的条件下生长,说明3株酵母菌株均能耐受乙醇体积分数12%。
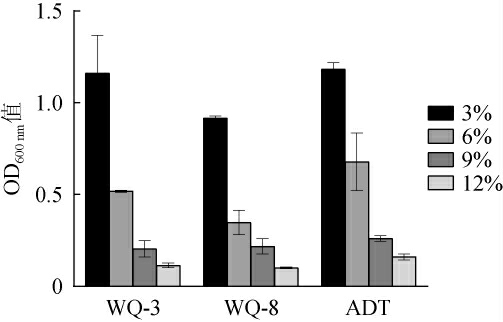
图4 筛选酵母菌的乙醇耐受性
Fig.4 Ethanol tolerance of isolated yeasts
2.4.2 pH耐受性
果酒发酵过程中的pH范围是2.5~4.0,pH对酵母菌的生长代谢和生物活性有较大影响,能影响细胞间的代谢传递及酶活性,在较低或较高的pH下会影响酵母菌的生长代谢能力[24]。因此,以商业酿酒酵母ADT为对照,考察酵母菌WQ-3、WQ-8对低pH的耐受性,结果见图5。
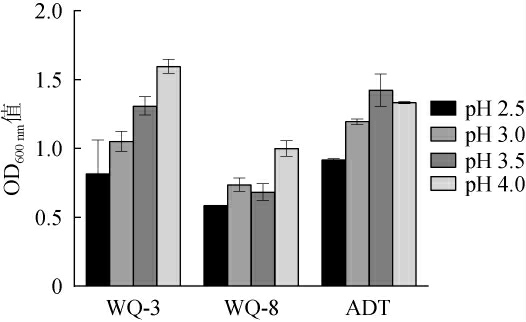
图5 筛选酵母菌的pH耐受性
Fig.5 pH tolerance of screened yeasts
由图5可知,当pH为2.5~4.0时,菌株WQ-3、WQ-8和商业酿酒酵母ADT均能生长,说明两株酵母菌均有一定的低pH耐受性能力,均可耐受pH 2.5。
2.4.3 温度耐受性
果酒发酵过程中的温度变化范围是15~25 ℃,温度影响酵母菌酶的活性和其对营养物质的吸收能力,而不同的酵母菌对温度的耐受性也不同[25]。因此,以商业酿酒酵母ADT为对照,考察酵母菌WQ-3、WQ-8对温度的耐受性,结果见图6。由图6可知,随着温度的升高,3株酵母菌株的OD600nm值均呈先上升后下降的趋势,但菌株均能在4~40 ℃范围内正常生长,说明3株酵母菌株均具有一定的温度耐受性能力,均可耐受低温4 ℃和高温40 ℃。
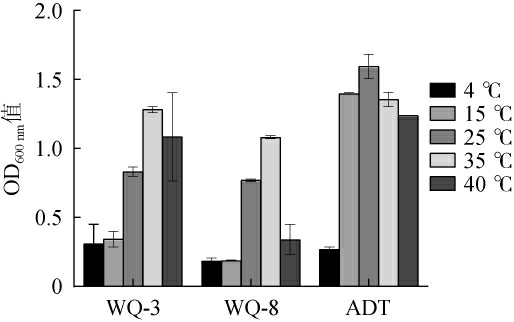
图6 筛选酵母菌的温度耐受性
Fig.6 Temperature tolerance of screened yeasts
2.4.4 SO2耐受性
通常在果酒酿造过程中需要添加30~250 mg/L SO2,对酒起到抗氧化、护色以及抑菌作用[26],因此,优良菌株需要在250 mg/L SO2条件下具有较好耐受性。3株酵母菌株对SO2的耐受性见图7。由图7可知,在SO2质量浓度60~400 mg/L范围内,3株酵母菌株均能正常生长,因此,3株酵母菌株均具有良好的SO2耐受性,均可耐受SO2质量浓度400 mg/L。
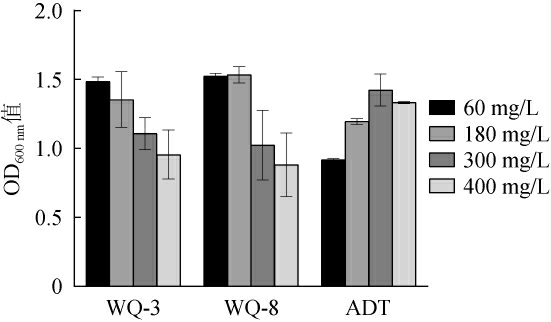
图7 筛选酵母菌的SO2耐受性
Fig.7 SO2 tolerance of screened yeasts
2.4.5 葡萄糖耐受性
通常在果酒酿造过程中需要添加100~300 g/L的葡萄糖,酵母菌的生长受葡萄糖浓度的影响,进而影响其酿酒特性[27]。以商业酿酒酵母ADT为对照,考察酵母菌WQ-3、WQ-8对葡萄糖的耐受性,结果见图8。由图8可知,在葡萄糖质量浓度为200~400 g/L的范围内,3株酵母菌株均能正常生长,说明3株酵母菌株均具有良好的葡萄糖耐受性,均可耐受葡萄糖质量浓度400 mg/L。
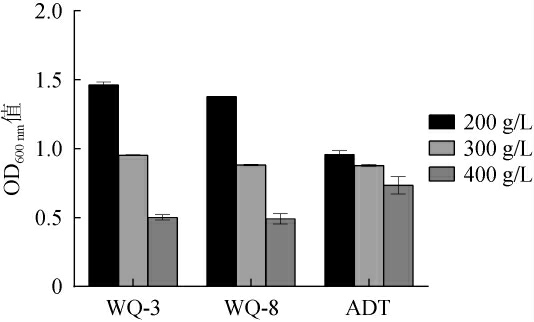
图8 筛选酵母菌的葡萄糖耐受性
Fig.8 Glucose tolerance of screened yeasts
3 结论
优良酵母菌应具有良好的发酵性能和耐受性能,本土优良酵母菌是果酒生产亟待解决的问题。本研究从黄泡发酵液中共分离纯化到79株酵母菌,通过形态观察及显微镜镜检,去除形态特征相似的菌株,共筛选出18株酵母菌,通过产气、产乙醇、产酯、嗜杀能力分子生物学鉴定结果表明其筛选得到2株优良酵母菌株,编号分别为WQ-3和WQ-8,分别属于库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)和盔形毕赤酵母(Pichia manshurica)。这2株酵母菌均具有良好的耐受性,均能耐受乙醇体积分数12%、pH 2.5、低温4 ℃、高温40 ℃、SO2质量浓度400 mg/L、葡萄糖质量浓度400 g/L,可为后续黄泡果酒生产提供菌株资源。
[1]俞德浚,陆玲娣,谷粹芝,等.中国植物志[M].北京:科学出版社,1985:210.
[2]宋志姣,周艺垠,郭燕,等.栽秧泡果酒发酵工艺优化及挥发性风味物质分析[J].中国食品添加剂,2021,32(1):51-58.
[3]李秀.云南普洱市野生果类植物资源研究[J].中国野生植物资源,2011,30(3):26-29,37.
[4]张良英,刘林,牛歆雨.西藏几种野生树莓的果实性状评价[J].种子,2016,35(8):70-71,75.
[5]郑玉琳,周文敏,何映江,等.云南黄泡果酒酿造工艺优化及抗氧化活性研究[J].食品安全质量检测学报,2022,13(6):1927-1934.
[6]RUIZ J, KIENE F, BELDA I, et al.Effects on varietal aromas during wine making: A review of the impact of varietal aromas on the flavor of wine[J].Appl Microbiol Biot,2019,103(11):7425-7450.
[7]杜沁岭,屠婷瑶,徐文,等.青梅野生酵母菌的筛选鉴定与耐受性研究[J].食品与发酵工业,2023,49(4):196-201.
[8]赵雪平,温雅娇,李正英,等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业,2020,46(11):178-183.
[9]李凯,王金晶,李永仙,等.红芯火龙果酒酿酒酵母的筛选及鉴定[J].食品与发酵工业,2019,45(5):115-120.
[10]刘根娣,隋明.冬果梨果酒酵母的筛选及鉴定[J].中国酿造,2016,35(6):85-89.
[11]李豪,章霞,张静,等.草莓果酒酵母菌的筛选、鉴定及耐受性研究[J].中国酿造,2017,36(2):85-88.
[12]胡江南,高熳熳,马立娟,等.葡萄酒发酵优良酵母的筛选、鉴定及应用[J].中国酿造,2023,42(7):43-50.
[13]申鹏森,田争福,田晓菊,等.一株降解氨基甲酸乙酯酿酒酵母菌的筛选及鉴定[J].食品与发酵工业,2022,48(9):20-25.
[14]徐丽萍.泸型大曲中产酯酵母的筛选鉴定及产酯条件优化[J].中国酿造,2016,35(2):74-78.
[15]闫兴敏,姜娇,高辉,等.优良本土酿酒酵母的酿酒特性及产香能力初析[J].食品与发酵工业,2022,48(4):62-68.
[16]冯莉,陈雪,李丽,等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报,2018,18(12):66-73.
[17]GOODWIN D C,LEE S B.Microwave miniprep of total genomic DNA from fungi,plants,protists and animals for PCR[J].Biotechniques,1993,15(3):438-441.
[18]KUMAR S,STECHER G,LI M,et al.MEGA X:Molecular evolutionary genetics analysis across computing platforms[J].Mol Biol Evol,2018,35(6):1547-1549.
[19]熊荣园,王黎明,魏玲,等.柑橘及桑葚中优质酵母菌的筛选及鉴定[J].中国酿造,2023,42(4):163-167.
[20]曹云,曹文涛,王晓丹,等.耐高温高产酒精酵母菌的筛选鉴定及特性研究[J].食品与发酵科技,2023,59(1):83-89.
[21]XIE G F,WANG L,GAO Q K,et al.Microbial community structure in fermentation process of Shaoxing ricewine by Illumina-based metagenomic sequencing[J].J Sci Food Agr,2013,93(12):3121-3125.
[22]SATYANARAYANA T,GOTTHARD K.Yeast diversity in human welfare[M].Singapore:Springer,2017:163-190.
[23]QIU Z L,JIANG R R.Improving Saccharomyces cerevisiae ethanol production and tolerance via RNA polymerase Ⅱsubunit Rpb7[J].Biotechnol Biofuels,2017,10(1):125.
[24]王辉,袁婷玉,白卫东,等.青梅自然发酵液中酵母菌的分离鉴定及特性研究[J].食品科技,2021,46(8):16-21.
[25]张二豪,何萍,刘盼盼,等.西藏沙棘酵母菌的分离鉴定及其产香特性分析[J].食品科学,2022,43(20):207-215.
[26]阎贺静,时月,刘畅,等.玫瑰香干红葡萄酒自然发酵过程中优势酵母分离鉴定及其应用潜力分析[J].食品科学,2017,38(22):124-131.
[27]吕银德,赵俊芳,秦令祥.鲜食葡萄降酸酵母菌的筛选、鉴定及酿造特性研究[J].中国酿造,2023,42(9):120-124.