酸木瓜俗称野木瓜,学名为皱皮木瓜(Chaenomeles speciosa),具有抗氧化[1-2]、降血脂和血糖[2]、抗癌[3]、抗炎和抗流感[4]等多种功能。但酸木瓜质地柴、糖酸比低,难以直接食用,可深加工为果汁[1]、果脯[5]、果酱[6]、果酒[7]和果醋等[8]。与传统食醋的混菌固态发酵工艺不同,果醋采用微生物纯种液态发酵工艺[9]。由于纯种液态发酵过程中参与的微生物种类单一,发酵周期短,产生的醇类、酯类等挥发性化合物和有机酸等风味物质较为单一,导致果醋风味较传统食醋明显不足[10-12]。WU L H等[13]研究发现,混菌发酵果醋中含有更丰富的风味物质,并利用宏基因组测序技术阐释了与果醋风味相关的关键微生物。邢晓莹等[14]研究发现,醋杆菌和乳酸菌混菌发酵制备的山楂果醋中风味物质种类比醋杆菌纯种发酵更多。因此,果醋混菌液态发酵工艺对果醋风味的改善和提升具有重要意义。
果醋液态发酵包括乙醇发酵和醋酸发酵两步。乙醇发酵是生产高品质果醋的重要步骤,通常利用酿酒酵母厌氧发酵[15]。研究表明,酵母和乳酸菌存在共生关系,酵母在代谢过程中产生的氨基酸和维生素等可以为乳酸菌的生长提供营养因子[16];而乳酸菌代谢产生的乳酸能为酵母提供能量,还可与其他风味物质发生反应形成多种呈味物质,丰富果醋风味[17-18]。因此,酿酒酵母和乳酸菌进行混合发酵是提高乙醇发酵效率和果醋风味的有效手酸。易鑫等[19]研究发现,相对于酿酒酵母单独发酵,接种一定量的植物乳杆菌可显著提升柚子果酒中乙醇和乳酸产量。TRISTEZZA M等[20]将酿酒酵母和乳酸菌进行混合乙醇发酵,葡萄酒发酵时间明显缩短。
罗望子胶(tamarind gum,TG)是由罗望子种子胚乳经过加工而成的天然多糖,其主要成分为木葡聚糖(xyloglucan,XG)[21]。罗望子胶的分子质量约为700~800 kDa,黏度大、常温下难溶解的理化特性导致直接添加会影响果醋澄清度和稳定性[22-23]。此外,罗望子胶化学结构、组成单体复杂,使其完全降解需要不同家族糖苷水解酶参与[24]。将罗望子胶降解为部分水解罗望子胶(partially hydrolyzed tamarind gum,PHTG)可有效降低其分子质量,提高溶解性。降解后的部分水解罗望子胶主要由葡萄糖、木糖、岩藻糖、半乳糖等组成,化学结构比罗望子胶简单,更容易被微生物发酵利用[25]。鼠李糖乳杆菌(Lactobacillus rhamnosus)因具有改善脂质代谢[26]、调节机体免疫[27]和影响宿主神经系统[28]等功能,在研究和生产等方面都备受关注。目前,已有研究表明[29-32],鼠李糖乳杆菌能够分泌多种糖苷水解酶,能够高效利用半乳糖、葡萄糖和岩藻糖等单糖及相关寡糖。本研究以酸木瓜为原料,选用鼠李糖乳杆菌与酵母菌混菌酒精发酵,并从灵石醋醅中筛选了一株高产乙酸的醋酸菌LS-4用于醋酸发酵制备酸木瓜果醋。以未添加部分水解罗望子胶为对照,考察在酒精发酵阶段添加部分水解罗望子胶对酸木瓜果醋品质的影响。旨在为部分水解罗望子胶的高值化利用提供参考价值,同时为液体发酵果醋风味提升提供重要依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
酸木瓜(Chaenomeles speciosa):购买于云南临沧;醋醅:灵石德义源醋厂采样并由实验室保藏;部分水解罗望子胶(重均分子质量2.7 kDa):山地类芽孢杆菌(Paenibacillus monticola)来源的木葡聚糖酶(PmXEG74):实验室自制。
高活性干酵母(RV 171):安琪酵母股份有限公司;鼠李糖乳杆菌(Lactobacillus rhamnosus)AS 1.2466、棒状乳杆菌棒状亚种(Lactobacillus coryniformis subsp.coryniformis)NRRLB-4391、干酪乳杆菌干酪亚种(Lactobacilluscasei subsp.casei)NRRL B-1922、嗜酸乳杆菌(Lactobacillus acidophilus)NRRL B-4495、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp.bulgaricus)NRRL B-548和罗伊氏乳杆菌(Lactobacillus reuteri)CICC 6132:本实验室保藏。
1.1.2 试剂
细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技有限公司;氢氧化钠、酚酞指示剂(均为分析纯)、磷酸二氢钠、磷酸、乙醇、乙酸(均为色谱纯):上海耐克林生化科技股份有限公司;纤维素酶(50 U/mg)、果胶酶(500 U/mg):上海源叶生物科技有限公司;D-异抗坏血酸钠、柠檬酸(均为分析纯):河南万邦化工科技有限公司;白砂糖(食品级):太古糖业有限公司;总糖含量检测试剂盒:北京索莱宝科技有限公司;1,2-二氯苯(色谱级):东京化成工业株式会社。
1.1.3 培养基
醋酸菌富集培养基:葡萄糖10 g,酵母粉10 g,MgSO4·7H2O 0.008 g,NaCl 0.004 g,FeSO4·7H2O 0.004 g,MnSO4·4H2O 0.004 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌21 min,冷却后加入30 mL无水乙醇。
醋酸菌分离培养基:葡萄糖100 g,酵母粉10 g,碳酸钙20 g,琼脂15 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌21 min。
醋酸菌发酵培养基:葡萄糖10 g,酵母粉10 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌21 min,冷却后加入40 mL无水乙醇。
MRS肉汤培养基:北京奥博星生物技术有限公司。
1.2 仪器与设备
JJT-900型超净工作台:北京半导体设备一厂;DHP-9052型电热恒温培养箱、HWS24型电热恒温水浴锅:上海一恒科学仪器有限公司;HZQ-X100型恒温双层振荡培养箱:江苏太仓实验设备厂;WBL2501B打浆机:美的集团有限公司;GL-20B型高速冷冻离心机:上海安亭科学仪器厂;PB21型pH计:德国Sartorius公司;TU-1810型紫外可见分光光度计:北京普析通用仪器设备有限责任公司;DF-101S型恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;PH-53型全自动高压蒸汽灭菌锅:上海尧勋智能科技有限公司;LC-20AT 高效液相色谱仪:日本岛津公司;7890B气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国Agilent公司。
1.3 方法
1.3.1 产醋酸菌株的筛选与鉴定
取约1 g醋醅至装液量为50 mL/250 mL富集培养基中,在30 ℃、200 r/min条件下富集培养5 d。选取醋味较为浓郁的样品,用无菌水梯度稀释,取不同梯度稀释液100 μL涂布于醋酸菌分离培养基,在30 ℃下倒置培养3 d。用无菌牙签挑取能够产生透明圈的单菌落到10 mL醋酸菌发酵培养基中,30 ℃、200 r/min培养5 d,离心取上清测定总酸含量。
筛选得到菌株的基因组DNA用细菌基因组提取试剂盒提取,并将16S rDNA基因送至擎科(北京)生物科技有限公司进行测序。测序结果利用基本局部比对搜索工具(basic local alignment search tool,BLAST)与美国国立生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中收录的菌株16S rDNA进行比对。采用MEGA 11软件中邻接法(neighbor-joining,NJ)构建系统进化树,根据基本的进化树拓扑结构,采用1 000次Bootstrap抽样对待检菌株的分类进化地位进行分析评价。
1.3.2 部分水解罗望子胶对乳杆菌的增殖活性
将6株乳杆菌(鼠李糖乳杆菌AS 1.2466、棒状乳杆菌NRRLB-4391、干酪乳杆菌NRRLB-1922、嗜酸乳杆菌NRRL B-4495、德氏乳杆菌NRRL B-548和罗伊氏乳杆菌CICC 6132)分别接种于MRS培养基中,在厌氧条件下37 ℃活化24 h。利用无菌离心管4 ℃、10 000 r/min离心5 min收集菌体,用无糖MRS培养基洗涤菌体2次,并将菌体密度(OD600nm值)稀释至0.05~0.10。吸取稀释后的菌液和过0.22 μm无菌滤膜部分水解罗望子胶(PHTG)溶液(2%)各100 μL加入96孔板中,并加入50 μL矿物油液封,置于37 ℃下培养不同时间后测定菌体密度(OD600nm值)。以纯水(water)为阴性对照,低聚果糖(fructooligosaccharide,FOS)为阳性对照。
1.3.3 酸木瓜果醋的制备
挑选无病虫害、无机械损伤的酸木瓜,清洗沥干,剖开去种后切成小块,65 ℃烫漂150 s,冷却后与水等比例混合打浆。打浆过程中加入0.1%D-异抗坏血酸钠护色。用Na2CO3调节木瓜汁pH至4.0,加入0.3%的纤维素酶和果胶酶,在50 ℃、500 r/min条件下酶解12 h,60 ℃灭酶30 min,即得酸木瓜果浆。
用碳酸钠调节酸木瓜果浆pH至5.5,加入7.5%蔗糖和1%部分水解罗望子胶,在60 ℃下保温30 min。冷却后接种活化后的酵母菌和鼠李糖乳杆菌AS 1.2466,接种量分别为7.5%(V/V)和5.0%(V/V),于35 ℃条件下进行混菌酒精发酵120 h,即得酸木瓜果酒。发酵过程中定时取样,测定酒精度和总糖含量,二者不再变化判定酒精发酵结束。
混菌酒精发酵结束后,接种5.0%(V/V)活化后的醋酸菌LS-4,于30 ℃、200 r/min条件下进行醋酸发酵84 h。醋酸发酵过程中每隔12 h取样,测定总酸产量,其基本不再增加来判定醋酸发酵结束。即得酸木瓜果醋,以不添加部分水解罗望子胶的样品为对照。
1.3.4 理化指标测定
总酸含量(以乙酸计)测定:根据国标GB 12456—2021《食品安全国家标准食品中总酸的测定》中酸碱指示剂滴定法;总糖含量测定:采用总糖含量检测试剂盒(可见分光光度法)。
乙醇含量测定采用高效液相色谱法[33]。色谱条件为:Aminex HPX-87H色谱柱(4 mm×250 mm),保护柱为Carbo-H Refill,示差折光检测器温度和柱温分别为50 ℃和55 ℃,流动相5 mmol/L硫酸,流速0.6 mL/min,进样体积20 μL,洗脱时间30 min。
定性定量方法:准确配制系列浓度乙醇标准品以相同色谱条件进样,根据标准品乙醇的保留时间对待测物进行定性分析;以标准品乙醇的浓度和峰面积绘制标准曲线得到回归方程,将待测物峰面积代入回归方程求得样品中乙醇浓度。
有机酸含量测定采用高效液相色谱法[34]。色谱条件为:Waters Atlantis T3色谱柱(4.6 mm×250 mm),柱温30 ℃,检测器为紫外检测器,流动相为20 mmol/L NaH2PO4(pH 2.7,磷酸调节),流速为0.4 mL/min,进样体积10 μL,洗脱时间40 min。
挥发性风味化合物利用气相色谱-质谱联用技术[35]。
气相色谱条件:DB-WAX色谱柱(30 m×0.25 mm,0.25 μm),载气为超纯氮气(N2),柱流量为1 mL/min,进样口温度250 ℃,升温程序:起始40 ℃,保持3.5 min,以5 ℃/min升至105 ℃,然后以3 ℃/min升至190 ℃,最后以10 ℃/min升至230 ℃并保持5 min。
质谱条件:连接杆温度、传输线温度和离子源温度分别为150 ℃、280 ℃和230 ℃,电子源为电子电离(electronic ionization,EI)源,电子能量70eV,质量扫描范围33~450 m/z,扫描方式Scan。
定性定量方法:将得到的质谱图与美国国家标准技术研究所(National Institute of Standards and Technology,NIST)谱库和已有报道文献进行检索比对,对各个色谱峰对应的化合物进行定性分析。筛选匹配度>750的风味化合物,以待测物峰面积与测得的1,2-二氯苯内标(200 mg/L)峰面积比值对各种挥发性风味物质含量进行定量分析。
1.3.5 酸木瓜果醋感官评价
根据农业标准NY/T2987—2016《绿色食品果醋饮料》对酸木瓜果醋进行感官评价。设计酸木瓜果醋感官评分标准见表1。由表1可知,总分为100分,其中色泽(20分)、口感(30分)、气味(30分)、组织状态(20分)。感官评价人员根据评分标准进行打分,参评人员12人,男性、女性各6人。
表1 酸木瓜果醋感官评分标准
Table 1 Sensory evaluation standards of Chaenomeles speciosa fruit vinegar

项目 评分标准 得分/分色泽(20分)颜色为金黄色,有光泽颜色较暗,透亮但无光泽颜色暗淡,澄清度不够且无光泽16~20 11~15 0~10
续表
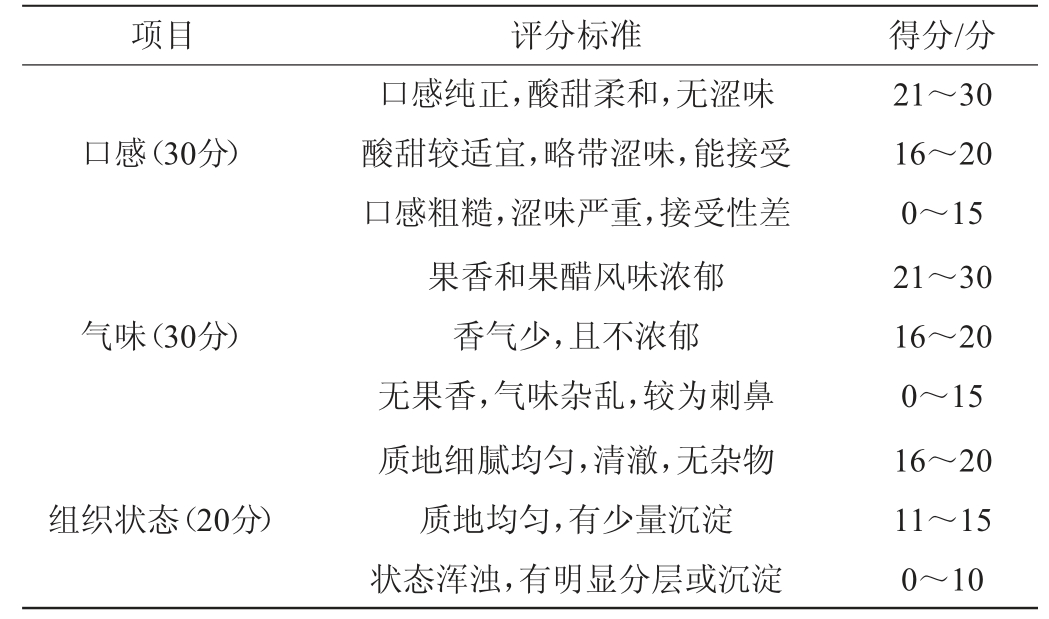
项目 评分标准 得分/分口感(30分)气味(30分)组织状态(20分)口感纯正,酸甜柔和,无涩味酸甜较适宜,略带涩味,能接受口感粗糙,涩味严重,接受性差果香和果醋风味浓郁香气少,且不浓郁无果香,气味杂乱,较为刺鼻质地细腻均匀,清澈,无杂物质地均匀,有少量沉淀状态浑浊,有明显分层或沉淀21~30 16~20 0~15 21~30 16~20 0~15 16~20 11~15 0~10
1.3.6 数据处理
数据统计分析采用SPSS 25.0软件进行方差分析(analysis of variance,ANOVA)检验(P<0.05),绘图使用Origin 9.5软件,数据结果均采用3次平行。
2 结果与分析
2.1 醋酸菌的筛选与鉴定
灵石醋醅通过富集培养、涂布分离得到单菌落,其菌落颜色为黄色并且有光泽、呈圆形;细胞形态为椭圆到杆状、稍弯曲,单个或成对。单菌落经30 ℃、200 r/min条件摇瓶发酵5 d后,菌株LS-4产酸量最高,可达38.56 g/L。该菌株16S rDNA序列长度1 387 bp,根据BLAST序列比对结果构建系统发育树见图1。由图1可知,菌株LS-4与巴氏醋杆菌巴士亚种(Acetobacter pasteuranus subsp.pasteuranus)同源性最高,为100%。因此,菌株LS-4被鉴定为巴氏醋杆菌巴士亚种(Acetobacter pasteuranus subsp.pasteuranus)。
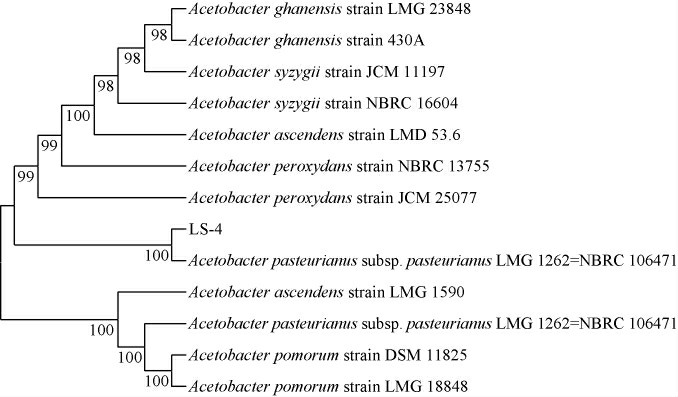
图1 基于16S rDNA基因序列菌株LS-4的系统发育树
Fig.1 Phylogenetic tree of strain LS-4 based on 16S rDNA gene sequences
菌株LS-4的产酸水平与其他研究中筛选的醋酸菌接近。冯荆舒等[36]从恒顺香醋醋醅中筛选到一株醋酸菌,其摇瓶发酵5 d产酸量为44.16 g/L。石晖琴等[37]从大红浙醋中分离的醋酸菌,其最高产酸量为34.50 g/L。
2.2 部分水解罗望子胶对乳杆菌的增殖作用
部分水解罗望子胶对六种乳杆菌的增殖作用见图2。
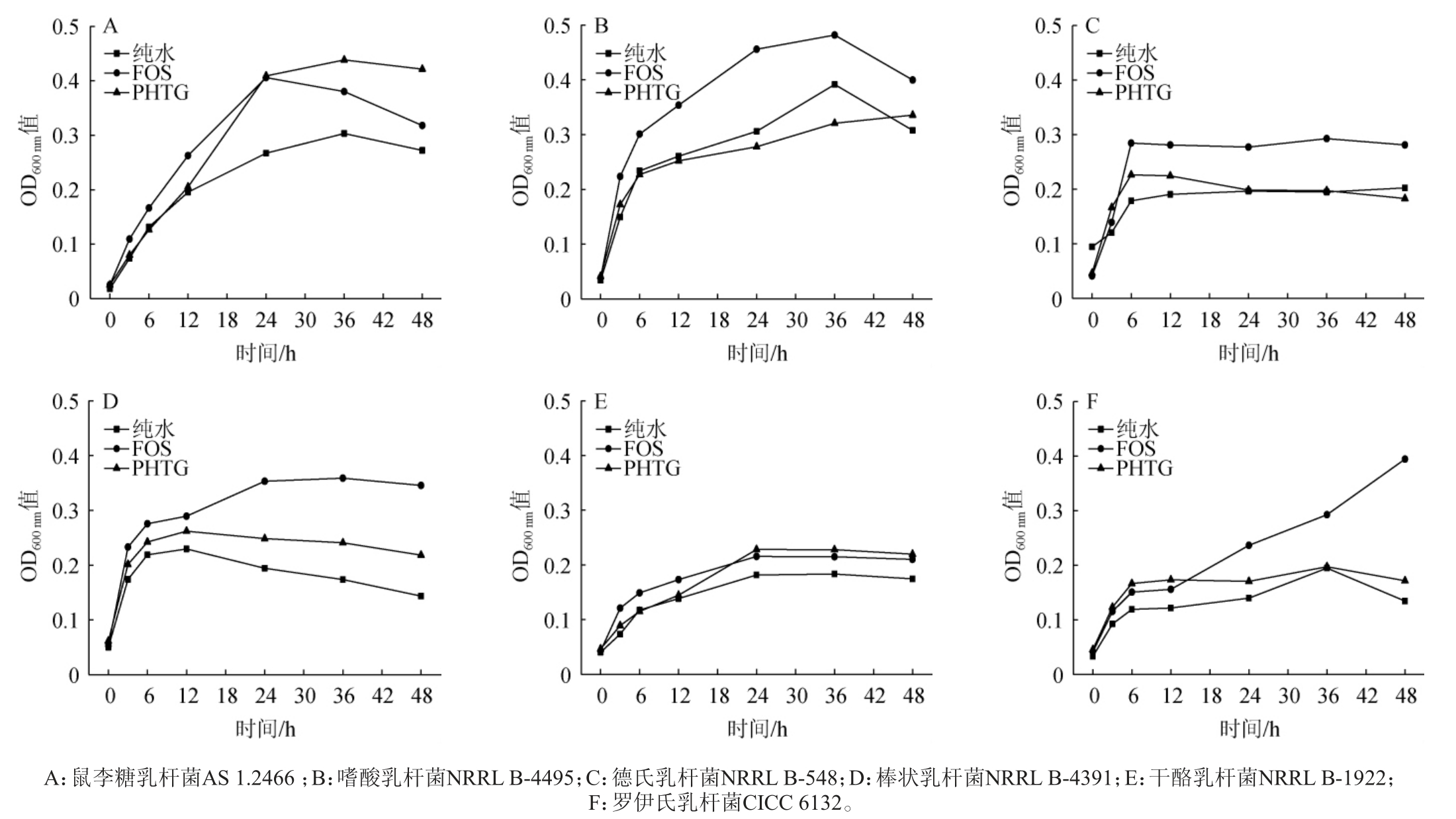
图2 部分水解罗望子胶对六种乳杆菌的增殖作用
Fig.2 Proliferative effect of partially hydrolyzed tamarind gum on 6 strains of Lactobacillus
由图2可知,部分水解罗望子胶对鼠李糖乳杆菌AS1.2466、棒状乳杆菌NRRL B-4391和干酪乳杆菌NRRL B-1922的增殖作用较为明显,分别在培养36 h、12 h、24 h后的菌体密度达到最大(OD600 nm值分别为0.44、0.26和0.18);而对嗜酸乳杆菌NRRL B-4495、德氏乳杆菌NRRL B-548和罗伊氏乳杆菌CICC 6132仅在培养前期有一定的增殖作用。与其他乳杆菌不同,部分水解罗望子胶对鼠李糖乳杆菌AS 1.2466的增殖作用最明显,培养36 h后菌体密度达到阳性对照组(低聚果糖)的1.5倍。
乳杆菌利用碳水化合物在很大程度上取决于碳水化合物的化学结构、组成单体以及乳杆菌自身的吸收机制和发酵途径[38]。许多研究表明,聚合度较低的低聚糖容易被乳杆菌利用,而聚合度较高的聚糖则难被乳杆菌利用[39-40]。与低聚果糖相比,部分水解罗望子胶由葡萄糖、木糖、岩藻糖、半乳糖等组成[25],组成单体和化学结构均更加复杂,导致大部分乳杆菌难以高效利用部分水解罗望子胶。研究表明,鼠李糖乳杆菌AS 1.2466能够有效利用低聚异麦芽糖、低聚果糖、低聚木糖和菊粉等多种碳水化合物,表明其具有丰富的碳水化合物降解酶系和转运、代谢途径[41]。这是部分水解罗望子胶能够有效促进鼠李糖乳杆菌AS 1.2466增殖的原因之一。因此,选择鼠李糖乳杆菌AS 1.2466对酸木瓜进行混菌发酵。
2.3 酸木瓜果醋酒精发酵过程中理化指标的变化
酸木瓜果醋酒精发酵过程中总糖和乙醇含量的变化见图3。由图3A可知,在酵母菌和鼠李糖乳杆菌AS 1.2466混菌发酵时,添加部分水解罗望子胶的实验组发酵36 h后总糖含量降低至21.8 g/L,随着发酵时间延长总糖含量基本保持不变;而未添加部分水解罗望子胶的对照组发酵48 h后总糖含量降低至13.3 g/L,随后保持稳定。虽然发酵48 h后对照组总糖含量减少更多,但发酵36 h时,添加部分水解罗望子胶的实验组总糖剩余量与对照组并无显著差异(P>0.05),说明部分水解罗望子胶中的一些组分可能被鼠李糖乳杆菌代谢利用。由图3B可知,混菌发酵36 h后实验组乙醇产量达到最大值3.3%(V/V),比对照组提高17.4%,这可能是由于鼠李糖乳杆菌通过代谢部分水解罗望子胶为酵母菌的生长提供能量,使得酵母菌代谢产物乙醇含量增加[17]。因此,选择混菌酒精发酵36 h后进行醋酸菌LS-4发酵。
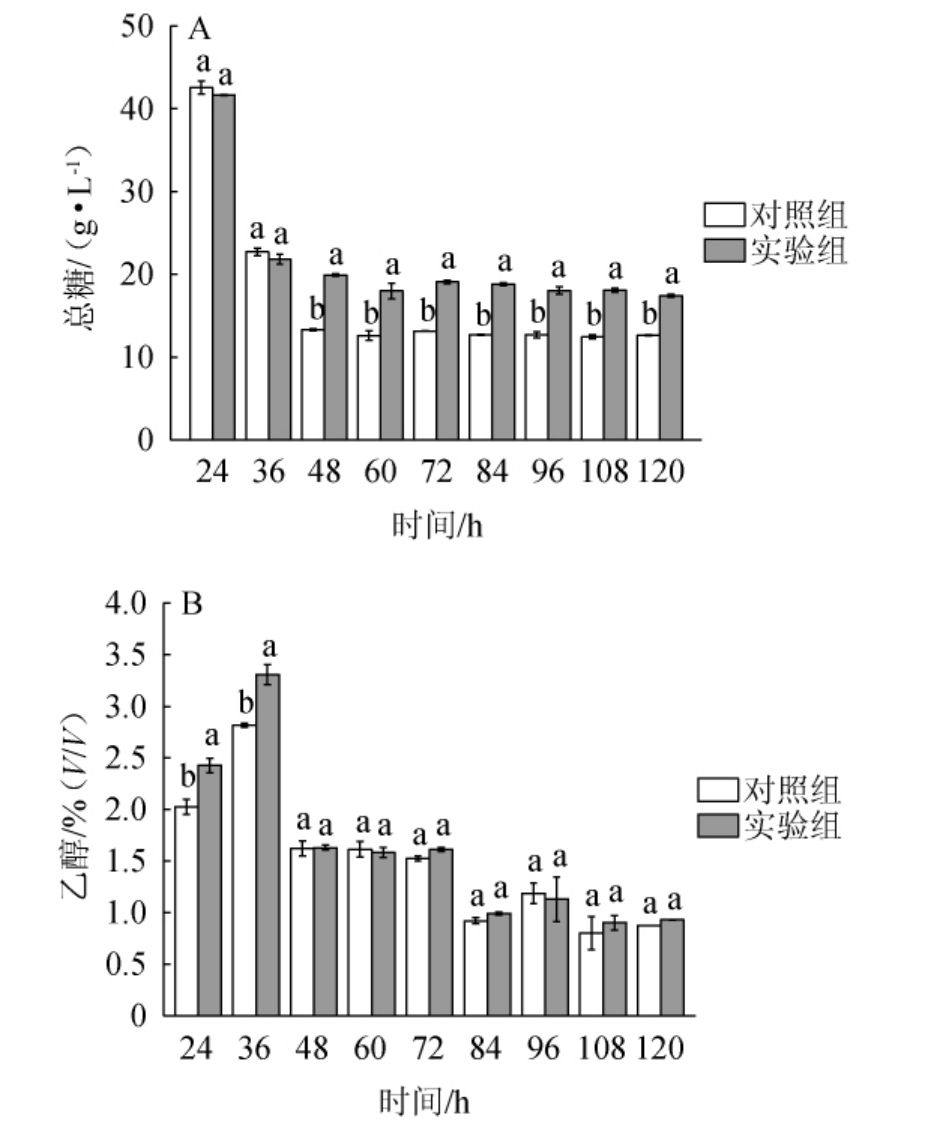
图3 添加部分水解罗望子胶对酸木瓜果醋酒精发酵过程中总糖(A)和乙醇(B)含量的影响
Fig.3 Effect of partially hydrolyzed tamarind gum addition on total sugar(A)and alcohol(B)contents during alcoholic fermentation of Chaenomeles speciosa fruit vinegar
小写字母a和b表示差异显著(P<0.05)。下同。
酵母菌和乳杆菌存在相互协同作用,酵母菌发酵产生的生长因子可促进乳杆菌生长,同时乳杆菌代谢产生的乳酸会促进酵母菌生长[17]。在酸木瓜果浆混菌酒精发酵过程中,可能由于部分水解罗望子胶促进了鼠李糖乳杆菌AS 1.2466的增殖,进而提高了酵母菌的发酵速度,使果浆中总糖含量在发酵36 h时迅速减少且此时与对照组总糖含量并无显著差异(P>0.05),而对照组总糖含量在发酵48 h后基本保持不变。
2.4 酸木瓜果醋醋酸发酵过程中总酸含量的变化
酸木瓜果醋醋酸发酵过程中总酸含量的变化见图4。
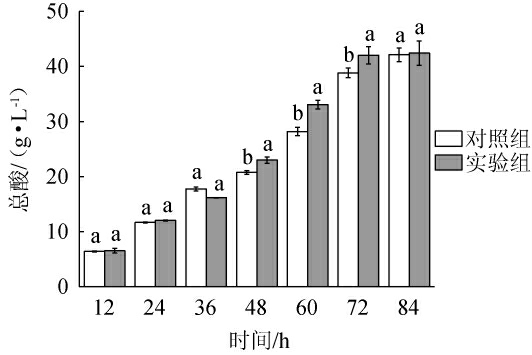
图4 酸木瓜果醋醋酸发酵过程中总酸含量的变化
Fig.4 Changes in total acid content during the acetic acid fermentation of Chaenomeles speciosa fruit vinegar
由图4可知,醋酸菌发酵过程中,总酸含量随发酵时间延长而逐渐增多,发酵72 h后实验组总酸含量达到42.0 g/L,此时比对照组提高8.0%,随后基本保持不变。但经过84 h发酵后,对照组和实验组总酸含量并无显著差异(P>0.05),这可能是由于随着发酵时间的延长,酵母菌发生自溶,导致细胞内的营养物质释放后被醋酸菌利用,造成对照组总酸含量有一定增加[42-43]。醋酸菌发酵过程中,实验组发酵时间明显缩短(12 h),这可能是因为添加部分水解罗望子胶的实验组经酒精发酵后,乙醇含量更高,使得醋酸菌代谢加快[44]。
我国现行国家标准GB 2719—2018《食品安全国家标准食醋》和农业标准NY/T 2987—2016《绿色食品果醋饮料》中分别规定了食醋和果醋饮料中总酸含量应达到35 g/L和30 g/L。经过酵母菌和鼠李糖乳杆菌混菌酒精发酵和醋酸菌醋酸发酵后,对照组和实验组酸木瓜果醋的总酸含量最高均达42.0 g/L左右,满足相关标准要求。
2.5 酸木瓜果醋香气成分分析
对酸木瓜果醋中的香气成分GC-MS分析总离子流色谱图见图5,各香气成分含量测定结果见表2。
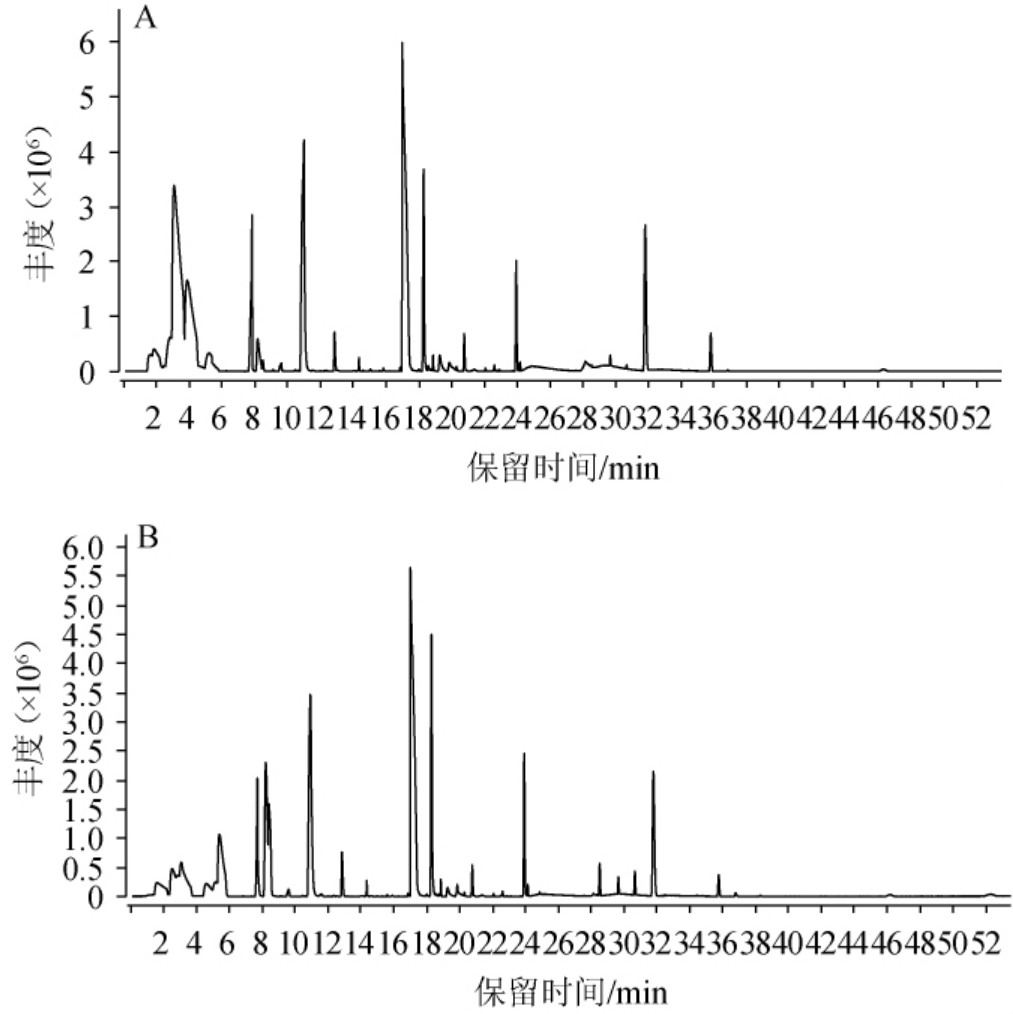
图5 酸木瓜果醋中的香气成分GC-MS分析总离子流色谱图
Fig.5 Total ion chromatogram of aroma components in Chaenomeles speciosa fruit vinegar analysis by GC-MS
A:对照组(未添加PHTG);B:实验组(添加PHTG)。
表2 酸木瓜果醋中的香气成分GC-MS分析结果
Table 2 Results of aroma components in Chaenomeles speciosa fruit vinegar analysis by GC-MS
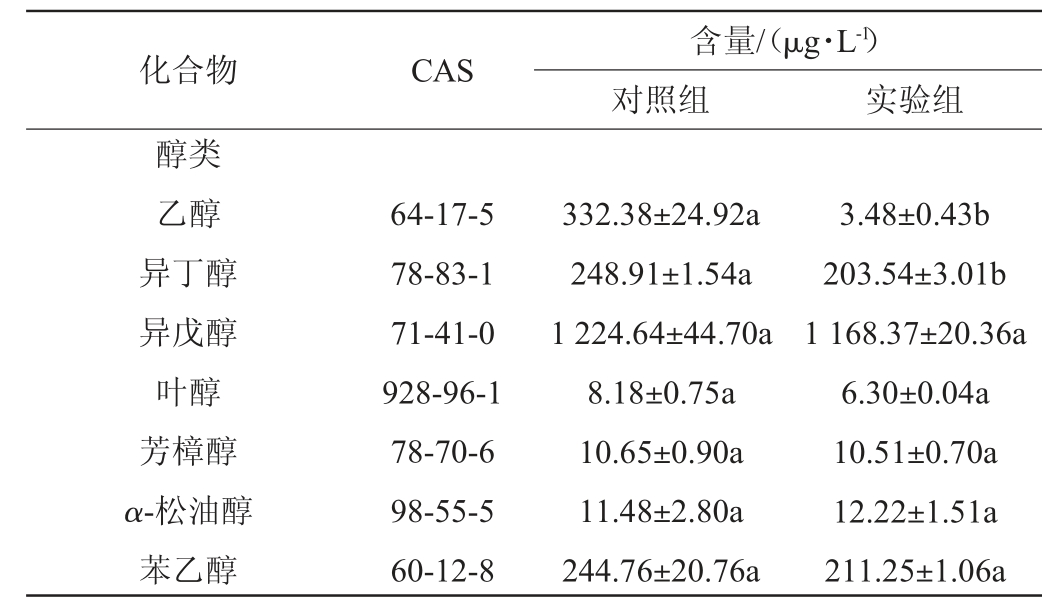
化合物 CAS 含量/(μg·L-1)对照组 实验组醇类乙醇异丁醇异戊醇叶醇芳樟醇α-松油醇苯乙醇64-17-5 78-83-1 71-41-0 928-96-1 78-70-6 98-55-5 60-12-8 332.38±24.92a 248.91±1.54a 1 224.64±44.70a 8.18±0.75a 10.65±0.90a 11.48±2.80a 244.76±20.76a 3.48±0.43b 203.54±3.01b 1 168.37±20.36a 6.30±0.04a 10.51±0.70a 12.22±1.51a 211.25±1.06a
续表
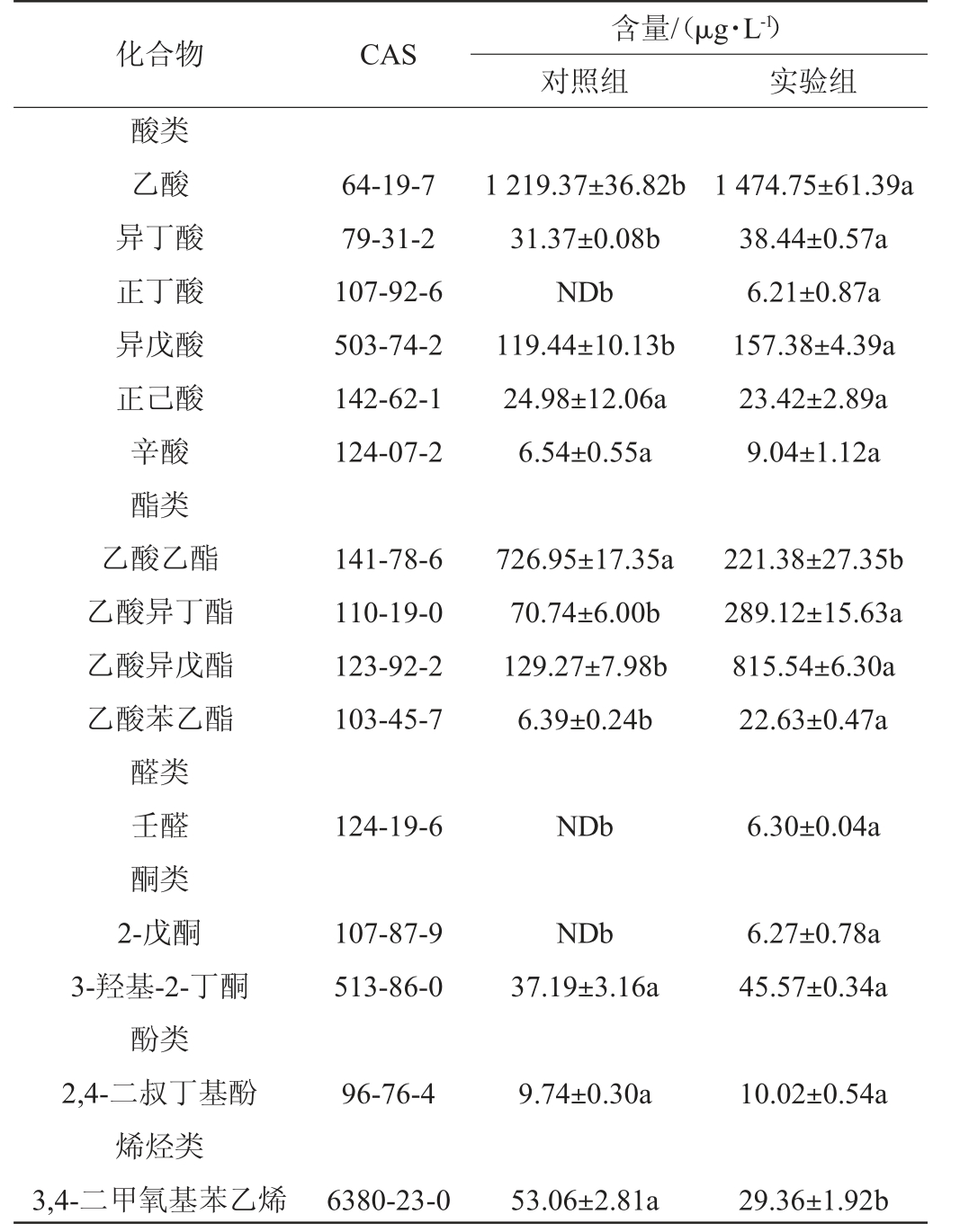
注:“ND”表示未检测出。小写字母不同表示差异显著(P<0.05)。
化合物 CAS酸类乙酸异丁酸正丁酸异戊酸正己酸辛酸酯类乙酸乙酯乙酸异丁酯乙酸异戊酯乙酸苯乙酯醛类壬醛酮类2-戊酮3-羟基-2-丁酮酚类2,4-二叔丁基酚烯烃类3,4-二甲氧基苯乙烯含量/(μg·L-1)对照组 实验组64-19-7 79-31-2 107-92-6 503-74-2 142-62-1 124-07-2 1 219.37±36.82b 31.37±0.08b NDb 119.44±10.13b 24.98±12.06a 6.54±0.55a 1 474.75±61.39a 38.44±0.57a 6.21±0.87a 157.38±4.39a 23.42±2.89a 9.04±1.12a 141-78-6 110-19-0 123-92-2 103-45-7 726.95±17.35a 70.74±6.00b 129.27±7.98b 6.39±0.24b 221.38±27.35b 289.12±15.63a 815.54±6.30a 22.63±0.47a 124-19-6 NDb 6.30±0.04a 107-87-9 513-86-0 NDb 37.19±3.16a 6.27±0.78a 45.57±0.34a 96-76-4 9.74±0.30a 10.02±0.54a 6380-23-0 53.06±2.81a 29.36±1.92b
由表2可知,未添加部分水解罗望子胶制备的酸木瓜果醋中共检出19种香气成分,其中醇类7种、酯类4种、酸类5种,醛酮类、酚类和烯烃类各1种;而添加了部分水解罗望子胶制备的酸木瓜果醋中共检出22种香气成分,其中醇类7种、酯类4种、酸类6种、醛酮类3种、酚类和烯烃类各1种。与对照相比,实验组果醋中检测出正丁酸、2-戊酮和壬醛3种化合物。添加部分水解罗望子胶后,酸木瓜果醋中的主要香气成分酸类和酯类挥发性化合物含量显著增加(P<0.05),如酸类物质中乙酸、异丁酸、正丁酸和异戊酸;酯类物质中乙酸异丁酯、乙酸异戊酯和乙酸苯乙酯。
2.6 酸木瓜果醋感官评价
酸木瓜果醋感官评价结果如表3所示,添加了部分水解罗望子胶的酸木瓜果醋感官评分80分,高于对照组果醋(74分)。部分水解罗望子胶对酸木瓜果醋的色泽、组织状态影响不明显,但对于口感和气味影响比较明显。
表3 酸木瓜果醋的感官评价结果
Table 3 Results of sensory evaluation of Chaenomeles speciosa fruit vinegar

样品 色泽/分 口感/分 气味/分 组织状态/分 总分/分对照组实验组16 16 19 22 22 24 17 18 74 80
混菌发酵过程中,乳杆菌会产生琥珀酸、苹果酸等多种有机酸[45],同时乳杆菌会利用部分水解罗望子胶产生丰富的次级代谢产物。有机酸等香气物质种类增加可以减少果醋中乙酸的刺激性,使果醋变得柔和醇厚[46]。添加部分水解罗望子胶后,混菌发酵产生的丰富的有机酸和挥发性风味物质有助于提升果醋整体风味;感官评价也表明添加部分水解罗望子胶的果醋口感更加柔和,果香味更加浓郁。
3 结论
部分水解罗望子胶对酸木瓜果醋品质有重要影响。在酵母菌和鼠李糖乳杆菌AS 1.2466混菌发酵阶段,部分水解罗望子胶可以提高乙醇产量;在醋酸菌LS-4发酵阶段,部分水解罗望子胶可以有效提高醋酸发酵速度。所得酸木瓜果醋中总酸含量可达42.0 g/L,符合相关国家标准。添加PHTG酸木瓜果醋共检出22种香气成分,其中醇类7种、酯类4种、酸类6种、醛酮类3种、酚类和烯烃类各1种,比对照新增了3种香气成分(正丁酸、2-戊酮和壬醛)。感官评价结果表明,添加PHTG有效提升酸木瓜果醋的口感和气味评分,改善酸木瓜果醋的感官品质。本研究为部分水解罗望子胶提供了新的应用领域,也为果醋品质的改善提供了理论和实践基础。
[1]RASHIMA R S,JASMIN A N A,ONG W L,et al.Effect of combination pre-treatment conditions on the physicochemical properties, antioxidant activities,and sensory acceptability of Carica papaya L.Eksotika juice[J].J Food Meas Charact,2022,16(6):4584-4595.
[2]MIAO J,LI X,ZHAO C C,et al.Solvents effect on active chemicals and activities of antioxidant,anti-alpha-glucosidase and inhibit effect on smooth muscle contraction of isolated rat jejunum of Chaenomeles speciosa[J].J Funct Foods,2018,40:146-155.
[3]YAO G D, LIU C Q, HUO H Q, et al.Ethanol extract of Chaenomeles speciosa Nakai induces apoptosis in cancer cells and suppresses tumor growth in mice[J].Oncol Lett,2013,6(1):256-260.
[4]ZHANG L,CHENG Y X,LIU A L,et al.Antioxidant,anti-inflammatory and anti-influenza properties of components from Chaenomeles speciosa[J].Molecules,2010,15(11):8507-8517.
[5]张月婷,陈中,林伟锋.控制木瓜果脯非酶褐变的研究[J].食品工业科技,2014,35(2):255-258.
[6]MARTÍNEZ S E Q,FUENTES E E T,ZAPATEIRO L A G.Food hydrocolloids from butternut squash (Cucurbita moschata) peel: Rheological properties and their use in Carica papaya jam[J].ACS Omega,2021,6(18):12114-12123.
[7]张健,赵庆桃,李静思,等.云南产区酸木瓜酒品质改良研究[J].中国果菜,2022,42(10):22-29.
[8]吴国卿,王文平,陈燕,等.液态发酵法酿造野木瓜果醋[J].食品研究与开发,2012,33(6):92-97.
[9]LIU F,HE Y,WANG L,et al.Detection of organic acids and pH of fruit vinegars using near-infrared spectroscopy and multivariate calibration[J].Food Bioproc Technol,2011,4(8):1331-1340.
[10]UBEDA C,CALLEJÓN R M,HIDALGO C,et al.Determination of major volatile compounds during the production of fruit vinegars by static headspace gas chromatography-mass spectrometry method[J].Food Res Int,2011,44(1):259-268.
[11]WEI K,CAO X H,LI X,et al.Genome shuffling to improve fermentation properties of acetic acid bacterium by the improvement of ethanol tolerance[J].Int J Food Sci Technol,2012,47(10):2184-2189.
[12]LIU D R,ZHU Y,BEEFTINK R,et al.Chinese vinegar and its solid-state fermentation process[J].Food Rev Int,2004,20(4):407-424.
[13]WU L H, LU Z M, ZHANG X J, et al.Metagenomics reveals flavour metabolic network of cereal vinegar microbiota[J].Food Microbiol,2017,62:23-31.
[14]邢晓莹,于迪,乔羽,等.山楂果醋混合菌种发酵工艺及香气成分的HS-SPME/GC-MS分析[J].中国调味品,2021,46(1):146-152.
[15]CHEN Y,HUANG Y,BAI Y,et al.Effects of mixed cultures of Saccharomyces cerevisiae and Lactobacillus plantarum in alcoholic fermentation on the physicochemical and sensory properties of citrus vinegar[J].Food Sci Technol,2017,84:753-763.
[16]ROOSTITA R, FLEET G H.The occurrence and growth of yeasts in Camembert and Blue-veined cheeses[J].Int J Food Microbiol, 1996,28(3):393-404.
[17]ADESULU-DAHUNSI A T,DAHUNSI S O,OLAYANJU A.Synergistic microbial interactions between lactic acid bacteria and yeasts during production of Nigerian indigenous fermented foods and beverages[J].Food Control,2020,110:106963.
[18]王梓桐,刘堉萍,汪超,等.乳酸菌与酵母菌联合发酵改善食品品质研究进展[J].中国酿造,2023,42(10):12-17.
[19]易鑫,谈安群,欧阳祝,等.植物乳杆菌混菌发酵对梁平柚果酒理化性质及风味影响[J].食品与发酵工业,2021,47(11):180-187.
[20]TRISTEZZA M,DI FEO L,TUFARIELLO M,et al.Simultaneous inoculation of yeasts and lactic acid bacteria:Effects on fermentation dynamics and chemical composition of Negroamaro wine[J].LWT-Food Sci Technol,2016,66:406-412.
[21]KUMAR C S, BHATTACHARYA S.Tamarind seed: properties, processing and utilization[J].Crit Rev Food Sci Nutr,2008,48(1):1-20.
[22]CHAWANANORASEST K, SAENGTONGDEE P, KAEMCHANTUEK P.Extraction and characterization of Tamarind (Tamarind indica L.)seed polysaccharides(TSP)from three difference sources[J].Molecules,2016,21(6):775-784.
[23]KHOUNVILAY K, SITTIKIJYOTHIN W.Rheological behaviour of tamarind seed gum in aqueous solutions[J].Food Hydrocolloid,2011,26(2):334-338.
[24]CHENG R, CHENG L, WANG L, et al.Characterization of an alkalistable xyloglucanase/mixed-linkage β-glucanase Pgl5A from Paenibacillus sp.S09[J].Int J Biol Macromol,2019,140:1158-1166.
[25]WANG N N,LI Y X,MIAO M,et al.High level expression of a xyloglucanase from Rhizomucor miehei in Pichia pastoris for production of xyloglucan oligosaccharides and its application in yoghurt[J].Int J Biol Macromol,2021,190:1-7.
[26]PARK S, KANG J, CHOI S, et al.Cholesterol-lowering effect of Lactobacillus rhamnosus BFE5264 and its influence on the gut microbiome and propionate level in a murine model[J].Plos One,2018,13(8):e0203150.
[27]KOLLING Y,SALVA S,VILLENA J,et al.Are the immunomodulatory properties of Lactobacillus rhamnosus CRL1505 peptidoglycan common for all Lactobacilli during respiratory infection in malnourished mice?[J].Plos One,2018,13(3):e0194034.
[28]WANG H Y,LEE I S,BRAUN C,et al.Effect of probiotics on central nervous system functions in animals and humans: A systematic review[J].J Neurogastroenterol Motil,2016,22(4):589-605.
[29]LARSBRINK J, ROGERS T E, HEMSWORTH G R, et al.A discrete genetic locus confers xyloglucan metabolism in select human gut Bacteroidetes[J].Nature,2014,506(7489):498-502.
[30]DOUILLARD F P,RIBBERA A,KANT R,et al.Comparative genomic and functional analysis of 100 Lactobacillus rhamnosus strains and their comparison with strain GG[J].Plos Genet,2013,9(8):e1003683.
[31]CEAPA C,LAMBERT J,LIMPT K V,et al.Correlation of Lactobacillus rhamnosus genotypes and carbohydrate utilization signatures determined by phenotype profiling[J].Appl Environ Microbiol,2015,81(16):5458-5470.
[32]HUANG D,YANG B,CHEN Y,et al.Comparative genomic analyses of Lactobacillus rhamnosus isolated from Chinese subjects[J].Food Biosci,2020,(36):100659.
[33]何丁平,吕雪,郭东毅,等.球磨玉米秸秆高固体酶解工艺模拟及经济性分析[J].生物加工过程,2021,19(4):448-456.
[34]余永建,邓晓阳,陆震鸣,等.高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化[J].食品科学,2014,35(4):55-59.
[35]AL-DALALI S,ZHENG F P,SUN B G,et al.Effects of different brewing processes on the volatile flavor profiles of Chinese vinegar determined by HS-SPME-AEDA with GC-MS and GC-O[J].LWT-Food Sci Technol,2020,133:109969.
[36]冯荆舒,张荣,高献礼,等.醋醅中优良醋酸菌的分离筛选及性能研究[J].食品与发酵工业,2023,49(1):95-100.
[37]石晖琴,张工,张彦民,等.大红浙醋醋酸菌分离及其产酸关键氨基酸分析[J].中国酿造,2022,41(2):34-39.
[38]WATSON D,MOTHERWAY M O,SCHOTERMAN M H C,et al.Selective carbohydrate utilization by Lactobacilli and Bifidobacteria[J].J Appl Microbiol,2013,114:1132-1146.
[39]VAN LAERE K M J,HARTEMINK R,BOSVELD M,et al.Fermentation of plant cell wall derived polysaccharides and their corresponding oligosaccharides by intestinal bacteria[J].J Agr Food Chem,2000,48:1644-1652.
[40]SONG A X,MAO Y H,SIU K C,et al.Bifidogenic effects of Cordyceps sinensis fungal exopolysaccharide and konjac glucomannan after ultrasound and acid degradation[J].Int J Biol Macromol,2018,111:587-594.
[41]NIU Z H,ZOU M J,BEI T T,et al.Effect of fructooligosaccharides on the colonization of Lactobacillus rhamnosus AS 1.2466T in the gut of mice[J].Food Science and Human Wellness,2023,12(2):607-613.
[42]马腾臻,鲁榕榕,孙永蓉,等.适应活化条件对起泡葡萄酒酵母发酵特性的影响[J].农产品加工,2018(24):1-6.
[43]苏星,张政,张棋炜,等.固态发酵下酵母自溶的工艺优化[J].生物工程学报,2019,35(4):726-736.
[44]CHAKRABORTY K,SAHA K S,RAYCHAUDHURI U,et al.Vinegar from Bael(Aegle marmelos):A mixed culture approach[J].Indian Chem Eng,2018,60(4):384-395.
[45]KULEY E, ÖZYURT G, ÖZOGUL I, et al.The role of selected lactic acid bacteria on organic acid accumulation during wet and spray-dried fish-based silages.contributions to the winning combination of microbial food safety and environmental sustainability[J].Microorganisms,2020,8(2):172.
[46]赵松,王颉,刘亚琼.不同发酵方法对枣醋主要有机酸含量的影响[J].中国食品学报,2014,14(3):135-139.