晋西北酸粥是以糜米(Panicum miliaceum)为主料,经常温自然发酵而成的传统发酵食品[1]。晋西北酸粥,具有上千年的食用历史,不仅酸爽可口、风味独特[2],而且具有消食健胃、生津止渴的作用,所以是当地居民主食中的必备佳品。
胞外多糖(exopolysaccharides,EPS)指乳酸菌分泌到细胞外的荚膜多糖或粘液多糖[3],其是一种安全的生物大分子[4],具如下多种生物活性:①抗氧化。嗜酸乳杆菌(Lactobacillus acidophilus)[4]、干酪乳杆菌(Lactobacillus casei)[4]、肠膜明串珠菌(Leuconostoc mesenteroides)[4]、乳酸乳球菌(Lactococcus lactis)[4]、格氏乳杆菌(Lactobacillus gasseri)[5]的EPS均对1,1-二苯基-2-三硝基苯肼有不同程度的清除活性。②抗肿瘤。格氏乳杆菌的EPS 能抑制HeLa细胞的增殖[6],植物乳杆菌NCU116的EPS能增加升高促凋亡基因的表达来抑制癌细胞增殖[7]。③抗炎。副干酪乳杆菌(Lactobacillus paracasei)和植物乳杆菌的EPS可以促进巨噬细胞增殖和促炎因子的释放[6],戊糖乳杆菌(Lactobacillus pentosus)的EPS可促进肿瘤坏死因子-α、白介素的释放[8]。④降低胆固醇。副干酪乳杆菌的EPS可将胆固醇溶液中的胆固醇降低至70.78%[9]。⑤预防糖尿病。植物乳杆菌的EPS可降低胰岛素抵抗HepG2细胞株中α-淀粉酶的表达,增加葡萄糖转运蛋白-4、蛋白激酶B和腺苷酸活化蛋白激酶的基因表达,促进细胞对葡萄糖的吸收[10]。⑥抗病毒。德氏乳杆菌(Lactobacillus delbrueckii)OLL1073R-1的EPS可上调猪肠上皮细胞中干扰素相关基因的表达,显著提高其抗病毒活性[11]。⑦作为免疫调节剂。瑞士乳杆菌(Lactobacillus helveticus)LZ-R-5的EPS能促进巨噬细胞增殖、增强酸性酶活性和促进细胞因子的产生来增强免疫调节活性[12],干酪乳杆菌的EPS能使细胞免疫活性增强[13]。⑧抗生物膜。融合魏斯氏菌(Weissella confusa)的EPS对白色念珠菌SC5314的生物膜抑制率达到70%等[14]。因此,EPS在食品、化妆品、生物医药和组织工程等行业应用广泛[15]。
不同乳酸菌的胞外多糖产量不同。干酪乳杆菌的EPS产量为50~130 mg/L[16-18],副干酪乳杆菌副干酪亚种(Lactobacillus paracasei subsp. paracasei)M5L 的EPS 产 量 为167.2 mg/mL[19],发酵黏液乳杆菌(Limosilactobacillus fermentum)的EPS产量为307.53 mg/L[20],植物乳杆菌C88的EPS产量为2g/L[21],植物乳杆菌LPC-1的EPS产量为2.06g/L[22],长双歧杆菌婴儿亚种(Bifidobacterium longum subsp.infantis)BF66-16的EPS产量为513.06 mg/L[23]。迄今为止,对乳酸菌EPS的研究中,除了肠膜明串珠菌的右旋糖酐已工业化外,其他乳酸菌的EPS产量较低,制约了其发展。因此,需要不断摸索条件来提高EPS的产量。
研究表明,分离自我国西藏酸马奶酒中的短乳杆菌的EPS产量为160 mg/L[24]。该研究以分离自晋西北酸粥、并能产生胞外多糖(EPS)的短乳杆菌(Levilactobacillus brevis)M-10为研究对象[25],采用MRS培养基,在优化碳源、氮源的基础上,通过单因素试验和响应面试验,对短乳杆菌M-10产EPS的发酵工艺进行优化。分别考察发酵温度、发酵时间、初始pH值和接种量对菌株M-10产胞外多糖(EPS)的影响,旨在最大程度地获得胞外多糖(EPS),为短乳杆菌M-10胞外多糖开发为功能性食品奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
短乳杆菌(Levilactobacillus brevis)M-10:本实验室保存于含有甘油(30%,V/V)的MRS液体培养基中,-80 ℃保藏,使用前30 ℃活化3次。
1.1.2 化学试剂
葡萄糖、酵母膏、果糖、吐温-80、牛肉膏、蔗糖、胰蛋白胨、乙酸钠、蛋白胨、磷酸氢二钾、大豆蛋白、七水硫酸锰、苯酚、柠檬酸二铵、三氯乙酸、四水硫酸锰、无水乙醇、甘油、透析袋(截留分子质量8 000~14 000 Da):索莱宝生物工程股份有限公司;浓硫酸、浓盐酸:山西国药集团有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母膏5 g/L,牛肉膏10 g/L,乙酸钠5 g/L,磷酸氢二钾2 g/L,硫酸镁0.58g/L,柠檬酸氢二铵2g/L,硫酸锰0.25g/L,吐温-801mL/L,蒸馏水1 L,pH值调至6.2~6.4。121 ℃灭菌15 min。
1.2 仪器与设备
SPX-250B-Z型生化培养箱、BXM-30R型高压蒸汽灭菌器:上海博迅工业有限公司医用设备厂;Centrifuge5430R型高速冷冻离心机:德国艾本德公司;TU-1810型紫外可见光分光计:北京普析通用仪器有限责任公司;RE-52AA型旋转蒸发仪:上海亚荣生化仪器厂。
1.3 方法
1.3.1 短乳杆菌M-10的种子液及发酵液的制备
从甘油管中吸取50 μL菌液接种于3 mL MRS液体培养基,30 ℃静置活化培养12~16 h至对数中期,得到短乳杆菌M-10种子液。将短乳杆菌M-10种子液按3%(V/V)接种量接种于MRS培养基中,于30 ℃静置培养48 h,得到短乳杆菌M-10发酵液。
1.3.2 胞外多糖的制备及含量测定
胞外多糖提取方法参考XIU L等[13]方法稍作修改。将短乳杆菌M-10发酵液于4 ℃、10 000 r/min条件下离心20 min,取上清液加入体积分数为80%三氯乙酸去除蛋白,使其终浓度为4%,4 ℃静置12 h后于4 ℃、10 000 r/min条件下离心20 min。向上清液加入3倍体积的无水乙醇,4 ℃条件下静置12 h 后于4 ℃、10 000 r/min条件下离心20 min。将沉淀溶解于蒸馏水中,装入透析袋中透析48 h(每间隔4 h换一次水),再经真空浓缩、冷冻干燥即得到胞外多糖。
胞外多糖含量:采用苯酚-硫酸法[26]测定。
1.3.3 短乳杆菌M-10产胞外多糖培养基碳源及氮源优化
碳源种类及最佳碳源添加量对EPS产量的影响:向MRS培养基(初始pH 6.2)中接种2.0%(V/V)短乳杆菌M-10,设置葡萄糖、果糖、蔗糖、乳糖和麦芽糖添加量均为20 g/L,于30℃静置培养48h,考察不同碳源对EPS产量的影响。在确定最佳碳源的基础上,设置最佳碳源添加量分别为10 g/L、20 g/L、30 g/L、40 g/L、50 g/L,通过测定EPS产量确定最佳碳源的添加量。
氮源种类及最佳氮源添加量对EPS产量的影响:向MRS培养基(初始pH 6.2)中接种2.0%(V/V)短乳杆菌M-10,设置酪蛋白、胰蛋白胨、蛋白胨、大豆蛋白胨和氯化铵添加量均为10 g/L,于30 ℃静置培养48 h,考察不同氮源对EPS产量的影响。在确定最佳氮源的基础上,设置最佳氮源添加量分别为5 g/L、10 g/L、15 g/L、20 g/L、25 g/L,通过测定EPS产量确定最佳氮源添加量。
1.3.4 短乳杆菌M-10产胞外多糖发酵工艺优化
(1)单因素试验
发酵温度的选择:向MRS培养基接种2.0%(V/V)短乳杆菌M-10,分别在发酵温度20 ℃、25 ℃、30 ℃、35 ℃、40 ℃条件下培养,考察不同发酵温度对EPS产量的影响。
发酵时间的选择:向MRS培养基接种2.0%(V/V)短乳杆菌M-10,分别在发酵时间为36 h、48 h、60 h、72 h、84 h条件下培养,考察不同发酵时间对EPS产量的影响。
初始pH值的选择:向MRS培养基接种2.0%(V/V)短乳杆菌M-10,分别在5.0、5.5、6.0、6.5、7.0初始pH值条件下培养,考察不同初始pH值对EPS产量的影响。
接种量的选择:向MRS培养基中分别接种0.5%、1.0%、1.5%、2.0%、2.5%(V/V)短乳杆菌M-10,于30 ℃静置培养72 h,考察不同接种量对EPS产量的影响。
(2)响应面试验
在单因素试验基础上,利用Design-Export 12.0软件设计Box-Behnken试验,选取发酵温度(A)、发酵时间(B)、初始pH值(C)、接种量(D)为自变量,以EPS产量(Y)为响应值,优化短乳杆菌M-10产EPS发酵工艺。Box-Behnken试验设计因素与水平见表1。
表1 发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for fermentation process optimization
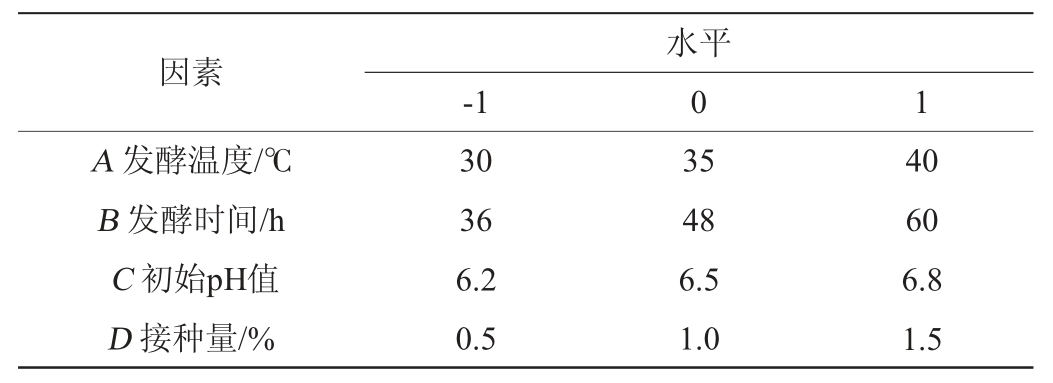
因素A 发酵温度/℃B 发酵时间/h C 初始pH值D 接种量/%-1水平0 1 30 36 6.2 0.5 35 48 6.5 1.0 40 60 6.8 1.5
1.3.5 数据处理
结果以“平均值±标准差”表示,通过SPSS 17.0软件利用Ducan多重比较法分析差异的显著性。
2 结果与分析
2.1 MRS培养基碳源和氮源的优化
2.1.1 碳源对短乳杆菌M-10EPS产胞外多糖影响
由图1A可知,五种糖为碳源短乳杆菌M-10均可产EPS,但产量差异显著(P<0.05);其中葡萄糖EPS产量最高,为(0.523±0.007)g/L。碳源是除水分之外微生物需要量最大的结构性营养物,构成微生物体有机分子的骨架,也是大多数微生物的能源物质。异养微生物所能利用的碳源是有机碳,其中糖类包括单糖、双糖、多糖等,这些都是优先利用的种类。异养微生物可以利用的碳源会随微生物种类的变化而变化。
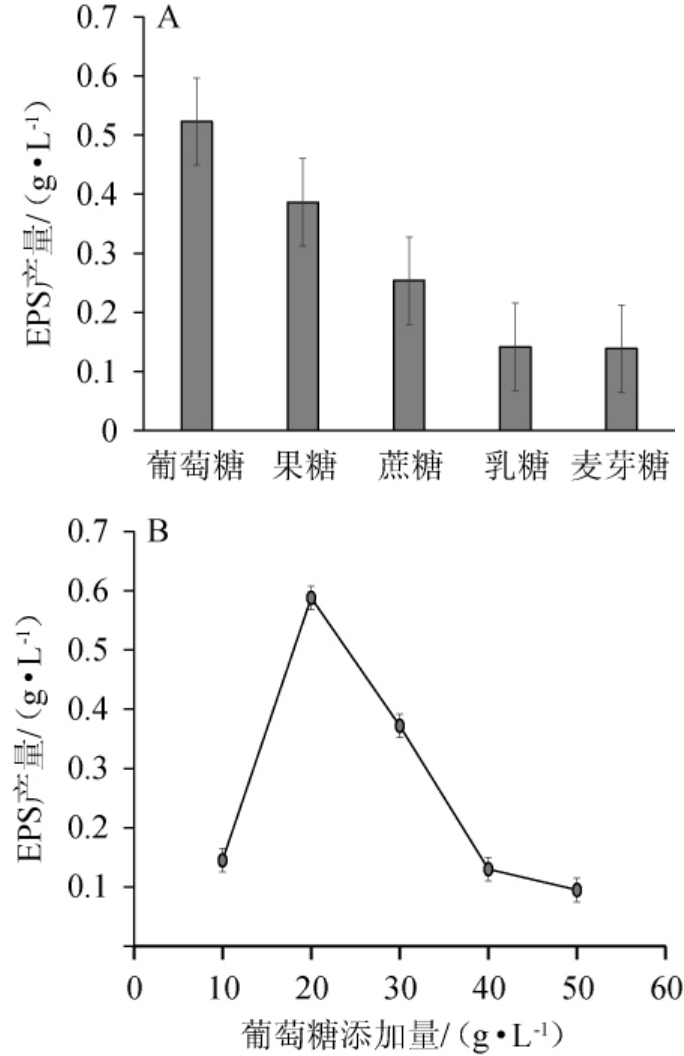
图1 碳源种类(A)及葡萄糖添加量(B)对胞外多糖产量的影响
Fig.1 Effects of carbon source types (A) and glucose addition (B)on exopolysaccharides yield
不同字母表示差异显著(P<0.05)。下同。
由图1B可知,在葡萄糖添加量为10~20 g/L时,EPS产量随之上升;葡萄糖添加量为20 g/L时,EPS产量最大,为(0.588±0.024)g/L;葡萄糖添加量>20 g/L之后,EPS产量反而呈现下降的趋势。在葡萄糖添加量较低时,EPS产量较低,原因可能是葡萄糖仅够微生物维持基本的生长和繁殖。而随着葡萄糖添加量的增加,产生EPS的前体物质充足,因而EPS产量增大。因此,最适葡萄糖添加量为20 g/L。
2.1.2 氮源对短乳杆菌M-10EPS产胞外多糖的影响
由图2A可知,三种氮源均可以被短乳杆菌M-10所利用代谢产生EPS,但是产量差异显著(P<0.05)。其中,蛋白胨为氮源的情况下EPS产量最高,为(0.601±0.001 3)g/L。由此可见,蛋白胨是短乳杆菌M-10生产EPS的最适氮源。
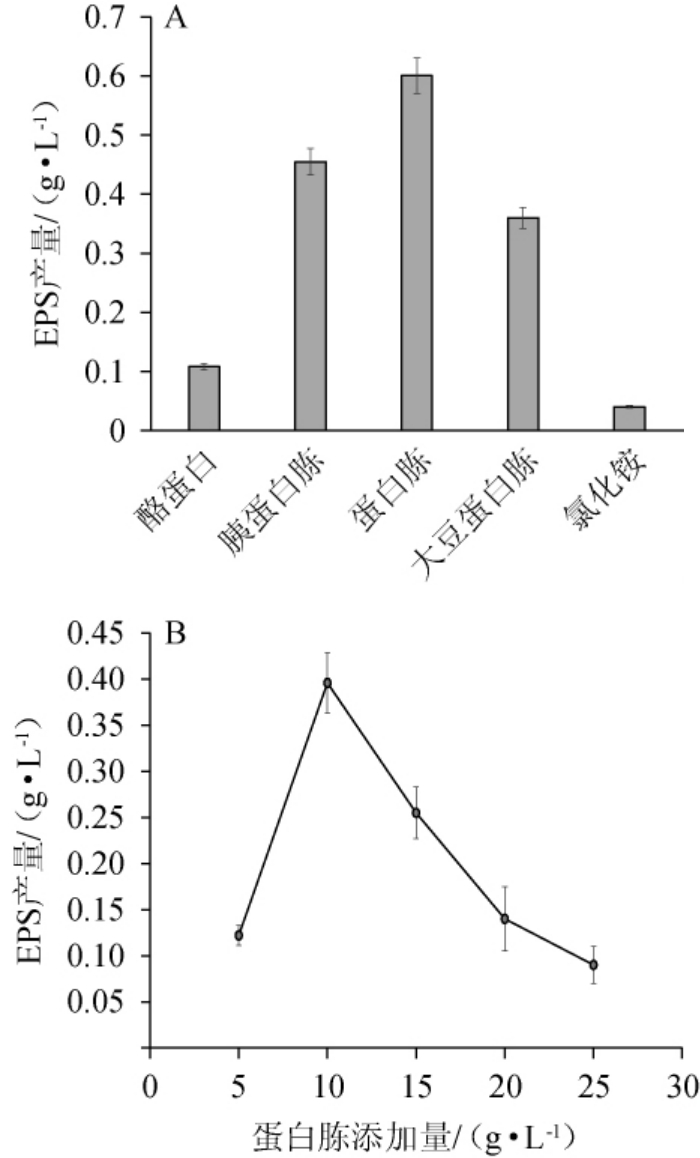
图2 氮源种类(A)及蛋白胨添加量(B)对胞外多糖产量的影响
Fig.2 Effects of nitrogen source types (A) and peptone addition (B)on exopolysaccharides yield
由图2B可知,在蛋白胨添加量为5~10 g/L时,EPS产量随之上升;在蛋白胨添加量为10 g/L 时,EPS产量达到峰值,为(0.396±0.033)g/L;在蛋白胨添加量>10 g/L之后,EPS产量有所下降。这可能是合成微生物重要生命物质所必需的氮源缺乏,造成微生物基本的生长繁殖受限,进而对EPS的合成造成影响。在提高蛋白胨含量后,EPS产量也随之上升。因此,最适蛋白胨添加量为10 g/L。
2.2 短乳杆菌M-10EPS产胞外多糖发酵工艺优化单因素试验
由图3A可知,随着发酵温度在20~35 ℃范围内的升高,EPS产量逐步上升;在发酵温度为35 ℃时,EPS产量最高,为(0.690±0.011)g/L;在发酵温度>35 ℃之后,EPS产量开始下降。这说明低温和高温均会显著影响短乳杆菌M-10EPS的产量,低温时菌体生长缓慢,而高温时合成EPS的酶活性降低。因此,最适发酵温度为35 ℃。
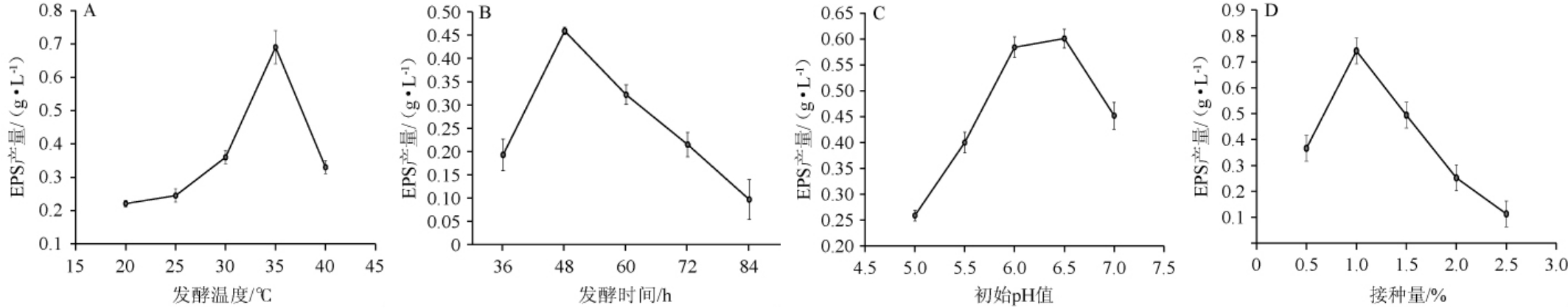
图3 发酵工艺条件对胞外多糖产量的影响
Fig.3 Effect of fermentation process conditions on exopolysaccharides yield
微生物均有自己的生长周期,不同生长周期的代谢产物不同。因此,研究获得微生物代谢物的最佳时间是非常必要的。由图3B可知,发酵时间在36~48 h时,EPS产量随之上升;发酵时间在48 h时,EPS的产量最大,为(0.459±0.008)g/L;发酵时间>48 h之后,EPS产量有所下降,可能是菌体产生酶分解EPS的原因[22]。因此,最适发酵时间为48 h。
合适的初始pH值是微生物正常生长代谢的保障,这主要是因为初始pH值可以影响营养物质的离子化程度和细胞膜功能。由图3C可知,初始pH值为5.0~6.5时,EPS产量随之上升;初始pH值为6.5时,EPS产量最高,为(0.601±0.006)g/L;初始pH值>6.5之后,EPS产量有所下降。这可能是乳酸菌合成EPS相关反应的酶活受到初始pH值的影响,继而对EPS产量产生影响。因此,最适初始pH值为6.5。
微生物代谢物的产量直接受接种量的影响。由图3D可知,接种量在0.5%~1.0%时,EPS产量随之升高;在接种量为1.0%(V/V)时,EPS产量最高,为(0.742±0.001)g/L。接种量>1.0%之后,EPS产量开始缓慢回落。这说明较低的接种量会导致代谢产物产生过少;而过高的接种量则在培养基中加速了养分的消耗[17],也使得EPS产量出现了较大幅度的下滑。因此,最适接种量为1.0%(V/V)。
2.3 短乳杆菌M-10EPS产胞外多糖发酵工艺优化响应面试验
2.3.1 发酵工艺优化Box-Behnken试验结果
在单因素试验基础上,利用Design-Export 12.0软件设计Box-Behken试验,选取发酵温度(A)、发酵时间(B)、初始pH值(C)、接种量(D)为自变量,以胞外多糖(EPS)产量(Y)为响应值,优化短乳杆菌M-10产胞外多糖(EPS)发酵工艺。Box-Behnken试验设计与结果见表2,方差分析见结果表3。
表2 发酵工艺优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for fermentation process optimization
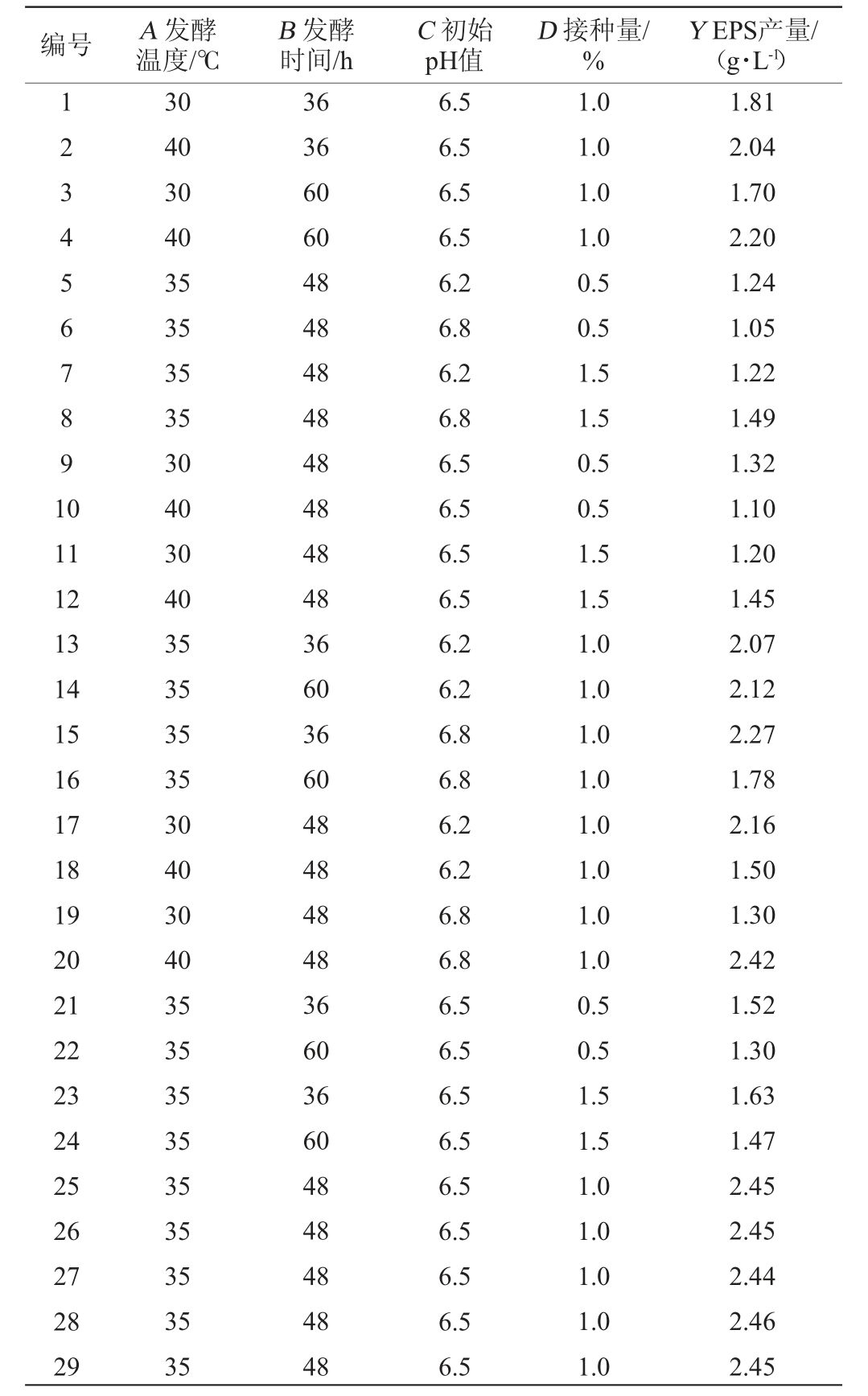
编号 A 发酵温度/℃B 发酵时间/h C 初始pH值D 接种量/%Y EPS产量/(g·L-1)1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 40 30 40 35 35 35 35 30 40 30 40 35 35 35 35 30 40 30 40 35 35 35 35 35 35 35 35 35 36 36 60 60 48 48 48 48 48 48 48 48 36 60 36 60 48 48 48 48 36 60 36 60 48 48 48 48 48 6.5 6.5 6.5 6.5 6.2 6.8 6.2 6.8 6.5 6.5 6.5 6.5 6.2 6.2 6.8 6.8 6.2 6.2 6.8 6.8 6.5 6.5 6.5 6.5 6.5 6.5 6.5 6.5 6.5 1.0 1.0 1.0 1.0 0.5 0.5 1.5 1.5 0.5 0.5 1.5 1.5 1.0 1.0 1.0 1.0 1.0 1.0 1.0 1.0 0.5 0.5 1.5 1.5 1.0 1.0 1.0 1.0 1.0 1.81 2.04 1.70 2.20 1.24 1.05 1.22 1.49 1.32 1.10 1.20 1.45 2.07 2.12 2.27 1.78 2.16 1.50 1.30 2.42 1.52 1.30 1.63 1.47 2.45 2.45 2.44 2.46 2.45
表3 回归模型方差分析
Table 3 Variance analysis of regression model
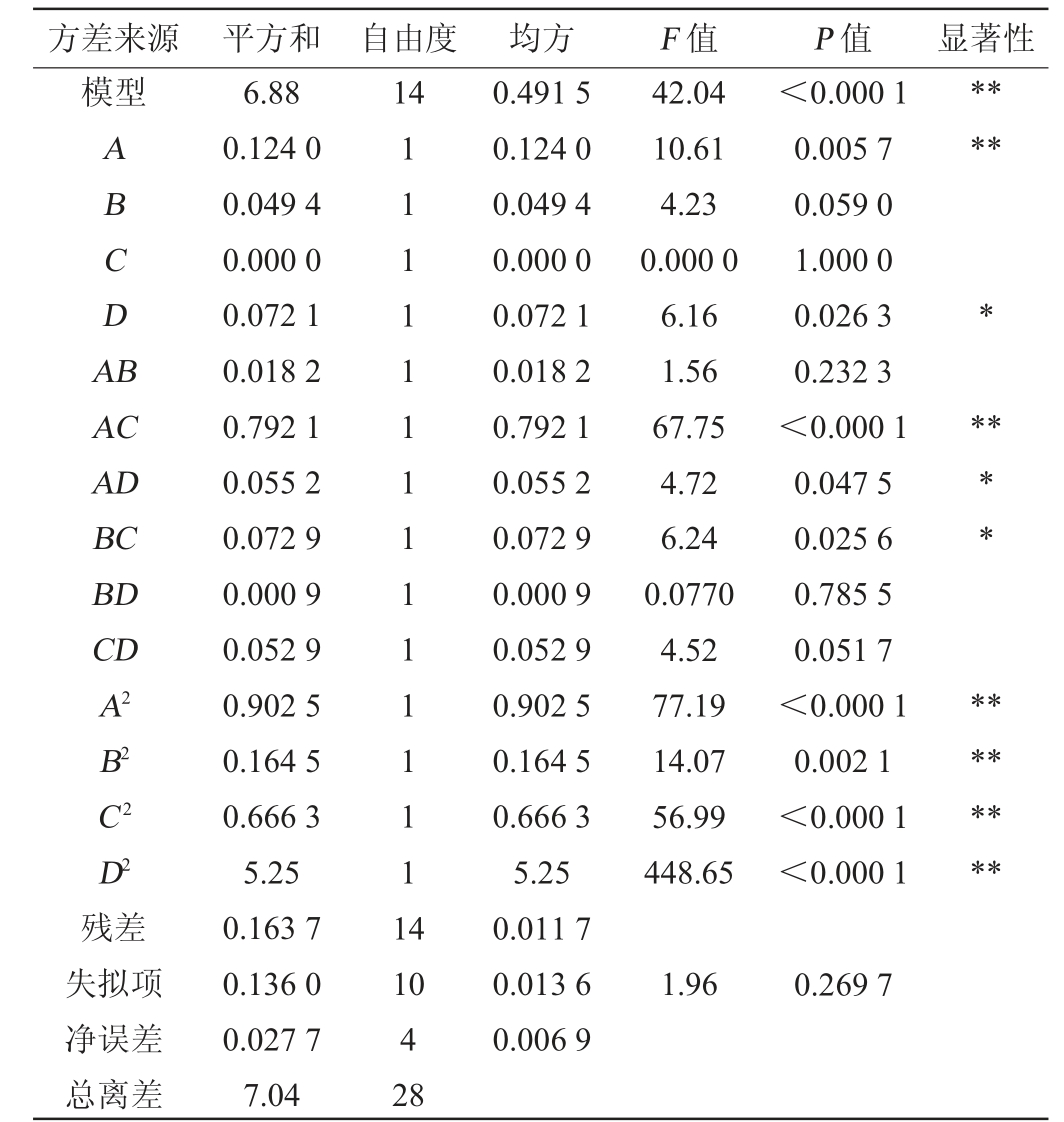
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B*****AC AD BC BD CD A2 B2 C2 D2残差失拟项净误差总离差6.88 0.124 0 0.049 4 0.000 0 0.072 1 0.018 2 0.792 1 0.055 2 0.072 9 0.000 9 0.052 9 0.902 5 0.164 5 0.666 3 5.25 0.163 7 0.136 0 0.027 7 7.04 111111111111111 4 42.04 10.61 4.23 0.000 0 6.16 1.56 67.75 4.72 6.24 0.0770 4.52 77.19 14.07 56.99 448.65<0.000 1 0.005 7 0.059 0 1.000 0 0.026 3 0.232 3<0.000 1 0.047 5 0.025 6 0.785 5 0.051 7<0.000 1 0.002 1<0.000 1<0.000 1**** ********10 4 28 0.491 5 0.124 0 0.049 4 0.000 0 0.072 1 0.018 2 0.792 1 0.055 2 0.072 9 0.000 9 0.052 9 0.902 5 0.164 5 0.666 3 5.25 0.011 7 0.013 6 0.006 9 1.96 0.269 7
通过Design-Expert 12.0软件对表2数据进行多元线性回归分析,得到二次多项式回归模型方程为:Y=2.52+0.1017A-0.0642B+0.0000C+0.0775D+0.0675AB+0.4450AC+0.117 5AD-0.135 0BC+0.015 0BD+0.115 0CD-0.373 0A2-0.159 2B2-0.320 5C2-0.899 2D2。
由表3可知,该模型极显著(P<0.000 1),失拟项P值=0.269 7>0.05,不显著,表明模型具有良好拟合度;模型决定系数R2=0.976 8,调整决定系数R2adj=0.953 5,说明该模型可以解释响应值95.35%的变化。由P值可知,一次项A,交互项AC,二次项A2、B2、C2、D2对EPS产量影响极显著(P<0.01);一次项D,交互项AD、BC对EPS产量影响显著(P<0.05)。由F值可知,对EPS产量影响的因素从大到小依次为:发酵温度(A)>接种量(D)>发酵时间(B)>初始pH值(C)。
2.3.2 各因素交互作用响应面分析
响应曲面的斜度变陡,说明响应值受发酵因素的影响变大;等高线呈椭圆状,表示响应值受两个因素交互作用的影响较大;等高线呈圆形,则表示在响应值上,两个因素的交互作用对其的影响不大[34]。
利用Design-Expert 12.0软件得到各因素交互作用对短乳杆菌M-10产EPS影响的响应面及等高线,结果见图4。由图4a、4e、4f可知,三维曲面均有最高点出现,EPS产量呈现先增后减的规律,等高线图接近椭圆形,但等高线不密集且响应曲面较为平缓,显示发酵温度和发酵时间、发酵时间和接种量、初始pH值和接种量的交互作用对EPS产量无显著影响。图4b呈现椭圆形等高线,且响应曲面最为陡峭,表明EPS的产量受发酵温度与初始pH值交互作用的影响极显著。图4c、4d 的响应面较为陡峭,显示发酵温度和接种量的交互作用对EPS产量有显著影响,以及发酵时间和初始pH值的交互作用。这与方差分析结果一致。
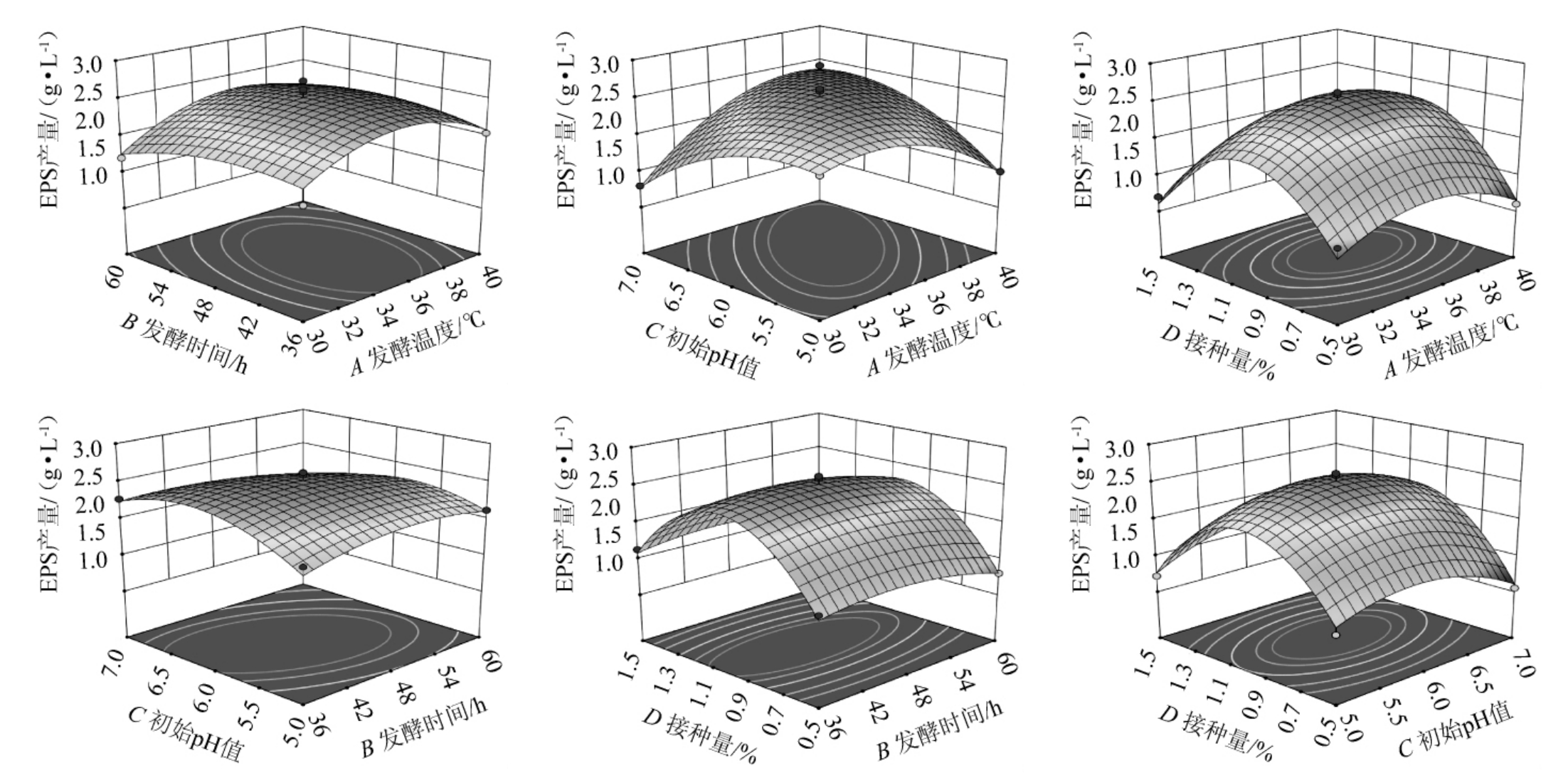
图4 各因素间交互作用对胞外多糖产量影响的响应面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between various factors on exopolysaccharides yield
2.3.3 短乳杆菌M-10产EPS最佳发酵工艺条件的验证
短乳杆菌M-10经Box-Behnken试验优化后预测产生EPS的最佳发酵工艺条件为:发酵温度36.410 ℃,发酵时间45.015 h,初始pH值6.261,接种量为1.04%(V/V)。在此条件下,EPS产量预测值为(2.541±0.034)g/L。为方便实际操作,将最优发酵工艺条件调整为:发酵温度36 ℃、发酵时间46 h、初始pH值6.2、接种量1.0%(V/V)。在此优化条件下进行3次平行验证试验,EPS产量实际值为(2.54±0.13)g/L,与预测值接近,EPS产量与优化前((0.74±0.08)g/L)相比,提高了2.42倍。
3 结论
本研究确定了短乳杆菌M-10产胞外多糖(EPS)的最佳碳源、氮源分别为20 g/L葡萄糖、10 g/L蛋白胨。在单因素试验基础上,通过Box-Behnken响应面优化试验,得到短乳杆菌M-10产胞外多糖(EPS)的最佳发酵工艺条件为:发酵温度36 ℃、发酵时间46 h、初始pH值6.2、接种量1.0%。在此优化条件下,EPS产量为(2.54±0.13)g/L,比优化前提高了2.42倍。该研究为该胞外多糖的结构表征、生物功效和机理解析奠定了基础,同时也为工业化制备短乳杆菌M-10胞外多糖提供了技术参考。
[1]WANG Q,LIU J Q,CAI J,et al.Functional characteristics of lactic acid bacteria in vitro isolated from spontaneously fermented sour porridge with broomcorn millet in northwestern Shanxi province of China[J].Foods,2022,11(15):2353.
[2]王琪,刘聪,景彦萍,等.晋西北酸粥发酵液中乳酸菌的潜在益生特性[J].食品与发酵工业,2019,45(2):60-66.
[3]RAMCHANDRAN L, SHAH N P.Effect of exopolysaccharides on the proteolytic and angiotensin-I converting enzyme-inhibitory activities and textural and rheological properties of low-fat yogurt during refrigerated storage[J].J Dairy Sci,2009,92(3):895-906.
[4]YANG X Y,REN Y M,ZHANG L N,et al.Structural characteristics and antioxidant properties of exopolysaccharides isolated from soybean protein gel induced by lactic acid bacteria[J].LWT-Food Sci Technol, 2021,150(3):111811.
[5]RIZWANA P R, MARIMUTHU A, ABRAHAM D R.Characterization of a novel exopolysaccharide produced by Lactobacillus gasseri FR4 and demonstration of its in vitro biological properties[J].Int J Biol Macromol,2018,109:772-783.
[6]SUNGUR T, ASLIM B, KARAASLAN C, et al.Impact of exopolysaccharides(EPSs)of Lactobacillus gasseri strains isolated from human vagina on cervical tumor cells(HeLa)[J].Anaerobe,2017,47:137-144.
[7]ZHOU X,HONG T,YU Q,et al.Exopolysaccharides from Lactobacillus plantarum NCU116 induce c-Jun dependent Fas/Fasl-mediated apoptosis via TLR2 in mouse intestinal epithelial cancer cells[J].Sci Rep,2017,7(1):110226.
[8]YOU X,YANG L,ZHAO X,et al.Isolation,purification,characterization and immunostimulatory activity of an exopolysaccharide produced by Lactobacillus pentosus LZ-R-17 isolated from Tibetan kefir[J].Int J Biol Macromol,2020,158:408-419.
[9]BILQEESA B,BIJENDER K B.Hypocholesterolemic potential and bioactivity spectrum of an exopolysaccharide from a probiotic isolate Lactobacillus paracasei M7[J].Bioact Carbohydr Diet Fibre,2019,19:100191.
[10]HUANG Z H, LIN F X, ZHU X Y, et al.An exopolysaccharide from Lactobacillus plantarum H31 in pickled cabbage inhibits pancreas α-amylase and regulating metabolic markers in HepG2 cells by AMPK/PI3K/Akt pathway[J].Int J Biol Macromol,2020,143:775-784.
[11]KANMANI P, ALBARRACIN L, KOBAYASHI H, et al.Exopolysaccharides from Lactobacillus delbrueckii OLL1073R-1 modulate innate antiviral immune response in porcine intestinal epithelial cells[J].Mol Immunol,2018,93:253-265.
[12]YOU X,LI Z,MA K,et al.Structural characterization and immunomodulatory activity of an exopolysaccharide produced by Lactobacillus helveticus LZ-R-5[J].Carbohyd Polym,2020,235:115977.
[13]XIU L, ZHANG H, HU Z, et al.Immunostimulatory activity of exopolysaccharides from probiotic Lactobacillus casei WXD030 strain as a novel adjuvant in vitro and in vivo[J].Food Agr Immunol,2018,29(1):1086-1105.
[14]ROSCA I, PETROVICI A R, PEPTANARIU D, et al.Biosynthesis of dextran by Weissella confusa and its in vitro functional characteristics[J].Int J Biol Macromol,2018,107:1765-1772.
[15]KORCZ E, VARGA L.Exopolysaccharides from lactic acid bacteria:Techno-functional application in the food industry[J].Trends Food Sci Tech,2021,110:375-384.
[16]WELMAN A D, MADDOX I S.Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J].Trends Biotechnol,2003,21(6):269-274.
[17]CERNING J,RENARD C,THIBAULT J F,et al.Carbon source requirements for exopolysaccharide production by Lactobacillus casei CG11 and partial structure analysis of the polymer[J].Appl Environ Microbiol,1994,60(11):3914-3919.
[18]MICHELI L, UCCELLETTI D, PALLESCHI C, et al.Isolation and characterisation of a ropy Lactobacillus strain producing the exopolysaccharide kefiran[J].Appl Microbiol Biot,1999,53(1):69-74.
[19]胡盼盼.乳酸菌胞外多糖发酵条件优化及抗肿瘤活性的研究[J].中国酿造,2020,39(8):187-192.
[20]安敏,刘唤明,钟秋红,等.产胞外多糖海洋乳酸菌的筛选及其多糖发酵工艺优化[J].广东海洋大学学报,2023,43(5):106-112.
[21]ZHANG L, LIU C, LI D, et al.Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J].Int J Biol Macromol,2013,54:270-275.
[22]张文平,赵英杰,罗晟,等.高产胞外多糖植物乳杆菌筛选及其发酵工艺优化[J].食品与发酵工业,2019,45(21):38-45.
[23]蔡静静,徐晓裕,张艳,等.新疆维吾尔族肠道中高产胞外多糖双歧杆菌的筛选及其抗氧化活性[J].食品科学,2020,41(8):144-151.
[24]RAJOKA M S R, MEHWISH H M, ZHANG H C, et al.Antibacterial and antioxidant activity of exopolysaccharide mediated silver nanoparticle synthesized by Lactobacillus brevis isolated from Chinese koumiss[J].Colloids Surfaces B,2020,186:110734.
[25]刘嘉秦.短乳杆菌M-10胞外多糖的分离纯化、结构表征及降胆固醇作用研究[D].太原:山西大学,2024.
[26]周万龙,焦学,孙亚杰,等.1株海洋来源鞘氨醇单胞菌胞外多糖的含量测定[J].中国海洋药物,2017,36(2):27-34.