羊奶果(Elatagnus conteta Roxb.)是一种罕见的热带水果,属于胡颓子科(Elaeagnaceae)[1],主要分布于越南、马来西亚、印度和中国西南地区[2]。羊奶果口感酸甜,富含8种人体必需氨基酸、番茄红素和胡萝卜素,具有很高的营养价值[3]。此外,还具有治疗癌症、糖尿病、溃疡、疼痛、风湿病、腹泻、炎症、肺部疾病及抗氧化活性等功效[4-12]。近年来,羊奶果的营养价值和药用价值被广泛关注,作为药食同源野生水果,羊奶果具有较高的深加工潜力和开发利用价值。然而,对于羊奶果果酒酿造的研究却很少。将品相不美观或滞销的羊奶果用于酿造果酒,不仅能缓解羊奶果鲜果滞销、不易储藏等问题,还能充分发挥其经济、药用价值,提高羊奶果的附加值,增加农户的收入。目前,市场上的羊奶果果酒存在着果香不显著,果酒澄清和脱涩技术不成熟等缺陷[13]。
近年来,随着非酿酒酵母(non-Saccharomyces)的深入研究,发现在果酒酿造过程中,非挥发性香气前体物质以糖苷结合态的形式存在于水果中,非酿酒酵母能分泌糖苷酶类,在代谢过程中产生酯类、醇类等香气物质,赋予果酒独特的风味[14]。改善果酒风味的非酿酒酵母主要包括克鲁维毕赤酵母(Pichia kluyveri)、葡萄汁有孢汉逊酵母(Hanseniaspora)、东方伊萨酵母(Issatchenkia orientalis)、季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)、铁红假丝酵母(Candida pulcherrima)、美极梅奇酵母(Metschnikowia pulcherrima)、柠檬形克勒克酵母(Kloeckera opiculata)、隐球酵母(Cryptococcus aerius)等[15-16]。不同属的非酿酒酵母或同属不同地区的非酿酒酵母菌种在发酵过程中的代谢机制各具特色[17],因此筛选一株适合羊奶果果酒酿造的非酿酒酵母具有重要意义。
本研究以羊奶果自然发酵液为研究对象,采用传统培养分离法从中分离筛选非酿酒酵母,通过形态学观察及分子生物学技术进行菌种鉴定,并以商业酿酒酵母(Saccharomyces cerevisiae)CECA为对照,对筛选菌株耐受性及生长特性进行研究,以期筛选出羊奶果果酒专用优良本土非酿酒酵母,为羊奶果果酒酿造提供一定技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
羊奶果:采摘于云南省曲靖市麒麟区。商业酿酒酵母菌CECA:安琪酵母股份有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固体培养基[18]:葡萄糖20 g/L,蛋白胨10 g/L,酵母浸粉5 g/L,琼脂14 g/L,pH自然,121 ℃高压蒸汽灭菌15 min。
YPD液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,pH自然,121 ℃高压蒸汽灭菌15 min。
2,3,5-三苯基氯化四氮唑(triphenyltetrazolium chloride,TTC)上层培养基[19]:TTC 0.5 g/L,葡萄糖5 g/L,琼脂15 g/L,煮沸2 min灭菌。TTC下层培养基[19]:MgSO4 0.4 g/L,KH2PO4 1.0 g/L,酵母浸出粉1.5 g/L,蛋白胨2 g/L,葡萄糖10 g/L,琼脂20 g/L,调节pH值为5.5,121 ℃高压蒸汽灭菌15 min。
YPD产酯定性筛选培养基[20]:蛋白胨20 g/L,葡萄糖20 g/L,酵母浸粉10 g/L,三丁酸甘油酯4 mL,琼脂20 g/L,121 ℃高压蒸汽灭菌15 min。
麦芽汁琼脂培养基、亚硫酸铋葡萄糖甘氨酸酵母琼脂(bismuth sulfite glucose glycine yeast agar,BIGGY)培养基、赖氨酸培养基:青岛科技工业园海博生物技术有限公司;沃勒斯坦实验室(Wallerstein laboratory,WL)营养琼脂培养基:青岛日水生物技术有限公司。
1.1.3 试剂
酵母浸粉(生化试剂):青岛科技工业园海博生物技术有限公司;2×Mix:南京诺唯赞生物科技股份有限公司;NL1和NL4引物:昆明擎科生物科技有限公司;葡萄糖、甘油、亚甲基蓝、TTC等(均为分析纯或生化试剂):昆明品美科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
LHP-250H恒温恒湿培养箱:常州润华电器有限公司;DHg/L-9245A电热鼓风干燥箱:上海一恒科学仪器有限公司;YP-B30002电子天平:上海光正医疗仪器有限公司;YXQ-100G立式压力蒸气灭菌器:上海博迅实业有限公司医疗设备厂;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;ZD-85AB多功能冷冻气浴恒温振荡器、T6新世纪紫外可见光分光光度计:常州润华电器有限公司;2700聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国应用生物系统公司;PowerPacTM HC十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)仪:美国BIO-RAD公司;PHS-3C精密pH计:上海仪电科学仪器股份有限公司;7GL-16M台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 酵母菌的分离、纯化
挑选新鲜成熟的羊奶果进行榨汁,在28 ℃条件下自然发酵2 d。羊奶果自然发酵液用四层纱布过滤,取1 mL滤液采用无菌水进行10倍系列梯度稀释,选择适宜梯度的稀释液0.2 mL分别涂布于含有0.01%抗生素的麦芽汁、YPD固体培养基上,28 ℃条件下培养至菌落长出后,挑取具有典型形态特征的菌落进行纯化、保种备用。
1.3.2 酵母菌的鉴定
形态学观察:将分离得到的菌株接种到WL营养琼脂培养基上,28 ℃条件下培养5 d,观察并记录不同菌落的颜色与形态。将初筛得到的酵母菌在显微镜(油镜)下观察芽殖情况和细胞形态[21]。
分子生物学鉴定:菌液离心后用微波炉法[22]提取酵母菌基因组脱氧核糖核苷酸(deoxyribonucleic acid,DNA),以其为模板,采用引物NL1(5′-GCATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTTTCAAGACGG-3′)对分离菌株的26S rDNA D1/D2区基因序列进行PCR扩增。PCR扩增体系(25 μL):DNA模板1 μL,NL1和NL4各0.5 μL,Taq PCR Master Mix 11 μL,双蒸水(ddH2O)12 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火40 s,72 ℃延伸1 min,30个循环,72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后,委托昆明硕擎生物科技有限公司进行测序。将测定结果提交至美国国家生物信息技术中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取同源性较高的模式菌株的26S rDNA D1/D2区基因序列,采用MEGA X软件中的邻接(neighbor-joining,NJ)法,构建系统发育树,分析菌株的分类地位。
1.3.3 非酿酒酵母产酯和产乙醇能力测定
产酯能力测定:取100μL甘油管保藏的菌液接种于YPD液体培养基中,在28 ℃、180 r/min条件下培养24 h制成菌悬液。取3 μL的菌悬液点样于产酯培养基,28 ℃条件下培养4 d后,观察并记录菌落周围透明圈大小。
产乙醇能力测定:取3 μL的菌悬液点样于TTC下层培养基,28 ℃条件下培养至酵母长势良好后,覆盖TTC上层培养基,28 ℃条件下避光培养24 h后,观察并记录菌落显色情况。
1.3.4 非酿酒酵母发酵性能分析
接种2%的菌悬液于含有杜氏小管的YPD液体培养基中,28 ℃条件下静置培养3 d,间隔24 h观察并记录杜氏小管中产气情况。
1.3.5 非酿酒酵母耐受性能分析[23]
乙醇耐受性:接种2%的菌悬液于乙醇体积分数分别为3%、6%、9%、12%、15%的YPD液体培养基中,28 ℃条件下培养24 h,测定OD600 nm值。每株菌设3组重复,以未接种的YPD液体培养基作为空白对照。
SO2耐受性:接种2%的菌悬液于SO2质量浓度分别为60 mg/L、120 mg/L、180 mg/L、240 mg/L、300 mg/L的YPD液体培养基中,28 ℃条件下培养24 h,测定OD600nm值。每株菌设3组重复,以未接种的YPD液体培养基作为空白对照。
pH值耐受性:接种2%的菌悬液于pH分别为2.8、3.2、3.6、3.8的YPD液体培养基中,28 ℃条件下培养24 h,测定OD600nm值。每株菌设3组重复,以未接种的YPD液体培养基作为空白对照。
葡萄糖耐受性:接种2%的菌悬液于葡萄糖质量浓度分别为200 g/L、250 g/L、300 g/L、350 g/L、400 g/L的YPD液体培养基中,28 ℃条件下培养24 h,测定OD600nm值。每株菌设3组重复,以未接种的YPD液体培养基作为空白对照。
温度耐受性:接种2%的菌悬液于YPD液体培养基中,分别置于温度为4 ℃、15 ℃、25 ℃、30 ℃、40 ℃的条件下培养24 h,测定OD600nm值。每株菌设3组重复,以未接种的YPD液体培养基作为空白对照。
1.3.6 非酿酒酵母产硫化氢特性分析
取菌悬液5 μL点样于BIGGY培养基,置于28 ℃条件下培养4 d,观察菌落颜色深浅程度。
1.3.7 数据处理
使用Microsoft Excel 2013及SPSS 26.0软件对数据进行处理,采用Duncan检验法进行方差分析,每组实验3个重复。采用Origin 2022软件绘图。
2 结果与分析
2.1 酵母菌的分离及鉴定
2.1.1 酵母菌的分离及形态学特征
在麦芽汁、YPD固体培养基上共分离纯化出60株酵母菌,通过观察菌落在WL营养琼脂培养基上的形态、颜色,去除部分重复菌落,初筛得到6株酵母菌,分别编号为H1、H5、H7、H9、H10、H12,其菌落及细胞形态见图1。由图1可知,菌株H1的菌落表面光滑,中央向边缘由深蓝色向浅蓝色过渡;菌株H5的菌落表面粗糙,呈灰绿色;菌株H7的菌落扁平、有颗粒感,表面为奶油色,底部为浅绿色;菌株H9的菌落似火山状、表面褶皱,中央向边缘由绿色向奶油色过渡;菌株H10的菌落表面光滑、较高的圆屋顶状突起,呈奶绿色;菌株H12的菌落扁平干燥,呈奶白色。由图1亦可知,菌株H1、H7的细胞呈卵圆形,菌株H5、H12的细胞呈圆筒形,菌株H9、H10的细胞呈圆形。
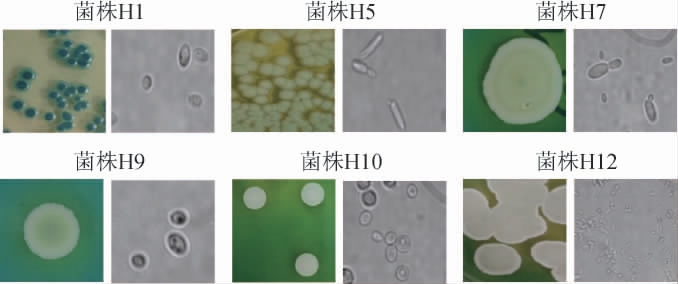
图1 6株酵母菌在WL营养琼脂培养基上的菌落及细胞形态
Fig.1 Colony and cell morphology of 6 yeast strains on WL nutrient agar medium
2.1.2 分离酵母菌的分子生物学鉴定结果
基于26S rDNA D1/D2区基因序列构建6株酵母菌株的系统发育树,结果见图2。由图2可知,菌株H1与葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)DS2-2聚于一支,菌株H5、H7、H9与发酵毕赤酵母(Pichia fermentans)LTQB25聚于一支,菌株H10与异常威克汉姆酵母(Wickerhamomyces anomalus)YGA70聚于一支,菌株H12与库德毕赤酵母(Pichia kudriavzevii)YF1702聚于一支,亲缘关系最近。结合形态观察,将菌株H1鉴定为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),菌株H5、H7、H9鉴定为发酵毕赤酵母(Pichia fermentans),菌株H10鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus),菌株H12鉴定为库德毕赤酵母(Pichia kudriavzevii)。
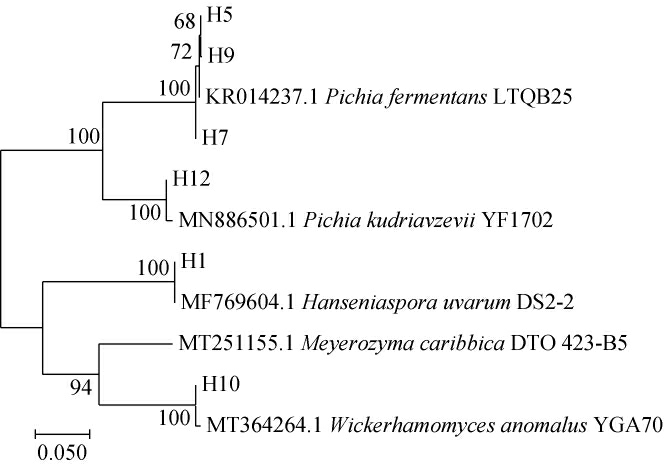
图2 基于26S rDNA D1/D2区基因序列6株酵母菌株的系统发育树
Fig.2 Phylogenetic tree of 6 yeast strains based on 26S rDNA D1/D2 region gene sequences
2.2 非酿酒酵母菌的产酯及产乙醇性能
非酿酒酵母产生的一种酯酶可以分解三丁酸甘油酯,能在菌落周围观察到透明圈,透明圈与菌落直径的比值与酯酶活性成正相关[24]。商业酵母菌CECA与6株非酿酒酵母菌的产酯能力见表1。由表1可知,7株酵母菌的透明圈直径(D)与菌落直径(d)的比值均>1,由大到小依次为菌株H10>菌株H5>菌株H9>菌株CECA>菌株H12>菌株H7>菌株H1,说明7株酵母菌都具备一定的产酯能力,有为果酒增添果香和花香的潜力[25]。其中,菌株H10的D/d值(1.61)最大,产酯能力最强,菌株H1的D/d值(1.15)最小,产酯能力最弱。
表1 7株酵母菌产酯能力的测定结果
Table 1 Determination results of ester production capacity of 7 yeast strains
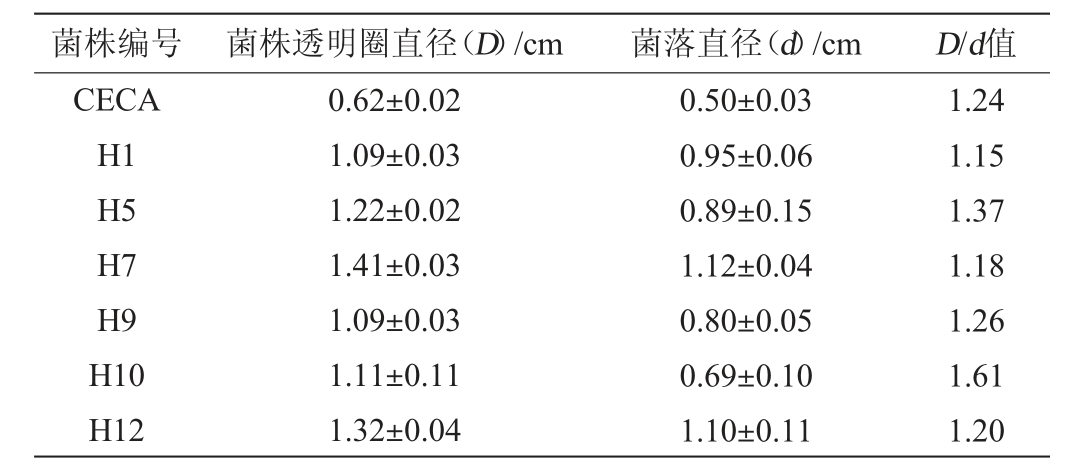
菌株编号 菌株透明圈直径(D)/cm 菌落直径(d)/cm D/d值CECA H1 H5 H7 H9 H10 H12 0.62±0.02 1.09±0.03 1.22±0.02 1.41±0.03 1.09±0.03 1.11±0.11 1.32±0.04 0.50±0.03 0.95±0.06 0.89±0.15 1.12±0.04 0.80±0.05 0.69±0.10 1.10±0.11 1.24 1.15 1.37 1.18 1.26 1.61 1.20
有研究表明,TTC能与酵母菌代谢过程中产生的脱氢酶生成红色或紫色的甲臜物质,酶的活性与菌落呈现红色的深浅成正相关[26]。商业酵母菌CECA与6株非酿酒酵母菌在TTC培养基上的显色结果见图3。由图3可知,菌株CECA呈红色,菌株H10呈深红色,菌株H9、H7、H12边缘呈红色,中间呈粉红色,菌株H1呈粉红色。则初步判断菌株H10产乙醇能力最强,菌株H1产乙醇能力最弱。
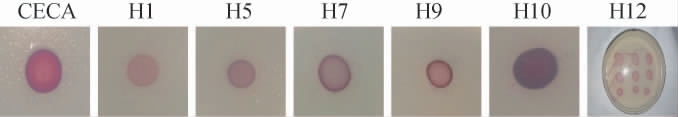
图3 7株酵母菌在TTC培养基上的显色结果
Fig.3 Chromogenic results of 7 yeast strains on TTC medium
通过比较6株非酿酒酵母菌株和商业酿酒酵母CECA产酯和产乙醇能力的强弱,发现菌株产酯、产乙醇能力存在正相关性。分析原因可能是脱氢酶参与了酵母菌的糖酵解过程,且酯酶作用的对象是酵母菌在糖酵解过程中代谢生成的乙醇和乙酸[14]。
2.3 非酿酒酵母的发酵能力
酵母菌在发酵过程中会产生CO2,通过观察杜氏管内气泡产生的体积与时间可以反映酵母菌的起酵速度和发酵能力[27],商业酵母菌CECA与6株非酿酒酵母菌的杜氏管产气情况见表2。
表2 7株酵母菌杜氏管产气情况
Table 2 Gas production in Duchenne tubes of 7 yeast strains
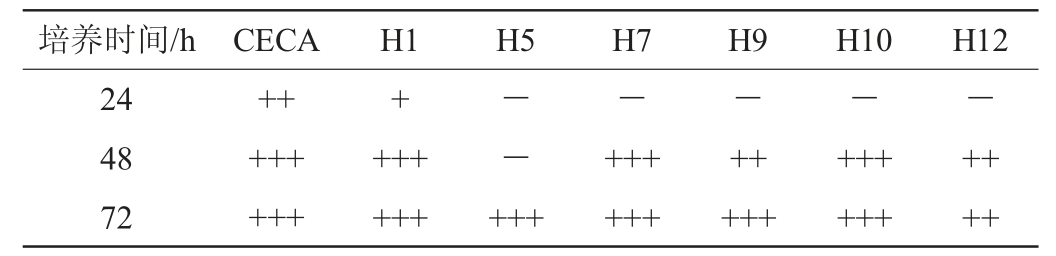
注:“-”表示产气量较少;“+”表示产气量在10%~30%;“++”表示产气量在50%~70%;“+++”表示产气量在90%~100%。
培养时间/h CECA H1 H5 H7 H9 H10 H12 24 48 72+++++++++----++++++--++++++++++++++++++++++++
由表2可知,培养24 h时,只有菌株H1和商业酵母CECA杜氏管中有气体产生,且商业酵母CECA产气量高于菌株H1,起酵速度更快;培养48 h时,只有菌株H5未起酵,菌株H1、H7、H10杜氏管中充满气体并浮在液体培养基上,菌株H9、H12已在杜氏管中产生2/3的气体;培养72 h后,只有菌株H12未使杜氏管充满气体。综上,菌株H1前期起酵速率快,发酵能力最强,菌株H12发酵能力最弱。
2.4 非酿酒酵母耐受性分析
2.4.1 乙醇耐受性
乙醇是酵母菌主要的发酵副产物,浓度过高会胁迫酵母菌的生长[28]。不同酵母菌株的乙醇耐受性见图4。由图4可知,除菌株H5、H7以外,商业酿酒酵母CECA及菌株H1、H9、H10、H12在乙醇体积分数为3%时OD600nm值均>0.5。当乙醇体积分数升高至6%和9%时,只有商业酿酒酵母CECA及菌株H12正常生长,而其他菌株的生长均严重受到抑制。当乙醇体积分数为12%时,所有菌株的OD600 nm值均<0.5。结果表明,商业酿酒酵母CECA及菌株H12均可耐受乙醇体积分数9%,菌株H10、H9和H1可耐受乙醇体积分数3%。综上,商业酿酒酵母CECA及菌株H12的乙醇耐受性较好。
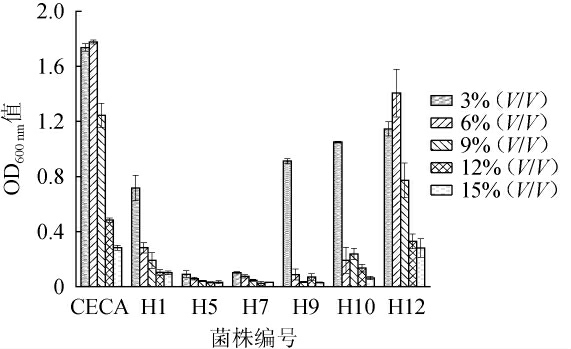
图4 7株酵母菌的耐乙醇实验结果
Fig.4 Results of alcohol tolerance of the 7 yeast strains
2.4.2 SO2耐受性
果酒酿造中通常会添加90~150 mg/L的SO2,以防止杂菌生长和酒液老化[29-30]。不同酵母菌株对SO2的耐受性见图5。由图5可知,所有菌株对SO2质量浓度变化不敏感,均能耐受300 mg/L SO2,但商业酿酒酵母CECA和菌株H9的OD600nm值较高,耐受性较好。
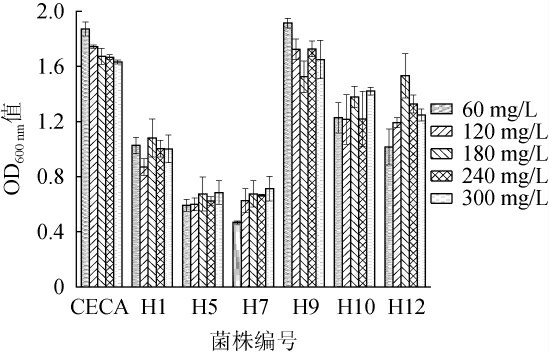
图5 7株酵母菌的耐SO2实验结果
Fig.5 Results of SO2 tolerance of the 7 yeast strains
2.4.3 pH耐受性
葡萄糖经过戊糖磷酸途径等会产生乳酸、柠檬酸等一些有机酸,改变营养成分的电离状态,影响酵母菌对营养物质的吸收利用[31]。考察不同酵母菌株的pH耐受性,结果见图6。由图6可知,当pH为3.2~3.8时,所有菌株均能正常生长,OD600 nm值均>0.5;当pH为2.8时,所有菌株的生长均受到不同程度的抑制,其中,菌株H5、H7和H10的生长受到较严重的抑制,OD600 nm值均<0.5。结果表明,商业酿酒酵母CECA和菌株H1、H9、H12均可耐受pH 2.8,其他菌株均可耐受pH 3.2。综上,商业酵母CECA和菌株H1、H9、H12的pH耐受性较好。
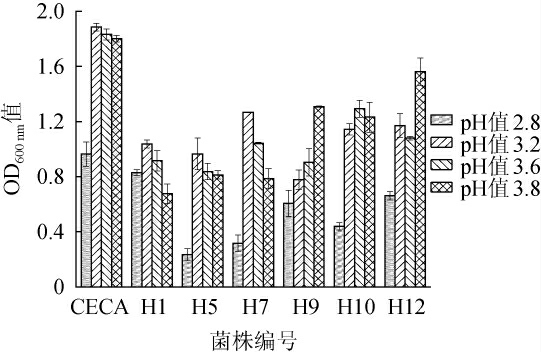
图6 7株酵母菌的耐pH实验结果
Fig.6 Results of pH tolerance of the 7 yeast strains
2.4.4 葡萄糖耐受性
细胞在高渗溶液中会出现脱水的情况,影响其功能的正常运转,因此,考察不同酵母菌株对葡萄糖的耐受性,结果见图7。由图7可知,6株酵母菌均在葡萄糖质量浓度为200 g/L时OD600 nm值最大,但均低于商业酵母CECA。随着葡萄糖质量浓度的升高,酵母菌的生长受到了明显的抑制。当葡萄糖质量浓度为250 g/L时,菌株H5、H7、H9及H12的OD600nm值均<0.5;当葡萄糖质量浓度为300 g/L,菌株H1和H10的OD600nm值均<0.5;而当葡萄糖质量浓度为400 g/L时,商业酵母CECA和菌株H9的OD600 nm值仍>0.5。结果表明,商业酵母CECA和菌株H9可耐受400 g/L葡萄糖,菌株H1和H10可耐受葡萄糖250 g/L,其他菌株可耐受葡萄糖200 g/L。综上,商业酿酒酵母CECA及菌株H1、H9和H10的葡萄糖耐受性较好。

图7 7株酵母菌的耐葡萄糖实验结果
Fig.7 Results of glucose tolerance of the 7 yeast strains
2.4.5 温度耐受性
不同酵母菌株的温度耐受性实验结果见图8。由图8可知,随着温度的升高,所有菌株的OD600 nm值均呈先升高后下降的趋势。当温度为15 ℃时,菌株H5、H7、H9微量生长,OD600nm值均<0.5,均不耐受15 ℃;当温度为4 ℃时,商业酵母CECA及菌株H1、H10、H12的OD600 nm值均<0.5,均不耐受4 ℃;当温度为30 ℃时,菌株H9的OD600nm值<0.5;当温度为40 ℃时,菌株H1、H7、H9、H10的OD600nm值均<0.5;然而商业酿酒酵母CECA及菌株H5、H12在温度25~40 ℃均能稳定生长,且生长能力为菌株H12>商业酿酒酵母CECA>菌株H5。结果表明,商业酵母CECA及菌株H1、H10、H12可耐受低温15 ℃,菌株H5、H7、H9可耐受低温25 ℃;商业酵母CECA及菌株H5、H12可耐受高温40 ℃,其他菌株可耐受高温30 ℃。综上,菌株H1、H10和H12对低温耐受性较好,商业酿酒酵母CECA及菌株H5、H12对高温耐受性较好。
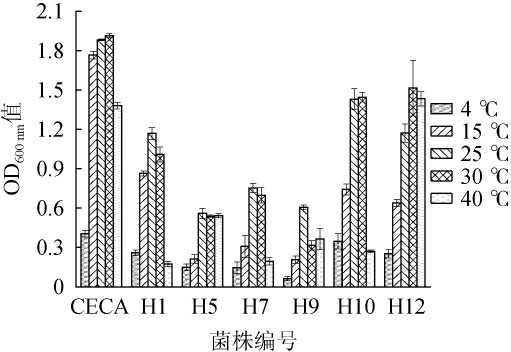
图8 7株酵母菌的耐温度实验结果
Fig.8 Results of temperature tolerance of the 7 yeast strains
2.5 非酿酒酵母菌产硫化氢特性
非酿酒酵母在丰富酒体香气的同时,也可能会产生低浓度的H2S,散发臭鸡蛋味,对果酒造成不良影响[32]。因此,考察不同酵母菌株的产H2S特性,结果见图9。由图9可知,商业酿酒酵母CECA、菌株H1、H7、H10呈白色,菌株H5边缘呈浅褐色,菌株H9、H12呈深褐色。说明商业酿酒酵母CECA、菌株H1、H7、H10不产H2S,菌株H5低产H2S,菌株H9、H12高产H2S。
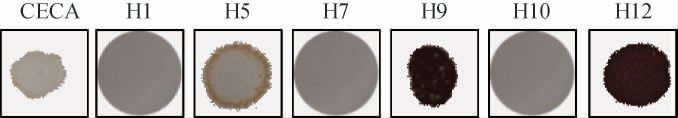
图9 7株酵母菌在BIGGY培养基上的生长显色结果
Fig.9 Chromogenic results of the 7 yeast strains on BIGGY medium
综上,菌株H10产酯和产乙醇能力最强,菌株H1的发酵能力最强,菌株H12受乙醇和高温胁迫最小,菌株H9、H10、H12对SO2的耐受性较好,菌株H1、H9、H12对低pH的耐受性较好,菌株H1、H9、H10对葡萄糖耐受性较好。但菌株H9和H12在酿造过程中产生不良风味的可能性最大。
3 结论
本研究以羊奶果自然发酵液作为酵母的分离来源,通过传统培养分离、菌落形态观察及分子生物学技术筛选鉴定得到6株非酿酒酵母,其中,菌株H1为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),菌株H5、H7、H9均为发酵毕赤酵母(Pichia fermentans),菌株H10为异常威克汉姆酵母(Wickerhamomyces anomalus),菌株H12为库德毕赤酵母(Pichia kudriavzevii)。以商业酿酒酵母(Saccharomyces cerevisiae)CECA为对照,对6株非酿酒酵母的耐受性及生长特性进行研究,筛选出两株具有酿造潜力的非酿酒酵母,分别为菌株H1、H10。菌株H1起酵速度快,发酵性能好;菌株H10具有良好的产酯、产乙醇和发酵能力。酵母菌H1和H10均能耐受乙醇体积分数3%、SO2 300 mg/L、pH值3.2、葡萄糖250 g/L、温度15 ℃,均不产H2S。本研究筛选出的菌种经驯化、优化发酵条件,有望成为优质羊奶果果酒酿造菌种。
[1]葛宇,戴敏洁,王甲水,等.云南德宏羊奶果资源收集和评价简报[J].热带农业科学,2016,36(11):48-50.
[2]番汝昌,余海星,朗关富,等.德甜羊奶果选育[J].热带农业科学,2011,35(5):20-23.
[3]李忠华,李倩,赵俊波,等.甜羊奶果扦插研究简报[J].山东林业科技,2018,48(4):47-49.
[4]JU S K,MJ K C,SEMOTIUK A J,et al.Indigenous knowledge on medicinal plants used by ethnic communities of South India[J].Ethnobotany Res App,2019,18:1-112.
[5]VALVI S,YESANE D P,RATHOD V S.Isolation of antioxidant enzymes from some wild edible fruits at mature and ripened stage rhizome[J].Curr Bot,2011,2(1):53-55.
[6]BINU S.Medicinal plants used for treating body pain by the tribals in Pathanamthitta district, Kerala, India[J].Indian J Tradit Know, 2011,10(3):547-549.
[7]DESHMUKH B S,WAGHMODE A.Role of wild edible fruits as a food resource: Traditional knowledge[J].Int J Pharm Life Sci, 2011, 2(7):919-924.
[8]SINGH G N, MUKTA G.Elaeagnus conferta: A comprehensive review[J].Res J Pharm Technol,2018,11(6):2667-2671.
[9]LIU J, GONG L D, QI L, et al.The complete chloroplast genome of Elaeagnus conferta Roxb(Elaeagnaceae)[J].Mitochondrial DNA Part B,2019,4(1):2035-2036.
[10]PATIL R P, PAI S R, PAWAR N V, et al.Chemical characterization,mineral analysis, and antioxidant potential of two underutilized berries(Carissa carandus and Eleagnus conferta)from the Western Ghats of India[J].Crit Rev Food Sci Nutr,2012,52(4):312-320.
[11]RAGHAVENDRA P, PRASAD A D, SHYMA T B.Investigations on anti-diabetic medicinal plants used by tribes of Wayanad district,Kerala[J].Int J Pharm Sci Res,2015,6(8):3617-3625.
[12]RANA M S,SAMANT S S.Diversity,indigenous uses and conservation status of medicinal plants in Manali wildlife sanctuary, North western Himalaya[J].Indian J Tradit Know,2011,10(3):439-459.
[13]何丝汀,易琦铭,宋易.羊奶果食品研究进展[J].中国食品,2022(15):131-133.
[14]王飞,王晓宇,赵擎豪,等.果酒增香酿造技术研究进展[J].食品科学,2023,44(13):244-252.
[15]RUIZ J, KIENE F, BELDA I, et al.Effects on varietal aromas during wine making:A review of the impact of varietal aromas on the flavor of wine[J].Appl Microbiol Biot,2019,103(11):7425-7450.
[16]TOFALO R,SCHIRONE M,TELERA G C,et al.Influence of organic viticulture on non-Saccharomyces wine yeast populations[J].Ann Microbiol,2011,61(1):57-66.
[17]王春晓,俞俊竹,周文亚,等.非酿酒酵母属酵母的葡萄酒发酵应用研究进展[J].中国农业科学,2023,56(3):529-548.
[18]李凯,王金晶,李永仙,等.红芯火龙果酒酿酒酵母的筛选及鉴定[J].食品与发酵工业,2019,45(5):115-120.
[19]赵雪平,温雅娇,李正英,等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业,2020,46(11):178-183.
[20]胡江南,高熳熳,马立娟,等.葡萄酒发酵优良酵母的筛选、鉴定及应用[J].中国酿造,2023,42(7):43-50.
[21]杨雪峰,苏龙,刘树文.利用WL营养培养基鉴定葡萄酒中的相关酵母菌[J].中外葡萄与葡萄酒,2006(4):4-7.
[22]赫然,张颖,王强,等.利用微波炉和煮沸法快速制备大肠杆菌基因组DNA PCR模板[J].中山大学学报(自然科学版),2004(S1):80-81.
[23]吕银德,赵俊芳,秦令祥.鲜食葡萄降酸酵母菌的筛选、鉴定及酿造特性研究[J].中国酿造,2023,42(9):120-124.
[24]彭东,蒋雪薇,陈幽,等.高盐稀态酱醪中耐盐生香酵母的筛选及生香特性研究[J].食品与发酵工业,2020,46(13):76-84.
[25]祝霞,赵丹丹,李俊娥,等.河西走廊产区酒球菌酯酶活性对葡萄酒酯类香气物质的影响[J].农业工程学报,2021,37(1):315-322.
[26]王犁烨,陈新军,卢丕超,等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造,2019,38(1):104-108.
[27]吴卓凡,圣弟青,王金晶,等.枇杷果酒酵母的筛选、分离与鉴定[J].食品与发酵工业,2019,45(24):71-76.
[28]闫兴敏,姜娇,高辉,等.优良本土酿酒酵母的酿酒特性及产香能力初析[J].食品与发酵工业,2022,48(4):62-68.
[29]李青青,刘甲伟,王帅帅,等.山楂火龙果复合果酒酿造稳定性分析研究[J].酿酒科技,2023(10):47-51.
[30]荆红彭,刘明,陈晓明,等.二氧化硫对蓝莓酒发酵动力学及品质变化的影响[J].食品与发酵工业,2021,47(21):73-78.
[31]昝立峰,杨香瑜,陈江魁,等.黑枣果酒发酵过程主要成分变化规律及香气成分分析[J].食品研究与开发,2020,41(2):12-17.
[32]刘晓柱,黄元敏,杨筱萱,等.一株库尔勒香梨源非酿酒酵母菌的鉴定及其发酵性能分析[J].中国酿造,2023,42(6):128-134.