乳酸菌是一类革兰氏阳性、过氧化氢酶阴性、微需氧、非孔球菌、球杆菌或以乳酸为碳水化合物主要发酵产物的棒状菌,在食品中的使用历史悠久,被认为是无毒食品级微生物[1]。乳酸菌发酵过程中,可将食品中复杂大分子物质分解成小分子物质,产生维生素、抗微生物代谢产物和生物活性化合物,提高食品安全性和营养价值,赋予食品独特的风味和质地[2]。部分被作为益生菌的乳酸菌,能够抵抗人体胃肠道低酸、高胆盐浓度的极端环境,并定殖于人体肠道后发挥益生作用,且对人体不产生安全危害。乳酸菌还具有抑菌、抗氧化、降血压等独特的功能作用,已被广泛应用于食品、医药、环境保护、水产和畜牧业等领域,尤其在发酵食品中的应用最为广泛[3]。
乳酸菌产生的胞外多糖具有抗糖尿病、抗炎、抗氧化、抗肿瘤、抗病毒、降低胆固醇、免疫调节和帮助微生物在肠道内定植等功能作用[4]。OERLEMANS M M P等[5]研究发现,胞外多糖不仅对肠道微生物群组成、先天免疫系统和适应性免疫系统产生影响,还与肠上皮屏障相关的过程相互作用。RAJOKA M等[6]研究发现,鼠李糖乳杆菌(Lactobacillus rhamnosus)产生的胞外多糖不仅具有良好的乳化、抗氧化、抗肿瘤活性,还具有较强的抑菌活性。此外,乳酸菌代谢产生的胞外多糖,可以提高产品的黏度及体系稳定性,使发酵乳制品的保水率提高,乳清析出率降低,进而提升产品品质。LOBO R M等[7]研究发现,嗜热链球菌(Streptococcus thermophilus)CRL1190产生的胞外多糖具有良好的保水保油能力、抗氧化和絮凝活性等作用。FENG F等[8]从柠檬明串珠菌(Leuconostoc citreum)N21中提取胞外多糖具有较高的水溶性、乳化活性和热稳定性,可作为食品添加剂用于食品加工。乳酸菌产胞外多糖具有非常大的应用前景和发展潜力,挖掘和研究产胞外多糖乳酸菌,对如何提高产品品质,改善产品风味,及促进其在食品工业中的应用具有重要意义。
巴马自然环境独特,空气中的负氧离子含量高,水是弱碱性小分子水、氧化还原电位低、富含对人体有益的矿物质和微量元素,地磁强度是一般地区的一倍多[9]。ZHAO L等[10]在广西巴马老年人粪便细菌群落与年龄和生活区的关系的研究中发现,年龄和生活区会对粪便细菌群落产生重要影响。WANG F等[11]在广西巴马百岁老人粪便双歧杆菌种类的定性和半定量分析研究中发现,百岁老人往往有更复杂的粪便双歧杆菌,且不同地区百岁老人身上发现的双歧杆菌种类存在差异。因此,本研究采用含碳酸钙的快速初筛培养基,结合形态学观察、革兰氏染色、过氧化氢酶接触实验、菌落拉丝法和硫酸-苯酚法,从巴马独特地区的家庭自制自然发酵食品(酸笋、泡菜、泡椒、泡蒜、酸豆角、泡姜、腌萝卜、腌柠檬、酸梅)中筛选产胞外多糖乳酸菌,并采用碳氢化合物粘着法、牛津杯法、圆盘扩散法等研究其耐酸、耐胆盐、细胞表面疏水性、抑菌和药敏等特性,为挖掘和开发传统发酵食品中的益生菌资源奠定基础,为特色地区益生菌资源的筛选鉴定提供借鉴,对产胞外多糖乳酸菌开发利用具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
家庭自制各类自然发酵食品发酵液(酸笋、泡菜、泡椒、泡蒜、酸豆角、泡姜、腌萝卜、腌柠檬、酸梅):从巴马地区采集,无菌瓶封装并于4 ℃保存;螯合树脂Chelex-100:上海麦克林生化科技股份有限公司;27F和1492R通用引物:生工生物工程(上海)股份有限公司;抗菌药物药敏纸片:常德比克曼生物科技有限公司;金黄色葡萄球菌(Staphylococcus aureus)CGMCC14519、大肠杆菌(Escherichia coli)CGMCC112252、沙门氏菌(Salmonella)CGMCC11190:中国普通微生物菌种保藏管理中心。
1.1.2 化学试剂
猪胆盐:上海源叶生物科技有限公司;过氧化氢、苯酚、三氯乙酸、浓硫酸、草酸铵、结晶紫、沙黄、碘化钾、磷酸二氢钠、磷酸氢二钠、碘、氯化钠、盐酸、酚酞、氢氧化钠、二甲苯(均为分析纯):国药集团化学试剂有限公司;Mix-Taq酶(2~5 U/μL):上海麦克林生化科技股份有限公司。
1.1.3 培养基
MRS固体培养基:蛋白胨10 g/L,牛肉粉5 g/L,酵母粉4 g/L,葡萄糖20 g/L,吐温-80 1 mL/L,磷酸氢二钾2 g/L,醋酸钠5 g/L,柠檬酸三铵2 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,琼脂15 g/L,蒸馏水1 L,调节pH至6.2。121 ℃高压灭菌15 min。
初筛培养基:在MRS固体培养基的基础上添加0.5%CaCO3。
MRS肉汤培养基:酪蛋白酶消化物10 g/L,牛肉膏粉10 g/L,酵母膏粉4 g/L,柠檬酸三铵2 g/L,乙酸钠5 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,磷酸氢二钾2 g/L,葡萄糖20 g/L,吐温80 1.08 g/L,蒸馏水1 L,调节pH至5.7。121 ℃高压灭菌15 min。
血琼脂平板:北京陆桥技术股份有限公司。
1.2 仪器与设备
DW-HL780超低温冰箱:中科美菱低温科技有限公司;UVS-3漩涡混合器:北京优晟联合科技有限公司;WBK-2A恒温水浴锅:广东环凯微生物科技有限公司;GZX -9140 MBE电热恒温鼓风干燥箱:上海博讯实业有限公司;Milli-Q Direct 8超纯水仪:德国默克有限公司;OSE-MC8掌上离心机、OSE-DB-02恒温金属浴:天根生化科技(北京)有限公司;SW-CJ-2FD无菌操作台:苏州安泰空气技术有限公司;Ni-U正置荧光显微镜:日本尼康Nikon公司;MDX-310落地高速冷冻离心机:日本TOMY公司;Master cycler nexus gradient聚合酶链式反应(polymerase chain reaction,PCR)仪:艾本德(中国)有限公司;Infinite 200 PRO全波长酶标仪:帝肯(上海)贸易有限公司。
1.3 方法
1.3.1 产胞外多糖乳酸菌筛选
(1)初筛
取适量混匀发酵液,接种于MRS肉汤培养基中进行富集培养,取1 mL培养液进行10倍梯度稀释(10-1~10-7),取50~100 μL稀释后的培养液涂布于初筛培养基中,37 ℃培养2 d,挑选有溶钙圈的典型菌落,于MRS培养基中进行划线培养和分离纯化,对纯化后菌株进行形态学观察、革兰氏染色和过氧化氢酶接触实验,将符合乳酸菌形态学特征、染色结果为蓝紫色且滴加过氧化氢能产生气泡的菌株初步判定为乳酸菌,用50%(V/V)甘油保存,于-80 ℃贮藏备用。
(2)复筛
将初筛得到的菌株在MRS肉汤培养基中活化两次,于MRS培养基上进行划线,37 ℃培养24 h,用无菌牙签挑取单菌落并轻柔向外拉起,观察其能否形成拉丝,重复挑取多个菌落进行验证,将能形成连续拉丝且菌落粘稠的菌株初步判定为产胞外多糖乳酸菌。
1.3.2 胞外多糖提取及含量测定
参照YASMIN I等[12]的方法并稍做修改。将复筛中能形成明显拉丝的菌株制成菌悬液并调整吸光度值(OD600 nm值)为0.8±0.1,以2%接种量接种于MRS肉汤培养基中,37 ℃培养24 h,得到发酵液。于100 ℃水浴20 min以灭活可能存在降解多糖的酶,取沸水浴后发酵液于4 ℃、7 000 r/min条件下离心20 min收集上清液,加入质量分数为800 g/L的三氯乙酸溶液至终质量浓度为40 g/L,4 ℃静置12 h,4 ℃、7 000 r/min离心20 min去除细胞和蛋白,收集上清液,并加入3倍体积的95%乙醇,4 ℃静置12 h,4 ℃、7 000 r/min条件下离心20 min,弃去上清液,沉淀用去离子水复溶后,装入透析袋(截留分子质量14 kDa)透析48 h,每8 h换一次水,透析液冷藏备用。
胞外多糖含量测定参照李嘉文等[13]的方法并稍做修改。分别吸取葡萄糖标准溶液(40 μg/mL)0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL至刻度试管中,补水至1.0 mL,然后加入质量分数为60 g/L苯酚溶液0.6 mL及浓硫酸3.0 mL,摇匀,80 ℃水浴加热15 min,快速冷却至室温,以零管为空白,于波长490 nm处测定吸光度值,以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线,得到标准曲线回归方程。准确量取1.0 mL透析液按上述步骤操作,测定吸光度值,按照回归方程计算样品中胞外多糖含量。
1.3.3 筛选菌株的16S rDNA鉴定
参照WANG X等[14]的方法并稍做修改,将产胞外多糖乳酸菌于MRS肉汤培养基中活化2次(即在液体培养基中重复培养两次),活化后的菌种划线于MRS培养基中,37 ℃培养24 h,挑取适量菌体于Chelex-100树脂溶液中,金属浴并离心后所得上清液即为菌株基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取液,以其为模版进行PCR扩增、纯化及测序。配制10%的Chelex-100树脂溶液(90 mL水+10 g树脂),牙签挑取少量菌体至树脂溶液中,100 ℃金属浴10 min,5 000 r/min、离心10 min,上清液即为菌种DNA提取液。PCR扩增体系(25 μL):12.5 μL Mix-Taq酶,11 μL水,正向引物(27F)0.5 μL,反向引物(1492R)0.5 μL,模板DNA 0.5~1.0 μL)。PCR扩增程序:95 ℃预变性3 min,98 ℃变性10 s,68 ℃退火15 s,72 ℃延伸5 min,共34个循环,循环结束后,72 ℃延伸2 min,4 ℃保存。PCR扩增产物委托南宁国拓生物科技有限公司进行测序,将测序结果于EzBioCloud和美国国家生物技术信息中心(national center of biotechnol ogy information,NCBI)数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析,选取同源性较高的模式菌株序列为参考,用MEGA7.0构建菌株系统发育树。
1.3.4 筛选菌株的耐受性测定
(1)耐酸性
参照ALONSO S等[15]的方法并稍作修改,用10%盐酸配制pH分别为2.5、3.0、3.5的MRS肉汤培养基,以2%(V/V)接种量接种待测菌株菌悬液(OD600 nm值为0.8±0.1)于各pH培养基中,37 ℃培养3 h后,通过存活率来评定菌株耐酸性,分别在0 h和3 h取样,用无菌水梯度稀释(10-1~10-7)后涂布于MRS培养基上,用平板计数法测定活菌数,计算菌株在各pH环境中筛选菌株的存活率,其计算公式如下:
式中:X为筛选菌株存活率,%;A1为在不同pH的MRS肉汤培养基中培养0 h的活菌数,CFU/mL;A2为在不同pH的MRS肉汤培养基中培养3 h的活菌数,CFU/mL。
(2)胆盐耐受性
参照JANG H J等[16]的方法并稍作修改,用猪胆盐配制含量分别为0、0.03%、0.05%的MRS肉汤培养基,以2%(V/V)接种量接种待测菌株菌悬液(OD600 nm值为0.8±0.1)于不同胆盐浓度的培养基中,37 ℃恒温培养,每小时测吸光度值(OD620 nm值),直至OD620 nm值上升0.3个单位,确定乳酸菌在不同浓度胆盐中的生长滞后期,其计算公式如下:
H=H1-H0
式中:H为滞后期,h;H1为实验组OD620 nm值上升0.3个单位需要的时间,h;H0为对照(不加胆盐)OD620 nm值上升0.3个单位需要的时间,h。
1.3.5 细胞表面疏水性的测定
参照SOMASHEKARAIAH R等[17]的方法并稍作修改,将待测菌株发酵液在4 ℃、10 000 r/min 条件下离心3 min,弃去上清液,收集菌体沉淀,用无菌磷酸盐缓冲液(phosphate buffer solution,PBS)(pH=7.4)洗涤菌体沉淀2次,重悬于无菌PBS中,调节菌悬液的光密度值(OD600 nm值)为0.8±0.1,取待测菌株菌悬液分别与等体积二甲苯和正十六烷混合并振荡混匀,室温静置30 min,至分离两相,吸取水相并测定OD600nm值,细胞表面疏水率计算公式如下:
式中:S为细胞表面疏水率,%;A4为菌悬液在波长600 nm处的吸光度值;A3为下层水相在波长600 nm处的吸光度值。
1.3.6 抗生素敏感试验
参照万倩等[18]的方法并稍作修改,测定待测菌株对8种常见抗生素的敏感性,吸取约100 μL待测菌株菌悬液(用无菌水配制,约108 CFU/mL)均匀涂布于MRS培养基中,用无菌镊子夹取含抗生素的药敏纸片平铺于培养基上,轻微按压使其贴紧,将平板倒置于37 ℃的恒温培养箱中培养24 h后,使用游标卡尺测量抑制区直径,实验结果依据临床和实验室标准协会(clinical and laboratory standards in stitute,CLSI)的标准进行判定。本试验所用抗生素种类及抑菌圈直径判断标准见表1。
表1 抗生素种类、药敏纸片含药量及抑菌圈直径
Table 1 Antibiotics types, drug content in drug sensitive paper and inhibition zone diameter
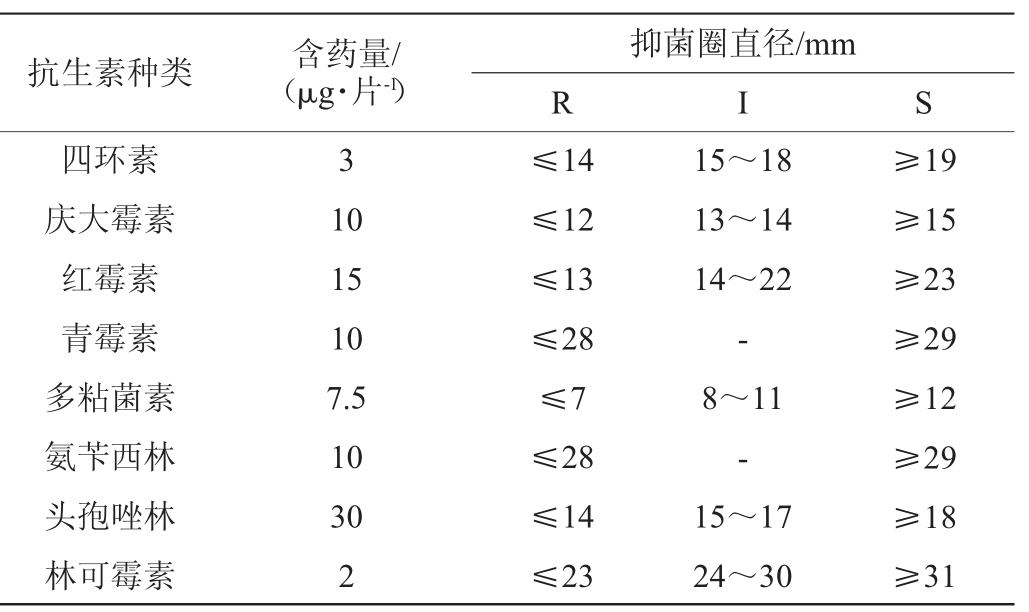
注:“R”表示耐药;“I”表示中介;“S”表示敏感;“-”表示无中介。药敏纸片直径为6 mm。
抗生素种类 含药量/(μg·片-1)抑菌圈直径/mm R I S四环素庆大霉素红霉素青霉素多粘菌素氨苄西林头孢唑林林可霉素3 10 15 10 7.5 10 30 2≤14≤12≤13≤28≤7≤28≤14≤23 15~18 13~14 14~22-8~11-15~17 24~30≥19≥15≥23≥29≥12≥29≥18≥31
1.3.7 溶血活性测定
参照JANG H J等[16]的方法并稍作修改,待测菌株经MRS培养基活化两次后,挑取单菌落划线于血琼脂平板中,37 ℃培养2 d,待测菌株菌落周围出现绿色区域为α-溶血,出现透明区域判定为β-溶血,无透明区域出现为γ-溶血,分别以沙门氏菌CGMCC11190、金黄色葡萄球菌CGMCC14519和大肠杆菌CGMCC112252作为α-溶血、β-溶血和γ-溶血阳性对照,以无菌MRS肉汤培养基为阴性对照。
1.3.8 抑菌能力测定
参照SUI Y等[19]的方法并稍作修改,待测菌株过夜培养后制成菌悬液(OD600nm值为0.8±0.1),按2%(V/V)接种量接种于MRS肉汤培养基中,37 ℃培养48 h,10 000 r/min离心5 min,上清液用无菌过滤器(0.22 μm)过滤,4 ℃冷藏备用,将无菌牛津杯放置在无菌培养皿表面,缓慢倒入30 mL均匀混有400 μL(106 CFU/mL)致病菌(金黄色葡萄球菌、大肠杆菌和沙门氏菌)的LB琼脂培养基,待其凝固后缓慢取出牛津杯,分别将200 μL无菌MRS肉汤培养基、待测菌株发酵液上清液加入孔中,37 ℃培养48 h,使用游标卡尺测量抑菌圈直径。抑菌圈直径被描述为:直径为0(无抑制),抑菌圈直径在0~3 mm之间(弱抑制),抑菌圈直径介于3~6 mm之间(良好抑制)和抑菌圈直径>6 mm(强抑制)。
1.3.9 数据统计分析方法
所有实验进行3次平行实验,结果以“平均值±标准差”表示。采用SPSS 25.0软件对实验数据进行分析,选择描述性单因素方差分析(analysis of variance,ANOVA),在均值95%的置信区间对数据进行显著性分析,差异显著时P<0.05。采用Origin 2023软件进行作图。
2 结果与分析
2.1 样品采集结果
巴马镇是全县物资集散地,经济繁荣,含多个大型农贸市场和超市。那社乡是盘洋河源头之一“命河”的发源地和滋养地,处于非长寿集落的土坡丘陵地带。所略乡是“油茶之乡”的所在地,位于长寿集落地的石山区。甲篆乡是“长寿之乡”所在地,也是著名景点“百魔洞’和”百鸟岩“的所在地。所以,选取巴马镇、那社乡、所略乡和甲篆乡作为采样地。分别从以上地区采集到酸笋、泡菜、酸豆角、泡姜、腌萝卜、腌柠檬、酸梅等9种各类家庭自制自然发酵食品发酵液共计24个样品见表2。
表2 巴马地区不同采集地各类自然发酵食品种类及数量
Table 2 Types and numbers of various naturally fermented foods samples collected from different sites of Bama region
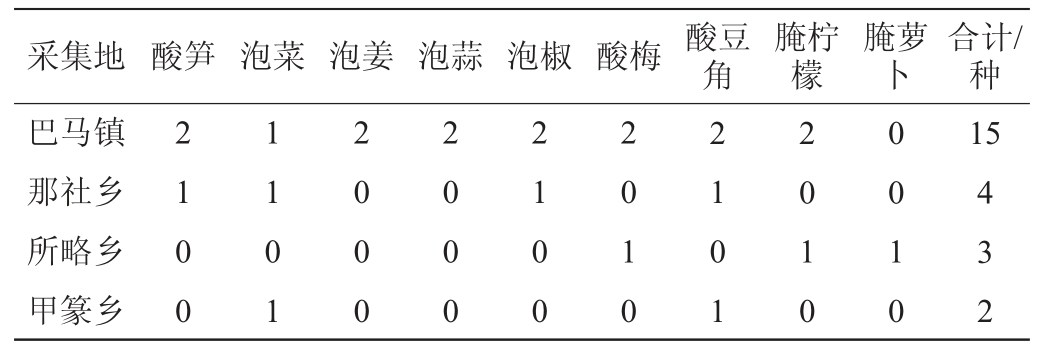
采集地 酸笋 泡菜 泡姜 泡蒜 泡椒 酸梅 酸豆角腌柠檬腌萝卜合计/种巴马镇那社乡所略乡甲篆乡2 1 0 0 1 1 0 1 2 0 0 0 2 0 0 0 2 1 0 0 2 0 1 0 2 1 0 1 2 0 1 0 0 0 1 0 15 4 3 2
2.2 乳酸菌初筛结果
采用含有0.5%CaCO3的初筛培养基从巴马自然发酵食品发酵液中分离纯化出51株能产生明显溶钙圈的菌株,对能产生溶钙圈的菌株进行形态学观察、过氧化氢酶接触实验和革兰氏染色,最终获得16株过氧化氢酶阴性(无气泡产生),革兰氏染色阳性(蓝紫色)的菌株,分别编号为R1~R16。各菌株菌落形态和细胞形态见图1。由图1可知,所有菌株的菌落形态均为椭圆形或圆形,乳白色,凸起,湿润有光泽,边缘整齐,符合乳酸菌的形态学特征,菌株细胞形态均为杆状,且分散不相连,将该16株菌初步判定为乳酸菌。

图1 初筛菌株的菌落和细胞形态
Fig.1 Colony and cell morphology of primary screening strains
2.3 产胞外多糖乳酸菌复筛结果
将16株初步判定为乳酸菌的菌株活化2次后划线于MRS培养基中,选取单菌落,用无菌牙签挑取菌落并轻柔向外拉,记录出现明显连续拉丝的菌株及菌落是否粘稠,结果见表3。由表3可知,最终从16株初步判定为乳酸菌的菌株中获得6株菌落粘稠且能形成明显连续拉丝的菌株,分别为菌株R2、R3、R4、R5、R6、R9,初步判定这6株菌为产胞外多糖菌株。
表3 产胞外多糖菌株复筛结果
Table 3 Rescreening results of exopolysaccharide-producing strains
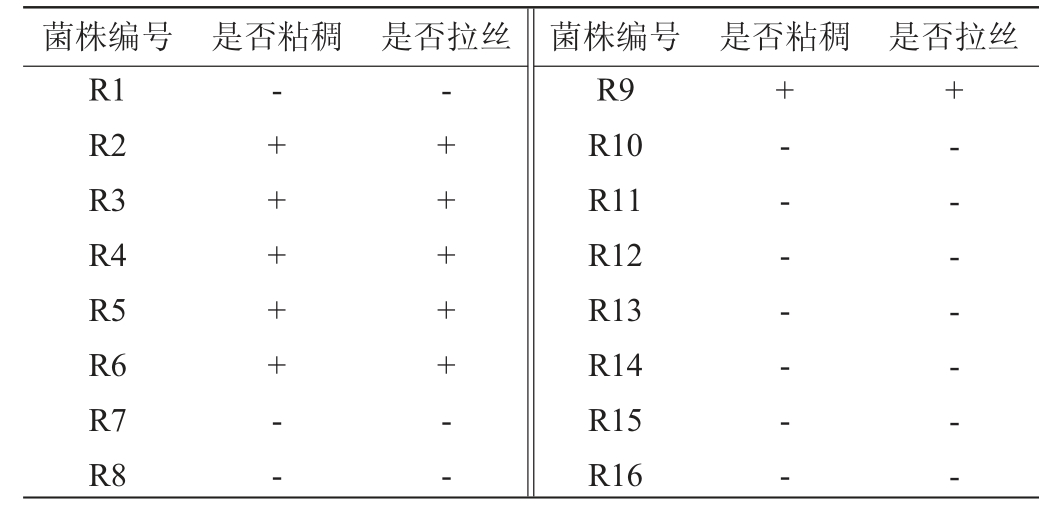
注:“+”表示结果为阳性;“-”表示结果为阴性。
菌株编号 是否粘稠 是否拉丝 菌株编号 是否粘稠 是否拉丝R1 R2 R3 R4 R5 R6 R7 R8-+++++---+++++--R9 R10 R11 R12 R13 R14 R15 R16+- - - - - - -+- - - - - - -
2.4 筛选菌株胞外多糖产量测定结果
采用硫酸-苯酚法测定不同乳酸菌胞外多糖的产量,结果见图2。
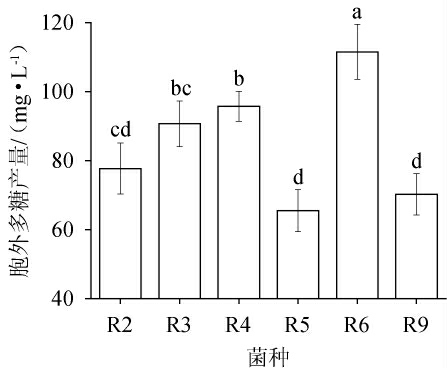
图2 筛选菌株胞外多糖产量测定结果
Fig.2 Determination results of extracellular polysaccharide production of screened strains
不同字母表示差异显著,P<0.05。下同。
由图2可知,不同乳酸菌的胞外多糖产量存在显著差异(P<0.05),6株产胞外多糖乳酸菌中,菌株R6的胞外多糖得率最高,为106.73 mg/L,显著高于其他菌株的胞外多糖产量(P<0.05);其次是菌株R3和R4,胞外多糖产量在90 mg/L左右,且彼此间无显著差异(P>0.05);菌株R5的胞外多糖产量最低,为70.33 mg/L。
2.5 筛选菌株耐酸性
耐酸能力是益生菌的必备特征,筛选菌株耐酸性测定结果见图3。由图3可知,菌株的生长受pH的影响,6株筛选菌株的存活率均随着pH值降低而降低,且不同菌株的耐酸性存在显著差异(P<0.05),pH在3.0~3.5范围内菌株R6的耐酸性最强,菌株R4的耐酸性最差;在pH为2.5时,菌株R3的耐酸性最强,存活率为58.63%,菌株R6的耐酸性最差,说明在极低pH下,菌株R6更容易受到影响。JO Y M等[20]测定了从各种植物性发酵食品中分离得到25株利莫西发酵乳杆菌的耐酸性,发现所有菌株均具有良好的耐酸性,菌株存活率随pH降低而降低,且不同菌株耐酸性存在显著差异。QIAN M等[21]对分离到的乳酸菌菌株耐酸性进行测定,发现所有菌株均具有很好的耐酸性,pH 3.0时的存活率均在90%左右。人体胃液pH在3.0左右,食物消化需1~2 h,其通常被用于筛选具有耐酸性益生菌株的条件。试验中所有菌株均有一定耐酸性,且存在菌种特异性,pH越低则对菌株生长抑制作用越强,这与文献报道一致。菌株R6在pH3条件下培养3 h后的存活率>100%,表明其耐酸性突出,能够很好抵抗人体胃肠道的低酸环境,具有发挥益生功能的潜力。
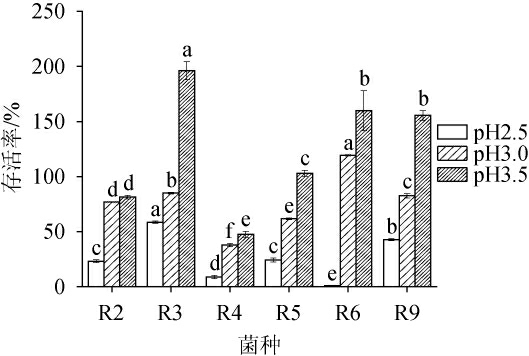
图3 筛选菌株耐酸性测定结果
Fig.3 Determination results of acid resistance of screened strains
2.6 筛选菌株胆盐耐受性
JO Y M等[20]研究发现,由于菌株或物种的特异性,乳酸菌胆盐耐受性存在显著差异,且高胆汁浓度的抵抗机制存在菌株和物种依赖性。胆盐耐受性是益生菌发挥益生作用的重要前提,筛选菌株胆盐耐受性测定结果见表4。由表4可知,胆盐浓度越高,乳酸菌生长受到的抑制作用越强,且不同菌株对同一胆盐浓度的耐受性存在显著差异(P<0.05),菌株R6相较于其他菌株有较强胆盐耐受性,在0.03%和0.05%胆盐环境中生长滞后期分别为0.65 h和1.50 h;菌株R9生长滞后期分别为1.23 h和4.25 h,胆盐耐受性最差。试验中6株乳酸菌均具有一定的胆盐耐受性,且存在菌种特异性,胆盐浓度越高则对菌株生长抑制作用越强,这与文献报道结果一致。低浓度胆盐会引起菌体表面疏水性、表面电势、细胞膜通透性和流动性等发生变化,以及引起一些膜镶嵌酶类的失活和跨膜转运功能的紊乱,而高浓度的胆盐则会快速溶解细胞膜中的脂质,造成膜蛋白的解离、细胞质组分的泄露,致使菌体死亡[22]。益生菌只有在抵御低酸高胆盐环境并定植于肠道后方能发挥益生功能,试验结果表明,菌株R6胆盐耐受性最佳,更能抵抗人体胃肠道的高胆盐浓度环境,益生潜力更突出。
表4 筛选菌株胆盐耐受性测定结果
Table 4 Determination results of bile salt tolerance of screened strains
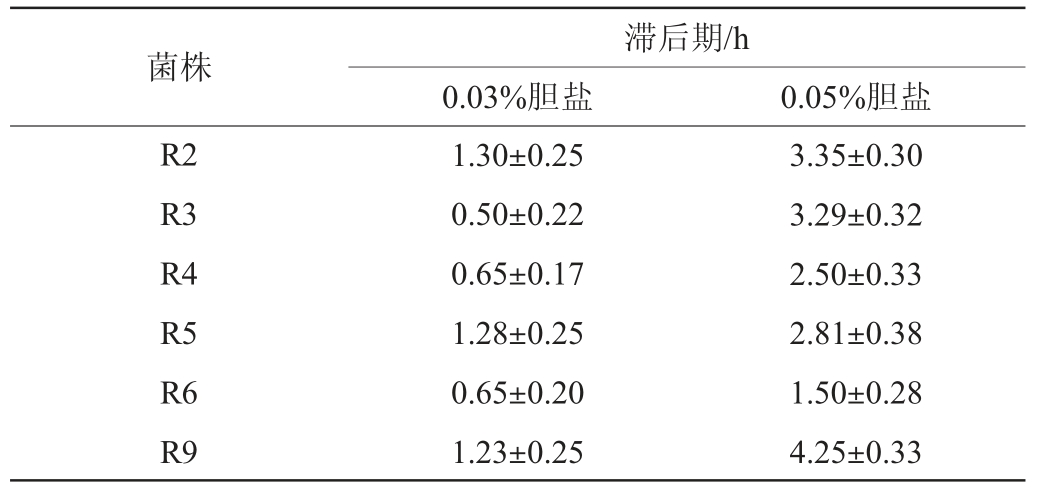
菌株R2 R3 R4 R5 R6 R9滞后期/h 0.03%胆盐 0.05%胆盐1.30±0.25 0.50±0.22 0.65±0.17 1.28±0.25 0.65±0.20 1.23±0.25 3.35±0.30 3.29±0.32 2.50±0.33 2.81±0.38 1.50±0.28 4.25±0.33
2.7 筛选菌株细胞表面疏水性
筛选菌株细胞表面疏水性测定结果见图4。由图4可知,不同乳酸菌的细胞表面疏水性存在显著差异,且在二甲苯中的细胞表面疏水性要优于在十六烷中的细胞表面疏水性;菌株R6的细胞表面疏水性比其他菌株更为突出,尤其在十六烷中的细胞表面疏水性达到了93.28%,菌株R4的细胞表面疏水性最低,其在两种有机溶剂中的最高细胞表面疏水性只有5.79%。QIAN M等[21]对分离到的利莫西发酵乳杆菌菌株细胞表面疏水性进行研究,发现不同菌株表现出不同程度的表面疏水性,从53.90%到90.16%不等。试验中的6株乳酸菌均具有一定的细胞表面疏水性,且存在菌种特异性,甚至同一株菌对不同物质的表面疏水性亦存在显著差异,该结果与文献报道一致。不同微生物的细胞表面成分和结构存在差异,且决定表面疏水性的物质基础有差异,使得不同菌种或不同菌株的细胞表面疏水性存在差异。受各种因素影响,菌株的表面疏水性无统一标准,但高疏水性是益生菌能够很好定植于肠道的积极特征。菌株R6的细胞表面疏水性最佳,具有定植肠道的良好基础。
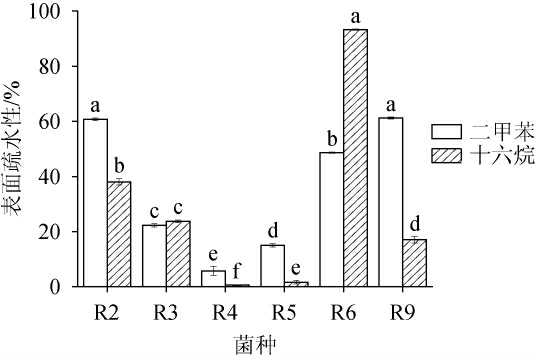
图4 筛选菌株的表面疏水性测定结果
Fig.4 Determination results of surface hydrophobicity of screened strains
2.8 筛选菌株抗生素敏感性
抗生素敏感性是选择益生菌的重要指标,筛选菌株抗生素敏感性测定结果见表5。
表5 筛选菌株抗生素敏感性测定结果
Table 5 Determination results of antibiotic sensitivity of screened strains
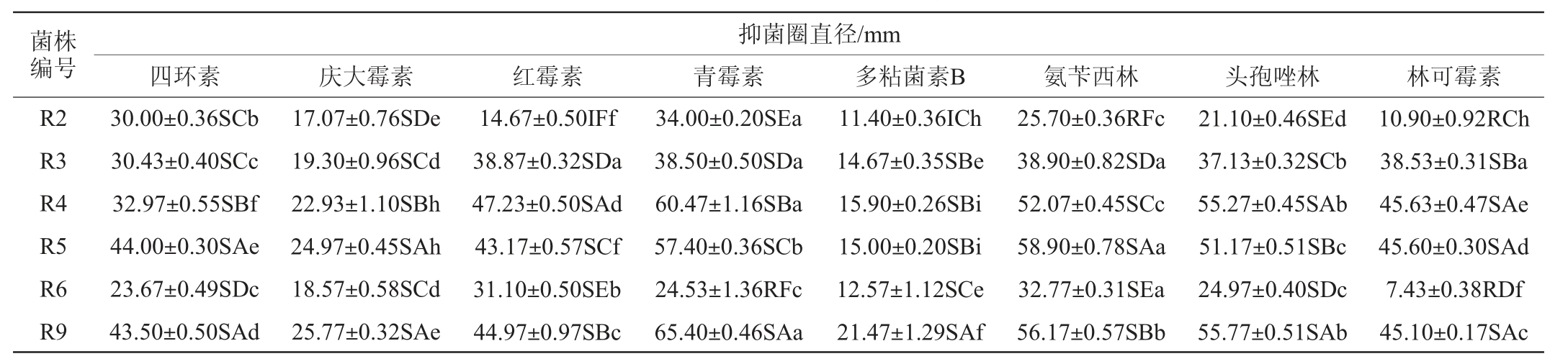
注:“R”为耐药;“I”为中介;“S”为敏感;右肩大写字母为同列数据比较,右肩小写字母为同行数据比较,不同字母表示存在显著差异(P<0.05)。
菌株编号R2 R3 R4 R5 R6 R9抑菌圈直径/mm四环素 庆大霉素 红霉素 青霉素 多粘菌素B 氨苄西林 头孢唑林 林可霉素30.00±0.36SCb 30.43±0.40SCc 32.97±0.55SBf 44.00±0.30SAe 23.67±0.49SDc 43.50±0.50SAd 17.07±0.76SDe 19.30±0.96SCd 22.93±1.10SBh 24.97±0.45SAh 18.57±0.58SCd 25.77±0.32SAe 14.67±0.50IFf 38.87±0.32SDa 47.23±0.50SAd 43.17±0.57SCf 31.10±0.50SEb 44.97±0.97SBc 34.00±0.20SEa 38.50±0.50SDa 60.47±1.16SBa 57.40±0.36SCb 24.53±1.36RFc 65.40±0.46SAa 11.40±0.36ICh 14.67±0.35SBe 15.90±0.26SBi 15.00±0.20SBi 12.57±1.12SCe 21.47±1.29SAf 25.70±0.36RFc 38.90±0.82SDa 52.07±0.45SCc 58.90±0.78SAa 32.77±0.31SEa 56.17±0.57SBb 21.10±0.46SEd 37.13±0.32SCb 55.27±0.45SAb 51.17±0.51SBc 24.97±0.40SDc 55.77±0.51SAb 10.90±0.92RCh 38.53±0.31SBa 45.63±0.47SAe 45.60±0.30SAd 7.43±0.38RDf 45.10±0.17SAc
由表5可知,菌株R3、R4、R5和R9对8种常见抗生素均表现出极强的敏感性,尤其是R4和R9有半数以上的抑菌圈达50 mm左右;菌株R2对红霉素和多粘菌素B的敏感性表现为中介,对氨苄西林和林可霉素耐药,对其余4种抗生素敏感;菌株R6对青霉素和林可霉素耐药,对其余6种抗生素敏感;同一菌株对不同抗生素敏感性具有显著差异,且绝大部分株菌株对青霉素和氨苄西林的敏感性显著高于其他类型的抗生素;不同菌株对同一抗生素的敏感性存在显著差异,相比于其他菌株,R9、R4、R5对这8中常见抗生素更为敏感。CASAROTTI S N等[23]对分离自水牛马苏里拉奶酪的乳酸杆菌分离株进行药敏试验,发现所有菌株都对常用于治疗细菌感染的氨苄青霉素、四环素、氯霉素、红霉素和克林霉素敏感,不同菌株抗生素敏感性存在显著差异。SORNSENEE P等[24]对从泰国宋克拉省发酵棕榈树液获得的10株乳酸杆菌进行药敏试验,发现所有菌株均对氨苄青霉素、红霉素、克林霉素、四环素和氯霉素敏感,且菌株抗生素敏感性存在菌种特异性。试验中的6株乳酸菌均对四环素、红霉素等多种常见抗生素敏感,且菌株的抗生素敏感性具有菌种特异性,该结果与文献报道一致。6株乳酸菌的抗生素敏感性试验结果表明,所有试验菌株均具有较好的安全性。
2.9 筛选菌株的溶血活性
不具有溶血活性,是选择益生菌的重要安全指标,筛选菌株的溶血活性测定结果见图5。由图5可知,α-溶血阳性对照组(沙门氏菌),菌落周围出现绿色区域,即出现α-溶血;β-溶血阳性对照(金黄色葡萄球菌),菌落周围出现透明区域,即出现β-溶血;γ-溶血阳性对照(大肠杆菌),菌落周围既没有出现绿色区域,也没有出现透明区域,即出现γ-溶血;阴性对照组(无菌MRS肉汤培养基)并未出现菌种生长;菌株R2、R3、R4、R5、R6和R9的菌落周围既没有出现透明区域,也没有出现绿色区域,结果为γ-溶血,表明无溶血能力。益生菌菌株要求不能具有溶血活性,试验中的6株菌株均为γ-溶血,均无溶血活性,对人体不具有溶血毒性,具有很好的益生潜力。MAHMOUDI I等[25]测定了从骆驼奶中分离出的14株发酵乳杆菌株和6株植物乳杆菌株的溶血活性,发现所有株菌均不具有溶血活性。NAMI Y等[26]对从伊朗阿塞拜疆省的不同地区的各种手工乳制品中分离出44株乳酸杆菌菌株,结果发现这些菌株具有显著的自聚集能力和胆固醇去除能力,且所有菌株均没有任何溶血活性。本试验的6株乳酸菌溶血活性测定结果与文献报道一致,具有一定的安全性。
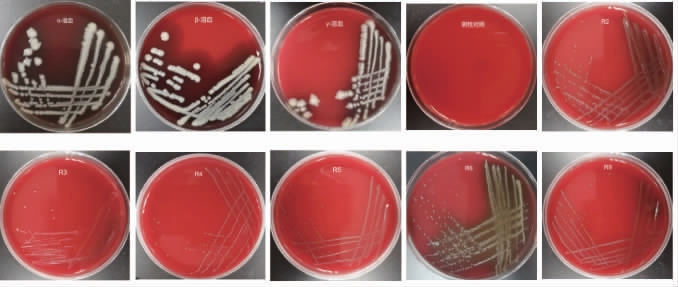
图5 筛选菌株的溶血活性测定结果
Fig.5 Determination results of hemolytic activities of screened strains
α-溶血阳性对照(沙门氏菌);β-溶血阳性对照(金黄色葡萄球菌);γ-溶血阳性对照(大肠杆菌);阴性对照(无菌MRS肉汤培养基)。
2.10 筛选菌株的抑菌活性
抑制肠道中病原微生物生长繁殖是益生菌菌株能够避免胃肠道感染的重要特性,也是筛选益生菌的重要指标,筛选菌株的抑菌活性测定结果见表6。由表6可知,6株产胞外多糖乳酸菌对大肠杆菌、金黄色葡萄球菌和沙门氏菌的抑菌圈均>6 mm,表明6株乳酸菌均对3株致病菌具有强抑制作用;同一菌株对不同致病菌的抑制作用存在显著差异,除菌株R2外,其余乳酸菌对沙门氏菌的抑制作用强于大肠杆菌、金黄色葡萄球菌;不同菌株对同一致病菌的抑制作用存在显著差异,菌株R3、R6对沙门氏菌、大肠杆菌和金黄色葡萄球菌的抑制作用显著强于其他菌株(P<0.05)。MAHMOUDI I等[25]从骆驼奶中分离的20株益生乳酸菌均对单核细胞增多性李斯特菌、金黄色葡萄球菌和大肠杆菌表现出抑制作用并阻止其生长。RYU E H等[27]从泡菜中筛选出10株乳酸菌株菌株,所有菌株对金黄色葡萄球菌、大肠杆菌O157:H7、伤寒沙门氏菌和单核细胞增多性李斯特菌具有生长抑制作用。本试验的6株乳酸菌均对大肠杆菌、金黄色葡萄球菌和沙门氏菌具有抑制作用,且菌株的抑菌活性存在菌种特异性,此结果与文献报道一致。
表6 筛选菌株的抑菌活性测定结果
Table 6 Determination results of inhibition activities of screened strains
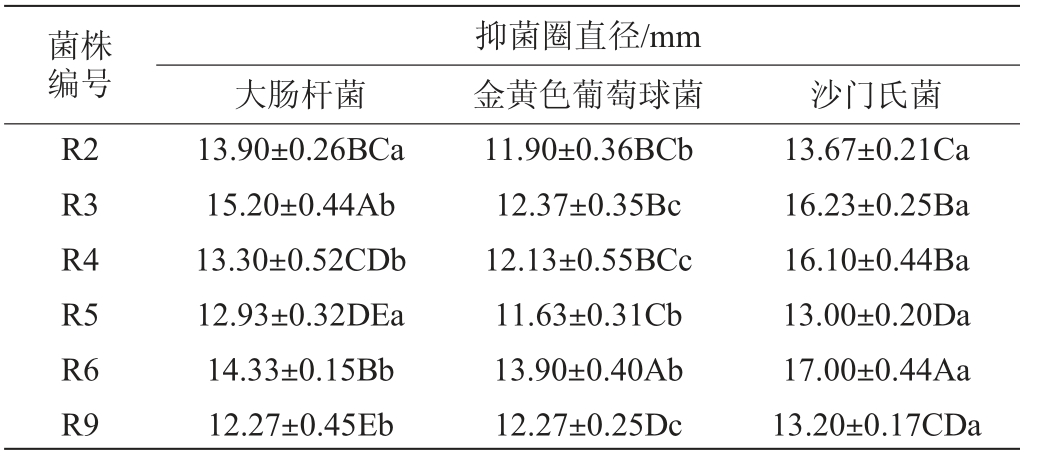
注:右肩大写字母为同列数据比较,右肩小写字母为同行数据比较,不同字母表示存在显著差异(P<0.05)。
菌株编号R2 R3 R4 R5 R6 R9大肠杆菌抑菌圈直径/mm金黄色葡萄球菌 沙门氏菌13.90±0.26BCa 15.20±0.44Ab 13.30±0.52CDb 12.93±0.32DEa 14.33±0.15Bb 12.27±0.45Eb 11.90±0.36BCb 12.37±0.35Bc 12.13±0.55BCc 11.63±0.31Cb 13.90±0.40Ab 12.27±0.25Dc 13.67±0.21Ca 16.23±0.25Ba 16.10±0.44Ba 13.00±0.20Da 17.00±0.44Aa 13.20±0.17CDa
2.11 筛选菌株16S rDNA鉴定结果
益生菌是服用适量后,能够对宿主健康产生有益作用的活的微生物,在进行益生菌筛选时,通常要对菌株的安全性、抗逆性、定植性、稳定性和有效性进行评价。菌株R6胞外多糖产量最高,pH3时耐酸性最佳,胆盐浓度为0.05%时延滞期最短,细胞表面疏水性最突出,对三种致病菌的抑制作用最显著,且对多种常见抗生素敏感和不具有溶血活性,具有很好的益生潜力。将菌株R6的16S rDNA测序结果在NCBI中进行同源性比对分析,获取与目的基因具有高同源性的基因序列,构建系统发育树,结果如图6所示,菌株R6与植物乳杆菌(Lactiplantibacillus plantarum)strain JCM 1149(NR_117813.1)最高相似率为98.37%,且在系统发育树中与植物乳杆菌处同一分支,因此,菌株R6被鉴定为植物乳杆菌(Lactiplantibacillus plantarum)。

图6 基于16S rDNA基因序列菌株R6的系统发育树
Fig.6 Phylogenetic tree of strain R6 based on 16S rDNA gene sequences
3 结论
本研究从采集自巴马不同地区的自然发酵食品发酵液中筛选到了6株产胞外多糖乳酸菌。耐酸、耐胆盐和细胞表面疏水性等试验结果表明,菌株R6多糖产量最高(106.73 mg/L),pH 3时耐酸性最佳,0.05%胆盐时生长滞后期最短(1.50 h),细胞表面疏水性最突出(在十六烷中的细胞表面疏水性达到了93.28%),对沙门氏菌、大肠杆菌和金黄色葡萄球菌的抑制作用最显著,且对多种常见抗生素敏感和不具有溶血活性,菌株R6被鉴定为植物乳杆菌(Lactiplantibacillus plantarum),可作为潜在益生菌株。本研究为发掘食品源乳酸菌、筛选和利用潜在益生菌株提供参考和借鉴,尤其对开发利用巴马地区益生菌资源和促进地区特色食品的开发具有重要意义。
[1]DIVYA J B,VARSHA K K,NAMPOOTHIRI K M,et al.Probiotic fermented foods for health benefits[J].Eng Life Sci,2012,12(4):377-390.
[2]MATHUR H,BERESFORD T P,COTTER P D.Health benefits of lactic acid bacteria(LAB)fermentates[J].Nutrients,2020,12(6):1679.
[3]OLOJEDE A O, SANNI A, BANWO K, et al.Sensory and antioxidant properties and in-vitro digestibility of gluten-free sourdough made with selected starter cultures[J].LWT-Food Sci Technol,2020,129(2):109576.
[4]HUSSAIN A, ZIA K M, TABASUM S, et al.Blends and composites of exopolysaccharides;properties and applications:A review[J].Int J Biol Macromol,2017,94(Pt A):10-27.
[5]OERLEMANS M M P,AKKERMAN R,FERRARI M,et al.Benefits of bacteria-derived exopolysaccharides on gastrointestinal microbiota, immunity and health[J].J Funct Foods,2021,76(1):104289.
[6]RAJOKA M,JIN M L,ZHAO H B,et al.Functional characterization and biotechnological potential of exopolysaccharide produced by Lactobacillus rhamnosus strains isolated from human breast milk[J].LWT-Food Sci Technol,2018,89(3):638-647.
[7]LOBO R E,GÓMEZ M I,FONT DE VALDEZ G,et al.Physicochemical and antioxidant properties of a gastroprotective exopolysaccharide produced by Streptococcus thermophilus CRL1190[J].Food Hydrocolloids,2019,96(6):625-633.
[8]FENG F,ZHOU Q,YANG Y,et al.Characterization of highly branched dextran produced by Leuconostoc citreum B-2 from pineapple fermented product[J].Int J Biol Macromol,2018,113(7):45-50.
[9]晋耀文.巴马,上天遗落人间的一块净土——寻访巴马仁寿源[J].中国民族博览,2020(21):105-109.
[10]ZHAO L,QIAO X W,ZHU J,et al.Correlations of fecal bacterial communities with age and living region for the elderly living in Bama,Guangxi,China[J].J Microbiol,2011,49(2):186-192.
[11]WANG F, HUANG G, CAI D, et al.Qualitative and semiquantitative analysis of fecal bifidobacterium species in centenarians living in Bama,Guangxi,China[J].Curr Microbiol,2015,71(1):143-149.
[12]YASMIN I, SAEED M, KHAN W A, et al. In vitro probiotic potential and safety evaluation (hemolytic,cytotoxic activity) of bifidobacterium strains isolated from raw camel milk[J].Microorganisms, 2020, 8(3):354.
[13]李嘉文,刘达,刘党生,等.乳酸菌胞外多糖产生菌的筛选与初步研究[J].中国微生态学杂志,2019,31(9):1027-1033.
[14]WANG X, WANG W, LV H, et al.Probiotic potential and wide-spectrum antimicrobial activity of lactic acid bacteria isolated from infant feces[J].Probiotics Antimicrob Proteins,2021,13(1):90-101.
[15]ALONSO S,CASTRO M C,BERDASCO M,et al.Isolation and partial characterization of lactic acid bacteria from the gut microbiota of marine fishes for potential application as probiotics in aquaculture[J].Probiotics Antimicrob Proteins,2019,11(2):569-579.
[16]JANG H J,LEE N,PAIK H.Probiotic characterization of Lactobacillus brevis KU15153 showing antimicrobial and antioxidant effect isolated from kimchi[J].Food Sci Biotechnol,2019,28(5):1521-1528.
[17]SOMASHEKARAIAH R,SHRUTHI B,DEEPTHI B V,et al.Probiotic properties of lactic acid bacteria isolated from Neera: A naturally fermenting coconut palm nectar[J].Front Microbiol,2019,10(1):13382.
[18]万倩,李启明,吴华星,等.传统发酵食品中乳酸菌的安全性评估[J].现代食品科技,2021,37(6):276-286.
[19]SUI Y,LIU J,LIU Y,et al.In vitro probiotic characterization of Lactobacillus strains from fermented tangerine vinegar and their cholesterol degradation activity[J].Food Biosci,2021,39(1):100843.
[20]JO Y M,KIM G Y,KIM S,et al.Limosilactobacillus fermentum MG7011:An amylase and phytase producing starter for the preparation of rice-based probiotic beverages[J].Front Microbiol,2021,12:745952.
[21]QIAN M,ZHOU X,XU T,et al.Evaluation of potential probiotic properties of Limosilactobacillus fermentum derived from piglet feces and influence on the healthy and E.coli-challenged porcine intestine[J].Microorganisms,2023,11(4):1055.
[22]毕洁.胆盐水解酶提高乳酸菌胆盐耐受能力的酶学与生理学机制研究[D].无锡:江南大学,2016.
[23]CASAROTTI S N,CARNEIRO B M,TODOROV S D,et al.In vitro assessment of safety and probiotic potential characteristics of Lactobacillus strains isolated from water buffalo mozzarella cheese[J].Ann Microbiol,2017,67(4):289-301.
[24]SORNSENEE P, SINGKHAMANAN K, SANGKHATHAT S, et al.Probiotic properties of Lactobacillus species isolated from fermented palm sap in Thailand[J].Probiotics Antimicrob Proteins,2021,13(4):957-969.
[25]MAHMOUDI I, MOUSSA O B, KHALDI T E M, et al.Functional in vitro screening of Lactobacillus strains isolated from Tunisian camel raw milk toward their selection as probiotic[J].Small Ruminant Res,2016,137(4):91-98.
[26]NAMI Y, HAGHSHENAS B, BAKHSHAYESH R V, et al.Novel autochthonous Lactobacilli with probiotic aptitudes as a main starter culture for probiotic fermented milk[J].LWT-Food Sci Technol,2018,98(12):85-93.
[27]RYU E H, CHANG H C. In vitro study of potentially probiotic lactic acid bacteria strains isolated from kimchi[J].Ann Microbiol,2013,63(4):1387-1395.