酱香型白酒是以茅台酒为代表的四大基础香型之一,具有酱香突出,回味悠长,空杯留香持久等特点[1]。酱酒生产工艺较为复杂,生产周期长,生产原料和工艺决定着酱酒的品质[2]。酱香型白酒是唯一使用单一纯粮小麦作为制曲原料的白酒,可见小麦的品质对于成品酒品质的影响程度[3]。曲是酒之骨,为酒提供菌系、物系和酶系,制曲过程中网罗了自然界的大量微生物,把环境中存在的有利于酿酒的微生物大部分都集于大曲中,从而促进白酒风味的产生。选用红缨子高梁为酿酒原料,因其具有较高的单宁以及支链淀粉含量,更适应酱香酒多次蒸煮的工艺特征,且产生更多的芳香酸和芳香醛,为白酒提供独特的风味[4]。
有研究表明,酱香型白酒原料含有的淀粉、蛋白质作为基础物质在高温制曲和发酵过程中分解后发生美拉德反应,是酱香风味物质的主要来源之一[5]。淀粉在白酒中主要参与酒精发酵过程,先糊化糖化成小分子的糊精和单糖,继而发酵产生酒精,因此淀粉含量直接与白酒的出酒率挂钩[6]。蛋白质通常通过一系列微生物或酶降解等反应最终生成白酒中重要的呈香呈味物质—醇和酯。水分是微生物生理活动所必需的物质,适量的水分保证发酵正常进行。适量的脂类化合物分解会给白酒带来特殊的香气,脂肪含量过高会严重影响成品酒质量,导致发酵过程中升酸快,产生异杂味[7-8]。
非靶向代谢组学技术是借助色谱、质谱等仪器对生物系统中小分子代谢物进行系统的定性定量分析,通过数据处理和分析准确找出样本间差异性代谢物,进而解析生物样本中代谢物的重要信息[9]。目前,对制曲原料小麦和制酒原料高粱的研究主要采用理化分析方法和气相色谱等对其主要成分进行定性或定量分析,随着代谢组学技术的推广,研究者采用非靶向代谢组学对普通小麦和高粱的成分分析,但对酱酒制曲原料小麦和制酒原料高粱与酒和曲中代谢物的关系的综合论述则少有论及[10-12]。
因此,该研究以酱香型白酒原料制曲小麦和红缨子高梁为研究对象,测定理化指标,结合非靶向代谢组学技术、主成分分析(principal component analysis,PCA)与正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)筛选两种原料的差异代谢物质,并重点分析两者在与美拉德反应相关的氨基酸类物质与吡嗪类物质上存在的差异性。旨在进一步完善该课题的研究理论,为后续探究曲和酒中的风味物质来源及代谢关系提供数据支持。
1 材料与方法
1.1 材料与试剂
小麦(wheat,WT),高粱(sorghum,SOR):贵州省仁怀市茅台镇某酒厂制酒车间,粉碎混合后用四分法进行缩分取样,分别在4 ℃和-80 ℃条件下保存,备用。
石油醚、亚铁氰化钾(均为分析纯):成都市科隆化学品有限公司;盐酸(分析纯):昆山金城试剂有限公司;氢氧化钠(分析纯):天津市科密欧化学试剂有限公司;乙酸铅(分析纯):成都金山化学试剂有限公司;硫酸钠(分析纯):天津市永大化学试剂有限公司;考马斯亮蓝试剂(指示剂):上海酶联生物科技有限公司;甲醇、乙腈(均为色谱纯):德国Merck公司;L-2-氯苯丙氨酸(色谱纯):上海阿拉丁生化科技股份有限公司;甲酸(色谱纯):印度HCL公司。
1.2 仪器与设备
FA1204N电子天平:上海菁海仪器有限公司;DHG-9140A电热鼓风干燥箱:上海一恒科学仪器有限公司;HME-700S粉碎机:台湾弘荃仪器有限公司;TD5A医用离心机:盐城凯特仪器有限公司;V-5100紫外可见分光光度计:上海元析仪器有限公司;上调LC Acquity I-Class PLUS超高效液相色谱,Acquity上调LC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),Waters上调LCXevoG2-XSQTOF高分辨质谱(配有电喷雾离子(electric spray ion,ESI)源):美国Waters公司。
1.3 方法
1.3.1 理化指标的测定
淀粉含量测定:采用酸水解法[13];蛋白质含量测定:采用凯氏定氮法;脂肪含量测定:采用索氏提取法[14]。
1.3.2 非靶向代谢组学分析
(1)小麦与高粱代谢物的提取与分析
小麦与高粱样品研磨成粉,各称取50 mg,加入1 000 μL混合溶液(甲醇∶乙腈∶水=2∶2∶1(V/V)),涡旋30 s;研磨仪45 Hz研磨10 min后置于冰水浴中超声10 min;-20 ℃条件下静置1 h,4 ℃、12 000 r/min离心15 min,取500 μL上清液真空浓缩干燥;将干燥后的代谢物加入100 μL乙腈∶水=1∶1(V/V)提取液中复溶,涡旋30 s后置于冰水浴中超声10 min;4 ℃、12 000 r/min离心15 min;取120 μL上清于进样瓶中上机检测,每个样本各取10 μL混合成质量控制(quality control,QC)样本上机检测。
(2)色谱条件
超高效液相色谱条件:液相色谱的流动相A为0.1%甲酸水溶液,流动相B为乙腈(含0.1%甲酸)。进样体积1 μL,流速为400 μL/min。梯度洗脱程序:0~0.25 min,98%流动相A,2%流动相B;0.26~13 min,2%流动相A,98%流动相B;13.1 min,98%流动相A,2%流动相B[15]。
质谱条件:采用ESI离子源的正、负离子模式检测,正离子模式毛细管电压为2 500 V,负离子模式毛细管电压为-2 000 V,锥孔电压为30 V;离子源温度为100 ℃,脱溶剂气温度500 ℃;反吹气流速为50 L/h,脱溶剂气流速为800 L/h;质核比50~1 200 m/z。
1.3.3 数据处理
小麦和高粱的理化指标涉及有效的3 组平行检测数据平均值,结果使用(平均值±标准差)的形式表示,利用SPSS 22.0软件进行统计学分析处理,当P<0.05时,理化指标数据组之间被认为具有统计学的显著差异。使用MassLynx V4.2采集的原始数据,通过Progenesis QI软件做峰提取、峰对齐等数据处理操作,基于京都基因与基因百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(https://www.genome.jp/kegg/pathway.html),人类代谢组数据库(human metabolome database,HMDB)数据库(https://hmdb.ca/metabolites)和脂质代谢途径研究计划(lipidmetabolites and pathways strategy,LipidMaps)数据库(http://www.lipidmaps.org/)开展化合物注释[16]。数据进行多维统计分析,采用prcomp 3.6.1进行主成分分析,ropls1.6.2进行正交偏最小二乘法分析(OPLS-DA)[17]。根据样品分组的变量重要性投影(variable importance in projection,VIP)和T检验计算各化合物的差异显著性P值进行筛选差异代谢物。
2 结果与分析
2.1 理化指标的测定
由表1可知,小麦与高粱的淀粉、蛋白质、水分和脂肪含量4个理化指标均存在显著性差异。高粱的淀粉、蛋白质和脂肪含量均显著高于小麦(P<0.05)。
表1 小麦与高粱理化指标测定结果
Table 1 Determination results of physicochemical indexes of wheat and sorghum
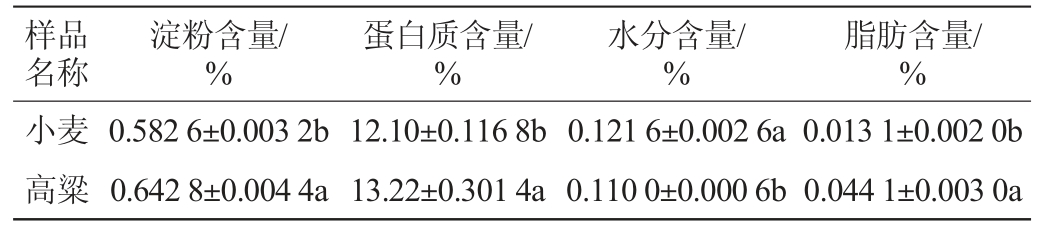
注:不同字母表示差异显著(P<0.05)。
样品名称脂肪含量/%小麦高粱淀粉含量/%蛋白质含量/%水分含量/%0.013 1±0.002 0b 0.044 1±0.003 0a 0.582 6±0.003 2b 0.642 8±0.004 4a 12.10±0.116 8b 13.22±0.301 4a 0.121 6±0.002 6a 0.110 0±0.000 6b
2.2 非靶向代谢组学分析
2.2.1 小麦与高粱样品重复相关性
小麦和高粱6个样本中共有8 862个峰,其中共稀释得到1 737个代谢产物。质量控制样本(QC)的相关系数越接近于1,说明整个检测过程的稳定性越好[18]。QC中皮尔逊的相关性见图1。由图1可知,QC在正、负离子模式下的相关系数(R2)均>0.964,说明整体检测过程的稳定性更好,在进行质谱检测时,样品的均一性更好。
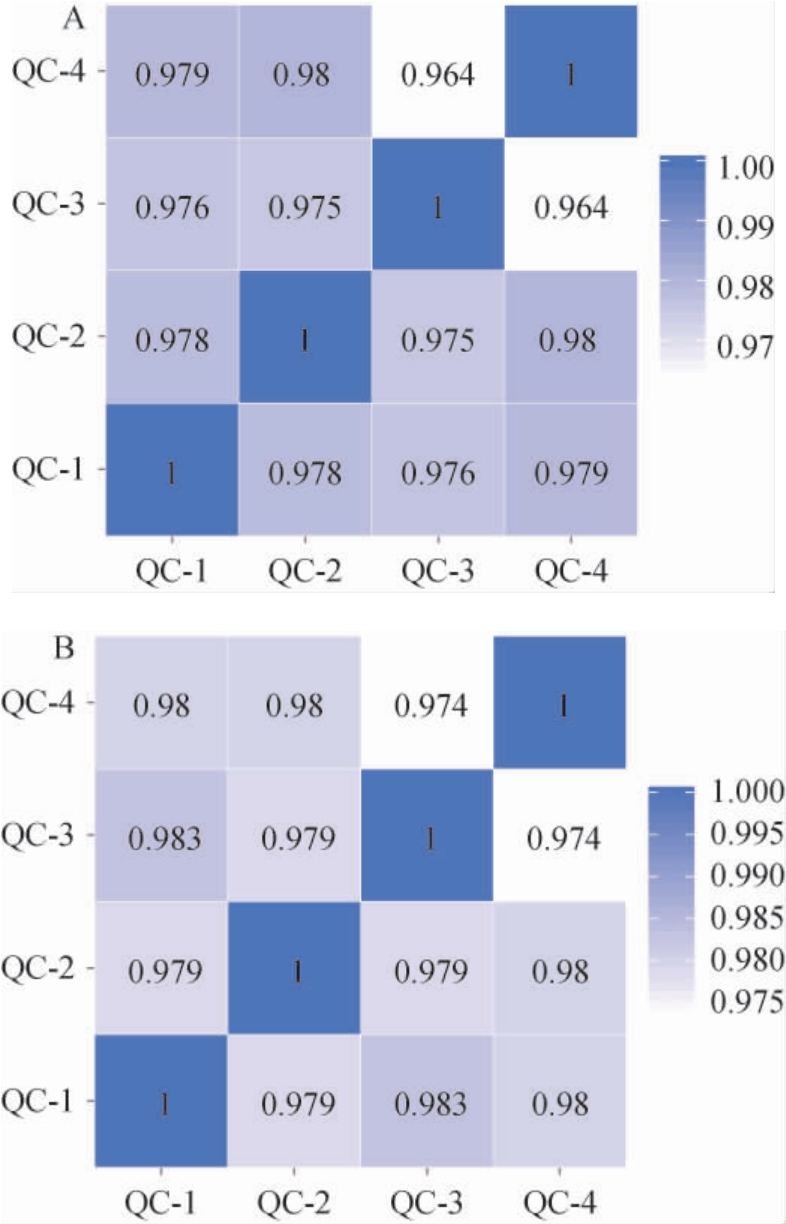
图1 小麦和高粱质量控制样本正(A)、负(B)离子模式下相关性分析
Fig.1 Correlation analysis of wheat and sorghum quality control samples under positive (A) and negative (B) ion modes
2.2.2 小麦和高粱代谢产物的主成分分析
对小麦与高粱样品进行主成分分析(图2),正离子模式下第一主成分(PC1)的方差贡献率为64.26%、第二主成分(PC2)的方差贡献率为13.63%,累计方差贡献率为77.89%;负离子模式下第一主成分(PC1)的方差贡献率为77.72%、第二主成分(PC2)的方差贡献率为8.56%,累计方差贡献率为86.28%;说明小麦与高粱均处于95%椭圆置信区间。在PCA得分图中,样本点间距离越远说明样本组间代谢物差异越大,反之则越小[19]。小麦与高粱样本点在正离子模式与负离子模式下,均距离较远,则说明大麦与高粱之间的代谢物存在明显差异性。
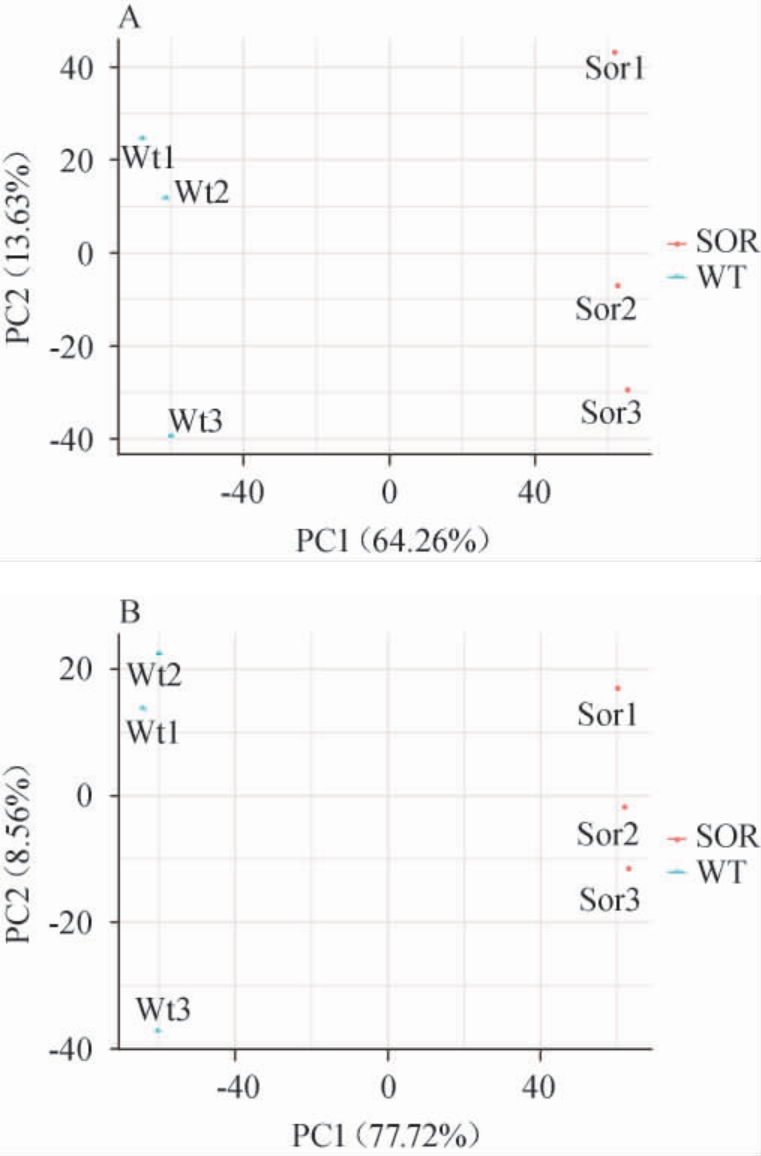
图2 小麦与高粱样品正(A)、负(B)离子模式下主成分分析得分图
Fig.2 Score plots of principal component analysis of wheat and sorghum samples under positive (A) and negative (B) ion modes
2.2.3 小麦和高粱代谢产物的OPLS-DA分析
OPLS-DA分析是利用预测变量和响应之间协方差的潜在变量回归方法,从而有效检测到相关性较小的变量,得到样本组间的特征变量即VIP值[20]。OPLS-DA得分图中,评估模型预测能力的指标Q2Y是进行评价该模型的预测参数之一,由图3可知,正离子模式和负离子模式下Q2Y值均>0.9,说明模型可靠,可用于筛选代谢物[21]。小麦与高粱样本点间横向距离均较大,且均处于95%置信区间内,则说明小麦与高粱样本的代谢物具有显著差异(P<0.05)。
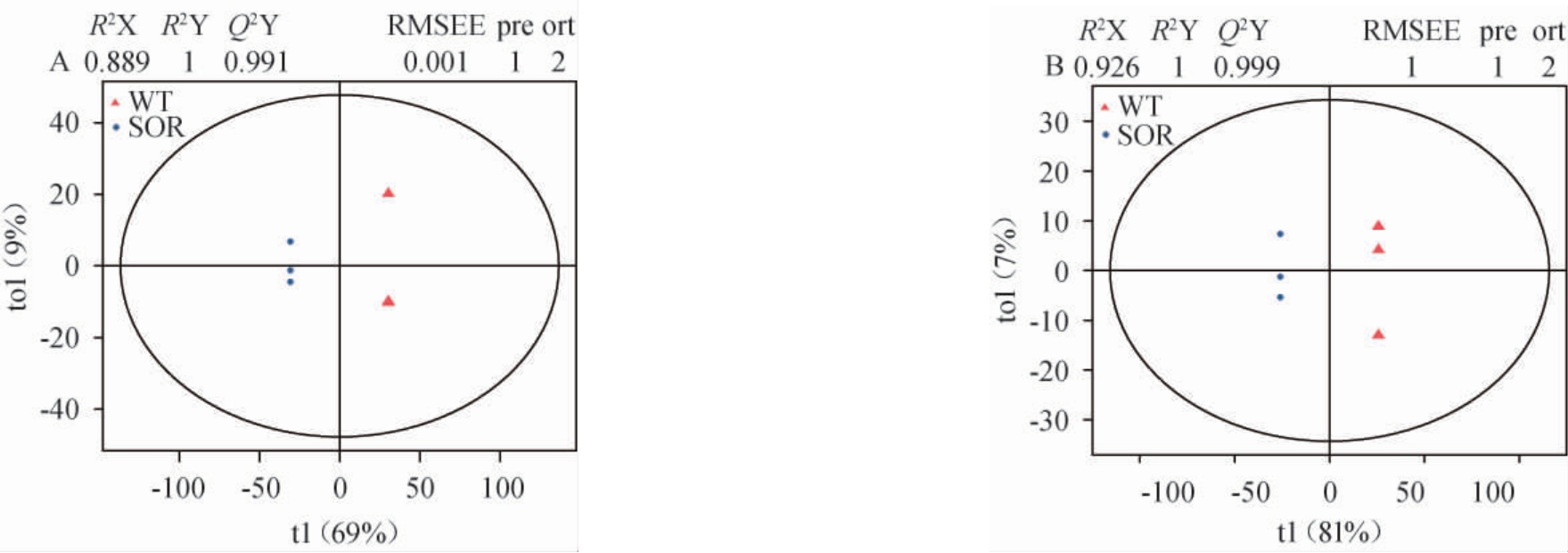
图3 小麦与高粱样品正(A)、负(B)离子模式下正交偏最小二乘-判别分析得分图
Fig.3 Scores diagram of orthogonal partial least squares-discriminant analysis of wheat and sorghum samples under positive (A) and negative (B) ion modes
为了验证OPLS-DA模式的可靠性,对OPLS-DA模型进行置换检验,即对模式进行多次排列测试(n=200)。对这些样品的数据包进行随机地排列,同时计算并统计每次置换后得到的模型的累计方差值R2Y与Q2Y值,并将其绘制成散点图如图4。图中x轴表示置换分组与原模型分组的相关性,y轴表示R2Y或者Q2Y的取值,蓝点表示置换后模型的R2Y值,红点表示置换后模型的Q2Y值,图中两条虚线表示R2Y和Q2Y拟合的回归线。在正离子和负离子模式下的模型中Q2Y拟合回归线系数均为正且>1,说明该模型有意义。图4中蓝点的位置均位于红点之上,表示检测值均低于真实值,则说明建模训练集和测试集的独立性较好[22]。综上得出,该模型不存在过拟合现象。
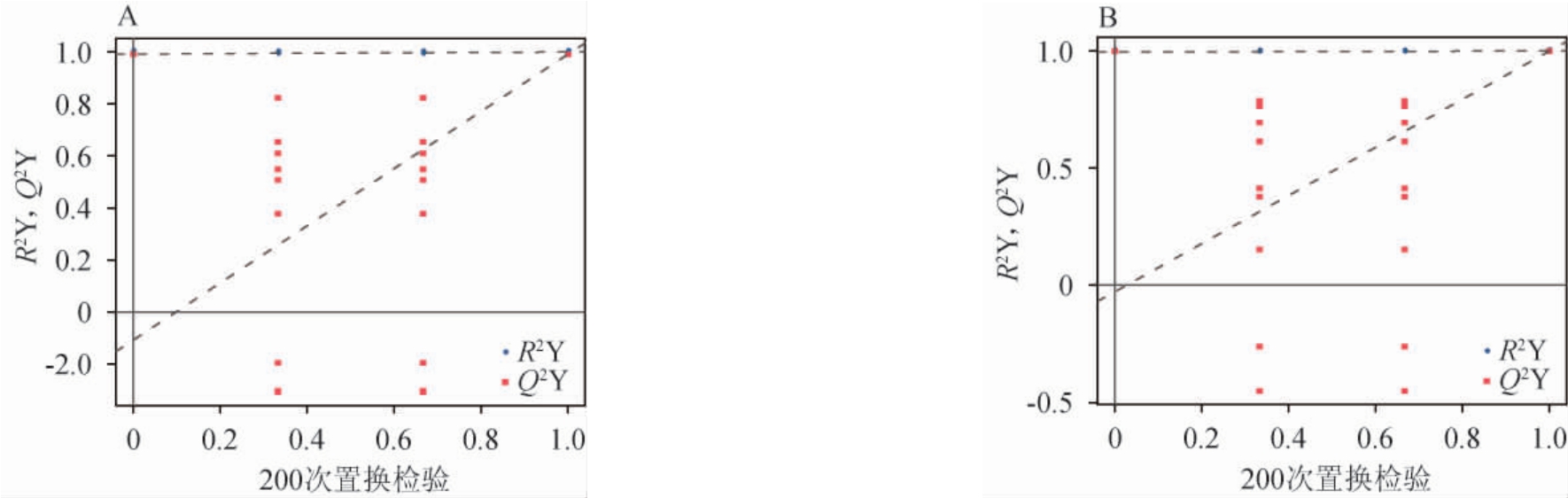
图4 小麦与高粱样品正(A)、负(B)离子模式下正交偏最小二乘-判别分析模型置换检验结果
Fig.4 Results of permutation tests of orthogonal partial least squares-discriminant analysis model of wheat and sorghum samples in positive (A) and negative (B) ion mode
2.2.4 小麦和高粱代谢产物的火山图分析与差异代谢物筛选
基于OPLS-DA模型所得到的分析结果,对样品组间差异代谢物质进行筛选[23]。VIP值反映了变量对模型的整体拟合度和分类能力的贡献大小,其值越高表示它在模型构建中越重要,一般认为VIP值大于1的变量对模型特别重要。P值是衡量观察到的数据与原假设一致性的概率值,其值小于0.05时,通常意味着处理组与对照组之间存在显著性差异。因此以VIP≥1且P<0.05作为小麦与高粱样品间显著性差异代谢物的筛选条件,共筛选得到1 599种代谢物。其中脂质和类脂分子为279种;有机杂环化合物为128种;有机酸及其衍生物为152种;有机含氧化合物为101种;苯环型化合物为75种;苯丙素类和聚酮类为68种;核苷、核苷酸和类似物为42种;含氮有机化合物为13种;烃类为7种;生物碱和衍生物为6种;同质非金属化合物为2种;木脂素、新木脂素及相关化合物为1种;有机硫化合物为1种;其他化合物为724种。差异代谢物火山图结果见图5。在正离子模式下,共筛选到916种差异代谢物,其中小麦与高粮对比上调的有485种(占比52.95%),下调的有431种(占比47.05%);在负离子模式下,共筛选到683种差异代谢物,其中小麦与高梁对比上调的有305种(占比44.66%),下调的有378种(占比55.34%)。
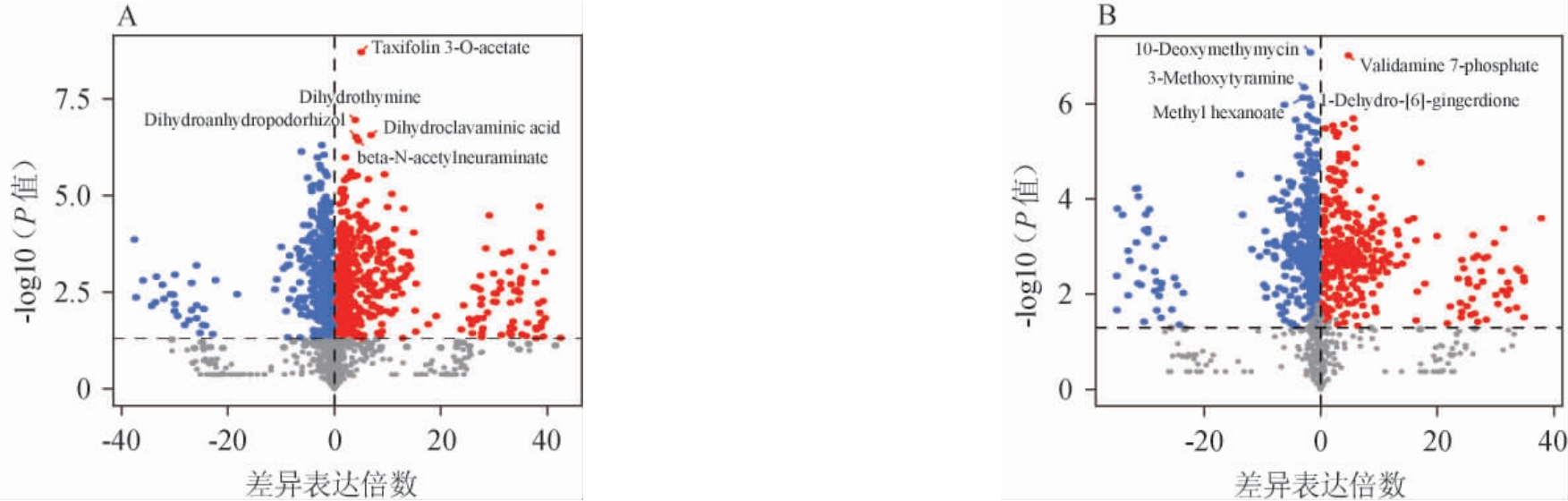
图5 小麦和高粱样品正(A)、负(B)离子模式下差异代谢物火山图
Fig.5 Volcanic maps of differential metabolites in wheat and sorghum samples under positive (A) and negative (B) ion models
酱香型白酒生产工艺讲究“四高两长”,其中“四高”是指高温制曲、高温发酵、高温蒸煮和高温馏酒。在高温环境下会加速大曲中蛋白质、氨基酸分解等并进行美拉德反应产生呋喃类、吡嗪类及芳香族化合物[24-25]。吡嗪类物质被认为是酱香型白酒中主要风味物质成分[26],分析小麦与高粱在氨基酸类物质与吡嗪类物质的差异性,结果见表2和表3。筛选得到小麦与高粱差异代谢物中氨基酸类物质共72种,由表2可知,其中31种物质上调,41种物质下调。由表3可知,筛选得到小麦与高粱差异代谢物中吡嗪类物质共7种,其中4种物质下调,3种物质上调。
表2 小麦与高粱差异代谢物中氨基酸类物质
Table 2 Amino acids in differential metabolites of wheat and sorghum

差异代谢物 VIP值 差异表达倍数L-亮氨酸L-异亮氨酸L-同型半胱氨酸L-苏氨酸4-氨基丁酸半胱氨酰甘氨酸L-脯氨酸缬氨酸精氨酰基亮氨酸环亮氨酸N-乙酰鸟氨酸脱酰基酶4-胍基丁酸D-哌啶酸L-组氨酸缬氨酰-酪氨酸N2-琥珀酰-L-鸟氨酸Nε-乙酰-L-赖氨酸L-2,4-二氨基丁酸L-苯丙氨酰-L-脯氨酸谷氨酰-蛋氨酸4-氨基苯丙氨酸异白氨酰-亮氨酸酪氨酰基-精氨酸5-羟基赖氨酸苯丙氨酰-异亮氨酸苯丙氨酰-赖氨酸L-精氨酸L,L-环(苯丙氨酸-脯氨酸)反式-3-羟基-L-脯氨酸鸟氨酸异戊酰谷氨酸羟脯氨酸缬氨酰-赖氨酸1.201 2 1.198 0 1.203 3 1.100 6 1.134 4 1.183 6 1.110 0 1.183 9 1.173 7 1.167 4 1.203 3 1.186 3 1.107 8 1.074 1 1.071 8 1.054 5 1.199 6 1.181 2 1.183 2 1.204 2 1.201 4 1.184 4 1.155 4 1.158 3 1.173 9 1.160 5 1.134 9 1.198 8 1.112 7 1.053 8 1.165 5 1.112 7 1.021 1-1.474 4-0.982 0-3.080 3-0.777 8-2.490 7 1.603 3-0.419 9-6.443 4-29.438 3 2.352 5-4.121 9 0.829 9-0.365 9 0.514 9 0.643 3-0.438 3-2.232 6-1.465 4-1.567 2 7.856 4 2.529 8 2.440 7-2.619 4-0.852 7-1.194 6-1.265 5-0.419 5-1.456 1 4.226 0 0.413 9 0.673 1 31.370 2-1.549 1
续表
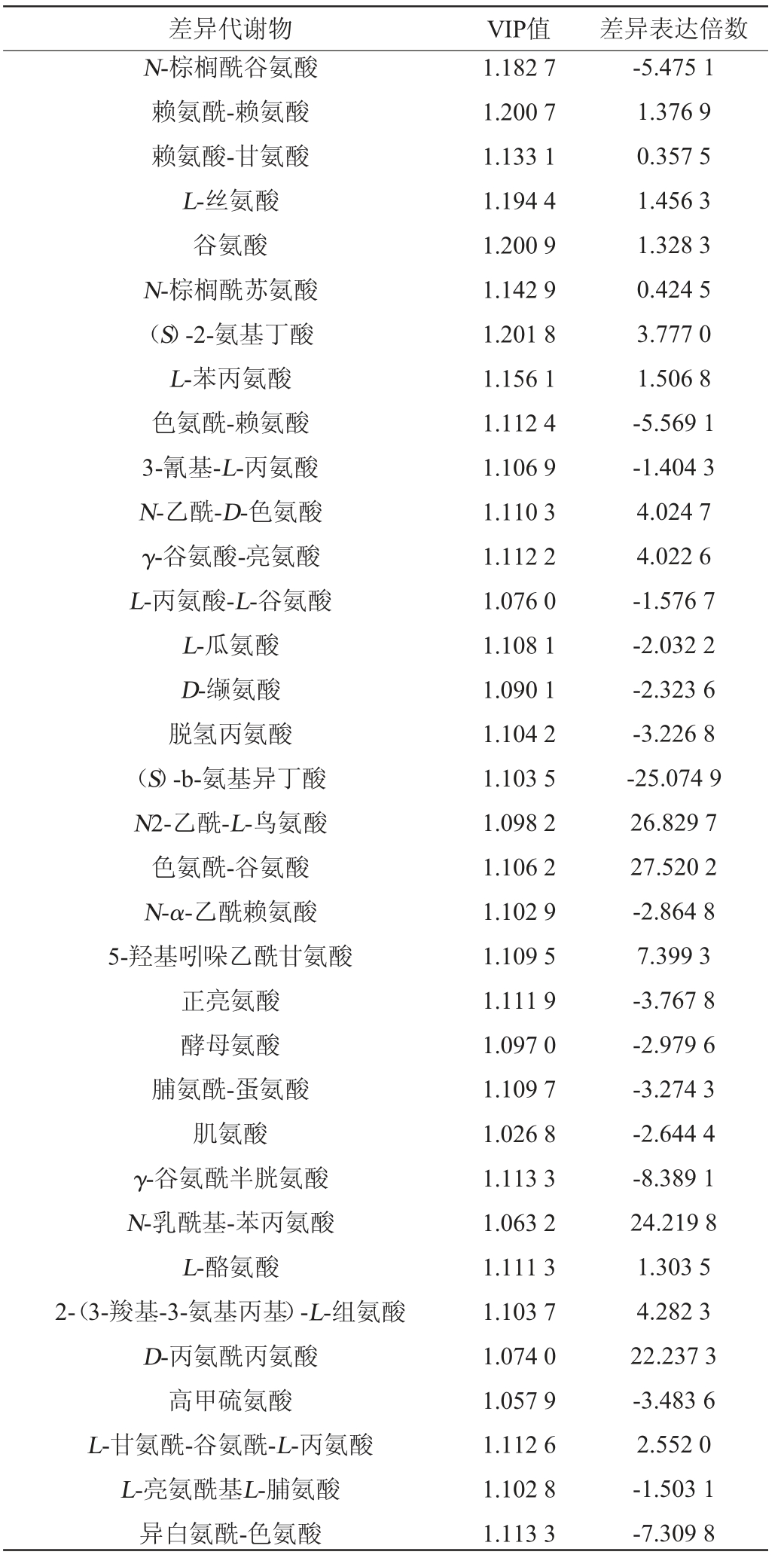
差异代谢物 VIP值 差异表达倍数N-棕榈酰谷氨酸赖氨酰-赖氨酸赖氨酸-甘氨酸L-丝氨酸谷氨酸N-棕榈酰苏氨酸(S)-2-氨基丁酸L-苯丙氨酸色氨酰-赖氨酸3-氰基-L-丙氨酸N-乙酰-D-色氨酸γ-谷氨酸-亮氨酸L-丙氨酸-L-谷氨酸L-瓜氨酸D-缬氨酸脱氢丙氨酸(S)-b-氨基异丁酸N2-乙酰-L-鸟氨酸色氨酰-谷氨酸N-α-乙酰赖氨酸5-羟基吲哚乙酰甘氨酸正亮氨酸酵母氨酸脯氨酰-蛋氨酸肌氨酸γ-谷氨酰半胱氨酸N-乳酰基-苯丙氨酸L-酪氨酸2-(3-羧基-3-氨基丙基)-L-组氨酸D-丙氨酰丙氨酸高甲硫氨酸L-甘氨酰-谷氨酰-L-丙氨酸L-亮氨酰基L-脯氨酸异白氨酰-色氨酸1.182 7 1.200 7 1.133 1 1.194 4 1.200 9 1.142 9 1.201 8 1.156 1 1.112 4 1.106 9 1.110 3 1.112 2 1.076 0 1.108 1 1.090 1 1.104 2 1.103 5 1.098 2 1.106 2 1.102 9 1.109 5 1.111 9 1.097 0 1.109 7 1.026 8 1.113 3 1.063 2 1.111 3 1.103 7 1.074 0 1.057 9 1.112 6 1.102 8 1.113 3-5.475 1 1.376 9 0.357 5 1.456 3 1.328 3 0.424 5 3.777 0 1.506 8-5.569 1-1.404 3 4.024 7 4.022 6-1.576 7-2.032 2-2.323 6-3.226 8-25.074 9 26.829 7 27.520 2-2.864 8 7.399 3-3.767 8-2.979 6-3.274 3-2.644 4-8.389 1 24.219 8 1.303 5 4.282 3 22.237 3-3.483 6 2.552 0-1.503 1-7.309 8
续表
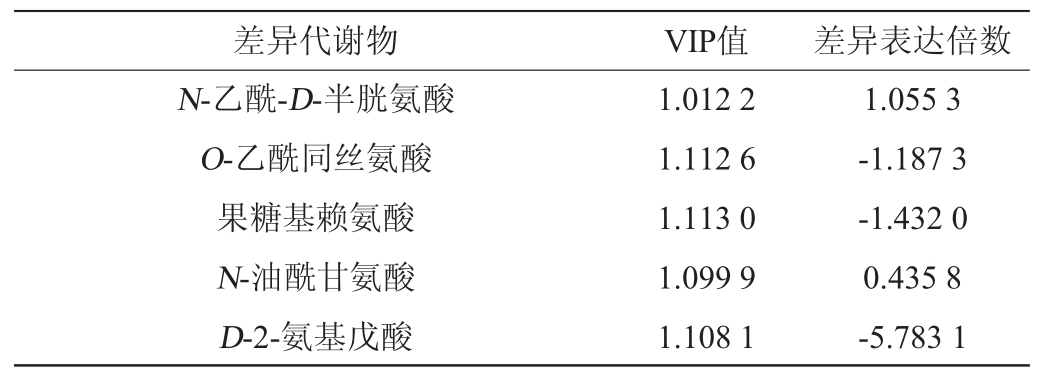
差异代谢物 VIP值 差异表达倍数N-乙酰-D-半胱氨酸O-乙酰同丝氨酸果糖基赖氨酸N-油酰甘氨酸D-2-氨基戊酸1.012 2 1.112 6 1.113 0 1.099 9 1.108 1 1.055 3-1.187 3-1.432 0 0.435 8-5.783 1
表3 小麦与高粱差异代谢物中吡嗪类物质
Table 3 Pyrazinines in the differential metabolites of wheat and sorghum
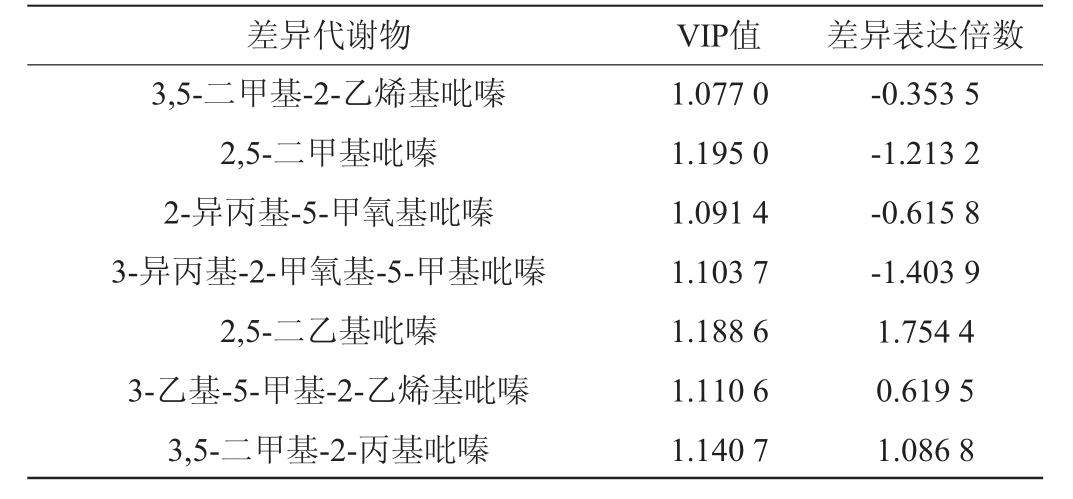
差异代谢物 VIP值 差异表达倍数3,5-二甲基-2-乙烯基吡嗪2,5-二甲基吡嗪2-异丙基-5-甲氧基吡嗪3-异丙基-2-甲氧基-5-甲基吡嗪2,5-二乙基吡嗪3-乙基-5-甲基-2-乙烯基吡嗪3,5-二甲基-2-丙基吡嗪1.077 0 1.195 0 1.091 4 1.103 7 1.188 6 1.110 6 1.140 7-0.353 5-1.213 2-0.615 8-1.403 9 1.754 4 0.619 5 1.086 8
2.2.5 小麦和高粱代谢物的代谢通路分析
KEGG数据库有助于研究者把基因、表达信息以及代谢物含量作为一个整体网络进行研究[27-28]。在KEGG数据库中匹配小麦和高粱的差异代谢物并进行注释,并得到差异代谢物所参与的代谢通路[29-30],选取KO pathway level2条目注释最多的top20注释信息,绘制代谢通路柱形图(图6)。由图6可知,在正离子模式下,小麦和高粱样品间富集到的代谢通路有所不同,主要代谢通路为ABC转运蛋白(ABC transporters)的生物合成、亚油酸代谢(linoleic acid metabolism)、嘌呤代谢(purine metabolism)、色氨酸代谢(tryptophan metabolism)、氨基苯甲酸盐降解途径(aminobenzoate degradation)等。在负离子模式下,主要的代谢通路为半乳糖代谢(galactose metabolism)、吩嗪生物合成(phenazine biosynthesis)、吲哚生物碱生物合成(indole alkaloid biosynthesis)、氨基苯甲酸降解(aminobenzoate degradation)、苯丙氨酸、酪氨酸型聚酮产物的生物合成(biosynthesis of type II polyketide products phenylalanine,tyrosine and tryptophan biosynthesis)等。其中,ABC转运蛋白的生物合成途径的主要差异物为4-三甲基氨碘丁酸酯、L-亮氨酸、硫酸盐、硫胺素、硫酸胆碱;亚油酸代谢中主要差异代谢物为亚油酸酯、辛酸、亚油酸;嘌呤代谢途径的主要差异物为鸟苷、1-(5′-磷酸核糖基)-5-氨基-4-咪唑甲酰胺、5-氨基-1-(5-磷酸-D-核糖基)咪唑-4-甲酰胺、肌苷、2′-脱氧肌苷、5′-磷酸核糖甘氨酰胺;色氨酸代谢途径的主要差异物为3-甲基吲哚、5-甲氧基吲哚乙酸酯、吲哚-3-乙酸酯、5-(2′-甲酰乙基)-4,6-二羟基吡啶甲酸酯、儿茶酚;氨基苯甲酸盐降解途径的主要差异物为二氢间苯三酚、苯甲酰胺、苯甲醛、3-羟基-5-氧代己酸酯;半乳糖代谢主要差异代谢物为肌醇、蜜二糖、棉子糖;吩嗪生物合成途径的主要差异物为异黄酮、2-庚基-3-羟基喹诺酮、1-(2-氨基苯基)癸烷-1,3-二酮、9-(二甲基烯丙基)-5,10-二氢吩嗪-1-羧酸酯;吲哚生物碱生物合成途径的主要差异物为色胺、4,21-脱氢钴氨酸醛;氨基苯甲酸降解途径的主要差异物为2-氨基苯酚、苯胺、4-羟基苯甲醛、香草酸;苯丙氨酸、酪氨酸型聚酮产物的生物合成途径的主要差异物为水氨霉素、脱水四环素、β-红霉素。
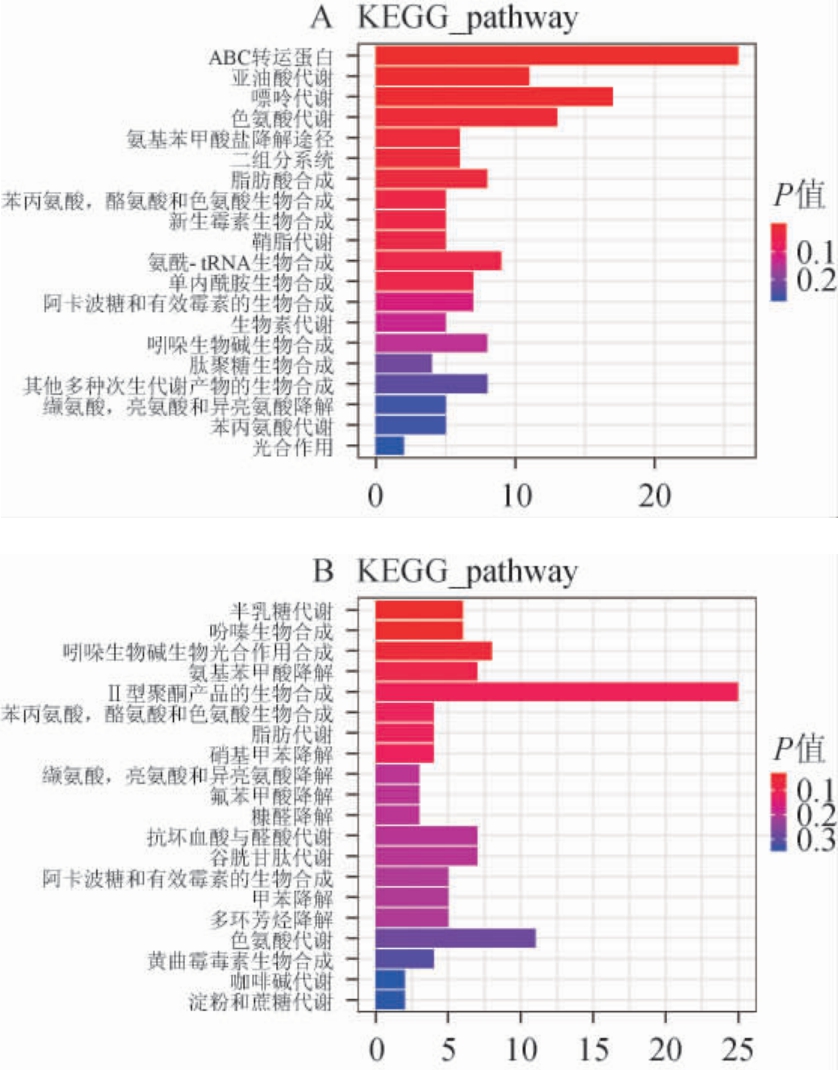
图6 小麦和高粱样品正(A)、负(B)离子模式下差异代谢物通路柱形图
Fig.6 Cylindrical diagram of differential metabolite pathways of wheat and sorghum samples under positive (A) and negative (B) ion models
3 结论
利用理化指标测定、非靶向代谢组学技术结合多元分析手段研究酱香型白酒原料小麦和高粱差异代谢物与代谢通路。结果表明,小麦与高粱样品在淀粉含量、蛋白质含量、水分含量、脂肪含量4个指标上均存在显著性差异。淀粉、蛋白质和脂肪含量高粱显著高于小麦,水分含量小麦显著高于高粱。
基于非靶向代谢组学结合多元分析手段分析酿酒小麦和高粱。共注释到1 737个和1 141个代谢物,以VIP≥1结合单变量分析的P<0.05为标准开展差异代谢物的筛选,并分析其差异代谢通路。结果表明,在正离子模式下,筛选到916种差异代谢物,上调485种,下调431种;在负离子模式下,筛选到683种差异代谢物,上调305种,下调378种。进一步筛选出小麦与高粱差异代谢物中氨基酸类和吡嗪类物质,其中氨基酸类共72种,31种上调,41种下调;吡嗪类物质共7种,3种上调,4种下调。在KEGG数据库中匹配小麦和高粱的差异代谢物,其代谢通路主要集中在ABC转运蛋白的生物合成、亚油酸代谢、嘌呤代谢和丙酮酸代谢、花生四烯酸代谢通路。
综上,通过对小麦与高粱样品理化指标分析以及非靶向代谢组学分析中针对与美拉德反应相关的氨基酸类物质与吡嗪类物质,掌握了原料中更多成分信息,初步探究了酱香型白酒酿造原料的代谢产物与代谢途径,为进一步研究原料在白酒风味中的贡献奠定理论基础。
[1]邱声强,唐维川,赵金松,等.酱香型白酒生产工艺及关键工艺原理简述[J].酿酒科技,2021(5):86-92.
[2]程度.酿酒用高粱原料对酱香型白酒品质影响的初步研究[D].贵阳:贵州大学,2022.
[3]赵洪芳,李国辉,冯海燕,等.酱香型白酒制曲用小麦硬度的评价研究[J].酿酒科技,2022(12):76-79,84.
[4]王海容.酿酒小麦品质探究及在不同产区的品质特性[D].杨凌:西北农林科技大学,2022.
[5]黄家岭,廖妍俨,孙棣,等.顶空固相微萃取-气相色谱法检测白酒中吡嗪类化合物[J].中国酿造,2016,35(8):163-168.
[6]JEZIORNY K,PIETROWSKA K,SIEMINSKA J,et al.Serum metabolomics identified specific lipid compounds which may serve as markers of disease progression in patients with Alström and Bardet-Biedl syndromes[J].Front Mol Biosci,2023,10:1251905.
[7]胡桂林.空气及空气中的微生物对清香型白酒发酵的影响[D].呼和浩特:内蒙古农业大学,2009.
[8]杨荣,华进,周亚宾.白酒酿造过程中乳酸乙酯产生机理及“降乳”技术研究进展[J/OL].食品工业科技,1-13[2024-01-03].https://doi.org/10.13386/j.issn1002-0306.2023110117.
[9]PENG Y, HONG J W, RAFTERY D, et al.Metabolomic-based clinical studies and murine models for acute pancreatitis disease: A review[J].BBA-Mol Basis Dis,2021,1867(7):166123.
[10]吕佳慧.白酒酿酒和制曲原料中结合态风味物质的研究[D].无锡:江南大学,2017.
[11]ZANAN R,KHANDAGALE K,HINGE V.Characterization of fragrance in sorghum(Sorghum bicolor(L.)Moench)grain and development of a gene-based marker for selection in breeding[J].Mol Breeding,2016,36(11):146.
[12]倪德让,孔祥礼,孙崇德,等.红缨子高粱淀粉分子结构及糊化特性研究[J].中国酿造,2019,38(12):75-79.
[13]王海英,王慧,严伟,等.浅析样品前处理和酸化操作方式对大曲淀粉检测结果的影响[J].酿酒,2024,51(2):88-92.
[14]龚正波.索氏测粗脂肪的两种改进方法[J].饲料与畜牧,2017(19):59-60.
[15]赵冠.酿酒高粱蒸煮品质及发酵特性研究[D].杨凌:西北农林科技大学,2021.
[16]胡志宏,周泳臣,茶凤官,等.代谢组学揭示茶树嫁接黄酮类物质代谢通路[J].北方园艺,2024(4):1-7.
[17]吴睿敏.参与有机固废生物转化的微生物功能基因数据库与分析平台构建[D].上海:华东师范大学,2023.
[18]斯仁达来,TUYATSETSEG,BANZRAGCH M,等.基于上调LC-MS非靶向代谢组学分析不同年龄双峰驼肉代谢物差异[J].食品科学,2024,45(4):154-163.
[19]徐晓敏,房城,卢芳.基于代谢组学技术的黄芩-白芍对二型糖尿病模型小鼠的作用机制[J].世界中医药,2023,18(5):600-605.
[20]徐攀,贾鑫,高鹏,等.基于正交偏最小二乘判别分析电子束辐照对黄精抗氧化活性的影响[J].食品安全质量检测学报,2023,14(12):274-282.
[21]LI M W,SHEN Y,LING T J,et al.Analysis of differentiated chemical components between Zijuan Purple Tea and Yunkang Green Tea by UHPLC-Orbitrap-MS/MS combined with chemometrics[J].Foods,2021,10(5):1070.
[22]曾丽珊,尤健开,王艳鸽,等.基于上调LC-Q-TOF-MS的凉粉草不同栽培品系代谢物分析[J].中药新药与临床药理,2023,34(11):1592-1599.
[23]黄书源,张立强,冉茂芳,等.不同原料添加提升曲药酱香风味的研究[J].中国酿造,2024,43(5):41-46.
[24]杨漫江.堆积发酵对酱香型白酒风味物质形成的影响[J].酿酒科技,2011(7):72-73.
[25]罗帅.酱香型大曲中黑曲形成机制及抑菌性能解析[D].无锡:江南大学,2022.
[26]孙细珍,熊亚青,倪兴婷,等.吡嗪类化合物对酱香型白酒香气特征的影响分析[J/OL].食品与发酵工业,1-9[2024-01-03].https://doi.org/10.13995/j.cnki.11-1802/ts.038681.
[27]聂元皓,徐岩,吴群,等.芳香族化合物前体物质酪氨酸和苯丙氨酸在白酒中的来源解析[J].食品与发酵工业,2018,44(10):1-6.
[28]李金洋,赵菲菲,余志凡,等.糯粳高粱理化性质及小分子代谢物差异分析[J].中国酿造,2024,43(3):121-125.
[29]龙亚飞,唐佳代,王相勇,等.中国白酒中健康因子及其富集途径的研究进展[J].中国酿造,2022,41(2):23-28.
[30]柏彩红.代谢组学上调LC-MS数据色谱峰识别算法的开发和半枝莲对肺腺癌细胞代谢调控的探究[D].成都:成都中医药大学,2022.