青金桔(Citrus microcarpa),又称青桔、山桔、年桔等,为芸香科柑橘族金柑属,是宽皮柑橘(Citrus reticulate Blanco)和金桔(Fortunella spp.)的杂交品种,原产于中国,目前主要分布于东南亚和中国热带地区,具有悠久的种植历史[1-2]。青金桔维生素尤其是维生素C(vitamin C,VC)含量丰富,经常饮用青金桔作为主要原料制备的饮料,可以达到美容养颜、止痰润喉、治咳嗽的效果[3-4]。因此,青金桔目前主要被用于榨汁。青金桔榨汁后产生约45%的皮渣副产物,由于缺乏相应的加工技术,其基本被丢弃,从而造成较大的资源浪费和环境污染[5]。
发酵作为生产和保存食物最古老、最经济的方法之一,可改善产品风味,提升产品营养品质,增加其功能活性,已成为果蔬精深加工产业研究的重点和热点[6-7]。本课题组前期研究发现[8],采用自然发酵青金桔全果浆可实现对青金桔的100%利用,并促进总酚、总黄酮释放,提升其抑制消化相关酶活性的能力。但自然发酵存在发酵时间长、品质不稳定等缺点。人工接种进行纯种发酵可快速提升目标菌数,抑制其他杂菌生长,有利于产品品质控制、风味形成及功能活性的改善[9-10]。目前用于果蔬纯种发酵的菌种主要为酵母菌、乳酸菌、醋酸菌等[11-13],这些菌种发酵的最适pH值一般在4~6,低pH条件下其生长受到抑制甚至死亡。青金桔的酸度较高,全果浆pH值仅为2~3,一般菌种在此条件下很难生长。因此,寻找适宜青金桔全果浆发酵的菌株,是采用纯种发酵,实现发酵过程、产品质量可控的关键。研究表明,部分酵母菌在耐低pH环境、促进活性物质释放等方面表现出较大的潜力[14-15],可作为青金桔全果浆纯种发酵的潜在菌种进行筛选。
因此,本研究拟采用传统分离、纯化方法对青金桔全果浆自然发酵液中的酵母菌进行分离纯化,通过菌落、细胞形态观察结合内转录间隔区(internal transcribed spacer,ITS)测序对分离菌种进行鉴定,并评价其生长性能及对温度、pH和葡萄糖浓度的耐受性。采用分离鉴定的酵母菌对青金桔全果浆进行纯种发酵,比较发酵前后青金桔全果浆可溶性总酚、总黄酮含量、α-葡萄糖苷酶抑制率和抗氧化活性变化情况,考察分离菌株的发酵特性。以期得到发酵性能较好的酵母菌,解决自然发酵条件下青金桔酵素产品质量不稳定等问题,提高发酵青金桔品质,为后续优质青金桔产品的开发提供支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
青金桔鲜果:采购自当地市场。
1.1.2 化学试剂
葡萄糖、蛋白胨、琼脂、美蓝染色剂:北京索莱宝科技有限公司;酵母提取物:英国OXOID公司;三氯化铝(AlCl3):美国阿拉丁公司;氯化钠(NaCl)、亚硝酸钠(NaNO2)、硝酸钠(NaNO3):西陇科学股份有限公司;甲醇(色谱纯):德国CNW公司;α-葡萄糖苷酶(3×105 U/g)、1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonate),ABTS)自由基、新亚铜试剂、福林酚试剂、抗坏血酸:上海源叶生物科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:蛋白胨20.0 g,酵母提取物10.0 g,葡萄糖20.0 g,加水定容至1 L,pH自然,121 ℃高压蒸汽灭菌15 min。
YPD固体培养基:YPD液体培养基添加2%琼脂。
1.2 仪器与设备
DMM-40型胶体磨:上海秦硕化工机械设备有限公司;LGJ-10NS/GC型冷冻干燥机:北京亚星仪科科技发展有限公司;HFsafe900型生物安全柜:上海力申科学仪器有限公司;DGL-50X型立式灭菌器:上海力辰仪器科技有限公司;SPH-200B型台式恒温培养振荡器:上海世平实验设备有限公司;YP5002型电子天平:上海越平科学仪器(苏州)制造有限公司;CX33型显微镜:日本Olympus公司;CenLee16X台式高速离心机:湖南湘立科学仪器有限公司;PLUS-E2-20TJ实验室级超纯水机:南京易普易达科技发展有限公司;FlexA-200酶联免疫分析仪:杭州优米仪器有限公司。
1.3 方法
1.3.1 青金桔全果浆发酵样品的制备
选择新鲜、表皮略黄色或黄色、具有青金桔特有香味、无破裂、无发霉的青金桔,洗净、晾干至青金桔表面无水分,全果破碎,过70目筛后,放入5 L发酵罐中自然发酵。于第10天取样,得到青金桔全果浆自然发酵酵素成品。
1.3.2 酵母菌的分离纯化
自然发酵青金桔样品连续稀释,取100 μL梯度稀释液涂布于YPD固体培养基中,28 ℃培养3 d。采用平板划线法分离,直到获得纯种,接种于斜面培养基和液体培养基,28℃培养1~2 d,纯种分别进行4 ℃斜面保藏和-80 ℃甘油管冻藏备用。
1.3.3 酵母菌的鉴定
形态学观察:采用平板培养24 h,观察菌落形态;取样,涂片,用美兰染色后显微镜下观察细胞形态。
分子生物学鉴定:采用ITS鉴定,送至青岛鹏翔生物科技有限公司进行聚合酶链式反应(polymerase chain reaction,PCR)扩增测序。
1.3.4 分离酵母菌在青金桔全果浆中生长性能测定
分离酵母菌分别接种于YPD液体培养基中,30 ℃培养48 h。4 ℃、1 800×g条件下离心,沉淀用0.85%生理盐水洗涤2次后,得到菌种用0.85%生理盐水稀释成107 CFU/mL的菌悬液。
分别取以上菌悬液以1%(V/V)的接种量接种到50 mL经115 ℃、15 min高压蒸汽灭菌的青金桔全果浆中,于30 ℃条件下培养10 d。取发酵后样品与无菌生理盐水混合制成10倍稀释液。采用平板计算法,计算发酵10 d后样品中相应活菌数,测定酵母菌在青金桔全果浆条件下的生长性能。
分离酵母菌生长曲线的测定:参照章之柱等[16]的方法并进行调整,取种子液以1%(V/V)接种量,在无菌条件下接种于YPD液体培养基中,培养温度30 ℃,每隔2 h取发酵液,采用分光光度计测定其OD600nm值。以培养时间为横坐标,OD600nm值为纵坐标,绘制酵母菌的生长曲线。
1.3.5 分离酵母菌耐受性能分析
参照赵广河等[17]的方法并进行调整,取种子液按照2%(V/V)的接种量分别接种到不同pH值(2.0、3.0、4.0、5.0、6.0)、温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、葡萄糖含量(100 g/L、200 g/L、300 g/L、400 g/L、500 g/L)的YPD液体培养基中,28 ℃恒温培养3 d,采用分光光度计测定其OD600 nm值,测定3个平行,取平均值,根据OD600 nm值来确定不同条件下酵母菌的生长情况。
1.3.6 分离酵母菌发酵特性评价
选取上述分离纯化的酵母菌,接种于YPD液体培养基中,培养48 h。4 ℃、1 800×g条件下离心,沉淀用0.85%生理盐水洗涤2次后,得到菌种。菌种用0.85%生理盐水稀释成107 CFU/mL的悬浮液。分别取以上菌悬液以1%(V/V)的接种量接种到50 mL经115 ℃、15 min高压蒸汽灭菌的青金桔全果浆中,于30 ℃条件下培养10 d。取发酵后的样品存放于-80 ℃冰箱中12 h,在真空度30 Pa、冷阱温度-60 ℃条件下,冷冻干燥48 h。准确称取冷冻干燥后的样品0.2 g于15 mL离心管中,加入10 mL体积分数为70%甲醇复溶,将样品置于超声清洗器中,360 W、50 ℃超声30 min,用0.22 μm孔径滤膜过滤得到样品提取液。对比发酵前后总酚、总黄酮含量、α-葡萄糖苷酶抑制率、抗氧化活性的变化,考察分离菌株的发酵特性。
1.3.7 分析检测
总酚含量(以没食子酸计)测定:采用张红建等[8]的方法,利用福林酚显色法测定,结果以mg没食子酸当量(gallic acid equivalent,GAE)/100 g冻干样品表示。
总黄酮含量(以芦丁计)测定:采用张红建等[8]的方法,利用亚硝酸钠-硝酸铝显色法测定,结果以mg芦丁当量(rutin equivalent,RE)/100 g冻干样表示。
α-葡萄糖苷酶抑制率的测定:采用张红建等[8]的方法。10 μL 样品提取液与50 μL α-葡萄糖苷酶(1.0 U/mL溶于0.1 mol/L pH 6.8的磷酸盐缓冲液中)添加到96孔板中,振动均匀,于37 ℃条件下孵化15 min。然后将50 μL的对硝基苯-α-D-葡萄糖吡喃苷(p-nitrophenyl α-D-glucopyranoside,pNPG)(5 mmol/L 溶于0.1 mol/L的磷酸盐缓冲液(pH6.8)中)添加到96 孔板中,振动均匀,继续于37 ℃条件下孵化15 min。添加150 μL 0.5 mmol/L的碳酸钠溶液终止反应,于波长415 nm处测吸光度值。α-葡萄糖苷酶活力以从pNPG中释放的p-硝基酚表示。α-葡萄糖苷酶抑制率(inhibition ratio,IR)计算公式如下:
式中:IR为α-葡萄糖苷酶抑制率,%;A控制为酶与底物反应的吸光度值;A控制空白为不加酶时底物的吸光度值;A样品为样品、酶与底物反应的吸光度值;A样品空白为样品与底物反应的吸光度值。
DPPH自由基清除能力测定:参考王露[18]的方法并进行调整。质量浓度分别为(4 mg/mL、8 mg/mL、12 mg/mL、16mg/mL、20mg/mL)的60μL样品提取物(对以上0.2g/10mL样品提取液稀释得到),分散于96孔板中,并分别与40 μL 1mmol/L的DPPH溶液(DPPH溶于甲醇中)混合,再加入150 μL的甲醇溶液。室温条件下暗处反应30 min,于波长517 nm处测定吸光度值。以维生素C(10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL)为阳性对照。半抑制浓度(half maximal inhibitory concentration,IC50)值定义为清除50%DPPH自由基所需的样品提取液的最小浓度。DPPH自由基清除能力计算公式如下:
式中:Ac为未加样品时DPPH溶液的吸光度值;As为DPPH溶液和样品反应后的吸光度值。
ABTS+自由基清除能力测定:参考王露[18]的方法并进行调整。将7 mmol/L ABTS 溶液(水配制)与2.4 mmol/L 过硫酸钾溶液等体积混合,温室条件下、暗处反应12~16 h,制备新鲜的ABTS+自由基溶液。使用前,将新鲜制备的ABTS+溶液用甲醇稀释至波长734 nm处吸光度值为0.7±0.02。150 μL ABTS+稀释液与30 μL样品提取液混合(质量浓度分别为2 mg/mL、4 mg/mL、6 mg/mL、8 mg/mL、10 mg/mL),室温、暗处反应10 min,波长734 nm处测定吸光度值。以维生素C为阳性对照,IC50值定义为清除50%ABTS+自由基所需的样品提取液的最小浓度。ABTS+自由基清除能力计算公式如下:
式中:Ac为未加样品时ABTS+溶液的吸光度值,As为ABTS+溶液和样品反应后的吸光度值。
铜离子还原能力测定:参考CELIK S E等[19]的方法并进行调整,在96孔酶标板中,依次加入25 μL样品、50 μL 10 mmol/L CuCl2、50 μL 7.5 mmol/L的新亚铜试剂溶液、50 μL 1 mol/L醋酸铵缓冲液(pH7),最后加入30 μL水,温室条件下反应30 min,以体积分数为70%甲醇作空白,于波长450 nm处测定吸光度值。分别精密吸取质量浓度为0.5 g/L没食子酸对照品溶液0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL置于10 mL容量瓶中,加甲醇定容至刻度,配制成系列质量浓度的没食子酸对照品溶液。以吸光度值(y)为纵坐标,没食子酸质量浓度(x)为横坐标,绘制没食子酸标准曲线,得线性回归方程y=0.003 3x+0.002 2,相关系数R2=0.996 4。结果以μgGAE/g样品表示。
1.3.8 数据处理
采用MEGA 7.0软件建立相关种的ITS rDNA序列系统发育树,IBM SPSS Statistics 26.0进行数据处理、方差分析及差异显著性分析,采用Origin 2018绘图。
2 结果与分析
2.1 酵母菌的形态和分子生物学鉴定
经过分离纯化、初筛,从自然发酵青金桔中共分离出3株酵母菌,分别编号为Y1、Y14、Y15,其菌落形态和细胞形态如图1所示,菌株Y1、Y14、Y15在YPD液体培养基中产生沉淀;菌落为乳白色、圆形、微凸,菌落质地黏稠、易挑取;通过显微镜观察,细胞形态均为椭圆形。
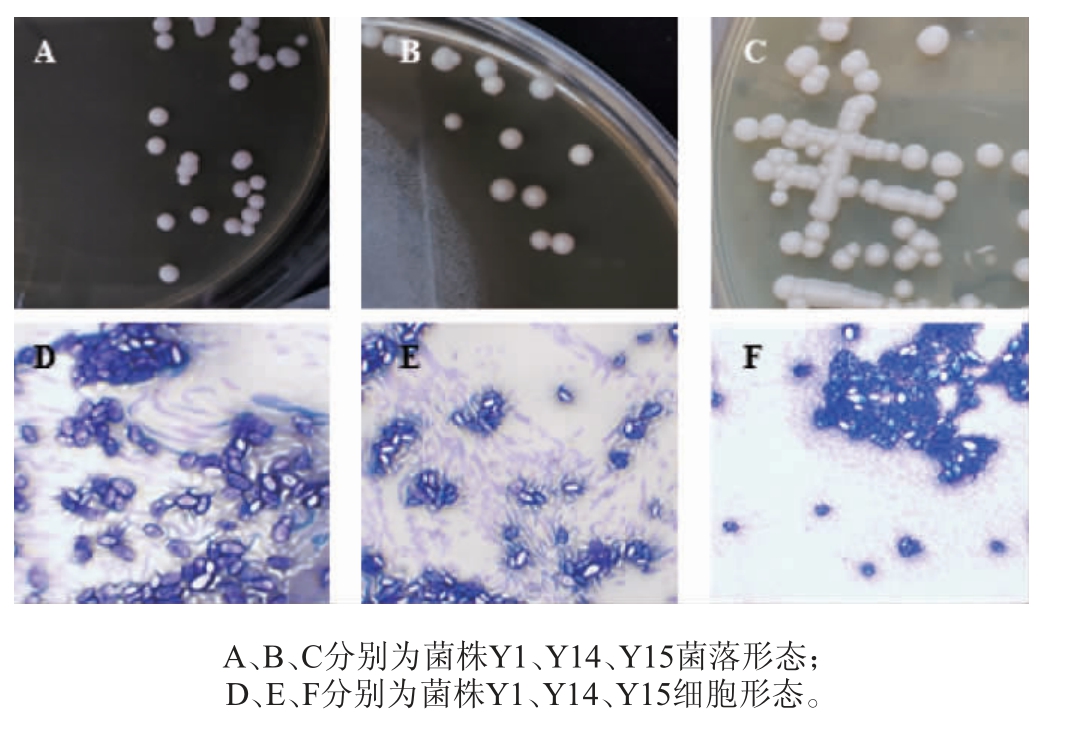
图1 分离菌株Y1、Y14及Y15的菌落形态和细胞形态
Fig.1 Colony and cell morphology of isolated strains Y1, Y14 and Y15
将菌株Y1、Y14和Y15 的ITS rDNA序列片段测序结果递交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,基于ITS rDNA序列采用MEGA 7.0软件建立相关种的系统发育树,如图2所示,菌株Y1与Pichia terricola KY495764.1聚于一支,同源性达72%,菌株Y14与Hanseniaspora opuntiae OR091284.1聚于一支,同源性达99%,菌株Y15与Hanseniaspora opuntiae OR091284.1聚于一支,同源性达99.86%。因此,菌株Y1被鉴定为特立科拉毕赤酵母(Pichia terricola),菌株Y14、Y15均被鉴定为仙人掌有孢汉逊酵母(Hanseniaspora opuntiae),3株菌均为非酿酒酵母(non-Saccharomyces)。
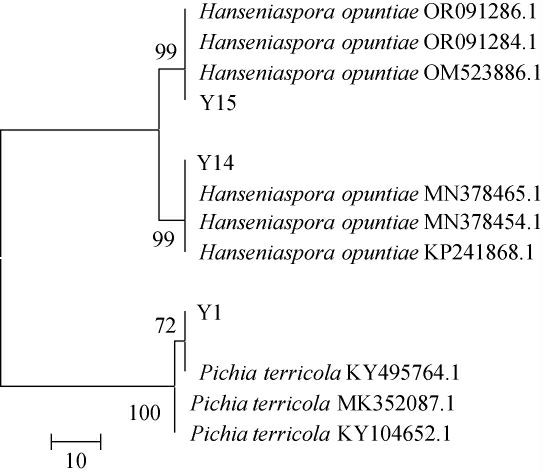
图2 基于ITS基因序列构建的分离菌株系统发育树
Fig.2 Phylogenetic tree of isolated strains based on ITS gene sequences
2.2 分离酵母菌在青金桔全果浆中生长性能测定
将分离菌株Y1、Y14和Y15以1%(V/V)的接种量分别接种到50 mL的灭菌青金桔全果浆中,于30 ℃条件下培养10 d,采用平板计算法(培养基为YPD固体培养基),计算样品中相应活菌数,结果表明,筛选得到的酵母菌Y1、Y14、Y15在灭菌青金桔全果浆中培养5 d后活菌数分别为1.1×109 CFU/mL、5.7×108 CFU/mL、3.4×108 CFU/mL,均能达到108 CFU/mL以上,生长良好。
2.3 分离酵母菌的生长曲线
酵母菌的生长一般都经历了延滞期、对数生长期、稳定期和衰亡期。3株分离酵母菌的生长曲线见图3。由图3可知,在酵母菌的生长过程中,前4 h酵母菌Y14和Y15基本都处于延滞期,菌株Y1延滞期为前6 h。延滞期后开始进入对数生长期,菌株Y14和Y15在4~24 h之间为对数生长期,从24 h之后趋于稳定,逐渐进入衰亡期。菌株Y1生长较慢,从8 h后才开始进入对数生长期,8~32 h左右为对数生长期,32 h之后对数生长期基本结束,进入稳定期。
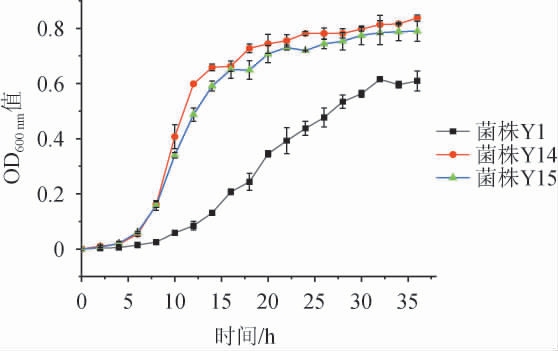
图3 分离酵母菌的生长曲线
Fig.3 Growth curves of isolated yeasts
2.4 分离酵母菌的耐受性实验
温度是影响酵母菌生长的重要因素,可以影响酵母的数量、种类及存活时间等,不同酵母菌的最适生长温度存在差异[20]。耐热性是微生物在食品工业中使用时面临的一个基本挑战[21]。分离酵母菌的耐受性实验结果见图4。
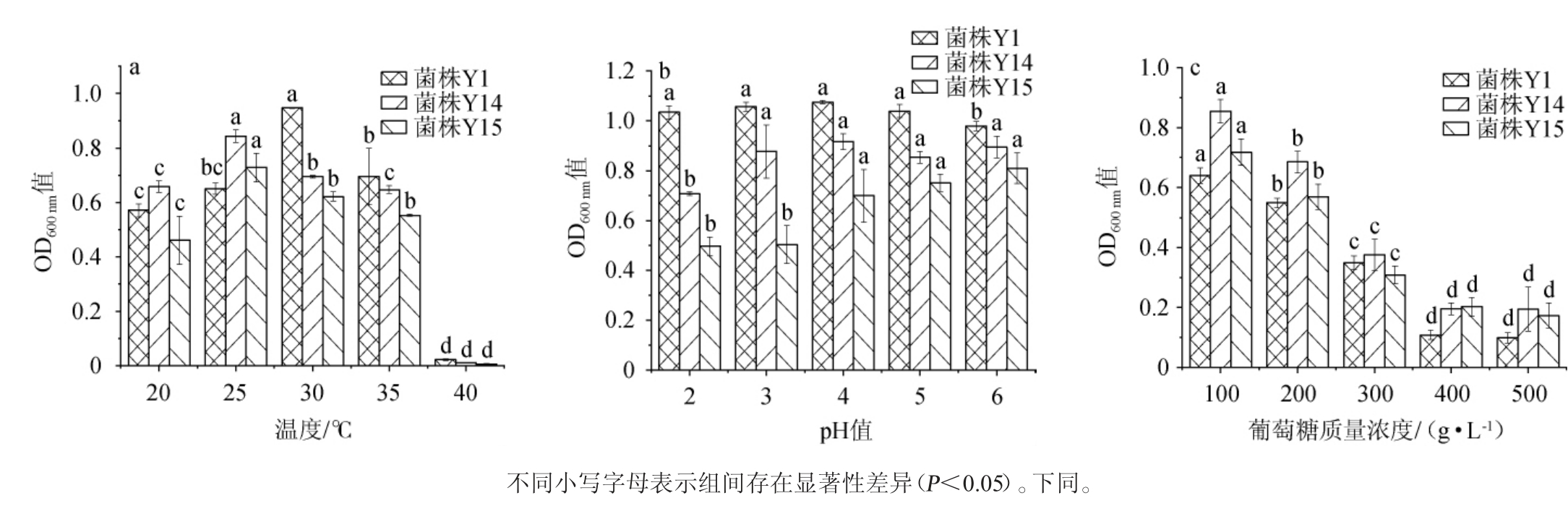
图4 分离酵母菌对温度(a),pH值(b)及葡萄糖质量浓度(c)耐受性实验结果
Fig.4 Tolerance experiments results of isolated yeasts to temperature (a), pH (b) and glucose mass concentration (c)
由图4a可知,3株分离酵母菌的生长情况随温度升高先增加后降低。温度在20~30 ℃时,菌株Y1的OD600nm值随着温度升高而增加,当温度为30 ℃时达到最大值,表明菌株Y1的最适温度为30 ℃;温度在20~25 ℃时,菌株Y14、Y15的OD600 nm值随着温度升高而增加,当温度为25 ℃时达到最大值,表明菌株Y14、Y15的最适温度为25 ℃;当温度达到40 ℃时,3株酵母菌受到抑制几乎不生长。冯文倩等[22]研究发现,汉逊酵母属是耐高温酵母属之一,能在40 ℃高温条件下正常生长,与本实验结果不一致。可能的原因是在40 ℃时,酵母菌的三磷酸腺苷酶(adenosine triphosphatase,ATP)等酶活受到抑制,影响了酵母正常生长。
pH也是影响酵母菌生长的重要因素之一,会影响酵母菌对营养物质的吸收、细胞膜通透性、酶的活性以及代谢途径[23]。由图4b可知,菌株Y1在pH 4条件下OD600nm值最大,与其他pH情况下的OD600nm值差异并不显著(P>0.05);菌株Y14在pH 4情况下OD600 nm值最大,在pH 2情况下OD600 nm值稍有降低;菌株Y15在pH2情况下OD600nm值最小,随着pH值升高OD600 nm值逐渐增大。3株酵母具有较好的低pH值耐受性,其中Y1和Y14的耐酸性相比Y15更强,与潘庆珉等[24]对毕赤酵母的研究结果一致。徐伟等[25]研究发现,耐低pH酵母菌中过氧化氢酶(catalase,CAT)和超氧化物歧化酶(superoxide dismutase,SOD)活力有所增加,促进了酵母菌的抗氧化能力,进而抵制了酸胁迫。青金桔全果浆的pH值通常在2~3,需要酵母菌具有较强的耐酸性能,因此3株酵母的低pH值耐受性应用于青金桔发酵方面有很大的前景。
由图4c可知,酵母菌的生长随着葡萄糖浓度的增加而逐渐减慢,当葡萄糖质量浓度达到400 g/L,3株菌的OD600nm值显著降低(P<0.05),说明3株菌的生长受到一定的抑制,但依然能够正常生长。此结果与杜沁岭等[26]研究结果不一致,可能原因是非酿酒酵母对葡萄糖的利用能力较差,且葡萄糖浓度过高形成高的渗透压,造成酵母菌的细胞破裂,活性降低[27]。
2.5 分离酵母菌发酵特性评价
酵母菌发酵特性评价情况结果见表1。由表1可知,由酵母菌发酵的青金桔全果浆的总多酚、总黄酮、DPPH、ABTS自由基清除率、铜离子还原能力和α-葡萄糖苷酶抑制率相比较0 d对照均显著提高(P<0.05)。其中菌株Y1发酵青金桔全果浆总酚、总黄酮、DPPH自由基清除率、ABTS自由基清除率、铜离子还原能力、α-葡萄糖苷酶抑制率分别提高20.65%、87.15%、20.45%、43.94%、34.08%、20.34%;Y14发酵青金桔全果浆总酚、总黄酮、DPPH自由基清除率、ABTS自由基清除率、铜离子还原能力、α-葡萄糖苷酶抑制率分别提高19.22%、51.90%、18.31%、39.39%、25.94%、24.82%;Y15发酵青金桔全果浆总酚、总黄酮、DPPH自由基清除率、ABTS自由基清除率、铜离子还原能力、α-葡萄糖苷酶抑制率分别提高19.97%、70.01%、22.92%、34.85%、30.85%、13.53%。
表1 酵母菌发酵青金桔全果浆10 d后总酚、总黄酮含量、抗氧化能力和抑制α-葡萄糖苷酶活性的变化
Table 1 Changes of total phenolic and total flavonoid contents, antioxidant capacity, and α-amylase inhibitory activities of Citrus microcarpa whole fruit pulp fermented by yeasts for 10 d
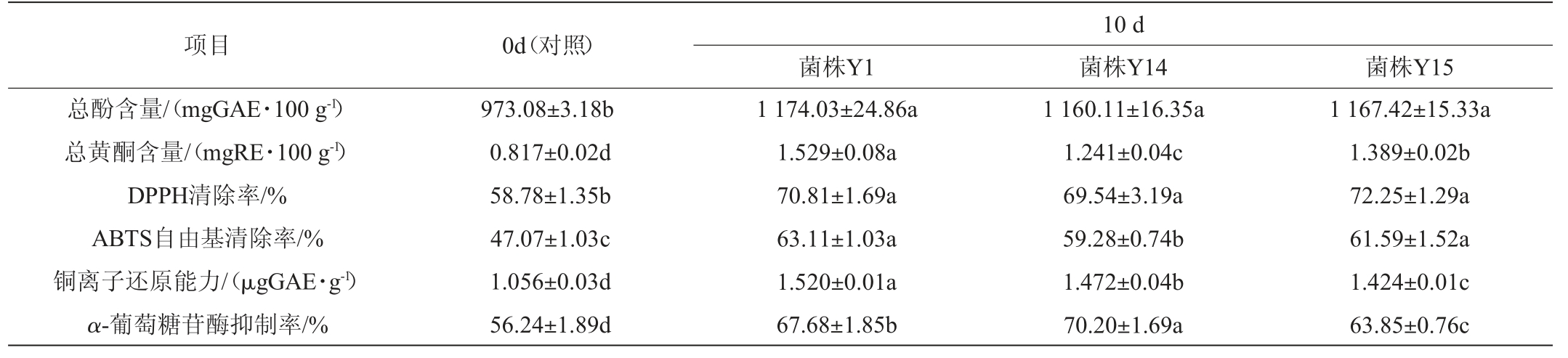
项目 0d(对照)总酚含量/(mgGAE·100 g-1)总黄酮含量/(mgRE·100 g-1)DPPH清除率/%ABTS自由基清除率/%铜离子还原能力/(μgGAE·g-1)α-葡萄糖苷酶抑制率/%973.08±3.18b 0.817±0.02d 58.78±1.35b 47.07±1.03c 1.056±0.03d 56.24±1.89d菌株Y1 1 174.03±24.86a 1.529±0.08a 70.81±1.69a 63.11±1.03a 1.520±0.01a 67.68±1.85b 10 d菌株Y14 菌株Y15 1 160.11±16.35a 1.241±0.04c 69.54±3.19a 59.28±0.74b 1.472±0.04b 70.20±1.69a 1 167.42±15.33a 1.389±0.02b 72.25±1.29a 61.59±1.52a 1.424±0.01c 63.85±0.76c
发酵食品的总酚含量的增加可能是由于一些酵母菌株,能够以某种方式从头从氨基酸合成多酚化合物,其抗氧化能力与总酚及黄酮类化合物存在正相关性[28-29]。LIU B等[30]利用土壤伊萨酵母(Issatchenkia terricola)发酵柠檬汁,发酵结束时柠檬汁柠檬酸含量降低了84.28%,总酚、总黄酮含量以及抗氧化性能相比对照组均呈上升趋势,与本实验结果一致。结果表明,纯种发酵青金桔全果浆产品有一定的体外抗氧化能力,具有开发应用价值,能够应用于健康食品的研发。
3 结论
本研究从青金桔自然发酵液中通过传统分离、纯化分离得到3株酵母菌株Y1、Y14和Y15,经过生长性能测定发现在灭菌青金桔全果浆中均能良好生长。通过菌落形态和细胞形态观察结合ITS测序鉴定,菌株Y1为特立科拉毕赤酵母(Pichiaterricola),菌株Y14、Y15为仙人掌有孢汉逊酵母(Hanseniaspora opuntiae)。3株酵母菌能耐受35 ℃、400 g/L葡萄糖和pH 2.0的环境条件。利用3株酵母纯种发酵青金桔全果浆均能显著提升其总酚含量、总黄酮含量和抗氧化能力,可以抑制α-葡萄糖苷酶活性。本研究筛选获得的3株酵母菌在青金桔全果浆中具备较好的发酵性能、生长特性与耐受能力,在后续优质青金桔产品开发的利用上具有巨大潜力。
但目前,以上3株酵母的潜在功能特征,如:毒力因子、对人类和动物临床相关的抗微生物药物的耐药性、已知有毒代谢物的产生、代谢通路、碳水化合物活性酶功能等亦不明确。在后续的研究工作中,需要对酵母菌纯种发酵的条件进行优化,对主要代谢产物和挥发性物质等进行检测,对菌株的全基因组测序及益生特性等进行评价,全面、准确掌握3株酵母菌的潜在功能特性,将其开发成工程菌,实现在青金桔发酵产品生产中的推广应用和生产过程精准化控制。
[1]张红建,梁爱文,王青松,等.青金桔籽油螺旋压榨工艺及其理化特性研究[J].中国粮油学报,2021,36(12):56-63,71.
[2]辛永辉,谢尚潜,吴元鑫,等.海南青金桔资源果实性状多样性及ISSR标记遗传多样性分析[J].分子植物育种,2022,20(2):455-463.
[3]方舒婷,曾荣,李海贤,等.青金桔格瓦斯的加工工艺研究[J].农产品加工,2018(8):41-43.
[4]XIN Y H,WU Y X,QIAO B,et al.Evaluation on the phenotypic diversity of Calamansi(Citrus microcarpa)germplasm in Hainan island[J].Sci Rep,2022,12(1):371.
[5]李荣丽,吴喆超,肖安红,等.采用复合材料喷雾干燥制备青金桔籽油微胶囊及其性质表征[J].中国油脂,2023,48(3):224-230.
[6]TORRES S,VERÓN H,CONTRERAS L,et al.An overview of plant-autochthonous microorganisms and fermented vegetable foods[J].Food Science and Human Wellness,2020,9(2):112-123.
[7]RIZO J, GUILLEN D, FARRES A, et al.Omics in traditional vegetable fermented foods and beverages[J].Crit Rev Food Sci Nutr,2020,60(5):791-809.
[8]张红建,刘帅光,马泽威,等.自然发酵对青金桔酚类物质及其抑制消化相关酶活性的影响[J].食品工业科技,2024,45(9):1-10.
[9]ZHANG Y,LIU W P,WEI Z,et al.Enhancement of functional characteristics of blueberry juice fermented by Lactobacillus plantarum[J].LWTFood Sci Technol,2021,139(1):110590.
[10]ZHONG W, CHEN T, YANG H, et al.Isolation and selection of non-Saccharomyces yeasts being capable of degrading citric acid and evaluation its effect on kiwifruit wine fermentation[J].Fermentation,2020,6(1):25.
[11]LEONÉS A,DURÁN-GUERRERO E, CARBU′ M, et al.Development of vinegar obtained from lemon juice:Optimization and chemical characterization of the process[J].LWT-Food Sci Technol,2019,100:314-321.
[12]XIONG K X,HAN F,WANG Z H,et al.Screening of dominant strains in red sour soup from Miao nationality and the optimization of inoculating fermentation conditions[J].Food Sci Nutr,2021,9(1):261-271.
[13]RÊGO E S B,ROSA C A,FREIRE A L,et al.Cashew wine and volatile compounds produced during fermentation by non-Saccharomyces and Saccharomyces yeast[J].LWT-Food Sci Technol,2020,126:109291.
[14]王姗姗.柠檬啤酒专用酵母菌的筛选及其应用研究[D].济南:齐鲁工业大学,2019.
[15]JAMES A,YAO T,KE H,et al.Microbiota for production of wine with enhanced functional components[J].Food Science and Human Wellness,2023,12(5):1481-1492.
[16]章之柱,尹金彦,孟洋,等.桑葚果园中酿酒酵母的分离鉴定及特性研究[J].食品与发酵工业,2020,46(14):148-155.
[17]赵广河,胡梦琪,陆玺文,等.桃金娘果酒酵母菌的筛选鉴定及生长特性分析[J].中国酿造,2023,42(9):103-108.
[18]王露.番石榴叶活性多酚组分快速鉴别及发酵释放与转化机制[D].广州:华南理工大学,2018.
[19]CELIK S E,OZYUREK M,GUCLU K,et al.Identification and anti-oxidant capacity determination of phenolics and their glycosides in elderflower by on-line HPLC-CUPRAC method[J].Phytochem Anal,2014,25(2):147-154.
[20]刘玉凌,任亭,赵志平,等.传统榨菜中酵母菌的分离鉴定及特性研究[J].食品科技,2022(10):57-61.
[21]ALKALBANI N S, OSAILI T M, AL-NABULSI A A, et al. In vitro characterization and identification of potential probiotic yeasts isolated from fermented dairy and non-dairy food products[J].J Fungi,2022,8(5):544.
[22]冯文倩,王倩,刘延琳,等.低产乙醇本土有孢汉逊酵母的筛选及酿造特性[J].食品与发酵工业,2021,47(21):9-17.
[23]杨新.开阳地区桑葚果园富硒酵母菌的筛选及其特性研究[D].贵阳:贵州大学,2020.
[24]潘庆珉,杨洁,岳海涛,等.阿勒泰地区酸驼乳中酵母菌的分离鉴定及耐受性分析[J].中国乳品工业,2023,51(6):27-31,39.
[25]徐伟,柴丽娜,傅徐阳,等.耐低pH酵母菌的分离及其对酸胁迫环境的适应性[J].食品工业科技,2019,40(16):112-117.
[26]杜沁岭,屠婷瑶,徐文,等.青梅野生酵母菌的筛选鉴定与耐受性研究[J].食品与发酵工业,2023,49(4):196-201.
[27]王智莹.葡萄有孢汉逊酵母的筛选及葡萄酒特性研究[D].晋中:山西农业大学,2022.
[28]TARKO T,KOSTRZ M,DUDA-CHODAK A,et al.The effect of apple cultivars and yeast strains on selected quality parameters and antioxidant activity of fermented apple beverages[J].CyTA-J Food,2018,16(1):892-900.
[29]晏殊.水果酵素自然发酵中优势菌株的分离鉴定及其代谢产物功效特性的研究[D].长沙:中南林业科技大学,2019.
[30]LIU B, YUAN D X, LI Q Y, et al.Changes in organic acids, phenolic compounds, and antioxidant activities of lemon juice fermented by Issatchenkia terricola[J].Molecules,2021,26(21):6712.