生香酵母是一类通过发酵可以产生醇、醛、有机酸和呋喃化合物等具有香气代谢物的菌株,其香气以酯类、醇类为主,主要是乙酸乙酯,与苹果香类似[1-2],被广泛应用于酒[3-4]、酱油[5-6]、香料[7-8]和一些发酵面制品生产中,具有改善成品香味、提高产品质量稳定性等特点。目前,国内主要的生香酵母有异常汉逊酵母(Hansenula anomala)、假丝酵母(Candida)、毕赤酵母(Pichia)、异常威克汉姆酵母(Wickerhamomyces anomalus)等[9-10]。不同地区的酵母具有不同的特性,WANG Y Y等[11]将烟台本土酵母H30和YT13顺序接种发酵葡萄汁,结果发现,菌株H30和YT13顺序发酵的葡萄酒乳酸及阿魏酸含量均比对照组、单酵母发酵组高,此外,混合发酵组中还含有丁内酯和丙酸花青素,增加了葡萄酒香气的复杂性,为生产白色葡萄酒提供了优质酵母资源,增加了地域特色。刘阳等[12]从四川地区的柑橘皮中分离鉴定出4株产生浓郁香气的生香酵母,主体香味成分为2-壬醇、苯乙醇,且苯乙醇相对含量均>30%,为柑橘果醋工业化生产奠定了基础;鲁云风等[13]从猕猴桃果实、枝干、树叶和树下土壤中分离出一株适合猕猴桃发酵的生香酵母X-5,发酵后的猕猴桃果酒酒香浓郁、汁液清澈,感官品质高,可用作猕猴桃酒发酵专用菌株;唐红梅等[14]从川南腌菜中筛选出四株既耐盐又具有强生香能力的4株菌株,为腌菜发酵菌剂的制备提供了理论支持。我国酵母种类丰富,功能各异,筛选出能令人感到愉悦芳香的酵母并应用于酒曲的制作,可以丰富我国酿酒行业的酵母选择,从而生产出香味更加浓烈和更受人欢迎的酒。然而,现有关于生香酵母的研究多趋于果醋、果酒等低酒精度饮料,对于加入到高酒精度的酒中发酵的研究较少。
本研究采用传统培养分离法、嗅闻法及测定总酯产量从酒糟、酒曲、葡萄等样品中分离筛选一株优良生香酵母菌,通过形态学观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并研究其耐受性。进一步以总酯产量为响应值,采用单因素试验及响应面试验对筛选菌株的发酵条件进行优化,为该生香酵母的后期应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒糟、酒曲、酒醅:湖南国渊酒业有限公司;柿子、葡萄、酸菜:市售。
1.1.2 试剂
蛋白胨、酵母浸粉、琼脂(均为生化试剂):广东环凯微生物科技有限公司;乙酸、乙醇、酚酞(均为分析纯):深圳市福林仪器科技有限公司;糖化酶(10万U/mL)、淀粉酶(4万U/mL):上海源叶生物科技有限公司;真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京博迈生物科技有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix(含染料)、RNase-free水:天根生化科技(北京)有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extractpeptone dextrose,YPD)培养基[15]:酵母浸粉1%,蛋白胨2%,葡萄糖2%,琼脂2%。YPD液体培养基:YPD培养基中不添加琼脂。115 ℃高压灭菌20 min。
WL营养琼脂培养基:青岛高科技工业园海博生物技术有限公司。
豆芽汁培养基[16]:新鲜豆芽10 g,加入蒸馏水100 mL,煮制30 min,过滤后加入葡萄糖2 g,补充蒸馏水至100 mL,115 ℃高压灭菌20 min。
1.2 仪器与设备
XMTD-7000恒温水浴锅、SW-CJ-2D超净工作台:苏州净化设备有限公司;LDZM-80-I高压蒸汽灭菌锅、SPX-250BSH-II恒温培养箱:上海新苗医疗器械制造有限公司;HNY-2102C摇床:天津欧诺仪器股份有限公司;SK200生物显微镜:麦克奥迪实业集团有限公司;T100梯度PCR仪:伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 酵母的分离
称取25 g样品于225 mL灭菌的生理盐水中,充分振荡混匀,按10倍梯度稀释法稀释至10-4,吸取上清液0.1 mL均匀涂布于YPD培养基,28 ℃条件下培养72 h,挑取形态不一致的菌落进行纯化培养,培养至第四代,用美兰染色镜检至完全纯化,4 ℃保存备用。
1.3.2 生香酵母的筛选
初筛[17]:将分离到的所有酵母菌划线接种于YPD培养基平板,28 ℃条件下活化培养24 h,连续活化两代后挑取单菌落接种于YPD液体培养基中,28 ℃条件下培养48 h后进行嗅闻,筛选出具有浓郁芳香的菌株。
复筛:将初筛得到的具有浓郁芳香的菌株接种于YPD液体培养基,置于28 ℃恒温培养箱活化培养24 h,用血球计数板计数并调整菌液浓度为107 CFU/mL后,按3%(V/V)的接种量接种于豆芽汁培养基中,置于28 ℃恒温培养箱中发酵5 d。参照CHEN L H等[18]的方法,采用皂化回流法测定总酯产量。
1.3.3 优良生香酵母菌菌株的鉴定
形态学鉴定:将筛选得到的优良生香酵母菌株划线接种于WL营养琼脂培养基上[19],于28 ℃条件下培养48 h,观察菌落的颜色、大小、表面形态、边缘形态等。同时挑取菌体进行美兰染色,并采用显微镜观察细胞形态。
生理生化试验:参照《酵母菌的特征与鉴定手册》[20]进行,主要包括发酵糖试验、碳源同化试验、氮源同化试验、类淀粉物质生成试验、分解尿素试验、石蕊牛乳试验等。
分子生物学鉴定:采用真菌基因组提取试剂盒提取DNA,以其为模板,采用26S rDNA通用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')PCR扩增26S rDNA D1/D2区基因序列。PCR扩增程序:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min,4 ℃保存。采用1%琼脂糖凝胶电泳检测PCR扩增产物。将检测合格的PCR扩增产物纯化后委托上海生工生物科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选取同源性较高的模式菌株的26S r DNA D1/D2区基因序列,采用MEGA6.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.4 优良生香酵母环境耐受性研究
参照文献[21]的方法,考察优良生香酵母对温度(24 ℃、28 ℃、32 ℃、36 ℃、40 ℃)、pH(pH=2、4、6、8、10)、乙醇体积分数(2%、4%、6%、8%、10%)及乙酸体积分数(0.2%、0.4%、0.6%、0.8%、1.0%)的耐受性。
1.3.5 优良生香酵母产酯发酵条件优化单因素试验[22]
在方法1.3.2的基础上只改变单一变量,分别考察发酵温度(24 ℃、28 ℃、32 ℃、36 ℃、40 ℃)、发酵时间(3 d、4 d、5 d、6 d、7 d)及接种量(1%、3%、5%、7%、9%)对优良生香酵母产酯能力的影响。
1.3.6 优良生香酵母产酯发酵条件优化响应面试验
在单因素试验的基础上,以发酵温度(A)、接种量(B)及发酵时间(C)为自变量,以总酯产量(Y)为响应值,采用Design Expert 8.6.0软件设计3因素3水平的Box-Behnken响应面试验,试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation condition optimization
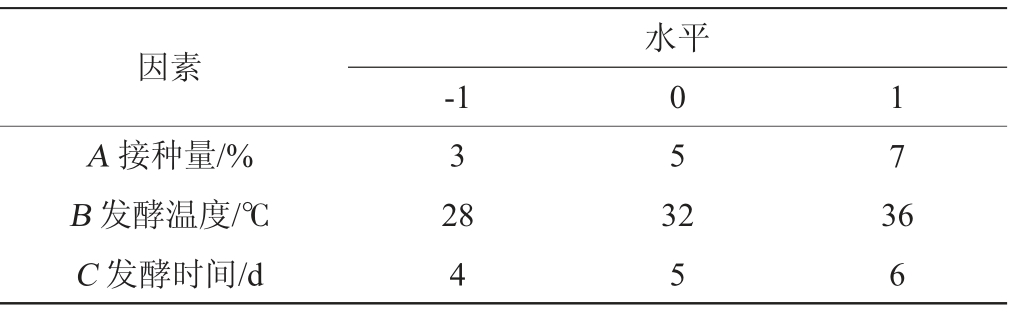
因素A 接种量/%B 发酵温度/℃C 发酵时间/d-1水平0 1 3 5 7 28 4 32 5 36 6
1.3.7 数据处理
每个试验重复3次,采用SPSS 26和Origin 2021处理数据,结果用“平均值±标准差”表示,采用Design Expert8.6.0和Origin 2021绘图。
2 结果与分析
2.1 生香酵母的分离及筛选
2.1.1 分离及初筛
从酒糟、酒曲、葡萄、柿子、酒醅、酸菜6种样品中共分离出64株酵母菌菌株,采用嗅闻法从中筛选出17株具有令人愉悦气味的酵母菌,具体见表2。
表2 17株酵母菌菌株的嗅闻结果
Table 2 Olfactory results of 17 yeast strains
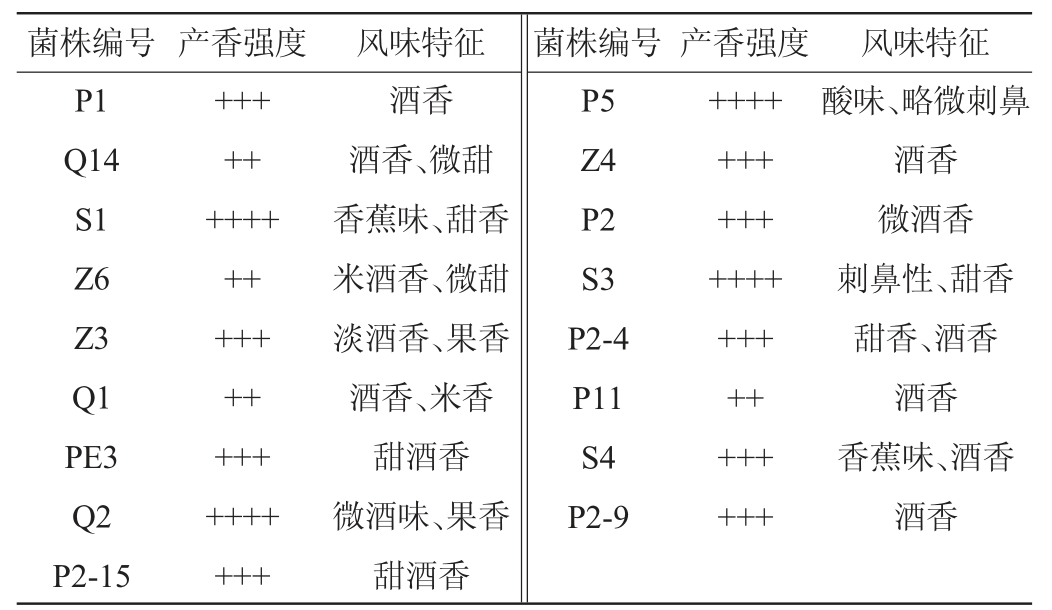
注:“+”代表产香强度,“++”表示弱香,“+++”表示较香,“++++”表示香味浓郁。
菌株编号 产香强度P1 Q14 S1 Z6 Z3 Q1 PE3 Q2 P2-15风味特征 菌株编号产香强度风味特征++++++++++++++++++++++++++酒香酒香、微甜香蕉味、甜香米酒香、微甜淡酒香、果香酒香、米香甜酒香微酒味、果香甜酒香P5 Z4 P2 S3 P2-4 P11 S4 P2-9+++++++++++++++++++++++++酸味、略微刺鼻酒香微酒香刺鼻性、甜香甜香、酒香酒香香蕉味、酒香酒香
由表2可知,菌株S1、Q2、P5、S3产香最为浓郁,其中,菌株S1具有香蕉味和甜香,菌株Q2具有明显的微酒味和果香,而菌株P5和S3却带有刺激性气味。菌株P1、Z3、PE3、Z4、P2、P2-4、S4、P2-15、P2-9这9株菌的香味较强,多为酒香。香味最弱的为菌株Q14、Z6、Q1、P11。
2.1.2 复筛
酯类是酒体主要香味来源之一,可以增加果酒的口感和丰富度[23]。研究发现,在白酒发酵过程中,使用高产酯的酵母可以有效提高白酒的酯含量,从而改善白酒的品质[24-25]。因此,测定17株产香酵母的总酯产量,结果见图1。由图1可知,17株酵母菌株的总酯产量为0.34~1.48 g/L,其中菌株S1的总酯产量最高,为(1.48±0.06)g/L,因此,确定菌株S1为目标菌株。
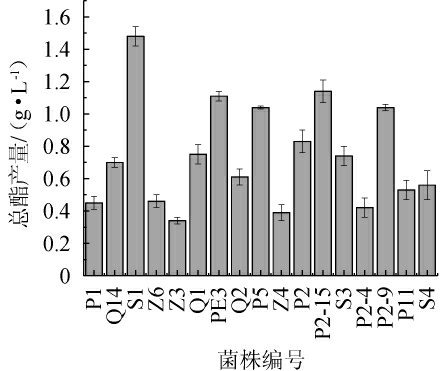
图1 17株初筛菌株的总酯产量测定结果
Fig.1 Determination results of total ester yield of 17 primary screening strains
2.2 菌株S1的鉴定
2.2.1 形态学鉴定
菌株S1的菌落及细胞形态见图2。由图2可知,菌株S1的菌落扁平粗糙,边缘整齐,中间呈火山状突起,细胞呈椭圆形。
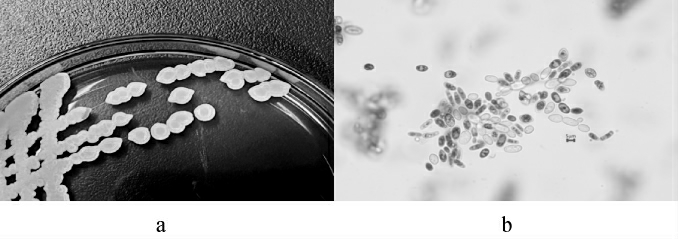
图2 菌株S1的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain S1
2.2.2 生理生化试验
菌株S1的生理生化试验结果见表3。由表3可知,菌株S1可发酵葡萄糖、甘露糖,能同化葡萄糖和赖氨酸,但不能发酵和同化其他碳源和氮源,不能分解尿素和产类淀粉,石蕊牛乳试验结果也为阴性。结合形态学特征,参照《真菌鉴定手册》[26]初步鉴定菌株S1为毕赤酵母属(Pichia sp.)。
表3 菌株S1的生理生化试验结果
Table 3 Results of physiological and biochemical tests of strain S1
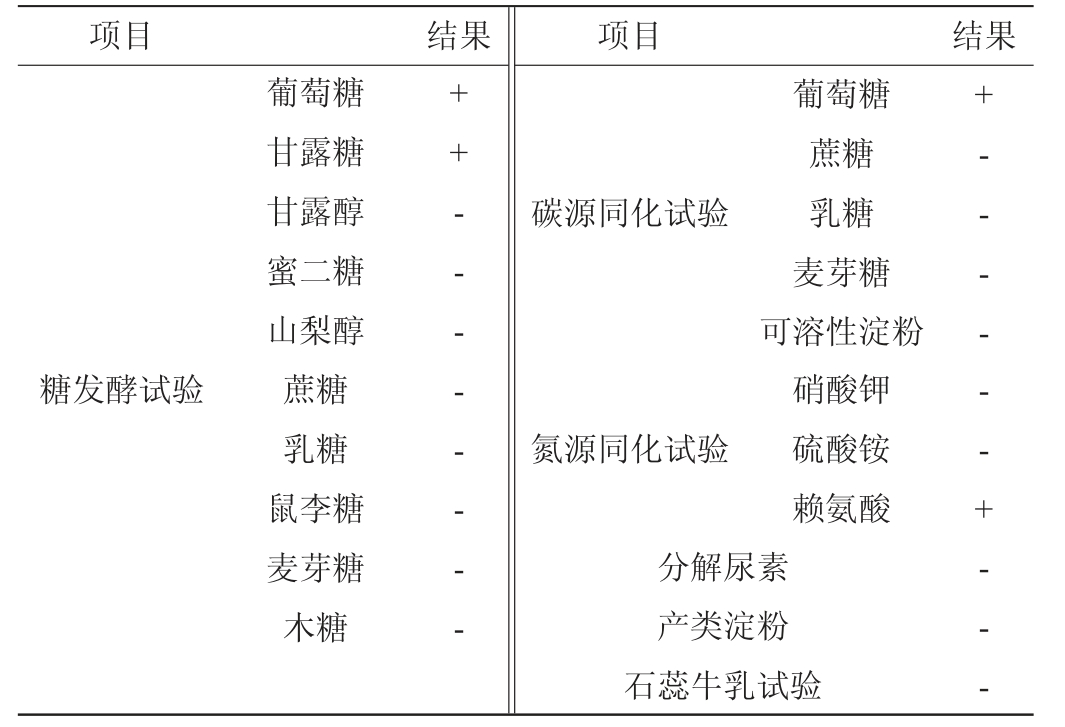
注:“+“表示结果呈阳性,”-“表示结果呈阴性。
项目结果项目结果碳源同化试验糖发酵试验葡萄糖甘露糖甘露醇蜜二糖山梨醇蔗糖乳糖鼠李糖麦芽糖木糖++————氮源同化试验葡萄糖蔗糖乳糖麦芽糖可溶性淀粉硝酸钾硫酸铵赖氨酸分解尿素产类淀粉石蕊牛乳试验+——--+---
2.2.3 分子生物学鉴定
基于26S rDNA D1/D2区基因序列构建菌株S1的系统发育树,结果见图3。由图3可知,菌株S1与克鲁维毕赤酵母(Pichia kluyveri)聚于一支,亲缘关系最近。结合菌株S1的形态学特征及生理生化试验结果,最终鉴定菌株S1为克鲁维毕赤酵母(Pichia kluyveri),这是一种常见的生香酵母,常用于酒类的生香[27-28]和增强口感[29]等。

图3 基于26S rDNA D1/D2区基因序列菌株S1的系统发育树
Fig.3 Phylogenetic tree of strain S1 based on 26S rDNA D1/D2 gene sequences
2.3 克鲁维毕赤酵母S1的环境耐受性分析
克鲁维毕赤酵母S1的环境耐受性结果见图4。由图4a可知,随着pH在2~10范围内的升高,菌株S1的活菌数呈现先上升后下降的趋势,当pH为6时,活菌数最高,为7.4×1012 CFU/mL,当pH为2和10时,菌株S1仍可生长,活菌数分别达到4.3×107 CFU/mL和6.5×1011 CFU/mL,结果表明,菌株S1在中性偏微酸性的环境中生存情况较好,最适生长pH为6.0,可耐受pH 2和10的环境。适宜的温度是微生物生长的重要条件,温度过低时微生物生长受到限制,温度过高则会死亡[30],且高温条件下会使蛋白质变性和质膜流动性的增加,破坏膜的完整性,从而导致细胞的存活力下降,生长速率降低或停止[31]。由图4b可知,在培养温度24~40 ℃范围内,随着培养温度的升高,菌株S1的活菌数呈先升高后下降的趋势。当培养温度为28 ℃时,菌株S1的活菌数最高,为6.9×1011 CFU/mL,当培养温度为40 ℃时,菌株S1仍可生长,活菌数为3.7×108 CFU/mL。结果表明,菌株S1的最适生长温度为28 ℃,可耐受40 ℃的高温环境。
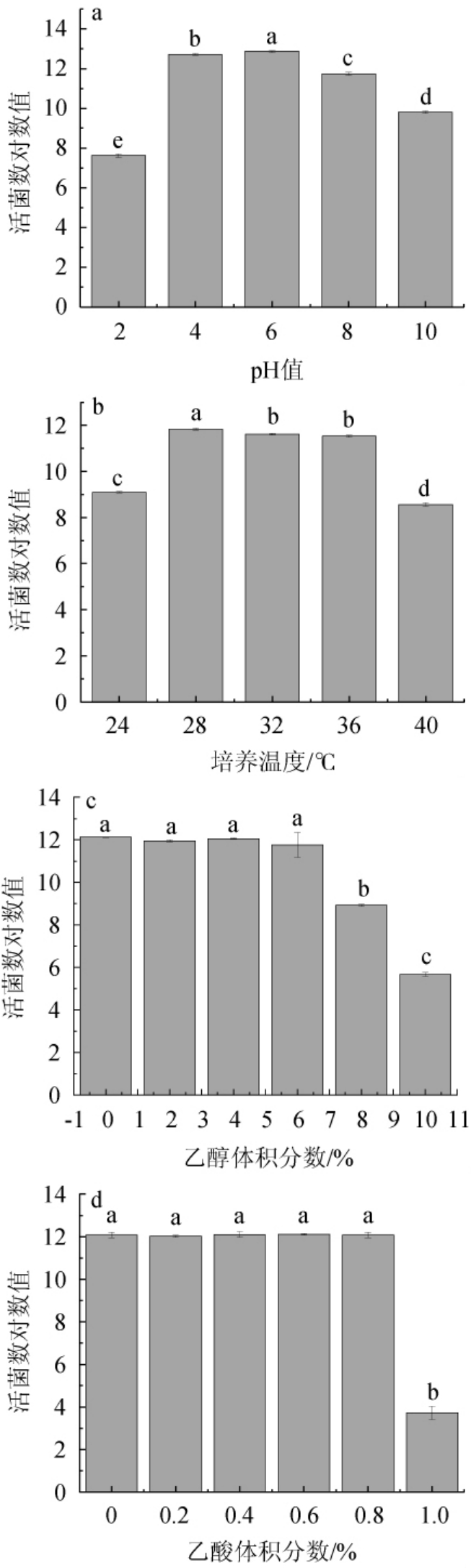
图4 克鲁维毕赤酵母S1对pH(a)、温度(b)、乙醇(c)及乙酸(d)的耐受性分析结果
Fig.4 Analysis results of tolerance of Pichia kluyveri S1 to pH (a),temperature (b), ethanol (c) and acetic acid (d)
不同字母代表组间具有显著差异(P<0.05)。下同。
由图4c和图4d可知,菌株S1在乙醇体积分数<8%和乙酸体积分数<1.0%的条件下生存较好,活菌数没有显著的差异(P>0.05),而在乙醇体积分数为10%和乙酸体积分数为1%时,菌株S1的生存受到抑制,活菌数降低,但仍可生长,活菌数分别为4.7×105 CFU/mL CFU/mL和5.23×103 CFU/mL,说明菌株S1可耐受乙醇体积分数10%和乙酸体积分数1.0%的环境。结果表明,一定体积分数的乙醇和乙酸对酵母的生存有促进作用,但体积分数过高会对酵母产生毒性作用[32],同时,乙醇是固态白酒发酵过程中菌落菌落演替的重要推动力,但随着乙醇体积分数的升高,对酵母会产生毒效应,抑制酵母的生存和繁殖[33]。
2.4 克鲁维毕赤酵母S1产酯发酵条件优化
2.4.1 单因素试验
不同发酵条件对菌株S1产酯的影响见图5。
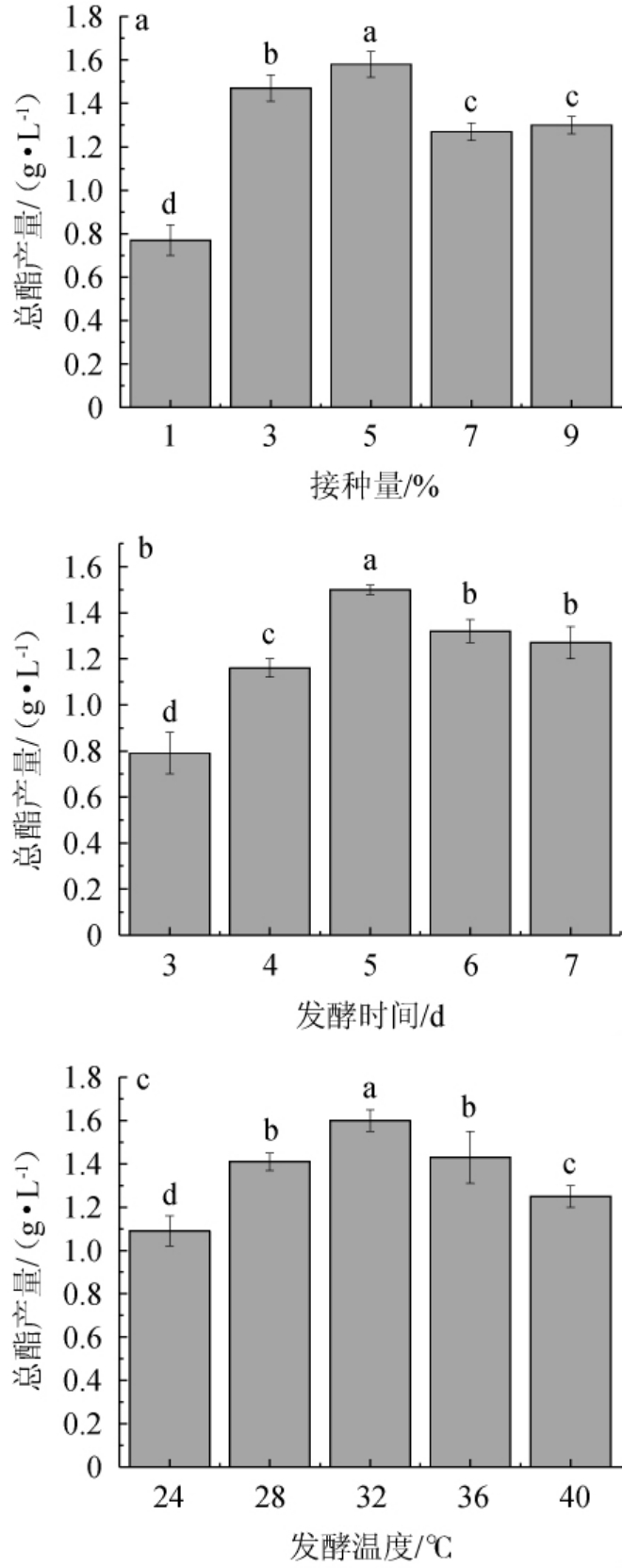
图5 不同发酵条件对克鲁维毕赤酵母S1产酯的影响
Fig.5 Effect of different fermentation conditions on ester production by Pichia kluyveri S1
由图5a可知,随着接种量的增加,总酯产量呈现先升高后下降的趋势,当接种量为5%时,总酯产量最高,为(1.58±0.06)g/L。分析原因可能是,接种量过大会引起溶氧不足,营养物质消耗过快,进而影响菌株生长性能;接种量过小则会延长培养时间,降低发酵物的生产率[34]。因此,确定最佳接种量为5%。由图5b可知,随着发酵时间的延长,总酯产量呈先升高后下降的趋势,当发酵时间为5 d时,总酯产量最高,为(1.50±0.02)g/L,分析原因可能是发酵时间过长可能导致部分酯类被分解[35]。因此,确定最佳发酵时间为5 d。由图5c可知,随着发酵温度的升高,总酯产量呈先升高后下降的趋势,当发酵温度为32 ℃时,总酯产量最高,为(1.60±0.05)g/L。温度会直接影响到酵母中酯化酶的活性,活性越高,酯产量越大,温度低于酶的最适温度则会导致酶的活力低,从而影响酯产量[36];温度过高会导致酯化酶失活和部分低沸点酯类降解[34],且发酵温度过高时,系统内小分子物质运动加快,不利于香味物质的保留[37]。因此,确定最佳发酵温度为32 ℃。
2.4.2 响应面试验
根据单因素试验结果,选择发酵温度(A)、接种量(B)、发酵时间(C)3个因素为自变量,总酯产量(Y)为响应值,采用Design8.6.0软件设计3因素3水平的Box-Behnken响应面优化试验,试验设计及结果见表4,回归模型方差分析见表5。
表4 克鲁维毕赤酵母S1产酯发酵条件优化Box-Behnken响应面试验设计及结果
Table 4 Design and results of Box-Behnken response surface tests for optimization of fermentation conditions for ester production by Pichia kluyveri S1
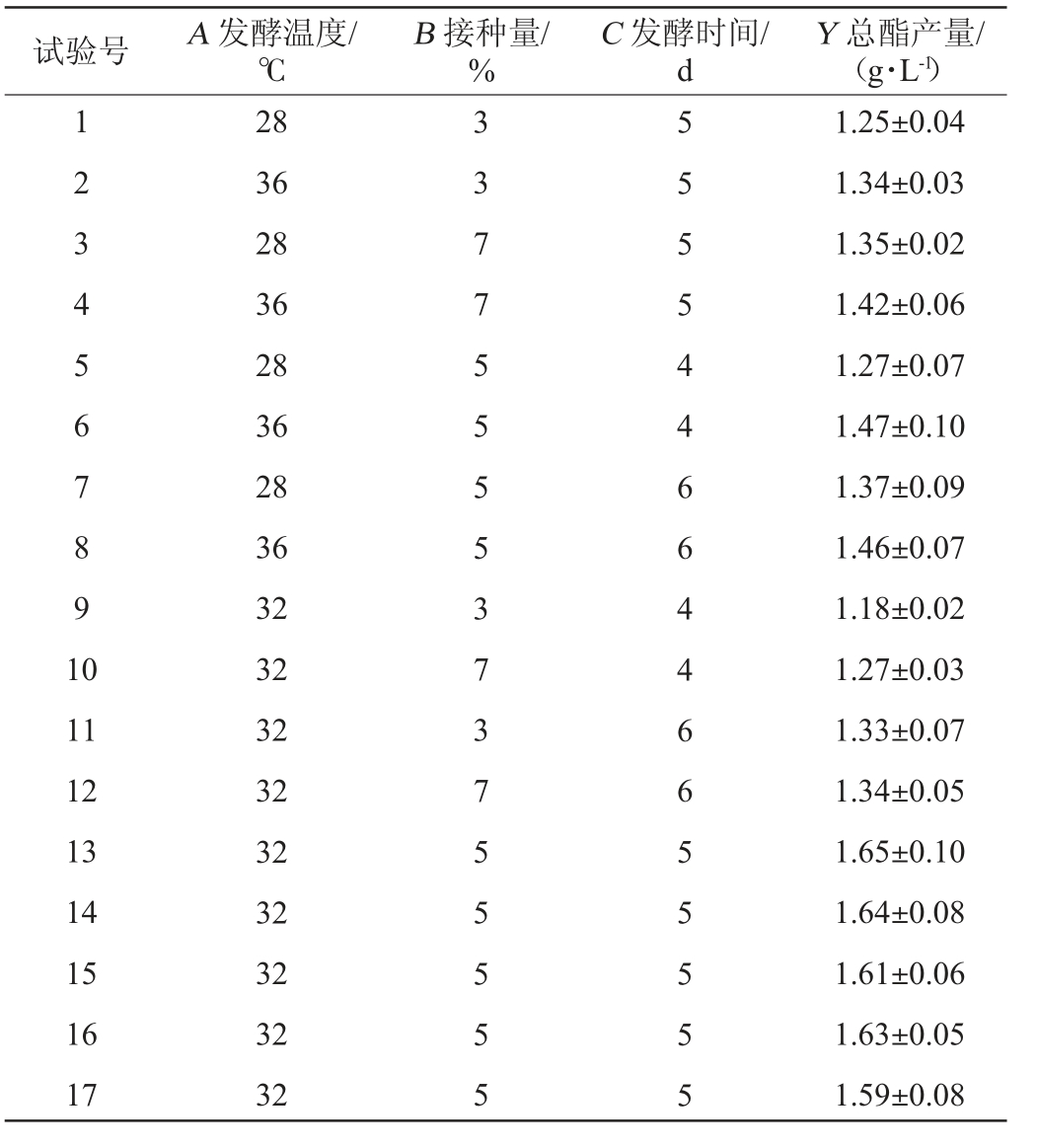
试验号A 发酵温度/℃B 接种量/%C 发酵时间/d Y 总酯产量/(g·L-1)1234567891 0 11 12 13 14 15 16 17 28 36 28 36 28 36 28 36 32 32 32 32 32 32 32 32 32 33775555373755555 55554466446655555 1.25±0.04 1.34±0.03 1.35±0.02 1.42±0.06 1.27±0.07 1.47±0.10 1.37±0.09 1.46±0.07 1.18±0.02 1.27±0.03 1.33±0.07 1.34±0.05 1.65±0.10 1.64±0.08 1.61±0.06 1.63±0.05 1.59±0.08
表5 回归模型方差分析
Table 5 Variance analysis of regression model
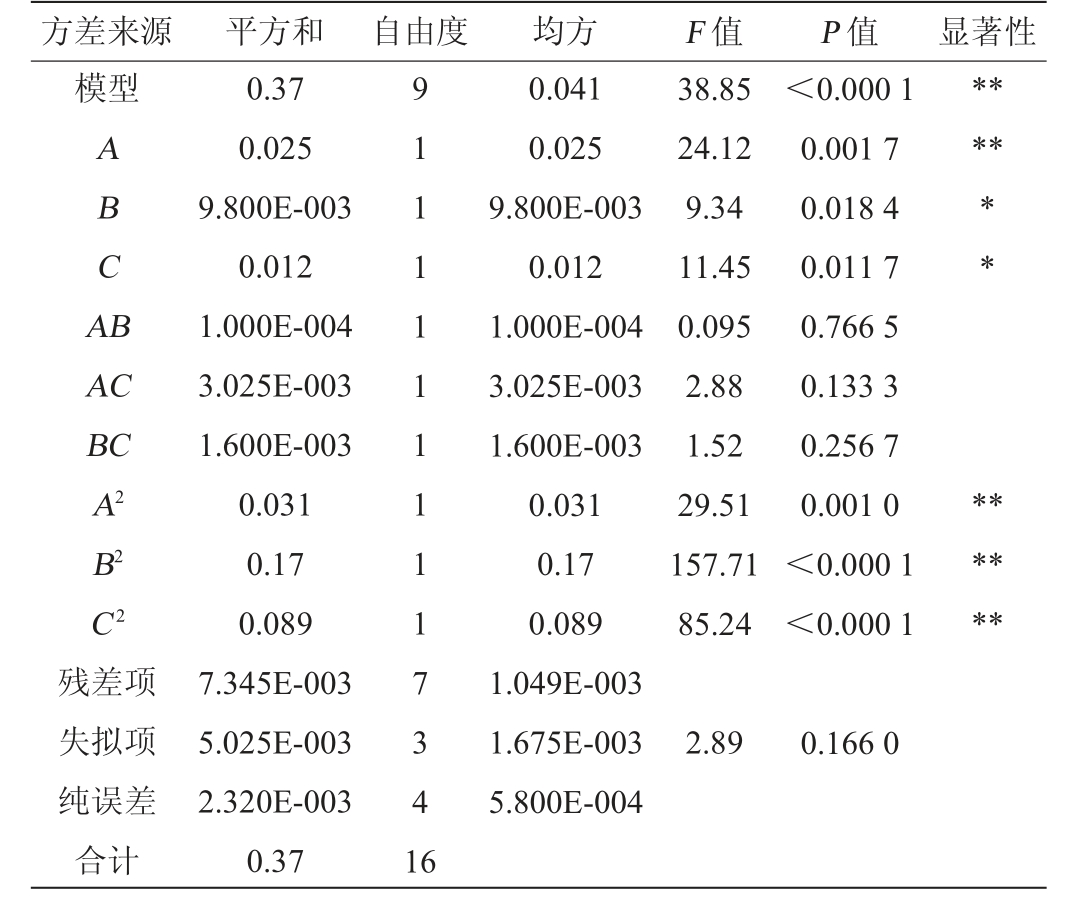
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源平方和 自由度均方F 值P 值显著性模型ABCA B****AC BC A2 B2 C2残差项失拟项纯误差合计0.37 0.025 9.800E-003 0.012 1.000E-004 3.025E-003 1.600E-003 0.031 0.17 0.089 7.345E-003 5.025E-003 2.320E-003 0.37 91111111117341 6 0.041 0.025 9.800E-003 0.012 1.000E-004 3.025E-003 1.600E-003 0.031 0.17 0.089 1.049E-003 1.675E-003 5.800E-004 38.85 24.12 9.34 11.45 0.095 2.88 1.52 29.51 157.71 85.24<0.000 1 0.001 7 0.018 4 0.011 7 0.766 5 0.133 3 0.256 7 0.001 0<0.000 1<0.000 1********2.89 0.166 0
利用Design-Expert 8.6.0软件对表4数据进行多元回归拟合,得到二次多项回归方程:Y=-10.928 06+0.394 56A+0.583 13B+1.766 25C-6.2500 0E-004AB-6.875 00E-003BC-0.0100 00AC-5.359 37E-003A2-0.049 562B2-0.145 75C2。
由表5可知,回归模型的P值<0.000 1,极显著,失拟项P=0.166 0>0.05,不显著,表明试验误差较小,拟合度较好,回归模型可充分反应实际情况。模型的决定系数R2=0.980 4,调整决定系数R2Adj=0.955 1,表明响应面效果与试验拟合程度高,可用于对试验结果进行分析和预测。由表5亦可知,一次项A、二次项A2、B2、C2对菌株S1总酯产量的影响极显著(P<0.01),一次项B、C对菌株S1总酯产量的影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,影响克鲁维毕赤酵母S1产酯的因素主次顺序为A>C>B,即发酵温度>发酵时间>接种量。
利用Design-Expert 8.0.6软件对响应面试验所得结果进行分析,得出克鲁维毕赤酵母S1产酯的最适发酵条件为33.24 ℃、接种量5.16%、发酵时间5.10 d,在此条件下,总酯产量预测值为1.64 g/L;考虑到实际操作的可行性,将最佳发酵条件修正为发酵温度32 ℃、接种量5%、发酵时间5 d,在该优化条件下进行3次平行验证试验,总酯产量实际值为1.69 g/L,实际值与预测值接近,表明此模型可以较好地预测酵母总酯产量。
3 结论
本研究从酒糟、酒曲、葡萄、柿子、酒醅、酸菜样品中共分离纯化出64株酵母菌菌株,从柿子样品中筛选出一株生香酵母S1,经鉴定,其为克鲁维毕赤酵母(Pichia kluyveri),该菌的最适最适生长温度为28 ℃、最适生长pH为6,可耐受温度40 ℃、pH 2和10、体积分数10%的乙醇和1.0%的乙酸。克鲁维毕赤酵母S1产酯的最佳发酵条件为发酵温度32 ℃、接种量5%,发酵时间5 d。在此优化条件下,总酯产量为1.69 g/L,比优化前提高14.19%。本研究筛选出的这株酵母产酯能力强,香味浓郁,弥补了部分白酒总酯含量不足的缺陷,同时后续工作将其应用于酒曲中,研究其对酒曲风味和生物多样性的影响,为各类酒行业的增香奠定基础。
[1]蔡雪梅,吴联海,陈梦圆,等.酱香型白酒酒糟中生香酵母的筛选及鉴定[J].中国酿造,2017,36(7):42-47.
[2]WU Y,CHEN X,FANG X B,et al.Isolation and identification of aromaproducing yeast from mackerel fermentation broth and its fermentation characteristics[J].J Aquat Food Prod Tec,2021,30(10):1264-1280.
[3]BOURBON-MELO N,PALMA M,ROCHA M P,et al.Use of Hanseniaspora guilliermondii and Hanseniaspora opuntiae to enhance the aromatic profile of beer in mixed-culture fermentation with Saccharomyces cerevisiae[J].Food Microbiol,2021,95:103678.
[4]VICENTE J,CALDERÓN F,SANTOS A,et al.High potential of Pichia kluyveri and other Pichia species in wine technology[J].Int J Mol Sci,2021,22(3):1196.
[5]蔡伟琪,钟武杰,周嘉健,等.天然酱醪中产β-苯乙醇酵母菌的分离鉴定、发酵条件优化及其应用[J].食品工业科技,2023,44(17):149-157.
[6]WU W Y,CHEN T,ZHAO M M,et al.Effect of co-inoculation of different halophilic bacteria and yeast on the flavor of fermented soy sauce[J].Food Biosci,2023,51:102292.
[7]ZHU C Y,YOU X,WU T,et al.Efficient utilization of carbon to produce aromatic valencene in Saccharomyces cerevisiae using mannitol as the substrate[J].Green Chem,2022,24(11):4614-4627.
[8]ZUO Y M,XIAO F,GAO J C,et al.Establishing Komagataella phaffii as a cell factory for efficient production of sesquiterpenoid α-santalene[J].J Agr Food Chem,2022,70(26):8024-8031.
[9]张杰,程伟,彭兵,等.小曲清香型白酒研究概述[J].酿酒科技,2017(9):91-95.
[10]FU Z L,SUN B G,LI X T,et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotech Biotechnol Equipment,2018,32(5):1218-1227.
[11]WANG Y Y,WANG M,LI W J,et al.Indigenous yeast can increase the phenolic acid and volatile ester compounds in Petit Manseng wine[J].Front Nutr,2022(9):1031594.
[12]刘阳,邓静,吴华昌,等.柑橘果皮中生香酵母的筛选及挥发性香气成分分析[J].食品安全质量检测学报,2014,5(12):4050-4055.
[13]鲁云风,刘智兴,张四普,等.猕猴桃生香酵母筛选鉴定及其发酵特性[J].河南农业科学,2021,50(8):166-173.
[14]唐红梅,王浩文,吴华昌,等.川南腌菜耐盐生香酵母的筛选、鉴定及特性[J].食品科学,2020,41(12):150-157.
[15]郝瑶,王陶,李文,等.富硒猕猴桃果酒酵母的筛选及鉴定[J].食品科学,2014,35(21):175-179.
[16]叶萌祺,袁亚宏,岳田利,等.产香酵母分离鉴定与苹果酒发酵中的应用[J].农业机械学报,2013,44(12):187-192.
[17]康艳丽,陈作林,曾小波,等.酱醪生香酵母的选育及其生长动力学研究[J].中国酿造,2023,42(4):118-124.
[18]CHEN L H,WANG S X,LIU B,et al.Flavor characteristics of hulless barley wine fermented with mixed starters by molds and yeasts isolated from Jiuqu[J].Food Biosci,2023,52:102349.
[19]冯炘,何凯翔,解玉红.葡萄中酵母菌的筛选及菌株鉴定[J].价值工程,2020,39(13):270-273.
[20]巴尼特J A,佩恩R W,亚罗D.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:124-135
[21]刘晓柱,赵湖冰,李银凤,等.一株刺梨葡萄汁有孢汉逊酵母的鉴定及酿酒特性分析[J].食品与发酵工业,2020,46(8):97-104.
[22]成福,肖洋,王婷,等.均匀设计优化生香酵母产酯发酵工艺[J].中国酿造,2020,39(12):91-94.
[23]时宽芹.草莓品种对其发酵酒理化性质与感官品质的影响研究[D].合肥:安徽农业大学,2021.
[24]HU Y N,HUANG X N,YANG B,et al.Contrasting the microbial community and metabolic profile of three types of light-flavor Daqu[J].Food Biosci,2021,44:101395.
[25]杨凯环,相里加雄,曹苗文,等.清香型酒曲中高产乙酸乙酯酵母的筛选及鉴定[J].酿酒科技,2023(7):38-43.
[26]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:88-98.
[27]葛家驹,王贵一,周畅,等.发酵芒果饮料的开发及其挥发性香气、氨基酸的测定[J].食品工业,2023,44(11):309-316.
[28]GAO M M,HU J N,WANG X J,et al.Effects of Pichia kluyveri on the flavor characteristics of wine by co-fermentation with Saccharomyces cerevisiae[J].Eur Food Res Technol,2023,249(6):1449-1460.
[29]BATISTA N N,RAMOS C L,RIBEIRO D D,et al.Dynamic behavior of Saccharomyces cerevisiae,Pichia kluyveri and Hanseniaspora uvarum during spontaneous and inoculated cocoa fermentations and their effect on sensory characteristics of chocolate[J].LWT-Food Sci Technol,2015,63(1):221-227.
[30]孙露露,贾军全,高志远,等.高产酒精酵母Y7的筛选及其制曲工艺优化[J].酿酒,2023,50(2):52-57.
[31]MÜHLHOFER M,BERCHTOLD E,STRATIL C G,et al.The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins[J].Cell Rep,2019,29(13):4593-4607.
[32]李小龙,吴群,徐岩.乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替[J].微生物学通报,2019,46(1):1-10.
[33]TANAKA K,KOYAMA M,PHAM P T,et al.Production of high-concentration bioethanol from cassava stem by repeated hydrolysis and intermittent yeast inoculation[J].Int Biodeter Biodegr,2019,138:1-7.
[34]袁英豪,何梦娇,唐春麟,等.醋源生香酵母的筛选及其特性研究[J].食品与发酵工业,2024,50(15):63-71.
[35]刘君,李玲珊,赵文鹏,等.中高温大曲产酯酵母代谢产酯性能研究[J].酿酒科技,2021(12):33-38,46.
[36]徐惠东,尤扬,游颖欣,等.一种高耐热乳糖酶的异源表达、固定化及酶学性质研究[J].食品与发酵工业,2024,50(21):1-8.
[37]吴林,袁雪,马靖童,等.猕猴桃苹果复合果酒低温发酵工艺优化及品质分析[J].中国酿造,2023,42(12):153-160.