核糖核酸(ribonucleic acid,RNA),简称核酸,作为一种重要的生物大分子存在于所有生物体中,在维持细胞生命活动、遗传代谢途径和细胞分裂方面发挥着重要作用[1-4]。RNA经过降解后,可生成核苷酸与相应的衍生物,被广泛应用于生物医药领域[5-10]。RNA经过酶解分离得到的呈味核苷酸,具有强烈的增鲜作用[11],被广泛应用于食品调味中;部分核苷酸产品也被应用到植物生长过程中,具有促进作物成熟、增强果实的品质与作物产量等作用[12-13]。
在不同的微生物菌种中,细胞内总RNA含量也有明显的不同。目前,已经有报道可以生产RNA的微生物主要是产朊假丝酵母(Candida utilis)、酿酒酵母(Saccharomyces cerevisiae)与枯草芽孢杆菌(Bacillus subtilis)[14]。其中,假丝酵母作为致病菌,生产安全性不能被保障;而枯草芽孢杆菌虽然具有生长速度快与易培养等优点,但其RNA产量相对来说并不算高,因此不能满足市场的需求[2]。马克斯克鲁维酵母(Kluyveromyces marxianus)虽然是一种非常规酵母菌,但其一般被认为是安全(generally recognized as safe,GRAS)菌株,适合用于医药与食品行业的发酵生产[15],且该菌株相对酿酒酵母来说生长周期较短,并在一定程度上与常见的酿酒酵母具有亲缘关系[16]。除此之外,K.marxianus在发酵过程中不仅具有原料利用率高与副产物含量少的优点,且该菌可利用的碳源也非常多,如木糖、果糖、阿拉伯糖等,并同时具有乳糖同化能力[17],既可以发酵乳糖,又可以利用半乳糖[18],这使得高乳糖含量的乳清资源也得到了充分地利用。
在K.marxianus中,HXT14与HXT15是有关类似己糖转运蛋白编码的基因[19]。WIECZORKE R等[20]研究发现,对K.marxianus的HXT14基因进行过表达改造后,当采用半乳糖(2%)作为K.marxianus生长的碳源时,该菌的生长状态良好,这可能说明HXT14蛋白具有对半乳糖转运的特异性;而当葡萄糖(2%)、果糖和甘露糖作为碳源时,重组菌株生长情况则并未显露出优越性。REIFENBERGER E等[21]推测,在过表达己糖转运蛋白相关基因后提高了葡萄糖的利用率,对细胞生长起到了正向作用,而己糖转运蛋白相关基因同时也参与减数分裂代谢相关的途径,因此在对相关基因进行过表达改造后,葡萄糖的摄取和糖酵解等途径也得到了促进,从而导致了细胞生长活性的增强。
本研究以可利用乳糖的马克斯克鲁维酵母TY20为亲本菌株,为了增强其对乳糖的利用能力并获得高RNA含量的重组菌株,对己糖转运蛋白编码相关基因HXT14与HXT15进行过表达改造,构建了重组菌株TY20-HXT14与TY20-HXT15。在此基础上,以RNA含量为评价指标,采用单因素试验及响应面试验对重组菌株TY20-HXT14的培养基组成进行优化,以期为高乳糖含量的乳清资源再利用与RNA的高效生产提供新的研究方向。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒及引物
亲本菌株K.marxianus-TY20、质粒pUG6(AmpR)、YEp352-PGK-K(YEp352-PGK1p-PGK1t-KanMX):本实验室;本研究所用引物见表1。
表1 本研究所用引物
Table 1 Primers used in this study
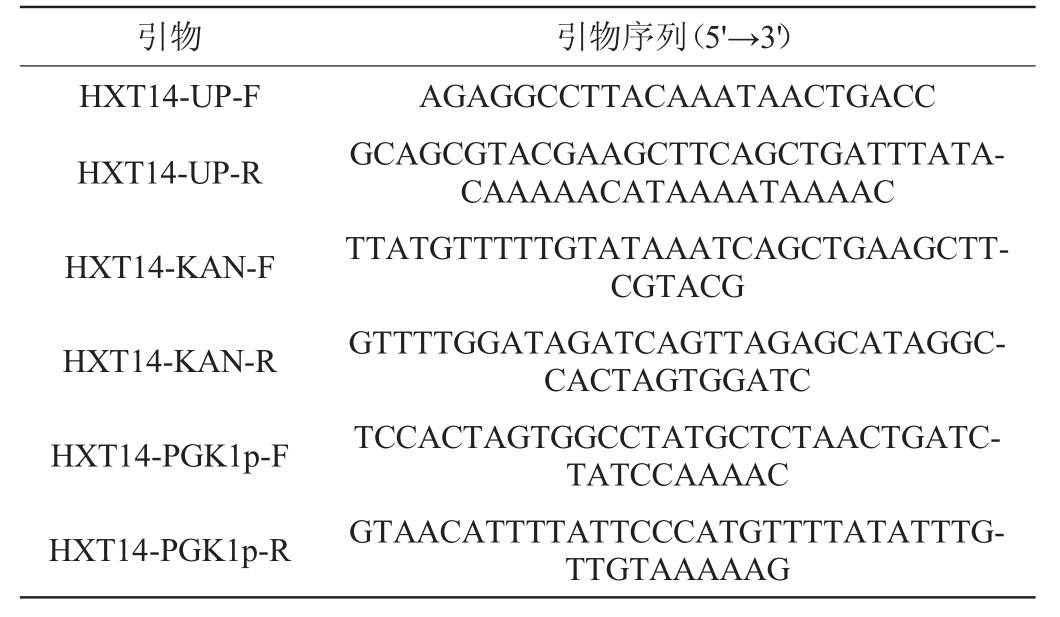
引物引物序列(5'→3')HXT14-UP-F HXT14-UP-R HXT14-KAN-F HXT14-KAN-R HXT14-PGK1p-F HXT14-PGK1p-R AGAGGCCTTACAAATAACTGACC GCAGCGTACGAAGCTTCAGCTGATTTATACAAAAACATAAAATAAAAC TTATGTTTTTGTATAAATCAGCTGAAGCTTCGTACG GTTTTGGATAGATCAGTTAGAGCATAGGCCACTAGTGGATC TCCACTAGTGGCCTATGCTCTAACTGATCTATCCAAAAC GTAACATTTTATTCCCATGTTTTATATTTGTTGTAAAAAG
续表

引物引物序列(5'→3')HXT14-F HXT14-R HXT14-PGK1t-F HXT14-PGK1t-R HXT14-DOWN-F HXT14-DOWN-R HXT15-UP-F HXT15-UP-R HXT15-KAN-F HXT15-KAN-R HXT15-PGK1p-F HXT15-PGK1p-R HXT15-F HXT15-R HXT15-PGK1t-F HXT15-PGK1t-R HXT15-DOWN-F HXT15-DOWN-R KAN-1R KAN-2F HXT14-1F HXT14-1R HXT14-2F HXT14-2R HXT14-3F HXT14-3R HXT14-4F HXT14-4R HXT14-5F HXT14-5R HXT15-1F HXT15-1R HXT15-2F HXT15-2R HXT15-3F HXT15-3R HXT15-4F HXT15-4R HXT15-5F TTACAACAAATATAAAACATGGGAATAAAATGTTAC GAAAAAAATTGATCTATCGTTACTCAGTGAGAGCATATAG CAAACTATATGCTCTCACTGAGTAACGATAGATCAATTTTTTTCTTTTCTC GAATCATATATTTCTTTGGAATATTCATTTTAACGAACGCAGAATTTTCGAG TTAATAACTCGAAAATTCTGCGTTCGTTAAAATGAATATTCCAAAGAAATATATG CTTTAGATTTAGGAGACAGTCCG AGCCTGTACTTTCATAATTGAACC CGTACGAAGCTTCAGCTGCTTAAAGTTTTATTTTGGAAACTGTCACT GACAGTTTCCAAAATAAAACTTTAAGCAGCTGAAGCTTCGTACG TCCACTAGTGGCCTATGCTCTAACTGATCTATCCAAAAC GATCCACTAGTGGCCTATGCTCTAACTGATCTATCCAAAACTG CAACATCTTTGTCGCTTGTCATGTTTTATATTTGTTGTAAAAAGTAGATAAT ATTATCTACTTTTTACAACAAATATAAAACATGACAAGCGACAAAGATGTTG GAAAGAGAAAAGAAAAAAATTGATCTATCGTTACGGAGTATACAATTCACCATCATC AAAGATGATGGTGAATTGTATACTCCGTAACGATAGATCAATTTTTTTCTTTTCTCT CATTTAAAAAAAAACTCTTGTTATATCTACTAACGAACGCAGAATTTTCGAGTTAT TTTAATAACTCGAAAATTCTGCGTTCGTTAGTAGATATAACAAGAGTTTTTTTTTAAATG ATAAGGCTTAATCAACGTCGTC GAAACGTGAGTCTTTTCCTTACC CCGACCATCAAGCATTTTATCC GATATTCTGGAAGGTGGTAATGG GAAACGTGAGTCTTTTCCTTACC AGGTTGTATTGATGTTGGACG GATGAGACCCCATTCTTTGAAG ATTGCAGCTTCCAATTTCGTC GTTCCCAAAGAGTAGATGGTTAGAG GTTTGATTCTTGGTTCGGTTG AAAGGATGGGGAAAGAGAAAAG TCGGGTTCAGCGTATTTTAAG CATTAGAAGAACTTTCCCTTCCAAC TGATATAATATCTGGCGCCCTAG GAAACGTGAGTCTTTTCCTTACC AGGTTGTATTGATGTTGGACG GATGAGACCCCATTCTTTGAAG ATTGCAGCTTCCAATTTCGTC CAATAGCTAATGACAACTGAAAAGC TCGCAAGAAGTTCCTTGTAGTTG AAAGGATGGGGAAAGAGAAAAG TCGGGTTCAGCGTATTTTAAG
续表

引物引物序列(5'→3')HXT15-5R Km-actin-RT-F Km-actin-RT-R RT-HXT14-F RT-HXT14-R RT-5.8S-F RT-5.8S-R RT-18S-F RT-18S-R RT-28S-F RT-28S-R CTTGGCCAGTCAACTTGAATAC ACGTTGTTCCAATCTACGCC CTTGTTCGAAGTCCAAAGCG ATCTCAGAGTTGTTCCCTGC CCGATACGAATAAGCACACAG CAACAACGGATCTCTTGGTTC AAATGACGCTCAAACAGGC GCACTTGCTGGTTAACTCTTC CACAAGATTACCCAGACCTCTC ATCGATCCTTTAGGTCCTCG CCAACGCTTACCGAATTCTG
1.1.2 培养基
乳糖液体培养基:采用乳糖代替酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基中的葡萄糖,具体成分为1%酵母浸粉、2%乳糖和2%蛋白胨,固体培养基需额外加入2%琼脂。115 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
乳糖(分析纯):戴维斯科食品国际公司;高氯酸(分析纯):天津化学试剂有限公司;磷酸二氢钾(分析纯):天津市风船化学试剂科技有限公司;硫酸镁(分析纯):天津博迪化工股份有限公司;酵母浸粉(生化试剂):北京欧博星生物技术有限公司;Omega纯化回收试剂盒:美国生物技术公司;YeaStarTM RNA试剂盒、PrimeScript TMRT试剂盒、SYBRRPremix Ex TaqTMII、LATaq高保真酶:日本TaKaRa公司;其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
Cary8454型紫外-可见分光光度计:美国安捷伦科技有限公司;5331梯度聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:德国Eppendorf公司;XMTB型电热恒温水浴锅:天津市中环实验电炉有限公司;IS-RDS3型恒温摇床:上海制成仪器制品有限公司;StepOne型实时荧光定量(real-time fluorescence quantitative PCR,RT-fqPCR)仪:美国ABI公司。
1.3 方法
1.3.1 重组菌株的构建与验证
重组菌株的构建方法以K.marxianus TY20-HXT14为例:采用珠磨法[22]提取亲本菌株K.marxianus-TY20的基因组DNA,以其作为模板,分别使用引物HXT14-UP-F和HXT14-UP-R、HXT14-F 和HXT14-R、HXT14-DOWN-F 和HXT14-DOWN-R,PCR扩增得到基因HXT14的上游片段、基因片段与下游片段。使用质粒YEp352-PGK-K作为模板,分别使用引物HXT14-PGK1p-F和HXT14-PGK1p-R、HXT14-PGK1t-F和HXT14-PGK1t-R,PCR扩增得到PGK1的启动子与终止子片段。以质粒pUG6为模板,以HXT14-Kan-F和HXT14-Kan-R为引物,PCR扩增得到筛选标记KanMX片段。PCR扩增体系及条件详见LATaq高保真酶说明书。采用Omega纯化回收试剂盒对PCR扩增产物进行纯化回收。采用醋酸锂化学转化法[23]将回收片段导入亲本菌株中,构建重组菌株K.marxianus TY20-HXT14,涂布于含有150 μg/mL G418的培养基平板上,30 ℃条件下培养48 h。
挑取正常生长的单菌落,采用上游片段连接(HXT14上游同源臂与KanMX片段)验证引物HXT14-1F和HXT14-1R、中游1(KanMX与PGK1启动子片段)验证引物HXT14-2F和HXT14-2R、中游2(PGK1启动子与HXT14基因片段)验证引物HXT14-3F和HXT14-3R、中游3(HXT14基因与PGK1终止子片段)验证引物HXT14-4F和HXT14-4R、下游片段连接(PGK1终止子与HXT14下游同源臂片段)验证引物HXT14-5F和HXT14-5R进行定点PCR验证,产物条带位置正确即代表目的菌株构建成功。K.marxianus TY20-HXT15的构建及验证与上述方法类似。
1.3.2 胞内总RNA含量的测定
(1)菌体干质量的测定
使用接种环挑一环菌体接种于装有5 mL乳糖液体培养基中,30 ℃、180 r/min条件下培养12 h作为种子液;将种子液以2%(V/V)的接种量接种至50 mL乳糖液体培养基中,开始培养后每2 h测定菌液的OD600nm值。取10 mL菌液,12 000 r/min离心3 min,收集菌泥,用无菌水冲洗2~3次后,65~70 ℃下干燥至恒质量,即可得到菌体的干质量(y)与对应OD600 nm值(x)的标准曲线及回归方程:y=0.384 6x+0.704 4(R2=0.999 8)。根据标准曲线回归方程计算得到菌体干质量。
(2)RNA含量的测定
参考高氯酸法测定总RNA含量[24-25],将酵母菌株种子液以2%(V/V)的接种量接种至50 mL乳糖液体培养基中,30 ℃、180 r/min条件下培养至OD600nm值=1.000。取1 mL发酵液至1.5 mL EP管中,12 000 r/min离心2 min,收集细胞沉淀后用无菌水冲洗2~3次,离心后在细胞沉淀中加入1 mL 0.5 mol/L高氯酸,振荡混匀,70 ℃水浴20 min,12 000 r/min离心2 min后,收集上清液(1 mL),采用无菌去离子水定容至10 mL,在波长260 nm处测定上清液的吸光度值,计算总RNA含量,其计算公式如下:
式中:A为上清液在波长260 nm处的吸光度值;V为发酵液体积,L;M为1 L菌液中酵母干质量,g;32为单位光吸收值;F为稀释倍数。
1.3.3 RNA的提取与实时荧光定量PCR
采用YeaStarTM RNA试剂盒提取酵母总RNA,使用PrimeScript TMRT试剂盒对所获得的RNA进行逆转录,然后使用SYBRRPremix Ex TaqTMII试剂盒中SYBR Green I监测方法进行实时荧光定量聚合酶链式反应(RT-fqPCR)扩增,使用2-ΔΔCT法对基因表达量进行计算[26]。使用引物RT-HXT14-F和RT-HXT14-R检测HXT14;使用引物RT-5.8S-F和RT-5.8S-R检测5.8S rRNA;使用引物RT-18S-F和RT-18S-R检测18S rRNA;使用引物RT-28S-F和RT-28S-R检测28S rRNA;使用引物Km-actin-RT-F和Km-actin-RT-R检测内参基因Actin。
1.3.4 菌株生长曲线的测定
取一环K.marxianus接种于5 mL乳糖液体培养基中,30 ℃、180 r/min条件下培养12 h作为种子液。按2%(V/V)的接种量将种子液接种至装液量为50 mL/250 mL乳糖液体培养基中,30 ℃、180 r/min条件下培养12 h,每1 h测量菌液的OD600nm值。以培养时间(x)为横坐标,对应的OD600nm值(y)为纵坐标,绘制生长曲线。
1.3.5 培养基优化单因素试验
将重组菌株种子液按2%(V/V)的接种量接种至装液量为50 mL/250 mL液体培养基中,30 ℃、180 r/min条件下培养至菌液的OD600nm值为1.000。在此基础上,分别考察乳糖添加量(2%、6%、10%、14%、18%)、酵母浸粉添加量(0、0.5%、1.0%、1.5%、2.0%)、磷酸二氢钾添加量(0、0.1%、0.2%、0.3%、0.4%)及硫酸镁添加量(0、0.1%、0.2%、0.3%、0.4%)对重组菌株RNA含量的影响。
1.3.6 培养基优化Box-Behnken响应面试验
根据单因素试验结果,以RNA含量(Y)为响应值,选取乳糖添加量(A)、酵母浸粉添加量(B)、磷酸二氢钾添加量(C)和硫酸镁添加量(D)4个因素为考察因素,采用Design-Expert 8.0.6进行4因素3水平的响应面试验,试验因素与水平见表2。
表2 培养基优化响应面试验因素与水平
Table 2 Factors and levels of response surface tests for medium optimization
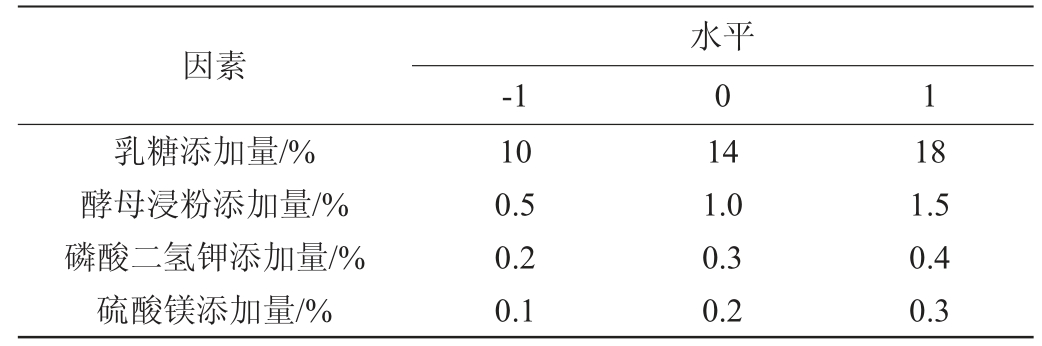
因素乳糖添加量/%酵母浸粉添加量/%磷酸二氢钾添加量/%硫酸镁添加量/%-1水平0 1 10 0.5 0.2 0.1 14 1.0 0.3 0.2 18 1.5 0.4 0.3
1.3.7 数据处理
每个试验重复3次,结果以“平均值±标准差”表示,试验数据采用IBM SPSS Statistics 20.0对数据进行显著性分析,采用Origin 2021软件绘图。
2 结果与分析
2.1 重组菌株的验证
采用菌落PCR法对重组菌株K.marxianus TY20-HXT14和K.marxianus TY20-HXT15进行验证,结果见图1。由图1a可知,以重组菌株K.marxianus TY20-HXT14的基因组为模板,使用定点验证引物HXT14-1F和HXT14-1R、HXT14-2F和HXT14-2R、HXT14-3F和HXT14-3R、HXT14-4F和HXT14-4R、HXT14-5F和HXT14-5R可分别扩增出碱基长度为1 491 bp、1 039 bp、1 000 bp、456 bp与747 bp的基因片段;以重组菌株K.marxianus TY20-HXT15的基因组为模板,使用定点验证引物HXT15-1F和HXT15-1R、HXT15-2F和HXT15-2R、HXT15-3F和HXT15-3R、HXT15-4F和HXT15-4R、HXT15-5F和HXT15-5R可分别扩增出碱基长度为1 332 bp、1 039 bp、1 011 bp、530 bp与720 bp的基因片段,而利用亲本菌株K.marxianus TY20基因组为模板,用以上引物未扩增出条带,证明重组菌株K.marxianus TY20-HXT14和K.marxianus TY20-HXT15构建成功。
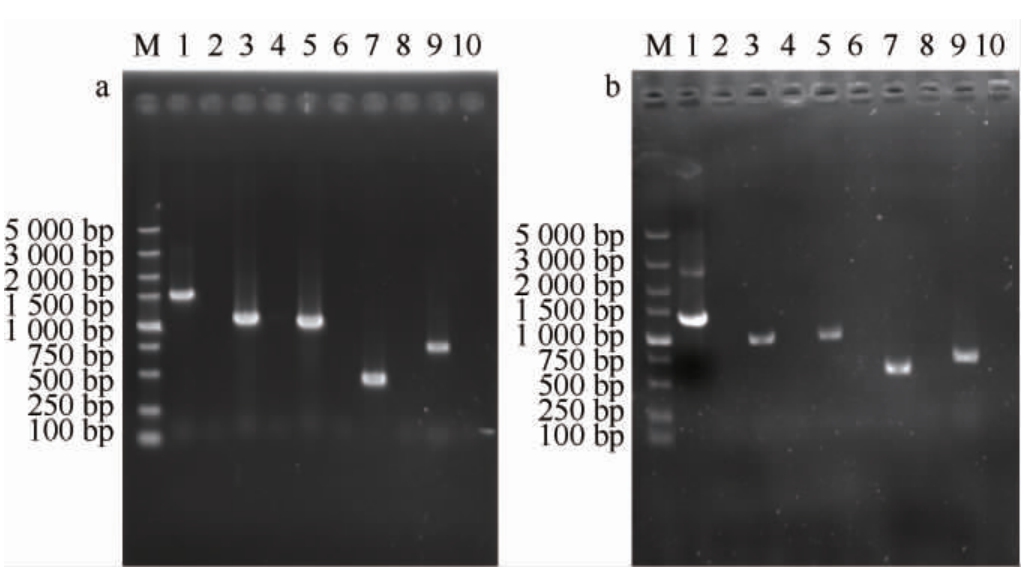
图1 重组菌株的聚合酶链式反应定点验证结果
Fig.1 Polymerase chain reaction site-specific verification results of recombinant strains
a:M为DL 5 000 DNA Marker;泳道1、3、5、7和9分别为重组菌株K.marxianus TY20-HXT14的上游、中游1、中游2、中游3和下游定点PCR扩增产物,泳道2、4、6、8和10分别是亲本菌株K.marxianus-TY20的相应PCR扩增产物。b:M为DL 5 000 DNA Marker;泳道1、3、5、7和9分别为重组菌株K.marxianus TY20-HXT15的上游、中游1、中游2、中游3和下游定点PCR扩增产物,泳道2、4、6、8和10分别是亲本菌株K.marxianus-TY20的相应PCR扩增产物。
2.2 重组菌株相关性能的测定
2.2.1 重组菌株与亲本菌株生长性能的比较
亲本菌株K.marxianus TY20与重组菌株K.marxianus TY20-HXT14、TY20-HXT15的生长曲线见图2。
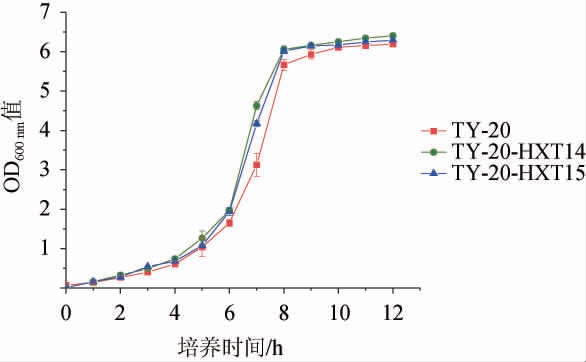
图2 亲本菌株与重组菌株生长性能比较
Fig.2 Comparison of growth performance between parent strain and recombinant strains
由图2可知,在过表达HXT14与HXT15基因后,重组菌株的生长速率明显升高,说明菌株在被改造后其生长性能并未受到明显影响。
2.2.2 胞内RNA含量的测定
重组菌株K.marxianus TY20-HXT14、K.marxianus TY20-HXT15与亲本菌株K.marxianus TY20胞内的RNA含量见图3。由图3可知,重组菌株K.marxianus TY20-HXT14胞内的RNA含量为14.23%,极显著高于亲本菌株K.marxianus TY20(12.43%)(P<0.01),相比亲本菌株提高14.48%,重组菌株K.marxianus TY20-HXT15胞内的RNA含量与亲本菌株K.marxianus TY20相比无显著差异(P>0.05)。因此,确定重组菌株K.marxianus TY20-HXT14为高产RNA的目标菌株。
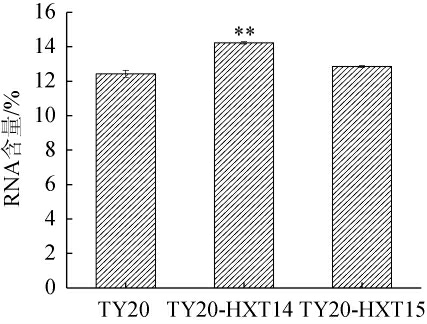
图3 亲本菌株与重组菌株的核糖核酸含量测定结果
Fig.3 Determination results of ribonucleic acid contents of parent strain and recombinant strain
“**”表示与K.marxianus TY20相比差异极显著(P<0.01)。下同。
2.2.3 重组菌株马克斯克鲁维酵母TY20-HXT14中相关基因转录水平的测定
为了从转录水平分析重组菌株K.marxianus TY20-HXT14胞内RNA的表达情况,选取亲本菌株K.marxianus TY20为对照菌株,通过RT-fqPCR对K.marxianusTY20-HXT14中相关基因(包括HXT14、5.8SrRNA、18SrRNA与28SrRNA)的转录水平进行分析,结果见图4。由图4可知,重组菌株K.marxianus TY20-HXT14中HXT14基因的表达量是亲本菌株K.marxianus TY20的5.65倍,5.8S rRNA、18S rRNA与28S rRNA的表达量分别是亲本菌株K.marxianus TY20的7.31、7.89与23.43倍,说明过表达HXT14基因后,重组菌株K.marxianus TY20-HXT14中该基因的转录水平不仅极显著升高(P<0.01),rRNA作为占比最多的一类RNA,其相关基因的转录水平也极显著增加(P<0.01)。
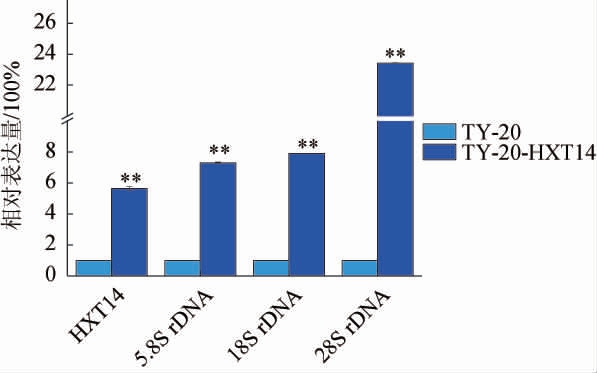
图4 亲本菌株Kluyveromyces marxianus TY20与重组菌株TY20-HXT14相关基因转录水平
Fig.4 Transcription levels of related genes of parent strain Kluyveromyces marxianus TY20 and recombinant strain TY20-HXT14
2.3 重组菌株马克斯克鲁维酵母TY20-HXT14培养基优化单因素试验
2.3.1 乳糖添加量的优化
不同乳糖添加量对重组菌株K.marxianus TY20-HXT14胞内RNA含量的影响见图5。由图5可知,随着乳糖添加量的增加,胞内RNA的含量呈先升高后下降的趋势,当乳糖添加量为14%时,RNA含量达到最大值,为18.30%。分析原因可能是乳糖添加量过低,碳源不足,不利于菌株的生长;而乳糖添加量过高时,细胞快速生长导致代谢产物短时间大量积累,从而影响了酵母细胞正常的生长代谢[27]。因此,确定乳糖的最优添加量为14%。
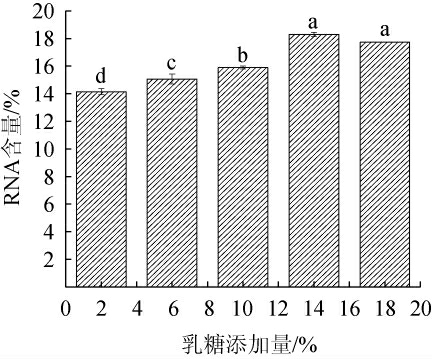
图5 乳糖添加量对重组菌株TY20-HXT14胞内核糖核酸含量的影响
Fig.5 Effect of lactose addition on intracellular ribonucleic acid contents of recombinant strain TY20-HXT14
不同小写字母表示差异显著(P<0.05)。下同。
2.3.2 酵母浸粉添加量的优化
由于在RNA的工业生产中,绝大多数采用效果显著的酵母浸粉做氮源对酵母细胞进行培养[28-29],因此,本研究重点考察了酵母浸粉对胞内RNA含量的影响。不同酵母浸粉添加量对重组菌株K.marxianus TY20-HXT14胞内RNA含量的影响见图6。由图6可知,随着酵母浸粉添加量的增加,胞内RNA的含量呈先升高后下降的趋势。当酵母浸粉添加量为1%时,胞内RNA含量最高,为14.21%。酵母浸粉作为菌体生长的氮源,含量过高会导致细胞生长过于旺盛,由此推断这很可能造成了培养基中的氮残留,且产生的代谢产物同样不利于目的产物积累[30]。因此,确定酵母浸粉的最优添加量为1%。
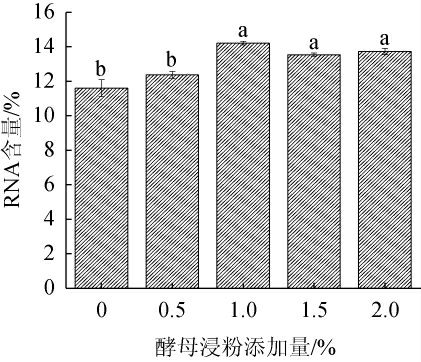
图6 酵母浸粉添加量对重组菌株TY20-HXT14胞内核糖核酸含量的影响
Fig.6 Effect of yeast extract addition on intracellular ribonucleic acid contents of recombinant strain TY20-HXT14
2.3.3 磷酸二氢钾添加量的优化
磷在细胞合成核糖核酸与能量代谢中起着重要作用[31],因此,选取工业酵母发酵中常用的磷酸二氢钾为菌株的生长发酵补充磷元素。不同磷酸二氢钾添加量对重组菌株K.marxianus TY20-HXT14胞内RNA含量的影响见图7。由图7可知,随着磷酸二氢钾添加量的增加,胞内RNA的含量呈先升高后下降的趋势,但是差异不显著(P>0.05)。当磷酸二氢钾添加量为0.3%时,胞内RNA含量最高,为14.32%。因此,确定磷酸二氢钾的最优添加量为0.3%。
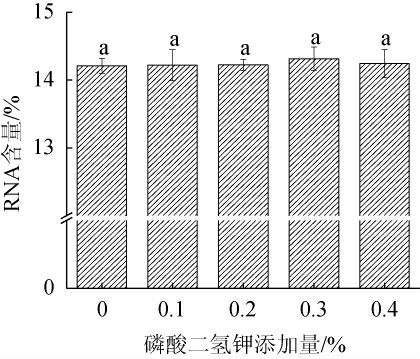
图7 磷酸二氢钾添加量对重组菌株TY20-HXT14胞内核糖核酸含量的影响
Fig.7 Effect of KH2PO4 addition on intracellular ribonucleic acid contents of recombinant strain TY20-HXT14
2.3.4 硫酸镁添加量的优化
虽然酵母在细胞生长过程中对无机盐需求量较小,但适量补充无机盐对细胞内的RNA合成具有重要作用,如热带假丝酵母(Candida tropicalis)在添加适量硫酸镁培养后,胞内RNA含量明显提高[31]。因此,选用硫酸镁作为金属离子。不同硫酸镁添加量对重组菌株K.marxianus TY20-HXT14胞内RNA含量的影响见图8。由图8可知,随着硫酸镁添加量的增加,胞内RNA的含量呈先升高后下降的趋势,但是差异不显著(P>0.05)。当硫酸镁添加量为0.2%时,胞内RNA含量最高,为14.25%。因此,确定硫酸镁的最优添加量为0.2%。
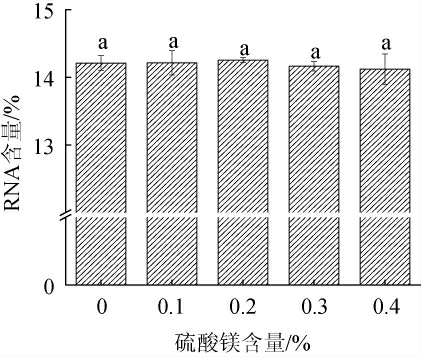
图8 硫酸镁添加量对重组菌株马克斯克鲁维酵母TY20-HXT14胞内核糖核酸含量的影响
Fig.8 Effect of MgSO4 addition on intracellular ribonucleic acid contents of recombinant strain TY20-HXT14
2.4 重组菌株马克斯克鲁维酵母TY20-HXT14培养基优化响应面试验
根据单因素试验结果,以RNA含量(Y)为响应值,选取乳糖添加量(A)、酵母浸粉添加量(B)、磷酸二氢钾添加量(C)、硫酸镁添加量(D)为响应变量,采用Design-Expert 8.0.6设计4因素3水平的Box-Behnken响应面试验,试验设计及结果见表3,方差分析结果见表4。
表3 培养基优化Box-Behnken响应面试验设计及结果
Table 3 Design and results of Box-Behnken response surface tests for medium optimization
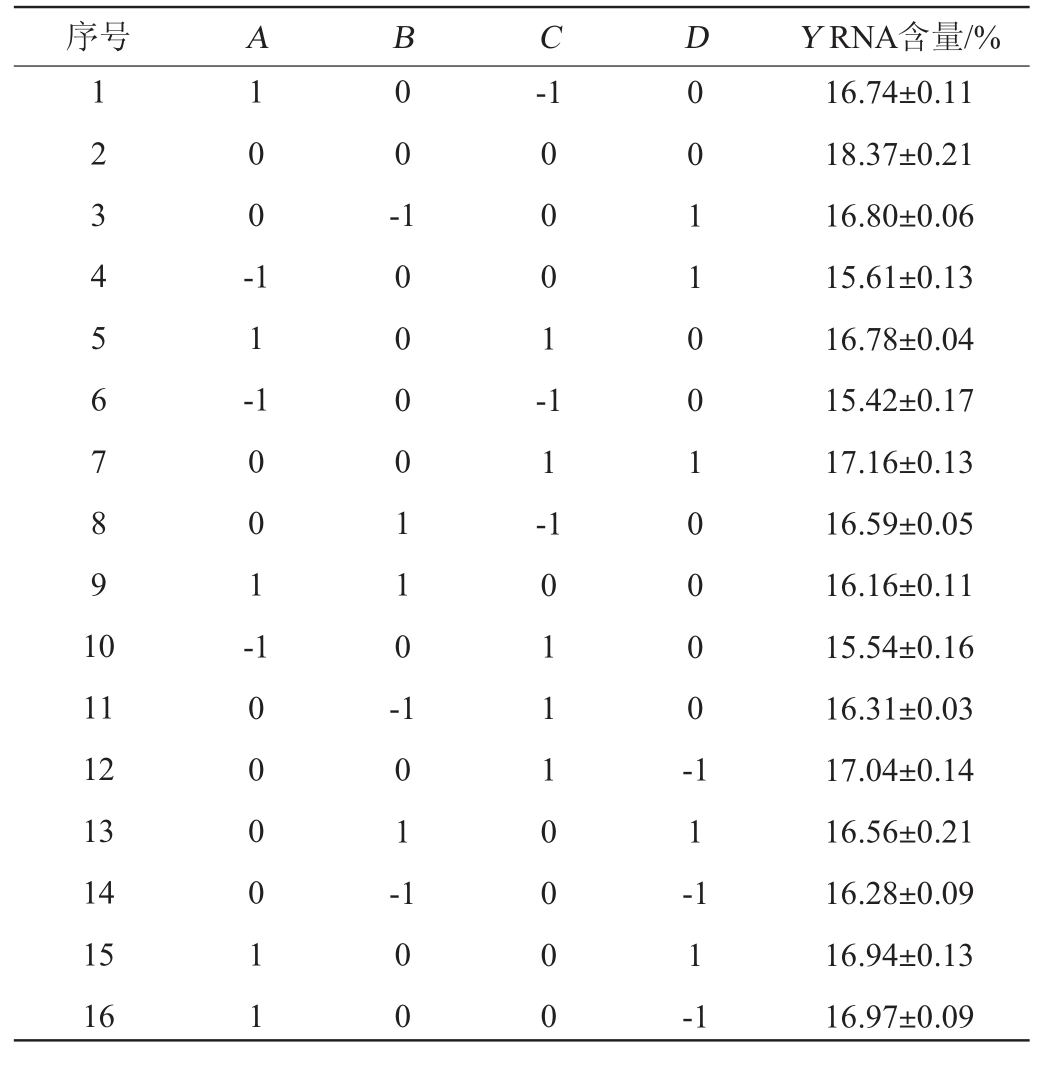
序号ABCDY RNA含量/%1234567891 0 100-00--1 11-1001-0001-11-11 12 13 14 15 16 1000011 10000110-101-00110010000-100 101110000 11-11-1 16.74±0.11 18.37±0.21 16.80±0.06 15.61±0.13 16.78±0.04 15.42±0.17 17.16±0.13 16.59±0.05 16.16±0.11 15.54±0.16 16.31±0.03 17.04±0.14 16.56±0.21 16.28±0.09 16.94±0.13 16.97±0.09
续表
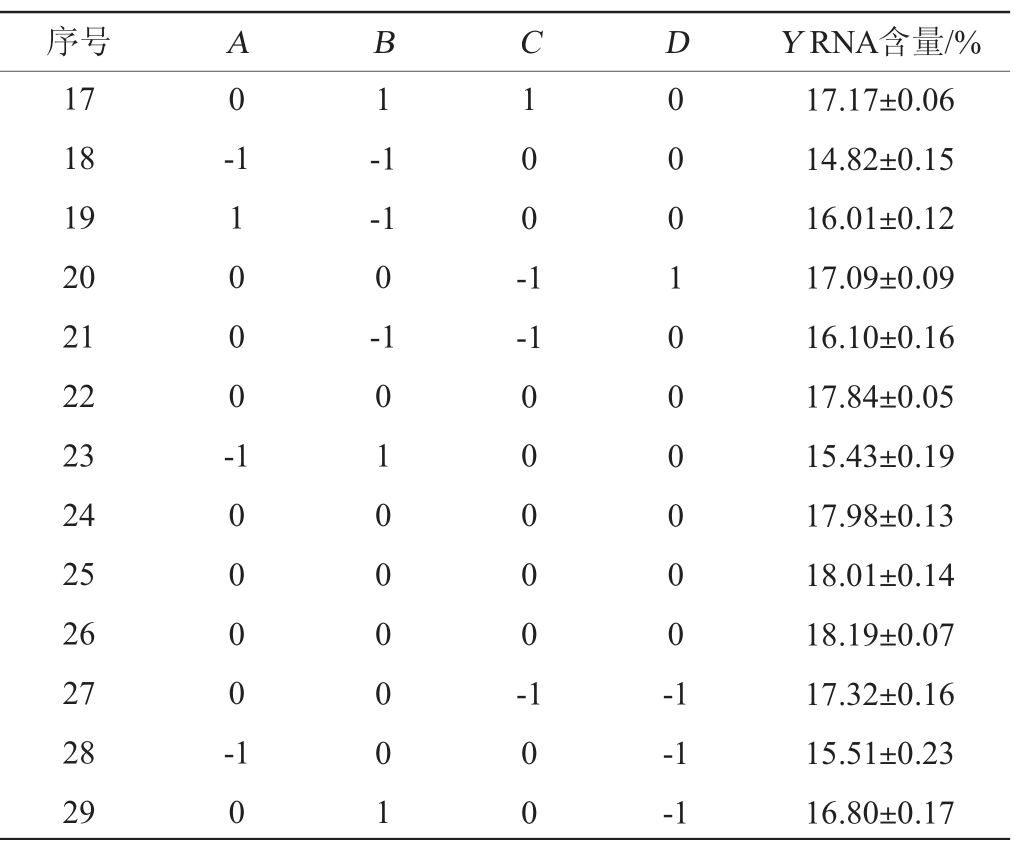
序号ABCDY RNA含量/%17 18 19 20 21 22 23 24 25 26 27 28 29 0 1-1 1000--1-1 0-1 100-1-1 10000-00000-0001000000-1 10 01000001 100-1-1 17.17±0.06 14.82±0.15 16.01±0.12 17.09±0.09 16.10±0.16 17.84±0.05 15.43±0.19 17.98±0.13 18.01±0.14 18.19±0.07 17.32±0.16 15.51±0.23 16.80±0.17
表4 回归模型方差分析
Table 4 Variance analysis of regression model
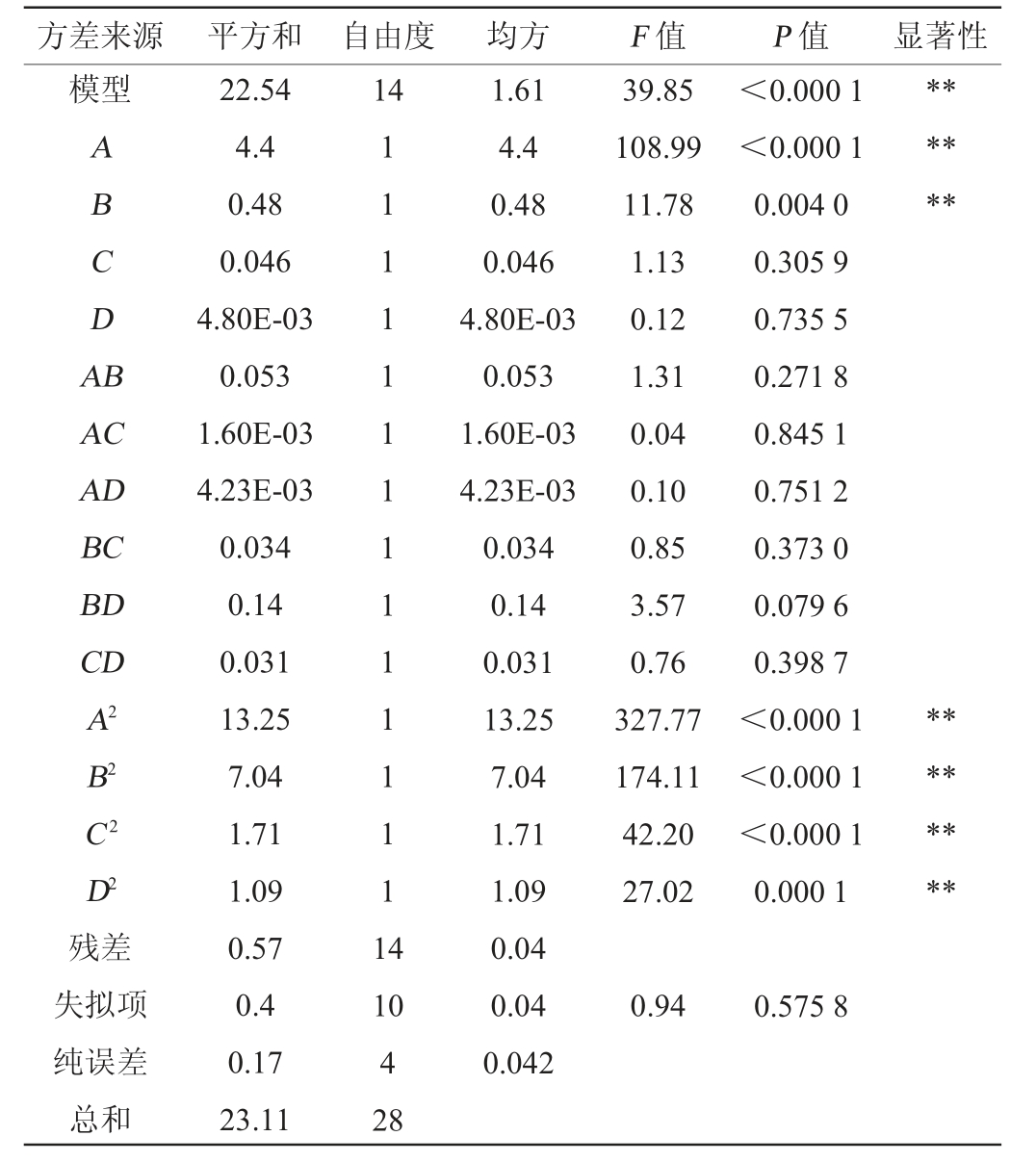
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度均方F 值P 值显著性模型ABCDA B******14 AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总和22.54 4.4 0.48 0.046 4.80E-03 0.053 1.60E-03 4.23E-03 0.034 0.14 0.031 13.25 7.04 1.71 1.09 0.57 0.4 0.17 23.11 111111111111111 4 39.85 108.99 11.78 1.13 0.12 1.31 0.04 0.10 0.85 3.57 0.76 327.77 174.11 42.20 27.02<0.000 1<0.000 1 0.004 0 0.305 9 0.735 5 0.271 8 0.845 1 0.751 2 0.373 0 0.079 6 0.398 7<0.000 1<0.000 1<0.000 1 0.000 1********10 4 28 1.61 4.4 0.48 0.046 4.80E-03 0.053 1.60E-03 4.23E-03 0.034 0.14 0.031 13.25 7.04 1.71 1.09 0.04 0.04 0.042 0.94 0.575 8
采用Design-Expert 8.0.6软件对表3试验结果进行多元拟合回归分析,得到各因素与响应值的多元二次回归方程:
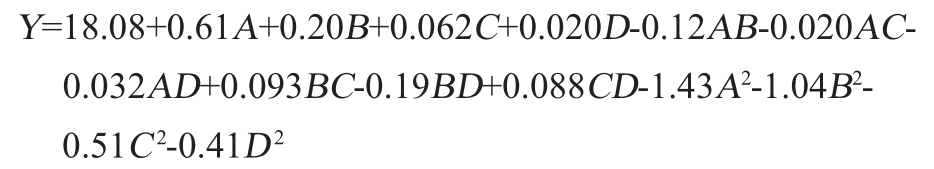
由表4可知,该模型的P值<0.000 1,极显著,失拟项P值为0.575 8>0.05,不显著,说明模型可靠。模型的决定系数R2=0.975 5,调整决定系数R2Adj=0.951 0,说明试验模型的拟合程度良好,能够很好地描述试验的结果[32]。由表4亦可知,一次项A、B及二次项A2、B2、C2、D2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05),根据F值可知,影响重组菌株马克斯克鲁维酵母TY20-HXT14胞内RNA含量的4个因素的主效应关系为A>B>C>D,即乳糖添加量>酵母浸粉添加量>磷酸二氢钾添加量>硫酸镁添加量。
采用Design-Expert 8.0.6软件对回归方程进行最优求解,得到重组菌株马克斯克鲁维酵母TY20-HXT14富集RNA的最优发酵培养基组成:乳糖添加量14.48%,酵母浸粉添加量1.04%,磷酸二氢钾添加量为0.31%,硫酸镁添加量0.20%,RNA含量预测值为18.15%。在此培养基组成下进行3次验证试验,重组菌株TY20-HXT14的胞内RNA含量达到18.04%,与理论预测值吻合良好,说明该模型可以很好的预测RNA的含量,响应面优化试验的方法具有可靠性。
3 结论
本研究以可利用乳糖的K.marxianus TY20为亲本菌株,采用同源重组技术过表达己糖转运蛋白基因HXT14、HXT15,构建重组菌株TY20-HXT14、TY20-HXT15,其中,重组菌株TY20-HXT14的生长性能较好、胞内RNA含量最高,其在乳糖培养基中培养至对数期(OD600nm=1.000)时,胞内RNA含量较亲本菌株TY-20提高14.48%。以胞内RNA含量为评价指标,采用单因素试验及响应面试验确定重组菌株TY20-HXT14的最佳发酵培养基配方为:乳糖添加量14.8%;酵母浸粉添加量1.04%;磷酸二氢钾添加量为0.31%;硫酸镁添加量0.20%。在此优化条件下,重组菌株TY20-HXT14胞内的RNA含量达到18.04%,与优化前相比提高了26.77%。本研究为RNA的工业生产提供了高效可行的新手段。
[1]黄芳,李欣,李沛,等.富核糖核酸热带假丝酵母发酵培养基优化[J].中国酿造,2019,38(6):35-42.
[2]宿安琪.调控枯草芽孢杆菌比生长速率强化核糖核酸合成[D].无锡:江南大学,2021.
[3]彭小芳,朱建军.酵母核苷酸的生理作用及其在养猪生产中的应用[J].湖南饲料,2011(4):16-19,9.
[4]丁庆豹,邱蔚然.核酸类产品的生物合成[M].上海:华东理工出版社,2006:106.
[5]王夏怡,许卉.寡核苷酸药物生物分析方法的研究进展[J].广东化工,2024,51(6):131-133.
[6]郑洲松,黄燕,黄泽炳.母婴阻断中抗乙型肝炎病毒药物核苷(酸)类似物的治疗进展[J].中国药理学通报,2023,39(12):2221-2224.
[7]陆丹娟,曲晨箫,李德瑶,等.反义寡核苷酸药物在慢性乙型肝炎治疗中的应用前景[J].中国病毒病杂志,2023,13(6):447-453.
[8]邵婉璇,樊渝川,殷涵,等.抗心血管疾病的反义核酸药物研究进展[J].生命科学仪器,2023,21(4):1-8.
[9]罗婷,霍春晓,周天华,等.治疗遗传病的RNA药物研究进展[J].浙江大学学报(医学版),2023,52(4):406-416.
[10]依文彦博.利用反义寡核苷酸抑制登革病毒复制的实验研究[D].北京:军事科学院,2023.
[11]王年久.呈味核苷酸在酱油中溶解稳定性研究及其感官分析[J].湖北农业科学,2022,61(20):133-135,140.
[12]BRAMLETT M, PLAETINCK G, MAIENFISCH P.RNA-based biocontrols-A new paradigm in crop protection[J].Engineering,2020,6(5):522-527.
[13]ZHU H, LI J, ZHANG X B, et al.Nucleic acid aptamer-mediated drug delivery for targeted cancer therapy[J].Chem Med Chem,2015,10(1):39-45.
[14]CHOUDHURY D,PAL A K,SAHU N P,et al.Dietary yeast RNA supplementation reduces mortality by Aeromonas hydrophila in rohu juveniles[J].Fish Shellfish Immunol,2005,19(3):281-291.
[15]MORRISSEY L.Kluyveromyces marxianus:A yeast emerging from its sister's shadow[J].Fungal Biol Rev,2010,24(1-2):17-26.
[16]LERTWATTANASAKUL N,KOSAKA T,HOSOYAMA A,et al.Genetic basis of the highly efficient yeast Kluyveromyces marxianus:Complete genome sequence and transcriptome analyses[J].Biotechnol Biof,2015,8(1):47.
[17]KOUTINAS A A,PAPAPOSTOLOU H,DIMITRELLOU D,et al.Whey valorization: A complete and novel technology development for dairy industry starter culture production[J].Biores Technol, 2009, 99(15):3734-3739.
[18]卢鑫.引起酸奶涨包的马克斯克鲁维酵母的分离鉴定及特性研究[D].保定:河北农业大学,2009.
[19]MARGARIDA P,MARIE-LINE S,BARET P V.Combined phylogenetic and neighbourhood analysis of the hexose transporters and glucose sensors in yeasts[J].Fems Yeast Res,2010,9(4):526-534.
[20]WIECZORKE R, KRAMPE S, WEIERSTALL T, et al.Concurrent knock-out of at least 20 transporter genes is required to block uptake of hexoses in Saccharomyces cerevisiae[J].Febs Lett,1999,464(3):123-128.
[21]REIFENBERGER E,FREIDEL K,CIRIACY M.Identification of novel HXT genes in Saccharomyces cerevisiae reveals the impact of individual hexose transporters on qlycolytic flux[J].Mol Microbiol,2010,16(1):157-167.
[22]石文琪.高产风味酯酿酒酵母菌株的选育[D].天津:天津科技大学,2023.
[23]BELEM M,LEE B H.Fed-batch fermentation to produce oligonucleotides from Kluyveromyces marxianus grown on whey[J].Proc Biochem,1999,34(5):501-509.
[24]GUO X W, ZHAO B, ZHOU X R, et al.Increased RNA production in Saccharomyces cerevisiae by simultaneously overexpressing FHL1,IFH1 and SSF2 and deleting HRP1[J].Appl Microbiol Biot,2020,104(18):1-13.
[25]GUO X W,ZHAO B,ZHOU X R,et al.Analysis of the molecular basis of Saccharomyces cerevisiae mutant with high nucleic acid content by comparative transcriptomics[J].Food Res Int,2021,142:110188.
[26]林福来,周洪波,郑甲,等.RT-PCR检测毕赤酵母外源β-甘露聚糖酶基因拷贝数[J].生物加工过程,2014,12(5):46-50.
[27]袁越锦,赵旭彤,熊奉奎,等.响应面法优化酿酒酵母培养基及培养条件[J].中国酿造,2023,42(8):158-165.
[28]俞灿,郑国斌,姚娟,等.富含核糖核酸酿酒酵母的选育及其高密度发酵工艺[J].中国酿造,2016,35(12):66-71.
[29]倪晓丰,赵宾,王东旭,等.硫酸二乙酯化学诱变选育高核糖核酸酿酒酵母及培养基组成优化[J].中国酿造,2018,37(8):32-36.
[30]原梦梦,李金宸,李贺贺,等.氮源对葡萄酒酵母发酵性能影响的研究进展[J].中国酿造,2023,42(2):1-9.
[31]黄芳.富核糖核酸热带假丝酵母的发酵工艺研究[D].武汉:湖北工业大学,2021.
[32]刘羽暄,杜慧,张换平,等.响应面分析法和单因素分析法优化艾草中黄酮类物质的提取条件[J].理化检验(化学分册),2020,56(6):635-640.