多酚类物质是指含有一个或多个与苯环相连的羟基化合物,是葡萄果实生长发育过程中产生的一种次级代谢产物,广泛的存在于葡萄果皮、果肉、果梗、种籽等组织中[1]。不同类型的酚类化合物赋予葡萄和葡萄酒特定的品质特征,赋予葡萄及葡萄酒颜色、味嗅觉结构感(涩味、苦味、香气)及营养价值,可彰显葡萄及葡萄酒的品质,并且还具有抑菌、抗氧化、预防心血管疾病、抗癌、延缓衰老等生物活性功能[2-6]。光照对果穗中花色苷的积累及葡萄酒的颜色有积极的影响[7-8],若光照不足,花色苷积累降低[9]。充足的光照有利于葡萄叶片进行光合作用,促进花色苷和类黄酮物质合成,利于葡萄坐果、着色及有机物的合成[10-11]。摘叶将直接影响葡萄冠层的小气候,调控葡萄浆果中的初级代谢物和次级代谢物[12]。PONI S等[13]研究认为,在花期进行摘叶处理,会降低坐果率并使果粒变小,但有助于改善葡萄酒颜色、香气和收敛性。黄土高原产区于浆果转色期摘叶,提高了果实花色苷等酚类物质的含量[14-16]。通过改进光照影响酿酒葡萄的果实品质,进而有利于葡萄酒的香气物质及异戊二烯类化合物的合成[17]。但也有研究认为,应避免葡萄膨大期进行摘叶处理,因为这样不仅导致葡萄品质下降[18],而且还会导致减产[19]。摘除结果枝基部5~6片叶,能显著提高黄酮醇含量、促进花色苷的积累,其中黄酮醇受到的影响最大[20]。综合来看,不同地区因生态因素的差异,摘叶对果实品质影响的研究结果也不一致。品丽珠是酿酒葡萄的优良品种之一,因其适应性强、耐干旱、抗病性好而广泛种植于贺兰山东麓产区。在葡萄酒酿造中,品丽珠通常用于生产口感柔和、单宁结构稳定、香气复杂的红葡萄酒,具有显著的陈年潜力。基于品丽珠在贺兰山东麓产区葡萄酒品质中的重要性,本研究以宁夏贺兰山东麓葡萄酒产区贺金樽酒庄的品丽珠(Vitis vinifera cv.Cabernet Franc)为试材,于浆果转色初期、完成期和完成后2周分别摘除新梢基部2片叶、4片叶和6片叶,比较不同处理的成熟葡萄果实中的酚类物质差异。旨在筛选适宜于贺兰山东麓产区酿酒葡萄新梢基部摘叶最佳的方法,为提高产区酿酒葡萄果实品质及葡萄酒质量奠定理论和技术基础。
1 材料与方法
1.1 材料与试剂
宁夏贺兰山东麓葡萄产区位于105°45′~106°27′E、37°43′~39°05 N之间,海拔1 124 m~1 432 m,属于典型的大陆性干旱半干旱气候,该区光能热量充足,全年日照时数2 851~3 106 h,有效积温3 300 ℃左右,年降水量不足200 mm,平均无霜期170 d。本试验在贺兰小产区的贺金樽酒庄酿酒葡萄基地进行,贺兰小产区为地处贺兰山苏峪口北侧,砾石土壤,质地疏松,通气性良好。供试品种为品丽珠(Vitis vinifera cv.Cabernet Franc),2014年定植,株行距0.8 m×3.5 m,单篱架厂字型树形,南北行向。
乙腈、甲酸、甲醇(均为色谱纯):德国Merck公司;福林酚、氢氧化钠、无水硫酸铜、甲基纤维素、氯化铝、甲酸、盐酸、甲醇、乙酸乙酯、硫酸铵、氯化钾、醋酸钠、亚硝酸钠(均为分析纯):天津科密欧化学试剂有限公司;芦丁、(+)-儿茶素、没食子酸标准品(纯度均>98%):美国Sigma公司。
1.2 仪器与设备
FD5-2.5E冷冻干燥机:美国SIM公司;KQ-300DE型数控超声波清洗器:昆山超声仪器有限公司;5804R离心机:德国Eppendorf公司;Centrivap离心浓缩仪:美国Labconco公司;UV-1800紫外/可见分光光度计、LC-20A高效液相色谱仪、LC-2030高效液相色谱仪:日本岛津公司。
1.3 方法
1.3.1 田间处理
摘叶处理:在浆果转色初期(5%果粒着色)、转色完成期(100%果粒着色)、转色完成后2周分别摘除新梢基部2片叶、4片叶及6片叶,以不摘叶作为对照(CK),共10个处理方案见表1,每个处理30株、3个重复。
表1 酿酒葡萄新梢基部摘叶处理方案
Table 1 Leaf removal treatments scheme of new shoots base of wine grape
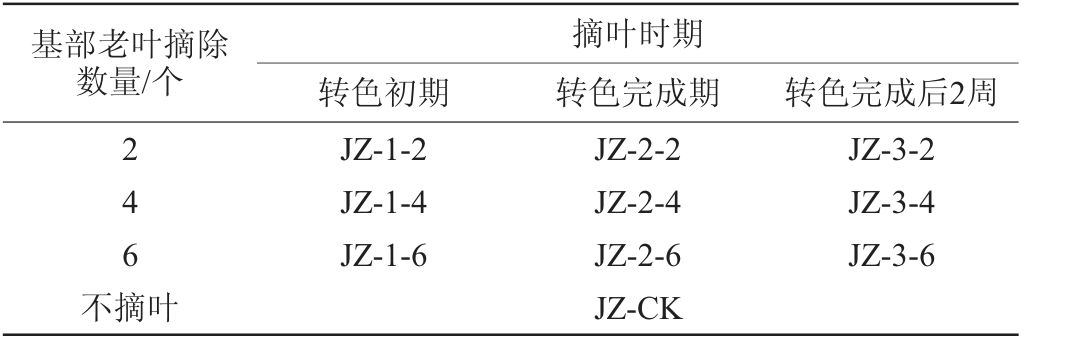
基部老叶摘除数量/个转色初期摘叶时期转色完成期转色完成后2周246 JZ-1-2 JZ-1-4 JZ-1-6 JZ-3-2 JZ-3-4 JZ-3-6不摘叶JZ-2-2 JZ-2-4 JZ-2-6 JZ-CK
1.3.2 样品采集
在浆果成熟进程(糖酸变化)监控的基础上,参照《葡萄种质资源描述规范》,当种子完全变褐、果实可溶性固形物及总酸在连续5 d内基本不再增加,即对试验处理进行取样。当天早上8∶00~10∶00 采样,每个处理随机采集21穗,立即带回实验室带梗剪下果粒,随机混匀,其中一部分果粒榨成果汁直接用于测定果实基本理化指标,另外随机选取100个果粒置于-40 ℃储存备用。
1.3.3 分析检测
(1)酚类物质含量的测定
总酚含量:采用福林-肖卡法[21]测定,结果以没食子酸当量(gallic acid equivalent,GAE)表示;总花色苷含量采用pH示差法[22]测定,结果以二甲花翠素葡萄糖苷当量(dimethylflorin glucoside equivalent,DGE)表示;总单宁采用甲基纤维素沉淀法[23]测定,结果以儿茶素当量(catechin equivalent,CE)表示;总黄酮采用亚硝酸盐-氯化铝法[24]测定,结果以芦丁当量(rutin equivalent,RE)表示;总黄烷醇含量采用对二甲基肉桂酸(ρ-dimethyl cinnamic acid,ρ-DMACA)-盐酸法测定,结果以(+)-儿茶素当量(catechin equivalent,CE)表示。
(2)酚类物质组分的测定
果皮花色苷物质组分提取参照YIN H N等[25]的方法,定性定量分析参照YANG P等[26]的方法,其含量以葡萄皮干粉中二甲花翠素-3-O-葡萄糖苷当量(dimethylidene-3-O-glucoside equivalent,DGE)表示;果皮非花色苷酚类物质组分提取参照赵宇等[27]的方法,定性定量分析参照YANG B H等[28]的方法。
1.3.4 数据处理
所有数据结果以“平均值±标准差”(n=3)表示。Microsoft Office Excel 2019进行数据整理及基本统计分析;PASW Statistics 18.0进行单因素方差分析,采用Duncan法进行处理间均值的多重比较(P<0.05表示差异显著)。
2 结果与分析
2.1 新梢基部摘叶处理对果实基本品质指标的影响
品丽珠新梢基部摘叶处理对果实基本品质的影响结果见表2。由表2可知,不同时期及强度的摘叶处理对品丽珠有不同效果,可溶性固形物含量、可滴定酸含量、pH和百粒质量均存在明显差异。摘叶处理组的果汁pH均低于CK组,且处理组JZ-2-6的pH值最低。除处理组JZ-2-2和JZ-3-4外,其余处理组的可溶性固形物含量均显著高于CK组(P<0.05),转色初期摘除基部叶片的可溶性固形物含量随着摘叶强度的提高而增加,且摘除6片基叶的可溶性固形物含量最高,达到28.73°Bx。转色初期摘叶的可滴定酸含量随着摘叶程度的提高呈现下降趋势,JZ-1-6处理组可滴定酸含量最低。综上,JZ-1-6处理在提高糖含量、降低可滴定酸含量方面效果最好。与CK组相比,其可溶性固形物含量提高了4.47%,可滴定酸含量降低了8.83%。
表2 品丽珠新梢基部摘叶处理对果实基本品质的影响
Table 2 Effect of leaf removal treatments at the new shoots base of Cabernet Franc on basic quality of grape fruits
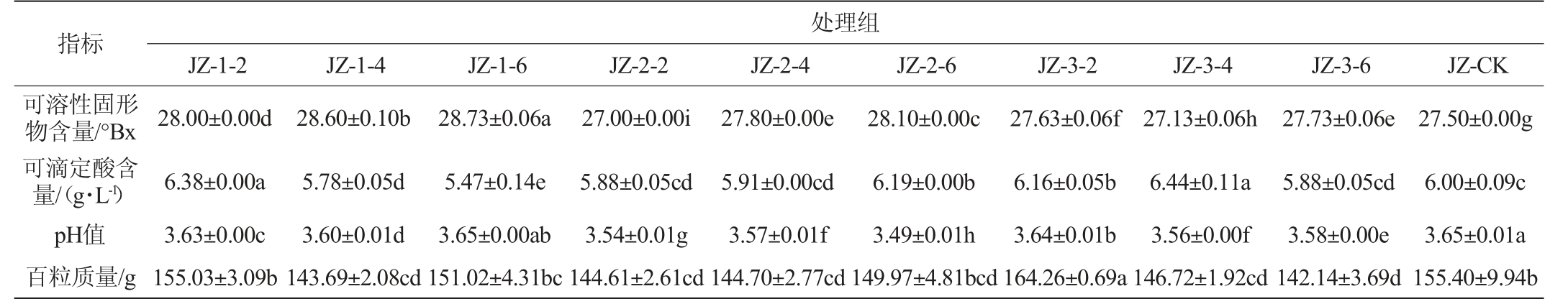
注:不同小写字母表示差异显著(P<0.05)。下同。
指标处理组JZ-1-2JZ-1-4JZ-1-6JZ-2-2JZ-2-4JZ-2-6JZ-3-2JZ-3-4JZ-3-6JZ-CK可溶性固形物含量/°Bx可滴定酸含量/(g·L-1)pH值百粒质量/g 28.00±0.00d 6.38±0.00a 3.63±0.00c 155.03±3.09b 28.60±0.10b 5.78±0.05d 3.60±0.01d 143.69±2.08cd 28.73±0.06a 5.47±0.14e 3.65±0.00ab 151.02±4.31bc 27.00±0.00i 5.88±0.05cd 3.54±0.01g 144.61±2.61cd 27.80±0.00e 5.91±0.00cd 3.57±0.01f 144.70±2.77cd 28.10±0.00c 6.19±0.00b 3.49±0.01h 149.97±4.81bcd 27.63±0.06f 6.16±0.05b 3.64±0.01b 164.26±0.69a 27.13±0.06h 6.44±0.11a 3.56±0.00f 146.72±1.92cd 27.73±0.06e 5.88±0.05cd 3.58±0.00e 142.14±3.69d 27.50±0.00g 6.00±0.09c 3.65±0.01a 155.40±9.94b
2.2 新梢基部摘叶处理对果实酚类物质含量的影响
品丽珠新梢基部摘叶处理对果实酚类物质含量的影响结果见图1。由图1可知,新梢基部摘叶能显著提高品丽珠果实的总酚、花色苷、黄烷醇和类黄酮含量。处理组JZ-2-4对果实总酚含量提升效果最显著,其含量达到了41.08 mg/g,较CK的36.87 mg/g提高了11.42%,其次是处理组JZ-2-6,达到了41.06 mg/g,较CK提高了11.31%。处理组JZ-2-4和JZ-2-6对果实单宁、花色苷、黄烷醇和类黄酮的提高均显著高于其他处理。在所有处理中,浆果转色完成期摘除新梢基部6片叶的处理对果实花色苷和单宁含量的提升程度最大,较CK分别提高了32.94%和28.51%。新梢基部摘叶处理的果实黄烷醇和类黄酮含量均处于较高水平,尤其是处理JZ-2-4,其黄烷醇和类黄酮的含量分别是CK的1.36和1.43倍。综上所述,JZ-2-4和JZ-2-6摘叶处理在提高酚类物质含量方面效果最好,特别是JZ-2-6处理对花色苷和单宁含量的提升尤为显著。这可能是由于摘叶处理改善了葡萄冠层的光照条件,增加了叶片间的通风效果,进一步优化了果实表面小气候,从而促进了酚类物质的生物合成。光照充足时,葡萄叶片的光合作用增强,增加了可利用的碳源,为次级代谢物(如花色苷和黄烷醇)的合成提供了充足前体物质。

图1 品丽珠新梢基部摘叶处理对果实酚类物质含量的影响
Fig.1 Effect of leaf removal treatments at the new shoots base of Cabernet Franc on phenols contents in grape fruits
2.3 新梢基部摘叶处理对果皮花色苷组分及含量的影响
2.3.1 新梢基部摘叶对果皮单体花色苷总量的影响
品丽珠新梢基部摘叶处理对果实花色苷组分含量影响结果见表3。
表3 品丽珠新梢基部摘叶处理对果皮花色苷组分含量的影响
Table 3 Effect of leaf removal treatments at the new shoots base of Cabernet Franc on anthocyanin contents in pericarp mg/kg
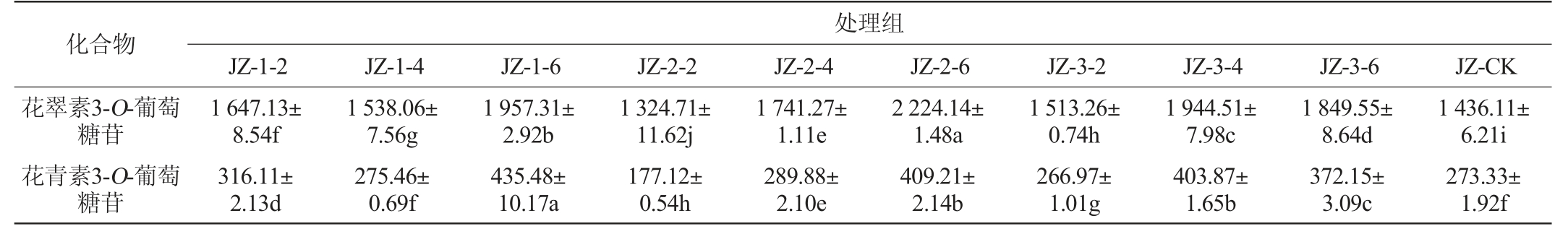
化合物处理组JZ-1-2JZ-1-4JZ-1-6JZ-2-2JZ-2-4JZ-2-6JZ-3-2JZ-3-4JZ-3-6JZ-CK花翠素3-O-葡萄糖苷花青素3-O-葡萄糖苷1 647.13±8.54f 316.11±2.13d 1 538.06±7.56g 275.46±0.69f 1 957.31±2.92b 435.48±10.17a 1 324.71±11.62j 177.12±0.54h 1 741.27±1.11e 289.88±2.10e 2 224.14±1.48a 409.21±2.14b 1 513.26±0.74h 266.97±1.01g 1 944.51±7.98c 403.87±1.65b 1 849.55±8.64d 372.15±3.09c 1 436.11±6.21i 273.33±1.92f
续表
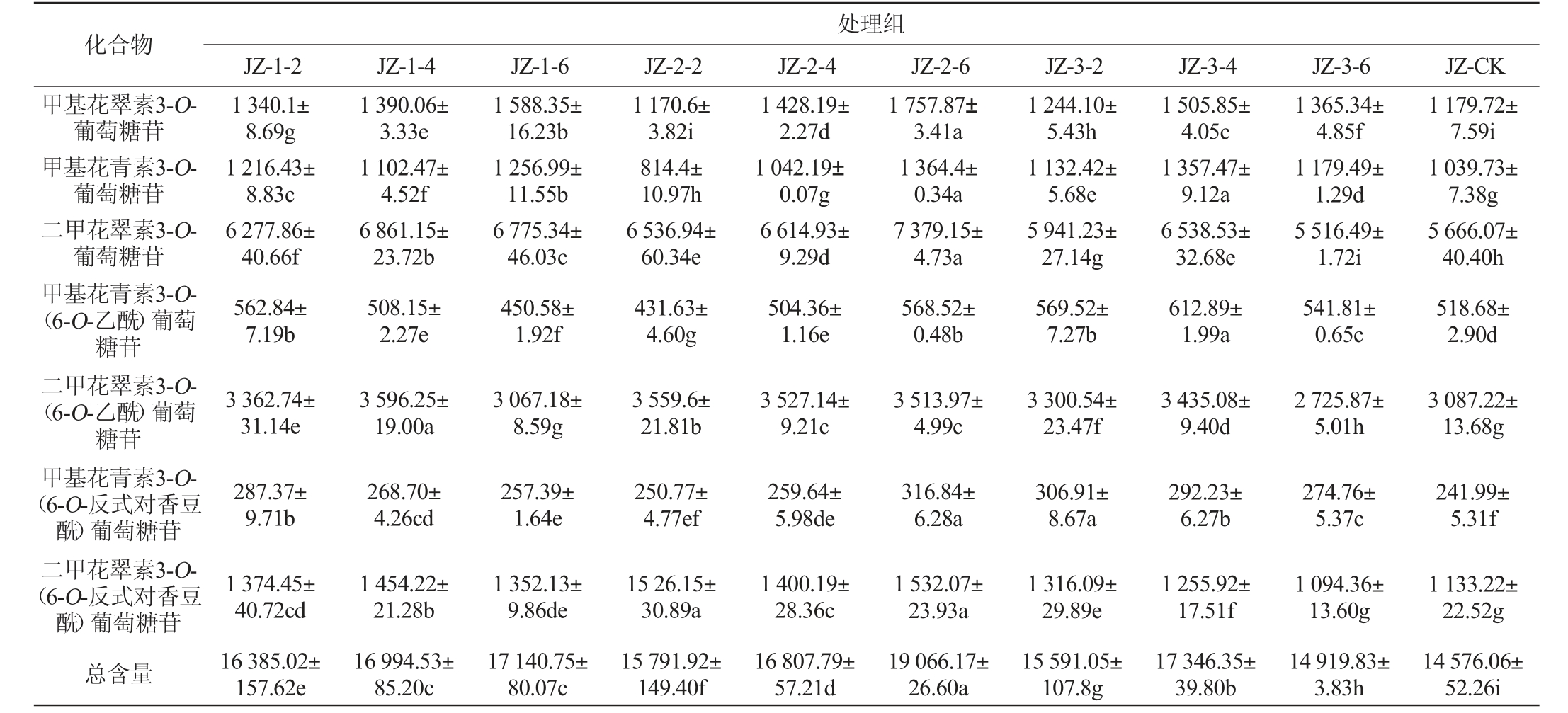
化合物处理组JZ-1-2JZ-1-4JZ-1-6JZ-2-2JZ-2-4JZ-2-6JZ-3-2JZ-3-4JZ-3-6JZ-CK甲基花翠素3-O-葡萄糖苷甲基花青素3-O-葡萄糖苷二甲花翠素3-O-葡萄糖苷甲基花青素3-O-(6-O-乙酰)葡萄糖苷二甲花翠素3-O-(6-O-乙酰)葡萄糖苷甲基花青素3-O-(6-O-反式对香豆酰)葡萄糖苷二甲花翠素3-O-(6-O-反式对香豆酰)葡萄糖苷总含量1 340.1±8.69g 1 216.43±8.83c 6 277.86±40.66f 562.84±7.19b 1 390.06±3.33e 1 102.47±4.52f 6 861.15±23.72b 508.15±2.27e 1 588.35±16.23b 1 256.99±11.55b 6 775.34±46.03c 450.58±1.92f 1 170.6±3.82i 814.4±10.97h 6 536.94±60.34e 431.63±4.60g 1 428.19±2.27d 1 042.19±0.07g 6 614.93±9.29d 504.36±1.16e 1 757.87±3.41a 1 364.4±0.34a 7 379.15±4.73a 568.52±0.48b 1 244.10±5.43h 1 132.42±5.68e 5 941.23±27.14g 569.52±7.27b 1 505.85±4.05c 1 357.47±9.12a 6 538.53±32.68e 612.89±1.99a 1 365.34±4.85f 1 179.49±1.29d 5 516.49±1.72i 541.81±0.65c 1 179.72±7.59i 1 039.73±7.38g 5 666.07±40.40h 518.68±2.90d 3 362.74±31.14e 3 596.25±19.00a 3 067.18±8.59g 3 559.6±21.81b 3 527.14±9.21c 3 513.97±4.99c 3 300.54±23.47f 3 435.08±9.40d 2 725.87±5.01h 3 087.22±13.68g 287.37±9.71b 268.70±4.26cd 257.39±1.64e 250.77±4.77ef 259.64±5.98de 316.84±6.28a 306.91±8.67a 292.23±6.27b 274.76±5.37c 241.99±5.31f 1 374.45±40.72cd 16 385.02±157.62e 1 454.22±21.28b 16 994.53±85.20c 1 352.13±9.86de 17 140.75±80.07c 15 26.15±30.89a 15 791.92±149.40f 1 400.19±28.36c 16 807.79±57.21d 1 532.07±23.93a 19 066.17±26.60a 1 316.09±29.89e 15 591.05±107.8g 1 255.92±17.51f 17 346.35±39.80b 1 094.36±13.60g 14 919.83±3.83h 1 133.22±22.52g 14 576.06±52.26i
由表3可知,所有处理组共检出花翠素3-O-葡萄糖苷等9种花色苷单体,包括5种基本花色苷、2种乙酰化花色苷和2种香豆酰化花色苷。与对照相比,所有摘叶处理组均显著提高了葡萄果皮中9种单体花色苷的总含量(P<0.05),其中处理组JZ-2-6、JZ-3-4、JZ-1-6、JZ-1-4、JZ-2-4、JZ-1-2分别较CK提高了30.81%、19.01%、17.60%、16.59%、15.31%和12.41%。其中处理组JZ-2-6在提高果皮单体花色苷总量方面效果最好。这可能是因为转色期摘叶增强了葡萄果穗光照,进而激活了相关的花色苷合成酶基因表达,进一步促进了花色苷的积累。
2.3.2 新梢基部摘叶对果皮不同类型花色苷的影响
品丽珠新梢基部不同摘叶处理对果皮中不同类型花色苷占比影响结果见图2。由图2可知,所有摘叶处理组果皮内甲基化花色苷的占比最高,占单体花色苷总量的53.35%~56.13%,处理组JZ-1-6、JZ-2-6、JZ-1-4较CK较大幅度的提高甲基化花色苷的占比,其中处理组JZ-1-6占比增加了2.03个百分点。果皮内乙酰化花色苷占单体花色苷总量的20.52%~25.27%,除处理组JZ-2-2和JZ-3-2外,其他摘叶处理组较CK,乙酰化花色苷占比略有降低。CK和各处理组的香豆酰化花色苷占单体花色苷总量的8.92%~11.25%。除处理组JZ-1-6、JZ-3-4和JZ-3-4外,其他摘叶处理组香豆酰化花色苷占比有所提高,其中处理组JZ-2-2占比增加了1.72%。CK和各处理组的果皮内糖基化花色苷占单体花色苷总量的9.51%~14.89%,处理组JZ-2-2、JZ-1-4和JZ-3-2降低了糖基化花色苷占比,而其他摘叶处理组则增加了其占比。JZ-1-6 和JZ-2-6摘叶处理对果皮花色苷质量的提升效果最佳。这可能是因为摘除新梢基部6片叶后,改善了果实表面的小气候和光照条件,促进了甲基化花色苷的合成。这种花色苷成分的优化有利于提高果实和葡萄酒的色泽稳定性、抗氧化性和结构感。
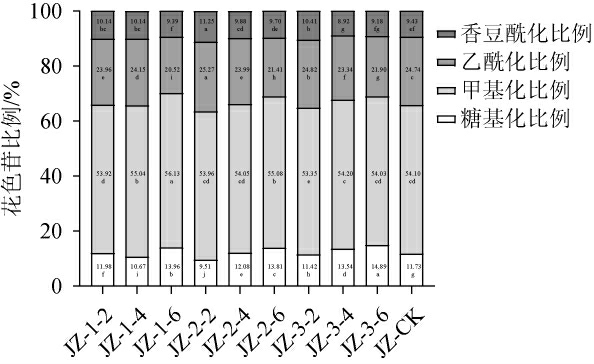
图2 品丽珠新梢基部摘叶处理对果皮不同类型花色苷的占比的影响
Fig.2 Effect of leaf removal treatments at the new shoots base of Cabernet Franc on the proportion of different types of anthocyanins in pericarp
2.4 新梢基部摘叶对果实非花色苷酚类物质组分的影响
2.4.1 新梢基部摘叶对果实非花色苷酚类物质总量的影响
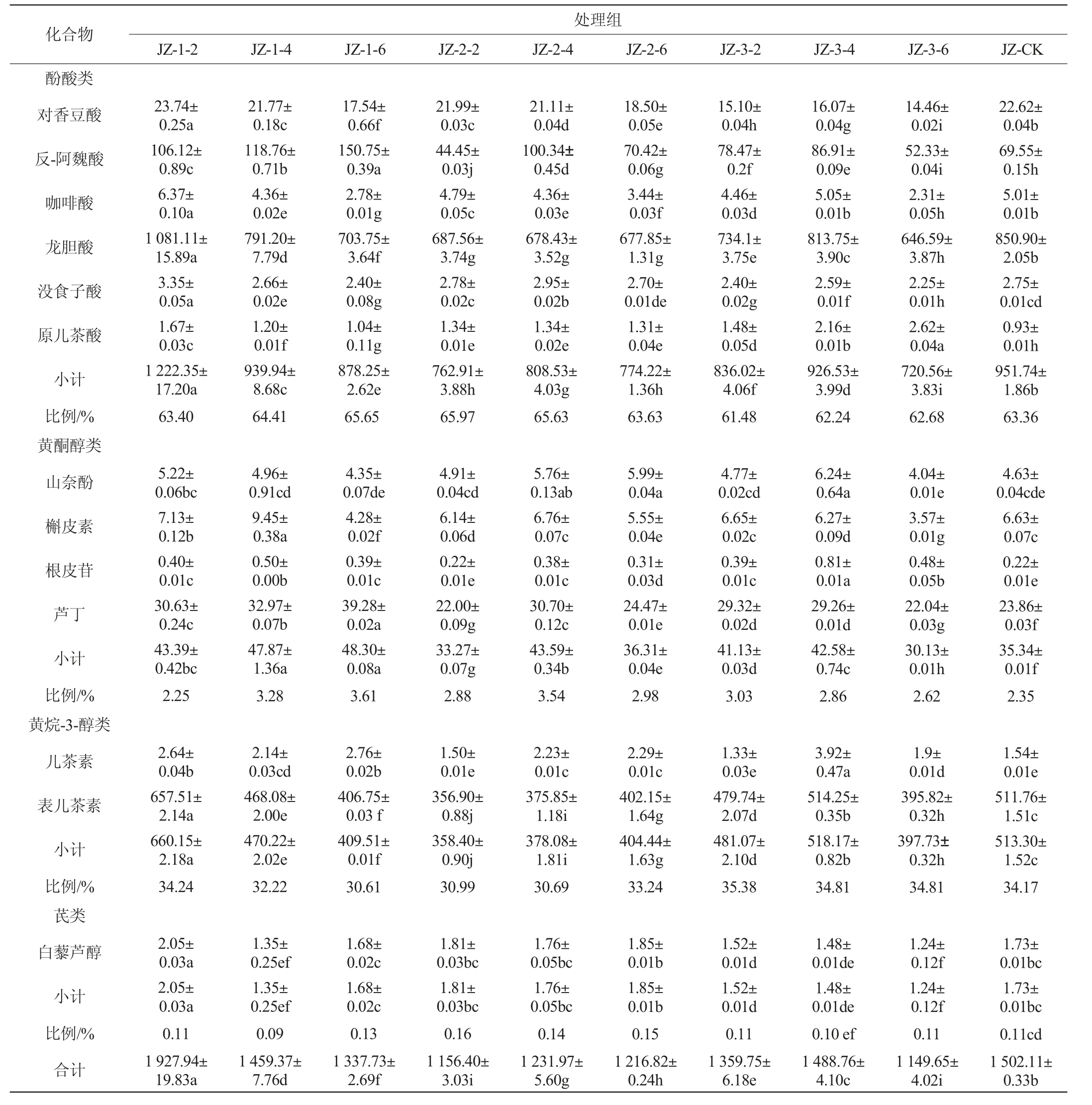
品丽珠新梢基部摘叶的果实非花色苷酚类物质组分及含量测定结果见表4。由表4可知,所有处理组共检测出13种单体酚类物质,其中酚酸类、黄烷-3-醇类、黄酮醇类和芪类物质分别占单体酚总量的61.48%~65.97%、30.61%~35.38、2.25%~3.61%、0.09%~0.16%。处理组JZ-1-2较CK使酚酸类物质含量提高了28.43%,其他摘叶处理组低于对照;浆果转色完成后2周的摘叶处理对黄烷-3-醇类物质含量影响不大,其他摘叶处理组则使其含量略有降低;所有摘叶处理组均能提高黄酮醇类物质的含量,中早期摘叶处理则能提高芪类物质的含量。
表4 品丽珠新梢基部摘叶处理对果实非花色苷酚类物质的组分及含量的影响
Table 4 Effect of leaf removal treatments at the new shoots base of Cabernet Franc grape fruits on the non-anthocyanins components and contents mg/kg
化合物处理组JZ-1-2JZ-1-4JZ-1-6JZ-2-2JZ-2-4JZ-2-6JZ-3-2JZ-3-4JZ-3-6JZ-CK酚酸类对香豆酸反-阿魏酸咖啡酸龙胆酸没食子酸原儿茶酸小计比例/%黄酮醇类山奈酚槲皮素根皮苷芦丁小计比例/%黄烷-3-醇类儿茶素表儿茶素小计比例/%芪类白藜芦醇小计比例/%合计23.74±0.25a 106.12±0.89c 6.37±0.10a 1 081.11±15.89a 3.35±0.05a 1.67±0.03c 1 222.35±17.20a 63.40 21.77±0.18c 118.76±0.71b 4.36±0.02e 791.20±7.79d 2.66±0.02e 1.20±0.01f 939.94±8.68c 64.41 17.54±0.66f 150.75±0.39a 2.78±0.01g 703.75±3.64f 2.40±0.08g 1.04±0.11g 878.25±2.62e 65.65 21.99±0.03c 44.45±0.03j 4.79±0.05c 687.56±3.74g 2.78±0.02c 1.34±0.01e 762.91±3.88h 65.97 21.11±0.04d 100.34±0.45d 4.36±0.03e 678.43±3.52g 2.95±0.02b 1.34±0.02e 808.53±4.03g 65.63 18.50±0.05e 70.42±0.06g 3.44±0.03f 677.85±1.31g 2.70±0.01de 1.31±0.04e 774.22±1.36h 63.63 15.10±0.04h 78.47±0.2f 4.46±0.03d 734.1±3.75e 2.40±0.02g 1.48±0.05d 836.02±4.06f 61.48 16.07±0.04g 86.91±0.09e 5.05±0.01b 813.75±3.90c 2.59±0.01f 2.16±0.01b 926.53±3.99d 62.24 14.46±0.02i 52.33±0.04i 2.31±0.05h 646.59±3.87h 2.25±0.01h 2.62±0.04a 720.56±3.83i 62.68 22.62±0.04b 69.55±0.15h 5.01±0.01b 850.90±2.05b 2.75±0.01cd 0.93±0.01h 951.74±1.86b 63.36 5.22±0.06bc 7.13±0.12b 0.40±0.01c 30.63±0.24c 43.39±0.42bc 2.25 4.96±0.91cd 9.45±0.38a 0.50±0.00b 32.97±0.07b 47.87±1.36a 3.28 4.35±0.07de 4.28±0.02f 0.39±0.01c 39.28±0.02a 48.30±0.08a 3.61 4.91±0.04cd 6.14±0.06d 0.22±0.01e 22.00±0.09g 33.27±0.07g 2.88 5.76±0.13ab 6.76±0.07c 0.38±0.01c 30.70±0.12c 43.59±0.34b 3.54 5.99±0.04a 5.55±0.04e 0.31±0.03d 24.47±0.01e 36.31±0.04e 2.98 4.77±0.02cd 6.65±0.02c 0.39±0.01c 29.32±0.02d 41.13±0.03d 3.03 6.24±0.64a 6.27±0.09d 0.81±0.01a 29.26±0.01d 42.58±0.74c 2.86 4.04±0.01e 3.57±0.01g 0.48±0.05b 22.04±0.03g 30.13±0.01h 2.62 4.63±0.04cde 6.63±0.07c 0.22±0.01e 23.86±0.03f 35.34±0.01f 2.35 2.64±0.04b 657.51±2.14a 660.15±2.18a 34.24 2.14±0.03cd 468.08±2.00e 470.22±2.02e 32.22 2.76±0.02b 406.75±0.03 f 409.51±0.01f 30.61 1.50±0.01e 356.90±0.88j 358.40±0.90j 30.99 2.23±0.01c 375.85±1.18i 378.08±1.81i 30.69 2.29±0.01c 402.15±1.64g 404.44±1.63g 33.24 1.33±0.03e 479.74±2.07d 481.07±2.10d 35.38 3.92±0.47a 514.25±0.35b 518.17±0.82b 34.81 1.9±0.01d 395.82±0.32h 397.73±0.32h 34.81 1.54±0.01e 511.76±1.51c 513.30±1.52c 34.17 2.05±0.03a 2.05±0.03a 0.11 1 927.94±19.83a 1.35±0.25ef 1.35±0.25ef 0.09 1 459.37±7.76d 1.68±0.02c 1.68±0.02c 0.13 1 337.73±2.69f 1.81±0.03bc 1.81±0.03bc 0.16 1 156.40±3.03i 1.76±0.05bc 1.76±0.05bc 0.14 1 231.97±5.60g 1.85±0.01b 1.85±0.01b 0.15 1 216.82±0.24h 1.52±0.01d 1.52±0.01d 0.11 1 359.75±6.18e 1.48±0.01de 1.48±0.01de 0.10 ef 1 488.76±4.10c 1.24±0.12f 1.24±0.12f 0.11 1 149.65±4.02i 1.73±0.01bc 1.73±0.01bc 0.11cd 1 502.11±0.33b
处理组JZ-1-2果实的白藜芦醇、黄烷醇和黄酮醇类物质较CK显著提高了18.50%、28.61%和22.75%(P<0.05)。浆果转色初期摘除新梢基部叶片均能提高反式阿魏酸、芦丁、原儿茶酸、儿茶素和根皮苷的含量,且摘除6片叶处理的反式阿魏酸和芦丁含量最高,分别较CK提高了116.75%和64.63%。除了原儿茶酸和根皮苷外,处理组JZ-3-6对检测到的其他非花色苷酚类物质没有提升作用,其中没食子酸、对香豆酸、槲皮素、白藜芦醇、龙胆酸、咖啡酸和山奈酚的含量均为最低,因此该处理不利于此类非花色苷酚类物质的合成与积累。综上可知,JZ-1-2相比CK果实非花色苷酚类物质总量显著增加,该处理对提高品丽珠葡萄果实非花色苷酚类物质处理效果最好。
2.4.2 果实非花色苷酚类物质组分的主成分分析及正交偏最小二乘判别分析
果实非花色苷酚类物质组分的主成分分析(principal component analysis,PCA)及正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),结果见图3。由图3a可知,主成分1(PC1)解释了总变量的34.6%,主成分2(PC2)解释了总变量的18.2%。各处理组在PCA图中分布较为分散,说明各处理组和对照之间的差异可以通过PCA进行有效区分。由图3b可知,变量重要性投影(variable important in the projection,VIP)值>1的化合物主要有6种,分别为反式阿魏酸、芦丁、没食子酸、对香豆酸、槲皮素和白藜芦醇。这六种物质为主要差异特征物质。
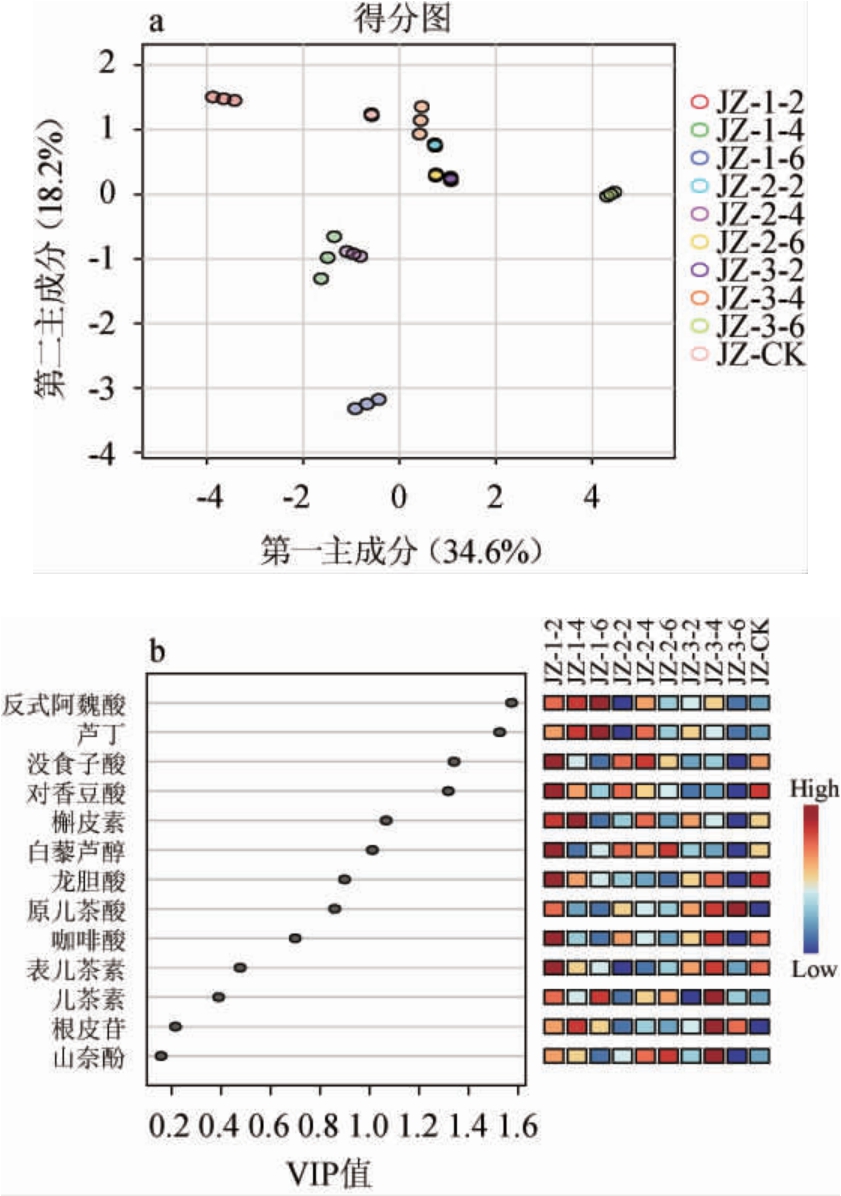
图3 品丽珠新梢基部摘叶处理果实非花色苷酚类物质组分的主成分分析(a)及正交偏最小二乘判别分析(b)
Fig.3 Principal component analysis (a) and orthogonal partial least squares discriminant analysis (b) of non-anthocyanins phenols of Cabernet Franc grape fruits with leaf removal treatments of new shoots
3 结论
新梢基部摘叶对改善贺兰山东麓品丽珠果实着色具有显著的作用。浆果转色初期、转色完成期和转色完成后2周分别摘叶新梢基部2片叶、4片叶和6片叶均显著提高了果实总花色苷含量(P<0.05),其中浆果转色完成期摘除6片叶和转色初期摘除4片叶的效果最佳。同时,三个时期三种摘叶强度的绝大多数处理显著提高了果实总酚、总单宁、总黄烷醇和总类黄酮含量(P<0.05)。
新梢基部摘叶对品丽珠果实酚类物质组分及含量有较大影响。所有摘叶处理均显著提高了果皮9种主要单体花色苷的总含量(P<0.05),多数摘叶处理提高了果皮香豆酰化花色苷、糖基化花色苷所占单体花色苷总量的比例,而对乙酰化花色苷所占比例影响不大;不同摘叶处理对果实非花色苷酚类物质组分的影响不同,摘叶处理与对照果实非花色苷酚类物质组分的差异物质主要是反式阿魏酸、芦丁、没食子酸、对香豆酸、槲皮素和白藜芦醇。
因此,摘叶对于提升贺兰山东麓品丽珠果实花色苷及其他酚类物质含量有显著作用,其中浆果转色完成期摘除6片叶和转色初期摘除4片叶的效果最佳。
[1]牛帅科,赵艳卓,牛早柱,等.葡萄果实中酚类物质研究进展[J].保鲜与加工,2022,22(2):107-112.
[2]KARAPETSAS N, ALEXANDRIDIS T K, BILAS G, et al.Delineating natural terroir units in wine regions using geoinformatics[J].Agriculture,2023,13(3):629.
[3]LU H C,TIAN M B,HAN X,et al.Vineyard soil heterogeneity and harvest date affect volatolomics and sensory attributes of Cabernet Sauvignon wines on a meso-terroir scale[J].Food Res Int,2023,174:113508.
[4]CAPPELLINI F,MARINELLI A, TOCCACELI M, et al.Anthocyanins:from mechanisms of regulation in plants to health benefits in foods[J].Front Plant Sci,2021,12:748049.
[5]朱美蓉,房玉林.葡萄多酚研究进展及其开发利用[J].中国酿造,2015,34(12):1-4.
[6]李旋,毕金峰,刘璇,等.苹果多酚的组成和功能特性研究现状与展望[J].中国食品学报,2020,20(11):328-340.
[7]PALLIOTTI A,GARDIA T,BERRIOSB J G,et al.Early source limitation as a tool for yield control and wine quality improvement in a high-yielding red Vitis vinifera L.cultivar[J].Sci Hortic,2012,145:10-16.
[8]ABD EL-RAZEK E,TREUTTER D,SALEH M M S,et al.Effect of defoliation and fruit thinning on fruit quality of'Crimson Seedless'grape[J].Res J Agr Biol Sci,2010,6:289-295.
[9]LIU M Y,SONG C Z,CHI M,et al.The effects of light and ethylene and their interaction on the regulation of proanthocyanidin and anthocyanin synthesis in the skins of Vitis vinifera berries[J].Plant Growth Regul,2016,79:377-390.
[10]杨亚蒙,韦静波,郭红娜,等.影响葡萄着色的原因及改进措施[J].果树资源学报,2023,4(5):56-58.
[11]马宗桓,姜雪峰,毛娟,等.不同光照强度对‘马瑟兰’葡萄果实发育及着色的影响[J].中外葡萄与葡萄酒,2019(5):47-50,54.
[12]LIKAR M,STRES B,RUSJAN D,et al.Grapevine leaf ionome is shaped by soil factors and plant age[J].Plant Soil Environ,2022,68(9):415-423.
[13]PONI S,CASALINI L,BERNIZZONI F,et al.Effects of early defoliation on shoot photosynthesis, yield components, and grape composition[J].Am J Enol Viticult,2006,57(4):397-407.
[14]赵亚蒙,陈黄曌,乐小凤,等.摘叶处理对酿酒葡萄果实酚类物质的影响[J].中国酿造,2019,38(6):83-89.
[15]YUE X F,JU Y L,TANG Z Z,et al.Effects of the severity and timing of basal leaf removal on the amino acids profiles of Sauvignon Blanc grapes and wines[J].J Integr Agr,2019,18(9):2052-2062.
[16]YUE X F,MA X,TANG Y L,et al.Effect of cluster zone leaf removal on monoterpene profiles of Sauvignon Blanc grapes and wines[J].Food Res Int,2020,131:109028.
[17]ASPROUDI A, PETROZZIELLO M, CAVALLETTO S, et al.Grape aroma precursors in cv.Nebbiolo as affected by vine microclimate[J].Food Chem,2016,211:947-956.
[18]GARRIDO-BAÑUELOS G, BUICA A, DU TOIT W.Relationship between anthocyanins,proanthocyanidins,and cell wall polysaccharides in grapes and red wines.A current state-of-art review[J].Crit Rev Food Sci Nutr,2022,62(28):7743-7759.
[19]PALLIOTTI A,GARDIA T,BERRIOSB J G,et al.Early source limitation as a tool for yield control and wine quality improvement in a highyielding red Vitis vinifera L.cultivar[J].Sci Hortic,2012,145:10-16.
[20]LEMUT M S,TROST K, SIVILOTTI P, et al.Pinot Noir grape colour related phenolics as affected by leaf removal treatments in the Vipava Valley[J].J Food Compos Anal,2011,24(6):777-784.
[21]王华.葡萄酒分析检验[M].北京:中国农业出版社,2011:51-53.
[22]ZHANG X K,JEFFERY D W,LI D M,et al.Red wine coloration:A review of pigmented molecules,reactions,and applications[J].Compr Rev Food Sci Food S,2022,21(5):3834-3866.
[23]BERRUETA L A,RASINES-PEREA Z,PRIETO-PEREA N,et al.Formation and evolution profiles of anthocyanin derivatives and tannins during fermentations and aging of red wines[J].Eur Food Res Technol,2020,246:149-165.
[24]TIAN B, HARRISON R, MORTON J, et al.Changes in pathogenesisrelated proteins and phenolics in Vitis vinifera L.cv.Sauvignon Blanc grape skin and pulp during ripening[J].Sci Hortic,2019,243:78-83.
[25]YIN H N,WANG L,XI Z M.Involvement of anthocyanin biosynthesis of Cabernet Sauvignon grape skins in response to field screening and in vitro culture irradiating infrared radiation[J].J Agr Food Chem,2022,70(40):12807-12818.
[26]YANG P, YUAN C L, WANG H, et al.Stability of anthocyanins and their degradation products from Cabernet Sauvignon red wine under gastrointestinal pH and temperature conditions[J].Molecules,2018,23(2):354.
[27]赵宇,沙青,孔彩琳,等.西北地区干红葡萄酒质量相关理化指标的判别功能解析[J].食品科学技术学报,2021,39(3):129-139.
[28]YANG B H,HE S,LIU Y,et al.Transcriptomics integrated with metabolomics reveals the effect of regulated deficit irrigation on anthocyanin biosyn thesis in Cabernet Sauvignon grape berries[J].Food Chem,2020,314:126170.