人参(Panax ginseng C.A.Mey.)是五加科、人参属多年生草本植物,在我国有数千年的药用历史,有百草之王的美誉,具有补益脾肺、生津养血、安精神、开心益智、除邪气等功效[1-4]。人参的主要活性成分是人参皂苷,目前从人参中分离鉴定了百余种人参皂苷类成分,结构上分为原人参二醇型、原人参三醇型、齐墩果酸型三类,其中人参皂苷如Rg1、Re、Rb1、Rb2、Rc等占人参总皂苷90%以上。稀有人参皂苷比常见人参皂苷具有更高的活性和临床疗效[5-9],但稀有人参皂苷在鲜参中含量较低,将常见人参皂苷转化得到稀有皂苷,可提高人参的药用价值,研究稀有人参皂苷转化方法的主要有物理法[10-11]、化学法[12-13]、微生物法[14-16]。通过酵母菌和乳酸菌对人参进行发酵处理,能显著提高稀有人参皂苷Rg3、Rg3(R)、Rg5的含量。现代研究发现,人参皂苷Rg3对乳腺癌、结肠癌、卵巢癌和胃癌等均有一定的疗效[17-19],且其乙醇提取物具有抗顺铂诱导的肾毒性作用[20];人参皂苷Rg3(R)在抑制乳腺癌细胞增殖、抗增生性瘢痕等方面具有良好的效果[21-23];人参皂苷Rg5对肝癌、宫颈癌和胃癌具有良好的抗增殖作用[24-25]。2020版《中国药典》中,以人参皂苷Rg1、Re、Rb1为人参的指标性成分,文献报道也多以人参、黑参、红参或人参制剂为研究对象,且以含量较高的人参皂苷Rc、Rf作为评价指标,以发酵人参为研究对象且同时检测发酵人参中稀有人参皂苷Rg3、Rg3(R)、Rg5的文献较少。因此,本实验建立高效液相色谱(high performance liquid chromatography,HPLC)同时测定发酵人参中三种稀有人参皂苷Rg3、Rg3(R)、Rg5含量的方法,为发酵人参的质量评价提供依据。
1 材料与方法
1.1 材料与试剂
发酵人参样品:安琪酵母股份有限公司;稀有人参皂苷Rg3对照品(纯度≥99.14%)(批号RDDR01011812017)、稀有人参皂苷Rg3(R)对照品(纯度≥98.76%)(批号RDDR03702208010)、稀有人参皂苷Rg5对照品(纯度≥99.39%)(批号RDDR02502106022):成都瑞芬生物科技有限公司;乙腈、甲醇(均为色谱纯):美国Sigma公司;磷酸(分析纯):国药集团化学试剂有限公司;实验用水为超纯水。
1.2 仪器与设备
Agilent 1260高效液相色谱仪:美国安捷伦科技有限公司;XSR205分析天平:梅特勒-托利多公司;KQ-400DE超声波清洗器:昆山市超声仪器有限公司;Millipore超纯水机:默克化工技术有限公司。
1.3 方法
1.3.1 发酵人参工艺流程及操作要点
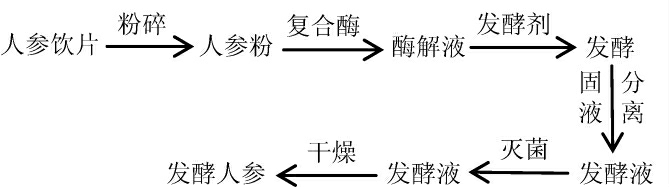
操作要点:将人参饮片机械粉碎后过100目筛,配制成20%的人参粉溶液,然后添加0.5%纤维素酶和1.0%木瓜蛋白酶,60 ℃水解处理5 h,接种0.8%酿酒酵母(Saccharomyces cerevisiae)和0.5%鼠李糖乳杆菌(Lactobacillus rhamnosus),37 ℃发酵60 h,121 ℃灭菌15 min,-60 ℃条件下干燥,即得发酵人参。
1.3.2 人参皂苷Rg3、Rg3(R)、Rg5的检测方法
色谱条件如下:Xtimate-C18色谱柱(4.6 mm×250 mm,5 μm);流速1 mL/min;柱温30 ℃,进样量20 μL,检测波长203 nm;流动相:乙腈(A)-0.1%磷酸水(B),梯度洗脱程序:0~20 min(20%~20%A),20~30 min(20%~35%A),30~80 min(35%~60% A),80~90 min(60%~60% A),90~100 min(60%~90%A),100~110 min(90%~90%A),110~111min(90%~20%A),111~120min(20%~20%A)。
对照品溶液的配制:精密称取人参皂苷Rg3、Rg3(R)、Rg5对照品各10 mg,分别置于不同的10 mL容量瓶中,加少量甲醇超声溶解,用稀释剂(体积分数40%甲醇)定容至刻度线,摇匀,作为标准储备液。分别精密量取上述标准储备液各2 mL、1 mL、1 mL,置于10 mL容量瓶中,用稀释剂定容至刻度线,配制得到人参皂苷Rg3、Rg3(R)、Rg5质量浓度分别为200 μg/mL、100 μg/mL、100 μg/mL对照品溶液。
供试品溶液的配制:称取发酵人参粉末约0.3 g,置10 mL容量瓶中,加入适量稀释剂(体积分数40%甲醇),超声提取30 min,取出,冷却至室温,定容,摇匀,采用0.45 μm有机滤膜过滤,取滤液,备用。标准曲线绘制:分别量取对照品储备液适量,用稀释剂逐级稀释,得到含稀有人参皂苷Rg3(78.76 μg/mL、157.51 μg/mL、196.89 μg/mL、236.27 μg/mL、315.02μg/mL),稀有人参皂苷Rg3R(39.94μg/mL、79.88μg/mL、99.85 μg/mL、119.82 μg/mL、159.75 μg/mL),稀有人参皂苷Rg5对照品(42.54 μg/mL、85.08 μg/mL、106.35 μg/mL、127.62 μg/mL、170.16 μg/mL)3种系列浓度混合对照品溶液,进行色谱测定。以对照品实际质量浓度(μg/mL,X)为横坐标,以峰面积(Y)为纵坐标,绘制人参皂苷各组分标准曲线。
定性定量的方法:根据稀有人参皂苷对照品在色谱图上的保留时间对待测样品进行定性,依据标准曲线回归方程得到各稀有人参皂苷Rg3、Rg3(R)、Rg5含量。人参皂苷含量计算公式如下:
式中:X为试样中待测人参皂苷含量,%;C为根据外标法得出的待测人参皂苷的质量浓度,μg/mL;V为样品稀释体积,mL;M为样品质量,g。
1.3.3 数据处理
使用Origin 9.8软件对实验数据进行统计分析。
2 结果与分析
2.1 高效液相色谱条件优化
2.1.1 流动相的选择
流动相考察了甲醇-水、乙腈-水、甲醇-0.1%磷酸水、乙腈-0.1%磷酸水四种洗脱体系,其中以乙腈-0.1%磷酸水作为流动相时,对照品及样品的HPLC色谱图见图1。由图1可知,各组分分离效果良好,色谱峰峰型良好,故将其作为流动相。另外,对梯度洗脱条件进行了摸索优化,稀有人参皂苷Rg3、Rg3(R)、Rg5分离度分别为6.8、2.7、2.7,均>1.5,分离度良好;三种人参皂苷的色谱峰拖尾因子分别为0.8、0.9、0.9,均在0.8~1.2之间,色谱峰峰型良好,且能够消除梯度洗脱时的溶剂峰。
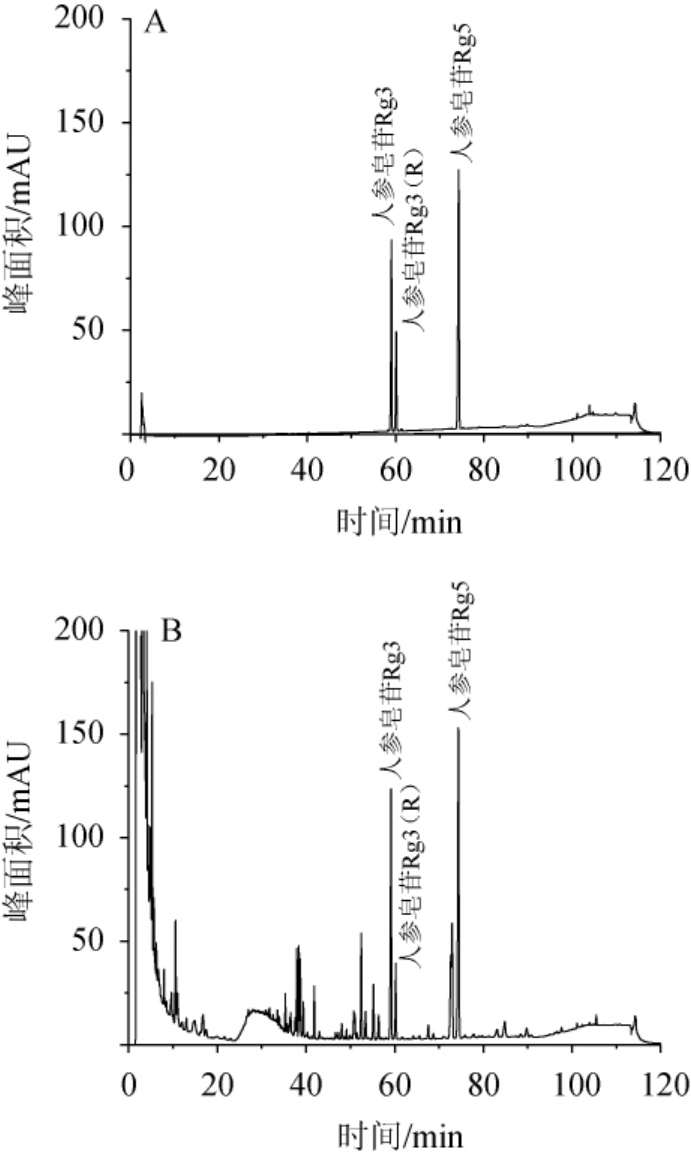
图1 三种稀有人参皂苷混合标准品(A)及发酵人参样品(B)的高效液相色谱图
Fig.1 HPLC chromatogram of 3 kinds of rare ginsenosides mixed standard (A) and fermented ginseng sample (B)
2.1.2 提取方法的考察
实验考察了超声和回流(回流方法采用GB/T 19506—2009《地埋标志产品吉林长白山人参》方法)两种提取方法,结果发现两者的提取率无明显差异,且超声提取方法简单便捷,缩短了提取时间,节约能耗,故选择超声法对发酵人参样品进行提取。另外,本实验考察了不同的超声时间和提取溶剂体系下稀有皂苷的提取率,综合考虑选用体积分数40%甲醇超声提取30 min作为提取方法。
表1 提取方法对稀有人参皂苷含量的影响
Table 1 Effects of extraction method on rare ginsenosides contents
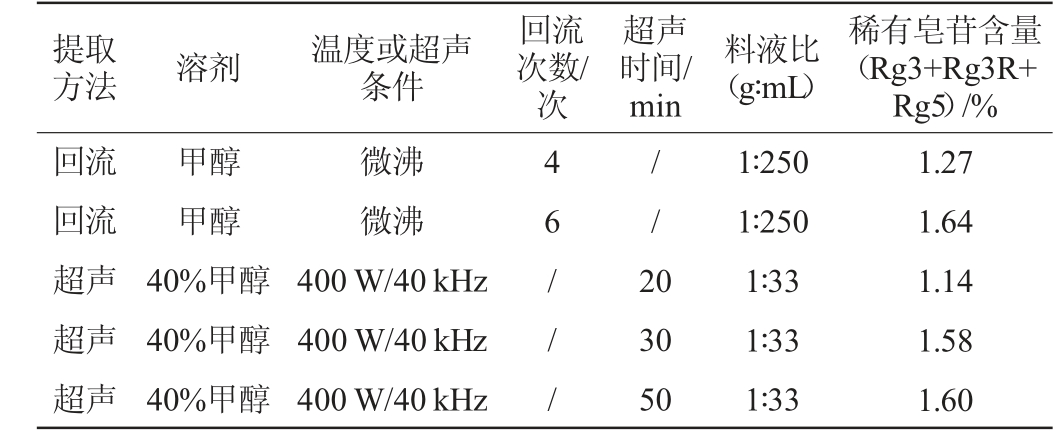
方法溶剂温度或超声条件提取回流次数/次超声时间/min料液比(g∶mL)稀有皂苷含量(Rg3+Rg3R+Rg5)/%回流回流超声超声超声甲醇甲醇40%甲醇40%甲醇40%甲醇微沸微沸400 W/40 kHz 400 W/40 kHz 400 W/40 kHz 46/////2 0 30 50 1∶250 1∶250 1∶33 1∶33 1∶33 1.27 1.64 1.14 1.58 1.60
2.2 方法学考察
2.2.1 线性关系、检出限与定量限
分别以三种稀有人参皂苷色谱峰的3倍和10倍信噪比对应的浓度来计算检出限、定量限。各组分线性范围、回归方程、相关系数(R2)、检出限及定量限结果见表2。由表2可知,稀有人参皂苷Rg3、Rg3(R)、Rg5分别在78.76~315.02 μg/mL、39.94~159.75 μg/mL、42.54~170.16 μg/mL质量浓度范围内呈良好线性关系,相关系数R2均>0.99。检出限(limit of detection,LOD)分别为0.05 μg/mL、0.08 μg/mL、0.02 μg/mL,定量限(limit of quantitation,LOQ)分别为0.15 μg/mL、0.23 μg/mL、0.07 μg/mL。
表2 三种稀有人参皂苷的标准曲线回归方程、线性范围、检出限和定量限
Table 2 Standard curve regression equation, linear range, limits of detection, and limits of quantitation of 3 kinds of rare ginsenosides
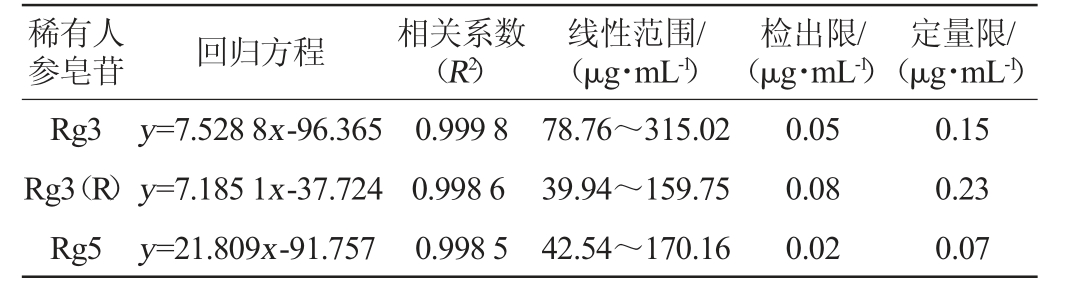
参皂苷回归方程相关系数(R2)稀有人线性范围/(μg·mL-1)检出限/(μg·mL-1)定量限/(μg·mL-1)Rg3 Rg3(R)Rg5 y=7.528 8x-96.365 y=7.185 1x-37.724 y=21.809x-91.757 0.999 8 0.998 6 0.998 5 78.76~315.02 39.94~159.75 42.54~170.16 0.05 0.08 0.02 0.15 0.23 0.07
2.2.2 加标回收率试验
取已知含量的同一批发酵人参0.12 g、0.15 g、0.18 g,置于10 mL容量瓶中,分别按照样品中各成分含量加入对照品溶液,每种浓度平行配制3份,进行色谱测定,计算各成分加标回收率,结果见表3。由表3可知,不同加标水平Rg3、Rg3(R)、Rg5的平均回收率分别在101.61%~104.10%、100.22%~104.04%、100.68%~102.79%之间,准确度实验结果相对标准偏差(relative standard deviation,RSD)均<2.0%,表明该方法准确度良好。
表3 三种稀有人参皂苷加标回收率试验结果
Table 3 Results of adding standard recovery rates experiments of 3 kinds of rare ginsenosides
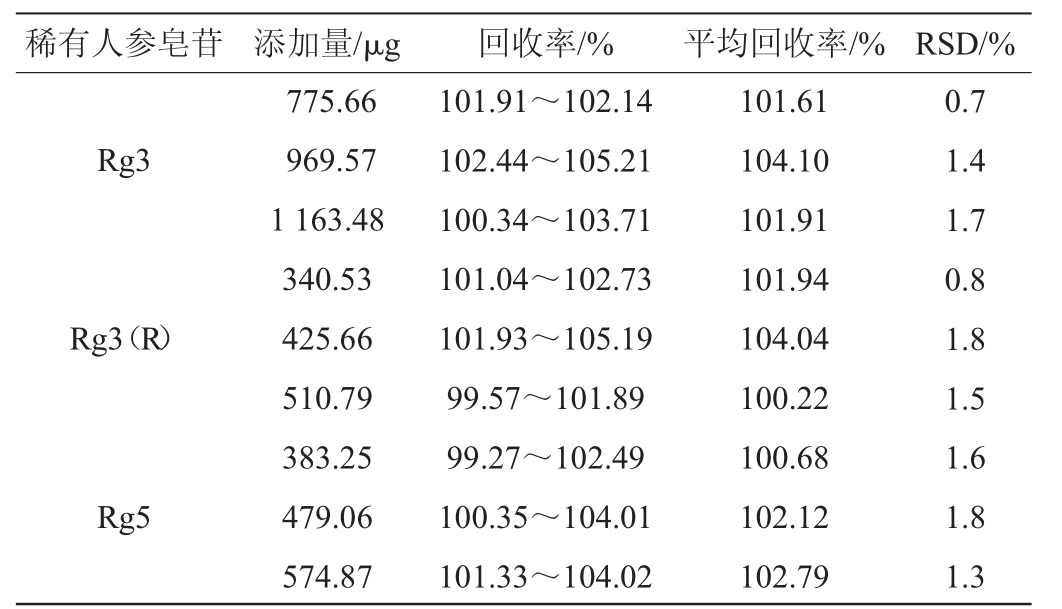
稀有人参皂苷 添加量/μg回收率/%平均回收率/% RSD/%Rg3 Rg3(R)Rg5 775.66 969.57 1 163.48 340.53 425.66 510.79 383.25 479.06 574.87 101.91~102.14 102.44~105.21 100.34~103.71 101.04~102.73 101.93~105.19 99.57~101.89 99.27~102.49 100.35~104.01 101.33~104.02 101.61 104.10 101.91 101.94 104.04 100.22 100.68 102.12 102.79 0.7 1.4 1.7 0.8 1.8 1.5 1.6 1.8 1.3
2.2.3 精密度试验
按照1.3.2操作步骤,将发酵人参样品配制6份供试品,进行色谱测定,三种稀有人参皂苷精密度实验结果见表4。由表4可知,6份供试品中人参皂苷Rg3、Rg3(R)、Rg5平均含量分别为0.59%、0.30%、0.32%,精密度实验结果相对标准偏差(relative standard deviation,RSD)值分别为2.6%、2.0%、2.5%,均<5.0%,表明该方法具有良好的精密度。
表4 三种稀有人参皂苷精密度试验结果
Table 4 Results of precision experiments of 3 kinds of rare ginsenosides
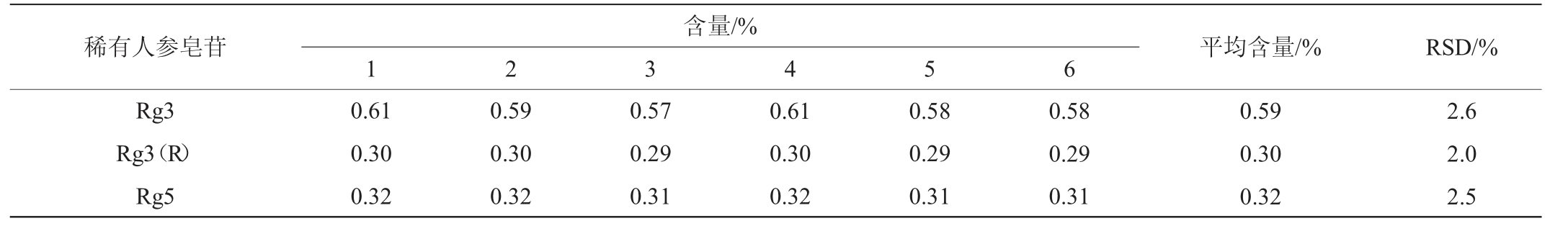
含量/%稀有人参皂苷平均含量/%RSD/%Rg3 Rg3(R)Rg5 1 2 3 4 5 6 0.61 0.30 0.32 0.59 0.30 0.32 0.57 0.29 0.31 0.61 0.30 0.32 0.58 0.29 0.31 0.58 0.29 0.31 0.59 0.30 0.32 2.6 2.0 2.5
2.2.4 稳定性试验
按1.3.2操作步骤制备对照品溶液和供试品溶液各一份,室温下分别在0 h、8 h、16 h、24 h、40 h、48 h时进样分析,稳定性试验结果见表5、表6。由表5、6可知,对照品溶液和供试品溶液在48 h内人参皂苷Rg3、Rg3(R)、Rg5峰面积RSD值分别为0.8%、0.7%、0.9%,0.3%、0.6%、0.5%,均<5.0%,表明两种溶液中稀有人参皂苷Rg3、Rg3(R)、Rg5在室温下放置48 h稳定性良好。
表5 3种稀有人参皂苷对照品溶液稳定性试验结果
Table 5 Results of stability experiments of 3 kinds of rare ginsenosides standard solution
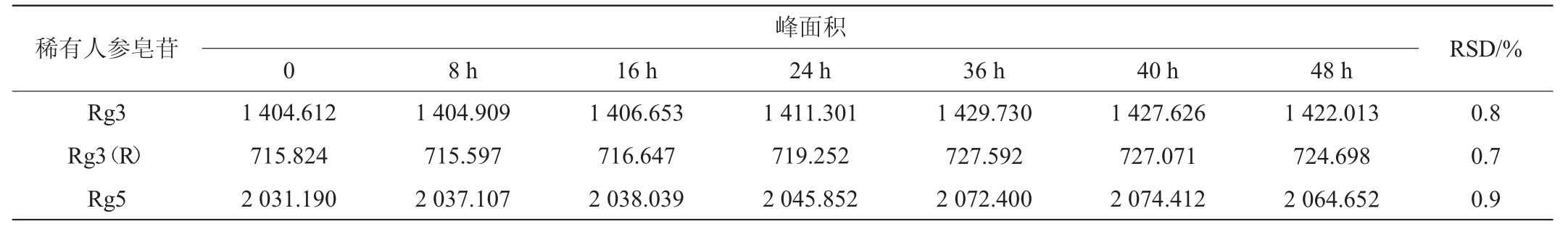
峰面积0稀有人参皂苷RSD/%Rg3 Rg3(R)Rg5 8 h16 h24 h36 h40 h48 h 1 404.612 715.824 2 031.190 1 404.909 715.597 2 037.107 1 406.653 716.647 2 038.039 1 411.301 719.252 2 045.852 1 429.730 727.592 2 072.400 1 427.626 727.071 2 074.412 1 422.013 724.698 2 064.652 0.8 0.7 0.9
表6 3种稀有人参皂苷供试品溶液稳定性试验结果
Table 6 Results of stability experiments of 3 kinds of rare ginsenosides samples solution
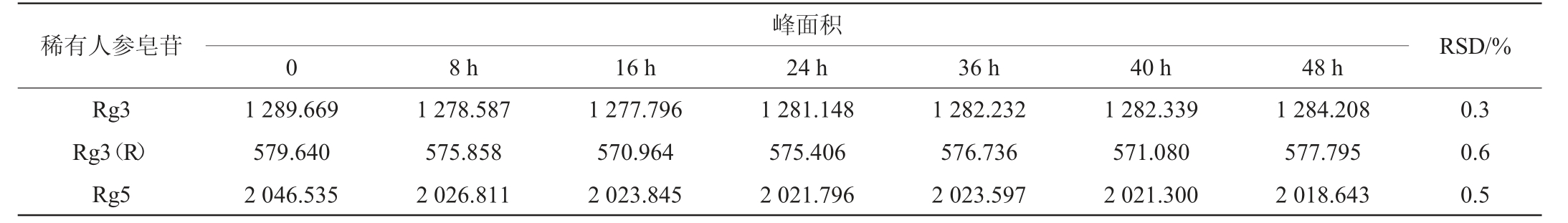
峰面积0稀有人参皂苷RSD/%Rg3 Rg3(R)Rg5 8 h16 h24 h36 h40 h48 h 1 289.669 579.640 2 046.535 1 278.587 575.858 2 026.811 1 277.796 570.964 2 023.845 1 281.148 575.406 2 021.796 1 282.232 576.736 2 023.597 1 282.339 571.080 2 021.300 1 284.208 577.795 2 018.643 0.3 0.6 0.5
2.2.5 发酵人参样品中人参皂苷含量测定
取三批发酵人参样品粉末,按1.3.2项下方法制备,平行配制2份,按照上述色谱条件进行检测,计算稀有人参皂苷Rg3、Rg3(R)、Rg5含量,检测结果见表7。由表7可知,三批样品中三种稀有皂苷的含量较近,证明发酵人参工艺稳定,不同批次间各指标成分含量差异较小。
表7 发酵人参样品中3种稀有人参皂苷含量测定结果
Table 7 Determination results of 3 kinds of rare ginsenosides in fermented ginseng samples
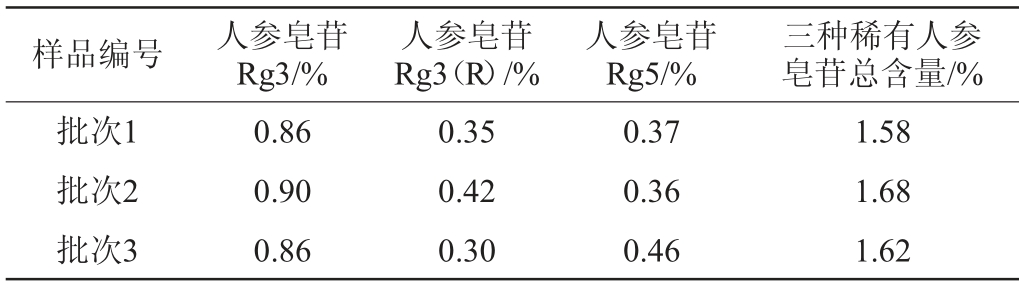
样品编号人参皂苷Rg3/%人参皂苷Rg3(R)/%人参皂苷Rg5/%三种稀有人参皂苷总含量/%批次1批次2批次3 0.86 0.90 0.86 0.35 0.42 0.30 0.37 0.36 0.46 1.58 1.68 1.62
3 结论
本研究建立了一种同时检测发酵人参中稀有人参皂苷Rg3、Rg3(R)、Rg5含量的高效液相色谱分析方法。3种稀有人参皂苷Rg3、Rg3(R)、Rg5分别在78.76~315.02 μg/mL、39.94~159.75 μg/mL、42.54~170.16 μg/mL质量浓度范围内呈良好线性关系(相关系数R2>0.99),检出限分别为0.05μg/mL、0.08μg/mL、0.02μg/mL,定量限分别为0.15μg/mL、0.23μg/mL、0.07μg/mL,平均回收率分别为101.61%~104.10%、100.22%~104.04%、100.68%~102.79%之间,准确度试验结果相对标准偏差(RSD)均<2.0%,精密度试验、重复性试验结果相对标准偏差(RSD)分别为2.6%、2.0%、2.5%;0.3%、0.6%、0.5%,均<5.0%。本方法线性范围、检出限、定量限、准确度、精密度等方法学验证指标均符合相关法规要求[26],可用于检测发酵人参中稀有人参皂苷Rg3、Rg3(R)、Rg5含量,为微生物转化稀有人参皂苷的研究及开发提供了参考和实验基础。
[1]高健,邵娃.人参化学成分及药理作用研究进展[J].中医药导报,2021,27(1):127-130.
[2]李倩,柴艺汇,高洁,等.人参现代药理作用研究进展[J].贵阳中医学院学报,2019,41(5):89-92.
[3]邢金月,杨涵童,韩莲花,等.人参及其药对的研究进展[J].中华中医药学刊,2022,40(5):176-179.
[4]曾露露,赵婷,李莹,等.高效液相色谱法同时测定黑参中4种稀有人参皂苷的含量[J].中国药学杂志,2017,52(12):1069-1072.
[5]陈树东,胡文军,孔祥词,等.固相萃取/超高效液相色谱-三重四极杆质谱法测定人参、人参叶与人参花中10种人参皂苷含量[J].分析测试学报,2021,40(9):1348-1354.
[6]谢佳明,阚玉娜,刘笑男,等.西洋参中人参皂苷结构多样性及药理活性研究进展[J].辽宁中医药大学学报,2022,24(1):75-80.
[7]谢丽娟,冯惠柳,李健豪,等.HPLC法同时测定人参根、茎叶、花中6种人参皂苷含量[J].人参研究,2023,35(4):24-26.
[8]陈丽华,杨秀伟,白雪媛,等.超快速液相色谱-质谱法测定鲜人参晶及林下山参中的39个人参皂苷成分[J].中国现代中药,2023,25(4):788-797.
[9]张浩然,朱小涵,赵迅,等.基于葡萄有机酸的稀有人参皂苷20(S,R)-Rg3和Rg5的绿色制备[J].吉林化工学院学报,2022,39(3):11-15,50.
[10]屈文佳,贾天颖,王海丽,等.不同蒸制时间下红参颜色及3种常见人参皂苷的转化规律研究[J].北京中医药大学学报,2020,43(9):769-775.
[11]XU X F,GAO Y,XU S Y,et al.Remarkable impact of steam temperature on ginsenosides transformation from fresh ginseng to red ginseng[J].J Ginseng Res,2018,42(3):277-287.
[12]颜红娇,郭琰,赵声兰,等.理化及生物转化稀有人参皂苷的方法[J].中南农业科技,2024,45(4):238-241.
[13]许凌巧,王安琪,何正有,等.提高人参茎叶皂苷中稀有人参皂苷含量的工艺[J].食品工业,2020,41(2):50-53.
[14]丛悦怡,孙佳,于恩,等.红曲霉发酵转化人参皂苷Rg3的研究[J].中草药,2018,49(6):1298-1303.
[15]夏晚霞,张尚微,葛亚中,等.乳酸菌发酵转化人参皂苷[J].现代食品科技,2018,34(9):136-142,157.
[16]李银飞,梁应忠,崔秀明,等.人参皂苷Rb1转化菌株筛选及转化产物分析[J].微生物学通报,2023,50(5):2127-2136.
[17]李雅晨,盛格格,吴基良,等.人参皂苷Rg3对乳腺癌骨转移大鼠疼痛的缓解作用及机制研究[J].现代肿瘤医学,2024,32(8):1397-1401.
[18]赵娅菽,邓丽聪,曹玥,等.人参皂苷Rg3与5-氟尿嘧啶联用对结肠癌小鼠肿瘤的血管生成与肿瘤生长抑制效果的实验研究[J].四川大学学报(医学版),2024,55(1):111-117.
[19]刘晓瑞,张坤峰,李鑫,等.人参皂苷Rg3抗肿瘤纳米给药系统研究进展[J].中草药,2023,54(22):7577-7587.
[20]HAN M S,HAN I H,LEE D,et al.Beneficial effects of fermented black ginseng and its ginsenoside 20(S)-Rg3 against cisplatin-induced nephrotoxicity in LLC-PK1 cells[J].J Ginseng Res,2016,40(2):135-140.
[21]陈德云,沈志强,何波.人参皂苷活性单体-20(R)-人参皂苷Rg3药理作用及其机制的研究进展[J].天然产物研究与开发,2019,31(7):1285-1290.
[22]GUO X,XU F F,BERA H,et al.20(R)-ginsenoside Rg3-loaded polyurethane/marine polysaccharide based nanofiber dressings improved burn wound healing potentials[J].Carbohyd Polym,2023,317:121085.
[23]YUNHEE L, ARUM P, YOUNGJUN P, et al.Ginsenoside 20(R)-Rg3 enhances natural killer cell activity by increasing activating receptor expression through the MAPK/ERK signaling pathway[J].Int Immunopharm,2022,107:108618.
[24]屈琳琳,刘彦楠,范代娣.人参皂苷Rg5通过诱导凋亡抑制原发性肝癌小鼠肿瘤生长[J].生物加工过程,2023,21(5):582-588.
[25]CHOI P,PARK J Y,KIM T,et al.Improved anticancer effect of ginseng extract by microwave-assisted processing through the generation of ginsenosides Rg3,Rg5 and Rk1[J].J Funct Foods,2015,14(4):613-622.
[26]中华人民共和国国家质量监督检验检疫总局,中国国家标准化委员会.GB/T 27404—2008 实验室质量控制规范食品理化检测[S].北京:中国标准出版社,2008.