中国白酒是世界六大蒸馏酒之一,其以大曲、小曲和麸曲等作为发酵剂,糖化、自然固态发酵和风味形成同时进行[1]。白酒发酵产物对于白酒品质及酿造微生物群落结构组成研究具有重要价值,但受限于固态发酵工艺,发酵环境处于密闭状态,直接采集酒醅需开窖或打孔,容易引起杂菌污染,且带入的氧气会影响窖内微生物的生长环境,引起群落结构发生变化[2-3]。在白酒发酵过程中,酒醅经过微生物分解代谢后产生了大量游离水,其中包含了酒醅的可溶性淀粉、酸、还原糖、酒精等,逐渐沉积在窖池底部形成黄水[2-4]。因此,黄水和酒醅关系密切,可通过检测黄水特性间接判断酒醅发酵状态。
黄水是固态发酵白酒的主要副产物,是一种棕褐色的粘稠液体[5-6]。在白酒企业中,一般每生产1万t白酒,会形成约3 500 t黄水[6-7]。厌氧处理是一种有效的黄水去污方法,但会产生大量的甲烷、硫化氢和一氧化碳等有害气体[8]。此外,黄水富含淀粉、多糖、蛋白质、氨氮和有机酸等营养物质[9]。黄水直接排放不仅严重污染环境,而且造成资源浪费。近年来,对黄水的研究多集中在理化特性、功能成分的提取[10]、调味液[11]及纤维素的制备[12]。黄水中含有丰富的微生物资源,GAO L等[6]研究发现乳杆菌属、梭菌属、瘤胃球菌属和沙雷氏菌属是黄水中的主要优势微生物。这些微生物大多数为白酒酿造的功能菌,可代谢产生多种醇、醛、酸和酯等风味化合物,对白酒的品质具有显著的影响[9]。同时,这些优势微生物在降解营养物质、参与窖的老熟、控制有害微生物等方面也发挥着重要的作用[9]。因此,黄水中功能微生物挖掘和生物活性物质资源的开发具有优良前景,但对不同车间窖池黄水真菌多样性的差异研究较少。
因此,该研究利用理化分析和高通量测序技术比较不同车间窖池黄水(A、B、C)的理化特性和真菌结构,通过生物信息学分析方法考察真菌菌群组成差异及其与理化因子间相关性,并采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行功能注释。以期为黄水功能微生物挖掘提供理论依据,促进黄水加工与利用。
1 材料与方法
1.1 材料与试剂
黄水:四川省绵竹市某浓香型白酒厂,从3个不同生产车间(A、B和C)的9个窖池中收集。
酒石酸钾纳、苯酚、葡萄糖、酚酞、氢氧化钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、亚硫酸钠:国药集团化学试剂有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(酶活500 U)、Omega Water DNA Kit:美国Omega公司;内转录间隔区(internal transcribed spacers,ITS)引物合成:广州迈景基因医学科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
S210型pH计:瑞士梅特勒-托利多公司;FA1104N型电子分析天平、754型紫外-可见分光光度计:上海菁华科技仪器有限公司;Nano-900型超微量分光光度计:上海沪析实业有限公司;TC1000-G型梯度基因扩增仪:大龙兴创实验仪器(北京)股份公司;DYCP-32B型琼脂糖水平电泳仪、WD-9403B型紫外透射切胶台:北京六一生物科技有限公司;Illumina Miseq测序平台:美国Illumina公司。
1.3 方法
1.3.1 理化指标测定
酒精度的测定:参照国标GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》;pH值的测定:根据国标GB 5009.237—2016《食品安全国家标准食品pH值的测定》;总酸的测定:参照国标GB 12456—2021《食品安全国家标准食品中总酸的测定》;还原糖的测定:采用GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》。
1.3.2 DNA提取、PCR扩增及高通量测序
根据Omega Water DNA Kit说明书要求提取黄水样品DNA,采用质量分数为0.8%琼脂糖凝胶电泳和Nano-900型超微量分光光度计检测DNA浓度和纯度。采用真菌通用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[13]。PCR扩增体系(20 μL):5×FastPfu缓冲液4 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2.5 mmol/L)2 μL,真菌上下游引物(5 μmol/L)各1 μL,DNA聚合酶1 μL,DNA模板10 ng,双蒸水(ddH2O)10 μL;PCR扩增程序为:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30次循环;72 ℃再延伸10 min[13]。每个黄水样品3次重复,合并同一黄水样品的PCR产物,采用2%琼脂糖凝胶电泳检测,切胶回收PCR产物,寄至广州迈景基因医学科技有限公司进行高通量测序。
1.3.3 序列处理及功能预测
采用QIIME 2[14]平台对测序数据进行分析,具体如下:对原始序列进行样本匹配,并过滤低质量的碱基,使用Cutadapt插件去除序列引物片段,随后利用DADA2插件对所有序列进行合并、去噪、拼接、去嵌合体、去冗余等步骤,获得扩增子序列变体(amplicon sequence variants,ASVs)特征序列,基于Unite数据库对ASVs特征序列进行物种注释,获取每个ASVs的分类学信息[15]。
使用PICRUSt 2[16]软件推断生物群落的功能,其通过高通量测序序列数据和京都基因与基因组百科全书(KEGG)数据库比对,赋予基因信息生物学意义,从而实现对样本中微生物的基因进行功能预测[17]。
1.3.4 数据处理
使用GraphPad Prism软件绘制柱状图,采用R语言进行真菌多样性及相似性分析(analysisofsimilarities,ANOSIM),绘制群落结构组成图、非度量多维标度(non-metric multidimensional scaling,NMDS)分析图、线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)图、冗余分析(redundancy analysis,RDA)图,利用SPSS 29.0.2.0软件进行单因素方差分析。
2 结果与分析
2.1 不同车间窖池黄水理化指标的分析
由图1A可知,不同车间窖池黄水的酒精度差异显著(P<0.05)。A车间窖池黄水的酒精度可达5.05%vol,显著高于B车间(4.23%vol)、C车间(3.76%vol)(P<0.05),表明A车间窖内微生物代谢产生乙醇的能力要强于B车间、C车间。乙醇是酵母菌的主要代谢产物,可能A车间窖池黄水酵母菌种类及数量优于其他两个车间,导致乙醇积累较多[18]。由图1B、1C可知,A车间窖池黄水的pH值仅为3.28,显著低于B车间(3.41)、C车间(3.67)(P<0.05)。不同车间窖池黄水的总酸含量变化规律与pH值的变化相反,A车间(25.44g/L)>B车间(22.91 g/L)>C车间(20.25 g/L)。A车间窖内产酸微生物的代谢活性强于B车间和C车间,其生长代谢受到乙醇浓度影响,表现为乙醇与酵母菌的代谢活性有关,而酵母菌在代谢过程中会产生多种有机酸,使黄水逐渐酸化[19]。由图1D可知,还原糖是发酵原料中淀粉的酶解产物,其可作为窖内微生物生长代谢的直接碳源[20]。A车间、B车间和C车间中窖池黄水的还原糖含量分别为5.33 g/L、7.48 g/L和8.62 g/L。酵母菌在发酵过程中可将还原糖转化为乙醇和有机酸,其转化效率越高,说明酵母菌代谢活性越旺盛[21]。综上所述,不同车间窖池黄水的酒精度、pH、总酸和还原糖含量等理化指标存在一定的差异。
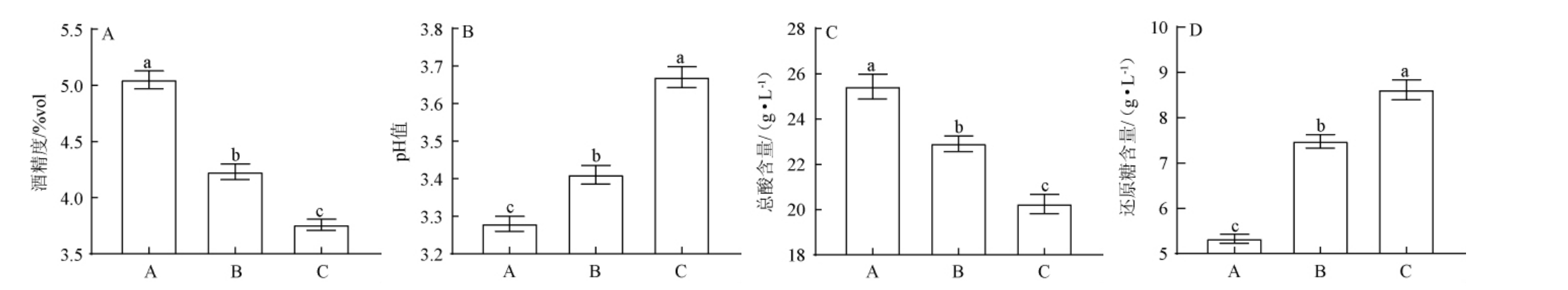
图1 不同车间窖池黄水的理化指标
Fig.1 Physicochemical indexes of Huangshui in pits of different workshops
不同小写字母表示差异显著(P<0.05)。
2.2 不同车间窖池黄水真菌菌群Alpha多样性
本研究采用QIIME 2对高通量测序数据进行过滤、去噪及删除无效注释等分析。由表1可知,9个黄水样品中获得1 149 807条优质序列,优质序列数量为121 513~134 147条,且各车间窖池黄水的优质序列数量无显著差异(P>0.05)。所有窖池黄水的高通量测序覆盖度均>99.8%,表明测序深度已足够,可获得绝大多数的真菌多样性信息,满足后续分析需求[15]。通过真菌数据库注释,C车间窖池黄水的ASVs数量可达186个,显著高于A车间(154个)、B车间(117个)(P<0.05)。不同发酵环境所形成的环境压力不同,会过滤掉一些不适宜生长繁殖的微生物,从而导致微生物数量差异[22]。Alpha多样性分析可反映黄水中微生物群落的物种丰富度、多样性和系统发育关系[15]。C车间窖池黄水的Shannon指数和Simpson指数(1.76、0.68)高于B车间(1.41、0.59)、A车间(1.05、0.42),表明C车间窖池黄水中真菌菌群的多样性较丰富。A车间窖池黄水的Chao1指数为124.66,显著低于B车间(169.42)、C车间(216.38)(P<0.05),表明A车间窖池黄水的物种丰富度较低。此外,PD指数可反映各物种之间的系统发育关系,其值越大代表样品中物种的系统发育距离越远。A车间、B车间和C车间中窖池黄水的PD指数分别为9.76、11.52、14.14,差异显著(P<0.05),说明C车间窖池黄水中物种系统发育距离较远,物种亲缘关系较远。
表1 不同车间窖池黄水真菌菌群Alpha多样性分析结果
Table 1 Results of Alpha diversity analysis of fungal communities of Huangshui in pits of different workshops
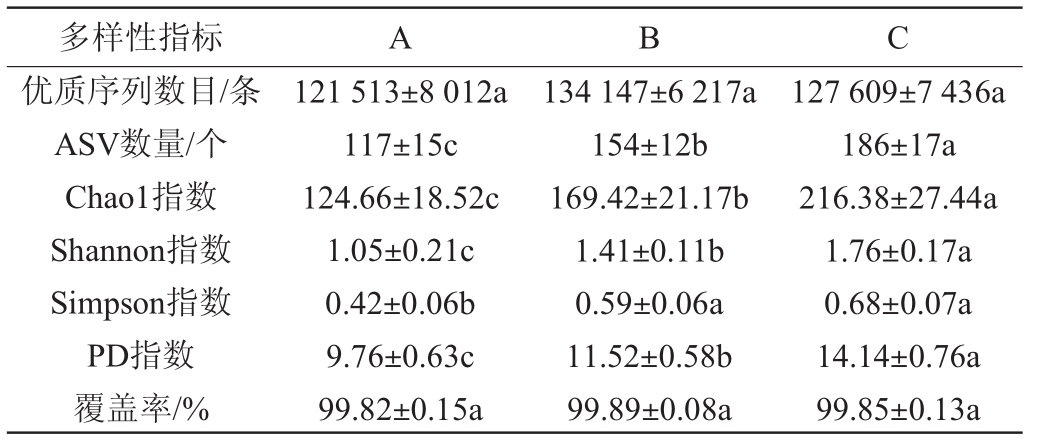
注:同行不同小写字母表示差异显著(P<0.05)。
多样性指标ABC优质序列数目/条ASV数量/个Chao1指数Shannon指数Simpson指数PD指数覆盖率/%121 513±8 012a 117±15c 124.66±18.52c 1.05±0.21c 0.42±0.06b 9.76±0.63c 99.82±0.15a 134 147±6 217a 154±12b 169.42±21.17b 1.41±0.11b 0.59±0.06a 11.52±0.58b 99.89±0.08a 127 609±7 436a 186±17a 216.38±27.44a 1.76±0.17a 0.68±0.07a 14.14±0.76a 99.85±0.13a
2.3 不同车间窖池黄水真菌菌群结构组成
对三个不同车间窖池黄水样品的真菌菌群进行鉴定,结果见图2。由图2A可知,共检测出8个真菌门。A车间窖池黄水的绝对优势菌门为子囊菌门(Ascomycota),相对丰度可达95.15%,担子菌门(Basidiomycota)的相对丰度仅为3.51%。B车间窖池黄水优势菌门中相对丰度较高的为子囊菌门、担子菌门和毛霉菌门(Mucoromycota),其相对丰度分别为67.35%、29.59%、1.79%。而C车间窖池黄水优势菌门中子囊菌门、担子菌门和毛霉菌门的相对丰度分别为86.85%、8.95%和1.16%。结果表明,子囊菌门是真菌界中种类最多的一个门,可适应多种不同的生境,包括酵母菌和霉菌等发酵菌株,其相对丰度变化会影响产品发酵品质[19]。KANG J等[18]研究发现,子囊菌门为湖南浓香型白酒黄水的优势菌门,其相对丰度高低会影响黄水代谢产物的组成及含量,尤其是有机酸、碳水化合物、核酸和脂肪酸,对氨基酸和糖的代谢产生影响。李可[23]采用传统分离培养方法分离黄水中真菌并研究其多样性,共分离得到61株真菌,主要隶属于子囊菌门、担子菌门和毛霉菌门,其中子囊菌门为绝对优势菌群。综上,子囊菌门是黄水真菌的主要优势类群之一,其相对丰度占比最高。
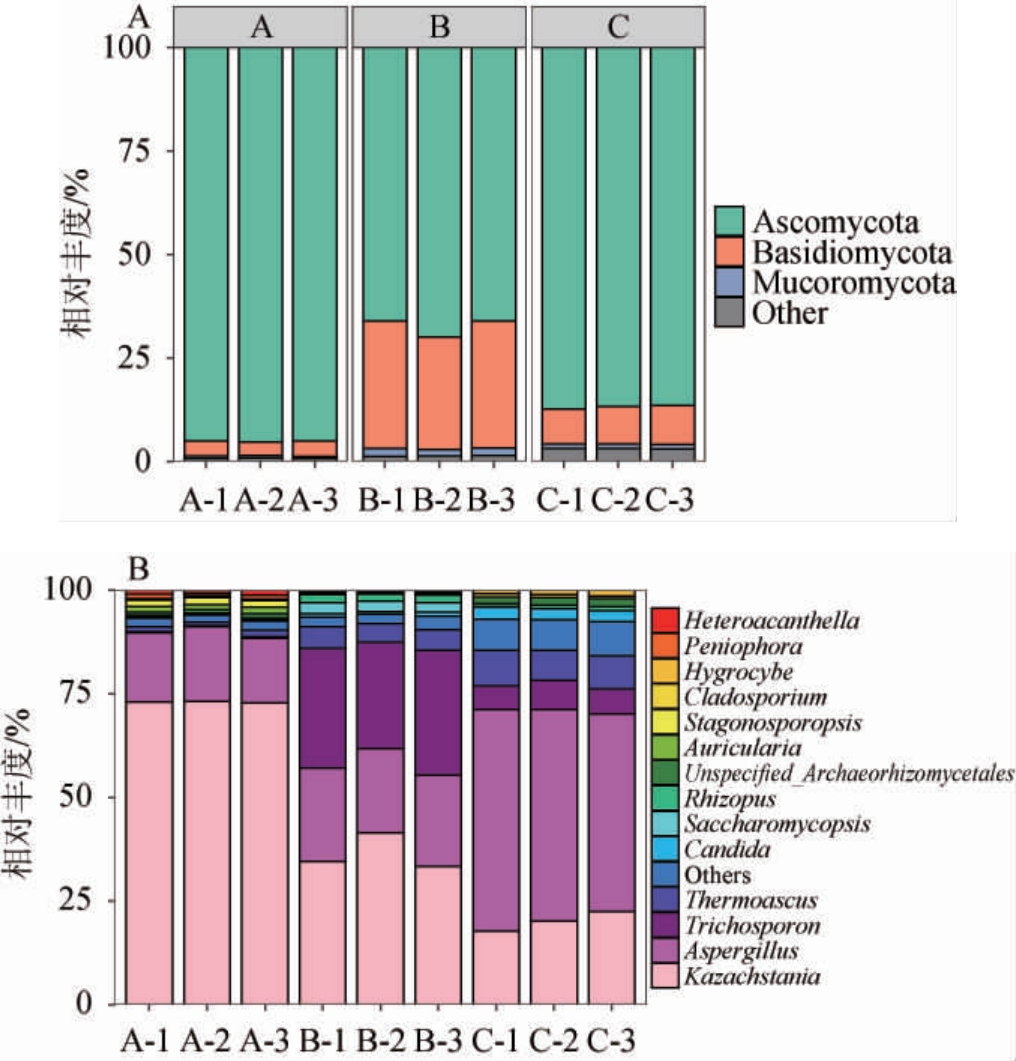
图2 基于门(A)和属(B)水平不同车间窖池黄水样品真菌菌群结构
Fig.2 Structure of fungal community of Huangshui in pits of different workshops based on phylum (A) and genus (B) levels
Others表示相对丰度<0.5%的真菌门或属的总和。
由图2B可知,共检测出77个真菌属。A车间窖池黄水的优势真菌属(相对丰度>1%)为哈萨克斯坦酵母属(Kazachstania)、曲霉属(Aspergillus)、Stagonosporopsis、Auricularia和嗜热子囊菌属(Thermoascus),其相对丰度分别为72.98%、16.84%、1.61%、1.33%、1.21%。B车间窖池黄水的优势真菌属分别为哈萨克斯坦酵母属、丝孢酵母属(Trichosporon)、曲霉属、嗜热子囊菌属、复膜酵母菌属(Saccharomycopsis)和根霉属(Rhizopus),其相对丰度分别为36.49%、28.24%、21.59%、4.85%、2.51%和1.79%。C车间窖池黄水的优势真菌属,曲霉属、哈萨克斯坦酵母属、嗜热子囊菌属、丝孢酵母属、假丝酵母菌属(Candida)、Unspecified_Archaeorhizomycetales和湿伞属(Hygrocybe),其相对丰度分别为50.81%、20.11%、7.92%、6.23%、2.72%、1.81%和1.05%。哈萨克斯坦酵母属、曲霉属和嗜热子囊菌属均在不同车间黄水中被作为优势菌属检测出,但相对丰度存在较大差异。该结果与QIAN W等[24]研究结果相一致,其发现浓香型白酒发酵过程中发酵酒醅和窖泥的真菌群落以哈萨克斯坦酵母属、曲霉属和嗜热子囊菌属为主[24]。哈萨克斯坦酵母菌可利用原料中碳源和氮源进行生长代谢,产生多种代谢产物,其中高分子质量的醇类化合物是其主要的代谢产物之一,尤其是丙醇和异戊醇[18]。曲霉属将淀粉和蛋白质降解为低分子质量的糖和氨基酸,这些糖和氨基酸被广泛存在于黄水中的酵母菌和乳酸菌进一步利用产生各种代谢产物[25]。嗜热子囊菌属是浓香型大曲发酵过程中的主要优势菌属之一,其参与吡嗪类物质的合成,而吡嗪类物质是促进白酒特定风味形成的决定性风味物质之一,尤其是2,3,5-三甲基吡嗪和2,3,5,6-四甲基吡嗪有助于浓香型白酒的呈香,并具有扩张血管、改善血循环、护肝等功能[26]。推测黄水中嗜热子囊菌属可能来自大曲,这是由于大曲作为一种发酵剂,为白酒酿造提供菌系和酶系。丝孢酵母属、假丝酵母菌属和复膜酵母菌属等都属于非酿酒酵母,其不仅进行碳水化合物代谢,还有助于促进白酒挥发性风味物质的形成[27]。
2.4 不同车间窖池黄水真菌菌群群落差异
2.4.1 线性判别分析效应大小分析
利用LEfSe分析比较不同车间窖池黄水的真菌群落差异类群,鉴定标志性真核微生物,结果见图3。由图3可知,A车间窖池黄水酵母科(Saccharomycetaceae)、木耳科(Auriculariaceae)、红菇目(Russulales)、格孢菌目(Pleosporales)和座囊菌纲(Dothideomycetes)真菌相对丰度显著高于其他两个车间(P<0.05)。B车间窖池黄水德巴利酵母菌科(Debaryomycetaceae)、根霉科(Rhizopodaceae)、丝孢酵母科(Trichosporonaceae)、复膜孢酵母科(Saccharomycopsidaceae)和毛霉目(Mucorales)真菌相对丰度较高,表明B车间黄水的非酿酒酵母相对丰度较高。C车间窖池黄水中曲霉科(Aspergillaceae)、耐热囊菌科(Thermoascaceae)、蜡伞科(Hygrophoraceae)和马拉色菌目(Malasseziales)真菌相对丰度较高。综上可知,不同车间窖池黄水的真菌差异类群不同。
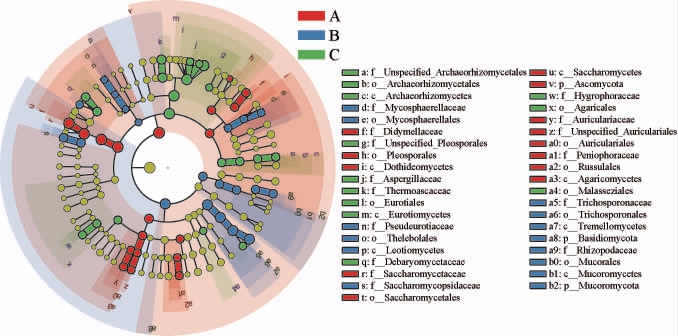
图3 不同车间窖池黄水真菌群落的线性判别分析效应大小分析
Fig.3 Linear discriminant analysis effect size analysis of fungal communities of Huangshui in pits of different workshops
2.4.2 非度量多维标度分析
通过使用基于加权的Bray-Curtis距离NMDS分析探究不同车间窖池黄水真菌群落组成的差异,结果见图4。
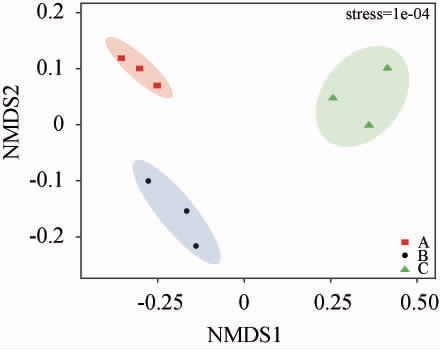
图4 不同车间窖池黄水真菌群落的非度量多维标度分析
Fig.4 Non-metric multidimensional scaling analysis of fungal communities of Huangshui in pits of different workshops
由图4可知,NMDS分析中Stress值为样品降维后形成的空间距离与其在原始多维空间距离的差值,Stress值越小,NMDS模型越准确,能在低维空间内更完整、准确的反映高维微生物群落数据的信息[18]。根据NMDS分析结果可知,Stress值仅为1×10-4,具有很好的代表性和准确性,表明NMDS模型可用于分析不同车间窖池黄水真菌群落组成差异。此外,A车间和B车间的窖池黄水分别位于坐标轴的第二象限和第三象限,而C车间窖池黄水则主要位于坐标轴的第一象限,表明组内差异小于组间差异,不同车间黄水的真核微生物群落组成差异较大。随后,通过ANOSIM分析进一步阐明不同车间窖池黄水的真菌群落组成差异,结果见表2。由表2可知,车间A vs B之间的相似性(R2=0.874)显著(P<0.05),真菌群落结构组成在车间A vs C之间相似性(R2=0.915)和车间B vs C之间相似性(R2=0.972)极显著(P<0.01),这与图4的结果相一致,说明黄水中真核微生物通过改变群落结构组成来适应不同的发酵环境[23]。
表2 不同车间窖池黄水真菌群落的相似性分析
Table 2 Similarity analysis of fungal communities of Huangshui in pits of different workshops
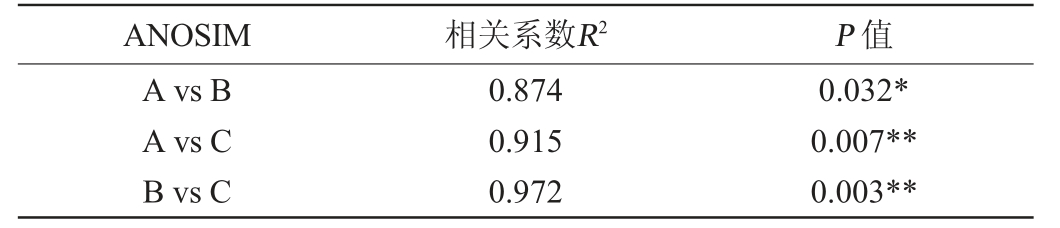
注:“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
ANOSIM相关系数R2P 值A vs B A vs C B vs C 0.874 0.915 0.972 0.032*0.007**0.003**
2.5 不同车间窖池黄水理化因子与真菌群落组成相关性分析
复杂多变的环境会制约黄水真菌群落的组成,进而改变真菌群落结构,以适应环境变化[28]。利用RDA揭示不同车间窖池黄水中差异微生物属与理化因子之间的相关性。由图5可知,RDA结果显示不同车间窖池黄水的主要真菌微生物属组成和理化因子差异较大,其中RDA的前两轴解释群落的91.94%变异,RDA1和RDA2分别解释群落变异的67.31%和24.63%,表明真菌微生物与理化因子具有很强的相关性。pH和还原糖与曲霉菌属、假丝酵母菌属和嗜热子囊菌属呈正相关,而酒精度和总酸与哈萨克斯坦酵母属呈正相关。此外,总酸与复膜酵母菌属和丝孢酵母属呈正相关。该结果与肖辰等[19]研究结果相一致,其发现浓香型白酒发酵过程中发酵酒醅中哈萨克斯坦酵母属与发酵温度、水分、酸度和乙醇浓度呈正相关[19]。因此,揭示真菌群落组成与理化因子之间的相关性,有助于了解黄水中微生物群落的代谢特性,提高其利用效率。
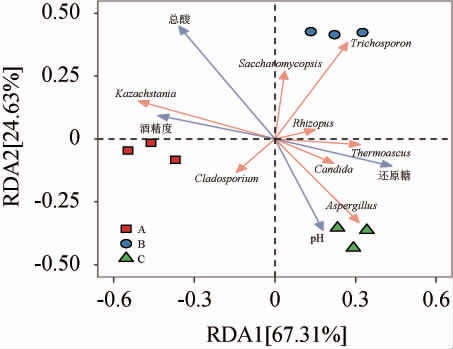
图5 不同车间窖池黄水真菌群落与理化因子的冗余分析
Fig.5 Redundancy analysis of fungal communities and physicochemical factors of Huangshui in pits of different workshops
2.6 不同车间窖池黄水真菌菌群功能预测分析
PICRUSt2可以根据微生物群落的测序数据对样品中微生物功能类别相对丰度进行基于数据库的预测宏基因组功能,可以观测不同样品之间的代谢差异和变化[29]。不同车间窖池黄水真菌群落一级、二级代谢通路分析见图6。由图6A可知,黄水真菌群落基因涉及6类一级代谢通路,其中代谢、遗传信息处理、环境信息处理和细胞过程是主要的代谢通路。代谢是黄水中相对丰度最高的一级代谢通路,其在A车间、B车间和C车间窖池黄水中的相对丰度分别为83.07%、82.75%、82.56%,各车间窖池黄水样品之间无显著差异(P>0.05)。A、B、C车间窖池黄水的遗传信息处理和环境信息处理代谢通路的相对丰度分别为12.25%和3.18%、12.11%和3.46、12.31%和3.49%,差异显著(P<0.05)。
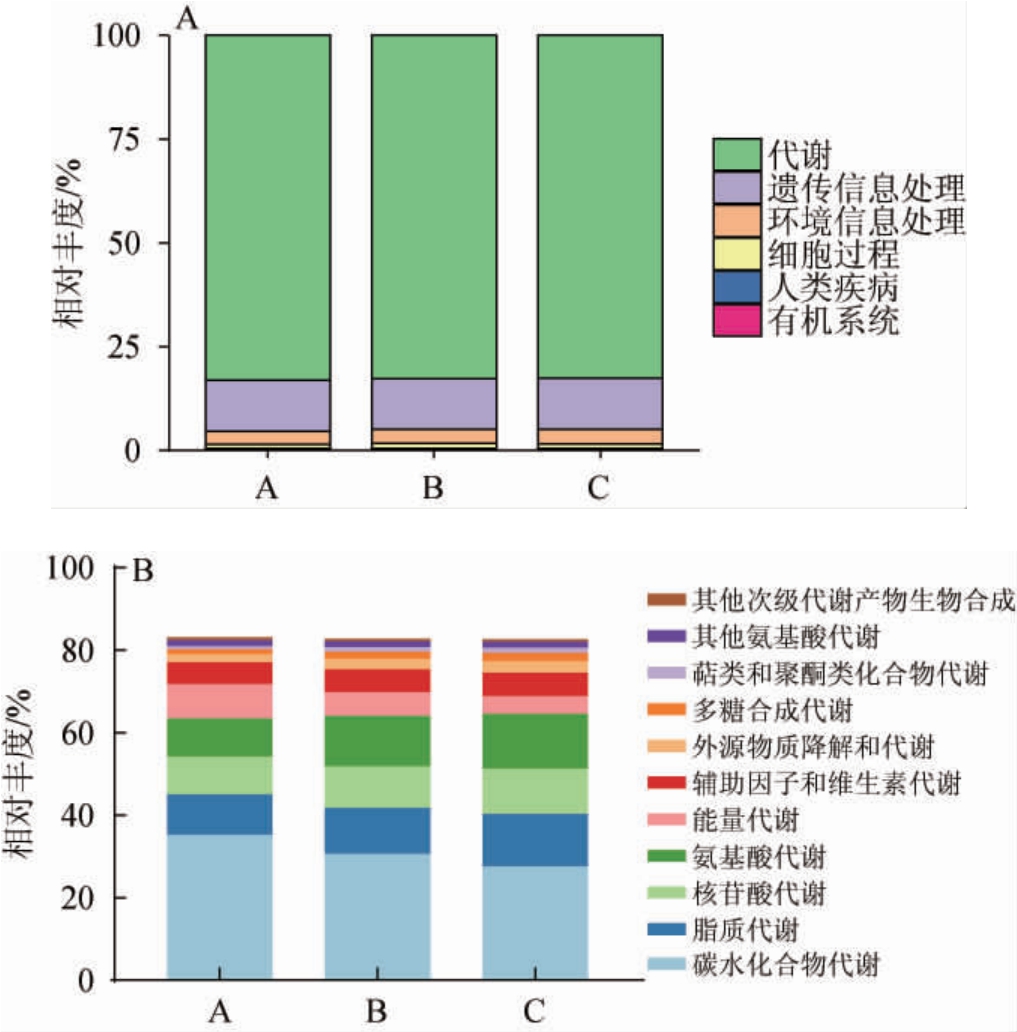
图6 不同车间窖池黄水真菌群落一级(A)及二级(B)代谢通路分析
Fig.6 Analysis of primary (A) and secondary (B) metabolic pathways of fungal communities of Huangshui in pits of different workshops
由图6B可知,不同车间窖池黄水真菌群落基因参与代谢的二级代谢通路共11类。A车间窖池黄水的碳水化合物代谢和能量代谢的相对丰度(35.21%、8.37%)显著高于B车间(30.58%和5.75%)、C车间(27.54%和4.13%)(P<0.05)。由于A车间窖池黄水的总酸含量和酒精度均高于其他两个车间,其真菌群落需要消耗更多的碳水化合物,加速糖酵解和三羧酸循环等代谢途径,从而产生更多的能量,用于抵御外界高酸度和高酒精度的发酵环境[30]。C车间窖池黄水的氨基酸代谢、脂质代谢、核苷酸代谢和多糖合成代谢的相对丰度分别为13.47%、12.84%、10.75%和2.06%,显著高于A车间(9.19%、9.78%、9.20%和1.11%)和B车间(12.24%、11.17%、10.06%和1.74%)(P<0.05)。此外,辅助因子和维生素代谢、外源物质降解和代谢及萜类和聚酮类化合物代谢的相对丰度在B车间、C车间窖池黄水样品之间无显著差异(P>0.05),显著高于A车间(P<0.05)。而氨基酸代谢、其他次级代谢产物生物合成在各车间窖池黄水的相对丰度无显著差异(P>0.05)。
3 结论
本研究比较不同车间窖池黄水的理化特性和真菌多样性的差异,并预测其功能代谢差异。研究发现不同车间窖池黄水的理性指标和多样性差异显著(P<0.05),A车间窖池黄水酒精度、pH、总酸及还原糖含量分别为5.05%vol、3.28、25.44g/L、5.33g/L,与其他两个车间差异显著(P<0.05)。门水平上,子囊菌门(Ascomycota)是黄水的绝对优势菌门,其相对丰度范围为67.35%~95.15%。属水平上,哈萨克斯坦酵母属(Kazachstania)、曲霉属(Aspergillus)和嗜热子囊菌属(Thermoascus)是不同车间窖池黄水的优势真菌属,其相对丰度范围分别为20.11%~72.98%、16.84%~50.81%和1.21%~7.92%。冗余分析结果表明,pH和还原糖与曲霉菌属、假丝酵母菌属和嗜热子囊菌属呈正相关,酒精度和总酸与哈萨克斯坦酵母属呈正相关,而总酸与复膜酵母菌属和丝孢酵母属呈正相关。此外,黄水真菌群落编码的大多数功能基因与代谢相关,不同车间窖池黄水真菌群落在多条参与代谢的二级代谢通路上存在显著差异(P<0.05)。本研究可为黄水微生物资源的利用提供数据参考。
[1]JIN G, ZHU Y, XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63:18-28.
[2]母雯竹,张贵宇,张维,等.基于CARS-SPA特征提取的黄水近红外光谱定量模型优化[J].食品科学,2024,45(19):8-14.
[3]黄治国,江科,乔宗伟,等.五粮浓香型白酒发酵过程中黄水变化规律探究[J].现代食品科技,2023,39(5):210-216.
[4]GAO Z,WU Z,ZHANG W.Effect of pit mud on bacterial community and aroma components in yellow water and their changes during the fermentation of Chinese strong-flavor liquor[J].Foods,2020,9(3):372.
[5]郭双海.黄水的化学组分、微生物组成及综合利用研究进展[J].中国酿造,2023,42(7):25-29.
[6]GAO L,XIE F,REN X,et al.Correlation between microbial diversity and flavor metabolism in huangshui:A by-product of solid-state fermentation Baijiu[J].LWT-Food Sci Technol,2023,181(5):162-173.
[7]冯兴垚,邓杰,谢军,等.白酒酿造副产物黄水综合利用现状浅析[J].中国酿造,2017,36(2):6-9.
[8]彭翠珍,宗绪岩,张宿义,等.酿酒废水处理存在的问题及解决措施[J].中国酿造,2017,36(5):1-4.
[9]王子豪,黄平,郑佳,等.白酒酿造副产物黄水研究现状及综合利用研究进展[J].中国酿造,2023,42(4):20-28.
[10]杨娇,赵兴秀,何义国,等.黄水多糖的分离纯化、结构表征及益生性研究[J].酿酒科技,2023(4):116-120,125.
[11]李安军,刘国英,李兰,等.基于超临界CO2萃取技术提取酿酒黄水中风味物质[J].食品与发酵工业,2019,45(2):118-123.
[12]HE F,YANG H,ZENG L,et al.Production and characterization of bacterial cellulose obtained by Gluconacetobacter xylinus utilizing the byproducts from Baijiu production[J].Bioproc Biosyst Eng,2020,43:927-936.
[13]魏亚情,吴志祥,杨川,等.海南岛橡胶林土壤真菌群落多样性的季节变化特征及其驱动因子分析[J].西北林学院学报,2022,37(2):37-42,89.
[14]BOLYEN E,RIDEOUT J R,DILLON M R,et al.Reproducible,interactive,scalable and extensible microbiome data science using QIIME 2[J].Nat Biotechnol,2019,37(8):852-857.
[15]高磊,黄银,马金彪,等.两种盐生植物内生真菌多样性及其功能预测[J].微生物学通报,2023,50(8):3357-3371.
[16]DOUGLAS G M, MAFFEI V J, ZANEVELD J R, et al.PICRUSt2 for prediction of metagenome functions[J].Nat Biotechnol, 2020, 38(6):685-688.
[17]孙静,杨雪,彭旭,等.鸭蛋及黑黄咸蛋壳外细菌多样性及PICRUSt基因功能预测分析[J].食品科学,2023,44(14):116-124.
[18]KANG J,SUN Y,HUANG X,et al.Unraveling the microbial compositions, metabolic functions, and antibacterial properties of huangshui, a byproduct of Baijiu fermentation[J].Food Res Int,2022,157(7):62-74.
[19]肖辰,陆震鸣,张晓娟,等.泸型酒中层酒醅真菌群落的发酵演替规律[J].应用与环境生物学报,2018,24(5):1081-1086.
[20]张榆俊,张宿义,张楷正,等.浓香型白酒发酵过程中黄水与酒醅的相关性[J].中国酿造,2023,42(5):35-40.
[21]CHAI L J,QIAN W,ZHONG X Z,et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production of strong-flavor Baijiu[J].Appl Environ Microbiol,2021,87(17):e00885-21.
[22]JIAO S,LU Y.Abundant fungi adapt to broader environmental gradients than rare fungi in agricultural fields[J].Global Change Biol,2020,26(8):4506-4520.
[23]李可.中国浓香型白酒发酵黄水中微生物群落结构及多样性解析[D].成都:西华大学,2014.
[24]QIAN W, LU Z M, CHAI L J, et al.Cooperation within the microbial consortia of fermented grains and pit mud drives organic acid synthesis in strong-flavor Baijiu production[J].Food Res Int,2021,147:110449.
[25]KANG J, HU Y, DING Z, et al.Deciphering the shifts in microbial community diversity from material pretreatment to saccharification process of Fuyu-flavor Baijiu[J].Front Microbiol,2021,12:705967.
[26]陈莹琪,陈杰,周耀进,等.浓香型大曲微生物菌群演替与吡嗪类物质合成的关系[J].食品科学,2023,44(2):222-230.
[27]LIU H L,SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[28]ZHU Y G, XIONG C, WEI Z, et al.Impacts of global change on the phyllosphere microbiome[J].New Phytol,2022,234(6):1977-1986.
[29]赖政,盛颖,肖力婷,等.鄱阳湖越冬白鹤肠道微生物群落结构及功能预测分析[J].微生物学报,2023,63(11):4302-4314.
[30]王康丽.基于宏转录组学的浓香型酒醅微生物群落多样性及代谢特征研究[D].郑州:郑州轻工业大学,2021.