爱德万甜是阿斯巴甜的衍生产品,化学结构式与纽甜类似[1],是一种新型甜味剂,其甜度是蔗糖的20 000倍[2]。2014年美国食品药品监督管理局(Food and Drug Administration,FDA)批准其作为非营养甜味剂和增味剂用于除肉类及家禽之外的食品中[3]。欧盟食品安全局对其使用限量也做了规定[4]。2017年,国家卫健委发布公告正式将爱德万甜纳入食品添加剂,并限定了其适用范围和最大使用量[5]。
目前,国内外关于爱德万甜的甜味评价和安全评价报道较多[6],但关于其测定方法的研究报道相对较少,主要集中在高效液相色谱(high performance liquid chromatography,HPLC)[7-8]、高效液相色谱-串联质谱[9-11]方法的研究上。2022年2月,国家市场监管总局发布食品补充检验方法BJS 202201《食品中爱德万甜的测定》[12],其中,高效液相色谱-串联质谱法因仪器昂贵、试验成本高,不能在检测机构尤其是县级检测机构中广泛推广普及;而高效液相色谱-荧光检测法虽然检测成本相对较低,但仅适用于加工水果中爱德万甜的测定,局限性很大。近年来,对爱德万甜检测方法的报道,主要集中在乳制品[13]、饮料[14-15]、料酒[16]、白酒[17-18]、药品糖浆[19]、电子烟烟液[20]等产品中,而酱类制品却鲜有报道。酱类制品尤其是调味酱、风味酱,在生产加工过程中会使用一定量的甜味剂来增加口感,缺少相关的检测方法会给生产企业、监管部门控制和监管产品质量带来难度。
本研究拟通过优化色谱条件,建立酱类制品中爱德万甜的超声提取-HPLC检测方法,为检测机构提升酱类制品中爱德万甜的检测能力以及相关部门对酱类制品的监管和执法提供技术支撑和方法储备。同时,依据JJF 1059.1—2012《测量不确定度评定与表示》[21],对试验中的不确定度来源及各分量的不确定度进行评定,分析影响结果可靠性的主要因素,为本试验及其他类似检测的正确评价提供科学依据。
1 材料与方法
1.1 材料与试剂
豆瓣酱:漯河市物美廉超市。
爱德万甜标准溶液(100.1 μg/mL):北京曼哈格生物科技有限公司;0.22 μm有机相微孔滤膜:天津津腾实验设备有限公司;甲醇、乙腈(均为色谱纯):德国Merck KGaA公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Waters2695型高效液相色谱仪(配有2475荧光检测器):美国Waters公司;KQ400DE型数控超声波清洗器:昆山市超声仪器有限公司;HC-3518高速离心机:科大创新股份有限公司中佳分公司;ML-204/02型电子天平:梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 标准溶液的配制
标准储备液的配制:精确吸取爱德万甜标准溶液1 mL于10 mL容量瓶中,加甲醇-水溶液(1∶1,V/V)定容至刻度,配制成质量浓度为10 μg/mL的标准储备液,冷藏储存。
标准工作液的配制:分别准确吸取0、0.05 mL、0.10 mL、0.20 mL、0.50 mL、1.00 mL、5.00 mL标准储备液于10 mL容量瓶中,用甲醇-水溶液(1∶1,V/V)定容,配制成质量浓度分别为0.、0.05 μg/mL、0.10 μg/mL、0.20 μg/mL、0.50 μg/mL、1.00 μg/mL、5.00 μg/mL的爱德万甜标准工作液。
1.3.2 样品前处理
称取粉碎后混匀的样品2.000 g(精确至0.001 g)于50 mL离心管中,加入10 mL甲醇-水溶液(1∶1,V/V),超声提取10 min,超声功率360 W,于8 000 r/min离心10 min。取上清液至25 mL容量瓶中,加入甲醇-水溶液(1∶1,V/V)定容至刻度,经0.22 μm有机滤膜过滤后,待测[7]。
1.3.3 高效液相色谱条件
C18色谱柱(150 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:A相为乙腈,B相为水;梯度洗脱条件:0~1 min,10%A;1~8 min,10%A~30%A;8~14 min,30%A;14~14.1 min,30%A~90%A;14.1~15 min,90%A;15~17 min,90%A~10%A;17~20 min,10%A。检测波长:激发波长230 nm,发射波长312 nm;进样量:10 μL[11]。在此基础上,分别考察柱温(25 ℃、30 ℃、35 ℃)、流动相(甲醇-水体系、乙腈-水体系及梯度洗脱条件)、检测波长(激发波长为232 nm、发射波长为313 nm;激发波长为230 nm、发射波长为312 nm;激发波长为230 nm,发射波长为310 nm)对样品中爱德万甜分离效果的影响。
1.3.4 定性定量方法
以色谱峰保留时间、光谱扫描图进行定性;采用外标法进行定量。
1.3.5 方法学的考察
标准曲线的绘制:采用优化后的高效液相色谱条件检测爱德万甜系列标准工作溶液,以爱德万甜的质量浓度(x)为横坐标,以峰面积(y)为纵坐标绘制标准曲线。
检出限和定量限:以空白豆瓣酱样品为基质,添加不同质量浓度的爱德万甜标准溶液,以信噪比(signal to noise ratio,S/N)为3计算检出限,信噪比为10时计算定量限。
精密度试验和加标回收率试验:以空白豆瓣酱样品为基质,分别添加低、中、高三个水平加标样品溶液(爱德万甜的终质量浓度分别为1.25 mg/kg、5.00 mg/kg、25.0 mg/kg),采用优化后的超声提取-高效液相色谱法进行提取和检测,每个质量浓度6 个平行,上机测试,分别计算加标回收率及精密度试验结果的相对标准偏差(relative standard deviation,RSD)。
1.3.6 爱德万甜含量的计算
依据检测方法和实验原理,建立测定爱德万甜的数学模型见公式(1)[22]:
式中:X为样品中爱德万甜的含量,mg/kg;c为试样溶液中爱德万甜的质量浓度,μg/mL;V为样品的定容体积,mL;m为样品质量,g。
1.3.7 不确定度来源分析
依据检测过程和数学模型,不确定度的主要来源见图1。其中,测量重复性、标准曲线拟合引入的不确定度采用A类评定方法,标准溶液、样品前处理、高效液相色谱仪引入的不确定度采用B类评定方法[21]。
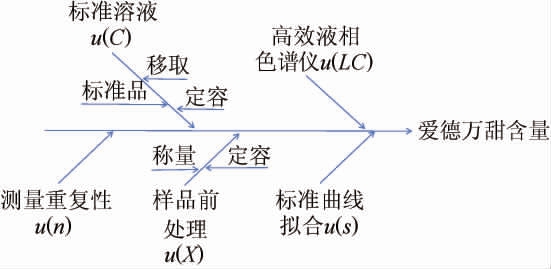
图1 不确定度的主要来源
Fig.1 Major sources of uncertainty
2 结果与分析
2.1 高效液相色谱条件的优化
2.1.1 荧光检测器波长的优化
爱德万甜的分子结构中具有刚性结构及平面结构的共轭体系,利用荧光检测器对爱德万甜进行全波长扫描,得到爱德万甜的全扫描荧光光谱图,结果见图2。由图2可知,爱德万甜在激发波长为232 nm、发射波长为313 nm时吸光度达到最高峰。
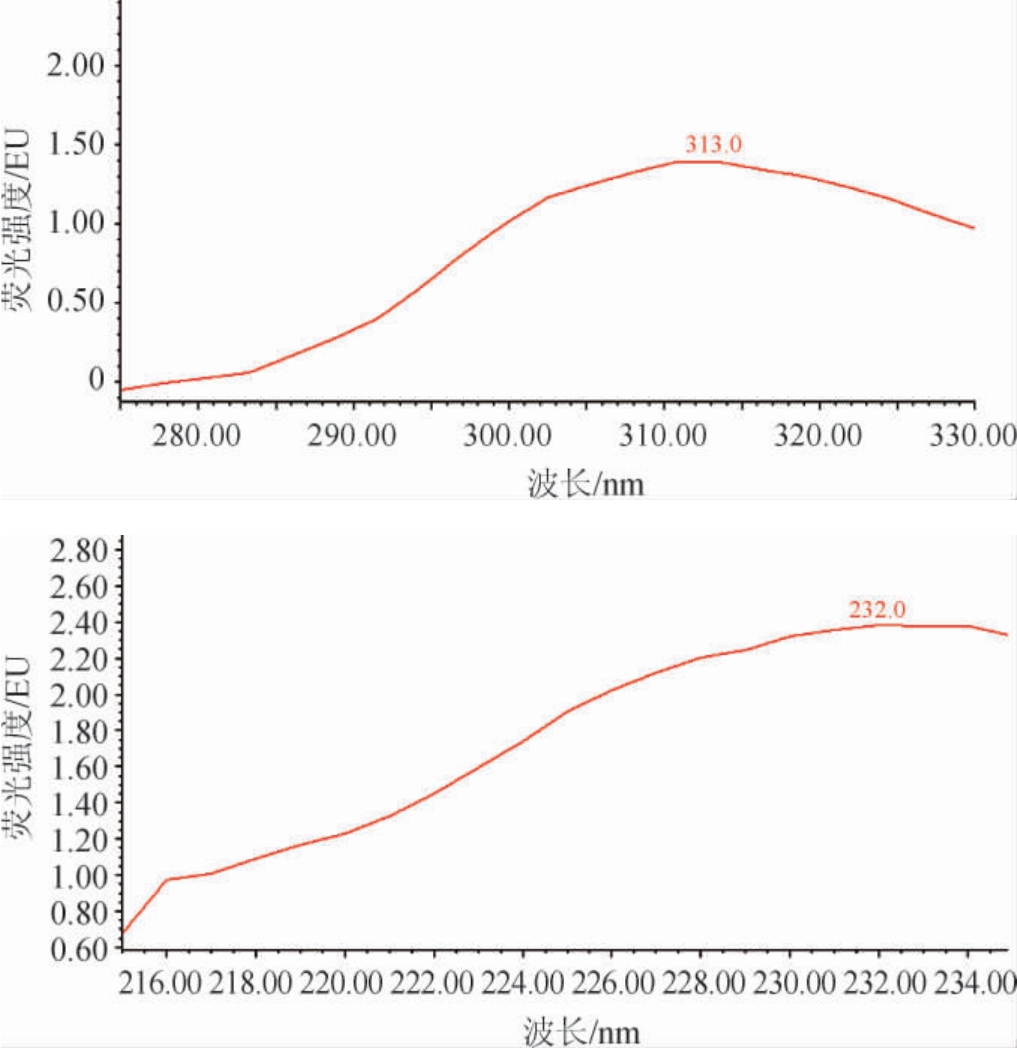
图2 爱德万甜全扫描荧光光谱图
Fig.2 Full-scan fluorescence spectra chromatogram of advantame
进一步选择该波长条件(激发波长为232 nm、发射波长为313 nm)、BJS 202201《食品中爱德万甜的测定》[12]中的参考波长(激发波长为230 nm,发射波长为312 nm)以及文献[23]中的参考波长(激发波长为230 nm,发射波长为310 nm)作为检测波长,采用HPLC检测质量浓度为1 μg/mL的爱德万甜标准工作液,结果见图3。由图3可知,在激发波长为232 nm、发射波长为313 nm时,响应值最高,说明在该条件下,灵敏度高,因此选择232 nm作为激发波长,313 nm作为发射波长。
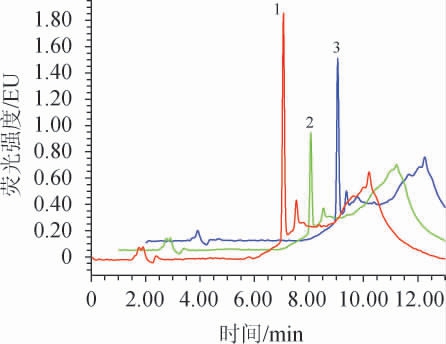
图3 不同检测波长条件下爱德万甜标准工作液(1 μg/mL)的高效液相色谱图
Fig.3 Chromatography of advantame standard solution (1 μg/ml)analyzed by HPLC at different detection wavelength
1:激发波长为232 nm、发射波长为313 nm;2:激发波长为230 nm,发射波长为312 nm;3:激发波长为230 nm,发射波长为310 nm。
2.1.2 柱温的选择
不同柱温条件下采用HPLC检测爱德万甜标准工作液(质量浓度为1 μg/mL),柱压、保留时间和色谱峰面积的变化见表1,分离效果见图4。由表1及图4可知,柱温的变化对爱德万甜的保留时间和灵敏度影响不大,且对峰型和分离度影响不大,但随着柱温的增加柱压有所降低,因此,柱温选用30 ℃,该温度既接近常温,减少消耗,又保持适当的柱压。
表1 不同柱温条件下HPLC法检测爱德万甜标准品溶液时柱压、保留时间和色谱峰面积的变化
Table 1 Changes of column pressure, retention time and chromatographic peak area for advantame standard solution detected by HPLC under different column temperature
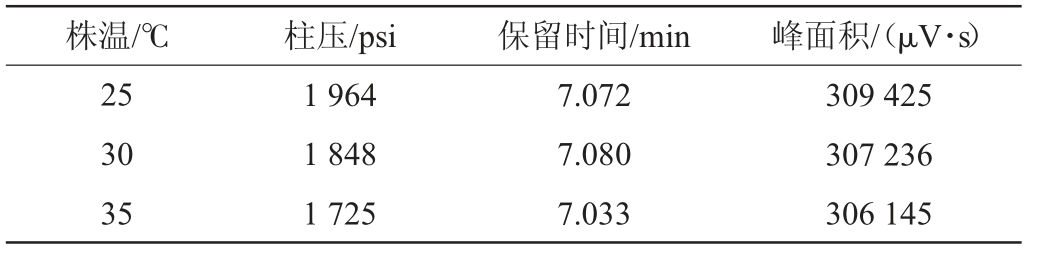
株温/℃柱压/psi保留时间/min峰面积/(μV·s)25 30 35 1 964 1 848 1 725 7.072 7.080 7.033 309 425 307 236 306 145
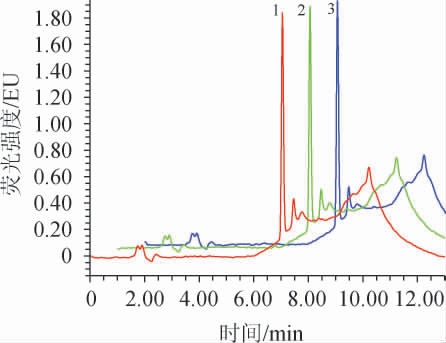
图4 不同柱温条件下爱德万甜标准工作液(1 μg/mL)的高效液相色谱图
Fig.4 Chromatography of advantame standard solution (1 μg/ml)analyzed by HPLC under different column temperature
1:柱温为25 ℃,2:柱温为30 ℃,3:柱温为35 ℃。
2.1.3 流动相的选择
分别以乙腈和甲醇作为A相,以水为B相,对爱德万甜标准工作液(质量浓度为1 μg/mL)进行梯度洗脱,结果见图5。
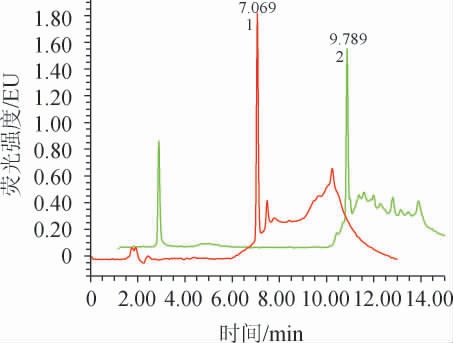
图5 不同流动相条件下爱德万甜标准工作液(1 μg/mL)的高效液相色谱图
Fig.5 Chromatography of advantame standard solution (1 μg/ml)analyzed by HPLC under different mobile phases
1:乙腈-水梯度洗脱;2:甲醇-水梯度洗脱。
由图5可知,当甲醇-水作为流动相进行梯度洗脱时,爱德万甜的保留时间为9.789 min,峰型略有干扰;当乙腈-水作为流动相进行梯度洗脱时,爱德万甜的保留时间为7.069 min,峰型良好,且与BJS 202201《食品中爱德万甜的测定》[12]中高效液相色谱-荧光检测法的保留时间(约12 min)相比,提前了5 min,大大缩短了检测时间,提升了工作效率。因此,确定以乙腈-水作为流动相进行梯度洗脱。
2.2 方法学考察
2.2.1 线性回归方程、检出限和定量限
采用最优的超声提取-高效液相色谱法检测爱德万甜系列标准工作液,得到爱德万甜的线性回归方程为y=1.64e+005x+2.74e+002,相关系数R2=0.999 8,说明爱德万甜在质量浓度为0.05 μg/mL~5.00 μg/mL范围内线性关系良好;方法的检出限为0.25 mg/kg,定量限为0.625 mg/kg。
2.2.2 加标回收率和精密度试验
加标回收率和精密度试验结果见表2。由表2可知,在高、中、低不同添加量时,加标回收率可保持在91.2%~98.5%,精密度试验结果的相对标准偏差(RSD)为1.09%~2.48%,满足GB 5009.295—2023《食品安全国家标准化学分析方法验证通则》[24]的要求,说明该检测方法可行性好,准确性好,重复性好,测定结果稳定。
表2 加标回收率和精密度试验结果
Table 2 Results of standard recovery and precision tests
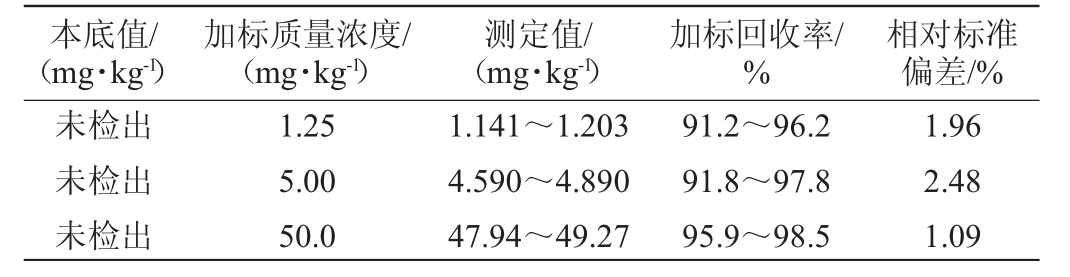
本底值/(mg·kg-1)加标质量浓度/(mg·kg-1)测定值/(mg·kg-1)加标回收率/%相对标准偏差/%未检出未检出未检出1.25 5.00 50.0 1.141~1.203 4.590~4.890 47.94~49.27 91.2~96.2 91.8~97.8 95.9~98.5 1.96 2.48 1.09
2.3 不确定度分量及计算
2.3.1 标准溶液引入的不确定度分量评定
(1)标准品引入的相对标准不确定度
根据爱德万甜标准物质证书,爱德万甜标准物质的标准值为100.1 μg/mL,相对扩展不确定度u(r)=3%,包含因子k=2,根据公式(2)计算得到爱德万甜标准品的相对标准不确定度u(B1)为0.015。
(2)配制标准溶液引入的相对标准不确定度
标准工作液配制过程中的不确定度主要来源于移取时使用的不同容量的移液器和定容时使用的容量瓶。
移取过程引入的相对标准不确定度:配制标准工作液过程中使用到的移液器最大容量分别为0.1 mL、0.2 mL、1.0 mL和5.0 mL,参照JJG 646—2006《移液器检定规程》[25],查得容量允许误差E,取矩形分布,实验室温度波动为±3 ℃,取矩形分布,分别根据公式(3)~(5)计算得到刻度误差、温度波动及移液器引入的相对标准不确定度,结果见表3。基于表3结果,进一步根据公式(6)计算得到最终移取过程引入的相对标准不确定度u(y)为0.024 9。
表3 标准工作液配制过程中移液器引入的不确定度
Table 3 Uncertainty introduced by pipette during the preparation of standard solutions

影响因素项目标准工作液质量浓度c/(μg·mL-1)0.050.10.20.51.05.010.0刻度误差温度波动移液器最大容量V/mL容量允许误差E/%标准不确定度u(k)/mL温度误差/℃水的体积膨胀系数β/℃-1标准不确定度u(w)/mL移液器引入的相对标准不确定度u(yi)0.1±3.0 0.000 866±3 0.000 21 0.000 018 2 0.017 32 0.1±2.0 0.001 155±3 0.000 21 0.000 036 4 0.011 55 0.2±1.5 0.001 732±3 0.000 21 0.000 072 7 0.008 67 1.0±1.0 0.002 887±3 0.000 21 0.000 181 9 0.005 78 1.0±1.0 0.005 774±3 0.000 21 0.000 363 7 0.005 78 5.0±0.6 0.017 321±3 0.000 21 0.001 818 7 0.003 48 1.0±1.0 0.057 735±3 0.000 21 0.003 637 3 0.005 78

式中:i为标准工作液中的第i个质量浓度点。
定容过程引入的相对标准不确定度:根据JJG 196—2006《常用玻璃量器》[26],定容所用的10 mL A级单标线容量瓶,20 ℃时其最大容量允差T为±0.02 mL,按矩形分布考虑,按照公式(7)计算得到容量瓶刻度误差引入的相对标准不确定度u(d)为0.011 5。实验室温度的波动范围为±3 ℃,水的体积膨胀系数β为2.1×10-4/℃[22,27],按照公式(8)计算得到体积变化引起的标准不确定度u(t)为0.003 64 mL。整个配制标准溶液过程使用到容量瓶共计7次,进一步按照公式(9)计算得到定容过程引入的相对标准不确定度u(p)为0.003 19。
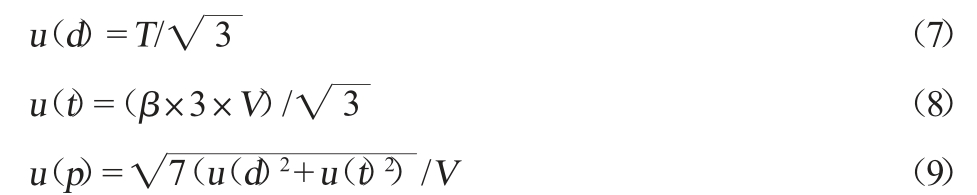
根据移液过程及定容过程引入的相对标准不确定度按照公式(10)计算得到最终配制标准溶液引入的相对标准不确定度u(B2)为0.025 1。
(3)标准溶液引入的相对标准不确定度
根据标准品和配制标准溶液引入的相对标准不确定度,按照公式(11)计算得到爱德万甜标准溶液引入的相对不确定度u(B)为0.029 2。
2.3.2 标准曲线拟合引入的不确定度分量评定
爱德万甜的线性回归方程为y=1.64e+005x+2.74e+002。以空白豆瓣酱样品为基质,添加一定浓度的爱德万甜标准溶液,按优化后的超声提取法-高效液相色谱法进行提取处理,样液测定8次,得到爱德万甜的平均质量浓度c为3.763 mg/kg。依据公式(12)~(16)计算可得到标准曲线拟合引入的相对标准不确定度u(s)为0.029 8。
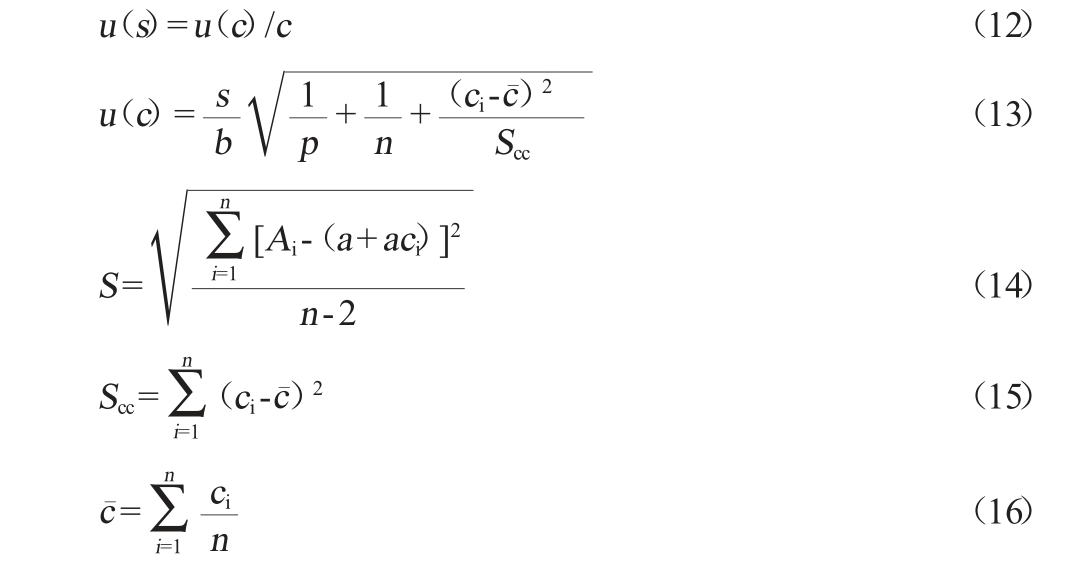
式中:Ai为标准工作液第i个质量浓度点的峰面积;a为线性回归方程的截距;b为斜率;ci为标准工作液第i个质量浓度点的质量浓度,μg/mL;n为标准工作液的质量浓度点数量;p为对试样溶液的测定次数;S为残差标准差。
2.3.3 样品前处理引入的不确定度分量评定
(1)样品称量引入的相对标准不确定度
ML-204天平精密称量样品m=2.0 g,查阅检定证书,此条件下天平最大允差Ep为±0.000 5 g,取矩形分布,按照公式(17)计算得到样品称量引入的相对标准不确定度u(m)为0.000 144。
(2)样品定容引入的相对标准不确定度
根据JJG 196—2006《常用玻璃量器》[26],样品定容所用的25 mL A级单标线容量瓶,20 ℃时其最大容量允差为±0.03 mL,按矩形分布考虑,按照公式(18)计算得到样品定容引入的相对标准不确定度u(V)为0.000 78。
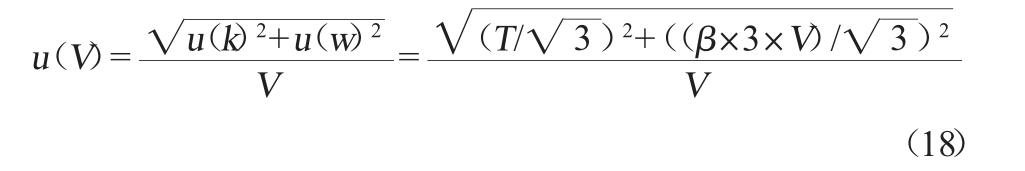
(3)样品前处理引入的相对标准不确定度
根据样品称量及定容引入的相对标准不确定度,按照公式(19)计算得到样品前处理引入的相对标准不确定度u(X)为0.000 79。
2.3.4 高效液相色谱仪引入的不确定度分量评定
查阅设备校准证书,Waters2695型高效液相色谱仪定量重复性误差Ey为0.2%,以均匀分布进行计算,按照公式(20)计算得到液相色谱仪的相对标准不确定度u(LC)为0.001 2。
2.3.5 测量重复性引入的不确定度分量评定
由2.4.2处理所得样液重复测定8次(n),测定值分别为3.750 mg/kg、3.820 mg/kgL、3.798 mg/kg、3.724 mg/kg、3.782 mg/kg、3.807 mg/kg、3.742 mg/kg、3.682 mg/kg,平均值c为3.763 mg/kg,标准偏差(standard deviation,SD)为0.047,按照公式(21)计算得到测量重复性的相对标准不确定度u(n)为0.004 4。
2.3.6 合成标准不确定度
由以上分量,根据公式(22)计算得到爱德万甜的合成相对标准不确定度urel(A)为0.042。实验测定样品中爱德万甜的平均质量浓度c为3.763 μg/kg,则根据公式(23)合成标准不确定度u(A)为0.158 mg/kg。以95%为置信限,包含因子k=2,按照公式(24)计算得到扩展不确定度U为0.316 mg/kg。由此得样品中爱德万甜含量为(3.763±0.316)mg/kg。
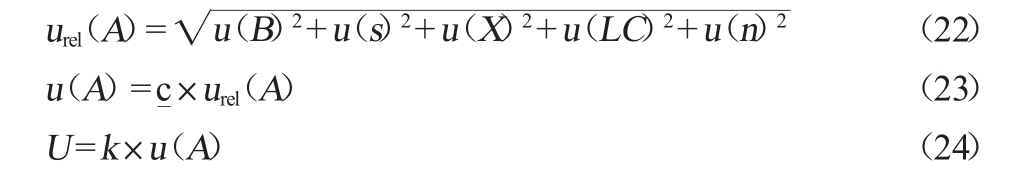
2.3.7 不确定度影响因素分析
通过对上述不确定度分量进行分析,各影响因素按大小依次为标准曲线拟合(0.029 8)、标准溶液配制(0.029 2)、测量重复性(0.004 4)、液相色谱仪(0.001 2)、样品前处理(0.000 79)。样品前处理操作相对简单,仅包含有天平和容量瓶带入的系统误差,故引入的不确定度较小,但是标准曲线拟合、标准溶液配制、测量重复性除了仪器设备带入的系统误差外,也包含偶然误差,所以引入的不确定度较大。因此在进行测定时,应提高实验人员的技术水平使其熟练操作步骤,及时调试仪器设备使其达到最优状态,增加测定的平行次数,减小样品在测定过程中引入的随机效应,减少偶然误差,进而保证检测结果的准确性与可靠性。
3 结论
本试验通过优化离心转速、离心时间等提取条件,检测波长、流动相、检测波长等仪器检测条件,建立了超声提取-高效液相色谱法测定酱类制品中的爱德万甜的检测方法,即酱类制品样品经超声提取后,经C18色谱柱(150 mm×4.6 mm,5 μm)分离,采用乙腈-水作为流动相进行梯度洗脱,激发波长为232 nm、发射波长为313 nm。在此检测条件下,爱德万甜的线性回归方程为y=1.64e+005x+2.74e+002,保留时间为7.069 min,检出限为0.25 mg/kg,定量限为0.625 mg/kg,在0.05 μg/mL~5 μg/mL的质量浓度范围内,线性关系良好,相关系数(R2)=0.999 8,加标回收率为91.2%~98.5%,精密度试验结果的RSD为1.09%~2.48%,该方法提取简单,污染少,耗时短,灵敏度高,结果准确稳定,可适用于酱类制品中爱德万甜的测定。同时通过建立数学模型,对标准溶液、标准曲线拟合、样品前处理、液相色谱仪及测量重复性引入的不确定度进行分析。结果发现,各因素中不确定度最大的是标准曲线拟合(0.029 8),其为检测过程中需要加以控制的关键点,建议在日常检测中要提高人员的操作水平,及时调试仪器设备,增加测定的平行次数,从而保证检测结果的准确性与可靠性。
[1]方聪,刘怡雪,黎四芳.新型超高甜度二肽甜味剂爱德万甜的研究进展[J].中国食品添加剂,2021,32(2):128-136.
[2]WARRINGTONS,LEEC,OTABE A,et al.Acute and multiple-dose studies to determine the safety,tolerability and pharmacokinetic profile of advantame in healthy volunteers[J].Food Chem Toxicol,2011,49:77-83.
[3]FDA.Food additives permitted for direct addition to food for human consumption; advantame[EB/OL].(2014-12-14).https://www.federalregister.gov/documents/2014/12/24/2014-30144/food-additives-permitted-fordirect-addition-to-food-for-human-consumption-advantame.
[4]乐袁通宇,陈宇坤,胡国华.爱德万甜与赤藓糖醇复配及其在酸奶中的应用[J].食品工业,2021,42(5):129-134.
[5]国家卫生和计划生育委员会.关于爱德万甜等6种食品添加剂新品种、食品添加剂环己基氨基磺酸钠(又名甜蜜素)等6种食品添加剂扩大用量和使用范围的公告(2017年第8号)[EB/OL].(2017-10-20).http://www.nhc.gov.cn/sps/s7890/201710/c4cc46c01005445f88ad169c8e820 aee.shtml.
[6]LOHNER S, TOEWS I, MEERPOHL J.Health outcomes of non-nutritivesweeteners:Analysis of the research landscape[J].J Nutr,2017,16:55.
[7]冷泽山,郭洪梅,蔡函青,等.高效液相色谱-电雾式检测器法同时检测食品中8种人工甜味剂的应用[J].应用化学,2023,40(3):436-440.
[8]汪辉,曹阳,曹雄杰,等.高效液相色谱法测定食品中爱德万甜[J].分析测试学报,2018,37(5):635-638.
[9]KOBAYASHI M, TERADA H, NAKAJIMA M.Determination method of ultra-high-intensity sweetener advantame in processed foods by HPLC and LC-MS/MS[J].J Food Hyg Soc Jpn,2015,56(1):14-18.
[10]KOKOTOU M G, THOMAIDIS N S.Characterization of the retention of artificial sweeteners by hydrophilic interaction liquid chromatography[J].Anal Lett,2018,51(1/2):49-72.
[11]LI F Y,LEE L M,CHAN S H,et al.Determination of a novel artificial sweetener advantame in food by liquid chromatography tandem mass spectrometry[J].Int J Nutr Food Eng,2015,7:29-30.
[12]国家市场监督管理总局.市场监管总局关于发布《食品中爱德万甜的测定》等5项食品补充检验方法的公告(2022年第4号)[EB/OL].(2022-02-11).https://www.samr.gov.cn/spcjs/bcjyff/
[13]杨惠成,林绪,王海鸣,等.固相萃取-超高效液相色谱-串联质谱法同时检测乳及乳制品中18种甜味剂[J].实验室检测,2023,1(5):14-22.
[14]淳泽利,谷莹莹,陈荣祥.超高效液相色谱-电化学检测法测定饮料中爱德万甜和5种二氢查耳酮类甜味剂的含量[J].理化检验-化学分册,2022,58(6):670-676.
[15]刘芸,刘红,李志全.超高效液相色谱法测定饮料中的25种常见和新型食品添加剂[J].理化检验-化学分册,2021,57(11):1017-1021.
[16]汤丽昌,陈高健,梁国华.超高效液相色谱-串联质谱法同时测定食醋、酱油及料酒中的13种甜味剂和防腐剂[J].食品安全质量检测学报,2021,12(6):2181-2188.
[17]仁绍坤,陆应彩.高效液相色谱-串联质谱法同时检测云南小曲清香型白酒中九种甜味剂的方法[J].中国食品,2021(11):70-74.
[18]郑小玲,唐柏彬,李贤良,等.超高效液相色谱-串联质谱法测定白酒中10种甜味剂[J].安徽农业科学,2021,49(5):192-196.
[19]钟菲菲,雷德卿,周金沙,等.高效液相色谱法检测药品糖浆剂中4种人工合成甜味剂[J].食品与机械,2022,38(7):75-79.
[20]叶智莲,杨文武,况利平.HPLC-ELSD法同时测定电子烟烟液中的10种甜味剂[J].云南化工,2024,51(3):86-90
[21]国家质量监督检验检疫总局.JJF 1059.1—2012 测量不确定度评定与表示[S].北京:中国质检出版社,2012.
[22]张小刚,王霞,王卫东,等.超高效液相色谱-串联质谱法测定复合调味料中爱德万甜的不确定度评定[J].食品研究与开发,2020,41(2):156-159.
[23]廖燕芝,秦海蛟,龚琴,等.食品中爱德万甜检测方法比较研究[J].中国食品卫生杂志,2019,31(1):53-58.
[24]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.295—2023 食品安全国家标准化学分析方法验证通则[S].北京:中国标准出版社,2023.
[25]国家质量监督检验检疫总局.JJG 646—2006 移液器检定规程[S].北京:中国计量出版社,2006.
[26]国家质量监督检验检疫总局.JJG196—2006 常用玻璃量器[S].北京:中国计量出版社,2006.
[27]梁洁怡,张志舟,梁柳泳,等.高效液相色谱法测定果皮丹中苯甲酸和山梨酸的不确定度评估[J].云南化工,2022,49(11):56-61.