由于葡聚糖独特的生理功能和广阔的应用前景,在食品、药品、化妆品等多个领域都展现出了巨大的增值潜力[1],是目前生物活性多糖研究的热点之一[2]。β-1,3-葡聚糖(β-1,3-glucan,β-1,3-G)和β-1,3-1,6-葡聚糖(β-1,3-1,6-glucan,β-1,3-1,6-G)是两种重要的生物活性多糖[3],广泛存在于植物[4]、微生物中[5]。它们在食品加工[6]、健康保健[7-8]等领域有广泛应用[9-10],且具有抗衰老[11-12]、抗炎[13-14]、免疫调节等生物活性[15]。β-1,3/α-1,3-葡聚糖(β-1,3/α-1,3-glucan,β-1,3/α-1,3-G)也具有生物活性,特别是在抗氧化方面[16-17]。这些葡聚糖主要通过微生物发酵生产[18],优化培养基[19]、改变培养条件[20]和改进提取方法可以提高产量[21]。
目前国内外针对β-葡聚糖的检测方法的报道较少,在较早时期KO Y T等[22]通过荧光定量的方法针对各种日常食品中的β-1,3-葡聚糖进行了微量测定。SEMEDO M C等[23]通过用刚果红染料结合高通量比色法测定了多种蘑菇菌株中的β-1,3-葡聚糖。RIEDER A等[24]基于苯胺蓝荧光检测的方法来定量了五种商业β-1,3-葡聚糖制剂添加到脆面包或酵母发酵面包中的量。NITSCHKE J等[25]基于刚果红染色开发了一种新的比色法定量食用菌中β-1,3,1,6-葡聚糖,并且通过荧光定量的方法测定了其总β-1,3-葡聚糖,将同一食用菌中的β-1,3-1,6-葡聚糖与β-1,3-葡聚糖进行了比较。KOENIG S等[26]用苯胺蓝定量测定自制发酵液中β-1,3-1,6葡聚糖。刚果红是一种苯偶氮类染料,能够与β-葡聚糖这一多糖发生特异性结合,在特定条件下形成有色复合物[27]。工业上出芽短梗霉(Aureobasidium pullulans)是一种可以产β-1,3-葡聚糖和β-1,3-1,6-葡聚糖的菌株,其二者分别为水溶性和非水溶性葡聚糖,后者经水热处理可变为水溶性[28]。出芽短梗霉发酵液中,除产葡聚糖外,还存在副产物普鲁兰多糖等多糖及未被利用的培养基成分,本研究通过单因素以及响应面实验研究刚果红法对于出芽短梗霉所产两种β-葡聚糖的最佳检测条件,通过方法学验证该法稳定性,结合以上内容通过研究并评估刚果红对发酵液中葡聚糖的检测方法,并建立高通量特异性检测方法对β-1,3-葡聚糖和β-1,3-1,6-葡聚糖在工业上的快速定量具有重要意义。
1 材料与方法
1.1 材料与试剂
β-1,3-葡聚糖(β-1,3-G)标准品(纯度99.9%)、刚果红、苯胺蓝(均为分析纯)、半纤维素标准品(纯度99.9%):上海源叶生物科技有限公司;普鲁兰标准品(纯度99.9%)、普鲁兰酶(酶活100 U/mg):日本Shodex公司;β-1,3-1,6-葡聚糖(β-1,3-1,6-G)标准品(纯度99.9%):阿勒山生物科技有限公司;β-1,3/α-1,3-葡聚糖(β-1,3/α-1,3-G)标准品(纯度99.9%):四川合泰新光生物科技有限公司;HCl、NaCl、KCl、MgCl2、FeCl2、ZnCl2、Na2HPO4、KH2PO4、甘氨酸、葡萄糖、蔗糖(均为分析纯)、酵母浸粉(生化试剂):天津盛腾达化学试剂有限公司。
1.2 仪器与设备
Epoch酶标仪、96孔酶标板:美国BioTek公司;日立F-7000荧光分光光度计、HH-M2恒温水浴锅:江苏新春兰科学仪器有限公司;25 mL高压水热合成反应釜:河南益源仪器有限公司;BLS-240热风高温烘箱:吴江华东标准烘箱有限公司。
1.3 实验方法
1.3.1 实验原理
刚果红可以与β-葡聚糖结合并在一定条件下形成有色复合物,在一定浓度范围内其吸光度值与β-葡聚糖的浓度呈正相关[29]。
1.3.2 反应染色液配制
刚果红染色液配制:首先配制15 mmol/L磷酸盐缓冲溶液(phosphate buffer solution,PBS),再称取目标质量的刚果红与15 mmol/L磷酸盐缓冲溶液混合配制成目标浓度的刚果红溶液以作为染色工作液。
1.3.3 反应检测液配制
标准品溶液的配制:分别取5 mg的β-1,3/α-1,3-葡聚糖、β-1,3-葡聚糖、普鲁兰、β-1,3-1,6-葡聚糖、半纤维素、普鲁兰酶标准品各自溶于10 mL的超纯水中配制为0.5 g/L的标准品溶液。其中β-1,3-1,6-葡聚糖标准品溶液额外配制一份装于水热合成反应釜中密封之后正置于热风高温烘箱中,设置风箱温度为180 ℃,待温度到达保持该温度15 min后取出反应釜冷却至室温待使用,其目的是为了让β-1,3-1,6-葡聚糖标准品变为水溶形式。
培养基各组分溶液配制:分别取10 mg的NaCl、KCl、MgCl2、FeCl2、ZnCl2、酵母浸粉、葡萄糖、蔗糖等各自溶于10 mL的超纯水中配制为1 g/L的各化合物溶液。
刚果红反应液配制:分别吸取140 μL的标准品或者化合物溶液在酶标板上与140 μL的刚果红溶液单孔混合至280 μL。
苯胺蓝反应液配制:标准品溶液取100 μL和900 μL工作液混合于反应管中,将反应管置于50 ℃水浴锅中孵育30 min,以加速荧光复合物的形成。待管冷却到室温(23 ℃)后,将其内容物充分振荡混合。每次测量吸取600 μL混合液于荧光池中。
1.3.4 最适刚果红质量浓度确定
配制0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L四种质量浓度的刚果红溶液分别与配制好的0.5 g/L的β-1,3-葡聚糖标准品溶液和高温处理的β-1,3-1,6-葡聚糖用酶标仪在波长510 nm条件下测定吸光度值,再用所得吸光度值减去该刚果红质量浓度下刚果红空白的吸光度值得到吸光度差值,根据其差值大小确定最适刚果红浓度。
1.3.5 刚果红法检测葡聚糖条件优化
(1)单因素试验
在反应温度10℃、20℃、30℃、40℃、50℃、60℃、70℃[18],磷酸盐缓冲液(PBS)pH 值6.0、6.5、7.0、7.5、8.0[18],反应时间10 min、20 min、30 min、40 min、50 min的条件下,分别考察上述影响因素对刚果红与两种葡聚糖(质量浓度均为0.5 g/L)的反应吸光度值的影响。
(2)响应面试验
在单因素试验验的基础上,采用Box-Behnken中心组合设计原理,以反应温度(A)、反应时间(B)、反应pH值(C)为自变量,以β-1,3-葡聚糖吸光度值(Y1)、β-1,3-1,6-葡聚糖吸光度值(Y2)为响应值,建立数学模型,采用3因素3水平Box-Behnken响应面试验优化,以得到最佳反应条件,Box-Behnken响应面试验因素与水平见表1。
表1 反应条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for reaction conditions optimization
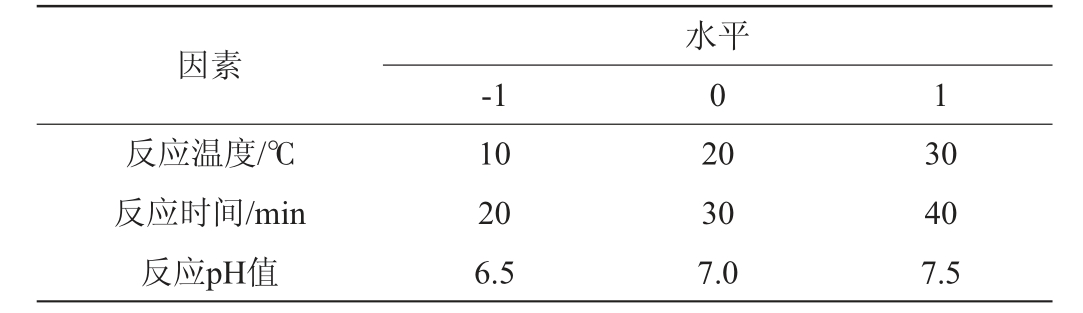
因素反应温度/℃反应时间/min反应pH值-1水平0 1 10 20 6.5 20 30 7.0 30 40 7.5
1.3.6 葡聚糖检出限、定量限的确定及标准曲线的绘制
β-1,3-葡聚糖检出限和定量限的确定:取配制好的5 g/L的标准品溶液与纯水以0.01 g/L的梯度配制0.01~0.10 g/L的低质量浓度标准溶液,之后以0.1 g/L的梯度配制0.1~5 g/L的高质量浓度标准溶液。分别吸取稀释好的140 μL的标准品溶液在酶标板上与140 μL的刚果红溶液单孔混合至280 μL待测。结果表明,β-1,3-葡聚糖在质量浓度为0.01~0.10 g/L范围内其吸光度值与空白溶液吸光度值并无差别,证明低质量浓度下刚果红与β-1,3-葡聚糖并无明显反应,在质量浓度为0.1~5.0 g/L的范围内其吸光度值呈现明显的上升趋势,但是在β-1,3-葡聚糖质量浓度>2 g/L之后,其吸光度值波动较大。因此,β-1,3-葡聚糖检出限为0.1 g/L,定量限为2 g/L。
β-1,3-1,6-葡聚糖检出限和定量限的确定:参考β-1,3-葡聚糖低浓度标准溶液与高浓度标准溶液的配制方法,分别配制两种浓度范围的高温处理的β-1,3-1,6-葡聚糖的标准溶液。分别吸取稀释好的140 μL的标准品溶液在酶标板上与140 μL的刚果红溶液单孔混合至280 μL待测。以β-1,3-1,6-葡聚糖质量浓度(x)为横坐标,酶标仪在波长510 nm处吸光度值(y)为纵坐标,绘制β-1,3-1,6-葡聚糖标准曲线。结果表明,β-1,3-1,6-葡聚糖在质量浓度为0.01~0.1 g/L的范围内其吸光度值与空白溶液吸光度值并无差别,证明低浓度下刚果红与β-1,3-1,6-葡聚糖并无明显反应,在质量浓度为0.1~0.8 g/L的范围内其吸光度值呈现明显的上升趋势,但是在β-1,3-1,6-葡聚糖质量浓度>0.8 g/L之后其吸光度值波动较大总体呈现下降趋势,其原因是随着该葡聚糖浓度的上升刚果红被高浓度的葡聚糖吸附缩合成为团状物导致吸光度值出现较大波折并且下降明显[29]。因此β-1,3-1,6-葡聚糖检出限为0.1 g/L,定量限为0.8 g/L。
β-1,3-葡聚糖标准曲线的绘制:取配制好的2 g/L的标准品溶液分别与纯水配制0.1 g/L、0.4 g/L、0.8 g/L、1.2 g/L、1.6 g/L的稀释液,之后分别吸取稀释好的140 μL的标准品溶液在酶标板上与140 μL的刚果红溶液单孔混合至280 μL待测。以β-1,3-葡聚糖质量浓度(x)为横坐标,酶标仪在波长510 nm处吸光度值(y)为纵坐标绘制β-1,3-葡聚糖标准曲线。结果表明,β-1,3-葡聚糖在质量浓度为0.1~2.0 g/L范围内线性关系良好,标准曲线回归方程为y=0.083 31x+0.611 28,相关系数R2=0.998 2。按照标准曲线回归方程计算样品中β-1,3-葡聚糖含量。
β-1,3-1,6-葡聚糖标准曲线的绘制:取配制好的2 g/L的高温处理的标准品溶液分别与纯水配制0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L、0.6 g/L、0.7 g/L、0.8 g/L的稀释液,之后分别吸取稀释好的140 μL的标准品溶液在酶标板上与140μL的刚果红溶液单孔混合至280μL待测。以β-1,3-1,6-葡聚糖质量浓度(x)为横坐标,酶标仪在波长510 nm处吸光度值(y)为纵坐标,绘制β-1,3-1,6-葡聚糖标准曲线。β-1,3-1,6-葡聚糖在质量浓度为0.1~0.8 g/L范围内线性关系良好,标准曲线回归方程为y=0.238 1x+0.615 61,相关系数R2=0.9910。按照标准曲线回归方程计算样品中β-1,3-1,6-葡聚糖含量。
1.3.7 刚果红法方法学考察
(1)精密度试验
用β-1,3-葡聚糖标准品和高温处理的β-1,3-1,6-葡聚糖标准品配制成0.8 g/L的标准待测液,配制12份一样的刚果红反应液在波长510 nm条件下用酶标仪测定吸光度值。按照标准曲线回归方程计算β-1,3-葡聚糖,β-1,3-1,6-葡聚糖含量,计算精密度试验结果相对标准偏差(relative standard deviation,RSD)。
(2)回收率试验
在酶标板上分别取五个孔,其单孔β-1,3-葡聚糖和高温水溶处理的β-1,3-1,6-葡聚糖样品量分别为40 μg、50 μg、60μg、70μg、80μg、90μg和20 μg、30 μg、40 μg、50 μg、60 μg,之后分别加入100 μg、90 μg、80 μg、70 μg、60 μg、50 μg β-1,3-葡聚糖和50 μg、40 μg、30 μg、20 μg、10 μg β-1,3-1,6-葡聚糖进行混合。两种葡聚糖与刚果红染液反应后在酶标仪波长510 nm条件下测定吸光度值,按照标准曲线回归方程计算β-1,3-葡聚糖和β-1,3-1,6-葡聚糖含量,根据其结果进行回收率、平均回收率以及RSD的计算。
1.3.8 数据处理
采用Excel 2016软件进行数据处理,采用Origin 2022进行差异显著性分析以及图片绘制,响应面使用Design Expert 13.0软件进行方案设计及结果分析,所有试验均重复3次,结果以“平均值±标准差”显示。
2 结果与分析
2.1 最适刚果红质量浓度确定
参考1.3.4节方法进行吸光度值的测定,其结果见图1。由图1可知,当刚果红在0.2 g/L时,其与两种葡聚糖所产生的红移吸光度值差值均最大,该结果说明了在刚果红质量浓度为0.2 g/L时,其与两种葡聚糖反应所产生的红移现象最为明显。这与曹桦强等[30]研究结果一致。因此,最适刚果红质量浓度为0.2 g/L。
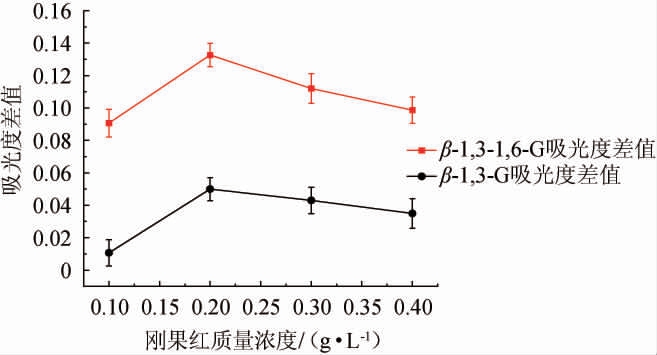
图1 β-1,3-G与β-1,3-1,6-G不同质量浓度刚果红红移吸光度差值
Fig.1 Difference in red-shifted absorbance of Congo red at different mass concentrations of β-1,3-glucan and β-1,3-1,6-glucan
2.2 刚果红法检测葡聚糖反应条件优化
2.2.1 单因素试验结果
反应温度、反应pH值、反应时间单因素试验结果见图2。由2a可知,两种葡聚糖与刚果红在反应温度10~20 ℃时,反应吸光度值均随之增高;反应温度为20 ℃时,反应吸光度值均为最高,分别为0.643和0.721;反应温度>20 ℃之后,反应吸光度值逐步下降,这是因为较高温度在一定程度上抑制了刚果红与葡聚糖的结合。因此,最适反应温度为20 ℃。由2b可知,两种葡聚糖反应pH值在6.0~7.0时,反应吸光度值均随之增高;反应pH值在7.0时,反应吸光度值均为最高,分别为0.649和0.731;反应pH值>7.0之后,反应吸光度值逐步下降,这是由于刚果红在水中电离带负电荷,在强酸或强碱环境下不利于其负电荷的屏蔽,也就不利于刚果红与β-葡聚糖结合形成复合物。因此,最适反应pH值为7.0。由2c可知,两种葡聚糖反应时间在10~40 min时,反应吸光度值均随之增高;反应时间在40 min时,反应吸光度值均为最高,分别为0.646和0.728;反应时间>40 min之后,反应吸光度值趋于平稳,这是因为β-葡聚糖与刚果红结合后,会形成一个动态的可逆反应过程。在这个过程中,随着时间的推移,反应会逐渐达到平衡状态[30]。因此,最适反应时间为40 min。
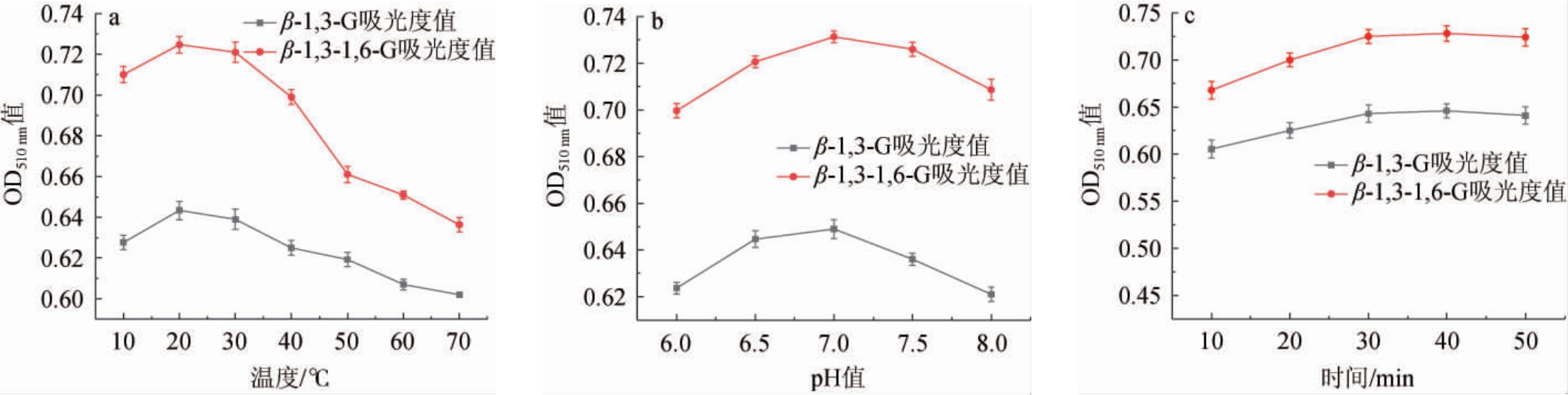
图2 刚果红法检测β-1,3-1,6-葡聚糖与β-1,3-葡聚糖条件优化单因素试验结果
Fig.2 Single factor tests results for detection conditions optimization of β-1,3-1, 6-glucan and β-1,3-glucan by Congo red method
2.2.2 响应面试验结果
以反应吸光度值(Y)为响应值,反应温度(A)、反应时间(B)、反应pH值(C)为自变量,采用Design Expert 13.0软件分别对β-1,3-葡聚糖和β-1,3-1,6-葡聚糖进行3因素3水平的Box-Behnken中心组合试验,Box-Behnken试验设计及结果见表2,回归模型方差分析结果见表3。
表2 反应条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken tests for reaction conditions optimization
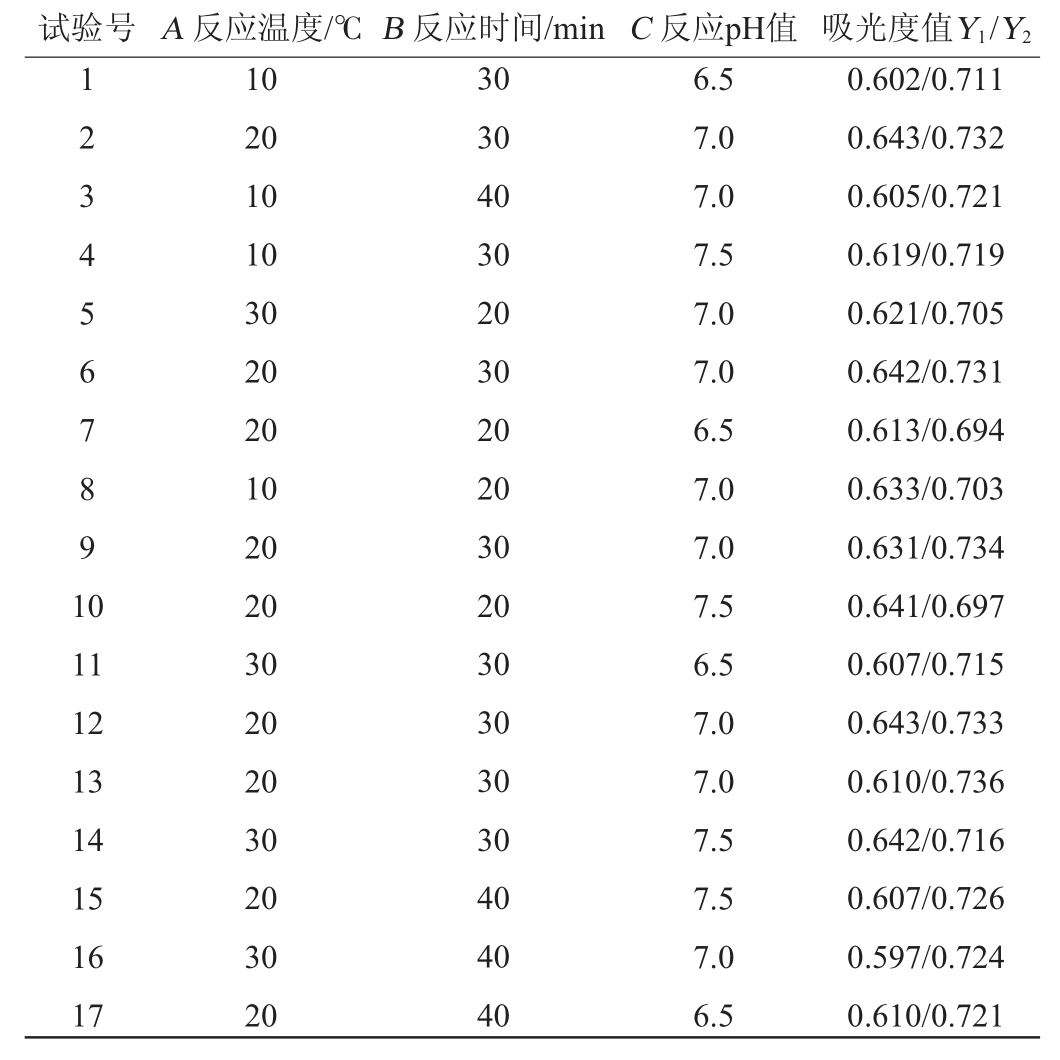
试验号 A 反应温度/℃B 反应时间/min C 反应pH值 吸光度值Y1/Y2 1234567891 0 11 12 13 14 15 16 17 10 20 10 10 30 20 20 10 20 20 30 20 20 30 20 30 20 30 30 40 30 20 30 20 20 30 20 30 30 30 30 40 40 40 6.5 7.0 7.0 7.5 7.0 7.0 6.5 7.0 7.0 7.5 6.5 7.0 7.0 7.5 7.5 7.0 6.5 0.602/0.711 0.643/0.732 0.605/0.721 0.619/0.719 0.621/0.705 0.642/0.731 0.613/0.694 0.633/0.703 0.631/0.734 0.641/0.697 0.607/0.715 0.643/0.733 0.610/0.736 0.642/0.716 0.607/0.726 0.597/0.724 0.610/0.721
表3 回归模型方差分析
Table 3 Variance analysis of regression models
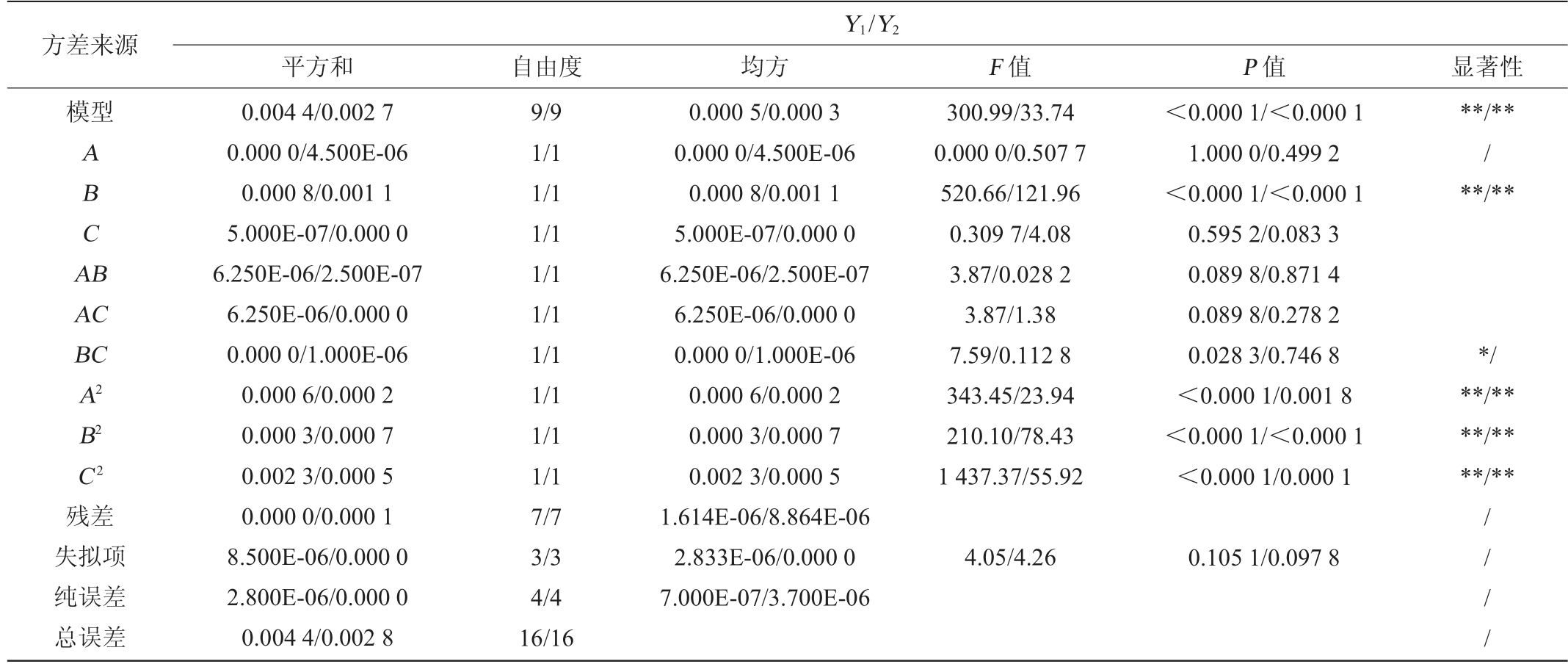
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源模型Y1/Y2平方和自由度均方F 值P 值显著性ABCA B**/**/**/**AC BC A2 B2 C2残差失拟项纯误差总误差0.004 4/0.002 7 0.000 0/4.500E-06 0.000 8/0.001 1 5.000E-07/0.000 0 6.250E-06/2.500E-07 6.250E-06/0.000 0 0.000 0/1.000E-06 0.000 6/0.000 2 0.000 3/0.000 7 0.002 3/0.000 5 0.000 0/0.000 1 8.500E-06/0.000 0 2.800E-06/0.000 0 0.004 4/0.002 8 9/9 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 7/7 3/3 4/4 16/16 0.000 5/0.000 3 0.000 0/4.500E-06 0.000 8/0.001 1 5.000E-07/0.000 0 6.250E-06/2.500E-07 6.250E-06/0.000 0 0.000 0/1.000E-06 0.000 6/0.000 2 0.000 3/0.000 7 0.002 3/0.000 5 1.614E-06/8.864E-06 2.833E-06/0.000 0 7.000E-07/3.700E-06 300.99/33.74 0.000 0/0.507 7 520.66/121.96 0.309 7/4.08 3.87/0.028 2 3.87/1.38 7.59/0.112 8 343.45/23.94 210.10/78.43 1 437.37/55.92<0.000 1/<0.000 1 1.000 0/0.499 2<0.000 1/<0.000 1 0.595 2/0.083 3 0.089 8/0.871 4 0.089 8/0.278 2 0.028 3/0.746 8<0.000 1/0.001 8<0.000 1/<0.000 1<0.000 1/0.000 1*/**/****/****/**4.05/4.26 0.105 1/0.097 8////
使用Design Expert 13.0软件进行数据的分析,通过软件的回归拟合得到β-1,3-葡聚糖和β-1,3-1,6-葡聚糖二者吸光度值(Y1和Y2)与反应温度(A)、反应时间(B)、反应pH值(C)的回归方程式分别为:

由表3可知,对于β-1,3-葡聚糖该模型P值<0.000 1,模型显著,失拟项P值0.105 1>0.05,不显著,该模型的决定系数R2为0.997 4,调整决定系数R2Adj为0.994 1,表明该模型和真实情况拟合较好,证明其试验的可靠性较高。根据P值可知,一次项B,二次项A2、B2、C2对结果影响极显著(P<0.01),交互项BC对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,影响反应吸光度值的因素次序依次为:反应时间(B)>反应pH值(C)>反应温度(A)。
由表3亦可知,对于β-1,3-1,6-葡聚糖该模型P值<0.000 1,模型显著,失拟项P值0.097 8>0.05,不显著,该模型的决定系数R2为0.977 5,调整决定系数R2Adj为0.948 5,表明该模型和真实情况拟合,证明其试验有可靠性。根据P值可知,一次项B,二次项A2、B2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。由F值可知,影响反应吸光度值的因素次序依次为:反应时间(B)>反应pH值(C)>反应温度(A)。
2.2.3 响应面交互因素分析
各因素两两之间交互作用对两种葡聚糖分析反应吸光度值的响应面和等高线分别见图3和图4。响应曲面坡度越陡峭,等高线越趋于椭圆形,则表示两者交互作用越显著;反之,响应曲面坡度越平缓,等高线越趋于圆形,则表示两者交互作用越不显著。由图3可知,反应时间(B)与反应pH值(C)交互作用响应面坡度陡峭,等高线倾向于椭圆型,因此二者交互作用对β-1,3-葡聚糖含量影响显著。由图4可知,各因素交互因素之间所成响应面并无边缘坡度陡峭中部椭圆向上突起的情况,各因素交互作用对β-1,3-1,6-葡聚糖含量影响不显著。这均与方差分析结果一致。
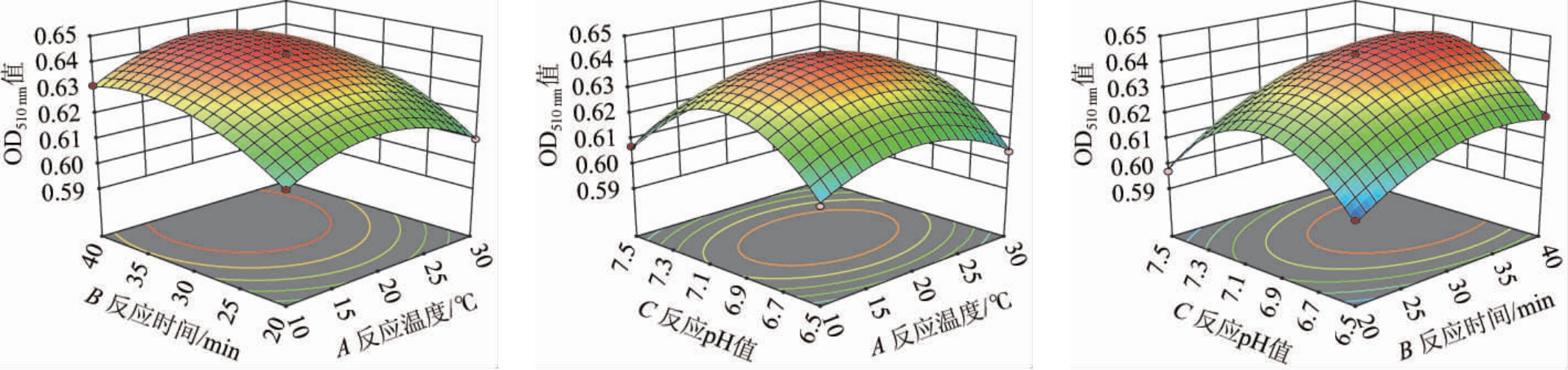
图3 各因素间交互作用对β-1,3-葡聚糖检测影响的响应面及等高线
Fig.3 Response surface plots and contour lines of effect of interaction between various factors on β-1,3-glucan detection

图4 各因素间交互作用对β-1,3-1,6-葡聚糖检测影响的响应面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between various factors on β-1,3-1,6-glucan detection
2.2.4 验证试验
为了验证模型的有效性与可行性。经过响应面软件Design-Expert 13.0 分析结果可知,对于β-1,3-葡聚糖的刚果红最佳反应条件为反应温度18.812 ℃、反应时间38.297 min、反应pH值6.984,反应吸光度值预测值为0.644。β-1,3-1,6-葡聚糖的刚果红最佳反应条件为反应温度20.483 ℃、反应时间34.544 min、反应pH7.052,吸光度预测值为0.736。为了方便操作且由于两种葡聚糖的最佳检测条件较为接近,因此两种葡聚糖统一修正检测条件为反应温度20 ℃、反应时间35 min、反应pH值7。在此优化条件下,β-1,3-葡聚糖、β-1,3-1,6-葡聚糖实际吸光度值分别为0.645和0.734,与预测值较为接近,说明响应面优化的模型有效性和可靠性较强。
2.3 方法学考察
2.3.1 精密度试验
采用刚果红检测β-1,3-葡聚糖和高温处理的β-1,3-1,6-葡聚糖进行精密度试验,其结果见表4。由表4可知,β-1,3-葡聚糖和高温处理的β-1,3-1,6-葡聚糖精密度试验结果的RSD分别为1.09%和1.15%,均<5%。结果表明,该检测方法精密度良好。
表4 刚果红法检测β-1,3-G和β-1,3-1,6-G的精密度试验结果
Table 4 Precision test results of β-1,3-G and β-1,3-1,6-G detection by Congo red method
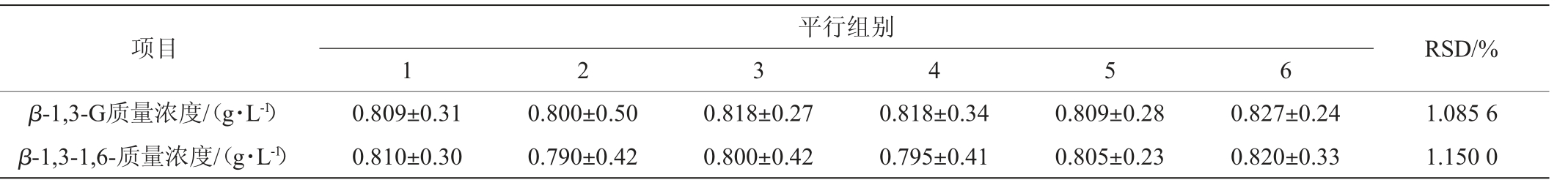
平行组别项目RSD/%β-1,3-G质量浓度/(g·L-1)β-1,3-1,6-质量浓度/(g·L-1)1 2 3 4 5 6 0.809±0.31 0.810±0.30 0.800±0.50 0.790±0.42 0.818±0.27 0.800±0.42 0.818±0.34 0.795±0.41 0.809±0.28 0.805±0.23 0.827±0.24 0.820±0.33 1.085 6 1.150 0
2.3.2 回收率试验结果
采用刚果红β-1,3-葡聚糖和高温处理的β-1,3-1,6-葡聚糖回收率试验结果分别见表5和表6。由表5和表6可知,刚果红检测方法针对于β-1,3-葡聚糖和高温处理的β-1,3-1,6-葡聚糖分析,平均回收率为99.6%和100.74%,回收率试验结果RSD值分别为2.27%和2.94%,均<5%。结果表明,该检测方法准确度高。
表5 刚果红法检测β-1,3-G的回收率试验结果
Table 5 Recovery rates test results of β-1,3-glucan detection by Congo red method
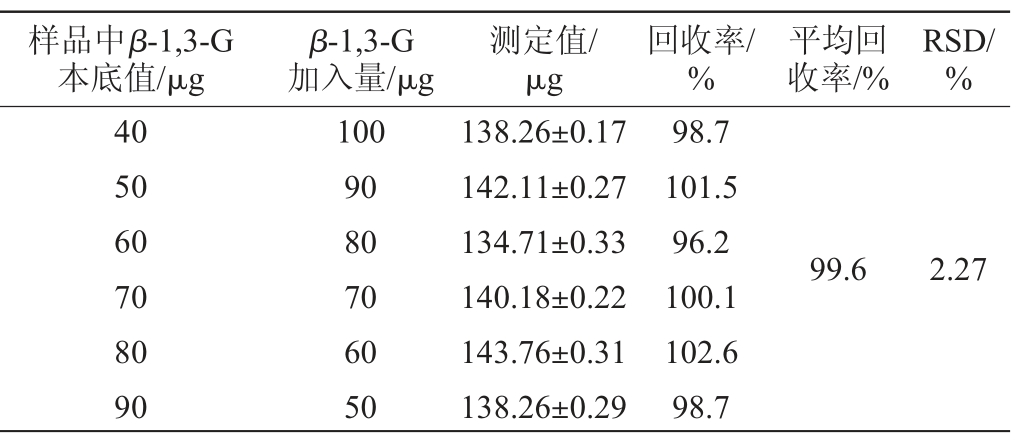
样品中β-1,3-G本底值/μg β-1,3-G加入量/μg测定值/μg回收率/%平均回收率/%RSD/%40 50 60 70 80 90 100 90 80 70 60 50 138.26±0.17 142.11±0.27 134.71±0.33 140.18±0.22 143.76±0.31 138.26±0.29 98.7 101.5 96.2 100.1 102.6 98.7 99.62.27
表6 刚果红法检测β-1,3-1,6-G的回收率试验结果
Table 6 Recovery rates test results of β-1,3-1,6-G detection by Congo red method
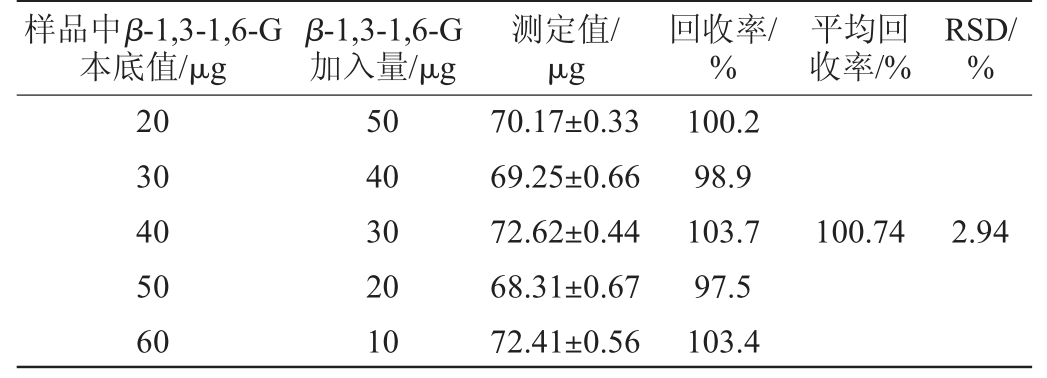
样品中β-1,3-1,6-G本底值/μg β-1,3-1,6-G加入量/μg测定值/μg回收率/%平均回收率/%RSD/%20 30 40 50 60 50 40 30 20 10 70.17±0.33 69.25±0.66 72.62±0.44 68.31±0.67 72.41±0.56 100.2 98.9 103.7 97.5 103.4 100.74 2.94
3 结论
刚果红法适宜于对β-1,3-葡聚糖和高温处理的β-1,3-1,6-葡聚糖二者的定量分析。采用单因素及响应面优化试验确定最佳的反应条件为刚果红质量浓度0.2 g/L,反应温度20 ℃,反应时间35 min,反应pH 7。在此优化反应条件下,β-1,3-葡聚糖、β-1,3-1,6-葡聚糖吸光度值分别为0.645和0.734。两种葡聚糖的检出限和定量限分别0.1 g/L、2.0 g/L及0.1 g/L、0.8 g/L。两种β-葡聚糖的精密度试验结果相对标准偏差(RSD)分别为1.09%和1.15%,平均加标回收率为99.6%和100.74%,加标回收率试验结果的RSD分别为2.27%和2.94%。表明该检测方法精密度、准确度良好。本研究为刚果红法快速准确检测β-1,3-葡聚糖和β-1,3-1,6-葡聚糖提供了实验依据与理论基础。
[1]SUZUKI T, KUSANO K, KONDO N, et al.Biological activity of highpurity β-1,3-1,6-glucan derived from the black yeast Aureobasidium pullulans:A literature review[J].Nutrients,2021,13(1):242.
[2]KIMURA Y,SUMIYOSHI M,SUZUKI T,et al.Effects of water-soluble low-molecular-weight β-1,3-D-glucan(branch β-1,6)isolated from Aureobasidium pullulans 1A1 strain black yeast on restraint stress in mice[J].J Pharm Pharmacol,2010,59(8):1137-1144.
[3]MÉLIDA H,SOPEÑA-TORRES S,BACETE L,et al.Non-branched β-1,3-glucan oligosaccharides trigger immune responses in Arabidopsis[J].Plant J,2018,93(1):34-49.
[4]TADA R,YOSHIKAWA M,KUGE T,et al.A highly branched 1,3-β-dglucan extracted from Aureobasidium pullulans induces cytokine production in DBA/2 mouse-derived splenocytes[J].Int Immunopharmacol,2009,9(12):1431-1436.
[5]RAGHAVAN K, DEDEEPIYA V D, SRINIVASAN S, et al.Beneficial immune-modulatory effects of the N-163 strain of Aureobasidium pullulansproduced 1,3-1,6 Beta glucans in Duchenne muscular dystrophy: Results of an open-label, prospective, exploratory case-control clinical study[J].IBRO Neurosci Rep,2023,15:90-99.
[6]LIU F W, LU X W, DAI W J, et al.IL-10-producing B cells regulate T helper cell immune responses during 1,3-β-glucan-induced lung inflammation[J].Front Immunol,2017,6(8):414.
[7]RAGHAVAN K, DEDEEPIYA V D, SRINIVASAN S, et al.Beneficial immune-modulatory effects of the N-163 strain of Aureobasidium pullulansproduced 1,3-1,6 Beta glucans in Duchenne muscular dystrophy:Results of an open-label, prospective, exploratory case-control clinical study[J].IBRO Neurosci Rep,2023,15(4):90-99.
[8]张琬姝,李贵玲,李亦武,等.黑酵母β1,3-1,6葡聚糖对大鼠全身电离辐射损伤的保护作用[J].医药导报,2013,32(12):1546-1551.
[9]王新建.β-1,3葡聚糖对肉鸭免疫器官指数和抗氧化能力的影响[J].中兽医学杂志,2021(6):7-9.
[10]LI W,ZHANG Y R,CONG F S.Effects of black yeast-derived β-1,3-1,6-glucan on serum cytokine and microRNA expression in transplanted sarcoma in mice[J].Biomed Rep,2013,1(1):139-143.
[11]WANG D, ZHU C, ZHANG G, et al.Enhanced β-glucan and pullulan production by Aureobasidium pullulans with zinc sulfate supplementation[J].Appl Microbiol Biot,2020,104(4):1751-1760.
[12]王国梁.出芽短梗霉发酵联产普鲁兰和β-葡聚糖研究[D].苏州:苏州大学,2023.
[13]KONO H,KONDO N,ISONO T,et al.Characterization of the secondary structure and order-disorder transition of a β-(1→3,1→6)-glucan from Aureobasidium pullulans[J].Int J Biol Macromol,2020,154:1382-1391.
[14]ZHANG G C,WANG G L,ZHU C,C et al.Metabolic flux and transcriptome analyses provide insights into the mechanism underlying zinc sulfate improved β-1,3-D-glucan production by Aureobasidium pullulans[J].Int J Biol Macromol,2020,164(1):140-148.
[15]NO H,KIM J,SEO C R,et al.Anti-inflammatory effects of β-1,3-1,6-glucan derived from black yeast Aureobasidium pullulans in RAW264.7 cells[J].Int J Biol Macromol,2021,193(15):592-600.
[16]张滨.根瘤菌β-葡聚糖的合成及其对甘油三酯代谢调控的研究[D].无锡:江南大学,2023.
[17]赵娟,刘元法,晨光,等.β-1,3/α-1,3-葡聚糖与益生菌复配物的润肠通便功能[J].食品研究与开发,2024,45(3):88-92.
[18]LIAO Y T,WANG R H,QIN X T,et al.A β-glucan from Aureobasidium pullulans enhanced the antitumor effect with rituximab against SU-DHL-8[J].Int J Biol Macromol,2022,220(1):1356-1367.
[19]谢婷.酵母β-葡聚糖的制备与β-1,3葡聚糖酶发酵工艺研究[D].武汉:湖北工业大学,2015.
[20]WANG G L,DIN A U,QIU Y S,et al.Triton X-100 improves co-production of β-1,3-D-glucan and pullulan by Aureobasidium pullulans[J].Appl Microbiol Biot,2020,104(24):10685-10696.
[21]CHEN J L,LU Y,LIU L,et al.Characteristic analysis and fermentation optimization of a novel Aureobasidium pullulans RM1603 with high pullulan yield[J].J Biosci Bioeng,2024,137(5):335-343.
[22]KO Y T,LIN Y L.1,3-β-glucan quantification by a fluorescence microassay and analysis of its distribution in foods[J].J Agr Food Chem,2004,52(11):3313-3318.
[23]SEMEDO M C,KARMALI A,FONSECA L.A high throughput colorimetric assay of β-1,3-d-glucans by Congo red dye[J].J Microbiol Meth,2015,109:140-148.
[24]RIEDER A,BALLANCE S,BÖCKER U,et al.Quantification of 1,3-β-D-glucan from yeast added as a functional ingredient to bread[J].Carbohydr Polym,2018,181(1):34-42.
[25]NITSCHKE J,MODICK H,BUSCH E,et al.A new colorimetric method to quantify β-1,3-1,6-glucans in comparison with total β-1,3-glucans in edible mushrooms[J].Food Chem,2011,127(2):791-796.
[26]KOENIG S, RÜHMANN B, SIEBER V, et al.Quantitative assay of β-(1,3)-β-(1,6)-glucans from fermentation broth using aniline blue[J].Carbohydr Polym,2017,174(15):57-64.
[27]OGAWA K, TSURUGI J, WATANABE T.Complex of gel-forming β-1,3-D-glucan with congored in alkaline solution[J].Chem Lett,1972,1:689-692.
[28]KONO H,KONDO N,HIRABAYASHI K,et al.Two-dimensional NMR data of a water-soluble β-(1→3,1→6)-glucan from Aureobasidium pullulans and schizophyllan from Schizophyllum commune[J].Data Brief,2017,15(1):382-388.
[29]张娟,杜先锋,饶砚琴.刚果红法测定燕麦中β-葡聚糖含量的研究[J].安徽农业大学学报,2007(1):23-26.
[30]曹桦强,刘琛仪,李赛芬,等.刚果红法定量检测酵母β-葡聚糖的方法研究[J].食品与发酵工业,2022,48(9):261-266.