白酒是以酒曲、酵母等为糖化发酵剂,利用粮谷或其他含淀粉或糖类的原料,经蒸煮、糖化发酵、蒸馏、陈酿(贮存)和勾调制成的蒸馏酒[1]。
中国白酒品种繁多,不同白酒产区生态环境不同,导致微生态环境也不同,微生态环境差异导致酿酒风味具有区域性特征[2-3]。白酒产区生态地理条件往往决定了白酒风味的地理独特性,所谓离开了产区就生产不出同样的白酒,也正是因为白酒产区的地理优势使得白酒具有异地不可复刻性,有相当一部分研究阐述了白酒特殊风味与生态地理条件的关系[4-5],然而都只局限于分析产区地理条件优势。
浓香型白酒采用的是中国独特的固态发酵工艺[6]。在酿造过程中,糟醅在环境微生物、大曲微生物、窖泥微生物的相互作用下,以窖池为载体,经过复杂的物质能量代谢过程进行发酵[7-8]。整个酿造操作过程是开放性的,发酵系统内的微生物与环境微生物不断交流[9],更容易网罗和聚集微生物,环境微生物群是发酵微生物群的重要来源[10],可以驱动白酒发酵过程中的微生物演替和代谢特征[11]。因此,白酒的挥发性风味特征都受到来自大曲微生物、窖泥微生物[12-14]和环境微生物区系的影响[15-16]。前期针对清香型白酒[17-19]和酱香型白酒[20-21]进行研究证明部分发酵微生物来源于车间内环境,对于浓香型白酒,窖泥微生物对酿造起着重要影响[22]。基于培养组学的研究表明[23],车间内空气中也能检测到发酵功能微生物,空气、窖泥、糟醅中的微生物群落之间存在着不同程度的相互交流,以窖泥和糟醅之间的交流最为密切。揭示产地微生物特性,分析环境与酿造过程的相互作用,可以促进高品质发酵食品的发展[24-25]。
本研究选取北纬28°黄金线上的三地进行横向比较,利用遥感技术着重分析了三地(四川省泸州市、江西省南昌市、浙江省台州市)的气候条件、生态环境、土壤及水质,通过SourceTracker定量分析对入窖糟的微生物进行溯源,为浓香型白酒特殊风味的形成与其独特的地理条件相关提供重要依据。
1 材料与方法
1.1 材料与试剂
环境样品(包括自然生态环境土壤、远离车间环境土壤、远离车间环境植物叶子表面、车间周围环境土壤、车间周围植物叶子表面、车间内环境样品(工具表面、车间内墙壁、工人皮肤表面、室内地面泥土、空气)和物料样品(大曲、高粱、稻壳、出窖糟、入窖糟、窖池壁及窖池底窖泥):来源于泸州市酒厂A、酒厂B、酒厂C;FastDNAR土壤脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国MPbio公司。
1.2 仪器与设备
Eppendorf Centrifuge 5804R冷冻离心机:德国Eppendorf公司;NanoDrop 8000超微量紫外分光光度计:美国Thermo公司;DYY-6C型电泳仪:北京市六一仪器厂;ABI 9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;Agilent 2100生物分析仪:美国Agilent公司;Q5000超微量核酸蛋白测定仪:美国Quawell公司。
1.3 方法
1.3.1 同纬度三地生态地理条件分析
(1)研究区域:选取同位于北纬28°的三个地区,即四川省泸州市、江西省南昌市、浙江省台州市。
(2)研究数据及来源:遥感数据来源于美国MODIS数据产品网站(https://search.earthdata.nansa.gov/),本文选取覆盖泸州市、南昌市以及台州市三地的影像范围(H27V6),数据产品为地表反射率(MOD09A1)、植被指数(MOD13Q1)、地表温度产品(MOD11A2)和气溶胶产品(MCD19A2),四种产品均经过辐射校正和大气校正等预处理,具有可靠的精度和质量。
气象数据为中国气象数据网(https://data.cma.cn/)下载的中国地面气候资料日值数据集,选取泸州市、南昌市以及台州市三地气象站点的气温、地表温度、降水量和相对湿度数据。该数据根据国家规范标准制作,经过了异常值检验和缺省剔除,精度可信。
1.3.2 浓香型白酒酿造车间内环境微生物区系结构分析
所有样品基因组的提取采用间接提取法:首先通过0.1 mol/L磷酸缓冲盐溶液(phosphate buffer solution,PBS)收集菌体,然后通过Fast DNAR土壤DNA提取试剂盒完成基因组提取,步骤参考操作说明书。提取得到的总DNA通过Q5000超微量核酸蛋白测定仪进行定量,并通过1%的琼脂糖凝胶电泳检测。符合测序要求的样品(质量浓度>50 ng/μL,且条带清晰)置于-80 ℃冰箱保存备用,进行扩增子三代测序。基于Pacbio测序平台,利用全长测序的方法,构建DNA文库进行扩增子测序。高通量测序在武汉未来组科技有限公司进行。
2 结果与分析
2.1 浓香型白酒独特的生态地理优势
2.1.1 气候条件
三地虽处于同一纬度,然而其气候有所不同,泸州市属亚热带湿润气候区,南昌市属于亚热带湿润季风气候,台州市属于亚热带季风气候。
泸州市、南昌市、台州市2010-2020年的年平均气温分别为18.11 ℃、19.04 ℃、16.6~17.5 ℃;年平均降水量分别为1 353.73 mm、1 790.9 mm、1 450~1 720 mm;年平均相对湿度分别为82.76%、73.8%、70%~90%;年平均风速分别为1.74 m/s、2.3 m/s、2.7 m/s;年平均日照时长分别为1 166 h、1 894~2 085 h、1 400~1 800 h。其中泸州市的年平均相对湿度(82.76%)最高、年日照时长(1 166 h)最短、年平均风速(1.74 m/s)最小,这种紫外少、湿度高、风速小的环境极易网罗和培养微生物,合适的纬度和独特的盆地地理环境,促使泸州四季温差比较小,特别是空气湿度基本属于终年恒湿,这种气候适合大部分微生物生长;且泸州市年日照时长最短,日照杀菌效果最不好,保留了更丰富的环境微生物,促使了微生物种类更加丰富,因此具备酿酒所需的极佳气候条件。
2.1.2 土壤
土壤的湿度对微生物的生长和富集起着关键性的作用。四川地区的黄黏土属于偏酸性土壤,含有多种微量成分,制成的窖泥是培养微生物的基础,是白酒酿造环节的关键因素[26]。2010-2020年泸州市土壤相对湿度变化见图1,2010-2020年泸州市、南昌市、台州市高湿度(相对湿度>0.6)土壤区域变化见图2。
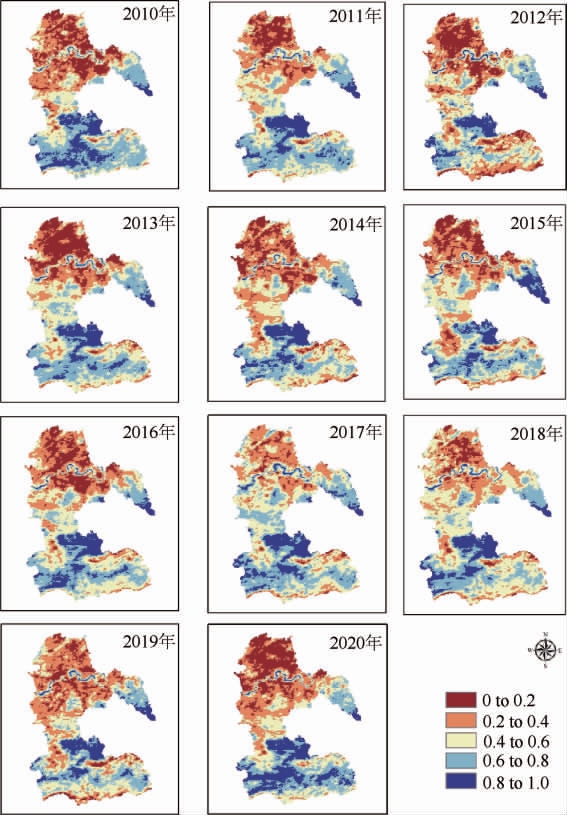
图1 2010-2020年泸州市土壤湿度变化
Fig.1 Changes of soil moisture in Luzhou during 2010-2020

图2 2010-2020年泸州市、南昌市、台州市高湿度土壤区域变化
Fig.2 Regional changes of high moisture soil in Luzhou,Nanchang and Taizhou during 2010-2020
由图1可知,2010-2020年泸州市的土壤湿度相对变化不大,说明泸州市土壤湿度稳定,土壤微生物生长环境稳定,有利于微生物的繁衍和生长,利用黄黏土制成的窖泥富含多种微生物,对白酒风味的产生有很大的贡献。
由图2可知,泸州市、南昌市、台州市土壤高湿度(相对湿度>0.6)区域面积占比最大的为泸州市,占比基本上在35%左右;其次为台州市,占比在30%左右;占比最低的为南昌市,占比在25%左右。表明三个区域中泸州市土壤湿度整体相对最高,而湿度较大的土壤环境有利于微生物的生长。
2.1.3 水质
丰富的水资源,为酿造优质白酒提供了丰富的源泉。浓香型白酒用水取自长江,水质无污染,澄清透明,清冽微甘,呈弱酸性,硬度适宜,富含多种对人体有益的矿物质,对酵母菌等有益微生物的生长繁殖和酶代谢起到了良好的促进作用。2010-2020年长江泸州段各断面水质评价结果表明,2010-2020年长江泸州段各断面水质评价结果均为Ⅱ类和Ⅲ类水质,无Ⅳ类、Ⅴ类和劣Ⅴ类水质[27];南昌市鄱阳湖流域总磷浓度偏高,主要污染物为总氮和总磷,表明水体具有富营养化问题[28];台州市近岸海域表现出污染及海水富营养化严重的问题[29]。三个城市相比,泸州市水资源丰富,水质优越。
2.2 浓香型白酒酿造产区车间内环境微生物
2.2.1 浓香型白酒酿造产区车间内微生物群落结构[2]
三个酒厂样品的微生物群落结构如图3所示。由图3A可知,从种水平进行分析,酒厂A高粱、稻壳、工具表面、墙壁黑泥、室内地面泥土、门口地面泥土、叶子表面、工厂外土壤样品中最主要的优势微生物分别为茎点霉(Phoma sp.Other)、桔青霉(Penicillium citrinum)、汉逊德巴利酵母(Debaryomyces hansenii)、Teratosphaeria sp.、伯顿毕赤酵母(Pichia burtonii)、阿萨希丝孢酵母(Trichosporon asahii)、小穴壳菌(Dothioraceae sp.331P)、高山被孢霉(Mortierella alpina);曲药、工人皮肤表面样品中主要的优势微生物均为横梗霉(Lichtheimia sp.Other)。汉逊德巴利酵母在所有的样品中均有检出,但在远离车间环境的工厂外土壤样品中的汉逊德巴利酵母含量较低,显示出厂区与自然环境微生物有着明显差异。在室内地面泥土(6.4%)及门口地面泥土(21.42%)中均检测到阿萨希丝孢酵母,但在室内地面泥土中伯顿毕赤酵母含量有10.32%,两者之间优势真菌群落有不同,说明厂区内外环境中的真菌群落组成有差异,但是存在交互影响作用,使得某些真菌在两种环境中都有着较多的分布,其中室内地面阿萨希丝孢酵母可能是通过物料运输及人员流动从门口带入。
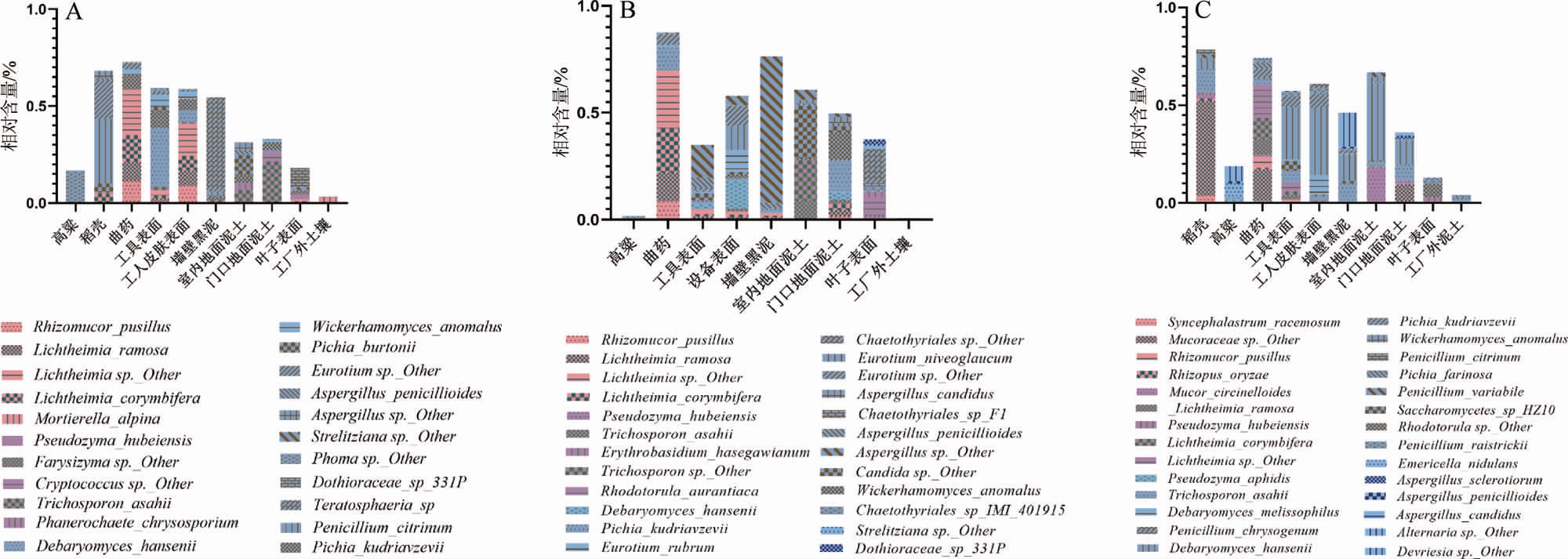
图3 不同酒厂样品的微生物群落结构
Fig.3 Microbial community structure of different wineries samples
由图3B可知,酒厂B高粱、曲药、设备表面、室内地面泥土、门口地面泥土、叶子表面、工厂外土壤样品中最主要的优势微生物分别为刺盾炱(Chaetothyriales sp.IMI 401915)、横梗霉(Lichtheimia sp.Other)、汉逊德巴利酵母、假丝酵母(Candida sp.Other)、库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、刺盾炱、总状横梗霉(Lichtheimia ramosa);工具表面、墙壁黑泥样品中主要的优势微生物均为曲霉(Aspergillus sp.Other)。曲药样品中微小根毛霉(Rhizomucor pusillus)、总状横梗霉(Lichtheimia ramosa)、伞枝犁头霉(Lichtheimia corymbifera)也是优势真菌群落,同其他酒厂的曲药样品种水平分析呈现出一致性,同时,总状横梗霉和伞枝犁头霉在过程样品(工具表面及设备表面)室内环境样品中含量也在1%左右,说明真菌在内部环境存在着一定的交互作用,这样的交互影响作用对于门口的环境也呈现出一定的影响,门口地面泥土样品中总状横梗霉和伞枝犁头霉的含量也较高。曲霉在过程样品、内部环境及门口地面样品中均为优势微生物,其中墙壁样品中,曲霉达到68%,可能因为墙壁上,与外界的交互作用相对较少,真菌群落相对稳定,靠墙存放的工具与其接触更加直接,两者之间真菌群落相互影响,组成比较类似。
由图3C可知,酒厂C高粱、墙壁黑泥、叶子表面、工厂外土壤样品中最主要的优势微生物分别为交链格孢(Alternaria sp.Other)、德福里斯孢(Devriesia sp.Other)、胶红酵母(Rhodotorula sp.Other)、雷斯青霉(Penicillium raistrickii);稻壳、曲药样品中最主要的优势微生物均为毛霉科(Mucoraceae sp.Other);工具表面、工人皮肤表面、室内地面泥土、门口地面泥土样品中最主要的优势微生物均为汉逊德巴利酵母。室内环境中大量分布汉逊德巴利酵母,而在另外两个酒厂环境中,汉逊德巴利酵母并不是显著的优势微生物,说明三个厂区内部环境的真菌群落组成存在一定的差异;同时酒厂C稻壳及门口地面样品中均有汉逊德巴利酵母、阿萨希丝孢酵母和毛霉科的分布,说明内外环境以及酿酒过程中物料的微生物存在一定的交互影响,同时,环境微生物会影响白酒的酿造过程。
进一步对产区环境微生物群落组成的差异分析,通过非度量多维尺度分析(non-metric multidimensional scaling,NMDS),结果见图4。由图4可知,显示不同样品之间真菌种群结构相似性比较,在图中分布越近,说明样品之间的群落组成更加相似,同车间的同类样品具有高度相似性,但是不同样品具有一定的差异性。
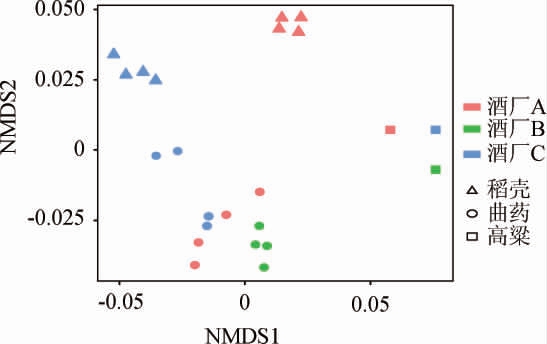
图4 不同酒厂车间内物料样品微生物组成差异分析
Fig.4 Analysis of microbial composition difference of material samples in different wineries
车间内物料样品真菌群落进行比较后,可以看出不同酒厂使用的不同物料样品的真菌群落有着明显的差异,酒厂的大曲样品相似度较高,可能是由于大曲中酿造相关微生物主要组成相似且具有一定的稳定性,所以所有酒厂的大曲样品都集中在图的左下角;而不同厂区堆放的物料高粱、稻壳表面的真菌群落组成有着显著的差异,可能是由于原料本身采购来源的不同,故在图中有着明显的区分。酒厂C的稻壳与大曲样品聚类相对集中,可能是由于物料堆积在车间内,微生物的交互作用,使得微生物的群落组成相对接近,比较集中聚集在图的左侧。
2.2.2 浓香型白酒酿造产区微生物种群多样性及溯源
分别对3个酒厂的样品进行基于Bray-curtis距离的聚类分析,结果见图5。图中的数值代表两个样品之间微生物群落组成的相似度,数值1代表两个样本的微生物群落完全相似,没有任何差异,数值越小,两个样本微生物群落之间的差异越大。

图5 不同酒厂微生物聚类分析
Fig.5 Microbial cluster analysis of different wineries
由图5A可知,酒厂A除车间室内及门口的地面样品外,其余同类样品均具有高度的相似性,而车间室内及门口的地面样品分别与墙壁黑泥样品或工厂外泥土样品相似性较高,说明了车间室内及门口的微生物群落组成分别与墙壁或者工厂外环境中的微生物群落组成相似,可以进一步证明车间内外的环境微生物存在着交互作用。而工人皮肤表面及工具表面与大曲及稻壳等物料样品的聚类也更加接近,可能是由于酿造过程中的接触,微生物产生交互作用使得其微生物群落组成具有一定的相似性。
由图5B可知,酒厂B除了高粱样品、工厂外土壤及远离厂区对照土壤外,所有的同类样品都有着高度的相似性,工厂外土壤及远离厂区对照土壤样品中微生物群落具有一定的相似性,两者的微生物群落组成接近,说明酿酒过程未使得酒厂外的环境微生物群落发生较大改变,与前面的NMDS分析结果具有一致性。室内地面泥土与墙壁黑泥的真菌群落组成更加接近,且与酒厂车间外的环境微生物组成相似性较低,说明酒厂B车间内外的环境微生物有着显著的区分。
由图5C可知,除工具表面样品外,酒厂C不同种类样品之间均有着明显的区分,门口地面泥土样品的真菌群落组成与工厂外的土壤样品更加接近,说明车间外部环境对车间周围的环境具有一定的交互作用;车间外植物叶子表面(空气)样品与车间内环境(工具及工人皮肤表面、室内地面和墙壁黑泥样品)及车间外环境(车间门口地面、工厂外土壤及远离工厂对照土壤)的相似性接近,说明车间外植物叶子表面(空气)的微生物组成即受车间内部环境的影响,又与车间外环境的微生物具有交互作用,可能车间内外环境的微生物均对其群落组成做出贡献,证明了酿造环境中微生物的交互作用。
通过SourceTracker溯源工具,将酿造微生态中潜在微生物来源对于白酒酿造的影响进行量化分析,分析结果如图6所示。
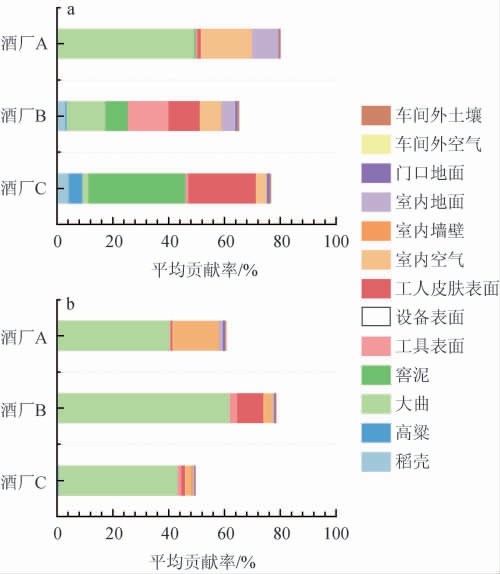
图6 不同车间入窖糟细菌(a)、真菌(b)溯源分析
Fig.6 Traceability analysis of bacteria (a) and fungi (b) in fermented grains from different wineries
结果显示大曲是浓香型白酒发酵的主要是微生物来源,特别是对于入窖糟中真菌种群贡献率为40.53%~73.28%,对于细菌种群,在新车间酒厂A中,大曲对于入窖糟中的细菌贡献也达到49.23%。同时,设备和工具表面也是入窖糟中细菌的主要来源,特别是在使用年限较久的车间中。酿造车间环境,特别是空气和地面也检测到了大量酿造功能微生物,通过溯源工具Sourcetracker的量化,证明入窖糟微生物还来源于空气和地面,说明了浓香型白酒酿造产区微生物是入窖糟微生物的重要来源之一。
3 结论
白酒酿造以生态为基础,没有良好适宜的酿酒生态环境,中国白酒将失去赖以存在的基本前提,白酒是地域生态资源的特色产业,对于生态环境有很大的依赖性。通过对泸州市、南昌市和台州市三地的生态地理条件分析,得出泸州市具有最高的年平均相对湿度(82.76%)、最短的年日照时数(1 166 h)、最小的年平均风速(1.74 m/s),气候条件最适宜微生物的生长;泸州市土壤偏酸性且湿度大,水质优越,矿物质含量丰富,有利于酿造微生物的生长繁殖。
为了验证浓香型白酒发酵环境微生物对发酵过程的影响,通过高通量测序分析酒厂车间微生物群落结构,表明车间内外的环境微生物存在着交互作用,不同厂区内部环境的真菌群落组成存在一定的差异,内外环境以及酿酒过程中物料的微生物存在一定的交互影响,同时,环境微生物会影响白酒的酿造过程。通过酒厂微生物聚类分析,证明车间内外的环境微生物存在着交互作用,但酿酒过程未使得酒厂外的环境微生物群落发生较大改变。进一步对车间入窖糟微生物进行溯源,入窖糟微生物来源于大曲、设备及工具表面、空气和地面,说明了浓香型白酒酿造产区微生物是入窖糟微生物的重要来源之一。
[1]陈兴唏,季克良.茅台酒的独特性概述[J].酿酒科技,2006(2):79-84.
[2]YUAN SK, ZHANG HD, YU XW.Fungal biogeographical patterns are key drivers shaping the regional flavor profiles of Chinese strong-flavor Baijiu[J].Food Biosci,2023(55):102951.
[3]HE Y X,LIU Z P,QIAN M,et al.Unraveling the chemosensory characteristics of strong-aroma type Baijiu from different regions using comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry and descriptive sensory analysis[J].Food Chem,2020,331:127335.
[4]唐亚,周永奎,乔宗伟,等.中国白酒金三角浓香型白酒产区气候独特性研究[J].食品与发酵科技,2013,49(6):60-67,79.
[5]赵曦琳,周永奎,乔宗伟,等.五粮液产地气候环境的独特性研究[J].酿酒,2013,40(5):5-10.
[6]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Tech,2017,63:18-28.
[7]HU X,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82(8):2506-2515.
[8]王一然,程寒,孙敏,等.白酒酿造过程中微生物多样性的研究进展[J].中国酿造,2024,43(1):1-6.
[9]XIE G F,ZHENG H J,QIU Z L,et al.Study on relationship between bacterial diversity and quality of Huangjiu (Chinese rice wine) fermentation[J].Food Sci Nutr,2021(9):3885-3892.
[10]LI Y L,LIU S P,ZHANG S Y,et al.Spatiotemporal distribution of environmental microbiota in spontaneous fermentation workshop:The case of Chinese Baijiu[J].Food Res Int,2022,156:111126.
[11]WANG L.Research trends in Jiang-flavor Baijiu fermentation:From fermentation microecology to environmental ecology[J].J Food Sci,2022,87(4):1362-1374.
[12]HE G Q,HUANG J,WU C D,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Res Int,2020,129:108851.
[13]马冲,刘淼,李涵,等.现代微生物技术在白酒酿造中的应用研究进展[J].酿酒科技,2023(5):117-122,127.
[14]毛凤娇,黄均,周荣清,等.人工窖泥微生物群落对浓香型白酒发酵过程风味代谢物形成的影响[J].食品科学,2024,45(4):125-134.
[15]WANG X, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2018,84(4):e02369-17.
[16]COLLER E,CESTARO A,ZANZOTTI R,et al.Microbiome of vineyard soils is shaped by geography and management[J].Microbiome,2019,7:1-15.
[17]PANG X N.HAN B Z, HUANG X N, et al.Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J].Sci Rep,2018,8:3396.
[18]LI XR,MA EB,YAN LZ,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146(1):31-37.
[19]乔美灵,任宇婷,张桂莲,等.传统清香型白酒发酵过程中细菌群落演替及自组装机理[J].食品科学,2023,44(22):139-148.
[20]LU Y,ZHANG C,ZHAO H,et al.Effect of environmental microorganisms on fermentation microbial community of sauce-flavor Baijiu[J].Foods,2023,12(1):10.
[21]LIU S P,JIANG Z F,MA D N,et al.Distance decay pattern of fermentedrelated microorganisms in the sauce-flavor Baijiu producing region[J].Food Biosci,2023,5:102305.
[22]ZHENG J, LIANG R, ZHANG L, et al.Characterization of microbial communities in strong aromatic liquor fermentation pit muds of different ages assessed by combined DGGE and PLFA analysis[J].Food Res Int,2013,54(1):660-666.
[23]游玲,王松,冯瑞章,等.宜宾产区浓香型白酒窖房空气、窖泥和糟醅可培养细菌的相关性[J].食品科学,2012,33(9):188-192.
[24]GAO X L,ZHANG J K,LIU E M,et al.Enhancing the taste of raw soy sauce using low intensity ultrasound treatment during moromi fermentation[J].Food Chem,2019,298:124928.
[25]GAO X L,LIU E M,ZHANG J K,et al.Accelerating aroma formation of raw soy sauce using low intensity sonication[J].Food Chem,2020,329:127118.
[26]TAO Y,WANG X,LI X Z,et al.The functional potential and active populations of the pit mud microbiome for the production of Chinese strongflavour liquor[J].Microb Biotechnol,2017,10:1603-1615.
[27]彭可,赵云锋,赵小联,等.长江泸州段水质变化与经济发展相关性分析[J].地下水,2023,45(3):100-101,109.
[28]聂含冰,闫冰,夏嵩,等.鄱阳湖南昌湖区典型断面水质变化特征及污染源解析研究——以伍湖分场国控断面为例[J].江西科学,2024,42(4):813-819,839.
[29]温世伟.基于PSR和RS的浙江台州市海洋生态安全评价研究[D].舟山:浙江海洋大学,2020.