肌醇又称维生素B8(vitamin B8,VB8),是一种从动物肌肉中分离得到的具有生物活性的环己六醇,其为人类多种细胞生长所必需[1-2],是合成肌醇磷脂、膜磷脂、鞘脂等神经组织的重要成分[3]。随着肌醇越来越多重要生理功能被挖掘,被广范应用于食品、医药和饲料等领域。在医药领域,肌醇因能增敏胰岛素、调节性激素和血糖代谢[4-6],常用于妊娠期糖尿病和多囊卵巢综合症的预防和治疗;美国食品药品监督管理局(Food and Drug Administration,FDA)已批准肌醇可用于轻度至中度阿莫茨海综合症治疗[7-8]。在食品和饲料领域,肌醇因能促进脂肪代谢、提高营养成分转化率被广泛用作营养强化剂,如作为婴幼儿奶粉、功能性饮料的营养强化剂[9]、动物饲料的生长促进剂等[10-11]。
传统肌醇生产以水压法为主,水压法因其工艺复杂、转化率低及环境污染严重等缺点严重制约其应用前景[12]。生物法制备肌醇因其原料价格低廉、来源丰富、工艺简单、成本低、环境友好等优点,展示出其明显的优势[13-15]。自然界中能产肌醇的微生物不多且肌醇产率较低,如酿酒酵母(Saccharomyces cerevisiae)、黑曲霉菌(Aspergillus niger)等,不适合作为肌醇生物合成工业化菌株[16-18]。大肠杆菌(Escherichia coli)因其良好的生长速度和清晰的遗传背景,是构建工程菌的最佳选择[19-20]。BROCKMAN I M等[21]利用基因重组技术,在大肠杆菌MG1655中引入关键酶肌醇-3-磷酸合成酶基因INO1,成功构建肌醇外源代谢途径。YI M H等[22]从酿酒酵母中克隆产肌醇关键酶基因INO1,以pTrc99a为载体,构建重组质粒pTrc99a-INO1并导入大肠杆菌E.coli K12,获得重组工程菌E.coli K12/pTrc99a-INO1。
从葡萄糖开始的肌醇合成途径简单高效,葡萄糖经磷酸转运酶系统(phosphotransferase system,PTS)从胞外转运到胞内并磷酸化成6-磷酸葡萄糖,6-磷酸葡萄糖经肌醇-1-磷酸合酶(inositol-1-phosphate synthase,IPS)氧化生成1-磷酸肌醇,1-磷酸肌醇在单磷酸酶作用下脱磷酸生产肌醇[21]。大肠杆菌虽然在重组工程菌构建中展现明显优势,但其胞内缺少内源肌醇-1-磷酸合酶基因INO1,缺少肌醇合成的内源途径。将来自酿酒酵母S.cerevisiae SC288的肌醇-1-磷酸合酶基因INO1在大肠杆菌细胞内异源表达,再利用大肠杆菌自身的磷酸转移酶和单磷酸酶就可以在其细胞内构建一条完整的异源肌醇合成途径(图1)。因此,将异源肌醇-1-磷酸合酶基因INO1构建进大肠杆菌是肌醇异源合成途径构建的关键。
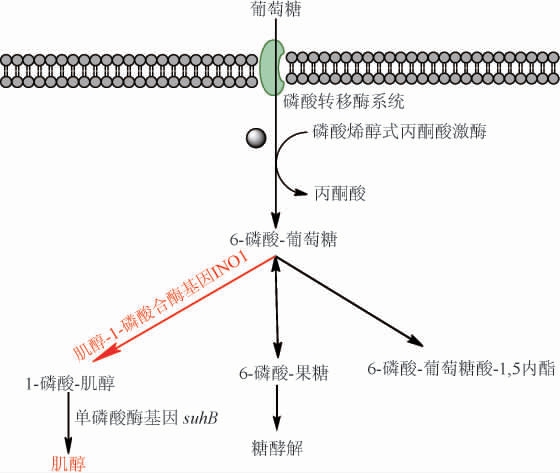
图1 大肠杆菌体内以葡萄糖为底物的肌醇生物合成途径
Fig.1 Biosynthetic pathway of myo-inositol using glucose as substrate in Escherichia coli
本研究利用基因工程技术从酿酒酵母S.cerevisiae SC288基因组中克隆肌醇合成途径关键酶IPS的表达基因INO1,以pETDuet-1为载体,构建重组质粒pETDuet-INO1并导入大肠杆菌E.coli BL21,获得重组工程菌E.coli BL21/pETDuet-INO1。采用单因素试验及正交试验对重组工程菌株E.coli BL21/pETDuet-INO1产肌醇的发酵条件进行优化,为实现工业化生物合成肌醇提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
酿酒酵母(S.cerevisiae)SC288、大肠杆菌(Escherichia coli)DH5α、大肠杆菌(Escherichia coli)BL21:本实验室保存。质粒pETDuet-1:金斯瑞生物科技有限公司。
1.1.2 化学试剂
蛋白胨、酵母粉、氯化钠、磷酸氢二钠、磷酸二氢钠、磷酸二氢钾、氯化铵、硫酸镁、氯化钙、三羟甲基氨基甲烷(Tris)、硼酸、冰醋酸、甲醇、考马斯亮蓝R-250(均为分析纯或生化试剂):国药集团化学试剂有限公司。异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside,IPTG)(分析纯)、聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒、氨苄、质粒脱氧核糖核酸(deoxyribonucleic acid,DNA)小量抽提试剂盒、柱式DNA胶回收试剂盒、酵母基因组快速抽提试剂盒、DL 10 000 DNA Marker:上海生物工程有限公司;Taq DNA聚合酶(5 U/μL)、BamH I和Hind III限制性核酸内切酶(10 U/μL)、T4 DNA连接酶(5 U/μL):宝生物工程(大连)有限公司;肌醇标准品(纯度≥99%):上海麦克林生化科技股份有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液体培养基[23]:酵母膏10 g/L、葡萄糖20 g/L、蛋白胨20 g/L,115 ℃高压蒸汽灭菌25 min。
LB液体培养基[22]:酵母粉5 g/L,氯化钠10 g/L,蛋白胨10 g/L,pH 7.0,121 ℃高压蒸汽灭菌20 min。LB固体培养基:在LB液体培养基中添加琼脂20 g/L。
发酵培养基(改良M9培养基)[24]:葡萄糖10 g/L,磷酸氢二钠6 g/L,磷酸二氢钾3 g/L,氯化铵1 g/L,氯化钠0.5 g/L,硫酸镁4.9 g/L,氯化钙0.1 g/L,酵母粉5 g/L,3-吗啉丙磺酸(3-morpholinopropanesulfonic acid,MOPS)10.5 g/L,pH 7.4,115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SPX-1508SH-II生化培养箱:上海新苗医疗器械制造有限公司;HZ-9211K恒温振荡器:太仓市科教器材厂;TGL-16G高速台式离心机:上海安亭科学仪器厂;SW-CJ净化工作台:上海新苗医疗器械制造有限公司;JY92-ⅡN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;T100 PCR仪:美国BIO-RAD公司;Gel DocXR+凝胶成像分析系统:美国BIO-RAD公司;1100高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;Aminex HPX-87H色谱柱(300 mm×7.8 mm):美国BIO-RAD公司。
1.3 方法
1.3.1 肌醇-1-磷酸合酶基因INO1的克隆
将S.cerevisiae SC288按照2%(V/V)接种量接种于YEPD培养基,28 ℃、180 r/min条件下培养18 h,采用酵母基因组快速抽提试剂盒提取S.cerevisiae SC288基因组。以其为模板,采用引物INO1-F1(5'-TCGCGAATTCATGACAGAAGATAATATT-3')和INO1-R1(5'-CTTCGGATCCTTACAACAATCTCTCTTC-3')PCR扩增肌醇-1-磷酸合酶基因INO1。PCR扩增体系(25 μL):基因组DNA模板0.2 μL,上下游引物各0.5 μL,Taq DNA聚合酶0.25 μL,10×Ex Taq Buffer 2.5 μL,10×脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mixture 2.5 μL,双蒸水(ddH2O)18.55 μL。PCR扩增条件:95 ℃预变性10 min;95 ℃变性10 s,45 ℃退火15 s,72 ℃延伸90 s,30个循环;72 ℃再延伸5 min。采用1%琼脂糖凝胶电泳对PCR扩增产物进行检测,并采用柱式DNA胶回收试剂盒将目标条带割胶回收。
1.3.2 重组质粒pETDuet-INO1的构建
采用限制性内切酶BamHI和HindIII分别双酶切肌醇-1-磷酸合酶基因INO1 PCR片段和质粒pETDuet-1,采用柱式DNA胶回收试剂盒纯化酶切片段,并采用T4 DNA连接酶连接得到重组质粒pETDuet-INO1。连接产物热激转化大肠杆菌DH5α感受态细胞,37 ℃复苏2 h,涂布于含100 μg/mL氨苄青霉素的LB固体培养基平板,37 ℃培养24 h。挑取平板上的单菌落接种于含有100 μg/mL氨苄青霉素的LB液体培养基,37 ℃培养12 h,采用质粒DNA小量抽提试剂盒提取重组质粒。采用双酶切验证质粒和基因大小,并进一步将重组质粒送金斯瑞生物公司测序验证,得到正确的阳性转化子。
1.3.3 重组工程菌的构建
将测序验证正确的阳性转化子,按照2%(V/V)的接种量接种于含有100 μg/mL氨苄青霉素的LB液体培养基,37 ℃培养12 h。采用质粒DNA小量抽提试剂盒提取重组质粒pETDuet-INO1,导入大肠杆菌BL21感受态细胞中,37 ℃复苏2 h,涂布于含100 μg/mL氨苄青霉素的LB固体培养基平板,37 ℃培养24 h。挑选平板上长出的单菌落接种于LB液体培养基,37 ℃培养12 h,采用质粒DNA小量抽提试剂盒提取重组质粒。采用双酶切验证质粒和基因大小,并进一步将重组质粒送金斯瑞生物公司测序验证,得到重组工程菌阳性转化子E.coli BL21/pETDuet-INO1,-80 ℃甘油管保藏。
1.3.4 重组工程菌肌醇-1-磷酸合酶的诱导表达
将E.coli BL21与重组工程菌E.coli BL21/pETDuet-INO1按2%(V/V)的接种量,分别接种于50 mL LB液体培养基(含100 μg/mL氨苄青霉素)中,于37 ℃、180 r/min条件下摇床振荡培养16 h作为种子液。再按2%(V/V)的接种量将种子液转接至装液量为50 mL的LB液体培养基(含100 μg/mL氨苄青霉素)中,于37 ℃、180 r/min条件下摇床振荡培养至OD600 nm值为0.8时,加入终浓度为1 mmol/L的IPTG,28 ℃、180 r/min条件下低温诱导培养12 h[25]。
1.3.5 肌醇-1-磷酸合酶SDS-PAGE电泳分析
取诱导培养12 h的重组工程菌E.coli BL21/pETDuet-INO1菌液50 mL,6 000 r/min离心10 min去除上清液,收集菌体。将菌体悬浮于2 mLpH 6.8磷酸缓冲盐溶液(phosphate buffer saline,PBS),超声破碎(功率350 W,工作5 s,停止3 s,持续20 min),得到菌体细胞破碎液。
取1 mL细胞破碎液,4 ℃、6 000 r/min条件下离心5 min,取上清液。细胞破碎液与上清液中分别加入20 μL 5×上样缓冲液,并加入80 μL蒸馏水,混匀,沸水浴煮沸5 min。取15 μL样品,使用10%分离胶和5%浓缩胶进行SDS-PAGE。电泳结束后采用考马斯亮蓝染色液(1 g考马斯亮蓝、450 mL甲醇溶液、100 mL冰醋酸、450 mL双蒸水)染色30 min,采用脱色液(30 mL甲醇、60 mL超纯水、10 mL冰醋酸)脱色1 h,经成像仪观察蛋白电泳条带。
1.3.6 重组工程菌Escherichia coli BL21/pETDuet-INO1发酵产肌醇条件优化
(1)单因素试验
将重组菌大肠杆菌E.coli BL21/pETDuet-INO1种子液按2%(V/V)的接种量,接种于装液量为50 mL/250 mL的发酵培养基中,于37 ℃、180 r/min条件下培养至OD600 nm值为0.8时,加入终浓度为1 mmol/L的IPTG诱导,28 ℃条件下发酵24 h,采用HPLC法[26]测定发酵液中肌醇产量。在此基础上,分别考察初始葡萄糖添加量(6%、8%、10%、12%、14%)、诱导温度(25 ℃、28 ℃、31 ℃、34 ℃、37 ℃)、接种量(1%、2%、3%、4%、5%)对重组工程菌E.coli BL21/pETDuet-INO1发酵产肌醇的影响。
(2)正交试验
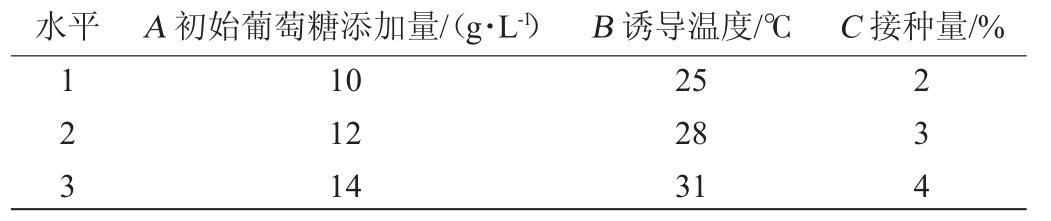
在单因素试验基础上,以初始葡萄糖添加量(A)、诱导温度(B)、接种量(C)为考察因素,肌醇产量为考察指标,设计3因素3水平的L9(33)正交试验,试验因素与水平见表1。
表1 重组工程菌Escherichia coli BL21/pETDuet-INO1产肌醇发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization of myo-inositol production by recombinant Escherichia coli BL21/pETDuet-INO1
水平 A 初始葡萄糖添加量/(g·L-1) B 诱导温度/℃ C 接种量/%123 10 12 14 25 28 31 234
1.3.7 数据处理与统计分析
所有试验重复3次,利用SPSS 23.0软件对数据进行处理和分析,结果用“平均值±标准差”表示,利用Origin Pro 9.0软件作图。
2 结果与分析
2.1 重组工程菌Escherichia coli BL21/pETDuet-INO1的构建
将质粒pETDuet-1与重组质粒pETDuet-INO1经BamH I、Hind III双酶切后,采用1%琼脂糖凝胶进行电泳分析,结果见图2。由图2可知,泳道1基因条带碱基长度与质粒pETDuet-1理论值(5 420 bp)符合,泳道2两条条带碱基长度分别与质粒pETDuet-1(5 420 bp)、目标基因INO1理论值(1 602 bp)符合。将重组质粒pETDuet-INO1送金斯瑞生物测序,并将测序序列与美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)GenBank数据库公布的INO1基因序列比对。结果发现,测序序列与NCBI GenBank数据库中S.cerevisiae SC288 基因组中的INO1基因序列相似性为100%,证明重组工程菌E.coli BL21/pETDuet-INO1构建成功。
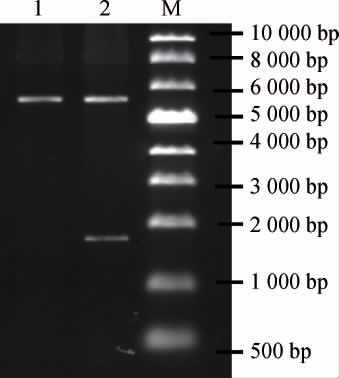
图2 双酶切质粒pETDuet-1及重组质粒pETDuet-INO1琼脂糖凝胶电泳结果
Fig.2 Agarose gel electrophoresis results of double enzyme digestion plasmid pETDuet-1 and recombinant plasmid pETDuet-INO1
M为DL 10 000 DNA Marker,1为质粒pETDuet-1双酶切,2为重组质粒pETDuet-INO1双酶切。
2.2 重组工程菌Escherichia coli BL21/pETDuet-INO1肌醇-1-磷酸合酶的诱导表达分析
重组工程菌E.coli BL21/pETDuet-INO1经过IPTG诱导表达后经SDS-PAGE电泳分析,结果见图3。
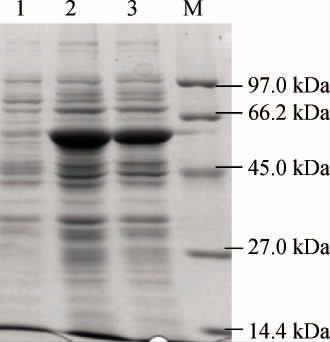
图3 Escherichia coli BL21及重组工程菌Escherichia coli BL21/pETDuet-INO1诱导表达肌醇-1-磷酸合酶的SDS-PAGE蛋白电泳结果
Fig.3 SDS-PAGE results of inositol-1-phosphate synthase induced and expressed by Escherichia coli BL21 and recombinant Escherichia coli BL21/pETDuet-INO1
M为蛋白Marker,泳道1为E.coli BL21细胞破碎液,泳道2、3分别为
E.coli BL21/pETDuet-INO1的细胞破碎液和细胞破碎上清液。
由图3可知,在第2、3泳道的60 kDa左右处有一条明显的蛋白条带,蛋白条带的大小和肌醇氧化酶理论值60 kDa大小接近。作为对照E.coli BL21细胞破碎液,在此位置未能看到明显蛋白条带,说明肌醇-1-磷酸合酶基因INO1在大肠杆菌中成功高效可溶性表达。
2.3 重组工程菌Escherichia coli BL21/pETDuet-INO1产肌醇发酵条件优化单因素试验
2.3.1 初始葡萄糖添加量对肌醇产量的影响
由图4可知,随着初始葡萄糖添加量的升高,肌醇产量呈先上升后下降的趋势。当初始葡萄糖添加量为12 g/L时,肌醇产量最高,为(0.69±0.004)g/L。过高的初始葡萄糖添加量不利于重组工程菌E.coli BL21/pETDuet-INO1肌醇产量的积累,分析原因可能是,葡萄糖经过PTS转运系统从胞外能快速进入胞内,迅速进入胞内的碳源被大量流入糖酵解途径和磷酸戊糖途径从而产生大量的副产物,如乙酸、丁酸等,而副产物的积累对菌体自身生长和目标产物合成产生明显抑制作用[27]。因此,确定最佳初始葡萄糖添加量为12 g/L。
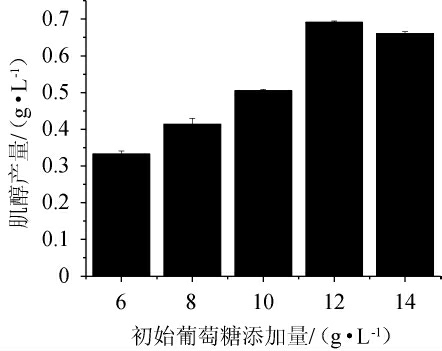
图4 初始葡萄糖添加量对重组工程菌Escherichia coli BL21/pETDuet-INO1肌醇产量的影响
Fig.4 Effect of initial glucose addition on myo-inositol production by recombinnant Escherichia coli BL21/pETDuet-INO1
2.3.2 接种量对肌醇产量的影响
由图5可知,随着接种量的增加,肌醇的产量呈先上升后下降的趋势。当接种量为3%(V/V)时,肌醇产量最高,为(0.68±0.004)g/L。过高的接种量不利于重组工程菌E.coli BL21/pETDuet-INO1肌醇产量的积累,分析原因可能是,接种量过大,菌体适应发酵培养条件时间短,迅速进入对数生长期,对培养基中的碳源葡萄糖吸收过快,迅速吸收的葡萄糖作为细胞生长所需的能量被大量消耗,进入到大肠杆菌的内源主要代谢途径:如糖酵解途径,减少了以葡萄糖为底物开始的外源肌醇合成途径中碳源的流入,导致肌醇产量下降[21]。因此,确定最佳接种量为3%。
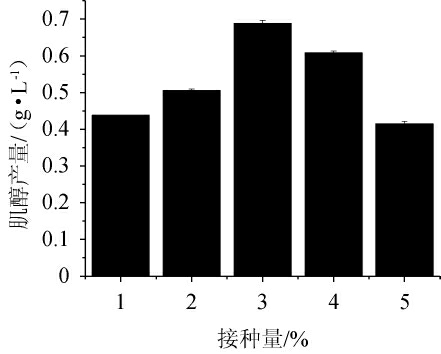
图5 接种量对重组工程菌Escherichia coli BL21/pETDuet-INO1肌醇产量的影响
Fig.5 Effect of inoculum on myo-inositol production by recombinnant Escherichia coli BL21/pETDuet-INO1
2.3.3 诱导温度对肌醇产量的影响
由图6可知,随着诱导温度的升高,肌醇产量呈先上升后下降的趋势。当诱导温度为28 ℃时,肌醇产量最高,为(0.51±0.005)g/L。过高的诱导温度不利于重组工程菌E.coli BL21/pETDuet-INO1肌醇产量的积累,分析原因可能是,过高的诱导温度让异源蛋白在大肠杆菌体内表达过快却来不及折叠,导致表达蛋白在胞内形成包涵体,酶活性下降[28]。另外,温度升高对载体质粒的稳定性有一定影响,可能导致质粒的丢失[29]。因此,确定最佳诱导温度为28 ℃。
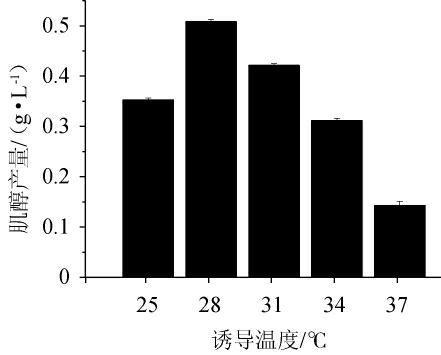
图6 诱导温度对重组工程菌Escherichia coli BL21/pETDuet-INO1肌醇产量的影响
Fig.6 Effect of induction temperature on myo-inositol production by recombinnant Escherichia coli BL21/pETDuet-INO1
2.4 重组工程菌Escherichia coli BL21/pETDuet-INO1产肌醇发酵条件优化正交试验
在单因素试验基础上,以初始葡萄糖添加量(A)、诱导温度(B)、接种量(C)为考察因素,肌醇产量为考察指标,设计3因素3水平的L9(33)正交试验,试验结果及分析见表2,方差分析见表3。
表2 重组工程菌Escherichia coli BL21/pETDuet-INO1产肌醇发酵条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization of myo-inositol production by recombinant Escherichia coli BL21/pETDuet-INO1
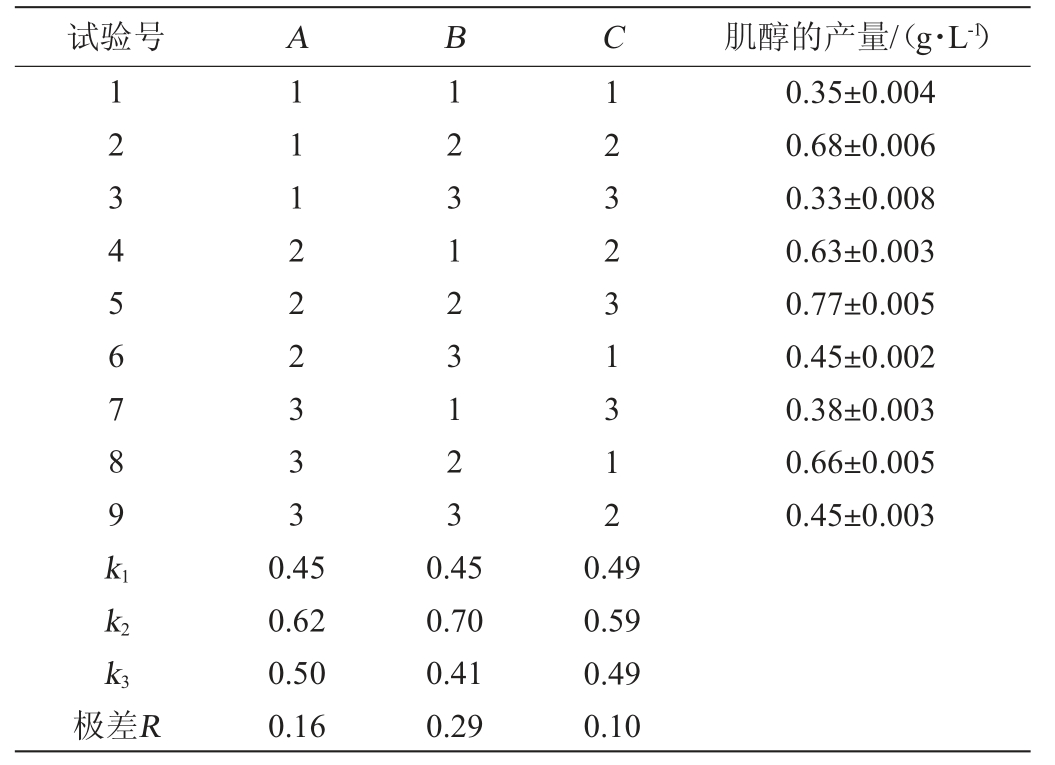
试验号ABC肌醇的产量/(g·L-1)123456789k1 111222333 123123123 123231312 0.35±0.004 0.68±0.006 0.33±0.008 0.63±0.003 0.77±0.005 0.45±0.002 0.38±0.003 0.66±0.005 0.45±0.003 k2 k3极差R 0.45 0.62 0.50 0.16 0.45 0.70 0.41 0.29 0.49 0.59 0.49 0.10
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiment results
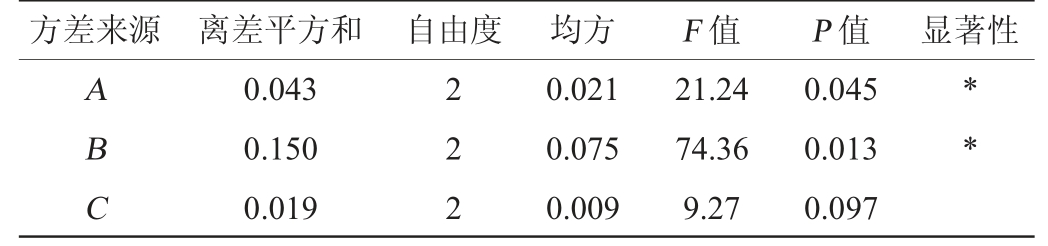
注:“*”表示对结果影响显著(P<0.05)。
方差来源 离差平方和 自由度 均方F 值P 值 显著性ABC 0.043 0.150 0.019 222 0.021 0.075 0.009 21.24 74.36 9.27 0.045 0.013 0.097**
由表2中的极差大小可知,各因素对肌醇产量影响顺序为B>A>C,即诱导温度>初始葡萄糖添加量>接种量。根据k值大小得知各因素最优水平组合为A2B2C2,即重组工程菌E.coli BL21/pETDuet-INO1合成肌醇的最佳发酵条件组合为:初始葡萄糖添加量12 g/L、诱导温度28 ℃、接种量3%。在此条件下进行3次平行发酵试验,肌醇的产量为(0.81±0.007)g/L,较优化前提高60.39%。
由表3可知,诱导温度、初始葡萄糖添加量的变化对肌醇的产量有显著影响(P<0.05),为关键影响因子,接种量对肌醇产量的影响不显著(P>0.05)。分析原因可能是,发酵过程中诱导温度升高,肌醇-1-磷酸合酶很有可能产生包涵体,因此对肌醇产量有明显的影响[30]。葡萄糖在发酵过程中发挥双重作用:重组工程菌细胞生长的碳源和肌醇合成底物。过高的初始葡萄糖添加量,可能影响葡萄糖摄入速度和在细胞内代谢副产物的积累,因此对肌醇产率的影响较大[31]。
3 讨论
重组工程菌E.coli BL21/pETDuet-INO1能有效合成肌醇,产量达到(0.81±0.007)g/L,转化率为6.75%,离工业化生产还有一定的距离。肌醇产率不高,有两个可能的原因。首先,肌醇合成重组工程菌虽然高效表达了IPS酶基因INO1,但肌醇合成途径中其他相关酶却没有相应高效表达[32-33]。其次,肌醇生物合成途径中,葡萄糖经过PTS系统生成的6-磷酸-葡萄糖能同时转入糖酵解途径、磷酸戊糖途径和肌醇合成途径等碳源代谢途径。其中前两个途径是大肠杆菌的内源途径,大量的6-磷酸-葡糖流入满足菌体的生长和能量代谢,肌醇合成途径是大肠杆菌的异源途径,在6-磷酸-葡糖的竞争中并无优势。因此,减弱糖酵解途径和磷酸戊糖途径对6-磷酸葡萄糖分流,或者为这两个途径找到替代的碳源,才能有更多的6-磷酸-葡萄糖流入肌醇合成途径。SHIU E等[34]通过敲除糖酵解途径中磷酸葡萄糖异构酶基因pgi和磷酸戊糖途径6-磷酸葡萄糖脱氢酶基因zwf,将更多的碳源流入肌醇代谢途径;GUPTA A等[35]通过动态调节大肠杆菌代谢途径,在菌体生长的前期将碳源调控流入糖酵解途径满足菌体生长需要,在菌体生长到达稳定期后将碳源调控流入肌醇合成途径,重组工程菌肌醇产率较原始菌提高5.5倍;TANG E J等[36]将大肠杆菌改造为能利用甘油作为碳源维持菌体细胞生长的工程菌,葡萄糖在代谢中仅作为肌醇合成的底物,通过对葡萄糖进行补料发酵,基因工程菌肌醇产量可达21 g/L。因此,提高肌醇产率的另一个有效途径是对大肠杆菌的自身的代谢途径进行优化改造。
4 结论
本研究以S.cerevisiae SC288基因组为模版,克隆肌醇合成途径关键酶IPS的表达基因INO1,以pETDuet-1为载体,构建重组质粒pETDuet-INO1,导入E.coli BL21,成功构建重组工程菌E.coli BL21/pETDuet-INO1。IPS在重组工程菌E.coli BL21/pETDuet-INO1高效可溶性表达,实现了E.coli BL21体内肌醇合成途径的异源引入。通过单因素试验及正交试验优化得到重组工程菌E.coli BL21/pETDuet-INO1产肌醇的最优发酵条件为:初始葡萄糖添加量12 g/L、诱导温度28 ℃、接种量3%。在此条件下,肌醇的产量为(0.81±0.007)g/L,较优化前提高60.39%。本研究为生物合成肌醇工业化生产提供了理论支持。
[1]JIN X,FOLEY K M,GEIGER J H,et al.The structure of the 1L-myo-inositol-1-phosphate synthase-NAD+-2-deoxy-D-glucitol 6-(E)-vinylhomophosphonate complex demands a revision of the enzyme mechanism[J].Biol Chem,2004,279(4):89-95.
[2]KRINGS E,KRUMBACH K,BATHE B,et al.Characterization of myoinositol utilization by Corynebacterium glutamicum:the stimulon,identification of transporters,and influence on L-lysine formation[J].Bacteriol,2006,188(23):54-61.
[3]SEELAN R S,PARTHASARATHY L K,PARTHASARATHY R N,et al.E2F1 regulation of the human myo-inositol 1-phosphate synthase(ISYNA1)gene promoter[J].Arch Biochem Biophy,2004,431(1):95-106.
[4]陈碧珍,吕祝武.补充肌醇对妊娠期糖尿病的影响[J].中国新药与临床杂志,2022,41(9):513-518.
[5]NORDIO M, BASCIANI S, CAMAJANI E.The 40:1 myo-inositol/Dchiro-inositol plasma ratio is able to restore ovulation in PCOS patients:comparison with other ratios[J].Eur Rev Med Pharmacol Sci, 2019,23(12):5512-5521.
[6]KACHHAWA G,SENTHIL K V,KULSHRESTHA V,et al.Efficacy of myo-inositol and d-chiro-inositol combination on menstrual cycle regulation and improving insulin resistance in young women with polycystic ovary syndrome:A randomized open-label study[J].Int J Gynaecol Obstet,2022,158(2):278-284.
[7]HONE B A,BOHSALI A,KRISHNAMURTHY L C,et al.Relationships between frontal metabolites and Alzheimer's disease biomarkers in cognitively normal older adults[J].Neurobiol Aging,2022,109:22-30.
[8]CHOL H I,KIM K,LEE J,et al.Relationship between brain tissue changes and blood biomarkers of cyclophilina, heme oxygenase-1, and inositolrequiring enzyme 1 in patients with Alzheimer's disease[J].Diagnostics,2021,11(5):740-747.
[9]周玮婧,何平,王澍,等.婴幼儿配方奶粉中肌醇的测定及稳定性研究[J].中国乳品工业,2018,46(1):42-51.
[10]王雅平.大菱鲆幼鱼对泛酸、肌醇需求量的研究[D].上海:上海海洋大学,2019.
[11]张树泽,王常安,陆绍霞,等.饲料中添加肌醇对施氏鲟消化生理的影响[J].饲料工业,2022,43(16):53-58.
[12]罗晓明,蒋雪薇.从米糠中制取高纯度肌醇新工艺研究[J].湖南轻工业高等专科学校学报,2003,15(1):8-11.
[13]ZHOU W,HUANG R,ZHU Z,et al.Coevolution of both thermostability and activity of poly-phosphate glucokinase from Thermobifida fusca YX[J].Appl Environ Microbiol,2018,84(16):12-18.
[14]CHENG K,ZHENG W M,CHEN H,et al.Upgrade of wood sugar D-xylose to a value-added nutraceutical by in vitro metabolic engineering[J].Metab Eng,2019,52:1-8.
[15]WANG J P,CHENG H,ZHAO Z H,et al.Efficient production of inositol from glucose via a tri-enzymatic cascade pathway[J].Bioresour Technol,2022,353:121-127.
[16]黄贞杰,陈由强,陈丽霞,等.代谢工程改造酿酒酵母合成肌醇[J].微生物学通报,2017,44(10):2289-2296.
[17]刘晓永,钱和,杨天宝.黑曲霉WS-65固态发酵生产肌醇的研究[J].饲料工业,2003(11):41-43.
[18]勾秋芬.不同发酵条件对酿酒酵母产D-手性肌醇含量的影响[J].产业科技论坛,2016,15(17):51-54.
[19]LIANG S,HE Z,LIU D,et al.Efficient biosynthesis of difucosyllactose via de novo GDP-l-fucose pathway in metabolically engineered Escherichia coli[J].J Agr Food Chem,2024,72(8):4367-4375.
[20]GONG Y, WANG R Q, MA L, et al.Optimization of trans-4-hydroxyproline synthesis pathway by rearrangement center carbon metabolism in Escherichia coli[J].Microb Cell Fact,2023,22(1):240-254.
[21]BROCKMAN I M,PRATHER K L.Dynamic knockdown of E.coli central metabolism for redirecting fluxes of primary metabolites[J].Metab Eng,2015,28:104-113.
[22]YI M H,YANG L Z,MA J,et al.Biosynthesis of myo-inositol in Escherichia coli by engineering myo-inositol-1-phosphate pathway[J].Biochemical Eng,2020,64:1-6.
[23]袁越锦,赵旭彤,熊奉奎,等.响应面法优化酿酒酵母培养基及培养条件[J].中国酿造,2023,42(8):158-165.
[24]SU B L,WU M B,ZHANG Z,et al.Efficient production of xylitol from hemicellulosic hydrolysate using engineered Escherichia coli[J].Metab Eng,2015,31:112-122.
[25]于平,杨柳贞,马健,等.基于葡萄糖激酶和葡萄糖-6-磷酸脱氢酶的NADPH高效再生[J].中国食品学报,2022,22(8):163-172.
[26]鹿依萍.酶法由葡萄糖合成肌醇技术的研究[D].大连:大连理工大学,2018.
[27]SHAO S,HU Y,CHENG J,et al.Effects of carbon source,nitrogen source,and natural algal powder-derived carbon source on biodegradation of tetracycline(TEC)[J].Bioresour Technol,2019,288:121-135.
[28]和玉军,张充,钱辉,等.重组大肠杆菌产脂肪氧合酶发酵条件优化[J].食品科学,2016,37(15):149-155.
[29]ZHANG R, YANG Y, WANG J, et al.Synthetic symbiosis combining plasmid displacement enables rapid construction of phenotype-stable strains[J].Metab Eng,2019,55(9):85-91.
[30]苗朝悦,杜乐,王佳琦,等.重组蛋白质在大肠杆菌体系中的可溶性表达策略[J].中国生物工程杂志,2023,43(9):33-45.
[31]QU Y N,YAN H J,GUO Q,et al.Biosynthesis of D-glucaric acid from sucrose with routed carbon distribution in metabolically engineered Escherichia coli[J].Metab Eng,2018,47(5):393-400.
[32]KONISHI K, IMAZU S.Method for producing glucaric acid: US2015/0010969[P].2015-10-09.
[33]MOON T S, YOON S H, LANZA A M, et al.Production of glucaric acid from a synthetic pathway in recombinant Escherichia coli[J].Appl Environ Microbiol,2009,75:589-595.
[34]SHIU E, BROCKMAN M, PRATHER K L, et al.Improving product yields on D-glucose in Escherichia coli via knockout of pgi and zwf and feeding of supplemental carbon sources[J].Biotechnol Bioeng,2015,112:579-587.
[35]GUPTA A,REIZMAN I M,REISCH C R,et al.Dynamic regulation of metabolic flux in engineered bacteria using a pathway-independent quorum-sensing circuit[J].Nat Biotechnol,2017,35(3):273-279.
[36]TANG E J,SHEN X L,WANG J,et al.Synergetic utilization of glucose and glycerol for efficient myo-inositol biosynthesis[J].Biotechnol Bioeng,2020,117(4):1247-1252.