淀粉酶是催化水解淀粉糖苷键的一类酶的总称,在食品发酵行业有着广泛的应用[1]。根据水解产物不同,淀粉酶可以分为α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶、异淀粉酶[2]。
酱香型白酒是我国著名白酒,其酿造过程主要以高温大曲作为发酵剂与生香剂[3-4]。高温大曲中含有丰富的微生物资源以及微生物所产生的复杂酶系,这些微生物与酶系对白酒的生产以及风味物质的产生起着至关重要的作用[5]。在酿酒过程中,粮食中的淀粉经历糊化、液化、糖化、酒化作用最终成为酒,其中液化和糖化分别需要α-淀粉酶及葡萄糖淀粉酶的参与[6-7]。淀粉酶降解淀粉产生的小分子物质一方面作为微生物生长的碳源,另一方面可被其他酶利用产生风味物质[8]。因此,白酒酿造中出酒率高低及白酒质量的好坏与淀粉酶有很大关系[9]。
目前,关于淀粉酶的研究,有大量关于高产淀粉酶菌株的筛选及诱变育种[10-12]、基因工程菌的构建及淀粉酶基因改造[13-20]的报道。目前已报道的产淀粉酶的微生物主要包括芽孢杆菌属(Bacillus sp.)和曲霉属(Aspergillus sp.),常见的产淀粉酶芽孢杆菌属菌株有贝莱斯芽孢杆菌(Bacillus velezensis)[21-22]、枯草芽孢杆菌(Bacillus subtilis)[23-24]、地衣芽孢杆菌(Bacillus licheniformis)[25]、蜡状芽孢杆菌(Bacillus cereus)[26]、苏云芽孢杆菌(Bacillus thuringiensis)[27]、巨大芽孢杆菌(Bacillus megaterium)[28]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)等[29],常见的产淀粉酶曲霉属菌株有温特曲霉(Aspergillus wentii)[30]、米曲酶(Aspergillus oryzae)[31]等,除此之外,部分酵母(Saccharomyces sp.)也可产生淀粉酶[32]。然而,对于能产生两个及两个以上淀粉酶的产淀粉酶系菌株鲜有报道。
本研究利用碘染法初筛[33]、酶活测定复筛,从酱香型大曲中筛选淀粉酶生产菌株,利用形态学观察及16S rDNA基因序列分析对其进行菌种鉴定,并对其进行全基因组测序,分析基因组中的淀粉酶基因。以淀粉酶活力为评价指标,采用单因素试验与正交试验对筛选菌株产淀粉酶的发酵培养基成分与发酵条件进行优化,以期为改善酒曲液化力和糖化力提供支持,为酿造生产提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香型大曲:贵州省仁怀市茅台镇某酒厂提供。
1.1.2 化学试剂
细麸皮、胰蛋白胨(生化试剂):北京鸿润宝顺科技有限公司;氯化钠(分析纯):国药集团化学试剂有限公司;可溶性淀粉(分析纯):天津市科密欧化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)显色液:飞净生物科技有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)预混液(含染料)、GelRed核酸染料、琼脂粉:北京索莱宝科技有限公司;琼脂糖:西班牙Biowest公司;其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
富集/种子培养基[26]:蛋白胨10.0 g,牛肉膏3.0 g,氯化钠5.0 g,可溶性淀粉2.0 g,蒸馏水1 000 mL。
固体培养基[26]:在富集培养基中添加琼脂15.0 g。
产酶培养基[3]:可溶性淀粉10.0 g,蛋白胨10.0 g,氯化钠10.0 g,蒸馏水1 000 mL。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
CLG-40L高压蒸汽灭菌锅:日本ALP公司;SW-CJ-2FD超净工作台:上海乔跃电子有限公司;DH124D电热恒温培养箱:天津市泰斯特仪器有限公司;BSD-TX270台式智能精密摇床:上海博迅医疗生物仪器股份有限公司;ProFlexTM PCR系统:美国赛默飞世尔科技公司;PowerPac Basic电泳仪、GelDocTM-XR+凝胶成像分析系统:美国BIO-RAD公司;3K15医用离心机:德国SIGMR公司;HH-6数显恒温水浴锅:常州润华电器有限公司;UV-5100紫外可见分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 产淀粉酶菌株的分离筛选
初筛:称取粉碎酱香型大曲1.5 g加入富集培养基中,37 ℃、160 r/min振荡培养24 h。将富集培养液进行梯度稀释,分别取10-3、10-4、10-5稀释液100 μL涂布于固体培养基中,于37 ℃培养箱中倒置培养24 h。向固体培养基中滴加卢戈氏碘液(1%),产淀粉酶菌株周围将出现透明圈,测量透明圈直径(D)与菌落直径(d),计算D/d值,并挑取产生透明圈的菌落进行纯化、备用。
复筛:将初筛后纯化的产淀粉酶菌株接种于50 mL种子培养基中,于37 ℃、180 r/min培养12 h后,按2%(V/V)接种量转接到装液量为20%(V/V)的产酶培养基中,于37 ℃、180 r/min振荡培养24 h。收集发酵液于12 000 r/min离心5 min,取上清液作为淀粉酶粗酶液,采用改良的DNS法测定淀粉酶活力[34]。淀粉酶活力单位定义:在一定反应条件下,1 mL粗淀粉酶液1 min水解淀粉生成还原糖(以葡萄糖计)的微克数为1个酶活力单位(U/mL)。
1.3.2 高产淀粉酶菌株的鉴定与全基因组测序
形态学观察:将复筛得到的高产淀粉酶菌株划线接种于固体培养基中,37 ℃培养24 h,观察菌落形态,并进行革兰氏染色,使用显微镜观察细胞形态。
分子生物学鉴定:利用月硅酸钠法提取高产淀粉酶菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)[35],以其为模板,使用通用引物27F(5'-AGAGTTTGATCMTG GCTCAG-3')与1492R(5'-GGTTACCTTGTTACGACTT-3')对其16S rDNA基因序列进行PCR扩增。PCR扩增体系:基因组模板1 μL,引物27F和1492R各1 μL,2×Taq PCR预混液12.5 μL,双蒸水(ddH2O)9.5 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,共循环34次;72 ℃再延伸10 min。PCR扩增产物送至生工生物工程(上海)有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,利用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,并下载同源性最高的16S rDNA基因序列,利用MEGA11中的邻接法(neighbor-joining,NJ)构建系统发育树[36]。
全基因组测序:高产淀粉酶菌株的全基因组测序同样送至生工生物有限公司进行。
1.3.3 筛选菌株产淀粉酶培养基组分优化单因素试验
将筛选菌株接种于50 mL种子培养基中,于37 ℃、180 r/min培养12 h(种龄)后,按2%(V/V)接种量转接到装液量为20%(V/V)的产酶培养基中,于37 ℃、180 r/min振荡培养24 h。在此基础上,采用单因素轮换法,分别考察碳源种类(可溶性淀粉、葡萄糖、蔗糖、玉米浆干粉、果糖、麦芽糖、纤维素、乳糖、麸皮)及质量浓度(2.0 g/L、4.0 g/L、6.0 g/L、8.0 g/L、10.0 g/L、12.0 g/L、14.0 g/L、16.0 g/L、18.0 g/L、20.0 g/L)、氮源种类(麦芽浸粉、棉籽饼粉、花生饼粉、黄豆饼粉、豆粕粉、酵母浸粉、酵母粉、牛肉膏、大豆蛋白胨、蛋白胨、胰蛋白胨)及质量浓度(0、0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L、3.0 g/L、3.5 g/L、4.0 g/L)、无机盐种类(氯化镁、氯化锰、氯化锌、氯化铁、氯化钙、氯化钾、氯化钠)及质量浓度(0、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L)对筛选菌株产淀粉酶的影响,以最高淀粉酶活力为100%计算相对酶活力。
1.3.4 筛选菌株产淀粉酶培养基组分优化正交试验
根据单因素试验结果,以淀粉酶活力为评价指标,以麸皮质量浓度(A)、胰蛋白胨质量浓度(B)、氯化钠质量浓度(C)为考察因素,设计3因素3水平的L9(33)正交试验,试验因素与水平见表1。
表1 培养基组分优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for medium components optimization

水平 A 麸皮质量浓度/(g·L-1)B 胰蛋白胨质量浓度/(g·L-1)C 氯化钠质量浓度/(g·L-1)123 6.0 8.0 10.0 1.0 1.5 2.0 0.2 0.4 0.6
1.3.5 筛选菌株产淀粉酶发酵条件优化
采用单因素轮换法分别考察发酵温度(25 ℃、30 ℃、35 ℃、40 ℃)、种龄(4 h、8 h、16 h、24 h、32 h)、接种量(1%、2%、3%、4%、5%、6%、7%、8%、9%、10%)、装液量(5%、10%、15%、20%、25%、30%)及转速(100 r/min、140 r/min、180 r/min、220 r/min)对筛选菌株产淀粉酶的影响,以最高淀粉酶活力为100%计算相对酶活力。
1.3.6 筛选菌株生长曲线及产酶曲线的绘制
将活化的筛选菌株接种到最优产酶培养基,在最适发酵条件下发酵,每隔3 h取样,将菌液稀释4倍后测定OD600 nm值,并取上清液测定淀粉酶活力。以培养时间为横坐标,OD600 nm值及淀粉酶活力为纵坐标,绘制生长曲线及产酶曲线。
1.3.7 数据处理
每个试验重复3次,采用Excel 2016软件处理数据,结果用“平均值±标准差”表示,采用Origin 9.0软件绘图。
2 结果与分析
2.1 产淀粉酶菌株的筛选
采用碘染法从酱香型大曲中初步筛选得到9株D/d值>2.0的菌株。通过摇瓶培养后,测定9株产淀粉酶菌株的淀粉酶活力,结果见表2。由表2可知,菌株L9的D/d值及淀粉酶活力最高,分别为7.48、403.25 U/mL。因此,选择菌株L9为高产淀粉酶活力的菌株。
表2 酱香型大曲产淀粉酶菌株的筛选结果
Table 2 Screening results of amylase-producing strains of sauce-flavor Daqu
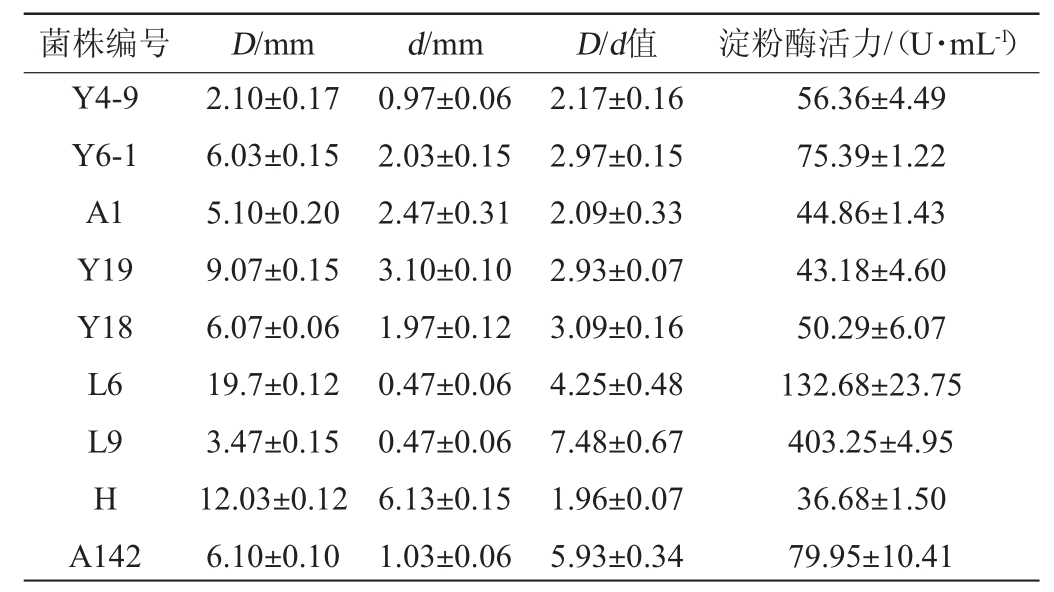
菌株编号D/mmd/mmD/d值淀粉酶活力/(U·mL-1)Y4-9 Y6-1 A1 Y19 Y18 L6 L9 H A142 2.10±0.17 6.03±0.15 5.10±0.20 9.07±0.15 6.07±0.06 19.7±0.12 3.47±0.15 12.03±0.12 6.10±0.10 0.97±0.06 2.03±0.15 2.47±0.31 3.10±0.10 1.97±0.12 0.47±0.06 0.47±0.06 6.13±0.15 1.03±0.06 2.17±0.16 2.97±0.15 2.09±0.33 2.93±0.07 3.09±0.16 4.25±0.48 7.48±0.67 1.96±0.07 5.93±0.34 56.36±4.49 75.39±1.22 44.86±1.43 43.18±4.60 50.29±6.07 132.68±23.75 403.25±4.95 36.68±1.50 79.95±10.41
2.2 菌株L9的鉴定
2.2.1 形态学观察
菌株L9的菌落形态及细胞形态见图1。由图1A可知,菌株L9的菌落表面粗糙不光滑,边缘不规则,颜色为灰白色;由图1B可知,菌株L9的细胞为杆状,以单细胞或多细胞首尾相连排列,经革兰氏染色呈紫色,为革兰氏阳性菌。参考《伯杰细菌鉴定手册》[37],初步鉴定菌株L9为芽孢杆菌属(Bacillus sp.)。
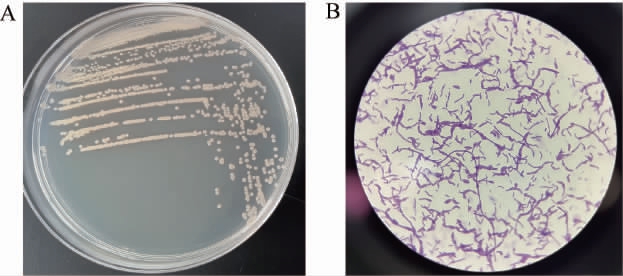
图1 菌株L9的菌落(A)及细胞(B)形态
Fig.1 Colony (A) and cell (B) morphology of strain L9
2.2.2 分子生物学鉴定
基于16S rDNA基因序列构建菌株L9的系统发育树,结果见图2。

图2 基于16S rDNA基因序列菌株L9的系统发育树
Fig.2 Phylogenetic tree of strain L9 based on 16S rDNA gene sequences
由图2可知,菌株L9与地衣芽孢杆菌(Bacillus licheniformis)DSM 13的相似度最高(相似度99.92%),且系统发育树中二者位于同一分支,亲缘关系相近,结合形态学特征,最终鉴定菌株L9为地衣芽孢杆菌(Bacillus licheniformis)。
2.3 地衣芽孢杆菌L9的全基因组测序
对地衣芽孢杆菌L9的全基因序列进行分析,发现其含两个淀粉酶编码基因,其中一个为α-淀粉酶基因(所处位置为54 699~56 238 bp),编码的淀粉酶单体大小为58.5 kDa,另一个为麦芽糖淀粉酶基因(所处位置为51706~53467bp),编码的淀粉酶单体大小为67.3 kDa,因此,确定地衣芽孢杆菌L9为淀粉酶系产生菌。
2.4 菌株L9产淀粉酶培养基组分优化单因素试验结果
2.4.1 碳源种类及其添加量对菌株L9产淀粉酶的影响
由图3A可知,碳源对地衣芽孢杆菌L9产淀粉酶的影响较大,以蔗糖、玉米浆干粉、麦芽糖为碳源时,其产淀粉酶活力较低,以麸皮为碳源时,其所产淀粉酶活力最高,与王君等[25]的研究结果相符。麸皮价格低廉,含有碳水化合物、蛋白质、维生素、矿物质、生长素等营养成分,是微生物生长所必需的[38],因此,选择麸皮作为最适碳源。由图3B可知,随着麸皮添加量的升高,相对酶活力呈先升高后下降的趋势,当麸皮添加量为8.0 g/L时,地衣芽孢杆菌L9所产淀粉酶活力达到最高。麸皮有利于微生物产酶,但是当添加量偏高时,影响培养基通气,使得产酶量下降[32],因此,确定麸皮的最佳添加量为8.0 g/L。
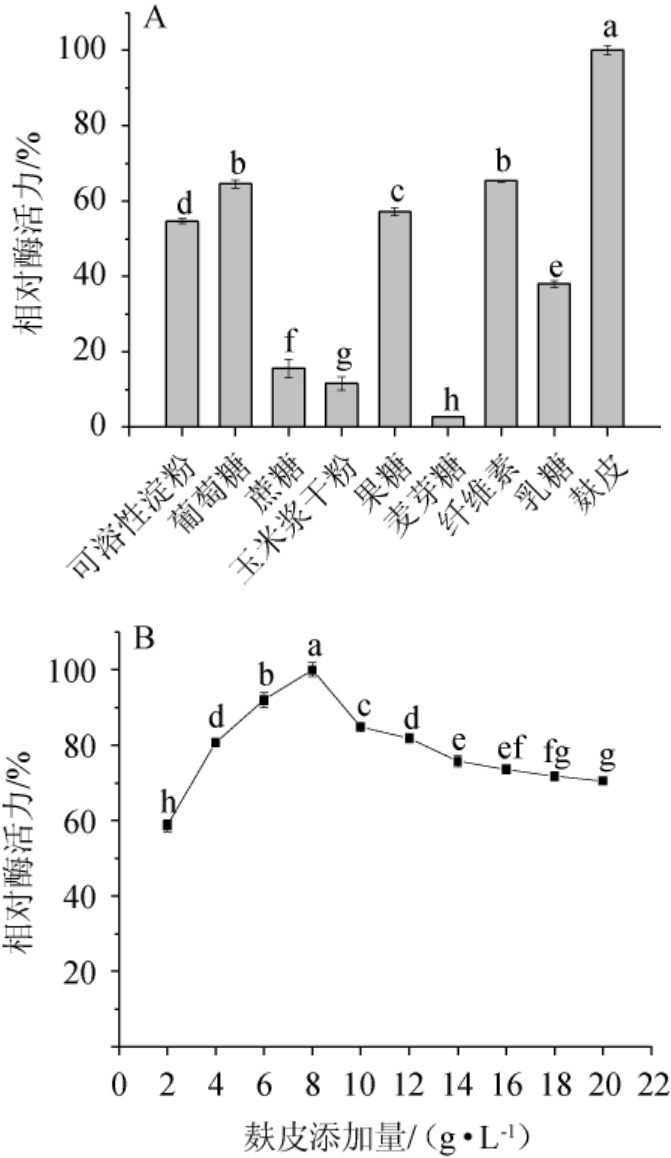
图3 碳源种类(A)及麸皮添加量(B)对菌株L9产淀粉酶的影响
Fig.3 Effects of carbon sources types (A) and bran addition (B) on amylase production of strain L9
不同小写字母表示差异显著(P<0.05)。下同。
2.4.2 氮源种类及其添加量对菌株L9产淀粉酶的影响
由图4A可知,以胰蛋白胨作为氮源时,淀粉酶活力最高,以牛肉膏为氮源时,相对酶活力达到93.15%,与王君等[25]的研究结果吻合。胰蛋白胨是优质蛋白胨,含有丰富的营养物质,如氨基酸、维生素、生长因子等,其中维生素可以作为一些酶的辅因子[39],因此,选择胰蛋白胨为最适氮源。由图4B可知,随着胰蛋白胨添加量的升高,相对酶活力呈先升高后下降的趋势,当胰蛋白胨添加量为1.5 g/L时,地衣芽孢杆菌L9所产淀粉酶活力最高。氮源是微生物生长所必需的营养物质,但是浓度偏高可能出现底物反馈抑制,使得产酶量降低[33],因此,确定胰蛋白胨的最佳添加量为1.5 g/L。

图4 氮源种类(A)及胰蛋白胨添加量(B)对菌株L9产淀粉酶的影响
Fig.4 Effects of nitrogen sources types (A) and tryptone addition (B)on amylase production of strain L9
2.4.3 无机盐种类及其添加量对菌株L9产淀粉酶的影响
由图5A可知,以氯化锰、氯化锌、氯化铁为无机盐时,淀粉酶相对酶活力较低,以氯化钠为无机盐时,地衣芽孢杆菌L9所产淀粉酶活力最大,这与王文娟等[40]的研究结果相符。由图5B可知,随着氯化钠添加量的升高,相对酶活力呈先升高后下降的趋势,当氯化钠添加量为0.4 g/L时,淀粉酶活力达到最高。分析原因可能是,氯化钠在提供营养物质的同时,可能改变淀粉酶的高级结构[41]。因此,确定氯化钠的最佳添加量为0.4 g/L。

图5 无机盐种类(A)及氯化钠添加量(B)对菌株L9产淀粉酶的影响
Fig.5 Effects of inorganic salts types (A) and NaCl addition (B) on amylase production of strain L9
2.5 菌株L9产淀粉酶培养基组分优化正交试验结果
以淀粉酶活力为评价指标,以麸皮质量浓度(A)、胰蛋白胨质量浓度(B)、氯化钠质量浓度(C)为考察因素,设计3因素3水平的正交试验,试验结果与分析见表3。
表3 培养基组分优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiments for medium components optimization
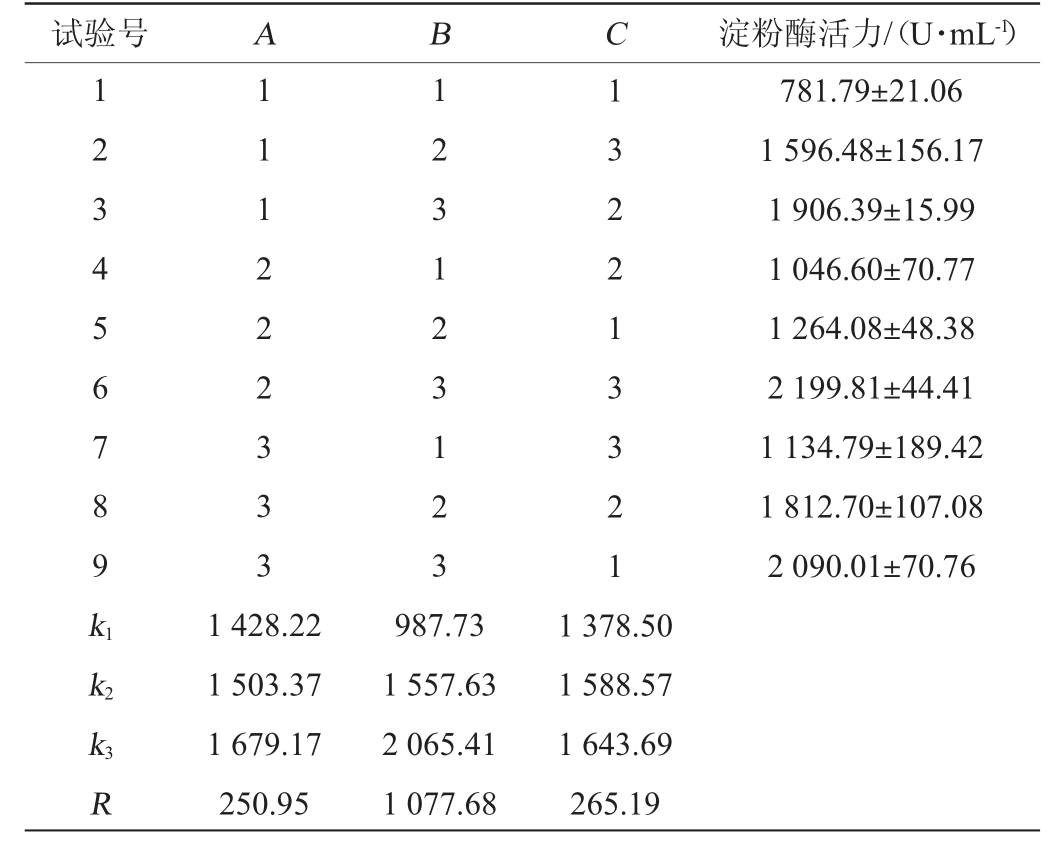
试验号ABC淀粉酶活力/(U·mL-1)123456789k1 111222333 123123123 132213321 781.79±21.06 1 596.48±156.17 1 906.39±15.99 1 046.60±70.77 1 264.08±48.38 2 199.81±44.41 1 134.79±189.42 1 812.70±107.08 2 090.01±70.76 k2 k3R 1 428.22 1 503.37 1 679.17 250.95 987.73 1 557.63 2 065.41 1 077.68 1 378.50 1 588.57 1 643.69 265.19
由表3可知,影响菌株L9产淀粉酶的因素主次顺序为B>C>A,即胰蛋白胨质量浓度>氯化钠质量浓度>麸皮质量浓度,菌株L9产淀粉酶的最佳培养基组分为A3B3C3,即麸皮质量浓度10.0 g/L,胰蛋白胨质量浓度2.0 g/L,氯化钠质量浓度0.6 g/L,对最佳组合进行验证,淀粉酶活力为2 208.06 U/mL,高于试验组6。因此,确定菌株L9产淀粉酶的最佳培养基组成为麸皮添加量10.0 g/L,胰蛋白胨添加量2.0 g/L,氯化钠添加量0.6 g/L。
2.6 地衣芽孢杆菌L9产淀粉酶发酵条件优化
2.6.1 发酵温度对地衣芽孢杆菌L9产淀粉酶的影响
由图6可知,随着发酵温度的升高,相对酶活力呈先升高后下降的趋势。当发酵温度为35 ℃时,地衣芽孢杆菌L9所产淀粉酶活力最高。发酵温度对微生物产酶影响较大,温度过高或过低都会抑制微生物产酶,这是因为温度过低,菌体生长缓慢,产酶速度降低;温度过高,菌体生长旺盛,过多的营养物质被用于微生物生长,产酶速度也受到影响[42]。因此,确定最佳发酵温度为35 ℃。
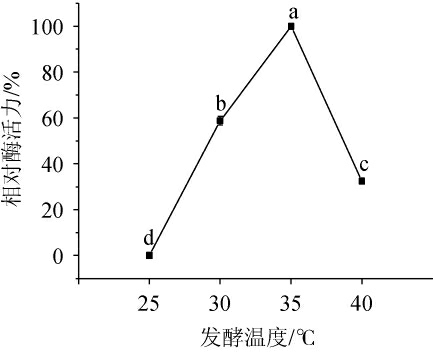
图6 发酵温度对地衣芽孢杆菌L9产淀粉酶的影响
Fig.6 Effects of fermentation temperature on the amylase production of Bacillus licheniformis L9
2.6.2 种龄对地衣芽孢杆菌L9产淀粉酶的影响
由图7可知,随着种龄的增加,相对酶活力呈先升高后下降的趋势,当种龄为8 h时,淀粉酶活力达到最大。种龄的大小与种子活力相关,种龄较小时,未进入对数生长期,种子活力不强;种龄过大时,种子进入衰亡期,种子活力弱,因此,选择合适的种龄,使种子处于对数生长期,有利于微生物产酶[43]。因此,确定最佳种龄为8 h。

图7 种龄对地衣芽孢杆菌L9产淀粉酶的影响
Fig.7 Effects of seed age on the amylase production of Bacillus licheniformis L9
2.6.3 接种量对地衣芽孢杆菌L9产淀粉酶的影响
由图8可知,随着接种量的增加,相对酶活力呈先升高后下降的趋势,当接种量为3%时,淀粉酶活力最大。这是因为接种量过小时,菌体生长量小,适应期长,进入对数生长期的时间延滞;而接种量过大,菌体生长旺盛,提前进入稳定期和衰亡期,对产酶不利[32],因此,确定最佳接种量为3%。
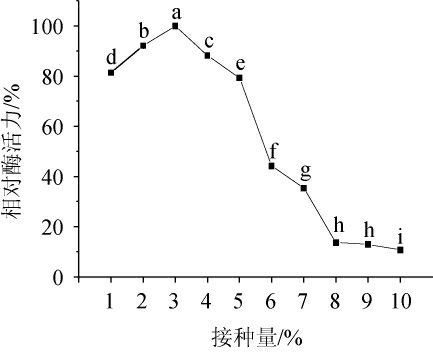
图8 接种量对地衣芽孢杆菌L9产淀粉酶的影响
Fig.8 Effects of inoculum on the amylase production of Bacillus licheniformis L9
2.6.4 装液量对地衣芽孢杆菌L9产淀粉酶的影响
由图9可知,随着装液量的增加,相对酶活力呈现下降趋势。芽孢杆菌为需氧微生物,装液量过大影响溶氧[25],从而影响微生物的产酶,导致随着装液量的增加,淀粉酶活力逐渐下降。为节约资源,选择装液量为20%。
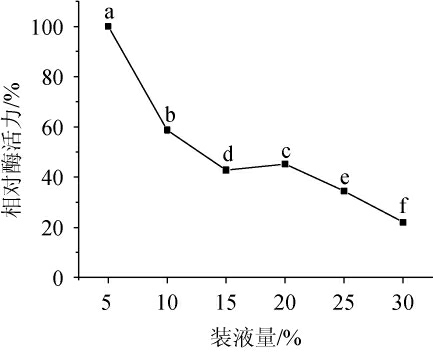
图9 装液量对地衣芽孢杆菌L9产淀粉酶的影响
Fig.9 Effects of liquid loading volume on the amylase production of Bacillus licheniformis L9
2.6.5 转速对地衣芽孢杆菌L9产淀粉酶的影响
由图10可知,随着转速的增加,相对酶活力呈先升高后降低的趋势,当转速为180 r/min时,淀粉酶活力最大。这是因为适当的转速有利于增加溶氧,并使微生物均匀分布,有利于微生物产酶,但转速过高时,可能导致菌体损伤,影响微生物产酶[44],因此,确定最佳转速为180 r/min。
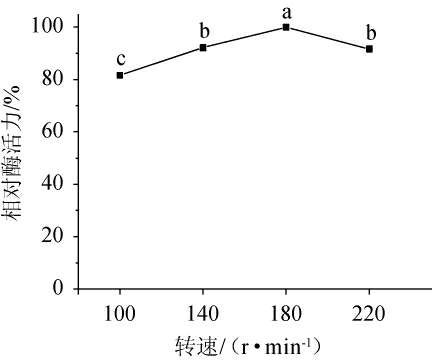
图10 转速对地衣芽孢杆菌L9产淀粉酶的影响
Fig.10 Effects of rotation speed on the amylase production of Bacillus licheniformis L9
2.7 地衣芽孢杆菌L9的生长曲线及产酶曲线
由图11可知,地衣芽孢杆菌L9产淀粉酶滞后于菌体生长,发酵0~3 h为生长适应期,此阶段几乎没有淀粉酶产生;发酵3~36 h菌体浓度逐渐增加,在此阶段,发酵12 h之前同样几乎无淀粉酶产生,发酵12~15 h开始产生淀粉酶,随着发酵时间的延长,开始大量生产淀粉酶,并在发酵33 h时达到最高水平,此时,淀粉酶活力为2 300.24 U/mL;发酵36 h进入衰亡期,淀粉酶活力呈现下降趋势。地衣芽孢杆菌L9产生的淀粉酶可能受到菌体活力及代谢产物的影响,因此需于发酵时间33 h左右收集所产淀粉酶[28]。
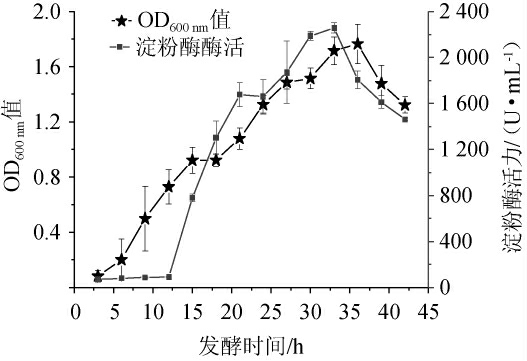
图11 地衣芽孢杆菌L9的生长及产淀粉酶曲线
Fig.11 Growth and amylase production curves of Bacillus licheniformis L9
3 结论
本研究从酱香型大曲中筛选获得一株淀粉酶活力较高的菌株L9,淀粉酶活力为403.25 U/mL,经鉴定为地衣芽孢杆菌(Bacillus licheniformis),其基因组中含有两个编码淀粉酶的基因,分别为α-淀粉酶基因与麦芽糖淀粉酶基因。经单因素试验及正交试验确定地衣芽孢杆菌L9产淀粉酶的最优培养基组分为:麸皮10.0 g/L、胰蛋白胨2.0 g/L、氯化钠0.6 g/L。通过单因素试验优化确定最优发酵条件为:发酵温度35 ℃、种龄8 h、接种量3%、装液量20%、转速180 r/min、发酵时间33 h,经优化后淀粉酶活力达到2 300.24 U/mL,是优化前5.7倍。本研究结果对酿造行业优化淀粉酶活力有一定指导作用,对功能菌的分离筛选以及产酶条件优化具有参考意义。
[1]罗春雷,韦宇拓.淀粉酶的分类及应用研究进展[J].广西科学,2018,25(3):248-252.
[2]张林吉,张海涛,李云龙,等.厨余中产淀粉酶芽孢杆菌的筛选、鉴定及酶学性质研究[J].饲料研究,2021,44(10):69-73.
[3]张璋,赵腾飞,李红霞,等.产淀粉酶芽孢杆菌的分离鉴定、高温驯化及酶学性质研究[J].中国酿造,2023,42(9):79-84.
[4]张春林,蒲春,白从广,等.高温大曲中产酱香风味细菌的筛选及其产香特性研究[J].食品科技,2022,47(5):1-6.
[5]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[6]白静,王君,李末,等.细菌α-淀粉酶活性提升研究进展[J].饲料研究,2023,46(15):158-162.
[7]WANG C,YANG L L,LUO L N,et al.Purification and characterization of glucoamylase of Aspergillus oryzae from Luzhou-flavor Daqu[J].Biotechnol Lett,2020,42:2345-2355.
[8]毛祥,黄丹,沈才萍,等.酱香型大曲中产淀粉酶菌的分离鉴定及发酵特性研究[J].中国酿造,2015,34(12):24-27.
[9]周阳子,边名鸿,刘文艺,等.高温大曲中一株产淀粉酶酵母的分离鉴定及其特性研究[J].食品与发酵工业.2020,46(2):79-84.
[10]王传旭,赵爱华,于慧瑛,等.淀粉酶高产菌株的筛选、紫外诱变及产酶条件优化[J].微生物学通报,2022,49(5):1759-1773.
[11]张晋,宇海萍,马磊磊,等.高温淀粉酶高产菌株的ARTP诱变选育及发酵条件优化[J].食品科技,2021,46(8):22-26.
[12]纪亮,汤羽萌,田嘉美,等.等离子体预处理对解淀粉芽孢杆菌生长和α-淀粉酶分泌的影响[J].精细化工,2021,38(7):1402-1408.
[13]刘霞,戴隆华,黄珍,等.Bacillus sp.B110胞内麦芽糖淀粉酶基因克隆与酶学特性[J].食品工业科技,2023,44(10):123-129.
[14]李佳欣,顾燕,汤伟,等.一株热反硝化地芽孢杆菌Y62产耐高温α-淀粉酶的异源表达[J].食品研究与开发,2023,44(10):194-200,207.
[15]ALAMRI A,ALGHAMDI M A,KHAN J A,et al.Escherichia coli expression and characterization of α-amylase from Geobacillus thermodenitrificans DSM-465[J].Braz J Biol,2021,82:e239449.
[16]邴孝凤,何玉,张学成,等.生淀粉水解α-淀粉酶AmyZ1热稳定性提升的分子改造[J].生物学杂志,2023,40(3):35-40.
[17]王玉川,马俊文,李延啸,等.米黑根毛霉α-淀粉酶的定向进化、高效表达及在面包中的应用[J].中国粮油学报,2022,37(11):78-85.
[18]RUAN Y Q,ZHANG R Z,XU Y.Directed evolution of maltogenic amylase from Bacillus licheniformis R-53: Enhancing activity and thermostability improves bread quality and extends shelf life[J].Food Chem,2022,381:132222.
[19]POUYAN S,LAGZIAN M,SANGTARASH M H.Enhancing thermostabilization of a newly discovered α-amylase from Bacillus cereus GL96 by combining computer-aided directed evolution and site-directed mutagenesis[J].Int J Biol Macromol,2022,197:12-22.
[20]SINDHU R,BINOD P,MADHAVAN A,et al.Molecular improvements in microbial α-amylases for enhanced stability and catalytic efficiency[J].Biores Technol,2017,245:1740-1748.
[21]王屈祎,钟倩,闫如玉,等.淀粉酶产生菌的筛选、鉴定及其发酵条件优化[J].微生物学通报,2022,49(1):173-188.
[22]刘延波,张世凯,赵志军,等.高产淀粉酶细菌的分离鉴定及产酶条件优化[J].食品与机械,2020,36(1):65-71.
[23]张晓瑞,刘晓晖,付博,等.烟草中淀粉降解菌的筛选、鉴定及发酵工艺优化[J].食品与机械,2021,37(2):34-41.
[24]赵海燕,梁军,刘凯文,等.一株中温淀粉酶菌株的分离鉴定及其产酶条件分析[J].基因组学与应用生物学,2021,40(3):1156-1162.
[25]王君,王腾,王敏,等.响应面法优化地衣芽孢杆菌产淀粉酶的研究[J].饲料研究,2022,45(15):71-77.
[26]曹丹,彭浩,兰阿峰,等.一株α-淀粉酶产生菌的分离、鉴定及产酶条件研究[J].食品研究与开发,2020,41(6):169-174,188.
[27]郑虹,陆小翠,邓加聪.α-淀粉酶产生菌的分离、筛选及鉴定[J].中国酿造,2020,39(7):116-119.
[28]杜东晓,赵龙妹,贾少轩,等.产淀粉酶菌株的筛选鉴定及酶学特性研究[J].饲料研究,2021,44(19):80-84.
[29]秦立芹,马景浩,李二浩,等.一株源于北派酱香白酒酿造环境中产淀粉酶细菌的筛选、鉴定及其特性研究[J].中国酿造,2021,40(11):154-160.
[30]LAGO M C,SANTOS F C D,BUENO P S A,et al.The glucoamylase from Aspergillus wentii: Purification and characterization[J].J Basic Microbiol,2021,61(5):443-458.
[31]邓维琴,肖晴芹,李雄波,等.郫县豆瓣中高产α-淀粉酶米曲霉筛选鉴定及产黄曲霉毒素特性评价[J].食品与发酵工业,2020,46(9):50-56.
[32]孙思佳,翟磊,白秀彬,等.一株高产淀粉酶扣囊复膜孢酵母的产酶条件优化及酶学性质研究[J].食品与发酵工业,2019,45(21):31-37.
[33]胡晓龙,冯大鸿,田瑞杰,等.中温大曲产淀粉酶菌株的筛选鉴定及培养条件优化[J].中国酿造,2023,42(1):78-85.
[34]刘彩华,曾嘉童,包竹君,等.3,5-二硝基水杨酸比色法测定芒果的可溶性糖含量[J].食品安全质量检测学报,2022,13(9):2892-2900.
[35]蔡文娇,徐大彬,蓝霞,等.一种提取真菌基因组DNA的新方法[J].农业研究与应用,2014(3):1-5.
[36]蒋泽元,万义芳,蒲驰中,等.高温大曲中高产淀粉酶和蛋白酶细菌的分离、鉴定及生物学特性研究[J].中国酿造,2024,43(2):60-63.
[37]布坎南R E.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:729-733.
[38]林琳.小麦麸皮的营养成分及其开发利用[J].农业科技与装备,2010(3):41-42.
[39]杜丽红,郝亚男,陈宁,等.有机氮源及其在微生物发酵中的应用[J].发酵科技通讯,2019,48(1):1-4.
[40]王文娟,刘志东,宁喜斌.南极磷虾产低温淀粉酶菌株的筛选、鉴定及酶学性质研究[J].食品与发酵工业,2019,45(19):38-44.
[41]陈中伟,王可可,刘艳霞,等.无机盐对小麦胚芽脂肪酶结构和活性的影响[J].中国粮油学报,2017,32(6):8-14.
[42]王中月,滕超,汤回花,等.产高分子量木聚糖酶细菌的筛选及产酶条件优化[J].食品与发酵工业,2017,43(10):88-95.
[43]易征璇.耐高温淀粉酶产生菌筛选及产酶条件和酶学性质的研究[D].长沙:湖南农业大学,2016.
[44]杨磊,陈良.浓香型酒醅中一株耐热地衣芽孢杆菌产淀粉酶和蛋白酶培养条件的优化[J].酿酒,2021,48(2):49-53.