中高温大曲是以小麦为原料在润水研磨后装入曲模,经压曲入曲房培养而得[1]。“曲乃酒之骨”,中高温大曲为浓香型白酒的酿造提供了丰富的微生物和酶系,是白酒酿造中不可或缺的糖化发酵剂[2]。浓香型白酒具有芳香浓郁、绵柔甘洌和尾净余长等特点,但由于地理位置和生产环境等的差异,使得不同地区浓香型白酒的风味存在不同[3]。SONG X B等[4]研究发现,相较于淮河流域,四川流域的浓香型白酒具有更加浓厚的酱香,究其原因可能是大曲较为开放的制作过程,使其微生物组成易受当地温度和湿度等气候条件、空气、水和仪器等生产环境以及制曲工艺的影响[5]。基于高通量测序技术,吴树坤等[6]分析了四川宜宾、泸州和遂宁地区浓香型大曲微生物群落结构的差异,结果发现弯孢属(Curvularia)和异茎点霉属(Paraphoma)仅在宜宾曲样中存在,小囊菌属(Microascus)和红曲霉属(Monascus)仅在遂宁曲样中存在,背芽突霉属(Cadophora)仅在泸州曲样中存在。由此可见,地理区域的差异对于大曲中微生物的组成具有较大的影响,解析不同地区生产中高温大曲微生物的组成可为酿酒微生物资源的挖掘提供数据支撑。
真菌是产酒、产香和产酶的重要微生物[2],其中酵母菌是大曲发酵力的主要来源,霉菌是大曲糖化力和液化力的主要来源[7]。因此,解析大曲中真菌菌群的组成,对于评价大曲品质及差异具有较为重要的意义。高通量测序技术具有通量高、速度快和成本低等优点,在解析大曲菌群结构上具有较好的运用[8]。根据中国水系的分布,中国白酒主要可分为长江中上游产区和黄淮流域产区两大类,当前研究人员就两大产区大曲中微生物组成展开了大量研究[9]。作为我国西北地区重要的城市之一,内蒙古巴彦淖尔河套地区亦存在大量酿造浓香型白酒的酒厂,但目前使用高通量测序技术解析其中高温大曲中真菌类群组成的研究尚少。
本研究采用Illumina MiSeq高通量测序技术解析内蒙古巴彦淖尔河套地区15个中高温大曲样品的真菌类群,并与江西鹰潭地区的15个中高温大曲的真菌菌群[10]进行对比分析,解析河套地区中高温大曲中真菌的菌群特征,以期为我国西北地区酿酒微生物资源的挖掘提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
河套地区中高温大曲,采自内蒙古自治区巴彦淖尔市河套地区(东经105°12′~109°53′,北纬40°13′~42°28′)某酒厂,该酒厂生产中高温大曲并酿造浓香型白酒,共采集15个样本,编号为BM1~BM15。采集时间为2022年4月,所有样品均以小麦为原料,生产后的曲块在曲库中储存时间均大于5个月,采集的样品寄回实验室打磨成粉末后置于-20 ℃冰箱备用。
1.1.2 试剂
QIAGEN DNeasy mericon Food Kit试剂盒:德国QIAGEN公司;5×Fast Pfu Buffer、2×聚合酶链式反应(polymerase chain reaction,PCR)mix、rTaq酶(5 U/μL)、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)mix和DL 2000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:北京全式金生物技术有限公司;引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCCGCTTATTGATATGC-3'):上海桑尼生物科技有限公司;Illumina MiSeq高通量测序平台配套试剂:美国Illumina公司。其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
JFSD-100Ⅱ粉碎机:上海隆拓仪器设备有限公司;ABI 9700 PCR仪:美国Applied Biosystems公司;DYY-12型电泳仪:北京六一仪器厂;Fluor Chem FC3化学发光凝胶成像系统:美国Protein Simple公司;MiSeq PE300高通量测序平台:美国Illumina公司;R930机架式服务器:美国DELL公司。
1.3 方法
1.3.1 DNA提取、PCR扩增及Illumina MiSeq高通量测序
参考QIAGEN DNeasy maricon Food Kit试剂盒中的方法提取中高温大曲样品的宏基因组DNA,参考王强等[11]的PCR扩增体系及条件对真菌的内源转录间隔区(internally transcribed spacer,ITS)序列进行PCR扩增,经1.0%琼脂糖凝胶电泳检测后,将合格且纯化后的产物寄往上海美吉生物医药科技有限公司进行Illumina MiSeq高通量测序。
1.3.2 生物信息学分析
为了清楚地解析河套地区中高温大曲的真菌类群并探究不同地区生产中高温大曲真菌类群的差异,本研究引用了王玉荣等[10]解析的江西省鹰潭市某特香型白酒厂的15个中高温大曲的真菌序列(美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)上传编号为studySRP471188)。参考GUO Z等[12]的方法对返回序列进行质控和拼接,基于QIIME(v1.9.1)平台[13]进行生物信息学分析,使用PyNAST软件[14]对序列进行校准与对齐,通过UCLUST算法[15]以97%的相似度对高质量序列进行划分并构建操作分类单元(operational taxonomic units,OTU)[16],基于UNITE数据库[17]注释各真菌物种的分类学地位。计算两地区中高温大曲样品的α多样性指数(超1指数和香农指数),并基于加权和非加权的UniFrac距离进行了主坐标分析(principal coordinate analysis,PCoA),最后使用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)甄别了2个地区生产中高温大曲的生物标志物。
1.3.3 多元统计学分析
使用两独立样本的秩和检验分析(Mann-Whitney)和置换多因素方差分析(permutational multivariate analysis of variance,PERMANOVA)比较2个地区中高温大曲的差异性;使用R软件(v4.1.2)、在线作图网站(http://huttenhower.sph.harvard.edu/galaxy/)和Gephi软件(v0.9.2)绘图。
2 结果与分析
2.1 河套地区中高温大曲样品真菌类群的结构解析
基于Illumina MiSeq高通量测序技术,从河套地区15个中高温大曲样品中共获得937 625条序列,剔除低质量和嵌合体序列后按97%相似度对序列进行划分,共得到2 381个OTU,经注释后发现共隶属于4个真菌门的42个真菌属。基于门和属水平对河套地区中高温大曲样品中的真菌菌群结构进行分析,结果见图1。其中,除不可鉴定和其他真菌门或属外,均在所有样品中存在且平均相对丰度>1.0%。
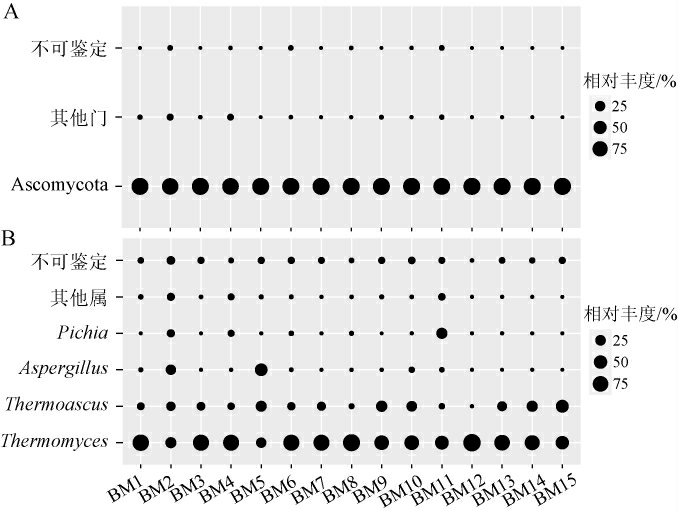
图1 基于门(A)和属(B)水平河套地区中高温大曲样品真菌菌群结构分析结果
Fig.1 Fungal community structure analysis results of middle-high temperature Daqu samples in Hetao area based on phylum(A) and genus (B) levels
由图1A可知,河套地区中高温大曲样品中真菌门以子囊菌门(Ascomycota)为主,平均相对丰度为99.47%。由图1B可知,河套地区中高温大曲样品中真菌属以嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)、曲霉菌属(Aspergillus)和毕赤酵母属(Pichia)为主,平均相对丰度分别为68.28%、16.87%、4.80%和3.15%。研究表明,Thermoascus和Thermomyces具有一定的糖化力和发酵力,可以分解淀粉原料形成各种小分子物质,为其他菌株的代谢合成提供物质基础,并且它们与氧含量呈正相关,与湿度、水分和酸度呈负相关[18]。Aspergillus可以转录翻译较多的酯类化合物,在中高温大曲酯类合成代谢网络中占主导地位[19]。Pichia是浓香型白酒发酵过程中最重要的功能真菌,能利用蔗糖和葡萄糖生成乙醇、乙酸乙酯和4-羟基-2-丁酮等多种芳香化合物[20]。杨少勇等[21]通过高通量测序分析发现,湖北襄阳地区的中高温大曲中真菌类群以Thermomyces(48.05%)、Thermoascus(17.72%)、Aspergillus(14.56%)、Rasamsonia(4.38%)、毛孢子菌属(Trichosporon)(3.08%)、根霉菌属(Rhizopus)(2.45%)和双足囊菌属(Dipodascus)(2.36%)为主。谭崇尧等[22]采用高通量测序研究发现,长江中游浓香型大曲的优势真菌为Aspergillus、Thermoascus和Thermomyces等,而江淮浓香型大曲的优势真菌为Aspergillus、Thermoascus和耐干霉菌属(Xeromyces)。由此可见,不同地区生产的中高温大曲真菌类群存在差异。
2.2 河套和鹰潭地区中高温大曲样品真菌类群多样性的比较分析
河套和鹰潭地区中高温大曲样品真菌类群的α多样性指数曲线见图2。
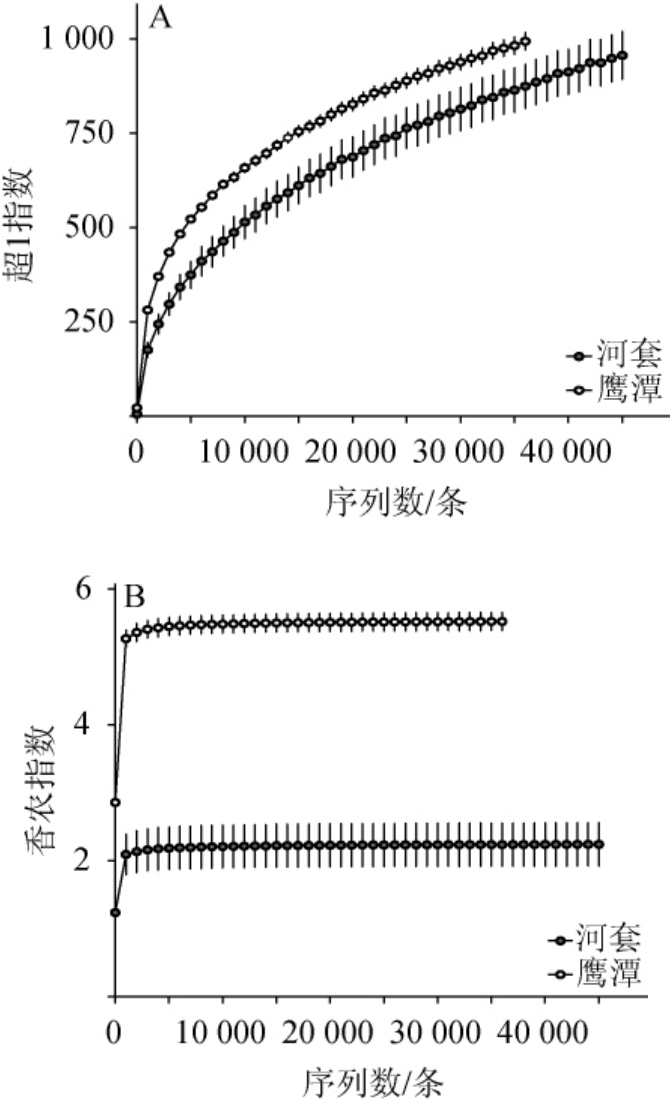
图2 河套和鹰潭地区中高温大曲样品真菌类群的稀疏曲线
Fig.2 Sparse curves of fungal community in medium-high temperature Daqu samples in Hetao and Yingtan regions
由图2可知,在相同测序深度下,河套地区中高温大曲样品真菌类群的超1指数和香农指数值均明显低于鹰潭地区,且在测序深度为36 010条序列时,河套和鹰潭地区中高温大曲样品真菌类群的超1指数值分别为875和994,香农指数值分别为2.24和5.52。结合Mann-Whitney检验可知,河套地区中高温大曲样品的超1指数值显著偏低(P<0.05),而香农指数值极显著偏低(P<0.01)。在α多样性指数中超1指数值越大,表明其菌群的物种丰富度越高,而香农指数值越大,则表明其菌群的物种多样性越高[23]。由此可见,河套地区中高温大曲样品的真菌类群丰富度和多样性均低于鹰潭地区。
在对2个地区中高温大曲样品真菌类群α多样性进行比较分析的基础上,进一步采用主坐标分析对其β多样性进行比较,基于加权和非加权UniFrac距离2个地区中高温大曲样品真菌类群空间排布的情况见图3。
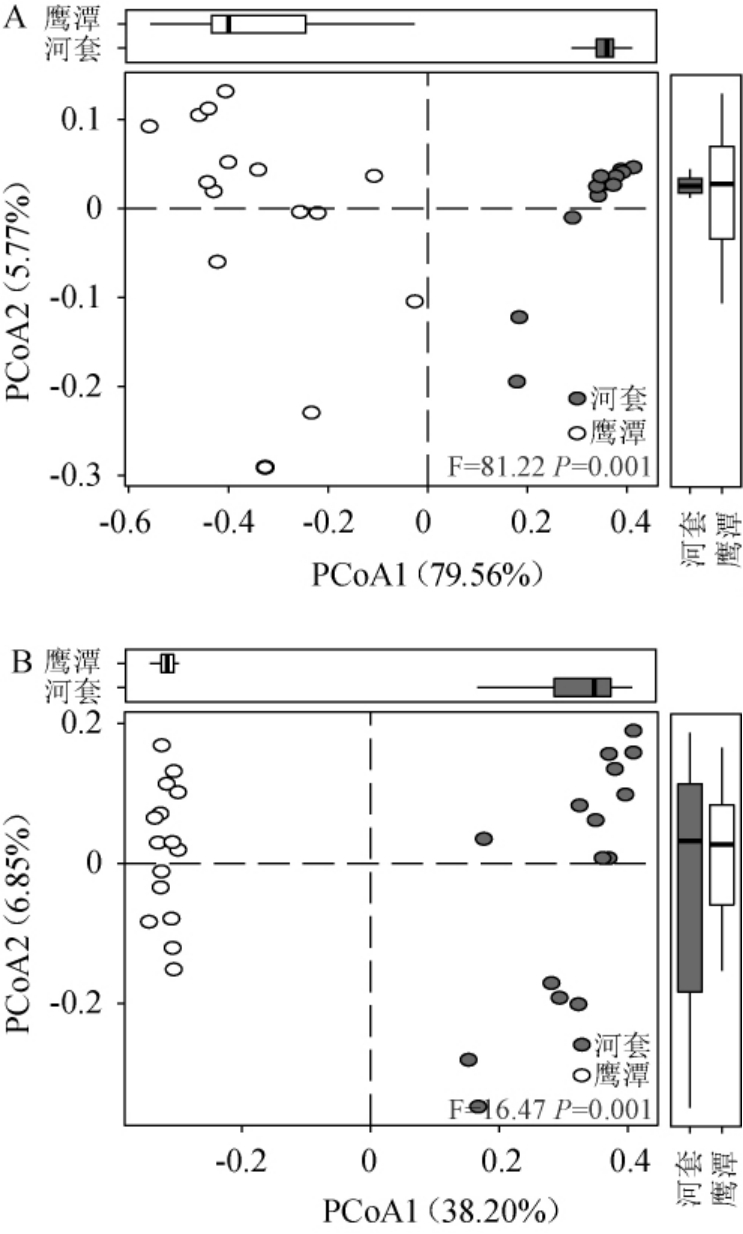
图3 基于加权(A)和非加权(B)UniFrac距离河套和鹰潭地区中高温大曲样品真菌类群的主坐标分析结果
Fig.3 Principal coordinate analysis results of fungal communities in medium-high temperature Daqu samples in Hetao and Yingtan regions based on weighted (A) and unweighted(B) UniFrac distances
由图3A可知,2个地区中高温大曲样品在二维空间上具有较为明显的分离趋势,其中河套地区中高温大曲样品分布在第一、四象限,而鹰潭地区样品分布在第二、三象限。经PERMANOVA检验可知,2个地区中高温大曲样品在空间分布上具有极显著差异(P<0.01)。由图3B可知,河套地区中高温大曲样品分布在第一、四象限,而鹰潭地区分布在第二、三象限,2个地区样品在空间上完全分离,且经PERMANOVA检验进一步证明了两者之间具有极显著差异(P<0.01)。由此可见,2个地区中高温大曲样品的真菌类群存在差异,且不同地区的酒曲可能各自存在较为独特的真菌类群。
2.3 河套和鹰潭地区中高温大曲样品特有真菌类群的甄别
采用LEfSe分析对河套和鹰潭地区中高温大曲样品各自的生物标志物进行甄别,结果见图4。

图4 河套和鹰潭地区中高温大曲样品真菌类群线性判别分析效应大小的进化分支图(A)和分布直方图(B)
Fig.4 Evolutionary branching diagram (A) and distribution histogram(B) of linear discriminant analysis effect size of fungal communities in medium-high temperature Daqu samples in Hetao and Yingtan areas
由图4A可知,2个地区中高温大曲样品中共存在17个真菌类群具有显著差异(P<0.05),河套地区中高温大曲样品真菌的标志物主要隶属于Ascomycota下的分支,而鹰潭地区中高温大曲样品真菌的标志物主要隶属于担子菌门(Basidiomycota)和毛霉门(Mucoromycota)下的分支。
由图4B可知,当线性判别分析(linear discriminant analysis,LDA)的对数值为4.0时,在属水平上,河套地区中高温大曲样品中Thermoascus和Thermomyces显著富集(P<0.05),而鹰潭地区中高温大曲样品中Rhizopus、Aspergillus和Lichtheimia显著富集(P<0.05)。基于相同的方法,马梦月等[24]解析了山东临沂和河南周口地区中高温大曲细菌群落结构的差异,明确了地杆菌属(Geobacter)为周口地区大曲的生物标志物,而临沂地区大曲不存在属水平的生物标志物。由此可见,不同地区中高温大曲中显著富集的微生物具有较大的差异,且河套地区中高温大曲样品中Thermoascus和Thermomyces的相对丰度更高,而Rhizopus、Aspergillus和Lichtheimia的相对丰度更小。ZHU M等[25]解析了环境因子对中高温大曲微生物演替的影响,结果发现湿度、温度、CO2浓度和水分等环境因素与大多数真菌呈现较为明显的相关性,其中Thermoascus与湿度和CO2浓度呈负相关,Thermomyces与湿度和酸度呈负相关,Aspergillus的生长主要与温度和酸度相关。XIANG F S等[26]采用单分子实时测序和纯培养技术相结合的方法研究发现,太原清香型大曲的真菌多样性和丰度显著低于随州地区,并且推测造成差异的原因可能是随州地区的制曲温度相较于太原地区更高。车路萍等[27]通过磷脂脂肪酸图谱分析法解析四川绵阳和泸州地区浓香型大曲及其曲房空气的微生物结构,结果发现,曲房空气微生物对浓香型大曲具有重要影响,并且不同地区曲房空气中微生物的组成和含量具有较大差异。综上所述,不同地区中高温大曲中真菌类群的组成具有差别,究其原因可能与制曲工艺及生产环境的不同有关。
2.4 河套和鹰潭地区中高温大曲样品真菌类群相关性的分析
微生物共现网络图常用于分析微生物的菌群结构及菌群内部的相互作用[28]。为了提高结果的有效性,挑取了相关系数|R|>0.6且P<0.05的真菌属构建网络图,结果见图5。
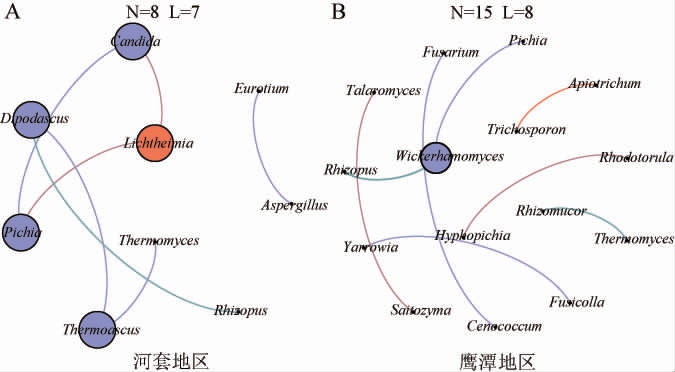
图5 河套(A)和鹰潭(B)地区中高温大曲样品真菌属间的相关性分析结果
Fig.5 Correlation analysis results between fungal genera in medium-high temperature Daqu samples in Hetao (A)and Yingtan (B) areas
N代表节点数;L代表边数。
由图5可知,河套地区中高温大曲样品中共有8个真菌属之间存在7个显著相关性(P<0.05),鹰潭地区中高温大曲中共有15个真菌属之间存在8个显著相关性(P<0.05),可见2个地区中高温大曲样品的真菌属之间相关性存在较大的差异。微生物共现网络图的网络密度反映了网络中各节点之间的联系程度,网络的密度越大表明其节点间的关系越密切[29]。河套和鹰潭地区中高温大曲样品真菌属的网络密度分别为0.194和0.076。由此可见,与鹰潭地区相比,河套地区中高温大曲样品中构成网络的真菌属具有更加密切的关系,并且网络的稳定性更高。
3 结论
河套地区中高温大曲样品中真菌属主要由隶属于Ascomycota的Thermomyces、Thermoascus、Aspergillus和Pichia等组成。不同酒厂生产中高温大曲的真菌类群结构存在较为明显的差异,与鹰潭地区相比,河套地区中高温大曲样品真菌类群的丰富度和多样性均显著偏低(P<0.05),其中Thermoascus和Thermomyces的相对丰度较高,而Rhizopus、Aspergillus和Lichtheimia的相对丰度较小,但相关性分析表明其真菌属间关系更密切、稳定性更好。
[1]JIANG X Y,PENG Z,ZHU Q,et al.Exploration of seasonal fermentation differences and the possibility of flavor substances as regulatory factors in Daqu[J].Food Res Int,2023,168:112686.
[2]CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150:110734.
[3]MA S Y, SHANG Z C, CHEN J, et al.Differences in structure, volatile metabolites, and functions of microbial communities in Nongxiangxing daqu from different production areas[J].LWT-Food Sci Technol,2022,166:113784.
[4]SONG X B,JING S,ZHU L,et al.Untargeted and targeted metabolomics strategy for the classification of strong aroma-type Baijiu(liquor)according to geographical origin using comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry[J].Food Chem,2020,314:126098.
[5]MA S Y, LUO H B, ZHAO D, et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing Daqu[J].Bioresource Technol,2022,345:126549.
[6]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[7]王清龙,李海登,刘延波,等.河南不同地区浓香型白酒大曲理化性质和微生物多样性分析[J].中国酿造,2022,41(11):31-38.
[8]HOU Q C,WANG Y R,CAI W C,et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Res Int,2022,156:111167.
[9]程伟,陈雪峰,陈兴杰,等.基于高通量测序技术解析皖北地区浓香型大曲的真菌群落结构[J].酿酒科技,2022(8):17-23.
[10]王玉荣,蔡文超,田龙新,等.基于Illumina MiSeq技术对特香型白酒中高温和高温大曲真菌群落结构解析[J].现代食品科技,2023,39(10):113-118.
[11]王强,蔡文超,刘忠军,等.清徐低温大曲真菌菌群多样性及其功能性关联分析[J].中国酿造,2022,41(11):56-60.
[12]GUO Z, WANG Y R, XIANG F S, et al.Bacterial diversity in pickled cowpea(Vigna unguiculata[Linn.]Walp)as determined by Illumina MiSeq sequencing and culture-dependent methods[J].Curr Microbiol, 2021,78:1286-1297.
[13]ESTAKI M,JIANG L J,BOKULICH N A,et al.QIIME 2 enables comprehensive end-to-end analysis of diverse microbiome data and comparative studies with publicly available data[J].Curr Protoc Bioinformatics,2020,70(1):e100.
[14]CAPORASO J G,BITTINGER K,BUSHMAN F D,et al.PyNAST: A flexible tool for aligning sequences to a template alignment[J].Bioinform,2010,26(2):266-267.
[15]EDGAR R C.Search and c'lustering orders of magnitude faster than BLAST[J].Bioinform,2010,26(19):2460-2461.
[16]WEI Z G,ZHANG X D,CAO M,et al.Comparison of methods for picking the operational taxonomic units from amplicon sequences[J].Front Microbiol,2021,12:644012.
[17]KÕLJALG U,NILSSON R H,ABARENKOV K,et al.Towards a unified paradigm for sequence-based identification of fungi[J].Mol Ecol,2013,22(21):5271-5277.
[18]TANG J,CHEN J,CHEN D M,et al.Structural characteristics and formation mechanism of microbiota related to fermentation ability and alcohol production ability in Nongxiang Daqu[J].Foods, 2022, 11(17):2602.
[19]WANG Y,QUAN S K, ZHAO Y J, et al.The active synergetic microbiota with Aspergillus as the core dominates the metabolic network of ester synthesis in medium-high temperature Daqu[J].Food Microbiol,2023,115:104336.
[20]HE M W, JIN Y, ZHOU R Q, et al.Dynamic succession of microbial community in Nongxiangxing daqu and microbial roles involved in flavor formation[J].Food Res Int,2022,159:111559.
[21]杨少勇,黎婷玉,蔡文超,等.襄阳地区高温大曲和中高温大曲真菌多样性解析[J].中国酿造,2021,40(5):76-80.
[22]谭崇尧,徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技,2018(9):118-122.
[23]LI Z X,ZHOU J,LIANG H,et al.Differences in alpha diversity of gut microbiota in neurological diseases[J].Front Neurosci,2022,16:879318.
[24]马梦月,郭壮,李学思,等.临沂和周口地区中高温大曲细菌群落结构与基因功能差异性研究[J].食品工业科技,2024,45(1):155-161.
[25]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110955.
[26]XIANG F S,CAI W C,HOU Q C,et al.Comparative analysis of the microbial community structure in light-flavor Daqu in Taiyuan and Suizhou regions,China[J].LWT-Food Sci Technol,2023,177(3):114599.
[27]车路萍,邓杰,卫春会,等.基于PLFA分析不同地域浓香型大曲及曲房空气细菌群落相关性[J].食品与发酵工业,2019,45(24):33-39.
[28]RÖTTJERS L, FAUST K.From hairballs to hypotheses-biological insights from microbial networks[J].FEMS Microbiol Rev,2018,42(6):761-780.
[29]万凌琳,陈芷凡,郭佳,等.生物共现网络原理及其在淡水生态系统评估中的应用[J].湖泊科学,2022,34(6):1765-1789.