窖泥发酵是浓香型白酒最典型的特征,是区别于其他香型白酒的关键所在,窖泥的质量也是决定其品质的关键因素之一[1]。研究表明,白酒发酵过程中的酸类物质和乙醇在酯化酶的催化下会生成酯类物质,是白酒中酯类物质的主要合成途径[2-3]。浓香型白酒的特征性香味成分己酸乙酯主要由酯化酶将发酵产物乙醇与窖泥功能己酸菌代谢产物己酸进行酯化合成[4-5]。
酯酶又被称为羧酸酯酶,除能够水解羧酸酯键外,还能促进低级脂肪酸酯生成[1]。在白酒生产领域,这些酶被称为酯化酶和酯水解酶[6]。酯化酶产生菌种类繁多,对浓香型白酒来说,可产生酯化酶的主要功能菌除细菌、根霉(Rhizopus)外,还有红曲霉(Monascus)[7-8]。红曲霉在我国有悠久的历史和使用记载,由于其高效产酶特性,如产淀粉酶、糖化酶、蛋白酶、酯化酶等,被广泛应用于发酵食品和白酒酿造中[9]。目前研究显示,红曲霉菌株具备高效合成己酸乙酯的能力[10],如紫红曲霉(Monascus purpureus)和烟灰色红曲霉(Monascus fuliginosus)皆能够通过酯化酶的酯化反应,将己酸与乙醇合成己酸乙酯,展现出强大的合成能力[11]。红曲霉产酯化酶会受到多方面因素的影响,如发酵过程中培养基的成分、培养条件和培养方式等方面[12],并且液态酯化酶已被证明比固态酯化酶具有更强的活性和稳定性[11]。但目前液态培养条件还在试验阶段,相关研究尚不够深入,相关生产参数的提供相对有限,优化液态培养条件来提高酯化酶合成风味成分己酸乙酯将具有重要的应用价值及实践指导意义。因此,有必要进一步挖掘优质高产酯化酶红曲霉菌种资源,并对其产酶培养条件和底物特性进行深入探索。
本研究采用传统培养分离法从大曲、红曲米、酒糟样品中分离红曲霉(Monascus)菌株,通过透明圈法及酯化酶活力测定从中筛选高产酯化酶菌株,并通过形态观察及分子生物学技术对其进行菌种鉴定。在发酵培养基优化的基础上,以酯化酶活力为响应值,采用单因素及响应面试验对其发酵条件进行优化[13],并对所产酯化酶底物特异性进行研究,以期为己酸乙酯酯化酶的合成及生产提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大曲:仙谭酱香酒厂;酒糟:福建古田酒厂、白云边酒厂;红曲米样品若干:武汉某厂。
1.1.2 试剂
可溶性淀粉、无水乙醇、正己烷、氯化钠、葡萄糖、硫酸镁、磷酸二氢钠、己酸、丁酸、乙酸乳酸、蔗糖(均为分析纯)、玉米糊精、乳糖(均为生化试剂):国药集团化学试剂有限公司;牛肉浸粉、麦芽浸粉(均为生化试剂):青岛海博生物技术有限公司;蛋白胨(生物试剂):北京双旋微生物培养基制品厂。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[14]:将200 g马铃薯去皮,加水煮沸20 min后纱布过滤,用蒸馏水定容至1 L,加入20 g/L蔗糖,20 g/L琼脂,pH值为7。115 ℃高压蒸汽灭菌30 min。
三丁酸甘油酯培养基[15]:PDA培养基中加入1.5%三丁酸甘油酯,pH值为7。115 ℃高压蒸汽灭菌30 min。
麦芽汁培养基:青岛海博生物技术有限公司。种子培养基[16]:采用麦芽汁培养基,115 ℃高压蒸汽灭菌30 min。
液态发酵培养基[11]:可溶性淀粉70 g/L、蛋白胨20 g/L、MgSO4 1 g/L、NaH2PO4 1 g/L,pH值为7,115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
ZHWY-2112恒温培养振荡器、ZHJH-1214B超净工作台、ZSD-2270电热恒温培养箱:上海智诚分析仪器制造公司;PL6001-S电子天平、DELTA 320pH计:梅特勒-托利多仪器有限公司;YXQ-LS-75SII压力蒸汽灭菌器:上海博讯实业公司医疗设备厂;AR3130电子分析天平:奥豪斯国际贸易有限公司;WD-9405B水平摇床:沃德生物医学仪器公司;ZDF-5430恒温鼓风干燥箱:重庆银河试验仪器制造有公司;7820A气相色谱(gas chromatography,GC)仪:美国安捷伦公司。
1.3 方法
1.3.1 红曲霉菌株的分离与纯化
将大曲、酒糟、红曲米粉粹,分别称取10 g样品于100 mL生理盐水中,振荡30 min,按十倍梯度进行稀释。取各梯度稀释液涂布于PDA培养基平板上,30 ℃恒温培养5 d,观察菌落情况。当菌丝生长较为明显时,用接种环挑取红曲霉菌丝移植于另一PDA培养基平板中,进行多次分离纯化,得到红曲霉单菌落,在显微镜下观察菌落形状、大小、类型、颜色。
1.3.2 高产酯化酶红曲霉菌株的筛选
初筛:将纯化的红曲霉菌株点接于三丁酸甘油酯培养基上,30 ℃恒温培养5 d。使用游标卡尺测定菌落(d)及其周围透明圈(D)的直径,计算D/d值,初步判断纯化菌株的酯化能力。
复筛:用10 mL无菌水加入到保存有菌落的PDA培养基斜面上,洗下孢子,然后转移到液态发酵培养基中,30 ℃、180 r/min条件下培养5 d。发酵液用擦镜纸过滤,然后计数,使种子液中的孢子浓度为1×106 CFU/mL。将种子液以10%(V/V)的接种量接种于100 mL液态发酵培养中,先在30 ℃静置培养12 h,再在30 ℃、180 r/min条件下培养5 d。发酵液用1层擦镜纸过滤后,制成粗酶液备用,测定酯化酶活力,筛选高产酯化酶的菌株。
1.3.3 酯化酶活力的检测
酯化反应体系中加入粗酶液1.5 mL、0.2 mol/L Na2HPO4缓冲液(pH 6.0)0.5 mL、无水乙醇1.5 mL、正己酸0.5 mL,混匀,30 ℃、180 r/min条件下酯化1 d[17-18]。空白对照为等体积液态发酵培养基。取2 mL酯化液,加入等体积的正己烷,于漩涡混匀器上萃取30 s,静置10 min。取上层萃取液过滤,采用气相色谱法测定己酸乙酯含量[19-22]。
酯化酶活力单位定义[23-24]:以酯化液中1 h合成1 μmol己酸乙酯所需要的酶量定义为1个酶活力单位,U/L。
1.3.4 高产酯化酶菌株的分子生物学鉴定
将样品送至武汉六合华大基因科技有限公司进行测序,对产酯化酶的霉菌进行分子生物学鉴定。引物为ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3'),PCR扩增体系:PCR Mix 21 μL、引物各1 μL、脱氧核糖核酸(deoxyribonucleic acid,DNA)模板2 ng/μL。PCR扩增条件:96 ℃预变性5 min;96 ℃变性20 s,56 ℃退火30 s,72 ℃延伸30 min,进行35个循环;然后于72 ℃终延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,观察条带性状,最后进行纯化测序。将测序结果提交至美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索。选取同源性较高的模式菌株的ITS基因序列,利用MEGA6.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树[25]。
1.3.5 高产酯化酶红曲霉菌株产酶培养基及培养条件优化试验
单因素试验:将高产酯化酶红曲霉菌株种子液接种于液态发酵培养基中,30 ℃、180 r/min条件下培养5 d。在此基础上,依次探究碳源种类(可溶性淀粉、葡萄糖、蔗糖、乳糖)及碳源质量浓度(30 g/L、40 g/L、50 g/L、60 g/L、70 g/L)、氮源种类(牛肉浸粉、麦芽浸粉、蛋白胨、玉米糊精)及氮源质量浓度(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L)、初始pH(2、3、4、5、6、7)、发酵温度(27 ℃、30 ℃、33 ℃、36 ℃、39 ℃)、转速(140 r/min、160 r/min、180 r/min、200 r/min、220 r/min)对酯化酶活力的影响。
响应面试验:根据单因素试验结果,以酯化酶活力(Y)为响应值,以发酵温度(A)、转速(B)、初始pH值(C)为考察因素,采用Design Expert 10.0.3软件设计3因素3水平的响应面试验,试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization

水平A 发酵温度/℃B 转速/(r·min-1)C 初始pH值-1 01 30 33 36 160 180 200 567
1.3.6 酯化酶底物特异性研究
酯化酶对单一酸的催化能力:按照1.3.3方法,酯化反应体系中分别添加0.5 mL乙酸、丁酸、己酸、乳酸。酯化酶对混合酸的催化能力:按照1.3.3方法,酯化液中共添加四大酸(乙酸、正己酸、丁酸、乳酸)各0.125 mL。空白对照为灭活的粗酶液。采用GC法测定乙酸乙酯、丁酸乙酯、己酸乙酯及乳酸乙酯的含量[19-22]。
1.3.7 数据处理与统计分析
使用Excel 2019、SPSS Siatistics 27.0对数据进行统计分析处理,所有试验均重复进行3次,数据以“平均值±标准偏差”表示。采用Origin 2022绘制柱状图,利用Dsign Expert 10.0.3软件设计响应面试验。
2 结果与分析
2.1 红曲霉菌株的分离及筛选
2.1.1 分离及初筛
从多种样品中共分离筛选得到6株具有酯化能力的红曲霉菌株,编号分别为XTQ(从仙谭酱香大曲中分离)、JZO、JZT、JZW(从白云边酒曲中分离)、QMR、QMO(从红曲米中分离),其在三丁酸甘油酯培养基上的酯化能力见表2。
表2 6株红曲霉菌株在三丁酸甘油酯培养基上的酯化力测定结果
Table 2 Determination results of esterification capacity of 6 strains of Monascus on glycerol tributyrate medium
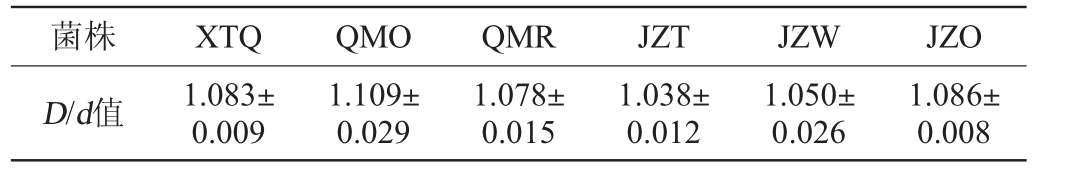
菌株XTQQMOQMRJZTJZWJZO D/d值1.083±0.009 1.109±0.029 1.078±0.015 1.038±0.012 1.050±0.026 1.086±0.008
由表2可知,6株红曲霉菌株均有一定的酯化能力,其中,菌株QMO、XTQ和JZO在三丁酸甘油酯培养基上的D/d值明显高于其他菌株,分别为1.109±0.029、1.083±0.009、1.086±0.008。
2.1.2 复筛
6株红曲霉菌株的酯化酶活力见图1。由图1可知,6株红曲霉菌株均具有一定的酯化能力,其中,菌株XTQ酯化酶活力显著高于其他菌株(P<0.05),为(43.08±0.266)U/L,菌株QMR次之。因此,选择菌株XTQ为高产酯化酶菌株进一步鉴定。
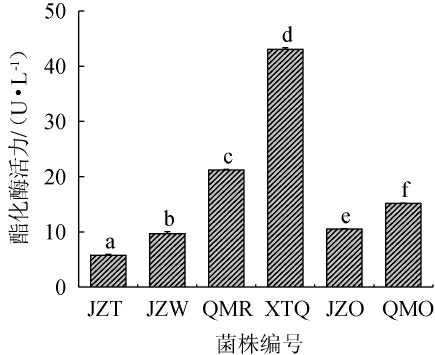
图1 6株红曲霉菌株酯化酶活力的测定结果
Fig.1 Determination results of esterase activity of 6 strains of Monascus
不同小写字母表示差异显著(P<0.05)。下同。
2.2 红曲霉菌株XQT的菌种鉴定
2.2.1 形态学观察
菌株XTQ的菌落及菌体特征见图2。由图2可知,菌株XTQ在PDA培养基上培养5 d后的菌落呈圆形,平整,菌丝中等长度,正面为浅灰色,背面为橙色;菌体包括闭囊、分生孢子、细胞隔膜和分枝菌丝。参照《中华医学百科全书》[16],初步鉴定菌株XTQ为红曲霉属(Monascus sp.)。
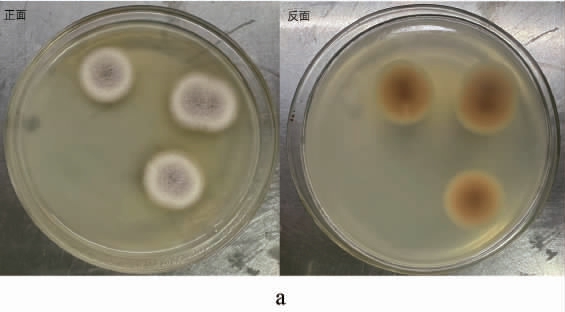
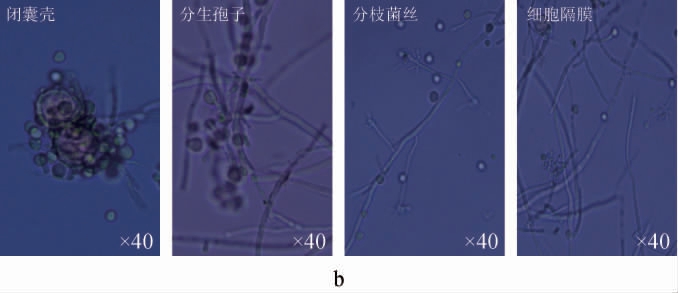
图2 菌株XTQ的菌落(a)及菌丝(b)形态
Fig.2 Colony (a) and mycelial (b) morphology of strain XTQ
2.2.2 分子生物学鉴定
基于ITS基因序列构建菌株XTQ的系统发育树,结果见图3。由图3可知,菌株XTQ与紫色红曲霉(Monascus purpureus)(MF787601.1)聚于一支,亲缘关系最近。结合形态学特征,最终鉴定菌株XTQ为紫色红曲霉(Monascus purpureus)。
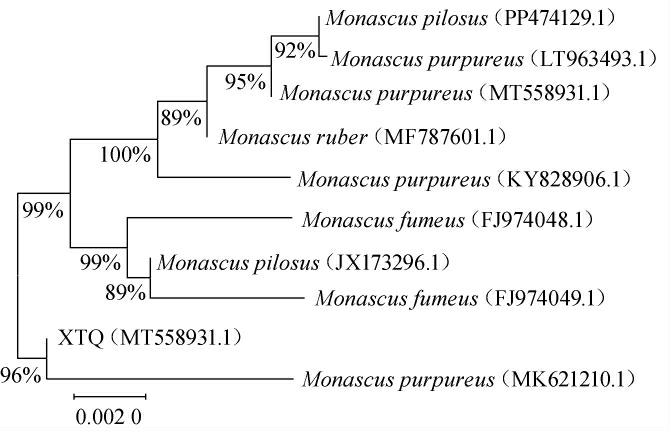
图3 基于ITS基因序列菌株XTQ的系统发育树
Fig.3 Phylogenetic tree of strain XTQ based on ITS gene sequences
2.3 紫色红曲霉XTQ产酯化酶发酵培养基优化
2.3.1 碳源种类对紫色红曲霉XTQ产酯化酶的影响
不同碳源对紫色红曲霉XTQ产酯化酶的影响见图4。

图4 碳源种类对紫色红曲霉XTQ产酯化酶的影响
Fig.4 Effect of carbon source types on esterase production by Monascus purpureus XTQ
由图4可知,适宜的碳源有利于紫色红曲霉XTQ产酯化酶。当葡萄糖作为碳源时,紫色红曲霉XTQ的酯化酶活力最高,达到(50.46±1.58)U/L,当可溶性淀粉和蔗糖作为碳源时,紫色红曲霉XTQ所产酯化酶的酶活性次之,乳糖为碳源时,酯化酶活力最低。因此,确定最佳碳源为葡萄糖,结果与潘名志[26]的研究结果类似。然而任佳明等[27]研究表明,当选用麦芽糖为培养基碳源时,紫色红曲霉(Monascus purpureus)产酯化酶酶活力最高,说明不同来源红曲霉的最佳碳源种类不同。
2.3.2 葡萄糖质量浓度对紫色红曲霉XTQ产酯化酶的影响
葡萄糖质量浓度对紫色红曲霉XTQ产酯化酶的影响见图5。由图5可知,随着葡萄糖质量浓度的增加,酯化酶活力呈现先升高后下降的趋势。这可能是因为碳源浓度过低不利于微生物的生长,而碳源浓度过高则会导致不适宜的碳氮比,从而影响菌体的生长和产酶[11]。当葡萄糖质量浓度为50 g/L时,酯化酶的酶活性达到最高,为(54.96±3.86)U/L。因此,确定最佳葡萄糖质量浓度为50 g/L。
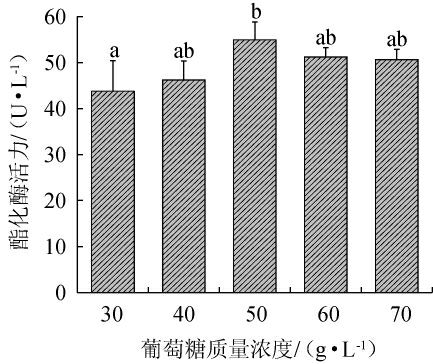
图5 葡萄糖质量浓度对紫色红曲霉XTQ产酯化酶的影响
Fig.5 Effect of glucose mass concentration on esterase production by Monascus purpureus XTQ
2.3.3 氮源种类对紫色红曲霉XTQ产酯化酶的影响
赵志军等[28]研究发现,红曲霉在无氮源添加的培养基中液态发酵时几乎不产酯化酶,说明红曲霉产酯化酶必须要利用氮源。不同氮源对紫色红曲霉XTQ产酯化酶的影响见图6。
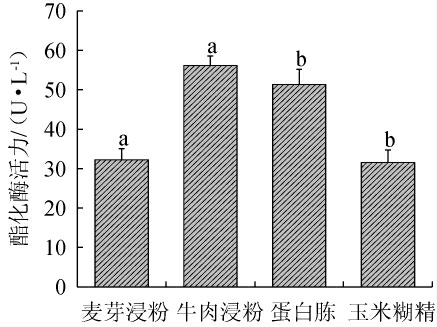
图6 氮源种类对紫色红曲霉XTQ产酯化酶的影响
Fig.6 Effect of nitrogen source types on esterase production by Monascus purpureus XTQ
由图6可知,当牛肉浸粉为氮源时,酯化酶活力最高,为(56.16±1.32)U/L,其次为蛋白胨、麦芽浸粉、玉米糊精,这与周帆顺[29]研究结果一致,牛肉浸粉对菌体增殖最为显著。因此,确定最佳氮源为牛肉浸粉。
2.3.4 牛肉浸粉质量浓度对紫色红曲霉XTQ产酯化酶的影响
牛肉浸粉质量浓度对紫色红曲霉XTQ产酯化酶的影响见图7。由图7可知,随着牛肉浸粉质量浓度的升高,紫色红曲霉XTQ的酯化酶活力呈先升高后下降的趋势,分析原因可能是,只有在最适碳氮比下有利于产酶。当牛肉浸粉质量浓度为20 g/L时,酯化酶酶活最高,为(57.07±1.15)U/L。因此,确定最佳牛肉浸粉质量浓度为20 g/L。
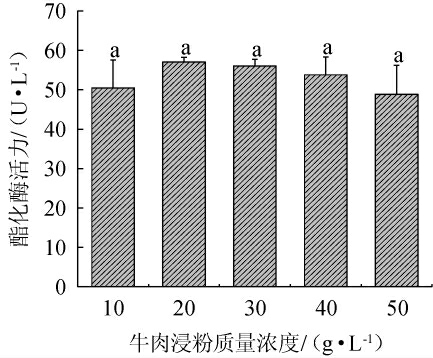
图7 牛肉浸粉质量浓度对紫色红曲霉XTQ产酯化酶的影响
Fig.7 Effect of beef extract mass concentration on esterase production by Monascus purpureus XTQ
2.4 紫色红曲霉XTQ产酯化酶发酵条件优化
2.4.1 发酵温度对紫色红曲霉XTQ产酯化酶的影响
培养温度影响红曲霉的生长和酯化酶的分泌量,红曲霉的生长温度范围为15~42 ℃,最适生长温度为28~35 ℃,属于中温型生物[30]。因此,选择温度范围27~39 ℃来研究其对紫色红曲霉XTQ产酯化酶的影响,结果见图8。
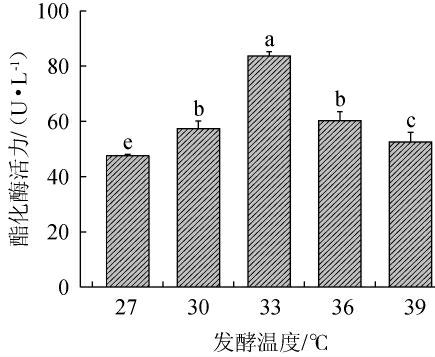
图8 发酵温度对紫色红曲霉XTQ产酯化酶的影响
Fig.8 Effect of fermentation temperature on esterase production by Monascus purpureus XTQ
由图8可知,随着发酵温度的升高,紫色红曲霉XTQ的酯化酶活力呈先升高后下降的趋势。当发酵温度为33 ℃时,紫色红曲霉XTQ所产酯化酶活力最高,为(83.74±1.58)U/L。温度不仅能影响菌株的生长,而且还能影响酯化酶的生成,当温度较低时,会使菌株生长缓慢导致产酯酶量少;当温度过高时蛋白开始变性,酶活下降[31]。因此,确定最佳发酵温度为33 ℃。
2.4.2 转速对紫色红曲霉XTQ产酯化酶的影响
在液体培养条件下,转速高低影响着供氧速率和菌丝生长,适宜的转速可以提高供氧的速率利于菌丝的生长,同时能让菌丝间隔松散,利于供氧[11]。因此,考察不同转速对紫色红曲霉XTQ产酯化酶的影响,结果见图9。由图9可知,随着转速的升高,酯化酶活呈先升高后下降的趋势,当转速为180 r/min时,酯化酶活力最高,达(83.66±2.07)U/L。因此,确定最佳转速为180 r/min。
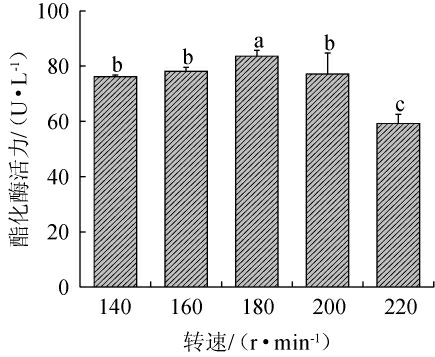
图9 转速对紫色红曲霉XTQ产酯化酶的影响
Fig.9 Effect of rotational speed on esterase production by Monascus purpureus XTQ
2.4.3 初始pH值对紫色红曲霉XTQ产酯化酶的影响
发酵培养基的初始pH值对微生物的生长、繁殖和产物的合成有显著影响,且不同微生物对pH值的要求各不相同[32]。潘名志[26]研究表明,红色红曲霉ZK产酯化酶的最优培养基初始pH值为5.5;张艳艳等[33]研究发现,一株产酯能力较高的红曲霉菌的最佳发酵培养基初始pH值为4.5;而王晓丹等[34]研究则表明,红曲霉产己酸乙酯脂肪酶固态发酵培养基的最适初始pH值为7。这说明不同红曲霉产酯化酶的最适培养基初始pH值存在差异。因此,考察不同初始pH值对紫色红曲霉XTQ产酯化酶的影响,结果见图10。由图10可知,随着培养基初始pH值的升高,红曲霉XTQ所产酯化酶活力呈现先升高后下降的趋势。当培养基初始pH值为6时,有利于菌体产酶,酯化酶的酶活性达到最大,为(88.165±2.652)U/L。因此,确定最佳初始pH值为6。
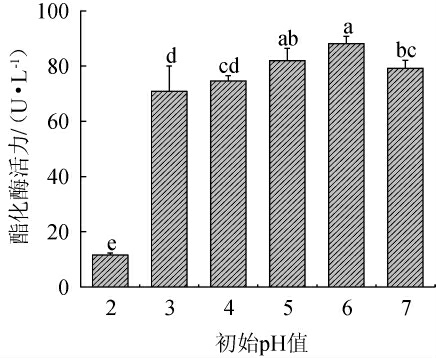
图10 初始pH值对紫色红曲霉XTQ产酯化酶的影响
Fig.10 Effect of initial pH value on esterase production by Monascus purpureus XTQ
2.5 紫色红曲霉XTQ产酯化酶发酵条件优化响应面试验
在单因素试验基础上,以酯化酶活力(Y)为响应值,选择发酵温度(A)、转速(B)、初始pH值(C)为考察因素,采用Design Expert 10.0.3软件设计3因素3水平的响应面试验,试验设计及结果见表3,方差分析结果见表4。
表3 紫色红曲霉XTQ产酯化酶发酵条件优化响应面试验设计及结果
Table 3 Design and results of response surface experiments of fermentation conditions optimization for esterase production by Monascus purpureus XTQ
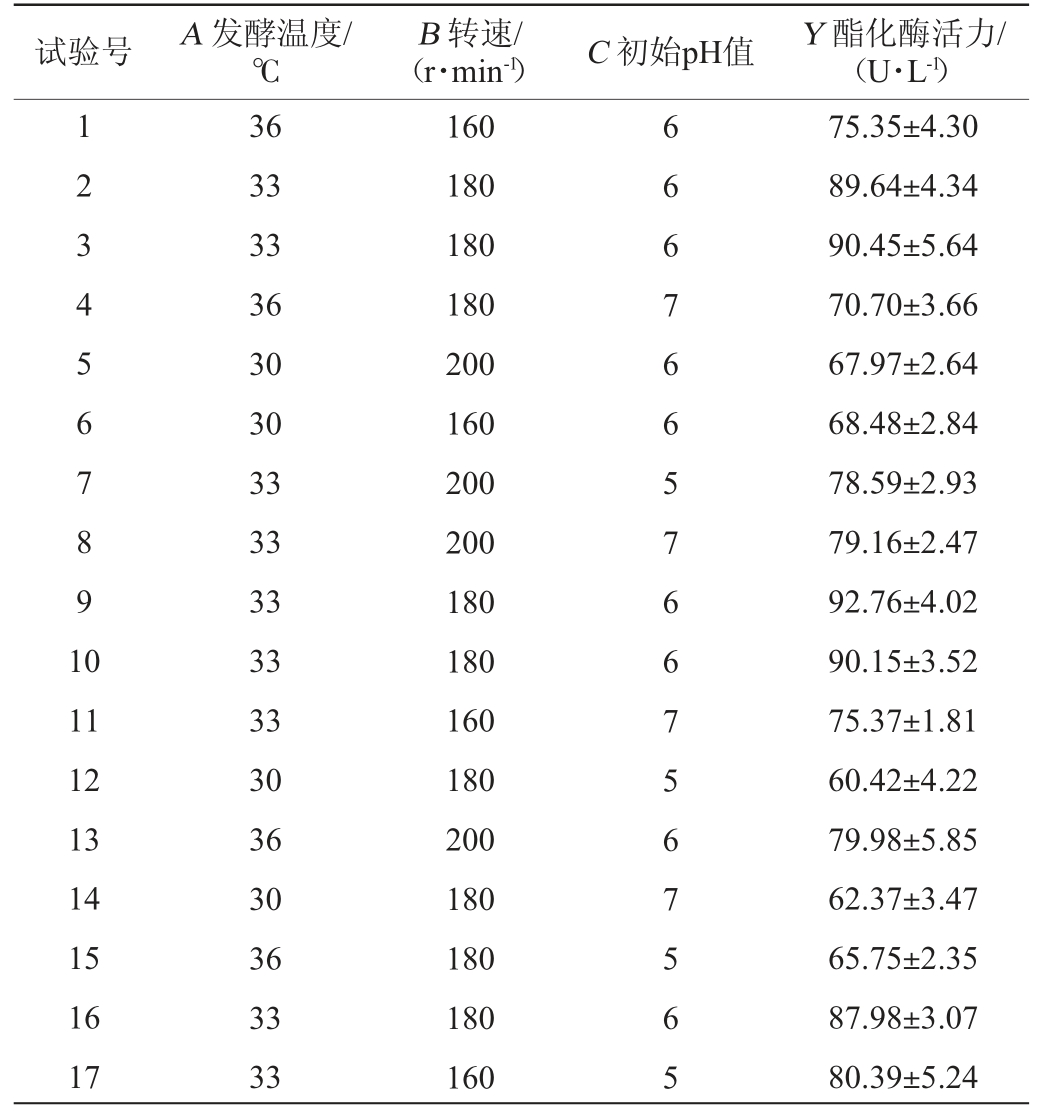
试验号 A 发酵温度/℃(r·min-1) C 初始pH值 Y 酯化酶活力/(U·L-1)B 转速/1234567891 0 11 12 13 14 15 16 17 36 33 33 36 30 30 33 33 33 33 33 30 36 30 36 33 33 160 180 180 180 200 160 200 200 180 180 160 180 200 180 180 180 160 66676657667567565 75.35±4.30 89.64±4.34 90.45±5.64 70.70±3.66 67.97±2.64 68.48±2.84 78.59±2.93 79.16±2.47 92.76±4.02 90.15±3.52 75.37±1.81 60.42±4.22 79.98±5.85 62.37±3.47 65.75±2.35 87.98±3.07 80.39±5.24
表4 回归模型方差分析
Table 4 Variance analysis of regression model

注:“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方F 值P 值显著性模型ABCA B****AC BC A2 B2 C2残差失拟项净误差总离差1 690.57 132.29 4.65 0.74 6.58 2.23 7.81 999.93 14.29 419.25 31.94 20.08 11.86 1 722.52 91111111117341 6 187.84 132.29 4.65 0.74 6.58 2.23 7.81 999.93 14.29 419.25 4.56 6.69 2.97 41.16 28.99 1.02 0.16 1.44 0.489 7 1.71 219.13 3.13 91.88 2.26<0.000 1 0.001 0 0.346 5 0.699 4 0.268 9 0.506 7 0.232 2 0.000 1 0.120 1<0.000 1 0.224 0****
使用响应面软件Design Expert 10.0.3对表3试验数据进行多元二次回归拟合分析,得到酯化酶活力(Y)对3个因素发酵温度(A)、转速(B)和初始pH值(C)的二次多项式回归方程:Y=90.20+4.07A+0.762 2B+0.303 9C+1.28AB+0.747 4AC+1.4BC-15.41A2-1.84B2-9.98C2。
由表4可知,模型的P值<0.000 1,极显著,失拟项的P值>0.05,不显著,说明模型可靠。模型决定系数R2=0.9815,调整决定系数R2Adj=0.957 6,说明模型与试验拟合度较好。由P值可知,一次项A、二次项A2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。由F值可知,影响酯化酶活力的3个因素主次顺序依次为:发酵温度>转速>初始pH值。
根据Design-Expert 10.0.3软件分析得出最佳发酵条件为:发酵温度33.43 ℃,转速185.45 r/min,初始pH值为6.04,在此条件下,紫色红曲霉XTQ的酯化酶活力理论值为90.60 U/L。根据实际生产过程中的操作情况,将最优发酵工艺参数修订为发酵温度33.4 ℃,转速185 r/min,初始pH值6.0,在此条件下进行3次验证试验,酯化酶活力实际值为(93.82±5.65)U/L,接近理论值,说明该模型可以准确预测在色红曲霉XTQ的酯化酶活力。
2.6 紫色红曲霉XTQ产酯化酶底物特异性
2.6.1 对单一酸的催化能力
紫色红曲霉XTQ所产酯化酶对单一酸—乙酸、丁酸、己酸和乳酸的酯化作用结果显示,紫色红曲霉XTQ所产酯化酶酯化合成己酸乙酯的含量最多,为[(346.2±22.36)mg/L],其次是乳酸乙酯[(149.71±9.08)mg/L]和乙酸乙酯[(110.45±31.51)mg/L]。然而,对丁酸与乙醇的酯化没有促进作用,表明紫色红曲霉XTQ所产酯化酶具有较强的专一性,对己酸的催化能力最好。
2.6.2 对混合酸的催化能力
在等量混合酸中,乙醇与四大混合酸在紫色红曲霉XTQ所产酯化酶的作用下主要生成己酸乙酯,产量为(279.26±1.59)mg/L。生成少量的乙酸乙酯[(80.73±9.49)mg/L]和乳酸乙酯[(93.31±13.33)mg/L],但没有丁酸乙酯生成,表明紫色红曲霉XTQ所产酯化酶对己酸的选择性最好。研究表明,红曲霉酯化酶在水相中对底物酸具有一定的酯化特异性[7]。己酸、乳酸和乙酸可以在丛毛红曲霉(Monascus pilosus)酯化酶作用下生成对应的酯类,该菌还可促进丁酸和混合酸生成己酸乙酯[35]。也有研究发现,烟灰色红曲霉(Monascus fuliginosus)对己酸乙酯的催化专一性很高[36],选择特异性大小为:己酸>丁酸>乳酸>乙酸,由此可见,不同来源的红曲霉酯化酶底物特异性存在差异。
3 结论
采用传统培养分离法及透明圈法从不同产地来源的大曲、酒糟等原料中分离筛选出6株产酯化酶红曲霉,通过酯化酶活力测定从中筛选得到一株高产酯化酶的红曲霉菌株,编号为XTQ,其酯化酶活力为(43.08±0.266)U/L。通过形态观察及分子生物学技术鉴定,确定菌株XTQ为紫色红曲霉(Monascus purpureus)。以酯化酶活力为响应值,通过单因素和响应面法优化得到紫色红曲霉XTQ的最优发酵培养基为葡萄糖50 g/L、牛肉浸粉20 g/L、硫酸镁1 g/L、磷酸氢二钠1 g/L,最优发酵条件为初始pH值6.0、发酵温度33.4 ℃、转速185 r/min。在该优化条件下,酯化酶活力达到(93.82±5.65)U/L,是优化前优化前的2.18倍。对紫色红曲霉XTQ菌株所产酯化酶的底物特异性进行研究发现,不管是单一酸还是混合酸,紫色红曲XTQ对己酸均具有较强的催化活性,对己酸的催化效率远高于其他酸类成分,能明显促进己酸乙酯的生成。本研究结果不仅为红曲霉酯化酶的液态发酵生产提供了工艺参数,在一定程度上也为浓香型白酒风味品质的提升提供了参考。
[1]宋川,刘双平,敖宗华,等.白酒酿造微生物酯化酶的研究进展[J].酿酒,2024,51(2):34-40.
[2]罗小叶,邱树毅,王晓丹.微生物发酵产酯化酶在浓香型白酒品质提升中研究进展[J].中国酿造,2019,38(8):6-8.
[3]黄丹,刘清斌,刘达玉,等.一株产己酸乙酯酯化酶霉菌的分离鉴定及酶条件研究[J].酿酒科技,2008(2):27-29.
[4]张惠芳,张婉莹,周索,等.赊店老酒窖池中产己酸菌分离鉴定及产酸条件研究[J].现代食品科技,2023,39(2):188-196.
[5]杨智华,陈菊.浓香型白酒特征风味关键酶的酶学特性研究[J].酿酒,2023,50(4):80-84.
[6]汤秀娟,吴成泽,陈聪,等.高产酯酶细菌的筛选、鉴定及复合诱变选育[J].中国酿造,2023,42(12):87-92.
[7]王晓程,徐友强,李秀婷,等.中国传统发酵食品来源典型小分子脂肪酸酯合成微生物及酶的研究进展[J].中国食品学报,2021,21(4):345-355.
[8]王艳,吴鑫颖,胡娜,等.紫色红曲霉FBKL3.0018液态发酵产酯化酶的工艺优化[J].食品工业科技,2018,39(15):147-153.
[9]杨恩超,程世春,刘光烨.己酸乙酯酯化菌分离筛选及鉴定[J].食品与发酵科技,2010,46(3):33-36.
[10]闫路娜,王英泽,李晨,等.食品生物化学[M].北京:北京师范大学出版社,2021:125-132.
[11]许春艳,孙宝国,徐友强,等.合成己酸乙酯酯化酶产生菌的鉴定及产酶条件优化[J].中国食品学报,2020,20(5):138-147.
[12]吕梅.Lichthelmia属HSM菌株酯酶发酵条件及酶学特性研究[D].武汉:湖北工业大学,2014.
[13]DAI W H,SHAO Y C,CHEN F S.Production of Monacolin K in Monascus pilosus: comparison between industrial strains and analysis of its gene clusters[J].Microorganisms,2021,9(4):747.
[14]袁爱华,梁永康,吴珊珊,等.食品常用霉菌增菌培养基的改良效果对比[J].食品科技,2020,45(10):317-322.
[15]张杰,侯珺淇,代振玉,等.一株产羧酸酯酶菌的鉴定及酯酶特征的研究[J].食品工业科技,2021,42(19):126-134.
[16]黎源倩.中华医学百科全书:卫生检验学[M].北京:中国协和医科大学出版社,2017:56-57.
[17]肖冬光.白酒酿造过程中酯类物质形成机理探讨[J].酿酒科技,2022(9):17-24.
[18]ZHANG S W, WANG T, ZHANG Y M, et al.Effects of Monascus on proteolysis,lipolysis,and volatile compounds of camembert-type cheese during ripening[J].Foods,2022,11(11):1662.
[19]董洋,刘亚琼,刘姗姗.杂粮红曲酒高级醇及其挥发性风味物质研究[J].酿酒科技,2017(3):55-59.
[20]郭通航,陈建新.GC双内标法同时测定发酵液中己酸和己酸乙酯的含量[J].酿酒科技,2015(2):114-117.
[21]张俊,张旭东,李江.气色谱仪在白酒己酸乙酯检测中的应用[J].科技经济导刊,2016(2):117-118.
[22]梁龙元,王露,薛栋升.白酒酿造中酯酶及己酸乙酯的研究进展[J].酿酒,2018,45(1):17-23.
[23]YU P B, DU J, CAO C L, et al.Development of a novel multi-strain wheat Qu with high enzyme activities for Huangjiu fermentation[J].J Sci Food Agr,2021,101(11):4808-4817.
[24]单夏男.中国部分白酒大曲红曲霉遗传及生理学多样性的研究[D].金华:浙江师范大学,2022.
[25]郑平,覃先武,张彦,等.高产开环型monacolin K红曲霉菌株的筛选及其在红曲酒酿造中的应用[J].中国酿造,2023,42(3):129-134.
[26]潘名志.红曲霉产酯化酶特性及其酶学性质的研究[D].贵阳:贵州大学,2009.
[27]任佳明,李付丽,吴鑫颖,等.紫色红曲霉FBKL3.0018液态发酵产酯化酶的研究[J].中国酿造,2016,35(7):69-73.
[28]赵志军,赵婷,刘延波,等.酯化型红曲菌复合诱变选育及其固态发酵条件优化[J].食品工业科技,2021,42(2):76-82.
[29]周帆顺.直投式发酵黄姜生产技术研究[D].南昌:南昌大学,2023.
[30]孙婷,黄彩桃,吕晓航,等.红曲霉高产菌株筛选及固态发酵研究[J].粮食科技与经济,2019,44(5):121-122.
[31]刘能,何朝玖,陈杰,等.浓香型大曲培菌期主要微生物变化及挥发性风味物质合成影响因素研究[J].酿酒科技,2023(9):17-25.
[32]王玉荣,侯强川,田龙新,等.酱香白酒第五轮次窖池发酵不同分层酒醅微生物群落与感官理化性质差异分析[J].食品科学,2023,44(22):250-256.
[33]张艳艳,孙晓康,张晓元,等.一株适用于苦荞米发酵的红曲霉菌株分离与筛选[J].食品与药品,2023,25(5):385-390.
[34]王晓丹,胡靖,胥思霞,等.合成己酸乙酯脂肪酶产生菌的产酶条件优化及其催化生产香酯液研究[J].酿酒科技,2013(5):11-13.
[35]李沅达,邓秀娟,吴婷,等.红曲霉发酵食品研究现状与分析[J].食品安全质量检测学报,2022,13(3):688-696.
[36]徐前景,陈茂彬,张岩,等.酯化红曲(酶)的酯化特性研究[J].酿酒,2009,36(1):52-54.