大曲是以小麦(大麦、豌豆等)为原料,经粉碎加水压成砖块状的曲坯,通过自然网罗环境中的微生物和控制生产工艺条件生产培制而成[1-2]。大曲长期存在于开放性的操作环境中,定向富集了大量的微生物,可产生多种酶系,形成有利于中高温白酒酒质的自然复合体[3],大曲所固有的复合曲香香气及大曲在糟醅发酵体系中微生物的演变与香味成分的代谢给白酒酒体的构成做出了重要贡献,因此自古就有“曲为酒之骨”之称。研究认为,中高温大曲在白酒酿造中的作用主要有三个:一是糖化发酵剂,在大曲中各类酶的协同作用下,原料中的淀粉和蛋白质转化为可发酵型糖和氨基酸等产物;二是生香,各类酶催化分解原料形成的产物进一步在酶的作用下参与白酒中各种风味物质或其前体物质的形成[4];三是作为酒粮的一部分,大曲中的残余淀粉含量高达50%以上,这些淀粉在白酒酿造过程中会被糖化发酵成酒。
大曲在发酵过程中,随着温度的升高和水分的散失,大曲外表面向内1~2 cm处出现的黄褐色圆圈(封火圈),将大曲分为曲皮和曲心两部分[5]。在发酵后期曲皮和曲心的感官特征明显不同:曲心充满白色菌丝,而曲皮的颜色更暗。此外,曲皮和曲心的生化指标也存在差异。有研究发现曲皮中的糖化力和液化力均大于曲心,然而曲心的出酒率和质量更高,曲心的酶具有更强的耐热性。同时,曲皮和曲心的理化特性[6]和微生物群落结构[7]也存在一定差异。丁丽[8]通过解析泸州老窖大曲在发酵阶段曲皮和曲心的微生物群落结构,发现曲皮和曲心微生物群落结构和优势微生物存在差异,并且曲皮中真菌群落较为丰富,曲心中细菌群落较为丰富。此外,有研究通过可培养的手段揭露了大曲表面的微生物,结果表明好氧微生物更多,特别是根酶,曲皮微生物的生物量和多样性也更为丰富[9-10]。目前,对于大曲微生物的研究日渐深入,但对于中高温大曲独特的结构赋予其不同部位的微生物群落多样性及其变化规律的研究还相对较少,因此有必要对其进行深入研究。
本研究通过检测中高温大曲曲皮、曲心的理化指标,利用高通量测序技术解析大曲发酵过程中曲皮、曲心微生物菌群结构的差异性及其变化规律,旨在深入了解中高温大曲的结构特点,并充分发挥其在酿酒中的作用。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
不同发酵期的中高温大曲样品:取自甘肃省某白酒企业制曲车间。
1.1.2 化学试剂
E.Z.N.A. Soil DNA Kit DNA抽提试剂盒:美国Omega Bio-Tek公司;Biowest agArose琼脂糖:西班牙Biowest公司;FastPfu聚合酶:上海TransGen公司;Axygen Biosciences DNA凝胶提取试剂盒:美国Axygen公司;NEXTFLEX
Soil DNA Kit DNA抽提试剂盒:美国Omega Bio-Tek公司;Biowest agArose琼脂糖:西班牙Biowest公司;FastPfu聚合酶:上海TransGen公司;Axygen Biosciences DNA凝胶提取试剂盒:美国Axygen公司;NEXTFLEX RapidDNASeq Kit建库试剂盒:美国Bioo Scientific公司;NovaSeq Reagent Kits测序试剂盒:美国Illumina公司。
RapidDNASeq Kit建库试剂盒:美国Bioo Scientific公司;NovaSeq Reagent Kits测序试剂盒:美国Illumina公司。
1.2 仪器与设备
LR-10M高速冷冻离心机:湖北鹤西仪器装备有限公司;DYY-6C电泳仪:北京市六一仪器厂;DHG-9245电热鼓风干燥箱:上海一恒科学仪器有限公司;TIB8600实时荧光定量聚合酶链式反应(real-time fluorescence quantitative-polymerase chain reaction,RT-FQPCR)仪:泰普生物科学(中国)有限公司;EDC-810型PCR仪:北京东胜创新生物科技有限公司;Illumina MiSeq 2500高通量测序平台:美国Illumina公司;Evolution 300紫外可见分光光度计:美国Thermo公司。
1.3 实验方法
1.3.1 取样方法
分别在中高温大曲发酵第0、3、6、9、12、15、18、24、30天取样。每次取样选择同一曲房不同位置的12块大曲,大曲表面1~2 cm的部分作为曲皮样(Qupi标记为P),曲块中心3 cm半径内作为曲心样(Quxin标记为X),分别粉碎、混匀、装袋。理化指标检测样各500 g于-20 ℃冰箱中保存,微生物检测样各50 g于-80 ℃冰箱中保存。
1.3.2 理化指标的检测
大曲表面1~2 cm处检测曲皮温度,垂直于大曲包包面的中心向内4~5 cm处检测曲心温度。根据中华人民共和国轻工行业标准QB/T 4257—2011中《酿酒大曲通用分析方法》检测中高温大曲曲皮和曲心的水分和酸度,所有指标测定均进行3次重复实验。
1.3.3 脱氧核糖核酸的提取
首先用脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒将粉碎好的大曲样品进行基因组DNA提取,其次使用1%琼脂糖凝胶电泳检测DNA,最后用紫外可见分光光度计在波长260nm处检测基因组DNA的浓度。
1.3.4 聚合酶链式反应
以提取的基因组总DNA为模板,带有Barcode的特异性引物338正向引物(forward primer,F)(5'-ACTCCTACGGGAGGCAGCA-3')和806反向引物(reversed primer,R)(5'-GGACTACHVGGGTWTCTAAT-3')扩增细菌16S核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)基因的V3-V4高变区,以转录间隔区序列(internal transcribed spacer,ITS)1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS 2R(5'-GCTGCGTTCTTCATCGATGC-3')为引物扩增真菌的内部转录间隔区。PCR扩增体系(20 μL):5×FastPfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)2μL,正、反向引物各0.8μL(5 μmol/L),FastPfu聚合酶0.4 μL,牛血清蛋白0.2 μL,模板DNA 10 ng,用重蒸水补足至20 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45s,30个循环;72 ℃再延伸10 min。每个样本3个PCR重复,将3个重复的PCR产物混合。使用2%琼脂糖凝胶电泳检测PCR扩增产物,利用AxyPrep DNA凝胶回收试剂盒对PCR产物进行纯化,使用量子晶体管荧光计定量,并用NEXTFLEXR Rapid DNA-Seq Kit进行Miseq文库构建。
1.3.5 Illumina Miseq高通量测序
交由武汉爱基百客生物科技有限公司,利用Illumina公司的Miseq PE300平台进行高通量测序。具体流程如下:DNA片段的一端与引物碱基互补,另一端随机与附近的另外一个引物互补,固定在芯片上,形成“桥(bridge)”;PCR扩增后产生的DNA簇经DNA扩增子线性化成为单链;加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3'端粘性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
1.3.6 数据处理
利用fastp 20.0软件对原始测序的细菌16S rRNA V3-V4区序列和真菌ITS1区序列进行分别质控,并使用FLASH 1.2.7软件拼接。拼接后的序列经过再次质控和过滤,得到优化序列。使用UPARSE 7.1软件,以97%相似度对序列进行操作分类单元(operational taxonomic units,OTU)聚类,同时剔除嵌合体。运用RDP2.2软件对所有序列进行物种分类注释,其中在Silva128数据库中进行细菌序列对比,在Unite 7.2数据库中进行真菌序列对比,以获得OTU对应的物种分类信息。基于分类学信息,分别对大曲样品的细菌和真菌进行Alpha多样性指数分析,绘制细菌和真菌的稀释性曲线、物种丰富度组成。
2 结果与分析
2.1 中高温大曲发酵过程中曲皮、曲心理化指标的变化
中高温大曲发酵过程中曲皮、曲心理化指标的变化见图1。由图1A可知,在大曲的整个发酵过程中曲心的水分含量始终高于曲皮,曲皮水分的下降速度也相比曲心快。由图1B可知,对于酸度的变化,曲皮和曲心的酸度在发酵前3天迅速上升,可能是由于温湿度适合产酸细菌如醋酸菌、乳酸菌等的生长,所以积累了大量有机酸。在发酵3~9 d,曲心酸度由0.87 mmol/10 g上升至1.03 mmol/10 g,曲皮酸度从第6天开始基本稳定在0.48 mmol/10 g左右,发酵前中期曲心酸度远大于曲皮,可能与有机酸在曲外层更易挥发和合成酯类不断损失[6]有关,发酵第24天后曲皮与曲心酸度趋于一致。由图1C可知,在发酵过程中曲心温度的变化符合中高温大曲“前缓中挺后缓落”的典型特征,且在第7天进入顶温阶段(60 ℃),研究表明发酵温度的首次升高是由于微生物大量繁殖产生的生物热引起的[11-12],在第15天开始进入“后缓落”时期。在整个发酵过程中由于曲皮散热速度较快,其温度均低于曲心。大量研究表明,大曲的块状结构是导致曲皮和曲心在温度、水分等理化因子上出现明显差异的主要原因,这种差异是从第3天开始的。曲皮和曲心的微环境差异是导致其微生物群落结构差异的重要原因[13],如曲心温度更高可能导致嗜热菌相对丰度在曲心中更有优势和更稳定;相反微生物群落代谢也会影响环境因子,尤其是酸度、温度等理化特性[14]。因此曲皮和曲心理化因子的差异可以在一定程度上解释曲皮和曲心微生物群落结构的差异。综上所述,水分、温度和酸度是影响大曲发酵的最主要因素,因此在生产过程中应严格把控大曲的水分、温度和酸度变化。
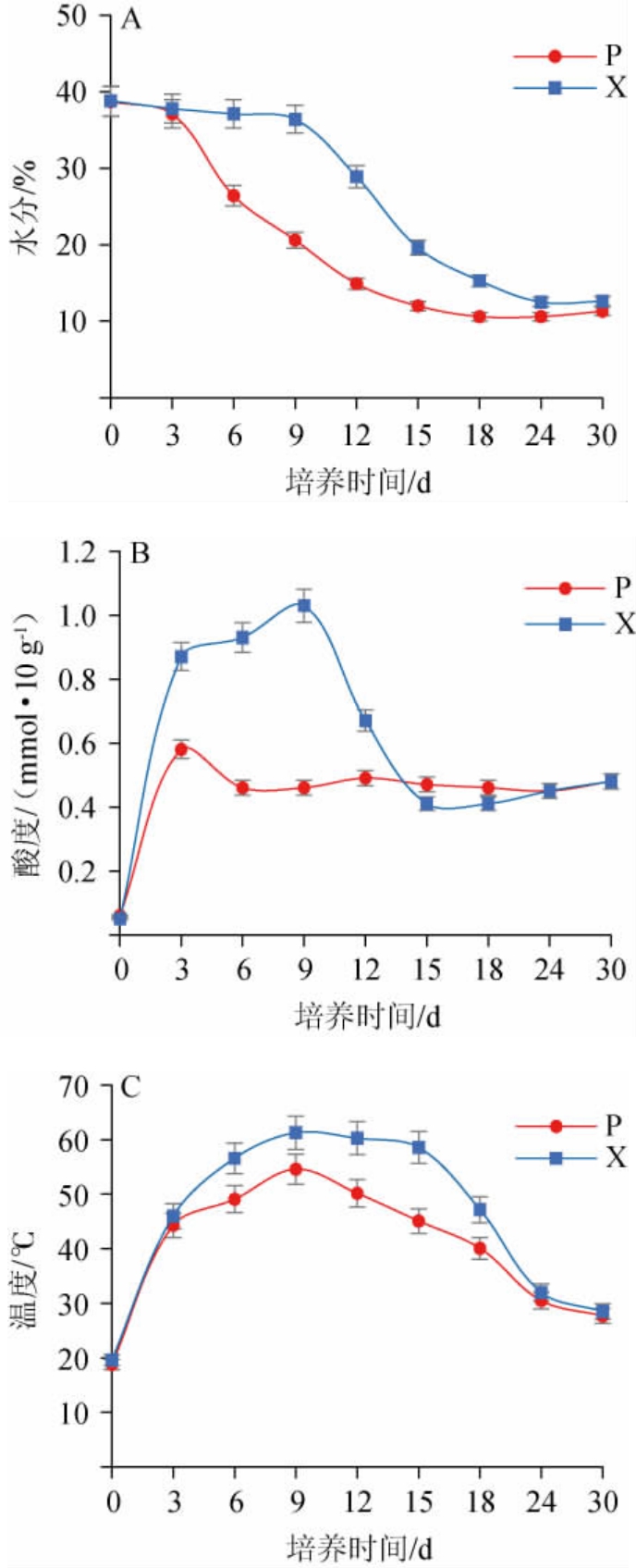
图1 中高温大曲发酵过程中曲皮及曲心理化指标变化
Fig.1 Changes of physicochemical indexes of Qupi and Quxin during medium-high temperature Daqu fermentation process
2.2 稀释曲线
稀疏曲线(rarefaction curves)是指从测序样本序列中随机抽取不同序列数,通过聚类的方式统计出代表的物种个数(OTUs),并通过物种个数与测序数构建曲线,用于表征该样本中微生物种类的多样性和丰富度。通过已知数据库用Uchime方法比对去除Fasta序列的嵌合体,未知数据库则使用自比对(denovo)的方法进行去除,同时去除不符合要求的短序列,最后得到140 740条细菌16S rRNA高质量序列和238 526条真菌16S rRNA高质量序列,其中细菌的测序长度主要分布在400~450 bp,而真菌的测序长度则主要分布在200~300 bp,样品的细菌和真菌稀释曲线见图2。由图2可知,随着样本测序深度的增加,稀释曲线逐渐趋于平缓,说明该样本的测序深度满足要求,测序结果能反映出样本的真实情况,能较好地反映该区域微生物菌群的结构和种类。

图2 中高温大曲曲皮及曲心样品细菌(A、B)及真菌(C、D)的稀释曲线
Fig.2 Rarefaction curves of bacteria (A, B) and fungi (C, D) in Qupi and Quxin of medium-high temperature Daqu
2.3 中高温大曲发酵过程中曲皮、曲心微生物群落Alpha多样性分析
大曲样本中菌群Alpha多样性主要用于研究微生物物种的丰富度和多样性,其中用于表征Alpha多样性的指标主要包括Chao1指数、ACE指数和Shannon指数,各指数越大,表明群落中物种数目越大,物种多样性越高,那么群落中物种的种类越丰富。中高温大曲曲皮、曲心微生物群落的Alpha多样性指数结果见表1。
表1 中高温大曲曲皮及曲心微生物群落的Alpha多样性指数
Table 1 Alpha diversity indexes of microbial community in Qupi and Quxin of medium-high temperature Daqu
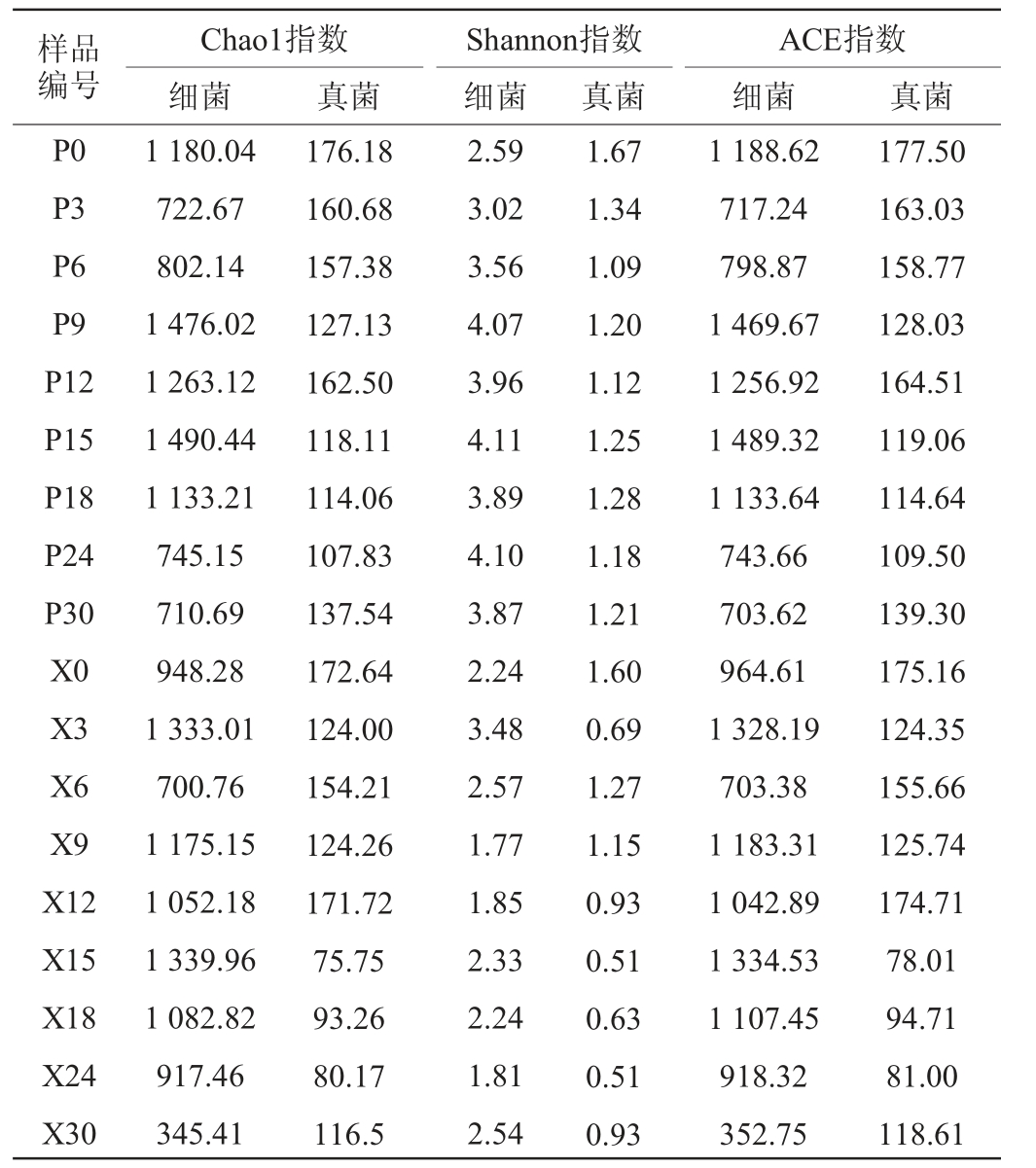
样品编号P0 P3 P6 P9 P12 P15 P18 P24 P30 X0 X3 X6 X9 X12 X15 X18 X24 X30 Chao1指数细菌Shannon指数细菌真菌真菌ACE指数细菌真菌1 180.04 722.67 802.14 1 476.02 1 263.12 1 490.44 1 133.21 745.15 710.69 948.28 1 333.01 700.76 1 175.15 1 052.18 1 339.96 1 082.82 917.46 345.41 176.18 160.68 157.38 127.13 162.50 118.11 114.06 107.83 137.54 172.64 124.00 154.21 124.26 171.72 75.75 93.26 80.17 116.5 2.59 3.02 3.56 4.07 3.96 4.11 3.89 4.10 3.87 2.24 3.48 2.57 1.77 1.85 2.33 2.24 1.81 2.54 1.67 1.34 1.09 1.20 1.12 1.25 1.28 1.18 1.21 1.60 0.69 1.27 1.15 0.93 0.51 0.63 0.51 0.93 1 188.62 717.24 798.87 1 469.67 1 256.92 1 489.32 1 133.64 743.66 703.62 964.61 1 328.19 703.38 1 183.31 1 042.89 1 334.53 1 107.45 918.32 352.75 177.50 163.03 158.77 128.03 164.51 119.06 114.64 109.50 139.30 175.16 124.35 155.66 125.74 174.71 78.01 94.71 81.00 118.61
由表1可知,中高温大曲在发酵过程中细菌和真菌群落的丰富度与多样性随着发酵时间的变化而改变。其中用于估计微生物物种丰富度的Chao1指数和ACE指数在曲皮细菌中从第0天开始整体趋势为先下降后上升再下降;曲心细菌丰富度指数整体从第0天开始先上升后下降,第15天达到最大值后开始缓慢下降至发酵结束。除第3天和第24天外曲皮的细菌丰富度指数均高于曲心。除第12天外曲皮的真菌丰富度指数均高于曲心。
曲皮和曲心真菌Shannon指数从第0天的最大值(曲皮1.67;曲心1.60)开始先下降后上升至发酵结束,除第6天外曲皮的真菌多样性指数均高于曲心。随着大曲发酵进行,首先淘汰了来自原料的曲皮中一些不耐高温细菌,随着曲心温度的升高,曲心中的不耐高温细菌也逐渐被淘汰,之后来自环境中的微生物大量富集在曲皮上,并且曲皮中存在度和多样性逐渐增加到最大值,同时曲心中细菌的丰富度和多样性增加到最大值,随后又开始缓慢降低。真菌主要存在于原料中,且大部分为不耐热菌。随着大曲发酵过程中温度的升高,曲皮和曲心真菌丰富度和多样性逐渐下降,其中在第6、9、12、18、30天均略有不同程度的回升,这可能与培菌过程中翻曲或排潮有关。总之中高温大曲发酵过程中,曲皮、曲心微生物群落丰富度和多样性具有不同的变化趋势,且曲皮总是具有更高的微生物丰富度和多样性。
2.4 中高温大曲曲皮、曲心不同发酵阶段微生物群落的结构分析
2.4.1 基于门水平的微生物群落结构分析
在大曲发酵过程中,曲皮和曲心细菌群落中相对丰度超过1%的微生物共检测出31个菌门(包括1个其他门),其中相对丰度排名前10的细菌见图3。由图3可知,整个发酵过程厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)和变形菌门(Proteobacteria)为曲皮和曲心相对丰度最高的细菌门。其中厚壁菌门占绝对优势,在曲皮发酵过程中相对丰度变化范围为59.5%~95.2%;在曲心发酵过程中相对丰度变化范围为59.1%~91.4%。厚壁菌门在3~6 d曲皮中的平均相对丰度高达94.2%,6~12 d在曲心中的平均相对丰度为88.9%。这与莫祯妮等[15-17]的研究结果一致,表明厚壁菌门是酒曲发酵过程中的主要菌门。经过高温筛选后曲皮和曲心的放线菌门相对丰度均上升,且曲心部位“后缓落”时期(18~30 d)平均相对丰度为27.3%,较前期上升较为明显。

图3 中高温大曲发酵过程中曲皮(A)及曲心(B)细菌群落在门水平的相对丰度
Fig.3 Relative abundance of bacterial community in the Qupi (A)and Quxin (B) during medium-high temperature Daqu fermentation at the phylum level
中高温大曲在发酵过程中曲皮和曲心的优势真菌门见图4。由图4可知,曲皮和曲心真菌群落中相对丰度超过1%的微生物共检测出4个菌门(包括1个未培养的真菌)。包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota),整个发酵过程中子囊菌门在大曲曲皮和曲心占绝对优势,相对丰度为98.8%左右,在曲心发酵过程中相对丰度高达99.5%左右。上述结果对曲皮优势菌门的研究与TANG J等[18]的研究结果相似,不同的是他们研究发现整个曲心微生物群落中最大的两个门是子囊菌门(23.0%)和变形菌门(22.6%)。邓长阳等[19]研究发现中高温大曲中子囊菌门(73.7%)、毛霉菌门(21.4%)和担子菌门(2.9%)为主要优势菌门,与本研究不同的是其曲皮中子囊菌门和毛霉菌门的平均相对含量分别为54.0%和39.0%。

图4 中高温大曲发酵过程中曲皮(A)及曲心(B)真菌群落在门水平的相对丰度
Fig.4 Relative abundance of fungal community in the Qupi (A)and Quxin (B) during medium-high temperature Daqu fermentation at the phylum level
2.4.2 基于属水平的微生物群落结构分析
中高温大曲发酵过程中曲皮和曲心中共检测出481个细菌属,其中曲皮481个属,曲心471个属。中高温大曲在发酵过程中曲皮和曲心微生物相对丰度排名前10的细菌属组成见图5。由图5可知,整个发酵过程中曲皮和曲心主要优势细菌属有高温放线菌属(Thermoactinomyces)、乳杆菌属(Lactobacillus)、糖多孢菌属(Saccharopolyspora)、明串珠菌属(Leuconostoc)、芽孢杆菌属(Bacillus)。发酵过程中相对丰度变化范围分别为高温放线菌属(曲皮10.6%~61.3%;曲心2.0%~81.7%)、乳杆菌属(曲皮8.1%~24.2%;曲心0.1%~65.8%)、糖多孢菌属(曲皮0.7%~16.3%;曲心1.0%~22.1%)、明串珠菌属(曲皮5.1%~26.6%;曲心0.2%~16.7%)、芽孢杆菌属(曲皮4.1%~11.1%;曲心0~4.0%)。高温放线菌属在曲皮发酵过程中相对丰度先上升至第3天达最大值61.3%,随后下降至18.3%出房;曲心发酵过程先下降后上升至第9天达最大值81.7%,随后继续下降至45.8%出房。可能是曲皮温度先升高,所以高温放线菌属优先富集于曲皮,后逐渐向曲心生长。乳杆菌属在曲皮发酵过程中相对丰度先下降后上升至第24天达最大值24.2%,随后继续下降至18.3%出房;曲心发酵过程先上升至第6天达最大值65.8%,随后下降至0.1%出房。有研究表明,乳杆菌属在大曲中起到产酸产酯的作用[20-22]。糖多孢菌属在曲皮和曲心发酵过程中整体呈上升趋势,出房时相对丰度达最大值(曲皮16.3%;曲心22.1%)。一些从大曲中分离的芽孢杆菌菌株已被应用于中国白酒酿造中的生物强化,实现了液体培养中的酸性改善[23]。与上述结论不同的是,胡晓龙等[24]研究河南某知名酒厂大曲中肠杆菌属(Enterobacter)、乳杆菌属(Lactobacillus)和乳球菌属(Lactococcus)为大曲样品中的优势菌属,其中肠杆菌属含量分别占曲皮和曲心细菌含量的90%和97.8%,且肠杆菌属含量明显高于其他优势菌属,出现这种现象的原因可能是地理位置的差异。

图5 中高温大曲发酵过程中曲皮(A)及曲心(B)细菌群落在属水平的相对丰度
Fig.5 Relative abundance of bacterial community in the Qupi (A)and Quxin (B) during medium-high temperature Daqu fermentation at the genus level
中高温大曲发酵过程中共检测出96个真菌属,其中曲皮73个属,曲心87个属,中高温大曲在发酵过程中曲皮、曲心中相对丰度前10的优势真菌属组成见图6。由图6可知,整个发酵过程中曲皮和曲心主要优势真菌属有复膜孢酵母属(Saccharomycopsis)、嗜热真菌属(Thermomyces)、链格孢属(Alternaria),发酵过程相对丰度变化范围分别为复膜孢酵母属(曲皮15.3%~75.1%;曲心5.3%~88.4%)、嗜热真菌属(曲皮8.1%~33.5%;曲心3.1%~89.3%)、链格孢属(曲皮0~57.1%;曲心0~66.0%)。曲皮发酵过程中,链格孢属在曲坯中相对丰度较高(曲皮57.1%;曲心55.9%),发酵开始后基本消失,说明其大部分来自原料,由于制曲环境和发酵条件的压力被淘汰;复膜孢酵母属在整个发酵期占主导地位,第6天相对丰度达最大值75.1%,随后略有下降。研究表明酵母菌有糖化、加快酯化、提供生香前驱物质和风味成分、增加投料、确定香型五种功能[25],因此酵母菌是大曲发酵过程中的重要功能菌。嗜热真菌属相对丰度先上升至第3天达最大值33.5%,随后下降至23.0%出房。曲心发酵过程中,复膜孢酵母属的相对丰度先上升至第3天达最大值88.0%,随后缓慢下降至10.6%出房。嗜热真菌属的相对丰度先上升至第15天达到最大值89.2%,随后下降至77.8%出房,且复膜孢酵母属和嗜热真菌属的相对丰度整体呈此消彼长的趋势。侯强川等[26]研究山东梁山某制曲厂中高温大曲中优势真菌属为嗜热子囊菌属(Thermoascus)、复膜孢酵母属(Saccharomycopsis)、假丝酵母属(Candida)和根霉属(Rhizopus);崔梦君等[27]研究湖北宜昌某酒厂中高温大曲中优势真菌属为曲霉属、嗜热子囊菌属、根毛霉属(Rhizomucor)、根霉属(Rhizopus)和横梗霉属(Lichtheimia)。上述结果说明,不同地域环境所生产的中高温大曲中的优势菌属有所不同。
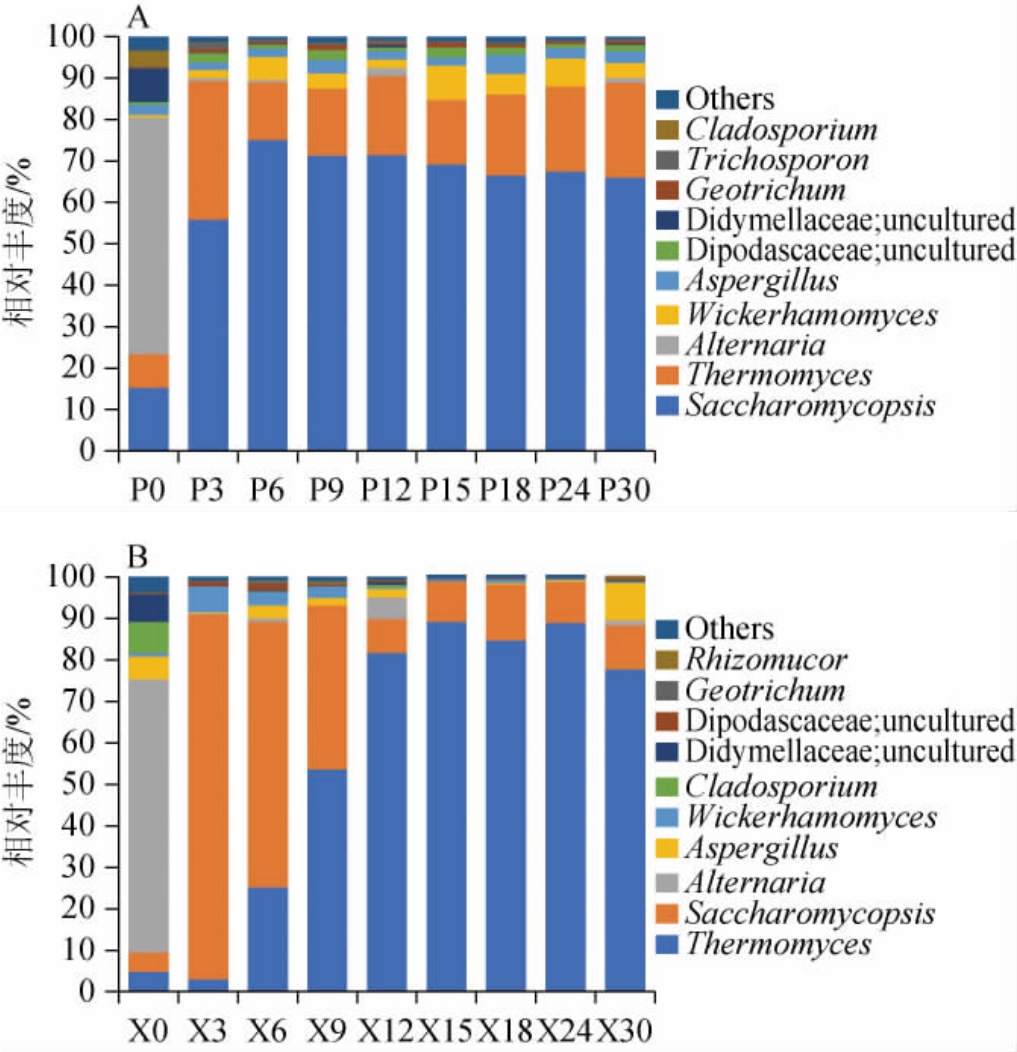
图6 中高温大曲在发酵过程中曲皮(A)及曲心(B)真菌群落在属水平的相对丰度
Fig.6 Relative abundance of fungal community in the Qupi (A)and Quxin (B) during medium-high temperature Daqu fermentation at the genus level
3 结论
本研究通过解析中高温大曲发酵过程中曲皮和曲心的微生物群落差异和规律,发现大曲发酵过程中,曲皮微生物丰富度和多样性总是高于曲心,且曲皮和曲心微生物群落相对丰度存在一定差异。其中厚壁菌门(Firmicutes)为整个发酵过程曲皮和曲心中的优势菌,该菌在曲皮和曲心中的整体变化变化趋势为先上升后下降,厚壁菌门在曲皮的变化先于曲心,并且在曲皮中的变化速率相比于曲心快。子囊菌门(Ascomycota)为曲皮和曲心发酵过程中的绝对优势菌,并且发酵过程中略有上升趋势。高温放线菌属(Thermoactinomyces)和乳杆菌属(Lactobacillus)为整个发酵过程曲皮和曲心中的主要优势菌,其中高温放线菌属的相对丰度在曲皮发酵过程中呈先上升后下降的趋势,在曲心中则相反;乳杆菌属的相对丰度在曲皮发酵过程中呈先下降后上升的趋势,在曲皮中呈相反趋势。复膜孢酵母属(Saccharomycopsis)和嗜热真菌属(Thermomyces)为整个发酵过程曲皮和曲心中的主要优势真菌属,复膜孢酵母属在曲皮和曲心发酵过程中呈先迅速上升后略下降的趋势,并且在曲皮中的变化速度快与曲心;嗜热真菌属在曲皮和曲心发酵过程中均迅速上升、后缓慢下降并略有浮动。本研究深入解析西北地区中高温大曲发酵过程中曲皮、曲心微生物菌群结构的差异性及其变化规律,为提升西北地区中高温大曲的质量提供帮助,后期可对中高温大曲不同结构对浓香型白酒发酵的作用进行深入探究。
[1]刘雄.中、高温大曲固态发酵过程微生物菌群结构变化的研究[D].广州:华南理工大学,2017.
[2]JIN Y,LI D,AI M,et al.Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[3]汪凌旭,易卓林,赵海,等.中高温大曲菌系、酶系的研究进展[J].四川轻化工大学学报,2021,34(5):17-25.
[4]范伟业.宏蛋白质组学解析浓香型大曲酶系组成[D].无锡:江南大学,2021.
[5]张倩.中高温大曲发酵过程中曲皮和曲心微生物群落结构和功能差异及形成机制[D].自贡:四川轻化工大学,2021.
[6]杨勇,李燕荣,姜雷,等.中高温大曲曲块部位间生化指标的差异及变化规律[J].食品与发酵工业,2019,45(19):73-78.
[7]李家民,王海英,张文学,等.用DGGE方法初步解析浓香型大曲微生物群落结构[J].酿酒科技,2012(11):32-35.
[8]丁丽.泸型大曲曲皮和曲心质量差异分析[D].雅安:四川农业大学,2020.
[9]姚万春,唐玉明,任道群,等.泸州老窖国窖曲曲坯层次间微生物差异研究[J].酿酒,2005,32(5):35-37.
[10]WANG C L, SHI D J, GONG G L.Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot,2008,24:2183-2190.
[11]LI P,LIN W F,LIU X,et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Front Microbiol,2016,7:1237.
[12]XIAO C,LU Z M,ZHANG X J,et al.Bio-heat is a key environmental driver shaping the microbial community of medium-high temperature Daqu[J].Appl Environ Microbiol,2017,83(23):e01550-17.
[13]明红梅,陈晓旭,刘清斌,等.泸型大曲曲表与曲心理化生化特性的对比研究[J].湖北农业科学,2015(54):1445-1447,1451.
[14]CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Front Microbiol,2021,11:592421.
[15]莫祯妮,邱树毅,曾祥勇,等.基于Illumina Hiseq高通量测序分析酱香型白酒大曲曲皮和曲心的细菌群落差异[J].中国酿造,2022,41(2):48-52.
[16]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[17]姚粟.芝麻香型白酒高温大曲细菌群落多样性研究[D].北京:北京林业大学,2013.
[18]TANG J,RAO J Q,ZOU Y F,et al.The community assembly patterns determined differences between the surface and the core microbial communities of Nongxiangxing Daqu[J].LWT-Food Sci Technol,2023,183:114936.
[19]邓长阳,黎婷玉,刘文汇,等.襄阳地区中高温大曲曲皮和曲心真菌多样性解析[J].中国酿造,2021,40(6):65-69.
[20]向慧平,林宜锦,关统伟,等.四川浓香型大曲生产中酵母菌、芽孢杆菌与工艺指标的关联性分析[J].食品科学,2020,41(2):196-201.
[21]LI H,LIAN B,DING Y H,et al.Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J].Ann Microbiol,2014,64:1659-1669.
[22]陈家晖.内源性芽孢杆菌的生物强化对大曲的理化特性和微生物群落的影响[D].武汉:武汉轻工大学,2022.
[23]YAN Z,ZHENG X W,CHEN J Y,et al.Effect of different Bacillus strains on the profile of organic acids in a liquid culture of Daqu[J].J I Brewing,2013,119(1-2):78-83.
[24]胡晓龙,王康丽,牛广杰,等.基于高通量测序技术的中温大曲中微生物群落多样性解析[J].轻工学报,2019,34(4):21-29.
[25]张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[26]侯强川,王文航,徐媛媛,等.徐坊中高温大曲发酵过程中理化品质、风味及真菌群落结构变化规律研究[J].食品工业科技,2024,45(19):133-141.
[27]崔梦君,王玉荣,侯强川,等.基于三代测序技术高温和中高温大曲真菌多样性解析及酵母菌的分离鉴定[J/OL].食品工业科技,1-16[2024-11-15].https://doi.org/10.13386/j.issn1002-0306.2024030064.