2,3-丁二醇(2,3-butanediol,2,3-BD)是一种广泛应用于食品、化工、燃料等多个领域的关键化合物[1-3]。因其具有较高的燃烧值和辛烧值,使其成为一种可与燃料乙醇比肩的新型生物能源[4-5]。同时,也可作为保湿剂应用于护肤品中,或作为食品添加剂和风味剂等[6-7]。微生物合成法和化学合成法是2,3-BD的两种合成方式,近年来,以生物质为原料、微生物为宿主细胞合成2,3-BD因其绿色环保和可持续的特点越来越受到科研工作者的重视[8-10]。
自然界中有很多细菌均能合成2,3-BD,主要包括克雷伯氏菌属(Klebsiella)、类芽孢杆菌属(Paenibacillus)、肠杆菌属(Enterobacter)、沙雷氏菌属(Serratia)、芽孢杆菌属(Bacillus)以及气单胞菌属(Aeromonas)等[11-15]。但目前普遍认为克雷伯氏菌属和芽孢杆菌属是最具工业价值的两类细菌。芽孢杆菌属的优势主要在于具有产淀粉酶和木聚糖酶的能力,因此能够直接使用淀粉类物质来进行发酵生产,但芽孢杆菌属也存在副产物多而导致2,3-BD转化率较低的问题[16]。相比之下,虽然克雷伯氏菌株直接利用淀粉类原料的能力不足,但其可利用的碳源底物宽范,不仅能利用木糖、阿拉伯糖等五碳糖,同时2,3-BD的产量也较高,因此克雷伯氏菌在木质纤维素类物质生物转化方面具有极强的应用潜力和广阔的应用前景[17-18]。
木质纤维素经过酸碱或酶进行水解等处理后会断裂水解产生大量的葡萄糖、D-木糖、甘露糖、L-阿拉伯糖和半乳糖等。木质纤维素经过水解后形成的母液中,木糖的含量仅次于葡萄糖,约占35%[19],故难以有效转化利用木糖极大的限制了木质纤维素的利用效率。目前,主要还是选择以葡萄糖为碳源利用微生物来发酵生产2,3-BD[20];而选择以木糖为底物的研究近年来鲜有报道[21],已报道的研究成果也主要集中在如何提高利用葡萄糖、木糖的混合糖产2,3-BD的发酵强度[22-23]。为此,进一步挖掘能利用木糖发酵生产2,3-BD的功能微生物对木质纤维素的生物能源转化具有非凡的意义。
本研究以木糖为唯一碳源,通过富集培养、初筛和复筛、纯化,从蜗牛样品中筛选产2,3-丁二醇菌株,通过形态学观察和分子生物学技术对其进行鉴定。采用气相色谱(gas chromatography,GC)法、气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法分析筛选菌株利用木糖发酵产物成分,利用木糖、葡萄糖与木糖混合糖发酵筛选高产2,3-丁二醇菌株,并对其发酵条件进行优化。旨在为充分利用木糖或木质纤维素发酵生产2,3-BD奠定理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜蜗牛样品:采集于广西大学碧云湖及周围草地湿地。
1.1.2 试剂
D-木糖、葡萄糖、硫酸铵、磷酸二氢钾、七水硫酸镁、尿素、氯化铵(均为分析纯)、2,3-丁二醇、乙酸乙酯、异丁醇(均为色谱纯):上海麦克林生化科技股份有限公司;玉米粉、蛋白胨、酵母粉、牛肉浸粉、琼脂(均为生化试剂):上海生工生物工程股份有限公司。
1.1.3 培养基
富集培养基:称取20 g/L木糖,5 g/L硫酸铵,1 g/L磷酸二氢钾,0.5 g/L七水硫酸镁,加去离子水1 000 mL,pH自然。115 ℃灭菌20 min。
筛选固体培养基:富集培养基基础上再加20 g/L琼脂即为筛选固体培养基。115 ℃灭菌20 min。
木糖发酵培养基:20 g/L木糖,3 g/L酵母膏,5 g/L蛋白胨,1 g/L磷酸二氢钾,0.5 g/L七水硫酸镁,加去离子水1 000 mL,pH自然。115 ℃灭菌20 min。
木糖固体培养基:木糖发酵培养基基础上再加20 g/L琼脂即为筛选固体培养基。115 ℃灭菌20 min。
混合糖发酵培养基:40 g/L葡萄糖,20 g/L木糖,3 g/L酵母膏,5 g/L蛋白胨,1 g/L磷酸二氢钾,0.5 g/L七水硫酸镁,加去离子水1 000 mL,pH自然。115 ℃灭菌20 min。培养基中的糖类和其余物质分开灭菌后,在无菌条件下混合均匀使用。
1.2 仪器与设备
PHS-3E雷磁pH计、TW-12恒温水浴锅:上海仪电科学仪器股份有限公司;UVmini-1240紫外-可见分光光度计:岛津仪器(苏州)有限公司;SHP-250生化培养箱:优博莱技术(北京)有限公司;PL-303电子分析天平:上海精宏实验设备有限公司;E2695高效液相色谱(high performance liquid chromatography,HPLC)仪:沃特世科技(上海)有限公司;GC-2014气相色谱仪:岛津企业管理(中国)有限公司;7890B-7000D气相色谱-质谱联用仪:安捷伦科技(中国)有限公司;THY-211D可调式恒温摇床:上海知楚仪器有限公司;YX-280B高压蒸汽灭菌锅:广州康迈医疗器械有限公司。
1.3 方法
1.3.1 菌株筛选
富集培养:取20只新鲜的蜗牛样品,每一只蜗牛分别用研钵磨碎,将研碎的粉末混匀后称取3 g加入装有30 mL富集培养基的试管中,置于含有20%氢气(H2)和80%氮气(N2)混合气体的厌氧罐中,37 ℃恒温静置培养36 h。随后吸取培养好的下层菌液接种到新配制富集培养基的试管中再次富集培养3~4次。
初筛:将最后一次的富集培养液进行适当的稀释后,吸取100 μL稀释菌液用涂布棒涂布于筛选固体培养基上,37 ℃恒温厌氧培养48 h。挑取在筛选固体培养基上生长较快的单菌落,在纯化固体培养基上划线,37 ℃恒温厌氧培养48 h。
复筛:挑取适量纯化后菌株的单菌落至装液量为100mL/250 mL木糖发酵培养基中,放至厌氧罐充入氮气(N2),37 ℃恒温厌氧培养48 h,重复培养3次。
1.3.2 筛选菌株的形态学观察和分子生物学技术鉴定
形态学观察:将复筛菌株菌落经过适当稀释后涂布于纯化固体培养基,放至厌氧罐中37 ℃培养48 h,观察菌落的颜色、形状、透明度、大小、表面隆起等,用显微镜观察菌株微观形态。
分子生物学鉴定:使用细菌通用鉴定引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACCTTGTTACGACTT-3')扩展各菌株的16S rRNA基因序列。聚合酶链式反应(polymerase chain reaction,PCR)扩增体系(50 μL)为:25 μL高保真酶,Taq Plus DNA聚合酶1 μL,27F和2.5 μL 1492R各2.5 μL,双蒸水(ddH2O)19 μL。PCR的程序为:94 ℃预变性5 min后,进入循环:94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸1 min,共35个循环;最后在72 ℃再进行10 min复延伸。将PCR扩增产物采用1%琼脂糖凝胶电泳检测合格后,送往生工生物工程(上海)有限公司进行基因测序,并将基因序列结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对。选取同源性较高的模式菌株的16S rRNA基因序列,采用MEGA11.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.3 筛选菌株利用木糖发酵产物成分分析
筛选菌株利用木糖发酵产物的制备:将发酵培养48 h的菌液在12 000 r/min条件下离心5 min,取上清并使用0.45 μm的滤膜过滤即得发酵产物。
定性:将筛选菌株发酵产物用气相色谱进行分离,与2,3-BD标准品比对相同实验条件下的保留时间进行初步定性。气相色谱检测条件为:SE-30毛细管柱(30 m×0.32 mm×0.23 μm);氢火焰离子检测器(flame ionization ditector,FID);载气为氮气(N2);干燥空气流速300 mL/min;氢气(He)流速30 mL/min;进样量1 μL;分流模式为不分流;检测器温度250 ℃;汽化室温度250 ℃。
筛选菌株发酵产物用旋转蒸发仪在70 ℃水浴下蒸干水分再经乙酸乙酯萃取后使用气相色谱-质谱联用仪(GC-MS)进行检测。GC条件:VF-WAXms色谱柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃;载气为高纯氦气(He);载气流速1.0 mL/min;进样方式不分流;进样量1 μL。MS条件:电子电离(electronic ionization,EI)源,电离能量70 eV;离子源温度230 ℃;传输线温度230 ℃;扫描方式为选择离子监测(selected ion monitoring,SIM)模式,通过离子质谱图进一步准确进行定性。
定量:采用内标法对2,3-BD进行定量分析,内标异丁醇质量浓度为1.000 0 g/L。
1.3.4 利用木糖、混合糖发酵筛选高产2,3-BD菌株
筛选菌株种子液的制备:挑取菌株的单菌落至装液量为50 mL/250 mL木糖发酵培养基中,37 ℃、220 r/min培养过夜后的菌液即为种子液。
将筛选菌株种子液以接种量6%(V/V)接种于装液量为100 mL/250 mL木糖发酵培养基中(木糖含量设置为50 g/L,培养基其他成分不变),分别在有氧(220 r/min)、微氧(静置)、厌氧(置于厌氧罐)三个条件下,37 ℃培养48 h后取发酵液,离心过滤后采用气相色谱仪测定2,3-BD含量,筛选高产2,3-BD菌株。
将筛选菌株种子液以接种量6%(V/V)接种于100 mL/250 mL混糖发酵培养基,37 ℃、220 r/min摇床培养27 h,每隔3 h取发酵液,用高效液相色谱测定葡萄糖、木糖的残糖量。高效液相色谱色谱条件:Hypersil NH2色谱柱(250 mm×4.6 mm,5 μm);示差折光检测器;流动相为体积分数80%乙腈;流速1 mL/min;柱温40 ℃;进样量20 μL。培养48 h待糖完全消耗完后,取发酵液用气相色谱测定2,3-BD的含量,筛选高产2,3-BD菌株。
1.3.5 筛选菌株摇瓶发酵条件优化
在木糖发酵培养基的基础上,对其培养基中pH值、氮源种类和初始木糖含量进行单因素优化,分别考察发酵温度(30 ℃、33 ℃、35 ℃、37 ℃、40 ℃)、初始pH值(4.5、5.0、5.5、6.0、6.5)、添加量均为5 g/L氮源种类(蛋白胨、牛肉浸粉、尿素、玉米粉、氯化铵、硫酸铵)和初始木糖含量(20 g/L、50 g/L、80 g/L、110 g/L、140 g/L)对2,3-丁二醇产量的影响,探求筛选菌株利用木糖发酵产2,3-BD的最优条件。将筛选菌株种子液按6%(V/V)接种于装液量为100 mL/250 mL优化条件下木糖发酵培养基中,于37 ℃、220 r/min条件下振荡培养48 h,取样用气相色谱检测各条件下摇床发酵液中2,3-BD的含量。木糖消耗率=(初始木糖含量-木糖残留量)/初始木糖含量×100%;2,3-丁二醇转化率=2,3-丁二醇产量/(初始木糖含量-木糖残留量)。
1.3.6 数据处理
使用GraphPad Prism 8.0软件制图,使用SPSS 22.0软件对数据进行统计分析。
2 结果与分析
2.1 筛选菌株的形态学观察与鉴定
从广西南宁采集的水蜗牛样品中通过富集培养、初筛、复筛,分离得到5株产2,3-丁二醇菌株,分别命名为SN1、SN2、SN3、SN4和SN5。其中代表菌株SN5的菌落细胞形态结果见图1。由图1a可知,菌株SN5在木糖固体培养基上的菌落形态为不透明、乳白色菌落;菌落边缘整齐,表面光滑、湿润,低凸起。由图1b可知,菌株SN5为杆状菌。
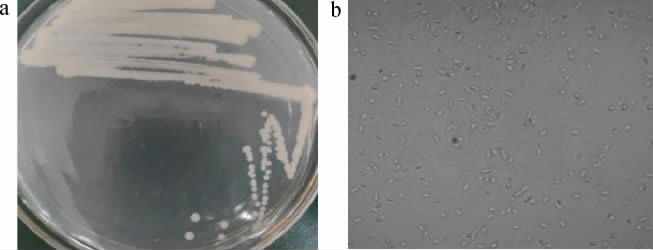
图1 菌株SN5的菌落(a)和细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain SN5
2.2 筛选菌株的分子生物学鉴定
对分离筛选5株菌均针对16S rDNA 进行PCR扩增,凝胶电泳验证PCR产物约在1 500 bp左右,将PCR扩增产物送往生工生物工程(上海)有限公司测序,并将得到的基因序列在NCBI数据库中进行BLAST比对,结果表明,与变栖克雷伯菌(Klebsiella variicola)的同源性高达99%以上。随后通过MEGA11.0软件构建筛选菌株的16S rDNA系统发育树,结果见图2。菌株SN1、SN2、SN3、SN4和SN5与变栖克雷伯菌(Klebsiella variicola)亲缘关系最近。因此,菌株N1、SN2、SN3、SN4和SN5均被鉴定为变栖克雷伯菌(Klebsiella variicola)。

图2 基于16S rDNA基因序列筛选菌株系统发育树
Fig.2 Phylogenetic tree of screened strains based on 16S rDNA gene sequences
2.3 筛选菌株利用木糖发酵产物分析
将5株筛选菌株按照1.3.4所述方法接种于木糖发酵培养基中培养,随后对发酵液进行气相色谱、气质联用检测,结果见图3。由图3a可知,发酵液中产量最大的物质与2,3-BD标准品的出峰时间一致,保留时间均在6.5 min左右,初步判断筛选出的菌株均能利用木糖为碳源发酵产2,3-BD。为进一步确定发酵产物的准确性,随后使用乙酸乙酯萃取发酵液,将萃取液用GC-MS进行鉴定,发酵产物质谱如图3b所示,根据特征离子(45.1 m/z、57.0 m/z、75.0 m/z)与2,3-BD可以确定所筛选菌株能利用木糖发酵产生2,3-BD。
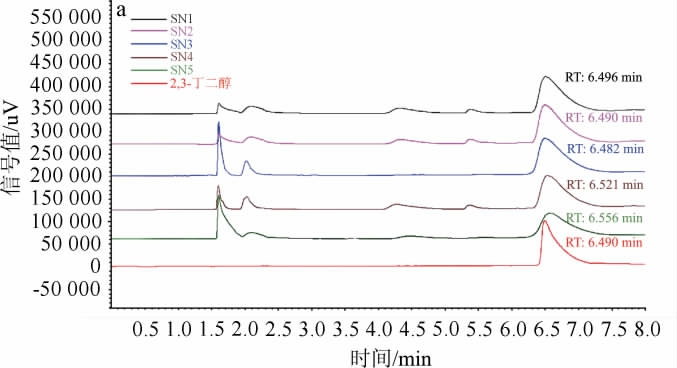
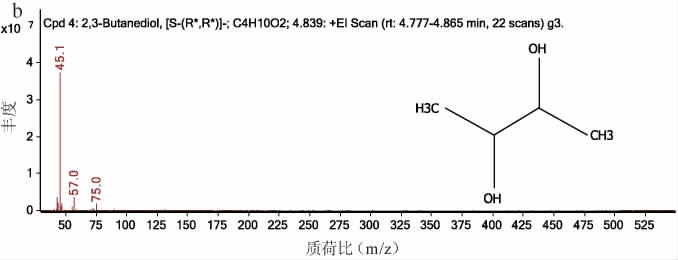
图3 筛选菌株发酵产物成分定性结果
Fig.3 Qualitative results of fermentation product component of screened strains
a:气相色谱图;b:质谱图。
2.4 利用木糖发酵产2,3-丁二醇菌株的筛选
为探究筛选菌株在不同氧气含量下利用木糖发酵产2,3-BD的情况,将5株菌接种木糖发酵培养基中,分别置于有氧、微氧和厌氧条件下培养48 h,取发酵液使用气相色谱进行2,3-BD定量检测后测定结果见图4。由图4可知,所有菌株在有氧条件下产2,3-BD的能力都高于微氧和厌氧的状态,而菌株SN5在三种不同含氧量的情况下所产的2,3-BD含量均高于另外4株菌株,其中在有氧时菌株SN5发酵生产2,3-丁二醇的产量最高,为(14.26±0.18)g/L。因此,在有氧条件下,菌株SN5利用木糖发酵产2,3-BD效果最佳。
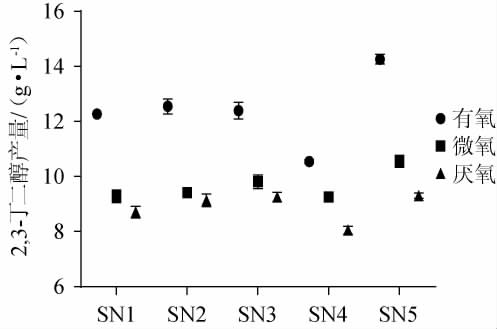
图4 筛选菌株在有氧、微氧和厌氧条件下利用木糖发酵产2,3-丁二醇
Fig.4 Production of 2,3-butanediol by xylose fermentation of screened strains under aerobic, microaerobic and anaerobic conditions
2.5 利用混合糖发酵产2,3-丁二醇菌株的筛选
将葡萄糖与木糖按照2∶1的比例混合模拟纤维素水解液中的糖类占比情况,将筛选的5株菌株接入混合糖发酵培养基中进行摇瓶培养,检测期间葡萄糖和木糖的消耗情况并在发酵48 h后检测各菌株产2,3-BD的情况,结果见图5。由图5a、图5b可知,菌株SN1~SN5都是先利用葡萄糖再利用木糖,在12 h时葡萄糖均基本消耗殆尽,随后从12~15 h间开始消耗木糖,且木糖的消耗速率明显较葡萄糖的消耗速率慢,而菌株SN5对于木糖的消耗能力稍强于其余4株。有氧条件下各菌株48 h利用混合糖发酵产2,3-BD的产量由图5c可知,菌株SN1~SN5发酵产2,3-BD分别为(16.92±0.32)g/L、(18.07±0.83)g/L、(18.97±0.54)g/L、(19.96±1.16)g/L和(21.83±0.66)g/L,其中菌株SN5的2,3-BD产量最高。因此,菌株SN5利用葡萄糖与木糖混合发酵产2,3-BD效果最佳。
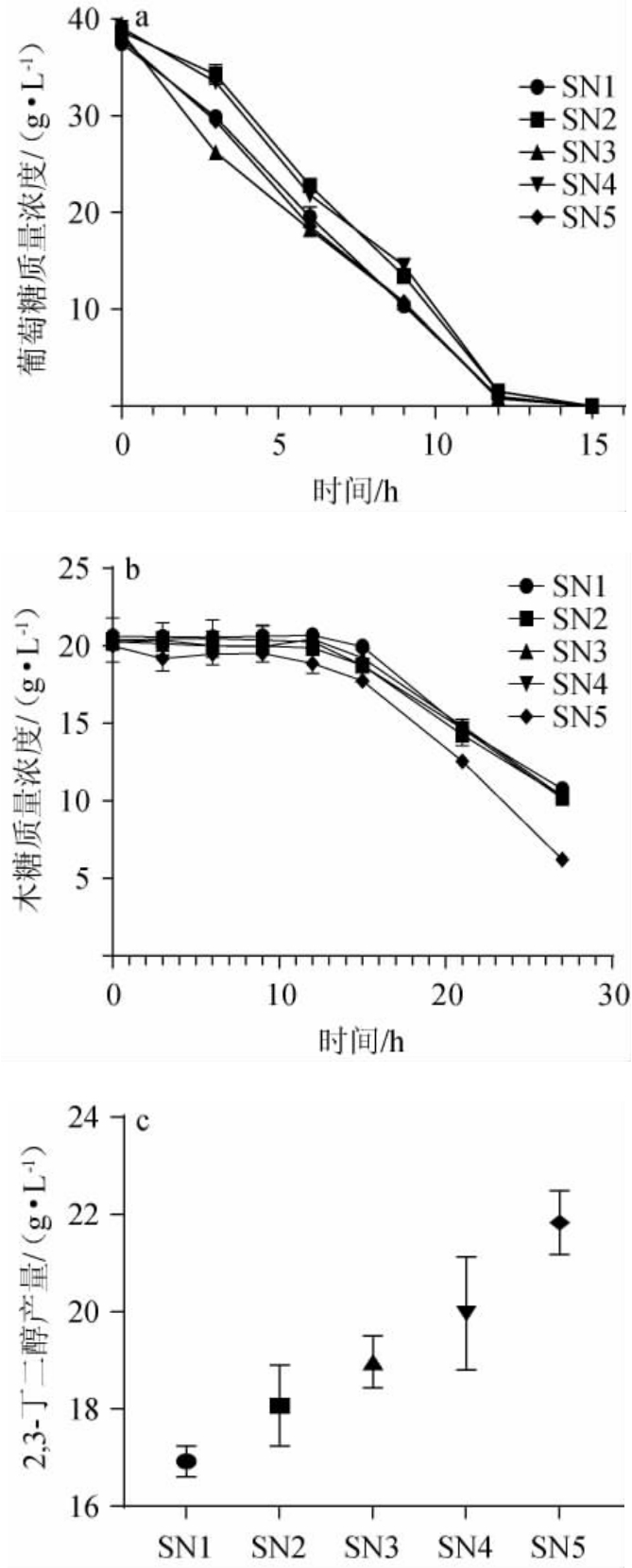
图5 筛选菌株利用葡萄糖与木糖混合(2∶1)发酵产2,3-丁二醇
Fig.5 Production of 2,3-butanediol by glucose-xylose mixed (2∶1)fermentation of screened strains
a:葡萄糖消耗情况;b:木糖消耗情况;c:2,3-丁二醇的生成量。
微生物对不同碳源利用具有偏好性,而在微生物中普遍存在先利用葡萄糖,待葡萄糖耗尽后才转向其他碳源的碳分解代谢抑制(carbon catabolite repression,CCR)[24]。毛亮阳等[25]前期构建出一株肺炎克雷伯氏工程菌(K.pneumoniae)HD79用于2,3-BD的生产,但在利用葡萄糖-木糖的混糖发酵时也受碳分解代谢抑制,通过敲除ptsG基因缓解了CCR效应。虽然敲除ptsG后也使2,3-BD的产量降低,未来可通过合适的基因工程手段改造本研究的SN5菌株,缓解CCR效应并进一步提高其在混糖发酵中的产量和木糖利用效率。
2.6 菌株SN5利用木糖产2,3-丁二醇发酵条件优化
对菌株SN5利用木糖产2,3-BD发酵条件进行优化,结果见图6。

图6 不同发酵温度(a)、初始pH(b)、氮源种类(c)及初始木糖含量(d)对菌株SN5发酵产2,3-丁二醇的影响
Fig.6 Effects of different fermentation temperature (a), initial pH (b),nitrogen source types (c) and initial xylose contents (d) on 2,3-butanediol production by strain SN5
由图6a可知,当发酵温度为30~37 ℃时,2,3-BD产量随发酵温度升高而增加;当发酵温度为37 ℃时,2,3-BD产量最高,为(14.03±0.03)g/L;当发酵温度>37 ℃之后,2,3-BD产量有所下降。因此,菌株SN5利用木糖发酵产2,3-BD的最适发酵温度为37 ℃。由图6b可知,当初始pH值为4.5~6.0时,2,3-BD产量随初始pH值升高而增加;当初始pH值为6.0时,2,3-BD产量最高,为(15.68±0.12)g/L;当初始pH值>6.0之后,2,3-BD产量有所下降。因此,菌株SN5利用木糖发酵产2,3-BD的最适初始pH值为6.0。由图6c可知,最优氮源为蛋白胨,2,3-BD产量为(19.10±0.05)g/L。由图6d可知,当初始木糖质量浓度为20~80 g/L时,2,3-BD产量随初始木糖质量浓度升高而增加;当初始木糖质量浓度为80 g/L时,2,3-BD产量最高,为(26.58±0.26)g/L;当初始木糖质量浓度>80g/L之后,2,3-BD产量有所下降。因此,菌株SN5利用木糖发酵产2,3-BD的最适初始木糖质量浓度为80 g/L。
将不同初始木糖含量的菌株SN5发酵结束后的发酵液利用高效液相色谱检测培养基中2,3-丁二醇产量及木糖残留量,并计算木糖的消耗率和2,3-BD转化率,结果见表1。
表1 菌株SN5利用木糖发酵2,3-丁二醇产量及转化率
Table 1 Production and conversion rates of 2,3-butanediol by xylose fermentation of strain SN5
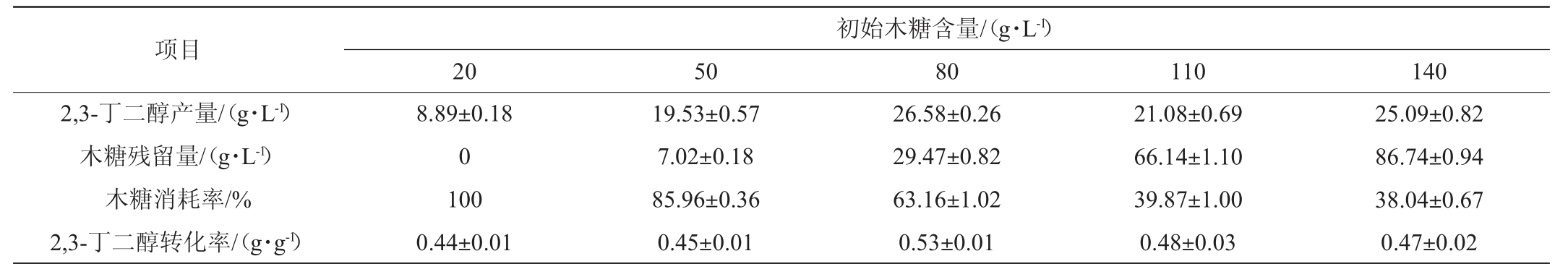
项目2,3-丁二醇产量/(g·L-1)木糖残留量/(g·L-1)木糖消耗率/%2,3-丁二醇转化率/(g·g-1)初始木糖含量/(g·L-1)205080110140 8.89±0.18 0 100 0.44±0.01 19.53±0.57 7.02±0.18 85.96±0.36 0.45±0.01 26.58±0.26 29.47±0.82 63.16±1.02 0.53±0.01 21.08±0.69 66.14±1.10 39.87±1.00 0.48±0.03 25.09±0.82 86.74±0.94 38.04±0.67 0.47±0.02
由表1可知,菌株SN5在初始木糖含量为80 g/L时,2,3-BD产量及转化率最高,分别为(26.58±0.26)g/L、(0.53±0.01)g/g。而当初始木糖含量升高至110 g/L和140 g/L时,2,3-BD产量下降且转化率也略微降低,这可能是由于菌株SN5中对于木糖的转运和代谢已经在80 g/L达到饱和,再继续增加初始木糖含量不但不能提升产量和转化率,反而会对菌株SN5形成抑制从而降低其生产效率。
目前已有的以木糖为底物发酵产2,3-BD的研究中,汪东升等[26]优化了一株肺炎克雷伯氏菌CICC 10011,发酵72 h 2,3-BD产量达到35.7 g/L,其转化率为0.46 g/g;郭学武等[21]优化菌株CICC 10011发酵条件,发酵72 h 2,3-BD产量高达43.75 g/L,其转化率为0.36 g/g;盛文建等[22]构建一株粘质沙雷氏菌MG1,发酵72 h 2,3-BD产量为20.1 g/L,其转化率为0.29 g/g;KUENZ A等[27]用芽孢杆菌发酵半纤维素浓缩馏分,2,3-BD的转化率为0.43 g/g;ZHANG C Y等[28]用阴沟肠杆菌CICC10011发酵玉米芯产2,3-BD,其转化率为0.444 g/g;任彤[29]用基因突变得到的菌株发酵混合糖产2,3-BD,其转化率0.438 g/g。本研究筛选出的菌株SN5虽然与工业化菌株尚有一定差距,但2,3-BD转化率均高于上述研究报道。
3 结论
本研究从自然界中分离、筛选出5株能利用木糖发酵产2,3-丁二醇的菌株SN1~SN5,其中菌株SN5发酵产2,3-丁二醇能力最强,在有氧条件2,3-丁二醇产量最高为(14.26±0.18)g/L。菌株SN5在葡萄糖和木糖含量为40 g/L和20 g/L的混合糖发酵条件下受碳分解代谢抑制影响,发酵48 h产2,3-丁二醇为(21.83±0.66)g/L。菌株SN5的最优发酵条件为:发酵温度为37 ℃,初始pH值为6.0,蛋白胨添加量为5 g/L,初始木糖含量为80 g/L。在此优化条件下,2,3-丁二醇产量为(26.58±0.26)g/L,较优化前提高89%,其转化率可达(0.53±0.01)g/g。本研究筛选出的菌株SN5可以进一步进行研究和改造,消除碳分解代谢抑制和进一步提高产量和产率,为生物法合成2,3-丁二醇的工业化生产提供理论基础和待选菌株。
[1]SYU M J.Biological production of 2,3-butanediol[J].Appl Microbiol Biot,2001,55(1):10-18.
[2]SONG C W, PARK J M, CHUNG S C, et al.Microbial production of 2,3-butanediol for industrial applications[J].J Ind Microbiol Biotechnol,2019,46(11):1583-1601.
[3]JI X J,HUANG H,LI S,et al.Development of an industrial medium for economical 2,3-butanediol production through co-fermentation of glucose and xylose by Klebsiella oxytoca[J].Biores Technol,2009,100(21):5214-5218.
[4]FLICKINGER M C.Current biological research in conversion of cellulosic carbohydrates into liquid fuels:How far have we come[J].Biotechnol Bioeng,1980,22:27-48.
[5]张燎原.粘质沙雷氏菌发酵生产2,3-丁二醇及其代谢调控研究[D].上海:华东理工大学,2010.
[6]JI X J,HUANG H,OUYANG P K.Microbial 2,3-butanediol production:A state-of-the-art review[J].Biotechnol Adv,2011,29(3):351-364.
[7]刘国兴,王元好,孙丽慧,等.盾叶薯蓣糖化液发酵生产2,3-丁二醇[J].过程工程学报,2009(9):95-100.
[8]CHAN S,KANCHANATAWEE S,TAILLANDIER P,et al.Using a combined oxygen-supply and substrate-feeding strategy to improve 2,3-butanediol production by metabolically engineered Klebsiella oxytoca KMS005[J].J Chem Technol Biot,2018,93(2):600-608.
[9]赵世敏.微生物发酵法生产2,3-丁二醇[D].无锡:江南大学,2008.
[10]JEONG J W, PARK K M, CHUNG M, et al.Influence of Vitreoscilla hemoglobin gene expression on 2,3-butanediol production in Klebsiella oxytoca[J].Biotechnol Bioproc Eng,2015,20(1):10-17.
[11]李丽.利用Klebsiella pneumonia ZH-1生物合成2,3-丁二醇的发酵研究[D].太原:山西师范大学,2018.
[12]宋源泉,许赟珍,李强,等.2,3-丁二醇的发酵生产[J].化工进展,2011,30:1069-1077.
[13]GARG S K,JAIN A.Fermentative production of 2,3-butanediol:a review[J].Biores Technol,1995,51(2):103-109.
[14]GURAGAIN Y N,CHITTA D,KARANJIKAR M R,et al.Appropriate lignocellulosic biomass processing strategies for efficient 2,3-butanediol production from biomass-derived sugars using Bacillus licheniformis DSM 8785[J].Food Bioprod Process,2017,104:147-158.
[15]SONG C W,RATHNASINGH C,PARK J M,et al.Isolation and evaluation of Bacillus strains for industrial production of 2,3-Butanediol[J].J Microbiol Biotechn,2018,28(3):409-417.
[16]张玉.高效利用木糖产2,3-丁二醇Klebsiella pneumoniae的选育[D].天津:天津科技大学,2018.
[17]MA C Q,WANG A L,QIN J Y,et al.Enhanced 2,3-butanediol production by Klebsiella pneumoniae SDM[J].Appl Microbiol Biot,2009,82(1):49-57.
[18]郝健.克雷伯氏菌细胞工厂[J].中国科学(生命科学),2023,53(8):1072-1082.
[19]齐凯.季也蒙氏毕赤酵母利用玉米芯水解液发酵产乙醇的研究[D].上海:华东理工大学,2016.
[20]ZHANG L Y, YANG Y, SUN J, et al.Microbial production of 2,3-butanediol by a mutagenized strain of Serratia marcescens H30[J].Bioresource Technol,2010,101(6):1961-1967.
[21]郭学武,张玉,关翔宇,等.产2,3-丁二醇高木糖耐性肺炎克雷伯氏菌转录组学分析与发酵优化[J].生物技术通报,2018,34(8):159-169.
[22]盛文建,白方敏,戴璐,等.重组粘质沙雷氏菌混合发酵木糖-葡萄糖生产2,3-丁二醇[J].基因组学与应用生物学,2019,38(12):5475-5482.
[23]朱玉红.重组枯草芽孢杆菌利用半纤维素生产手性2,3-丁二醇发酵条件的优化[D].天津:天津大学,2018.
[24]NESSLER S,FIEULAINE S,PONCET S,et al.HPr kinase/phosphorylase,the sensor enzyme of catabolite repression in Gram-positive bacteria: structural aspects of the enzyme and the complex with its protein substrate[J].J Bacteriol,2003,185(14):4003-4010.
[25]毛亮阳,李娜,葛菁萍.ptsG基因敲除对肺炎克雷伯氏菌CCR效应的缓解及发酵产2,3-BD的影响[J].中国农学通报,2024,40(3):95-102.
[26]汪东升,张翠英,彭晓培,等.木糖母液发酵生产2,3-丁二醇的研究[J].食品研究与开发,2012,33(7):132-135.
[27]KUENZ A,JAEGER M,NIEMI H,et al.Conversion of xylose from birch hemicellulose hydrolysate to 2,3-butanediol with Bacillus vallismortis[J].Fermentation,2020,6(3):86.
[28]ZHANG C Y,LI W,WANG D S,et al.Production of 2,3-butanediol by Enterobacter cloacae from corncob-derived xylose[J].Turk J Biol,2016,40(4):856-865.
[29]任彤.采用Klebsiella pneumoniae生物合成2,3-丁二醇过程分析[D].上海:华东理工大学,2011.