硒是人体所必需的微量元素之一,具有提高人体免疫力、抗氧化、抗癌等功效,长期硒缺乏会引起克山病、大骨节病,也会增大患神经退行性疾病、癌症、心血管疾病、甲状腺疾病的概率[1-2]。由于人体不能自行合成硒元素,只能通过饮食来补充,因此,土壤硒匮乏地区的人无法满足每日硒建议摄入量(55 μg/d)[3]。在自然界中硒主要以无机硒的形式存在:亚硒酸盐和硒酸盐,但无机硒不易被人体吸收且具有潜在的安全风险,现在多趋向于补充具有高生物相容性且安全性更高的有机硒,如硒代半胱氨酸(SeCys)、硒代蛋氨酸(SeMet)和硒甲基硒代半胱氨酸[4]。
研究表明,微生物如乳酸菌、酵母菌和蕈菌等能将无机硒转化为有机硒。其中,富硒酵母是最易获得、使用最为安全有效的人及动物的补硒来源[5],其硒生物转化效率高,蛋白质中的硒化合物占总蛋白质的60%~80%[6]。目前,国外报道的富硒酵母中硒含量高达1.4 mg/g,国内报道的富硒酵母硒含量为0.3~2.3 mg/g[7-8]。富硒酵母的生产大部分是以酿酒酵母(Saccharomyces cerevisiae)为微生物载体,关于非酿酒酵母的研究较少[9]。非酿酒酵母可以产生不同的代谢产物,包括萜类化合物、酯类、高级醇、甘油、乙酸及乙醛等[10],这些代谢产物是形成酒类感官特性的风味物质,影响产品的香气、口感[11]。
安康地区是全国最大的天然富硒地区之一,安康市平利县土壤平均硒含量为0.65 mg/kg,为富硒土壤[12]。湖北恩施土家族苗族自治州建始县土壤硒含量达0.94 mg/kg,总体上属于足硒及富硒范畴,同时关口葡萄在建始县具有广阔的种植面积,关口葡萄已是建始县“地理标志产品”[13]。因此,本研究以安康市平利县富硒土壤和建始县关口葡萄作为分离源,通过富硒培养的选育方法,筛选出富硒能力强的酵母菌。采用形态学观察、生理生化试验及分子生物学技术对分离出的酵母菌进行鉴定,并利用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)及气相色谱-质谱联用(gas chromatgraphy-mass spectrometry,GC-MS)技术对富硒酵母菌发酵液中的挥发性香气成分进行检测分析,揭示其呈香组分,为生产具有独特风味的发酵产品提供了一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土壤:采集于陕西省安康市平利县富硒地带土壤,按“S”形5点混合法取样,分别将表层土壤刨开,采集地表以下2~10 cm的土壤后装入无菌密封袋中,混匀,放入冰盒,带回实验室,放入4 ℃冰箱中保存。
葡萄:采集于湖北省恩施土家族苗族自治州建始县某关口葡萄园,随机选取1亩地的四个角及中心点葡萄树共5棵,分别在每棵树的上中下处随机摘取适量葡萄,装于无菌密封袋,然后混匀,带回实验室,放入4 ℃冰箱中保存。
1.1.2 培养基
孟加拉红固体培养基[14]:蛋白胨5.0 g/L、葡萄糖10.0 g/L、磷酸二氢钾1.0 g/L、无水硫酸镁0.5 g/L、琼脂20.0 g/L、孟加拉红0.033 g/L、氯霉素0.1 g/L、pH值7.2。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基[15]:酵母浸粉10.0 g/L、蛋白胨20.0 g/L、葡萄糖20.0 g/L。
YPD固体培养基:YPD液体培养基中添加琼脂20 g/L。
以上培养基均在115 ℃条件下高压蒸汽灭菌20 min,备用。
1.1.3 主要试剂
酵母脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:上海迈跟生物科技有限公司;亚硒酸钠、酵母粉、胰蛋白胨、葡萄糖、琼脂粉、硝酸:武汉欣申试化工科技有限公司;硒标准溶液(1 000 μg/mL):国家有色金属及电子材料分析测试中心;仲辛醇(纯度≥99%):上海阿拉丁生化科技股份有限公司。实验所用试剂均为分析纯或生化试剂。其他试剂均为国产分析纯。
1.2 仪器与设备
ZEALWAY-G154DS高压灭菌锅:美国致微仪器公司;SPD-900生化培养箱:武汉瑞华仪器有限公司;AG223331聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、Neo 15R冷冻高速离心机:德国Eppendorf公司;HDL超净工作台:北京东联哈尔仪器有限公司;ANTO NPAARMONOWAVE300微波消解仪:上海商贸有限公司;G-400智能控温电加热器赶酸仪:上海屹尧仪器科技发展有限公司;LC-AFS8530海光液相原子荧光联用仪:北京海光仪器有限公司;LGJ-12F真空冷冻干燥机:北京博励行仪器有限公司;EXPEC 5231气相色谱-三重串联四极杆质谱联用(gas chromatography-triple quadrupole mass spectrometry,GC-MS/MS)仪:杭州谱育科技发展有限公司。
1.3 方法
1.3.1 酵母菌菌株的分离
土样处理:取10.0 g土样直接加入灭过菌的装有90 mL磷酸缓冲盐溶液(pH值为7.2~7.4)的250 mL锥形瓶中,于28 ℃、180 r/min条件下振荡30 min后静置,取上层土壤悬液,5 000 r/min、4 ℃离心15 min,沉淀用10 mL无菌磷酸缓冲盐溶液悬浮,取2 mL悬浮液于100 mL YPD液体培养基中,于28 ℃、180 r/min条件下培养12 h。
葡萄样品处理:取10 g葡萄用无菌的研钵碾碎,全部加入灭过菌的装液量为100 mL/250 mL的YPD液体培养基中,于28 ℃、180 r/min条件下培养1~2 d。
菌株分离:将培养好的发酵液分别梯度稀释后涂布于孟加拉红固体培养基中,于28 ℃条件下倒置培养,待平板上长出菌落,挑选具有典型酵母菌特性的单菌落进行划线分离纯化,将纯化后的菌株进行编号并用30%甘油保藏于-80 ℃冰箱中备用。
1.3.2 富硒酵母菌的筛选
采用耐硒法和红硒法相结合的方式筛选富硒酵母菌株,耐硒法是基于微生物对无机硒的抗性与其对无机硒的生物转化能力成正相关;红硒法是基于微生物对硒的生物转化能力与红硒的形成呈负相关[7]。
种子液的制备:挑取活化后的菌种,接种到装液量为100 mL/250 mL的YPD液体培养基中,于28 ℃、180 r/min条件下培养10 h,即得种子培养液。
富硒酵母菌的初筛:将分离纯化后的酵母菌分别划线至Na2SeO3质量浓度分别为0、50 mg/L、100 mg/L、200 mg/L、500 mg/L的YPD固体培养基平板上,在28 ℃恒温培养箱中培养48~60 h,观察菌株的生长情况及菌落颜色变化,挑选出生长良好,且在较高亚硒酸钠质量浓度下菌落颜色变红或微红的菌株。
富硒酵母菌的复筛:将初筛得到的菌株以5%(V/V)的接种量接种至Na2SeO3质量浓度分别为0、10 mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70 mg/L Na2SeO3的YPD液体培养基中,于28 ℃、180 r/min条件下培养12 h、18 h和24 h后,在波长600 nm处测定吸光度值,筛选出OD600nm值较高的菌株,表明该菌株对硒有较好的耐受性[16]。并将初筛得到的菌株以5%(V/V)接种量接种到含有50 mg/L Na2SeO3的YPD液体培养基中,于28 ℃、180 r/min条件下培养36 h后,离心收集菌体,并用去离子水洗涤菌体三次,冷冻干燥后测定其生物量和硒含量,筛选出生物量和硒含量最高的菌株。
1.3.3 富硒酵母菌的鉴定
形态学及生理生化鉴定:参照《酵母菌的特征与鉴定手册》[17]及《真菌鉴定手册》[18]对复筛得到的优质酵母菌进行细胞形态和菌落特征观察以及生理生化鉴定。
分子生物学鉴定:将筛选到的菌株接种于YPD液体培养基,28 ℃、180 r/min条件下培养至对数生长期,8 000 r/min条件下离心10 min,收集菌体,采用酵母菌DNA提取试剂盒提取基因组DNA。以其为模板,采用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')对酵母菌的26S rDNA D1/D2区基因序列进行PCR扩增[19]。取5 μL PCR扩增产物采用1%琼脂糖凝胶电泳检测,检测合格后,将PCR扩增产物送至生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比搜索工具(basic local alignment search tool,BLAST)与已知序列进行同源比对分析,选取同源性较高的模式菌株的26S rDNA D1/D2区基因序列,并采用MEGA 11.0软件中的邻接法(neighbor-joinin,NJ)构建系统发育树[20]。
1.3.4 富硒酵母菌菌株生长曲线的绘制
将活化后的筛选菌株以5%(V/V)的接种量接种于装液量为100 mL/250 mL的YPD液体培养基中,于28 ℃、180 r/min条件下培养48 h,每隔2 h取样,在波长600 nm处测定OD600 nm值,以培养时间为横坐标,OD600 nm值为纵坐标,绘制菌株的生长曲线。
1.3.5 富硒酵母菌菌株的耐受性试验
将筛选得到的酵母菌菌株以5%(V/V)的接种量接种到含不同质量浓度葡萄糖(100 g/L、150g/L、200g/L、250 g/L、300 g/L)、SO2(80 mg/L、130 mg/L、180 mg/L、230 mg/L、280 mg/L)、乙醇体积分数(6%、9%、12%、15%、18%)的YPD液体培养基中,于28 ℃条件下培养24 h后测定OD600nm值,以YPD液体培养基作对照[21],考察菌株的耐受性。
1.3.6 富硒酵母发酵液的制备
将筛选酵母以5%(V/V)的接种量接种到含有50 mg/L Na2SeO3的YPD液体培养基中,标记为SeG-1,同时以5%(V/V)接种量接种到未加硒的YPD液体培养基中作为对照组,标记为G-1,两组样品同时在28 ℃、180 r/min条件下培养60 h,测定发酵液中的挥发性香气成分。
1.3.7 测定方法
硒含量的测定:参考文献[22]采用氢化物原子荧光光谱法;生物量的测定:采用干重法[23];挥发性香气成分的测定:采用HS-SPME-GC-MS法测定[24]。
1.3.8 数据处理
所有试验均设置3次重复,采用Excel 2019、Origin 9.0及MEGA 11.0软件进行数据分析与制图,结果以“平均值±标准差”表示。
2 结果与分析
2.1 富硒酵母菌的分离及初筛
通过观察孟加拉红平板上菌落特征,共分离纯化得到46株具有典型酵母菌菌落特征的单菌落,编号分别为AK-1~AK-24和G-1~G-22,其中从土壤中分离得到24株,葡萄中分离得到22株,其菌落形态主要呈凸起的球形,乳白色或白色,表面光滑湿润,易挑起,与酵母菌典型菌落特征基本相符。通过划线法接种到含有不同质量浓度Na2SeO3的YPD培养基上,根据酵母菌的菌落大小及颜色,筛选出4株菌落较大且在较高Na2SeO3含量下菌落颜色呈粉红或微红的酵母菌,分别为G-1、G-7、G-16和AK-19。
2.2 富硒酵母菌的复筛
2.2.1 耐硒能力的比较
4株初筛菌株在含有不同质量浓度Na2SeO3的YPD液体培养基中培养12 h、18 h和24 h后,在波长600 nm处测定吸光度值,结果见图1。由图1可知,不同酵母菌株对硒的耐受性存在很大差异,当Na2SeO3质量浓度>10 mg/L之后,菌株G-7和G-16的OD600 nm值开始降低,然而菌株AK-19的OD600 nm值在Na2SeO3质量浓度<20 mg/L之前几乎没有影响,当Na2SeO3质量浓度达到20 mg/L时其生长受到抑制。菌株G-1的OD600 nm值在培养18 h、24 h,Na2SeO3质量浓度0~70 mg/L时整体变化不大。综上,在相同条件下,菌株G-1生长良好,耐硒能力最强。
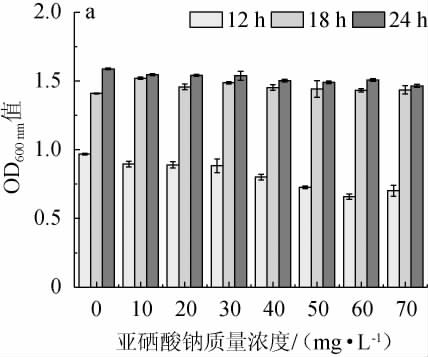
图1 初筛菌株耐硒能力的比较
Fig.1 Comparison of selenium tolerance ability of primary screening strains
a为菌株G-1;b为菌株G-7;c为菌株G-16;d为菌株AK-19。
2.2.2 富硒能力的比较
4株初筛菌株在Na2SeO3质量浓度为50 mg/L的YPD液体培养基中培养36 h时的生物量和硒含量见表1。由表1可知,当培养基中的Na2SeO3质量浓度为50 mg/L时,菌株G-1生长良好,可以获得较高的硒含量,生物量和硒含量分别为4.80 g/L、1.64 mg/g,因此,选择菌株G-1为高富硒菌株。
表1 初筛菌株的生物量和硒含量测定结果
Table 1 Determination results of biomass and selenium contents of primary screening strains

菌株编号生物量/(g·L-1)硒含量/(mg·g-1)G-1 G-7 G-16 AK-19 4.80±0.034 3.15±0.004 3.28±0.067 2.32±0.008 1.64±0.034 1.12±0.076 1.03±0.055 1.55±0.050
2.3 高富硒酵母菌G-1的鉴定
2.3.1 形态学观察
菌株G-1的菌落及细胞形态见图2。由图2可知,菌株G-1的菌落呈凸起的球形,乳白色或白色,表面光滑湿润,易挑起,在10×100倍光学显微镜下菌体细胞呈圆形,直径约2 μm,扫描电镜显示酵母菌呈圆形,出芽生殖,其细胞形态符合酵母菌特征。

图2 菌株G-1的菌落(A)及细胞(B,C)形态
Fig.2 Colony (A) and cell (B, C) morphology of strain G-1
2.3.2 生理生化鉴定
酵母菌株G-1的生理生化试验结果见表2。由表2可知,菌株G-1能发酵利用、同化葡萄糖、甘露糖、蔗糖,能同化硫酸铵、蛋白胨,不能发酵利用、同化乳糖、麦芽糖,不能同化亚硝酸钠,不能水解尿素,参照《酵母菌的特征与鉴定手册》[17]和《真菌鉴定手册》[18],结合形态学特征,初步鉴定菌株G-1为孢圆酵母属(Torulaspora sp.)。
表2 菌株G-1的生理生化试验结果
Table 2 Results of physiological and biochemical tests of strain G-1
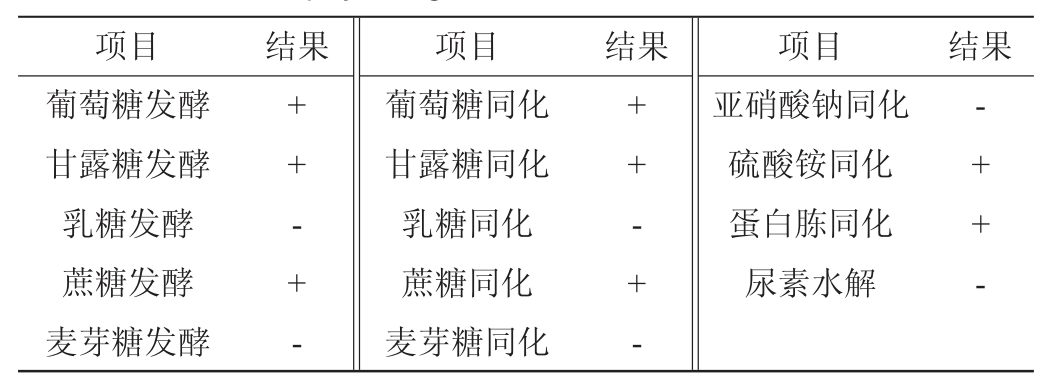
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
项目结果项目结果项目结果葡萄糖发酵甘露糖发酵乳糖发酵蔗糖发酵麦芽糖发酵++-+-葡萄糖同化甘露糖同化乳糖同化蔗糖同化麦芽糖同化++-+-亚硝酸钠同化硫酸铵同化蛋白胨同化尿素水解-++-
2.3.3 分子生物学鉴定
基于26S rDNA D1/D2区基因序列利用MEGA 11软件构建菌株G-1的系统发育树,结果见图3。由图3可知,菌株G-1与戴尔有孢圆酵母(Torulaspora delbrueckii)isolate UTAD1045(GenBank登录号OQ304702.1)聚于一支,亲缘关系最近。结合形态学特征及生理生化试验结果,最终鉴定菌株G-1为戴尔有孢圆酵母(Torulaspora delbrueckii)。戴尔有孢圆酵母因为在发酵过程中具有产生酯类化合物,且能使挥发性酸度降低、甘油含量增加的特点,近几年在葡萄酒和啤酒的生产中广泛应用[25-27]。

图3 基于26S rDNA D1/D2区基因序列高富硒酵母菌菌株G-1的系统发育树
Fig.3 Phylogenetic tree of selenium-enriched yeast strain G-1 based on 26S rDNA D1/D2 gene sequence
2.4 戴尔有孢圆酵母G-1的生长特性
菌株G-1的生长曲线及其对SO2、葡萄糖、乙醇的耐受性见图4。由图4A可知,培养0~4 h,菌株G-1生长较为缓慢,表明菌株生长处于延滞期;培养至4 h后,其OD600 nm值呈指数增长,表明菌株进入对数生长期,在培养至12 h左右进入生长稳定期。
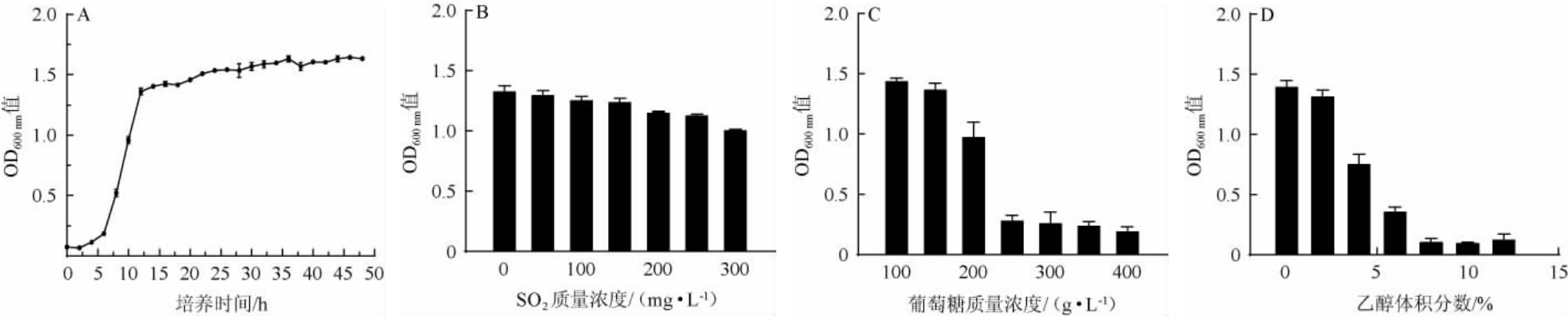
图4 戴尔有孢圆酵母G-1的生长特性
Fig.4 Growth characteristics of Torulaspora delbrueckii G-1
在果酒发酵过程中添加的SO2具有抑菌、提高澄清率、防腐等作用[28]。由图4B可知,随着SO2质量浓度在0~300mg/L范围内的升高,菌株G-1的OD600nm值呈下降趋势,但均能正常生长,说明菌株G-1具有较强的SO2耐受性。
糖类是酵母生长的必需营养物质,是酵母生长代谢的基质[29],在果酒发酵过程中糖含量一般在20%~25%[30]。由图4C可知,随着葡萄糖质量浓度的增加,菌株G-1的OD600nm值呈下降趋势。当葡萄糖质量浓度达到250 g/L时,菌株G-1的生长受到明显抑制;当葡萄糖质量浓度为200 g/L时,菌株G-1能够正常生长,说明菌株G-1对葡萄糖有良好的耐受性。
酒精超过一定浓度会对酵母细胞膜造成损伤[31],由图4D可知,随着乙醇体积分数的升高,菌株G-1的OD600nm值呈下降趋势。在乙醇体积分数为0~6%环境下,菌株G-1可以生长;当乙醇体积分数>6%之后,菌株G-1的生长受到严重抑制。
综上所述,酵母菌株G-1可耐受300 mg/L SO2、200 g/L葡萄糖,具有较好的二氧化硫和葡萄糖耐受性,但对乙醇较为敏感,乙醇耐受性差,可耐受体积分数6%的乙醇。
2.5 戴尔有孢圆酵母G-1发酵液中挥发性香气成分分析
酵母菌在发酵过程中将糖类转化为醇类并产生各种副产物(如酯类、酸类、醛酮类等挥发性化合物),这些产物有助提供宜人的香气[32]。采用HS-SPME-GC-MS检测戴尔有孢圆酵母G-1发酵液中的挥发性香气成分,结果见表3。由表3可知,从戴尔有孢圆酵母G-1发酵液中共鉴定出33种挥发性香气成分,其中醇类8种、酯类10种、酸类3种、醛酮类5种、烷烃类3种以及其他类4种。SeG-1组和G-1组发酵液中挥发性香气物质的组成和含量有明显差异,两组有13种共有的化合物(如异戊醇、苯乙醛、乙酸苯乙酯等),同时SeG-1组还产生了17种独特的化合物(如苯乙醇、壬醇、壬酸等),这些物质能提供更醇厚的口感和独特花香、脂香风味[33]。
表3 加硒与未加硒条件下戴尔有孢圆酵母G-1发酵液中挥发性化合物GC-MS分析结果
Table 3 GC-MS analysis results of volatile compounds in fermentation broth of Torulaspora delbrueckii G-1 with and without selenium
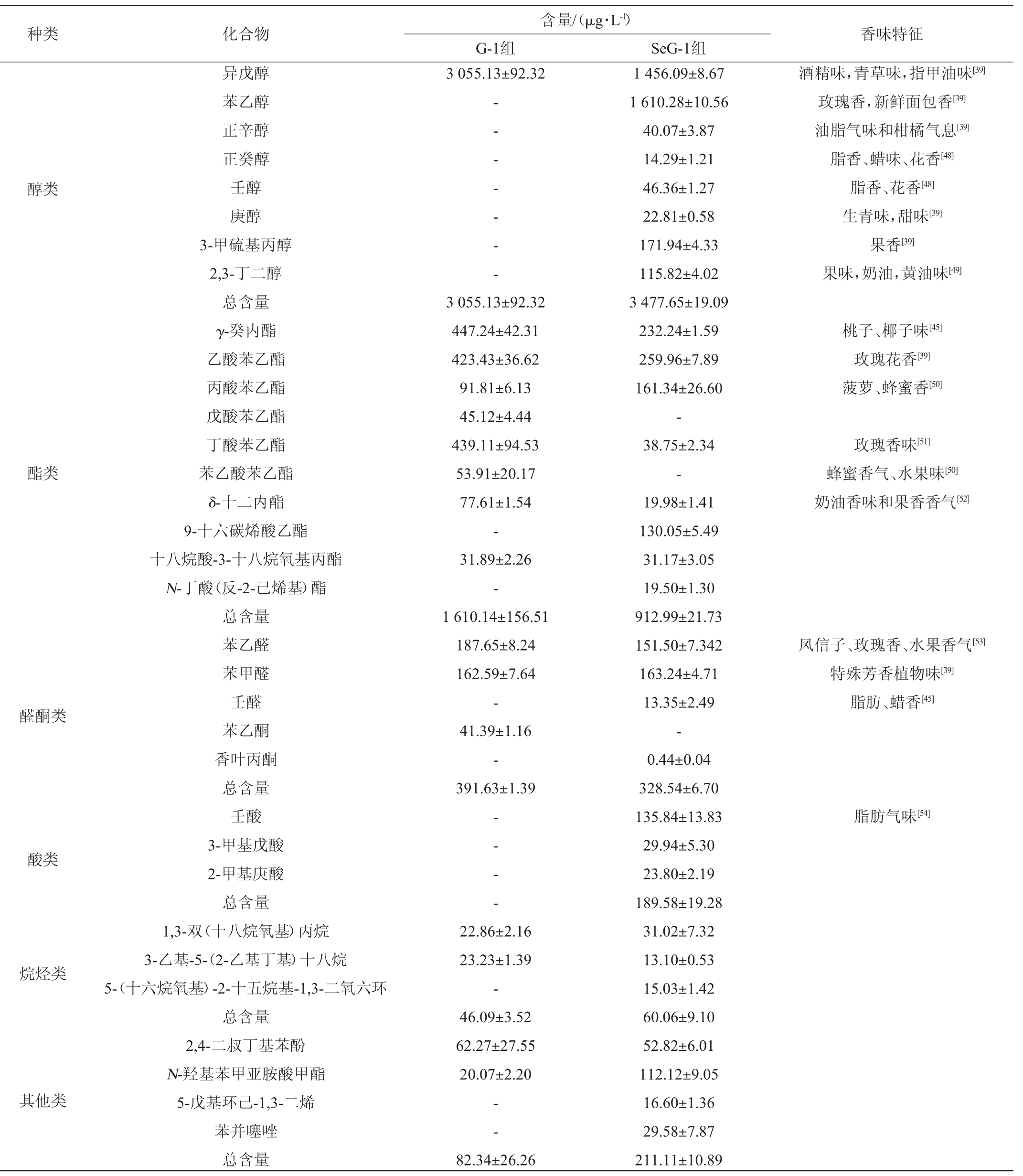
注:“-”表示未检出。
含量/(μg·L-1)G-1组SeG-1组3 055.13±92.32——---醇类酒精味,青草味,指甲油味[39]玫瑰香,新鲜面包香[39]油脂气味和柑橘气息[39]脂香、蜡味、花香[48]脂香、花香[48]生青味,甜味[39]果香[39]果味,奶油,黄油味[49]种类化合物香味特征异戊醇苯乙醇正辛醇正癸醇壬醇庚醇3-甲硫基丙醇2,3-丁二醇总含量γ-癸内酯乙酸苯乙酯丙酸苯乙酯戊酸苯乙酯丁酸苯乙酯苯乙酸苯乙酯δ-十二内酯9-十六碳烯酸乙酯十八烷酸-3-十八烷氧基丙酯N-丁酸(反-2-己烯基)酯总含量苯乙醛苯甲醛壬醛苯乙酮香叶丙酮总含量壬酸3-甲基戊酸2-甲基庚酸总含量1,3-双(十八烷氧基)丙烷3-乙基-5-(2-乙基丁基)十八烷5-(十六烷氧基)-2-十五烷基-1,3-二氧六环桃子、椰子味[45]玫瑰花香[39]菠萝、蜂蜜香[50]酯类玫瑰香味[51]蜂蜜香气、水果味[50]奶油香味和果香香气[52]醛酮类3 055.13±92.32 447.24±42.31 423.43±36.62 91.81±6.13 45.12±4.44 439.11±94.53 53.91±20.17 77.61±1.54-31.89±2.26-1 610.14±156.51 187.65±8.24 162.59±7.64-41.39±1.16-391.63±1.39风信子、玫瑰香、水果香气[53]特殊芳香植物味[39]脂肪、蜡香[45]脂肪气味[54]酸类——烷烃类22.86±2.16 23.23±1.39-46.09±3.52 62.27±27.55 20.07±2.20其他类总含量2,4-二叔丁基苯酚N-羟基苯甲亚胺酸甲酯5-戊基环己-1,3-二烯苯并噻唑总含量--82.34±26.26 1 456.09±8.67 1 610.28±10.56 40.07±3.87 14.29±1.21 46.36±1.27 22.81±0.58 171.94±4.33 115.82±4.02 3 477.65±19.09 232.24±1.59 259.96±7.89 161.34±26.60-38.75±2.34-19.98±1.41 130.05±5.49 31.17±3.05 19.50±1.30 912.99±21.73 151.50±7.342 163.24±4.71 13.35±2.49-0.44±0.04 328.54±6.70 135.84±13.83 29.94±5.30 23.80±2.19 189.58±19.28 31.02±7.32 13.10±0.53 15.03±1.42 60.06±9.10 52.82±6.01 112.12±9.05 16.60±1.36 29.58±7.87 211.11±10.89
醇类物质是酒香味的主要组成成分,主要呈水果香、花香,适宜的浓度可促进香气的协调性[34]。SeG-1组发酵液与G-1组相比新增了苯乙醇、2,3-丁二醇等7种醇类物质,总含量提高了422.52 μg/L。其中,异戊醇的含量在两组发酵液中均最高,分别为3 055.13 μg/L、1 456.09 μg/L,异戊醇是葡萄酒中重要的挥发性风味物质,具有宜人的玫瑰和蜂蜜香气[35]。SeG-1组发酵液中的苯乙醇和2,3-丁二醇含量分别为1 610.28 μg/L、115.82 μg/L,此结果与YIN L等[36]的研究结果一致,苯乙醇是酵母以L-苯丙氨酸为前体物,通过戊糖磷酸途径、艾利希途径、莽草酸途径等代谢途径生成,具有独特的玫瑰花香气[37]。
酯类物质也是重要的挥发性风味物质,大多数酯类化合物具有水果甜香味,对酒的香气产生重要影响[38],两组发酵液中的酯类物质主要包括γ-癸内酯、乙酸苯乙酯、丙酸苯乙酯和丁酸苯乙酯等,其中γ-癸内酯和苯乙基类化合物占比较大,苯乙基类化合物具有令人愉悦的玫瑰花香味道[39]。SeG-1组发酵液与G-1组相比新增了9-十六碳烯酸乙酯和N-丁酸(反-2-己烯基)酯,含量分别为130.05 μg/L和19.50μg/L,但SeG-1组发酵液中的酯类物质总量(912.99μg/L)低于G-1组(1 610.14 μg/L),这可能是因为酯类生物合成前体一般来源于相应的氨基酸,氨基酸生物合成中关键酶的反馈抑制在调节酯类的产生中起着至关重要的作用,添加亚硒酸钠可能影响菌株合成氨基酸[40-41]。
酸类物质是酯类物质合成的前体,大部分是酵母菌代谢的副产物[42],有机酸的种类、含量对于果酒的风味、口感、稳定性等方面有重要影响[43]。SeG-1组发酵液中酸类物质明显增加,与G-1组发酵液相比酸类物质增加3种,总含量增加189.58 μg/L。其中饱和脂肪酸壬酸不仅有呈香作用,还是重要的酸味物质[44],这使得SeG-1组发酵液具有更加丰富的风味。
醛酮类物质可通过醇氧化而成,是不稳定的中间体化合物,通过与其他化合物相互作用呈现香味,有助于整体芳香气味的平衡[34]。SeG-1组发酵液与G-1组相比醛酮类化合物增加了2种,分别是壬醛和香叶丙酮,含量分别为13.35 μg/L和0.44 μg/L,这为发酵液提供了脂香和蜡香[45]。香叶丙酮对氧化损伤细胞内的活性氧具有清除作用,能够提高细胞的抗氧化能力[46]。SeG-1组发酵液与G-1组相比烷烃类化合物增加了13.97 μg/L,其他类化合物增加了128.77 μg/L,烷烃类化合物大多无气味或香气较弱,对发酵液呈香无太大贡献[47]。
3 结论
本研究结合耐硒法和红硒法从安康市平利县富硒土壤和建始县关口葡萄样品中分离筛选得到一株具有高富硒能力的酵母菌,编号为G-1,通过形态学观察、生理生化试验和分子生物学技术鉴定该菌株为戴尔有孢圆酵母(Torulaspora delbrueckii),其在含有50 mg/L Na2SeO3的YPD液体培养基中培养36 h后,硒含量为(1.64±0.034)mg/g,生物量为(4.80±0.034)g/L。菌株G-1具有良好的耐受性,可耐受葡萄糖200 g/L、SO2 300 mg/L,乙醇体积分数6%。利用HS-SPME-GC-MS技术对菌株G-1发酵液中的挥发性香气成分进行分析发现,从戴尔有孢圆酵母G-1发酵液中共检出33种挥发性香气物质,包括醇类8种、酯类10种、酸类3种、醛酮类5种、烷烃类3种以及其他类4种。与未加硒发酵液相比,富硒发酵液中增加了17种独特的挥发性化合物(如苯乙醇、9-十六碳烯酸乙酯、壬酸等),丰富了发酵液的花香、脂香和蜡香,在发酵食品等领域具有良好的应用前景。
[1]GUILLIN O M,VINDRY C,OHLMANN T,et al.Selenium, selenoproteins and viral infection[J].Nutrients,2019,11(9):2101.
[2]KIELISZEK M,BLAZEJAK S,BZDUCHA-WRÓBEL A,et al.Effect of selenium on growth and antioxidative system of yeast cells[J].Mol Biol Rep,2019,46(2):1797-1808.
[3]STANDING COMMITTEE ON THE SCIENTIFIC EVALUATION OF DIETARY REFERENCE INTAKES,SUBCOMMITTEE ON INTERPRETATION,USES OF DIETARY REFERENCE INTAKES,et al.Dietary reference intakes for vitamin C,vitamin E,selenium,and carotenoids[M].Washington:National Academies Press,2000:364.
[4]HADRUP N, RAVN-HAREN G.Absorption, distribution, metabolism and excretion(ADME)of oral selenium from organic and inorganic sources:A review[J].J Trace Elem Med Biol,2021,67:126801.
[5]王茜,方荣,邓娟娟,等.富硒酵母功能作用研究进展及法规现状[J].中国食品添加剂,2023,34(2):327-335.
[6]YANG J P, YANG H.Recent development in Se-enriched yeast, lactic acid bacteria and bifidobacteria[J].Crit Rev,2023,63(3):411-425.
[7]童凡,黄家琪,黄仕新,等.海洋源富硒酵母的分离鉴定及其发酵工艺优化[J].食品工业科技,2024,45(5):118-125.
[8]杨新,陈莉,杨双全,等.开阳地区桑葚果园富硒酵母菌的分离、筛选及鉴定[J].食品与发酵工业,2020,46(24):66-73.
[9]NIE X,YANG X,HE J,et al.Bioconversion of inorganic selenium to less toxic selenium forms by microbes: A review[J].Front Bioeng Biotech,2023,11:1167123.
[10]王凤梅,马利兵.非酿酒酵母在发酵过程中的代谢产物对葡萄酒质量的影响[J].中国酿造,2016,35(12):12-17.
[11]SHI W K, WANG J, CHEN F S, et al.Effect of Issatchenkia terricola and Pichia kudriavzevii on wine flavor and quality through simultaneous and sequential co-fermentation with Saccharomyces cerevisiae[J].LWTFood Sci Technol,2019,116:108477.
[12]王浩东,张建东,谢娟平,等.安康地区土壤硒资源分布规律研究[J].安康学院学报,2013,25(6):8-11.
[13]高婕妤,周小娟,万翔,等.湖北省建始县土壤硒分布特征及影响因素分析[J].华中农业大学学报,2023,42(1):212-218.
[14]中华人民共和国国家卫生和计划生育委员会.GB 4789.15—2016 食品安全国家标准食品微生物学检验霉菌和酵母计数[S].北京:中国标准出版社,2016.
[15]赵广河,胡梦琪,陆玺文,等.桃金娘果酒酵母菌的筛选鉴定及生长特性分析[J].中国酿造,2023,42(9):103-108.
[16]MÖRSCHBÄCHER A P,DULLIUS A,DULLIUS C H,et al.Assessment of selenium bioaccumulation in lactic acid bacteria[J].J Dairy Sci,2018,101(12):10626-10635.
[17]巴尼特J A.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:17-33.
[18]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:105-110.
[19]杜沁岭,屠婷瑶,徐文,等.青梅野生酵母菌的筛选鉴定与耐受性研究[J].食品与发酵工业,2023,49(4):196-201.
[20]曹云,曹文涛,王晓丹,等.耐高温高产酒精酵母菌的筛选鉴定及特性研究[J].食品与发酵科技,2023,59(1):83-89.
[21]王丹,江春阳,邓乔晟,等.地参发酵酒中专用酵母菌的筛选、鉴定及特性研究[J].食品科技,2023,48(5):18-25.
[22]谢超新,苏悦,朱利沙,等.响应面法优化葡萄有孢汉逊酵母菌富硒发酵工艺[J].食品科技,2022,47(3):15-22.
[23]李颖.高生物量富硒酵母的制备和性能改善研究[D].无锡:江南大学,2021.
[24]WANG X,XIE K,ZHUANG H,et al.Volatile flavor compounds,total polyphenolic contents and antioxidant activities of a China gingko wine[J].Food Chem,2015,182:41-46.
[25]林亚兰,张爱华.混合酵母发酵对火龙果酒发酵特性及风味特征的影响[J].食品研究与开发,2021,42(21):149-155.
[26]KAYADELEN F, AGIRMAN B, JOLLY N P, et al.The influence of Torulaspora delbrueckii on beer fermentation[J].FEMS Yeast Res,2023,23:foad006.
[27]POURCELOT E,CONACHER C,MARLIN T,et al.Comparing the hierarchy of inter-and intra-species interactions with population dynamics of wine yeast cocultures[J].FEMS Yeast Res,2023,23:foad039.
[28]CUIJVERS K,VAN DEN HEUVEL S,VARELA C,et al.Alterations in yeast species composition of uninoculated wine ferments by the addition of sulphur dioxide[J].Fermentation,2020,6(2):13.
[29]MARTÍN-GARCÍA F J,PALACIOS-FERNÁNDEZ S,DE LERMA N L,et al.The effect of yeast, sugar and sulfur dioxide on the volatile compounds in wine[J].Fermentation,2023,9(6):15.
[30]谢克林.浸渍方式和发酵罐容积对藤稔葡萄酒风味的影响及家庭酿造器的设计[D].上海:上海技术应用大学,2016.
[31]ISHMAYANA S,KENNEDY U J,LEARMONTH R P.Further investigation of relationships between membrane fluidity and ethanol tolerance in Saccharomyces cerevisiae[J].World J Microb Biot,2017,33(12):10.
[32]CAO Y X, WU Z F, WENG P F.Comparison of bayberry fermented wine aroma from different cultivars by GC-MS combined with electronic nose analysis[J].Food Sci Nutr,2020,8(2):830-840.
[33]邵长军,李刚,李亮,等.白酒香型与香味成分探究[J].酿酒科技,2005(8):92-93.
[34]桂江平,于化泓,余勃,等.基于GC-MS江西米酒风味物质的分析及品质比较[J].中国酿造,2023,42(1):231-237.
[35]FIORINI D,CAPRIOLI G,SAGRATINI G,et al.Quantitative profiling of volatile and phenolic substances in the wine vernaccia di serrapetrona by development of an HS-SPME-GC-FID/MS method and HPLC-MS[J].Food Anal Method,2014,7(8):1651-1660.
[36]YIN L,WANG C C, ZHU X H, et al.A multi-step screening approach of suitable non-Saccharomyces yeast for the fermentation of hawthorn wine[J].LWT-Food Sci Technol,2020,127:109432.
[37]CONGCONG W, VINOTHKANNA A, MA Y K, et al.Production of mulberry wine using selenium-enriched Saccharomyces cerevisiae: Implications from sensory analysis, phytochemical and antioxidant activities[J].J Food Sci Tech Mys,2024,61(2):366-384.
[38]NIU Y W, WANG P P, XIAO Z B, et al.Evaluation of the perceptual interaction among ester aroma compounds in cherry wines by GC-MS,GC-O,odor threshold and sensory analysis:An insight at the molecular level[J].Food Chem,2019,275:143-153.
[39]王铁儒,郭丽,马曼,等.SPME-GC-MS与电子鼻结合分析不同酵母混菌发酵猕猴桃酒的挥发性香气物质[J].食品工业科技,2021,42(16):119-128.
[40]LEE S, VILLA K, PATINO H.Yeast strain development for enhanced production of desirable alcohols/esters in beer[J].J Am Soc Brew Chem,1995,53(4):153-156.
[41]KIELISZEK M, BLAZEJAK S, BZDUCHA-WRÓBEL A, et al.Effect of selenium on lipid and amino acid metabolism in yeast cells[J].Biol Trace Elem Res,2019,187(1):316-327.
[42]肖付才,李颖奎,刘凯,等.非酿酒酵母与酿酒酵母混合发酵对薏米酒醪色泽及风味的影响[J].中国酿造,2024,43(3):95-101.
[43]ROBLES A,FABJANOWICZ M,CHMIEL T,et al.Determination and identification of organic acids in wine samples.Problems and challenges[J].Trac-trend Anal Chem,2019,120:115630.
[44]龚燕川,符东,蔡光容,等.不同品牌醪糟感官评定及挥发性成分分析[J].食品与发酵工业,2022,48(23):281-287.
[45]LIU X S,LIU J B,YANG Z M,et al.Aroma-active compounds in Jinhua ham produced with different fermentation periods[J].Molecules,2014,19(11):19097-19113.
[46]张倩,朱婷婷,黄明泉,等.白酒中两种萜烯类化合物的细胞内抗氧化活性[J].食品科学,2020,41(9):66-73.
[47]李治华,王自鹏,胡静,等.传统与商品郫县豆瓣酱挥发性成分的比较分析[J].现代食品科技,2014,30(4):268-273,219.
[48]魏铭,赵莱昱,杨航宇,等.不同酵母和氮源对笃斯越橘果酒香气的影响[J].食品科学,2018,39(10):257-262.
[49]马宇,黄永光.清酱香型白酒挥发性风味组分及香气特征[J].食品科学,2019,40(20):241-248.
[50]孙细珍,杜佳炜,黄盼,等.现代工艺和传统工艺酿造小曲清香型白酒感官表征及风味成分分析[J].食品科学,2021,42(6):282-290.
[51]王喆,张梦思,孙细珍,等.小曲清香型白酒中关键风味成分分析[J].食品科学,2022,43(14):264-271.
[52]于海燕,姚文倩,陈臣,等.内酯类化合物在食品中的风味贡献及形成机制[J].现代食品科技,2022,38(5):337-349,355.
[53]王梦琪,朱荫,张悦,等.“清香”绿茶的挥发性成分及其关键香气成分分析[J].食品科学,2019,40(22):219-228.
[54]范文来,徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,38(4):80-84.