我国秸秆年产量在8×108 t以上,占世界秸秆总产量的10%~30%[1]。秸秆的处置方式通常有三种:焚烧、工业化资源利用和农业化利用[2-5]。秸秆田间焚烧不仅造成大气污染和资源、能源浪费,而且破坏土壤理化性质和微生物群落结构,导致土壤肥力下降;秸秆工业化资源利用主要通过酶水解工艺处理秸秆生产乙醇、沼气等化工产品,但相关工艺条件严格,成本较高[4];秸秆农业化处置的最主要方式是破碎还田,还田能有效地改良土壤结构、全面提升土壤肥力[2]。但秸秆主要由纤维素、半纤维、木质素组成,它们通过共价键连接成三维网状结构,导致秸秆在自然条件中降解缓慢,反而会影响田间耕作,对作物培育壮苗不利,造成“黄弱苗”或“吊根”[6-7]。
有研究表明,秸秆降解可以通过纤维素酶、木聚糖酶和木质素酶系中的一种或多种酶协同完成[8-9]。目前,关于单菌株降解秸秆的报道较多,例如袁宏等[10]从土样中分离筛选得到一株多功能优势秸秆降解细菌,使秸秆降解率提高21%,且对水稻生长促进作用显著;韩月颖等[11]从冻土中筛选得到一株高效低温木质素降解菌LS-1,其与秸秆在15 ℃固态发酵后,秸秆质量损失率为18.85%,木质素降解率为36.14%,是对照组的6倍以上。但由于田地实际环境复杂,单菌株存在产酶较单一的问题,难以破坏木质素,导致纤维素酶与秸秆纤维素接触困难,无法达到秸秆纤维素的高效降解。构建复合菌系,利用菌株之间的协同作用,可弥补单一菌系酶活较弱和产酶较单一等不足,提高秸秆纤维素降解率[12-13]。目前报道的玉米秸秆降解菌复合菌系多由细菌或真菌构成,缺乏放线菌参与的复合菌系[14-15]。放线菌的产酶能力不如真菌,繁殖速度不及细菌,但放线菌在环境中的抗逆性较强,能在低温环境有效降解纤维素,适合在我国东北地区应用[16]。研究高效快速分解秸秆的方法是推进秸秆还田的重要措施。利用微生物发酵降解秸秆能提高秸秆降解速率、促进秸秆养分释放,促进农作物生长,成为目前秸秆降解研究的热点[17-26]。
本研究采用传统培养分离法,以纤维素降解酶活力和秸秆降解率为筛选指标,从玉米秸秆中分离筛选纤维素降解菌,通过形态学观察及分子生物学技术对筛选菌株进行鉴定,并经拮抗实验组合验证,最终构建包含细菌、真菌和放线菌的玉米秸秆纤维素降解复合菌系,以期为高效秸秆降解菌剂的开发提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
玉米秸秆:于2021年秋季取自辽宁省鞍山市台安县玉米田。秸秆粉碎压实,实验室烘干备用。
1.1.2 试剂
葡萄糖、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):国药集团化学试剂有限公司;蛋白胨、牛肉膏(均为生化试剂):北京奥博星生物技术有限责任公司;Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒SK8255、Ezup柱式真菌基因组DNA抽提试剂盒SK8259:生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
初筛培养基:琼脂20 g,蒸馏水1 L,调节pH为7.0~7.4。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:新鲜马铃薯200 g,蔗糖20 g,琼脂20 g,蒸馏水1 L,pH 7.0~7.4。
高氏一号培养基[19]:可溶性淀粉10 g,NaCl 0.25 g,KNO3 0.5 g,K2HPO4·3H2O 0.25 g,MgSO4·7H2O 0.25 g,FeSO4·7H2O 0.005 g,琼脂9 g,蒸馏水500 mL,pH 7.4~7.6。
牛肉膏蛋白胨培养基[19];牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,蒸馏水1 L,pH 7.0~7.4。
富集培养基:粉碎秸秆200 g、琼脂20 g,蒸馏水1 L,调节pH为7.0~7.4。
液体产酶培养基[19]:KH2PO4 2 g,(NH4)2SO4 1.4 g,CaCl2 0.3 g,MgSO4·7H2O 0.3 g,CMC-Na 5.0 g,FeSO4·7H2O 0.005 g,蛋白胨5.0 g,牛肉膏2.5 g,蒸馏水1 L,调节pH为7.0。
液体发酵培养基[19]:蛋白胨2 g,MgSO4·7H2O 0.5 g,KH2PO4 1.0 g,NaCl 0.5 g,CaCl2 0.2 g,酵母膏0.5 g,蒸馏水1 L,调节pH为7.0。
以上培养基均在115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
LDZX-75KBS全自动压力蒸汽灭菌锅:上海申安医疗器械厂;SW-CJ-2FD双人单面垂直超净工作台:上海博讯医疗生物仪器股份公司;LBI-400智能型生化培养箱:上海龙跃仪器设备有限公司;HZQ-F160立式恒温振荡培养箱:哈尔滨市东联电子技术开发有限公司;UV-2450紫外可见分光光度计:上海美析仪器有限公司;BM1000数码生物显微镜:南京江南永新光学有限公司。
1.3 方法
1.3.1 纤维素降解菌的分离及初筛
将粉碎后的玉米秸秆均匀的铺在初筛培养基上,分别在15 ℃、28 ℃和45 ℃条件下恒温培养3 d,筛选能以秸秆为唯一碳源生长的菌落。将初筛培养基中长出的单菌落分别接种到牛肉膏蛋白胨培养基、PDA培养基和高氏一号培养基中,分别于15 ℃、28 ℃和45 ℃条件下恒温培养,并进行多次传代培养以纯化菌株。将纯化的菌株接种到富集培养基中培养,选取直径较大的菌株进行分离纯化并保存。
1.3.2 纤维素降解菌的复筛
纤维素降解酶活性的测定:将初筛菌株用无菌水制成菌悬液(6×107 CFU/mL),吸取5 mL菌悬液于液体产酶培养基中,在28 ℃、160 r/min条件下恒温振荡培养12 d,取20 mL发酵液于4 000 r/min离心10 min,取上清液,采用DNS法测定纤维素降解酶活性[27-28]。
玉米秸秆降解率的测定:将玉米秸秆于105 ℃烘干至恒质量,在装液量为150mL/250 mL液态发酵培养基中加入5 g玉米秸秆,然后接入5 mL初筛菌株的菌悬液,在28 ℃、135 r/min条件下振荡培养20 d,每隔4 d取培养液,在4 ℃条件下3 500 r/min离心10 min,弃上清液,采用去离子水反复冲洗去除菌体后,再次离心,于105 ℃烘干至恒质量,测定发酵前后秸秆质量并计算玉米秸秆降解率,其计算公式如下:
1.3.3 纤维素降解菌的鉴定
形态学观察:将筛选得到的细菌接种于牛肉膏蛋白胨培养基,将放线菌接种于高氏一号培养基,分别于37 ℃、28 ℃条件下培养,待菌株生长旺盛后,观察菌落形态进行革兰氏染色,放到1 000倍镜下采用显微镜进行观察。采用嵌片法[19]对筛选得到的霉菌进行培养,25 ℃培养3 d,置于400倍镜下采用显微镜进行观察,观察孢子、产孢体、菌丝的形态结构等。
分子生物学鉴定:采用Ezup柱式细菌基因组DNA抽提试剂盒SK8255、Ezup柱式真菌基因组DNA抽提试剂盒SK8259分别提取原核、真核生物的基因组DNA,以其为模板,原核、真核生物分别采用通用引物27F(5'-AGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')、NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS6(5'-GCATCACAGACCTGTTATTGCCTC-3')对16S rDNA、18S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:模板(20~50 ng/μL)0.5 μL、10×Buffer(with Mg2+)2.5 μL、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)1 μL、rTaq酶0.2 μL、上下游引物(10 μmol/L)各0.5 μL、加双蒸水(ddH2O)至25 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸10 min,4 ℃终止反应。采用1%琼脂糖凝胶检测合格后,PCR扩增产物委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,并采用MEGA 11.0软件中邻接(neighbor-joining,NJ)法构建系统发育树,选取相似性较高的模式菌株对菌株进行鉴定。
1.3.4 纤维素降解复合菌系的构建
综合考虑菌株门类、纤维素酶活性和玉米秸秆降解效果,确定中心菌株,协同其他菌株构建复合菌系。首先采用平板对峙法,将菌株两两一组在牛肉膏蛋白胨固体平板中划平行线,菌株间隔1 cm,28 ℃倒置恒温培养,验证各菌株共同生长过程中是否有拮抗、抑制孢子生成等现象。然后将各菌株菌悬液按照体积比1∶1混合构建不同复合菌系,分别接种5 mL于液体产酶培养基中,于28 ℃、135 r/min条件下振荡培养。从第3天开始,每天取样测定纤维素降解酶活性,最终确定复合菌系的构成。
1.3.5 玉米秸秆形态分析
将待观察的秸秆切成2 mm×2 mm大小,用导电双面胶将样品贴在样品托上,采用扫描电镜进行观察。
1.3.6 数据处理与统计分析所有试验重复3次,采用SPSS 28.0.1.1处理数据,结果用“平均值±标准差”表示,采用Origin 2018软件绘图。
2 结果与分析
2.1 纤维素降解菌的分离与筛选
从以玉米秸秆为唯一碳源的培养基中共分离筛选得到8株具有纤维素降解能力的菌株,包括细菌5株(编号为S381-1、S381-3、S381-4、S381-7和S381-8)、放线菌1株(编号为S381-2)、真菌2株(编号为S876-2和S876-6)。其中,菌株S381-7是在45 ℃条件下筛选得到的耐高温细菌,其余菌株是在28 ℃条件下筛选得到的。8株筛选菌株的纤维素降解酶活力及玉米秸秆降解率见图1。
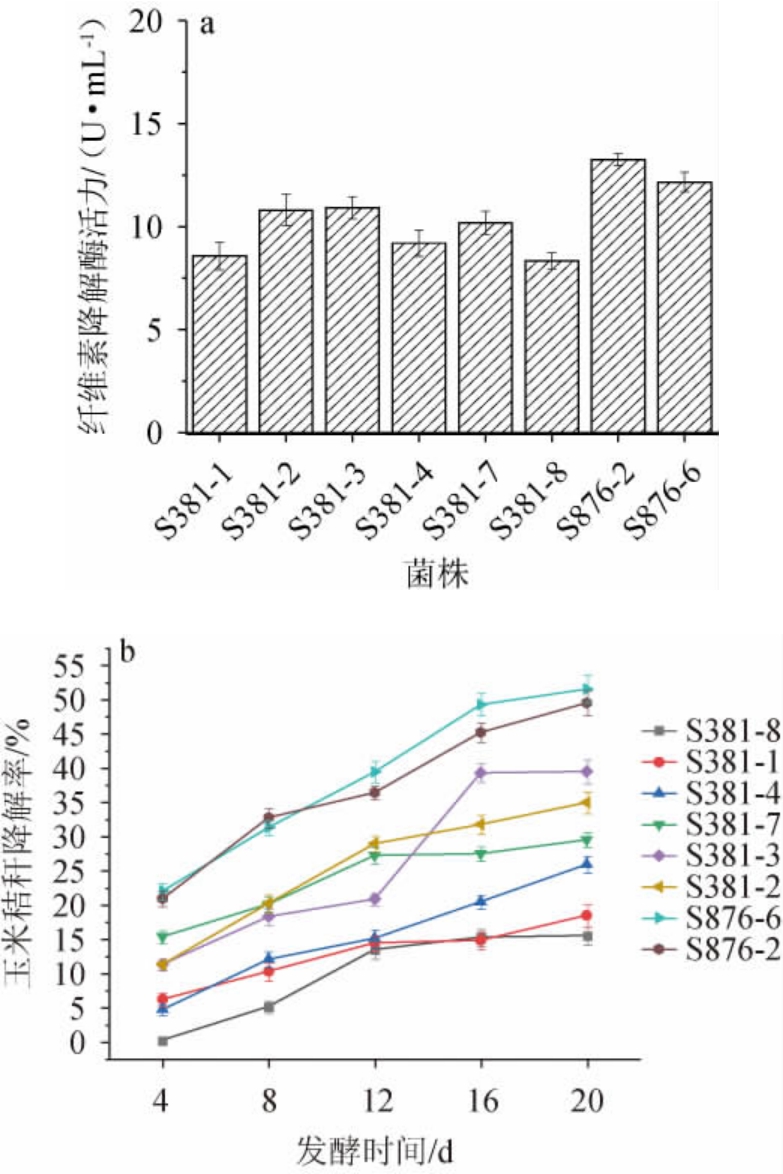
图1 8株筛选菌株的纤维素降解酶活力(a)及其对玉米秸秆的降解率(b)
Fig.1 Activities of cellulose-degrading enzyme (a) and degradation rates of corn straw (b) of 8 screened strains
由图1a可知,8株菌株的纤维素降解酶活力为8.34~13.26 U/mL。其中,菌株S876-2的纤维素降解酶活力最高,为13.26 U/mL。由图1b可知,各菌株在液态发酵条件下,秸秆含量均有大幅度的减少,降解速率呈现先快后慢的趋势。发酵20 d时,各菌株对玉米秸秆的降解率为:菌株S876-6(51.56%)菌株>S876-2(49.54%)>菌株S381-3(39.50%)>菌株S381-2(34.96%)>菌株S381-7(29.50%)>菌株S381-4(25.90%)>菌株S381-1(18.45%)>菌株S381-8(15.50%)。经菌株S876-6和S876-2处理后的玉米秸秆降解率明显高于其他菌株,表明这两株菌株具有较强的秸秆降解能力。各菌株对玉米秸秆的主要降解作用时间段并不相同,经菌株S876-6和S876-2发酵8 d后,玉米秸秆的降解率均>30%。菌株S381-3发酵前12 d对玉米秸秆降解缓慢,主要的降解作用集中在12~16 d。菌株S381-2、S381-7、S381-4、S381-1和S381-8从培养开始至结束对玉米秸秆的降解性能变化不大。
2.2 纤维素降解菌株的鉴定
2.2.1 形态学鉴定
8株纤维素降解菌株的菌落及细胞形态见图2。
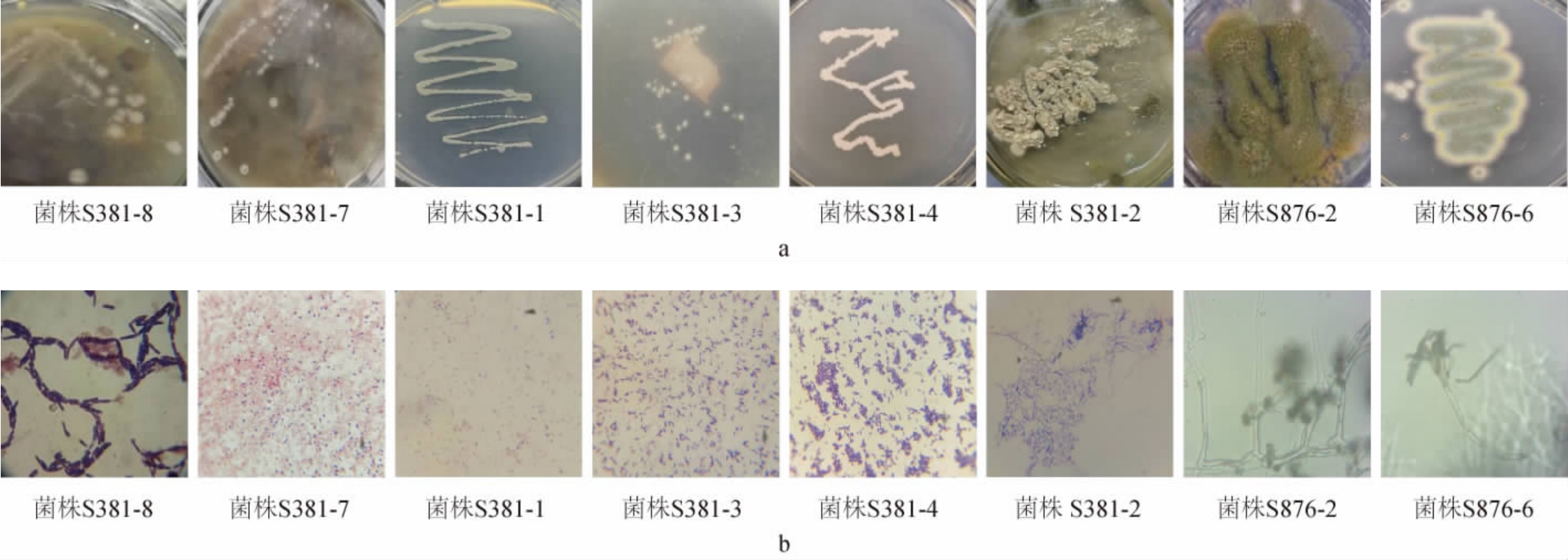
图2 8株纤维素降解菌株的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of 8 cellulose-degrading strains
由图2可知,菌株S381-8的菌落呈浅黄色,不透明,表面湿润有光泽、微波状,细胞呈长杆状,末端圆,芽孢呈椭圆形,为革兰氏阳性菌;菌株S381-7的菌落呈白色、湿润透明、边缘整齐,细胞呈圆形短杆状,为革兰氏阳性菌;菌株S381-1的菌落呈白色,湿润有光泽,表面低凸,不规则,细胞呈短杆状,为革兰氏阳性菌;菌株S381-3的菌落呈淡黄色,不透明,表面粗糙,有隆起,边缘不规则,细胞呈杆状,可形成内生芽孢,呈椭圆形,为革兰氏阳性菌;菌株S381-4的菌落呈淡黄色,不透明,表面粗糙,有隆起,边缘不规则,细胞呈杆状,可形成内生芽孢,呈椭圆形,为革兰氏阳性菌。菌株S381-2的菌落呈微黄色,表面为绒毛状且起粉,细胞呈丝状,为革兰氏阳性菌。菌株S876-2的菌丝体呈棉絮状、白色致密平坦、产浅绿孢子、分生孢子梗短侧枝,多分枝;菌株S876-6的菌丝体为绒状或絮状、橘黄色或黄色、分生孢子梗帚状枝、分生孢子面为暗绿色或暗灰绿色。
2.2.2 分子生物学鉴定
8株纤维素降解菌株的分子鉴定结果见表1。
表1 8株纤维素降解菌株的分子生物学鉴定结果
Table 1 Molecular biological identification results of 8 cellulose-degrading strains

菌株编号模式菌株NCBI号相似性/%鉴定结果S381-1 S381-2 S381-3 S381-4 S381-7 S381-8 S876-2 S876-6 Brevibacillus agri strain DSM 6348 Streptomyces bacillaris strain ATCC 15855 Bacillus amyloliquefaciens strain MD33 Bacillus velezensis strain PgBe179 Brevibacillus brevis strain NCTC2611 Priestia megaterium strain HGS7 Trichoderma reesei strain CBS999.97 Talaromyces pinophilus strain 1-95 CP026363.1 CP029378.1 KP059106.1 MH211270.1 LR134338.1 CP065213.1 CP020878.1 CP017345.1 99.79 99.93 100.00 99.30 99.72 99.86 100.00 100.00土壤短芽孢杆菌(Brevibacillus agri)杆菌状链霉菌(Streptomyces bacillaris)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)贝莱斯芽孢杆菌(Bacillus velezensis)短短芽孢杆菌(Brevibacillus brevis)巨大芽孢杆菌(Priestia megaterium)里氏木霉(Trichoderma reesei)产紫青霉(Penicillium purpurogenum)
由表1可知,结合形态学观察和分子生物学技术,最终鉴定菌株S381-1、S381-2、S381-3、S381-4、S381-7、S381-8、S876-2、S876-6分别为土壤短芽孢杆菌(Brevibacillus agri)、杆菌状链霉菌(Streptomyces bacillaris)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、贝莱斯芽孢杆菌(Bacillus velezensis)、短短芽孢杆菌(Brevibacillus brevis)、巨大芽孢杆菌(Priestia megaterium)、里氏木霉(Trichoderma reesei)、产紫青霉(Penicillium purpurogenum)。
2.3 复合菌系的构建
综合考虑菌株门类、纤维素降解酶活力和玉米秸秆降解效果,确定以产紫青霉S876-6、里氏木霉S876-2、解淀粉芽孢杆菌S381-3、杆菌状链霉菌S381-2这4株菌株为中心菌株,协同短短芽孢杆菌S381-7、贝莱斯芽孢杆菌S381-4、巨大芽孢杆菌S381-8构建复合菌系。进一步考察7株菌株两两菌株间的拮抗性,结果见图3。由图3可知,7株菌株中的两两菌株间均能够和谐生长,无抑制孢子生成,不存在拮抗现象。
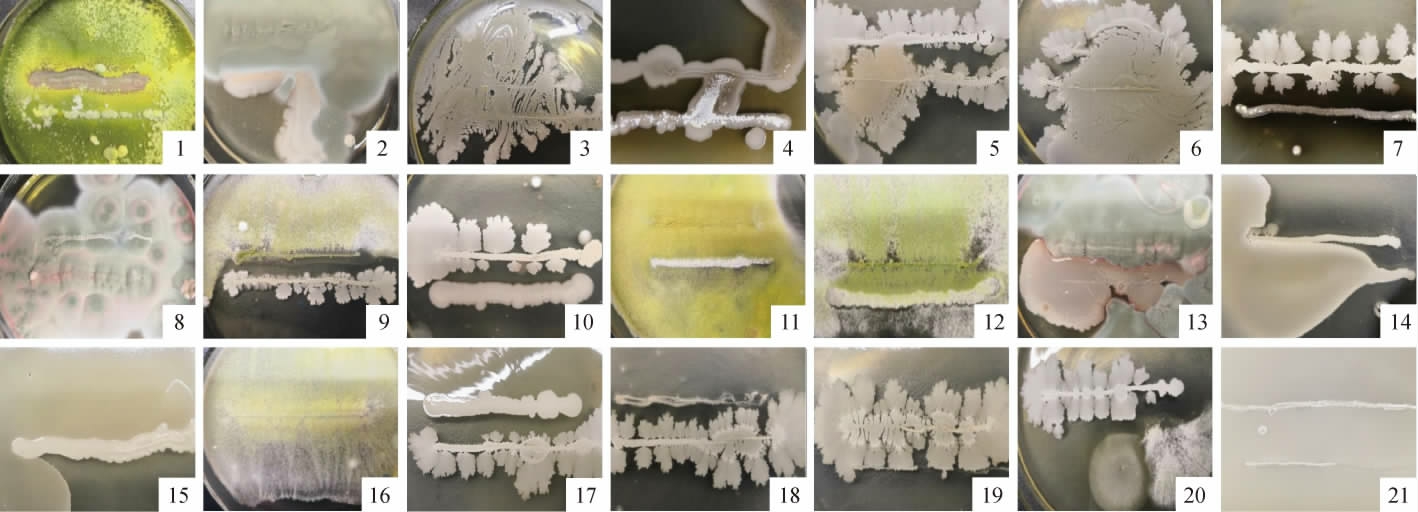
图3 7株纤维素降解菌两两菌株之间的拮抗活性
Fig.3 Antagonistic activities of 7 cellulose-degrading strains between pairings
1为菌株S876-6与S876-2;2为菌株S876-6与S381-8;3为菌株S381-7与S381-4;4为菌株S381-2与S381-8;5为菌株S381-3与S381-4;6为菌株S381-2与S381-4;7为菌株S381-3与S381-2;8为菌株S381-2与S387-6;9为菌株S876-2与S381-4;10为菌株S381-3与S381-8;11为菌株S876-2与S381-2;12为菌
株S876-2与S381-8;13为菌株S876-6与S381-7;14为菌株S381-3与S381-7;15为菌株S381-7与S381-8;16为菌株S876-2与S381-7;17为S381-8与
S381-4;18为菌株S876-6与S381-4;19为菌株S876-6与S381-3;20为菌株S876-2与S381-3;21为菌株S381-2与S381-7。
不同复合菌系的组合见表2,各复合菌系在液体产酶培养基中的纤维素降解酶活力见图4。
表2 不同复合菌系的组合
Table 2 Combinations of different complex microbial system
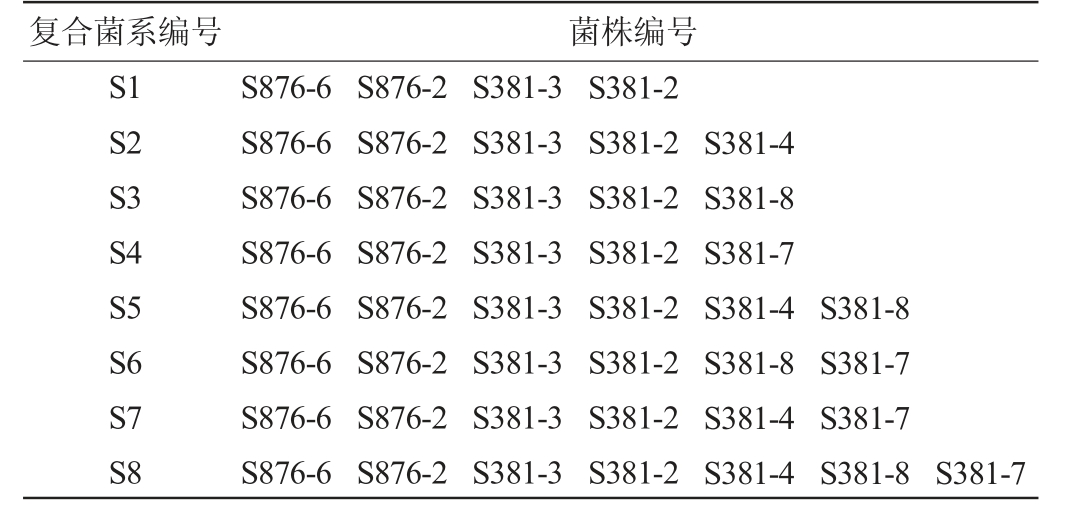
复合菌系编号菌株编号S1 S2 S3 S4 S5 S6 S7 S8 S876-6 S876-6 S876-6 S876-6 S876-6 S876-6 S876-6 S876-6 S876-2 S876-2 S876-2 S876-2 S876-2 S876-2 S876-2 S876-2 S381-3 S381-3 S381-3 S381-3 S381-3 S381-3 S381-3 S381-3 S381-2 S381-2 S381-2 S381-2 S381-2 S381-2 S381-2 S381-2 S381-4 S381-8 S381-7 S381-4 S381-8 S381-4 S381-4 S381-8 S381-7 S381-7 S381-8 S381-7
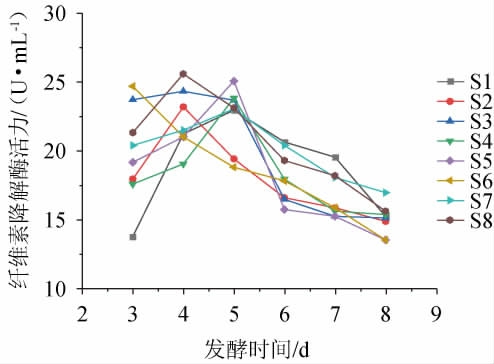
图4 不同复合菌系的纤维素降解酶活力
Fig.4 Cellulose degrading enzyme activities of different complex microbial system
由图4可知,各复合菌系的纤维素降解酶活力均高于单一菌株(图1),说明通过构建复合菌系的方法可以提高菌系的纤维素降解能力。除复合菌系S6外,其他复合菌系的纤维素降解酶活力均在发酵第4天或第5天达到最高,随后由于培养基中的营养物质供不应求,导致复合菌系的纤维素降解酶活力不断下降。8组复合菌系的最高纤维素降解酶活力均处于22.94~25.58 U/mL范围之间,复合菌系S1是由4株纤维素降解酶活力最高的中心菌株组合而成的,最高纤维素降解酶活力为22.94 U/mL;复合菌系S2、S3和S4是在中心菌株的基础上添加1种菌株构建的,最高纤维素降解酶活力分别为23.18 U/mL、24.32 U/mL和23.82 U/mL;复合菌系S5、S6和S7是在中心菌株的基础上添加2种菌株构建的,最高纤维素降解酶活力分别为25.06 U/mL、24.68 U/mL和23.04 U/mL;复合菌系S8是包含全部7种菌株构成的复合菌系,最高纤维素降解酶活力为25.58 U/mL。结果表明,相比于复合菌系S1,其他复合菌系的纤维素降解酶活力均有一定提高,其中复合菌系S8的最高纤维素降解酶活力最高。
有研究发现,里氏木霉具有一套完整的酶系能降解纤维素为可溶性糖,且产纤维素酶量高、稳定性好、适应性强[29]。在农业上,木霉属等菌株也能提高种子发芽率,促进植物生长和开花,还可以帮助改善根系,提高作物产量[30]。产紫青霉:青霉属真菌不仅能分泌比较全的降解天然木质纤维素的酶系,而且较木霉纤维素酶能产较多β-葡萄糖苷酶[31]。杆菌状链霉菌,链霉菌属的孢子生存能力强,其菌丝容易穿透秸秆纤维,从而使秸秆纤维降解速度得到提高[32]。杆菌状链霉菌能分泌多类生长素促进植物生长,还能分解固化的有机质、有机磷和营养元素,可以补充土壤有机质,改善土壤理化性质[33]。解淀粉芽孢杆菌可以分泌抗菌物质来抑制植物病原菌同时可以抑制病虫害的发生从而提高植物的抗逆性。同时这类微生物可以分泌多种具有生物功能活性的次生代谢产物,包括抗菌、竞争抑制病原菌生长或诱导植物产生系统抗病性等作用[34]。短短芽孢杆菌广泛分布于植物根际,其分泌的次级代谢产物具有抑制植物病原菌及病原细菌的作用,在生物防治上拥有广阔的应用价值[35];贝莱斯芽孢杆菌通过分泌抑菌活性代谢物来抑制立枯丝核菌、辣椒疫霉和尖刀镰孢菌等植物病原菌,能够有效地防控多种植物病害[36];巨大芽孢杆菌是溶磷菌,能溶解土壤作物中不易吸收的钙磷、铁磷、铝磷等化合物,促进土壤中无效磷的溶解及利用的特点[37]。此外,巨大芽孢杆菌能分泌大量高活性的几丁质酶,抑制植物病原菌,加快根瘤菌的生长,促进作物根系发育,对作物因重茬导致的生理病害有极强的预防效果[37]。由此可见,这7种菌均对植物生长具有促进作用,且部分菌株具有抑制植物病原菌的效果。因此,最终确定了由巨大芽孢杆菌(Priestia megaterium)S381-8、短短芽孢杆菌(Brevibacillus brevis)S381-7、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)S381-3、贝莱斯芽孢杆菌(Bacillus velezensis)S381-4、杆菌状链霉菌(Streptomyces bacillaris)S381-2、里氏木霉(Trichoderma reesei)S876-2和产紫青霉(Penicillium purpurogenum)S876-6,组成的高效秸秆纤维素降解复合菌系。
2.4 玉米秸秆形态分析
对未处理、经里氏木霉S876-2单菌株和复合菌S8处理的玉米秸秆进行电镜扫描分析,结果见图5。

图5 玉米秸秆的扫描电镜结果
Fig.5 Scanning electron microscopy images of corn straw
A为未处理过的玉米秸秆;B为经过里氏木霉S876-2处理过的玉米秸秆;C为经过复合菌剂S8处理过的玉米秸秆。
由图5可知,未处理的玉米秸秆表面比较光滑平整,纤维组织排列有序,结构紧密,无明显的破损和孔隙;经里氏木霉S876-2单菌株处理后的玉米秸秆表面凹凸不平,疏松多孔,有大量缝隙和裂纹,表明微生物大量生长繁殖并依附在秸秆表面,且微生物能够分解破坏纤维素复杂的结构,使得内部的纤维素结构暴露,更利于微生物的分解利用。经复合菌系S8处理后的玉米秸秆比里氏木霉S876-2单菌株处理后的玉米秸秆的表面缝隙和裂纹更大,呈现出完全的蜂窝状,表明复合菌对于秸秆的降解比单一菌的效果更好。
3 结论
本研究从玉米秸秆中共分离、筛选、鉴定得到7株纤维素降解能力较高的优良菌株,分别为巨大芽孢杆菌(Priestia megaterium)S381-8、短短芽孢杆菌(Brevibacillus brevis)S381-7、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)S381-3、贝莱斯芽孢杆菌(Bacillus velezensis)S381-4、杆菌状链霉菌(Streptomyces bacillaris)S381-2、里氏木霉(Trichoderma reesei)S876-2、产紫青霉(Penicillium purpurogenum)S876-6,各菌株间无拮抗性。以菌株S876-6、S876-2、S381-3、S381-2为中心菌株,协同菌株S381-7、S381-4、S381-8(各菌株菌悬液体积比1∶1)混合构建的复合菌系S8纤维素降解酶活力(25.58 U/mL)最高,并且经其处理后的秸秆表面物理结构更为疏松多孔,表明该复合菌系具有良好的秸秆降解潜力。
[1]马欣雨,孙丽娜,卢珊,等.秸秆降解菌的筛选及对秸秆的降解效果[J].生态学杂志,2020,39(4):662-673.
[2]高利伟,马林,张卫峰,等.中国作物秸秆养分资源数量估算及其利用状况[J].农业工程学报,2009,25(7):173-179.
[3]隋雨含,赵兰坡,赵兴敏.玉米秸秆焚烧对土壤理化性质和腐殖质组成的影响[J].水土保持学报,2015,29(4):316-320.
[4]陈相雪.木质纤维素预处理工艺及利用其生产秸秆乙醇的研究[D].南京:南京理工大学,2022.
[5]孙丽娜,马欣雨,刘克斌,等.秸秆的微生物处理处置及强化技术研究进展[J].沈阳大学学报(自然科学版),2018,30(3):188-195.
[6]朱金霞,孔德杰,尹志荣.农作物秸秆主要化学组成及还田后对土壤质量提升影响的研究进展[J].北方园艺,2020(5):146-153.
[7]MATHEWS S L,PAWLAK J,GRUNDEN A M.Bacterial biodegradation and bioconversion of industrial lignocellulosic streams[J].Appl Microbiol Biot,2015,99(7):2939-2954.
[8]ZHAO S C,LI K J,ZHOU W,et al.Changes in soil microbial community,enzyme activities and organic matter fractions under long-term straw return in north-central China[J].Agr Ecosyst Environ,2016,216:82-88.
[9]付丽,朱红雨,杜明楠,等.秸秆降解菌株的筛选、鉴定及生物学特性研究[J].中国农业大学学报,2018,23(12):39-49.
[10]袁宏,钱丹惠,叶文玲,等.一株促生秸秆降解菌的分离与鉴定[J].微生物学杂志,2023,43(1):77-84.
[11]韩月颖,张喜庆,曲云鹏,等.一株低温木质素降解菌的筛选、产酶优化及酶学性质[J].微生物学通报,2021,48(10):3700-3713.
[12]王海滨,韩立荣,冯俊涛,等.高效纤维素降解菌的筛选及复合菌系的构建[J].农业生物技术学报,2015,23(4):421-431.
[13]WANG W D, YAN L, CUI Z J, et al.Characterization of a microbial consortium capable of degrading lignocellulose[J].Bioresource Technol,2011,102(19):9321-9324.
[14]QINGGEER,GAO J L,YU X F,et al.Screening of a microbial consortium with efficient corn stover degradation ability at low temperature[J].J Integr Agr,2016,15(10):2369-2379.
[15]张必周,高聚林,于晓芳,等.玉米秸秆低温降解菌的分离与鉴定及复配菌降解效果研究[J].玉米科学,2020,28(6):168-175.
[16]张晶,钱玉婷,曲萍,等.秸秆降解放线菌的分离鉴定及其降解特性[J].中国农业大学学报,2023,28(12):75-83.
[17]王梦柯.秸秆堆肥及其对盐碱土壤特性及植物生长的影响[D].长春:东北师范大学,2020.
[18]刘国辉,买文选,田长彦.施用有机肥对盐碱土的改良效果:Meta分析[J].农业资源与环境学报,2023,40(1):86-96.
[19]沈萍,范秀容.《微生物学实验》[M].北京:高等教育出版社,2002:214-216.
[20]徐明岗,于荣,孙小凤,等.长期施肥对我国典型土壤活性有机质及碳库管理指数的影响[J].植物营养与肥料学报,2006(4):459-465.
[21]杨洪坤,周保平,王亚明,等.盐分对作物生长及氮素营养的影响研究[J].新疆农垦科技,2016,39(10):44-47.
[22]张雅贞.有机无机肥配施对土默川平原盐碱土改良效果研究[D].呼和浩特:内蒙古农业大学,2020.
[23]石祖梁,李想,王久臣,等.中国秸秆资源空间分布特征及利用模式[J].中国人口资源与环境,2018,28(S1):202-205.
[24]曹志宏,郝晋珉,梁流涛.作物秸秆对中国居民食物安全的支撑能力[J].农业工程学报,2009,25(4):179-184.
[25]李晨辉.农作物秸秆还田技术推广中的问题与解决措施[J].当代农机,2024(2):37-38.
[26]BRUNECKY R,DONOHOE B S,YARBROUGH J M,et al.The multi domain Caldicellulosiruptor bescii CelA cellulase excels at the hydrolysis of crystalline cellulose[J].Sci Rep,2017,7:9622.
[27]赵玉萍,方芳.应用生物化学实验[M].南京:东南大学出版社,2013:48-62.
[28]杨磊,许伟,颜子怡,等.车前子壳诱导木聚糖酶与阿拉伯糖苷酶协同制备[J].中国酿造,2023,42(1):92-97.
[29]张家松,董宏标,段亚飞,等.里氏木霉产纤维素酶的研究及其应用进展[J].南方水产科学,2014,10(5):99-104.
[30]BAYER E A, MORAG E, WILCHEK M, et al.Cellulosome do-mains for novel bio-technological application[J].Carbohydr Bioeng,1995,10:251-260.
[31]孙宪昀,曲音波,刘自勇.青霉木质纤维素降解酶系研究进展[J].应用与环境生物学报,2007(5):736-740.
[32]赵明文,史玉英.纤维分解菌群对水稻秸秆田间腐熟效果的研究[J].江苏农业科学,2000(1):51-53.
[33]姚锦爱,黄鹏,赖宝春,等.链霉菌ZZSP-7的鉴定及其对草莓炭疽病的防效[J].中国生物防治学报,2021,37(1):178-183.
[34]刘润泽,王世伟,王卿惠,等.解淀粉芽孢杆菌酶系及其应用研究进展[J].高师理科学刊,2019,39(3):70-75.
[35]杜杰,蔡海林,黄彬彬,等.短短芽孢杆菌X23中edeB基因的克隆、原核表达及转录时相分析[J].激光生物学报,2023,32(2):146-152.
[36]邓安玲,常若葵,李卓然,等.贝莱斯芽孢杆菌挥发性有机化合物对番茄灰葡萄孢的抑制及活性组分分析[J/OL].植物病理学报,1-14[2024-08-30].https://doi.org/10.13926/j.cnki.apps.001654.
[37]潘纪源,董庆龙,温海彬,等.巨大芽孢杆菌菌剂对苹果产量、品质及土壤微生物的影响[J].园艺学报,2023,50(11):2453-2465.