酿酒酵母(Saccharomyces cerevisiae)是发酵生产中最常用的一类微生物,在食品加工方面起着重要作用。细胞膜是由磷脂构成的富有弹性的半透性膜,可以通过调控和筛选各种物质的出入,以维持细胞内环境的相对稳定和细胞的正常代谢[1]。因此,酵母细胞膜的通透性、流动性和完整性等特性会影响细胞与外界环境进行信息、能量和物质的交换,进而影响酵母发酵的进程[2-3]。郭红等[4]研究表明,酿酒酵母在高糖压力下会通过下调细胞壁和细胞膜成分相关的基因进而造成酿酒酵母细胞壁和细胞膜的损伤。杨金龙等[5]则证明高盐浓度下细胞膜的流动性更高,且不同盐离子对细胞膜的流动性影响也不同。李清亮等[6]研究发现,以氮气和二氧化碳为介质的压力下细胞膜结构完整性受到损伤,细胞膜通透性增大。而在氧化条件下,酵母细胞膜的通透性和流动性降低,产生跨膜梯度,保护细胞免受氧化胁迫的伤害[7]。
原花色素(proanthocyanidins,PAS)称为缩合单宁,是一类具有C6-C3-C6基本构架的一类多酚化合物的总称。前期研究表明,原花色素可以保护酵母细胞,并促进其代谢能力,缩短发酵周期[8-9]。李欣洋等[10]研究表明,茶多酚对自由基引起的细胞膜脂质过氧化损伤有保护作用。杨益等[11]观察两种植物多酚表没食子儿茶素没食子酸酯和单宁酸在腺病毒感染宿主细胞过程中对宿主细胞膜流动性的改变具有干预作用,可以抑制病毒感染。然而,原花色素对酵母细胞的保护促进作用是否与对细胞膜的影响有关还未见报道,因此有必要对其进行研究。
该文以酿酒酵母(Saccharomyces cerevisiae)为研究对象,在前期研究基础上考察原花色素对酵母细胞膜特性包括细胞膜完整性、通透性以及流动性产生的影响。从酵母细胞膜特性的角度揭示原花色素影响酵母细胞的代谢的机制,更加系统地阐述原花色素对酵母细胞的作用,以促进酵母细胞的广泛应用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)BH8,分离自红葡萄品种“北红”葡萄汁的自然发酵液。
1.1.2 试剂
原花色素:国药集团化学试剂有限公司、二乙酸荧光素(fluorescein diacetate,FDA)、碘化丙啶(propidium iodine,PI)、盐酸、氨水、焦性没食子酸、乙醚、石油醚、乙醇(95%)、氢氧化钠、15%三氟化硼甲醇溶液、无水硫酸钠、氯化钠(均为分析纯):上海麦克林生化科技有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:蛋白胨20 g/L,葡萄糖20 g/L,酵母膏10 g/L,溶于1 000 mL水中,121 ℃,15 min灭菌后使用。
模拟培养基:是一种模拟标准葡萄汁的化学成分确定的培养液,(每100 mL)MnSO4·7H2O 400 mg,GuSO4·5H2O 100 mg,KI 100 mg,CoCl2·6H2O 40 mg,(NH4)6Mo7O24·4H2O 100 mg,H3BO3 100 mg,VH 4 mg,VB1 100 mg,VB6 100 mg,烟酸100 mg,泛酸100 mg,对氨基苯甲酸100 mg,棕榈酸100 mg,棕榈烯酸20 mg,硬脂酸300 mg,油酸50 mg,亚油酸50 mg,亚麻酸20 mg,D-葡萄糖10 g,D-果糖10 g,MgSO4 20 mg,KH2PO4 200 mg,肌醇30 mg,L-酒石酸300 mg,L-柠檬酸30 mg,L-苹果酸30 mg,(NH4)2SO4 30 mg,天冬氨酸60 mg,pH值3.5。培养基过膜121 ℃,15 min灭菌后使用。
1.2 仪器与设备
BX53+DP80研究级正置荧光显微镜:日本奥林巴斯公司;Cary 60 UV-Vis紫外可见分光光度计:美国安捷伦公司;DDS-307A电导率仪:上海雷磁仪器有限公司;TSQ8000气相色谱串联四级杆质谱联用仪:美国赛默飞公司。
1.3 方法
1.3.1 样品处理
酵母菌株从斜面上接到YPD培养基中进行有氧预培养至指数期进行活化,将活化后的酵母以1%的接种量转接到含有不同添加量的原花色素(0、0.5 g/L、1.0 g/L)的模拟葡萄汁发酵培养基中,于培养箱中28 ℃恒温培养,每4 h取样。
1.3.2 酿酒酵母生长特性的测定
采用美兰染色剂法[12]。每4 h取样,取相同体积的1%的菌液与1 g/L美蓝染色液混合均匀,利用血球计数板计活菌数。
1.3.3 酿酒酵母发酵性能测定
采用二氧化碳失重法[13]测定酿酒酵母的发酵性能,发酵瓶每天用电子天平称质量并记录。连续3 d质量差值低于0.02 g时,发酵结束,记录发酵瓶的质量。
1.3.4 细胞膜完整性的测定
参考JAMBOR T等[14]的方法,取样品1 mL于1.5 mL离心管中,离心机5 000 r/min离心10 min。离心后的样品倒掉上清液,用蒸馏水润洗3次,加入FDA溶液20 μL,振荡混合均匀后加入60 μL PI溶液和920 μL无菌水,放入4 ℃恒温箱避光保存5 min。5 min后在5 000 r/min的条件下离心10 min,蒸馏水润洗3次,加1 mL蒸馏水振荡摇匀后涂片,用荧光显微镜观察拍照记录。
1.3.5 细胞膜通透性的测定
取1 mL样品于10 mL离心管中,加入2 mL蒸馏水后振荡摇匀,将电导率仪探头浸入样品中,待读数稳定后记录数据用以测量溶液电导率,来反映样品细胞膜的通透性。
1.3.6 细胞膜流动性的测定
前处理条件:参考NG T W等[15]的方法。取1 mL样品于2 mL离心管中在5 000 r/min离心10 min,弃上清液后用8.5 g/L无菌生理盐水洗涤3次。向沉淀加入1.5 mL浓度为1 mol/L甲醇钠溶液剧烈振荡5 min,置于4 ℃冰箱中静置10 min。之后转入5 mL离心管中,加入1 mL的正己烷溶液,振荡2 min,静置5 min,在6 000 r/min条件下离心5 min,取上清液于进样瓶。
气相色谱条件:采取CROMPTON M J等[16]的方法,用气相色谱串联质谱的方法分析细胞膜脂肪酸的组成与含量,色谱柱采用hp88毛细管柱(0.25 mm×100 m×0.25 μm),载气为高纯氦气(He),进样量为1 μL,不分流进样。进样口温度240 ℃,柱流速1 mL/min,柱起始温度为160 ℃,以5 ℃/min升温至190 ℃保持5 min,再以2 ℃/min升温至220 ℃,保持5 min。
质谱条件:电子电离(electron ionization,EI)源,传输线温度280 ℃,离子源温度250 ℃,四级杆温度150 ℃,电子轰击能量70 eV,全扫描模式,扫描范围为40~650 amu。
定性定量方法:通过美国国家标准技术研究所(national institute of standards and technology,NIST)05质谱库检索结合文献报道的保留指数和香气物质的分子式和物质结构图进行定性分析。通过每种物质在质谱峰中所占峰面积的百分比来计算出相应物质的相对含量。
1.3.7 脂肪酸流动指数的计算
1.3.8 丙二醛含量的测定
丙二醛(malondialdehyde,MDA)的测定参照HERDEIRO R S等[17]的方法,取样5 mL后离心,收获的细胞用预冷的50 mmol/L磷酸缓冲液(pH=7.0)洗涤两次,并在4 ℃、12 000 r/min离心10 min。收获的细胞悬浮在1.5 mL 100 g/L三羧酸(tricarboxylic acid,TCA)中,加入适量的酸洗玻璃珠(450~500 μm),用超声破碎仪(400 W)在冰水浴(0 ℃)中进行破碎。之后于4 ℃、12 000 r/min离心20 min,取上清液2 mL(对照使用2 mL蒸馏水),加入2 mL 6 g/L硫代巴比妥酸(thiobarbituric acid,TBA),混匀于沸水浴上反应10 min,迅速冷却后于4 ℃、12 000 r/min,离心20 min,取上清液测定波长450 nm、532 nm、600 nm下的吸光度值,以0.6%TBA溶液为空白,计算MDA含量。MDA含量计算公式如下[18]:
式中:A450,A532,A600分别为上清液在波长450 nm,532 nm和600 nm处的吸光度值。
1.3.9 数据处理
采用Microsoft Excel 2010和Origin 2020软件进行数据统计分析并作图。
2 结果与分析
2.1 原花色素对酿酒酵母生理活性的影响
原花色素对酿酒酵母生长的影响见图1A。如图1A所示,添加原花色素的发酵体系初期,酵母菌开始会被原花色素抑制,可能是由于原花色素可以螯合金属离子,干扰细胞前期生长必需的金属离子,从而抑制其生长,因此,酵母生长量低于对照组。但菌体适应后会迅速开始繁殖,其酵母菌数会超过空白组,且添加原花色素组酵母生存时间长于空白组。随着原花色素添加量越大,细胞的数量就越多,其生存也时间越长,由此说明原花色素的添加可以促进酿酒酵母的生长、维持细胞的活性。
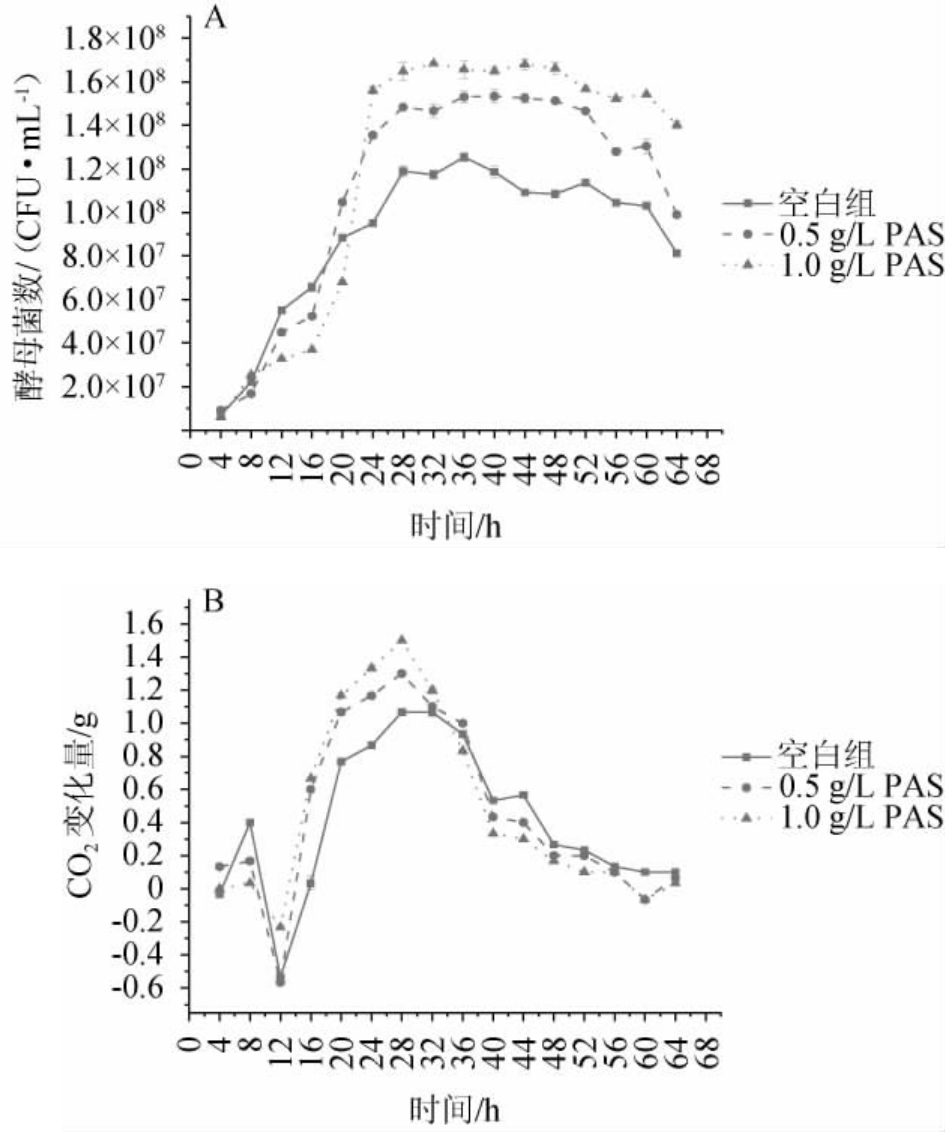
图1 不同原花色素添加量对酿酒酵母生理活性的影响
Fig.1 Effect of different proanthocyanidins addition on physiological activities of Saccharomyces cerevisiae
CO2是酿酒酵母发酵代谢产物的主要产物之一,其产生速度可以反应出酵母各个阶段的代谢情况,原花色素对CO2变化量的影响见图1B。由图1B可知,在发酵的前12 h内CO2变化量均为负值,这可能是由于酵母繁殖有氧呼吸造成的质量增加高于发酵初期CO2生成量。12 h后空白组与添加了原花色素组在CO2的产生速率出现了明显差别,添加了原花色素组产生CO2的速率高于空白组,且原花色素添加量越高,CO2的变化量越大。这是因为酵母细胞在原花色素作用下代谢速度提高,CO2产生速度增加,且这一作用与添加量正相关。
2.2 原花色素对细胞膜完整性的影响
二乙酸荧光素(FDA)可以自由出入完整的细胞膜,进入细胞膜后会被细胞内的脂酶分解[19],生成荧光素,积累在细胞膜内,使活细胞在荧光显微镜下发出绿色荧光;在细胞膜失去其完整性之后,碘化丙啶(PI)会进入细胞并与细胞内的核酸类物质相结合,在荧光显微镜下发出红色荧光[20-21]。黄色荧光是因为部分细胞的细胞膜失去了其完整性,导致部分细胞可被FDA和PI同时染色。因此,利用FDA与PI对酿酒酵母细胞进行联合染色可以测定细胞膜的完整性。不同添加量的原花色素对酿酒酵母培养至48 h细胞膜的影响结果见图2。
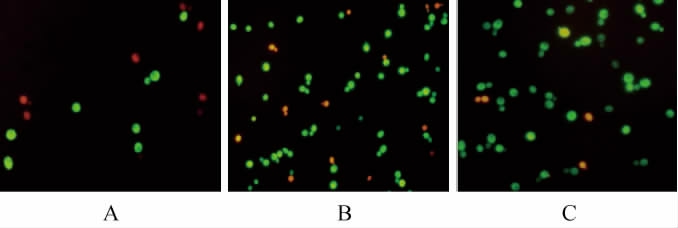
图2 不同原花色素添加量对酿酒酵母细胞膜完整性的影响
Fig.2 Effect of different proanthocyanidins addition on cell membrane integrities of Saccharomyces cerevisiae
A:空白组;B:添加0.5 g/L的PAS;C:添加1.0 g/L的PAS。
由图2可知,与对照相比,添加原花色素处理后的细胞数目增多,且染色后绿色细胞的比例增加(空白组、0.5 g/L PAS、1.0 g/L PAS绿色细胞的比例分别为61.5%、78.2%、93.3%),说明细胞膜的完整性更好。由此说明原花色素在维持细胞膜的完整性方面有一定的积极作用。微生物细胞膜完整性与其疏水基相互作用有关,即疏水基相互作用对于维持细胞膜稳态具有重要作用[22]。当环境胁迫因子对细胞膜疏水核心进行破坏,造成疏水核心极性化[23-24],从而削弱细胞膜的完整性,引发细细胞内容物外泄。因此,原花色素对细胞膜完整性的积极作用可能与其维持细胞膜疏水基相互作用有关。
2.3 原花色素对细胞膜通透性的影响
细胞膜是细胞的最外层屏障,可以选择性的控制物质进出细胞,改变发酵液的电导率[25]。因此,测定发酵液的电导率可以反映细胞膜结构的通透性。发酵液的电导率根据其中的导电物质不断变化而随之变化。在酵母的生长过程中细胞为合成自身物质会不断吸收环境中的各种无机离子,进而导致电导率下降,但同时细胞又会向发酵液分泌有机酸等代谢物质从而使电导率增加。不同添加量的原花色素对电导率的影响结果见图3。

图3 不同原花色素添加量对电导率的影响
Fig.3 Effect of different proanthocyanidins addition on electrical conductivities
由图3可知,在发酵初始各发酵体系电导率不同,这可能是原花色素的添加影响了初始电导率。在发酵过程中,不同发酵体系的电导率均呈现下降的趋势,这可能与乙醇体积分数有关。乙醇属于非电解质,随着发酵进行,乙醇体积分数增加,导致溶液的电导率下降。在56 h处电导率突然止降,出现上升,这可能是因为酒精度基本达到最高值,大部分细胞死亡,细胞膜上的离子泵递送能力受到破坏,细胞内各种离子流出到发酵液中。
比较不同发酵体系中的电导率,发现随着原花色素添加量的升高,电导率的下降趋势越明显。这可能是由于含有原花色素的发酵体系中,酿酒酵母更快速地从外界吸收无机离子用于合成自身物质。同时,乙醇的含量升高更快也是导致电导率下降幅度大的原因之一。所以原花色素的添加量可以提高细胞膜的通透性,且添加量越大作用越明显。
2.4 原花色素对细胞膜流动性和脂肪酸含量的影响
2.4.1 对细胞膜流动性的影响
细胞膜在维持细胞结构的完整性以及细胞的能量传导等方面发挥着极其重要的作用,而细胞膜中脂肪酸的分布变化是细胞抵抗外界恶劣环境胁迫的一种应激反应,细胞膜中脂肪酸的组成对于维系细胞的正常生长、代谢以及内环境的稳定性方面有着极为重要的影响。细胞膜的流动指数(U/S)可以作为环境胁迫的指标[26],U/S值越大,脂肪酸链排列就更为紧密,有利于脂类和蛋白通过疏水作用结合,膜环境形成“凝胶状”,细胞膜的流动性就越强,膜的稳定性也随之增加。不同添加量原花色素对细胞膜流动指数的影响结果见图4。
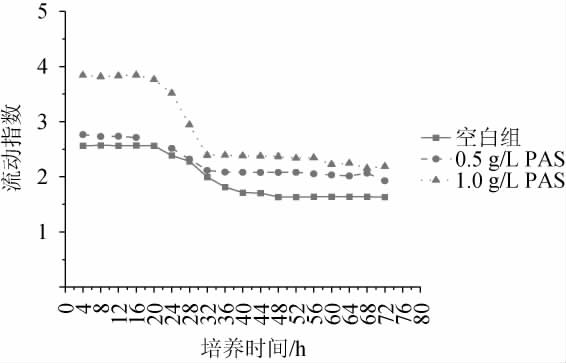
图4 不同原花色素添加量对流动指数的影响
Fig.4 Effect of different proanthocyanidins addition on flow indexes
由图4可知,随着培养时间的延长,流动指数逐渐下降,这是因为随着发酵的进行,细胞膜中大部分不饱和脂肪酸的含量下降,而饱和脂肪酸的含量上升。比较不同发酵体系中细胞膜的流动指数,发现原花色素可以提高细胞膜的流动性,且添加量越高流动指数越大,0.5 g/L和1.0 g/L原花色素添加量组的流动指数优于对照组,而1.0 g/L原花色素添加量组的流动指数高于其他两组,证明随着原花色素添加量的增加会使细胞膜的流动性变好,因此添加原花色素的实验组细胞的流动指数优于对照组,且1.0 g/L原花色素作用更明显。这可能与原花色素可以有效地提高不饱和脂肪酸的含量有关。说明原花色素在增强细胞膜的流动性方面的积极作用,可以帮助酵母细胞抵抗外界不良环境的胁迫,稳定菌体自身的正常生理代谢。
2.4.2 对脂肪酸含量的影响
酿酒酵母能够适应发酵环境依赖于细胞膜的流动性,细胞膜中不饱和脂肪酸是维持细胞膜流动性能的关键分子,增加不饱和脂肪酸的质量分数,可以降低脂膜的熔点[27],提高细胞膜的流动性,增强对极端环境的适应性。分析细胞膜的脂肪酸组成,主要由丁酸、十三碳酸、棕榈油酸、花生酸4种饱和脂肪酸和肉豆蔻烯酸、顺-10-十五碳一烯酸、棕榈油酸、反油酸、反亚油酸、顺-5,8,11,14,17-二十碳五烯酸和顺-4,7,10,13,16,19-二十二碳六烯酸共7种不饱和脂肪酸组成。其中,不饱和脂肪酸是酿酒酵母细胞膜的主要成分,占70%左右。各脂肪酸的含量变化见图5。
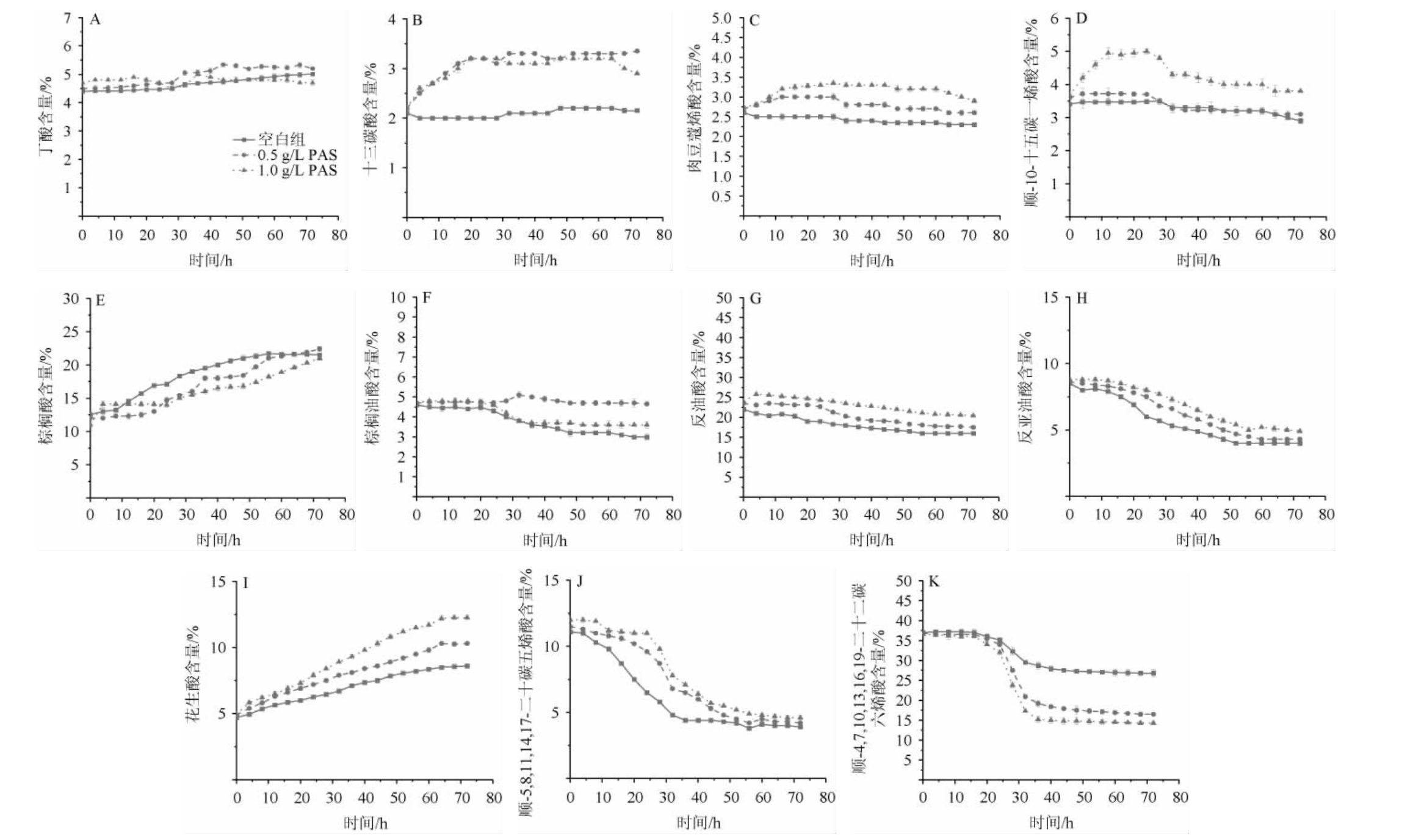
图5 不同原花色素添加量对11种脂肪酸含量的影响
Fig.5 Effects of different proanthocyanidins addition on 11 kinds of fatty acids contents
由图5可知,发酵过程中各体系中丁酸和肉豆蔻烯酸的比例基本不变,十三碳酸、棕榈酸和花生酸的比例上升,而其他脂肪酸的比例均表现出下降的趋势。比较原花色素对脂肪酸分布的影响,丁酸的含量基本不受原花色素的影响,而在含有原花色素的发酵体系中棕榈酸和顺-4,7,10,13,16,19-二十二碳六烯酸的含量,其他脂肪酸的含量均因原花色素的处理表现出上升的趋势,其中花生酸含量的变化最为明显,空白组在发酵过程中花生酸的含量增加了3%,1.0 g/L原花色素组增加了7%;在发酵初期1.0 g/L原花色素顺-10-十五碳一烯酸的含量变化比较明显,在发酵20 h后顺-10-十五碳一烯酸的含量变化较为平缓。细胞膜中不饱和脂肪酸对酿酒酵母有关键作用,加入原花色素会使部分脂肪酸含量增加,从而影响脂膜的熔点,使细胞膜的流动性增加,增强酿酒酵母对极端环境的适应性。
2.5 丙二醛含量的测定
MDA是膜脂过氧化产物,其含量多少是膜受损伤程度的标志[28-29],原花色素对MDA含量的影响结果见图6。由图6可知,从整体来看,加入原花色素的发酵体系中MDA的含量略低于空白对照组,除发酵第1天外,其余发酵时间内0.5 g/L原花色素组MDA的含量比1.0 g/L原花色素组MDA的含量高,在发酵第3天,空白组与加入1.0 g/L原花色素组相差3.4 μmol/L,在第5天1.0 g/L原花色素组MDA含量最低,为1.3 μmol/L,且原花色素添加量越高MDA含量越低。这说明加入原花色素可降低活性氧对细胞膜不饱和脂肪酸的过氧化,减少氧化胁迫对细胞膜造成的伤害。
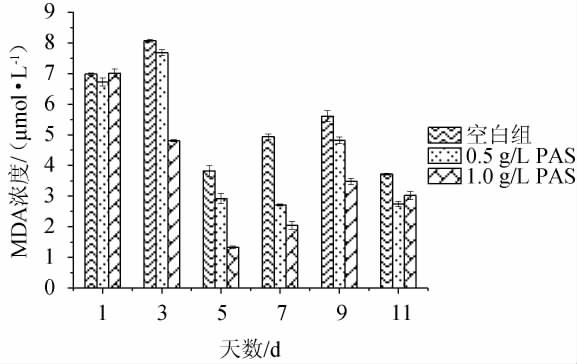
图6 不同原花色素添加量在氧化胁迫中对胞内丙二醛含量的影响
Fig.6 Effects of different proanthocyanidins addition on malondialdehyde contents in cells under oxidative stress
3 结论
酿酒酵母细胞膜特性的变化与外界环境的优劣息息相关,细胞膜特性的变化还会影响到细胞的活性。本实验在前期研究的基础上试图从细胞膜特性的角度分析原花色素可以保护和促进酿酒酵母的生长和代谢的原因。结果表明添加原花色素后细胞膜的完整性、通透性以及流动性都有所增加,这可帮助细胞抵抗外界不良环境的胁迫,稳定菌体自身的正常生理代谢。另外,通过分析膜脂的过氧化产物,发现添加原花色素降低了胁迫条件下MDA含量。这说明原花色素可以提高酵母在发酵过程中对氧化胁迫的耐受性,从而提高整个发酵过程中酵母活菌数和发酵末期细胞存活率,进而促进酵母的糖代谢。
[1]MASHANOV G I,NENASHEVA T A,MASHANOVA A,et al.Heterogeneity of cell membrane structure studied by single molecule tracking[J].Faraday Discuss,2021,232:358-374.
[2]KHOO K S,CHIA W Y,WANG K,et al.Development of proton-exchange membrane fuel cell with ionic liquid technology[J].Sci Total Environ,2021,793:148705.
[3]ZHAO N, SHI Z, GIRARD F.Superior proton exchange membrane fuel cell (PEMFC) performance using short-side-chain perfluorosulfonic acid(PFSA)membrane and ionomer[J].Materials,2021,15(1):78.
[4]郭红,邱月,魏建平,等.酿酒酵母细胞壁和细胞膜应对高渗胁迫机制研究[J].农业机械学报,2020,51(6):346-352.
[5]杨金龙,朱圆圆,朱均均,等.盐类对树干毕赤酵母乙醇发酵及其细胞膜流动性的影响[J].生物学杂志,2015,32(6):60-64.
[6]李清亮,贾士儒,陈娜,等.温度和压力对面包酵母细胞膜通透性的影响[J].食品与发酵工业,2013,39(8):32-36.
[7]孙廷丽,施庆珊,欧阳友生,等.过氧化氢诱导酿酒酵母细胞膜透性和组成的变化[J].生物工程学报,2009,25(12):1887-1891.
[8]LI J, ZHU K, ZHAO H.Transcriptome analysis reveals the protection mechanism of proanthocyanidins for Saccharomyces cerevisiae during wine fermentation[J].Sci Rep,2020,10(1):6676.
[9]MEKOUE NGUELA J,SIECZKOWSKI N,ROI S,et al.Sorption of grape proanthocyanidins and wine polyphenols by yeasts,inactivated yeasts,and yeast cell walls[J].J Agr Food Chem,2015,63(2):660-670.
[10]李欣洋,郭磊,刘亭丽,等.茶多酚对红细胞膜氧化损伤保护作用的研究[J].包头医学院学报,2019,35(10):62,130.
[11]杨益,苏文莉,孙走南,等.植物多酚对5型腺病毒感染后宿主细胞膜流动性的影响[J].现代生物医学进展,2015,15(18):3443-3447.
[12]PARKER R A,GABRIEL K T,GRAHAM K,et al.Validation of methylene blue viability staining with the emerging pathogen Candida auris[J].J Microbiol Meth,2020,169:105829.
[13]KWAK H,SHIN S,KIM J,et al.Protective coating of strawberries with cellulose nanofibers[J].Carbohyd Polym,2021,258:117688.
[14]JAMBOR T,ARVAY J,TVRDA E,et al.The effect of Apium graveolens L., Levisticum officinale and Calendula officinalis L.on cell viability,membrane integrity, steroidogenesis, and intercellular communication in mice leydig cells in vitro[J].Physiol Res,2021,70(4):615-625.
[15]NG T W,CHAN W L,LAI K M.Influence of membrane fatty acid composition and fluidity on airborne survival of Escherichia coli[J].Appl Microbiol Biot,2018,102(7):3327-3336.
[16]CROMPTON M J,DUNSTAN R H.Evaluation of in-situ fatty acid extraction protocols for the analysis of staphylococcal cell membrane associated fatty acids by gas chromatography[J].J Chromatogr B,2018,1084:80-88.
[17]HERDEIRO R S,PEREIRA M D,PANEK A D,et al.Trehalose protects Saccharomyces cerevisiae from lipid peroxidation during oxidative stress[J].BBA-Bioenergetics,2006,1760(3):340-346.
[18]曹建康,赵玉梅,姜微波.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2013:154-155.
[19]JONIEC J,G  SIOR J,VOLOSHANSKA S,et al.Evaluation of the effectiveness of land reclamation based on microbiological and biochemical parameters assessed in an ozokerite mining and processing landfill sown with Trifolium hybridum and Dactylis glomerata[J].J Environ Manage,2019,242:343-350.
SIOR J,VOLOSHANSKA S,et al.Evaluation of the effectiveness of land reclamation based on microbiological and biochemical parameters assessed in an ozokerite mining and processing landfill sown with Trifolium hybridum and Dactylis glomerata[J].J Environ Manage,2019,242:343-350.
[20]KUMAR R,SANEJA A,PANDA A K.An annexin V-FITC-propidium iodide-based method for detecting apoptosis in a non-small cell lung cancer cell line[J].Methods Mol Biol,2021,2279:213-223.
[21]LI R,LI Q,MA L.Modified pseudo-schiff propidium iodide for staining the shoot apical meristem in arabidopsis[J].Bio Protocol,2023,13(9):e4672.
[22]KONUK H B,ERGÜDEN B.Phenolic-OH group is crucial for the antifungal activity of terpenoids via disruption of cell membrane integrity[J].Folia Microbiol,2020,65(4):775-783.
[23]ICHIHASHI K, UMEZAWA M, UEYA Y, et al.Effect of the enantiomeric structure of hydrophobic polymers on the encapsulation properties of a second near infrared(NIR-II)fluorescent dye for in vivo deep imaging[J].RSC Adv,2022,12(3):1310-1318.
[24]ROTERMAN I, STAPOR K, FABIAN P, et al.The functional significance of hydrophobic residue distribution in bacterial beta-barrel transmembrane proteins[J].Membranes,2021,11(8):580.
[25]RAFIEIOLHOSSEINI N,EJTEHADI M R.Thermal conductivity of the cell membrane in the presence of cholesterol and amyloid precursor protein[J].Phys Rev E,2020,102(4-1):042401.
[26]MILOVANOVA T, CHATTERJEE S, HAWKINS B J, et al.Caveolae are an essential component of the pathway for endothelial cell signaling associated with abrupt reduction of shear stress[J].BBA-Bioenergetics,2008,1783(10):1866-1875.
[27]DE SARRAU B,CLAVEL T,ZWICKEL N,et al.Unsaturated fatty acids from food and in the growth medium improve growth of Bacillus cereus under cold and anaerobic conditions[J].Food Microbiol, 2013, 36(2):113-122.
[28]PENG J, WANG K, FENG T, et al.The effect of (1S,2R-((3-bromophenethyl)amino)-N-(4-chloro-2-trifluoromethylphenyl)cyclohexane-1-sulfonamide)on Botrytis cinerea through the membrane damage mechanism[J].Molecules,2019,25(1):94.
[29]ZHANG Z,ZHAO Y,CHEN X,et al.Effects of cinnamon essential oil on oxidative damage and outer membrane protein genes of Salmonella enteritidis cells[J].Foods,2022,11(15):2234.