清香型白酒作为中国传统典型白酒之一,因其清香爽口的感官特征而在中国广受欢迎[1]。近两年,清香型白酒产业呈现快速发展态势,品质不断提升,并且产品线丰富,同时价格带向上突破,品牌和品类关注度的提高有目共睹。清香型白酒销售额的高速增长以及高端产品的出现更显示出其未来复兴之路值得期待[2]。
清香型白酒采用中温大曲为糖化发酵剂,以高粱为原料,经清蒸清烧、地缸式发酵而成[3]。其中,大曲作为一种复杂的糖化发酵剂,对白酒的风格和品质至关重要。相较于浓香型和酱香型大曲,清香型大曲的发酵温度较低,因而蕴含的微生物类群和酶系更为丰富,它们与清香型白酒的风格特征具有密不可分的联系[4-5]。关于传统清香型白酒发酵微生物菌群的研究已有报道,多数研究采用微生物纯种培养技术,研究发酵机理并分离获得功能性微生物,主要包括酵母(如扣囊复膜孢酵母(Saccharomycopsis fibuligera)、霉菌、细菌、乳酸菌等[6]。
霉菌作为大曲中主要的菌种之一,富含蛋白酶、糖化酶、酯化酶,在提升出酒率和提高清香型白酒的品质方面具有积极作用,此外,霉菌的次级代谢产物还可以为酵母菌提供生长因子[7]。近年来,关于不同香型白酒酒曲中霉菌产淀粉酶性能的研究较多[8-10],雷学俊等[11]基于传统培养法从五粮液酿造环境空气中筛选鉴定得到一株产α-淀粉酶的烟草色曲霉(Aspergillus tabacinus)1-49,其α-淀粉酶活力为(13.34±0.89)U/g;李冬琴等[12]从芝麻香型白酒专用曲中筛选出8株产糖化酶的霉菌,其中菌株MJ10的糖化酶活力最高,达到1 026.37 U/g。然而,关于清香型白酒大曲中高产淀粉酶霉菌及其产香特性的研究相对较少。本研究采用传统培养分离技术从清香型大曲中分离霉菌,对其形态特征进行观察。将分离菌种通过麸皮培养进行脂肪酶活、糖化力、液化力、酯化力及产香能力测定,筛选产酶及产香性能优良的菌株。最后,通过分子生物技术对优良菌株进行菌种鉴定,并分析其环境耐受性,旨在获得一株功能性优良霉菌。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
清香型白酒大曲:湖北省某酒厂。
1.1.2 试剂
琼脂、蛋白胨(均为生化试剂)、无水乙醇、葡萄糖、NaCl(均为分析纯):国药集团化学试剂有限公司;植物脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:武汉纳磁生物有限公司;BGI 2xSuper聚合酶链式反应(polymerase chain reaction,PCR)Mix(with dye)、BGI D2000 Plus DNA Ladder:北京六合华大基因科技有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
沙氏葡萄糖琼脂(Sabouraud glucose agar,SDA)培养基[13]:葡萄糖40 g、蛋白胨10 g、琼脂20 g、蒸馏水1 000 mL,pH值自然。121 ℃高压蒸汽灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[14]:马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL,pH值自然。121 ℃高压蒸汽灭菌20 min。
麸皮培养基[15]:细麸皮100 g,蒸馏水70 mL,pH值自然。121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂;LRH-250生化培养箱:上海智城分析仪器有限公司;5977B-7890B气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦公司。
1.3 方法
1.3.1 霉菌的分离
称取10 g粉碎过筛后的清香型白酒大曲于250 mL锥形瓶中,加入90 mL 0.9%的生理盐水,30 ℃、120 r/min摇床振荡30 min,静置后取1 mL上清液置于装有9 mL 0.9%生理盐水的试管中,制成10-1的稀释液,以此方法梯度稀释,分别制得10-2、10-3、10-4、10-5、10-6的稀释液。分别吸取上述梯度稀释液150 μL均匀涂布于SDA培养基上,置于恒温培养箱中30 ℃培养2 d。选取长势良好、形态不同的单菌落划线接种并传代直至得到纯种菌落,参照《中华医学百科全书卫生检验学》[16]初步判定菌株类型。
1.3.2 优良霉菌的筛选
孢子悬液的制备:取斜面保存的纯种菌株,加入5 mL 0.9%的生理盐水,将其孢子冲入已灭菌且装有玻璃珠的空三角瓶中,在30 ℃、120 r/min条件下振荡30 min,采用四层纱布过滤,利用血球计数板计数,将孢子悬浮液中孢子浓度稀释至106~107 CFU/mL。
麸曲的制作:在麸皮培养基中加入5 mL 孢子悬浮液,30 ℃条件下培养3 d,每隔12 h扣瓶一次,保证其麸皮松散,使菌株生长均匀。测定麸曲的糖化力、液化力、酯化力及脂肪酶活力,并对其挥发性风味成分进行分析。
1.3.3 测定方法
糖化力、液化力、酯化力的测定:参考QB/T 4257—2011《酿酒大曲通用分析方法》[17];脂肪酶活力的测定:参考GB/T 23535—2009《脂肪酶制剂》[18];挥发性风味成分的检测:采用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)-GC-MS法[19]。
1.3.4 优良霉菌的耐受特性分析[20]
将筛选得到的优良霉菌按1%的接种量将孢子悬液分别接种于100 mL PDA液体培养基,分别置于不同培养温度(30 ℃、33 ℃、36 ℃、39 ℃、42 ℃)下,180 r/min摇床培养60 h;将筛选的到的优良霉菌按1%的接种量将孢子悬液分别接种于100 mL不同pH(3、4、5、6、7)、乙醇体积分数(0、2%、4%、6%、8%)的PDA液体培养基中,30℃、180r/min摇床培养60 h;测定菌丝体干质量,考察菌株对温度、pH和乙醇的耐受性。
1.3.5 优良霉菌的鉴定
按照真菌脱氧核糖核酸(DNA)提取试剂盒提取优良菌株的基因组DNA,以基因组DNA为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')PCR扩增18S rDNA-ITS基因序列。PCR扩增体系:PCR Mix 21μL、ITS1 μL、ITS4 1 μL、DNA模板2 ng/μL。PCR扩增程序:96 ℃预变性5 min;96 ℃变性20 s,56 ℃退火30 s,72 ℃延伸30 min,进行35个循环;72 ℃终延伸10 min。取PCR扩增产物用1.0%琼脂糖凝胶电泳检测,将检测合格的PCR扩增产物委托北京六合华大基因科技有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对搜索,选取同源性较高的模式菌株的18S rDNA-ITS基因序列,采用Mega-X软件中的邻接法(neighbor-joining,NJ)构建系统发育树[21]。
1.3.6 数据处理
使用Excel 2019、SPSS Statistics 26.0对数据进行统计分析处理,采用GrapHPad Prism 9.0、Chiplot软件绘图。
2 结果与分析
2.1 霉菌的分离
以清香型白酒大曲为样本,通过在SDA培养基上涂布、多次分离纯化后,成功得到6株霉菌,编号为MJ-1~MJ-6,其菌落及细胞形态见图1。由图1可知,菌株MJ-1的菌落呈黑色,菌落较稀疏,无假根,孢子呈球状;菌株MJ-2的菌落呈白色,菌落较发达,孢子束老熟后几乎透明无色,孢子呈球状,无假根;菌株MJ-3的菌落质地棉絮状,基部菌丝呈白色,后变为灰褐色,孢子囊近球形,假根不发达;菌株MJ-4的菌落呈白色,后变为灰褐色,菌落稀疏,孢子囊呈球形,无假根;菌株MJ-5的菌落呈白色,菌丝体发达,呈棉絮状,孢子囊颗粒明显;菌株MJ-6的菌落呈白色羊毛状,孢子束老熟后几乎透明无色,无假根。通过形态观察初步鉴定菌株MJ-1、MJ-4、MJ-3为根霉属(Rhizopus sp.)、菌株MJ-2、MJ-6为毛霉属(Rhizopus sp.)、MJ-5为横梗霉属(Lichtheimias sp.)。

图1 6株分离霉菌的菌落及细胞形态
Fig.1 Colony and cell morphology of 6 isolated strains of mold
2.2 优良霉菌的筛选
2.2.1 霉菌麸曲糖化力、液化力、酯化力及脂肪酶活力的测定
将6株霉菌接种于麸皮培养基,测定霉菌麸曲的糖化力、液化力、酯化力、脂肪酶活力,结果见图2。
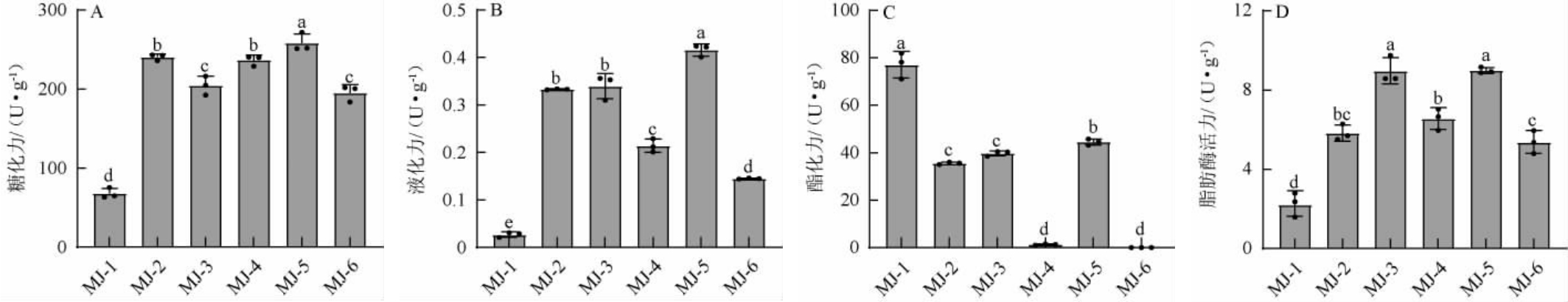
图2 6株霉菌麸曲的糖化力(A)、液化力(B)、酯化力(C)及脂肪酶活力(D)测定结果
Fig.2 Determination results of saccharification power (A), liquefaction power (B), esterification power (C) and lipase activities (D) of Fuqu fermented with 6 strains of mold
不同字母表示差异显著(P<0.05)。
由图2A可知,6株霉菌麸曲的糖化力在67.69~258.02U/g之间,其中,菌株MJ-5的糖化力最高,显著高于其他5株霉菌的糖化力(P<0.05),达到了258.02 U/g,是马鹏[22]筛选得到的红曲霉M14麸曲的糖化力的2.74倍。菌株MJ-2和MJ-4次之,菌株MJ-1麸曲的糖化力最低。
在酿酒过程中,液化酶可将淀粉质原料水解为糊精、麦芽三糖、直链麦芽低聚糖及葡萄糖等微生物所需营养物质,有利于发酵的进行,对白酒风味的形成也起到一定的促进作用,因此液化力是衡量菌株糖化能力的指标之一[23]。由图2B可知,6株霉菌麸曲的液化力在0.03~0.42 U/g之间,其中,菌株MJ-5麸曲的液化力显著高于其他霉菌(P<0.05),达到了0.42 U/g,但相比赵恒山[24]筛选的菌株M1纯种麸曲的液化力(0.79 U/g)较弱。菌株MJ-2、MJ-3麸曲的液化力次之,分别为0.33 U/g、0.34 U/g,菌株MJ-1、MJ-4、MJ-6麸曲的液化力较低,均<0.21 U/g。
由图2C可知,6株霉菌麸曲的酯化力在0~76.98 U/g之间,其中,菌株MJ-1的酯化力最高,达到76.98 U/g,显著高于其余5株菌(P<0.05),菌株MJ-5次之,为44.51 U/g,菌株MJ-2和MJ-3的酯化力相对较低且无显著差异(P>0.05),菌株MJ-4和MJ-6酯化力最低。由图2D可知,6株霉菌麸曲的脂肪酶活力在2.19~8.98 U/g之间,其中,菌株MJ-5的脂肪酶活力最高,为8.98 U/g,且与菌株MJ-3相比无显著性差异(P>0.05)。
2.2.2 霉菌麸曲挥发性风味成分的检测
霉菌可以产生乙醇、苯乙醇、3-甲基丁醇、十六酸乙酯、油酸乙酯、2-甲基-1-丁酮、3-甲基-1-丁酮、乙酸、苯乙酸、3-甲基丁酸、亚麻油酸等多种代谢产物[25],其中,许多物质为白酒中的风味物质和风味前体,也是大曲中众多呈香、呈味物质的组成成分,对白酒的风味和口感有重要影响[26]。因此,研究霉菌代谢产生的挥发性风味成分具有重要意义。通过HS-SPME-GC-MS法分析6株霉菌麸曲的挥发性风味成分,结果见图2。
由表1可知,从6株霉菌麸曲中共检测出45种挥发性风味成分,包括12种酯类、18种醇类、3种酸类、2种酚类、10种其他类。菌株MJ-2、MJ-4所产香气成分较少,分别为9种和14种,其中相对含量较多的风味成分为正己醇(7.19%、12.98%)和异戊烯醇(28.45%、27.3%)。在菌株MJ-1和MJ-3麸曲中检测到了多种高级脂肪酸酯,在菌株MJ-1麸曲中检测到了十四酸乙酯、十六酸乙酯、反油酸乙酯、亚油酸乙酯、亚麻酸甲酯,相对含量分别为0.64%、14.29%、4.81%、6.14%、0.17%;在菌株MJ-3麸曲中检测到了十四酸乙酯、反油酸乙酯、亚油酸乙酯、亚麻酸甲酯、苯乙酸乙酯、月桂酸乙酯、十五酸乙酯、棕榈酸甲酯、棕榈酸乙酯、9-十六碳烯酸乙酯,相对含量分别为2.71%、8.33%、15.62%、0.66%、0.21%、0.43%、0.87%、0.18%、34.18%、0.72%。在菌株MJ-6麸曲中检测到了异戊醇、正己醇、苯乙醇、异戊烯醇、(2S,3S)-(+)-2,3-丁二醇、冰醋酸、正己酸、异丁酸、3-羟基-2-丁酮、(-)-反式石竹烯,相对含量分别为1.87%、6.97%、1.45%、4.19%、2.55%、9.69%、0.66%、1.53%、11.99%、2.12%。在菌株MJ-5麸曲中检测到了苯乙酸乙酯和月桂酸乙酯,相对含量分别为15.7%、1.74%,远高于其他5种麸曲。这两种物质有助于白酒中花果香气的形成[27]。此外,仅在该麸曲中检测出了(-)-alpha-古芸烯,其相对含量为0.96%。研究发现,多种植物提取物中发现了α-古芸烯,赵梓颐等[28]从大叶蒟根茎挥发油中检测到反式-石竹烯、δ-荜澄茄烯及α-古芸烯等萜烯类化合物。然而关于从微生物发酵产物中检测到(-)-alpha-古芸烯的研究目前鲜有报道。(-)-alpha-古芸烯是一种具有木质香的天然健康因子,对神经系统起到辅助作用,可以镇静心神、稳定情绪[29]。综上,确定菌株MJ-5在不仅是一株产酶功能菌,也是一株重要的产香功能菌,对清香型白酒的风味形成具有贡献。
表1 6株霉菌麸曲中挥发性风味成分GC-MS分析结果
Table 1 Results of volatile flavor components in Fuqu fermented with 6 strains of mold analyzed by GC-MS
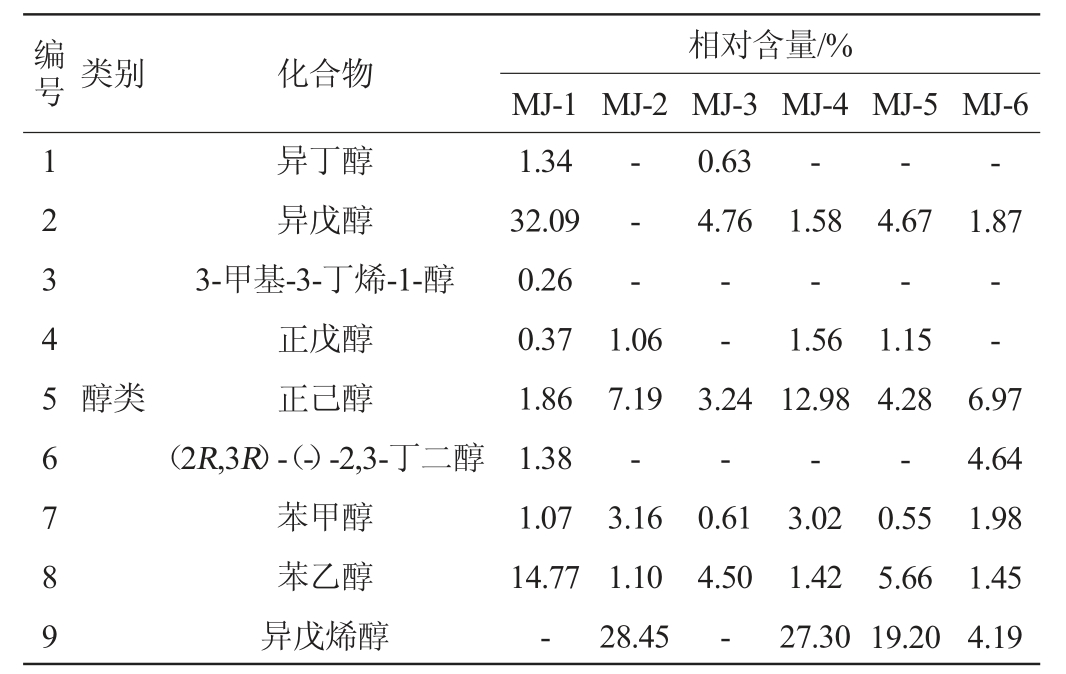
编号类别化合物相对含量/%MJ-1 MJ-2 MJ-3 MJ-4 MJ-5 MJ-6 123456789---0.63 4.76-异丁醇异戊醇3-甲基-3-丁烯-1-醇正戊醇正己醇(2R,3R)-(-)-2,3-丁二醇苯甲醇苯乙醇异戊烯醇1.34 32.09 0.26 0.37 1.86 1.38 1.07 14.77---1.87 1.06 7.19-3.16 1.10 28.45——醇类3.24-0.61 4.50-1.58-1.56 12.98-3.02 1.42 27.30 4.67-1.15 4.28-0.55 5.66 19.20 6.97 4.64 1.98 1.45 4.19
续表
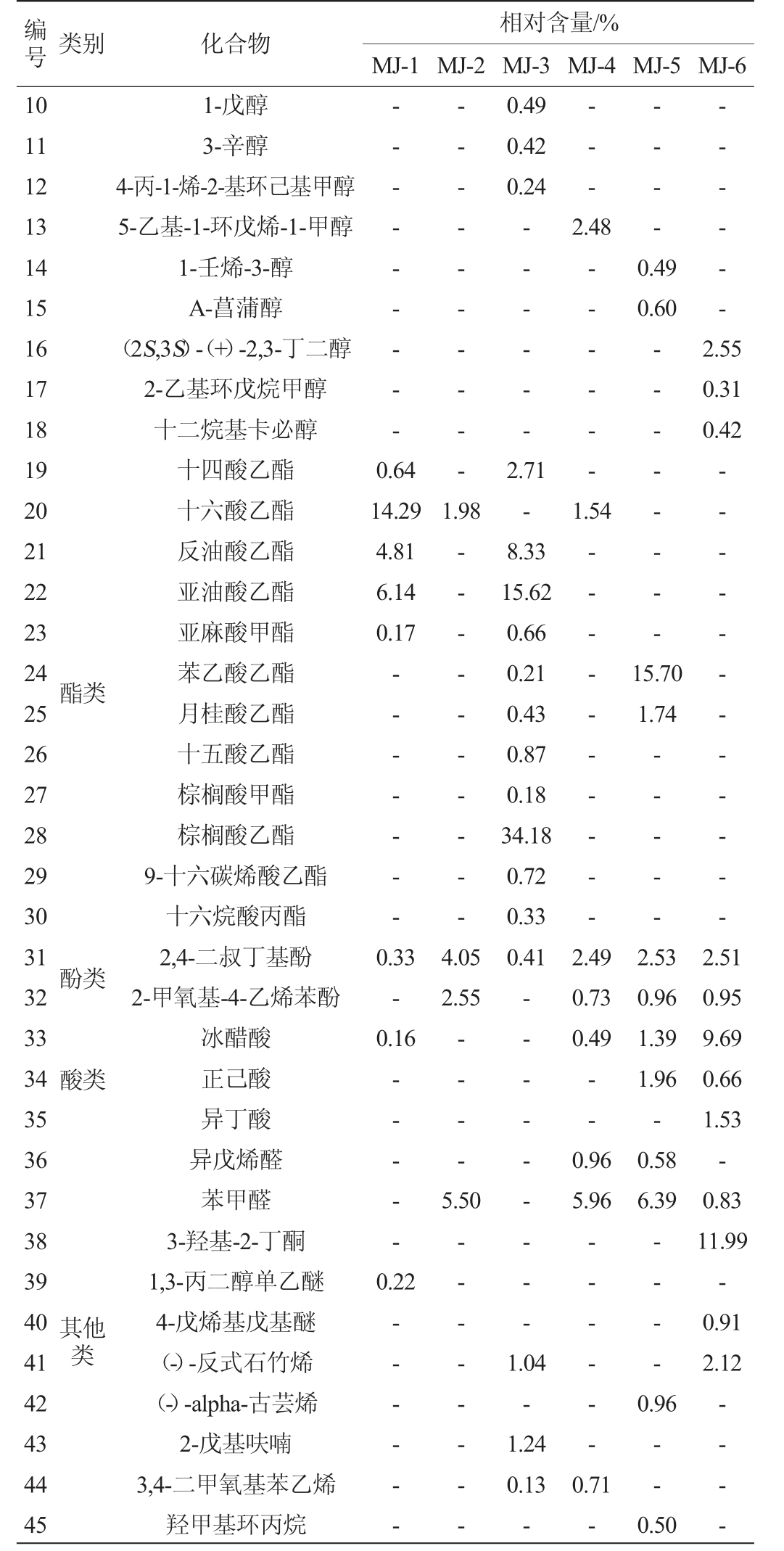
注:“-”表示未检出。
编号类别化合物10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45相对含量/%MJ-1 MJ-2 MJ-3 MJ-4 MJ-5 MJ-6————-0.49 0.42 0.24 1-戊醇3-辛醇4-丙-1-烯-2-基环己基甲醇5-乙基-1-环戊烯-1-甲醇1-壬烯-3-醇A-菖蒲醇(2S,3S)-(+)-2,3-丁二醇2-乙基环戊烷甲醇十二烷基卡必醇十四酸乙酯十六酸乙酯反油酸乙酯亚油酸乙酯亚麻酸甲酯苯乙酸乙酯月桂酸乙酯十五酸乙酯棕榈酸甲酯棕榈酸乙酯9-十六碳烯酸乙酯十六烷酸丙酯2,4-二叔丁基酚2-甲氧基-4-乙烯苯酚冰醋酸正己酸异丁酸异戊烯醛苯甲醛3-羟基-2-丁酮1,3-丙二醇单乙醚4-戊烯基戊基醚(-)-反式石竹烯(-)-alpha-古芸烯2-戊基呋喃3,4-二甲氧基苯乙烯羟甲基环丙烷————————---2.48——0.49 0.60——--2.55 0.31 0.42 0.64 14.29 4.81 6.14 0.17——--1.98 1.54————酯类————————————---15.70 1.74————————-酚类0.33-0.16 4.05 2.55 2.71-8.33 15.62 0.66 0.21 0.43 0.87 0.18 34.18 0.72 0.33 0.412.49 0.73 0.49酸类————---5.50 0.96 5.96 2.53 0.96 1.39 1.96-0.58 6.39 0.22其他类——————————---1.04-1.24 0.13————---2.51 0.95 9.69 0.66 1.53-0.83 11.99-0.91 2.12 0.96 0.71---0.50——
2.3 菌株MJ-5的分子生物学鉴定
基于18S rDNA-ITS基因序列构建筛选菌株MJ-5的系统发育树,结果见图3。
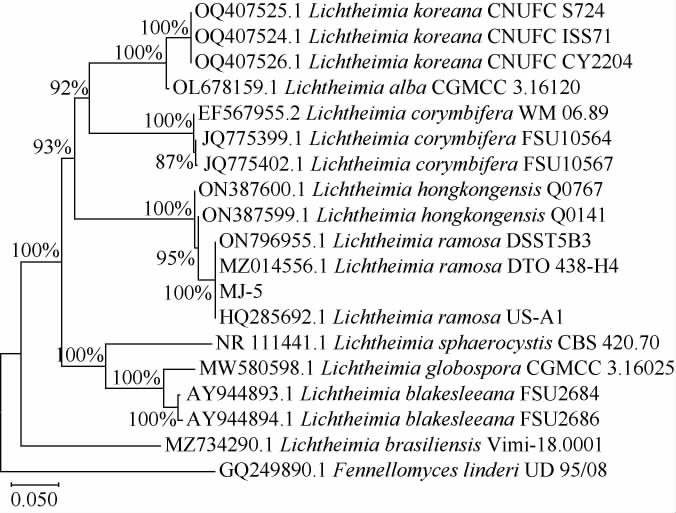
图3 基于18S rDNA-ITS基因序列菌株MJ-5的系统发育树
Fig.3 Phylogenetic tree of strain MJ-5 based on 18S rDNA-ITS gene sequences
由图3可知,菌株MJ-5与分支横梗霉(Lichtheimiaramosa)同源性达100%,属同一分支,亲缘关系最近,因此,鉴定菌株MJ-5为分支横梗霉(Lichtheimia ramose),属于菌物界接合菌门接合菌纲毛霉目毛霉科横梗霉属生物。
2.4 分支横梗霉MJ-5的耐受性研究
分支横梗霉MJ-5对温度、pH、乙醇的耐受性见图4。
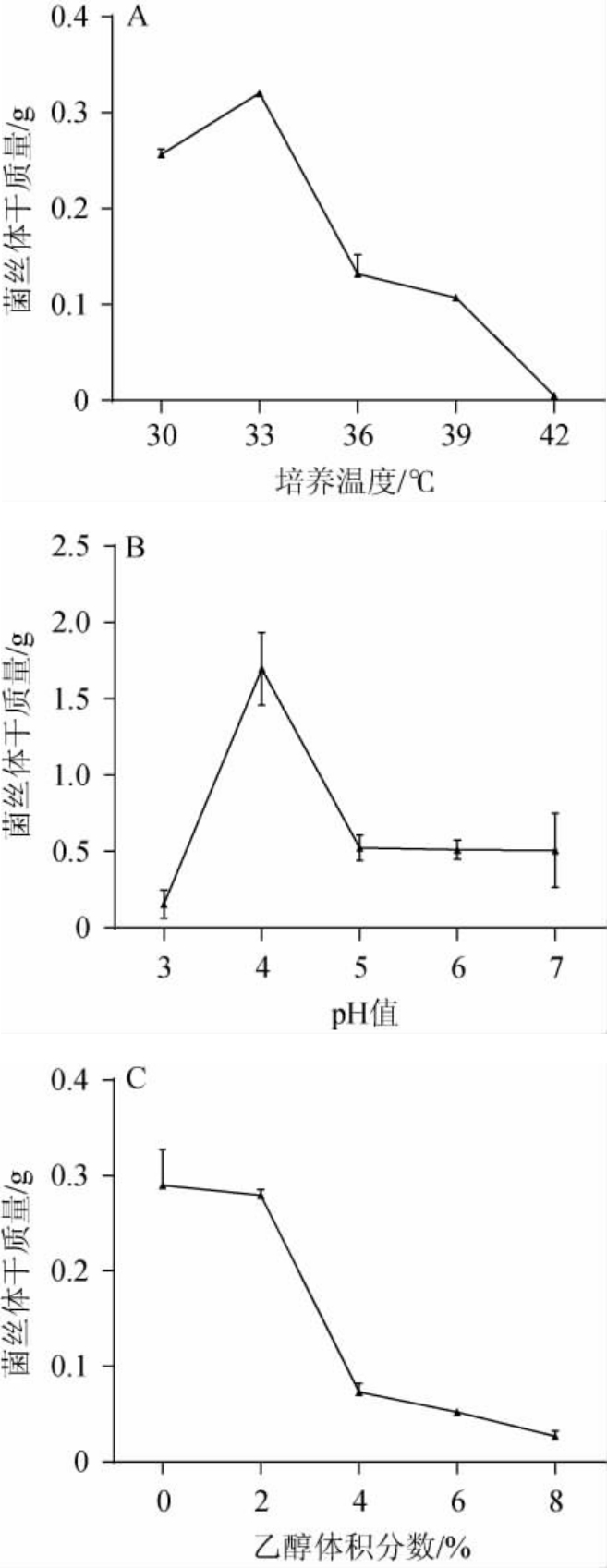
图4 分支横梗霉MJ-5对温度(A)、pH(B)及乙醇(C)的耐受性试验结果Fig.4 Results of resistance tests of Lichtheimia ramosa MJ-5 to temperature (A), pH (B) and ethanol (C)
在清香型白酒大曲的制曲过程中,根据培曲过程中升温及降温情况差异性可分为清茬曲、红心曲和后火曲,清茬曲热曲温度在40 ℃左右,属于小热大晾,后火曲最高曲温可达到48 ℃,属于大热中晾,红心曲无明显晾霉期,但升温较快[30]。因此,耐高温的微生物更有利于清香型白酒的酿造。由图4A可知,分支横梗霉MJ-5随着培养温度的升高,菌丝体干质量呈先升高后下降的趋势。当培养温度为33 ℃时,分支横梗霉MJ-5生长情况最好,菌丝体干质量为0.32 g;当培养温度为42 ℃时,菌株基本不生长。因此,分支横梗霉MJ-5的最适生长温度为33 ℃,可耐受39 ℃的高温,其对温度的耐受性强于王新叶等[31]筛选出的杂色曲霉(Aspergillus versicolor),该菌株在37 ℃以上时无法生长。
由图4B可知,随着pH的升高,分支横梗霉MJ-5的菌丝体干质量呈先升高后下降的趋势。当pH为4时,分支横梗霉MJ-5生长情况最好,菌丝体干质量为1.70 g;当pH为5~7时,分支横梗霉MJ-5的生长受到抑制且生长情况相似;当pH为3时,分支横梗霉MJ-5几乎不生长。因此,分支横梗霉MJ-5的最适生长pH为4,可耐受pH 4,其对pH的耐受性与刘茗铭等[32]筛选出的高糖化酶霉菌M21的pH耐受性相似。
酒精是清香型白酒大曲中酵母菌厌氧发酵的产物,酒精度的高低直接影响白酒发酵,霉菌和酵母本身在高酒精度环境中都受到一定的抑制作用[32]。因此,在清香型白酒大曲发酵过程中,霉菌的乙醇耐受性对大曲的出酒率也有较大影响。由图4C可知,随着乙醇体积分数的升高,分支横梗霉MJ-5的生长情况逐渐受到抑制,在不含有乙醇的环境中生长情况最好;当乙醇体积分数为2%时,分支横梗霉MJ-5的生长能力受到一定抑制;当乙醇体积分数为6%时,分支横梗霉MJ-5的耐受性明显减弱但仍可以生长;当乙醇体积分数为8%时,分支横梗霉MJ-5几乎不能生长。因此,分支横梗霉MJ-5可耐受乙醇体积分数6%,其对乙醇的耐受性和张琳等[33]筛选出的高糖化酶霉菌M6的乙醇耐受性相似。
3 结论
采用传统培养分离技术结合形态学观察从清香型白酒大曲中分离得到6株生长状况良好的霉菌,编号为MJ-1~MJ-6,其中,菌株MJ-5产酶及产香性能优良,利用其制备的纯种麸曲的糖化力、液化力、酯化力和脂肪酶活力分别为258.02 U/g、0.42 U/g、44.51U/g、8.98 U/g,同时,采用HS-SPMEGC-MS从中检测到相对含量较高的苯乙酸乙酯(15.7%)、月桂酸乙酯(1.74%),有助于增加白酒果香,此外还检测到了(-)-alpha-古芸烯,相对含量为0.96%。通过分子生物技术鉴定菌株MJ-5为分支横梗霉(Lichtheimia ramosa)。通过耐受性分析发现,分支横梗霉MJ-5可耐受高温39 ℃、pH值4、乙醇体积分数6%的生长环境,具有良好的耐受性。
本研究成功地从清香型大曲中分离得到一株高产酶的产香霉菌。这一发现在清香型白酒大曲酿造环境方面具有一定的应用潜力并且能够适应实际生产要求,为强化大曲、提高原料利用率提供了理论支持。通过开发和利用这种高产淀粉酶的产香霉菌,有望在清香型白酒的酿造方面实现资源的高效利用。
[1]王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J].食品科学,2022,43(7):232-244.
[2]欧志强.让“清香”走向世界[N].山西经济日报,2022-08-07(1).
[3]凌荔,牟飞燕,袁萌,等.清香型白酒大曲研究进展[J].酿酒,2022,49(6):17-22.
[4]陈佩,翟彩宁,刘莹,等.白水地区清香型大曲理化指标及真菌多样性分析[J].食品与发酵工业,2024,50(10):197-204.
[5]李艳婷,郭尚,郭霄飞,等.清香型白酒发酵过程中微生物群落结构变化及与理化性质的相关性[J].中国食品学报,2023,23(5):330-340.
[6]陈占秀,李善文,黄和强,等.高原青稞酒的功能性酿造微生物及代谢产物研究[J].酿酒科技,2022(11):72-81.
[7]谢翔云.酱香型白酒功能性霉菌的筛选与应用[D].天津:天津科技大学,2022.
[8]贺奕森,唐涛,周玉岩,等.大曲中高产酯化酶霉菌的分离鉴定[J].中国食品工业,2023(2):105-107.
[9]朱治宇,黄永光.茅台镇酱香白酒不同轮次主酿区可培养霉菌种群结构多样性[J].食品科学,2020,41(22):184-192.
[10]李建芳,张阳阳,王荣荣,等.芝麻香型白酒专用曲中霉菌分离及产酶特性分析[J].食品科技,2021,46(5):33-37.
[11]雷学俊,赵东,郑佳,等.五粮液酿造环境空气中霉菌的分离鉴定及产酶初探[J].食品与发酵工业,2022,48(23):71-77.
[12]李冬琴,李建芳,周枫,等.芝麻香型白酒专用曲中产糖化酶霉菌的筛选[J].酿酒,2021,48(3):90-93.
[13]石琳,杜蓉,李学兴.药品霉菌和酵母菌计数替代培养基验证[J].药物分析杂志,2019,39(5):859-863.
[14]张双双,陈亮,许茜茜,等.储藏小麦中草酸青霉的分离鉴定及其侵染防控[J].粮食与油脂,2024,37(4):49-53,79.
[15]丁娟,许勤虎,王祥河,等.多微麸曲清香型白酒酿造用糖化菌种筛选研究[J].天津科技,2023,50(7):19-22,26.
[16]黎源倩.中华医学百科全书卫生检验学[M].北京:中国协和医科大学出版社,2017:56-57.
[17]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[18]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23535—2009 脂肪酶制剂[S].北京:中国标准出版社,2009.
[19]卢中明,张祥,叶光斌.不同生产月份中高温成品大曲理化指标、挥发性风味物质分析[J].食品与发酵工业,2024,50(9):315-320.
[20]倪海斌,彭奎,王超凯,等.藏曲高产糖化酶霉菌的筛选及其产酶条件优化[J].食品与发酵科技,2022,58(2):31-37.
[21]杜琳琳,赵祥颖,刘丽萍,等.红曲霉菌的筛选及其在液态食醋酿造中的应用[J].中国调味品,2024,49(1):33-39.
[22]马鹏.高酯化力、糖化力和液化力霉菌的筛选及强化大曲的研究[D].阿拉尔:塔里木大学,2023.
[23]李泽洋,伍时华,龙秀锋,等.米酒糖化菌的分离筛选鉴定及其性能研究[J].食品与发酵工业,2021,47(4):188-194.
[24]赵恒山.产糖化酶、液化酶菌株的筛选及麸曲的制备[D].晋中:山西农业大学,2019.
[25]王佳丽,朱丹,孙列雄,等.山西老陈醋大曲霉菌生理代谢特征及优良菌株间的互作[J].中国食品学报,2021,21(4):79-89.
[26]HU P P,WANG J,ALI U,et al.Comparative study on physicochemical properties,microbial composition,and the volatile component of different light flavor Daqu[J].Food Sci Nutr,2023,11(9):5174-5187.
[27]鲁珍,王红照,李恩中,等.高温大曲中霉菌的筛选及其挥发性产物分析[J].酿酒科技,2019(7):50-55.
[28]赵梓颐,武佳文,胡仁传,等.大叶蒟根茎提取物中化学成分的结构和药理作用研究进展[J].山东医药,2023,63(30):106-110.
[29]SARANYA J,EGANATHAN P,SUJANAPAL P,et al.Chemical composition of leaf essential oil of Syzygium densiflorum Wall.ex Wt.&Arn.-a vulnerable tree species[J].J Essent Oil Bearing Plants, 2012, 15(2):283-287.
[30]王冬,王涛.清香型大曲白酒工艺研究[J].食品工程,2023(4):38-39,52.
[31]王新叶,王永欢,陈晓青,等.酱香型酒醅中一株曲霉的鉴定及生物学特性分析[J].工业微生物,2022,52(5):7-13.
[32]刘茗铭,周阳子,袁乐梅,等.酒曲中高产糖化酶霉菌的筛选及其固态发酵产酶条件优化[J].食品与发酵工业,2018,44(10):118-123.
[33]张琳,张也,王如福,等.大曲中高产糖化酶菌株的筛选及环境耐受性分析[J].山西农业大学学报(自然科学版),2016,36(10):740-744.