我国白酒类型多样且丰富,主要以产区、环境、水域、生产工艺、产品风味等方面的特征来加以分类[1],且不同类型的白酒使用的发酵剂(俗称“曲药”)也完全不同[2-3]。四川地区以浓香型白酒为主,使用的发酵剂(曲药)为中高温大曲[1]。大曲不仅是白酒发酵过程的酶制剂,也是白酒生产中不可或缺的原料之一[4-6],对于解析白酒的“地域性密码”具有突出的贡献。因此,“先制大曲、后酿白酒”成为我国白酒行业上下传承千百年来的共识。现有研究表明,大曲在为白酒发酵引入丰富微生物和酶的同时,也为其提供多种前体风味物质[7-8]。目前,已有的研究更表明,不同产区的大曲微生物群落组成和代谢特征显著差异是白酒风格迥异的主要贡献力[9]。此外,大曲中的微生物多数是自然富集于环境[10],即使同一地区不同产地的大曲理化及微生物群落结构差异也十分显著[11],如任宇婷等[12]比较了北方不同地区的中高温大曲,发现水分含量、糖化酶及优势细菌属具有显著差异。王清龙等[13]分析了河南地区不同浓香型白酒大曲,发现糖化力、酯化力、酸度及微生物群落组成等均显著差异。吴树坤等[14]利用高通量测序技术比较了四川泸州、宜宾和遂宁三个地区不同浓香型大曲的微生物群落结构,发现产区地理位置相对接近的样品微生物结构则更相似。总之,现存相关研究表明,大曲产区微生物群落具有明显的“独特性和差异性”,但不同产区大曲的特征参数、优势微生物菌属及相关联系依旧还不明晰,亟待进一步解读。
该研究以成都、宜宾和泸州产区作为川派浓香型白酒主产区的典型代表,对三个主产区浓香型大曲的理化、微生物群落结构及挥发性风味物质组成的差异性进行分析,旨在为初步明晰四川地区浓香型大曲的典型产区特征提供一定的数据支撑,助力川酒“密码产区”的建设与解密。
1 材料与方法
1.1 材料与试剂
大曲样品:分别取自四川宜宾、泸州及成都某典型代表浓香型酒厂生产且使用的成品曲,编号分别为Q1~Q3。3个酒厂该批次成品曲均在2023年5月初前后几天的相近时间生产(主发酵期时间基本相似,均在28~30 d左右,而贮存期也基本一致,均在3个月左右)。3个酒厂制曲工艺类似,均采用半机械化生产模式,每个酒厂随机取大曲10块,粉碎混合均匀,取样约500 g,分为两份,一份用于物理化学性质及挥发性风味物质检测,另一份及时送样进行微生物组成测定。
乙酸正戊酯:上海阿拉丁试剂有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
TSQ9000Ⅱ气相色谱-质谱联用仪(gas chromatographymass spectrometry,GC-MS):美国赛默飞世尔公司;50/30 μm DVB/CAR/PDMS三相微萃取头:美国Supelco公司;BS210S电子分析天平:德国Sartorius公司;PHS-3C酸度计:安亭科学仪器厂;CS501恒温水浴锅:上海浦东荣丰科学仪器有限公司;DHP-9082恒温培养箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 大曲微生物群落组成检测
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取的方法和DADA2序列去噪程序均参考唐慧芳等[15]的方法。
1.3.2 大曲理化指标检测
水分、酸度、淀粉、液化力、糖化力、酯化力、发酵力参照QB/T4257—2011《酿酒大曲通用分析方法》进行检测,每组样品取3组平行样进行检测[15]。
1.3.3 挥发性风味物质的检测
样品的前处理:参考JIA Y等[16]所述方法稍作修改。称取大曲粉1.00 g于25 mL顶空瓶中,加入50 μL 0.087 5 mg/mL的乙酸正戊酯(内标)。置于恒温搅拌器中500 r/min、60 ℃预热平衡30 min,吸附提取50 min。结束后,将固相微萃取头插入仪器进样口解吸5 min,检测挥发性风味组分。
色谱条件:40 ℃保持2 min,以5 ℃/min升至230 ℃,保持8 min,进样口温度为250 ℃。进样后延迟2 min后开始检测;质谱条件:电子电离(electron ionization,EI)源:离子温度设定250 ℃;传输线温度设定280 ℃;溶剂延迟时间设定2 min。检测质谱数据通过与标准谱库(national institute of standards and technology,NIST)2017对比进行组分鉴定,对比匹配度≥75%的物质予以分析。定性定量方法:检测质谱数据通过与美国国家标准与技术研究院(national institute of standards and technology,NIST)标准谱库2017对照进行组分鉴定,对匹配度>80%的物质予以分析;采用内标法定量。
1.3.4 数据处理
采用派森诺基因云(https://www.genescloud.cn/home)平台进行主坐标分析(principal coordinate analysis,PCoA)。利用Origin2019做堆叠图、Canoco5.0做冗余分析(redundancy analysis,RDA)图。
2 结果与分析
2.1 三个浓香型大曲样品理化分析
三个浓香型大曲样品的理化指标见表1。
表1 三种大曲的理化指标
Table 1 Physicochemical indexes of the three types of Daqu

注:同一列不同字母间表示差异显著(P<0.05)。
编号水分/%酸度/(mmol·10 g-1)淀粉/(g·100 g-1)液化力/[g淀粉·(g曲·h)-1]糖化力/[g葡萄糖·(g曲·h)-1]酯化力/[mg·(50 g曲·7 d)-1]发酵力/[gCO2·(g·72 h)-1]Q1 Q2 Q3 10.47±0.282 8b 11.67±0.282 8a 8.28±0.260 5c 0.720 5±0.064 3b 0.651 5±0.042 0b 0.876 7±0.025 1a 68.64±0.388 0a 68.94±4.544 5a 61.57±2.465 7a 1.573 3±0.025 2a 0.623 3±0.020 8b 0.620 0±0.020 0b 747.60±5.909 3a 724.40±9.321 8b 715.40±5.032 0b 314.39±2.524 2a 297.82±7.004 7ab 294.51±12.379 3b 0.12±0.008 2a 0.12±0.050 2a 0.14±0.017 1a
由表1可知,四川不同区域的浓香型大曲淀粉含量及发酵力均无显著差异(P>0.05);样品Q3的水分含量显著低于Q1和Q2(P<0.05),通常认为大曲较低的水分含量降低了微生物的代谢速度使大曲更能长时间保存[17];酸度显著高于Q1和Q2(P<0.05)。样品Q1的液化力和糖化力显著高于Q2和Q3(P<0.05),表明样品Q1的霉菌类微生物生长可能更具优势,可显著提高大曲发酵体系中原料的利用率,进一步利用对白酒的出酒率及发酵效率等均可能产生一定的正向作用[18]。大曲液化力和糖化力的差异可能与四川不同主产区的气候环境差异有关,有报道称湿润环境更有利于霉菌菌丝的生长发育[19]。根据表1可以推测,成都产区特征参数可能为水分和酸度,宜宾产区特征参数可能为液化力和糖化力。
2.2 三个浓香型大曲样品微生物多样性分析
2.2.1 α多样性差异性分析
Chao 1和Observed species指数用于反映菌群丰度,Shannon和Simpson指数用于表征菌群多样性。由表2可知,四川不同产区的浓香型成品曲α多样性差异显著。Q2的细菌Chao1指数和Observed species指数显著高于Q1和Q3,而真菌Q1最高,Q2最低。另外,Q2微生物的Shannon指数和Simpson指数是三个样品中最低的,Q1是最高的,结果显示Q2细菌丰度最高而多样性最低,真菌的丰度及多样性均是最低的,Q1真菌的丰度和多样性均是最高的。四川不同产区的浓香型成品曲α多样性的差异,进一步表明不同大曲间微生物存在明显的不同与特征,有必要结合具体的群落结构组成与内在相关性差异进行深入解析。
表2 三种浓香型大曲样品α多样性指数
Table 2 Alpha diversity index of the three types of strong-flavor Daqu samples
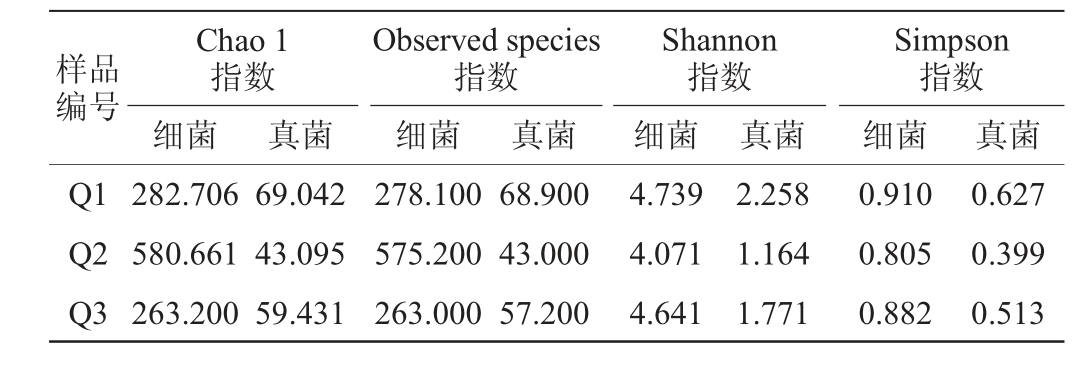
样品编号Chao 1指数细菌Observed species指数细菌Shannon指数细菌真菌真菌真菌Simpson指数细菌 真菌Q1 Q2 Q3 282.706 580.661 263.200 69.042 43.095 59.431 278.100 575.200 263.000 68.900 43.000 57.200 4.739 4.071 4.641 2.258 1.164 1.771 0.910 0.805 0.882 0.627 0.399 0.513
2.2.2 微生物群落的差异性分析
通过PCoA比较了三个样品大曲的微生物组成,结果见图1。由图1可知,基于真菌及细菌的主坐标分析,宜宾、泸州及成都产区的浓香型白酒大曲微生物群落结构差异显著。
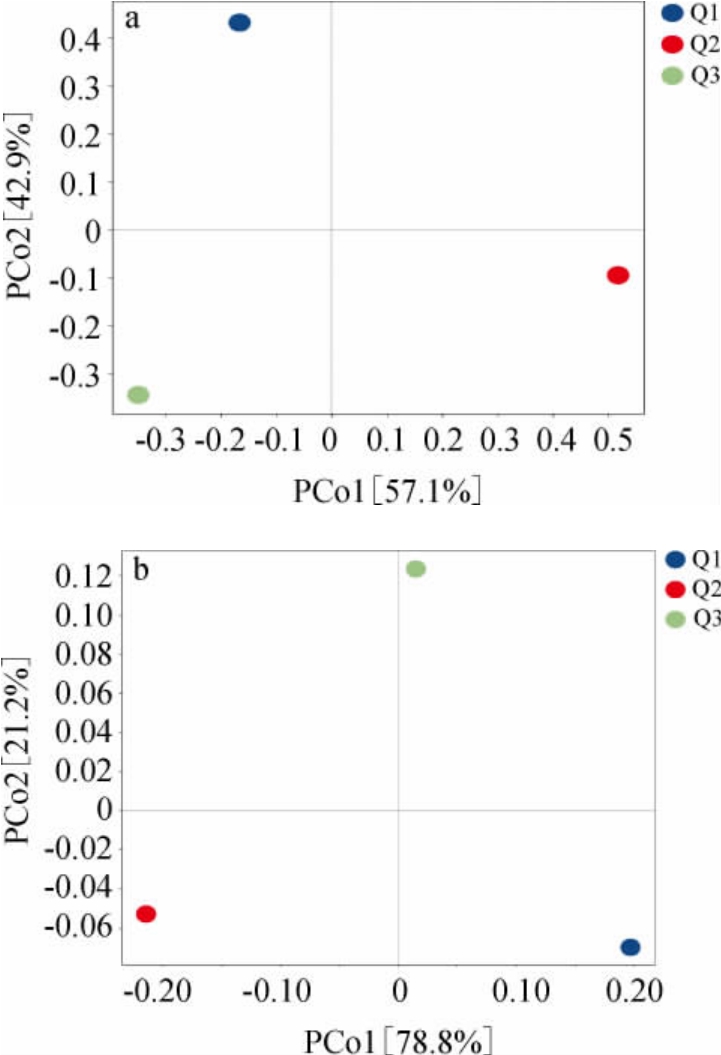
图1 三种大曲样品真菌(a)和细菌(b)的主坐标分析结果
Fig.1 Principal coordinate analysis results of fungi(a)and bacteria(b)of three types of Daqu samples
基于门、属水平的三种大曲微生物群落结构比较见图2。由图2可知,真菌水平而言,子囊菌门是三种样品的绝对优势真菌门,相对丰度达到81.99%以上,其次是毛霉门和担子菌门,这与以前的研究[20]结果保持一致。毕赤酵母属(Pichia)、嗜热子囊菌属(Thermoascus)、根毛霉属(Rhizomucor)、曲霉属(Aspergillus)和根霉属(Rhizopus)在三个产区大曲样品中均有检测到,但由于产区不同而在样品中相对丰度占比不同。显而易见,嗜热子囊菌属(Thermoascus)是川派浓香型白酒大曲的绝对优势真菌属(Q1、Q2和Q3的相对丰度分别为56.51%、74.71%和69.11%)。Q1中曲霉属(As pergillus)、根霉属(Rhizopus)和根毛霉属(Rhizomucor)的相对丰度分别为22.70%、4.27%和2.06%;Q2中嗜热真菌属(Thermomyces)、毕赤酵母属(Pichia)和根毛霉属(Rhizomucor),相对丰度分别为20.61%、2.07%和1.11%;Q3的曲霉属(Aspergillus)、毕赤酵母属(Pichia)和根霉属(Rhizopus),相对丰度分别为15.50%、11.62%和1.85%。总体来看,川派浓香型白酒成都、宜宾和泸州三大核心产区大曲的真菌群落结构具有一定的相似性。但具体差异而言,宜宾产区大曲的霉菌相对丰度显著高于其他两个产区,而霉菌类微生物有助于淀粉的糖化和液化,进而可能产生更多有利于白酒发酵及品质的特征风味物质[21-22],此结果也与上文大曲糖化力和液化力的差异保持一致(表1),进一步验证了宜宾产区大曲特征参数可能为液化力和糖化力。

图2 基于门和属水平的三种大曲微生物群落结构比较
Fig.2 Comparison of microbial community structure of three types of Daqu based on phylum and genus level
a、真菌门、b真菌属、c细菌门、d细菌属,Q1为宜宾产区大曲;Q2为泸州产区大曲;Q3为成都产区大曲。
细菌水平而言,Q1的主要细菌门为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),相对丰度分别为84.09%和12.59%;Q2和Q3类似,均以厚壁菌门(Firmicutes)为优势细菌门,相对丰度分别为94.82%和74.87%。其次是变形菌门(Proteobacteria),其相对丰度分别为2.95%和21.09%。Q1的优势细菌属为泛菌属(Pantoea),相对丰度为62.27%,该菌属是浓香型白酒大曲中常见的优势菌属[2],同时检测到相对丰度>1%的细菌属还有热放线菌属(Thermoactinomyces)(2.28%)、魏氏斯菌属(Weissella)(3.09%)、乳酸杆菌属(Lactobacillus)(3.01%)和明串珠菌属(Leuconostoc)(2.14%);虽然Q2和Q3的细菌门类相似,但是在属水平上却差异显著。Q2中热放线菌属(Thermoactinomyces)(70.84%)和魏氏斯菌属(Weissella)(11.82%)是主要的优势细菌属,乳酸杆菌属(Lactobacillus)(6.34%)和片球菌属(Pediococcus)(2.36%)也在该样品中检测到。Q3样品中魏氏斯菌属(Weissella)(42.50%)和乳酸杆菌属(Lactobacillus)(12.81%)占主导地位,同时检测到明串珠菌属(Leuconostoc)和醋酸杆菌属(Acetobacter)相对丰度为7.46%和5.95%,有报道显示这些微生物属对酸性物质的产生有一定促进作用和贡献,是白酒酿造中的重要微生物菌属之一[23-24]。同时,丰富的产酸微生物菌属进一步解释了Q3大曲酸度显著高于Q1和Q2的微生物菌群层次机制的可能性。已有研究表明,环境微生物通过不断繁殖和适应发酵环境,形成具有“独特性的大曲功能微生物群落[10,25]。因此,可以推测川派浓香型白酒成都、宜宾和泸州三大核心产区大曲的细菌优势菌属差异可能与产区独特的水文、环境、气候条件及空气微生物菌群的差异密切相关。
2.2.3 不同大曲样品的挥发性风味物质差异性分析
三种大曲各类挥发性风味物质含量及占比见图3,三种大曲挥发性风味物质含量见表3。在三种大曲样品中共检测出37种挥发性风味物质,主要包括酯类14种、醇类2种、含氮化合物5种、醛类3种、其他12种。由图3a可知,Q1挥发性风味物质总量最高(77.10 μg/g),约达到Q2挥发性风味物质总量(38.89 μg/g)的2倍,其次是Q3挥发性风味物质总量为65.35 μg/g。由图3b可知,Q1~Q3的挥发性风味物质组成结构类似,均以酯类物质为主,组分占比均在70%以上。值得注意的是,仅在Q2样品(泸州产区大曲)中检测到己酸乙酯(0.94 μg/g,图3和表3),它能为白酒带去香甜的果味[26]。据此可以大胆推测,微量的己酸乙酯作为泸州产区大曲的特征参数具有一定的潜力和可能性。此外,十四酸甲酯是具有蜂蜜和鸢尾样的香气[27],在Q1和Q3样品中的含量为1.87 μg/g和1.28 μg/g,但Q2样品中仅有0.77 μg/g(表3);以苯乙酮为代表的酮类物质在Q1、Q2样品中含量较高,质量浓度分别为4.36 μg/g、4.67 μg/g,而Q3样品仅有0.29 μg/g,该物质在茶树鲜花中检测到,具有明显花香[28];含氮化物主要是在Q3样品中检测到,包括2,6-二甲基吡嗪、三甲基吡嗪、2-乙烯基-6-甲基吡嗪和四甲基吡嗪等,含量分别为0.23 μg/g、0.38 μg/g、0.25 μg/g、1.42 μg/g,这是酒精饮料中重要的一类香气化合物[29],可赋予大曲坚果、焙烤及炒花生的焦香味[26],同时Q3样品中检测到了其他两个样品未检测到的具有玫瑰、茉莉等花果香的苯乙醛(0.31 μg/g)、苯甲醇(0.11 μg/g)[30]、1-十五烯(0.64 μg/g),使得Q3样品风味可能更加饱满、层次可能更加丰富多样。总之,川派浓香型白酒成都、宜宾和泸州三大核心产区大曲的挥发性风味物质具有显著的差异,不同产区的大曲均有突出的典型挥发性风味物质代表,带有明显的“产区差异与特征”。
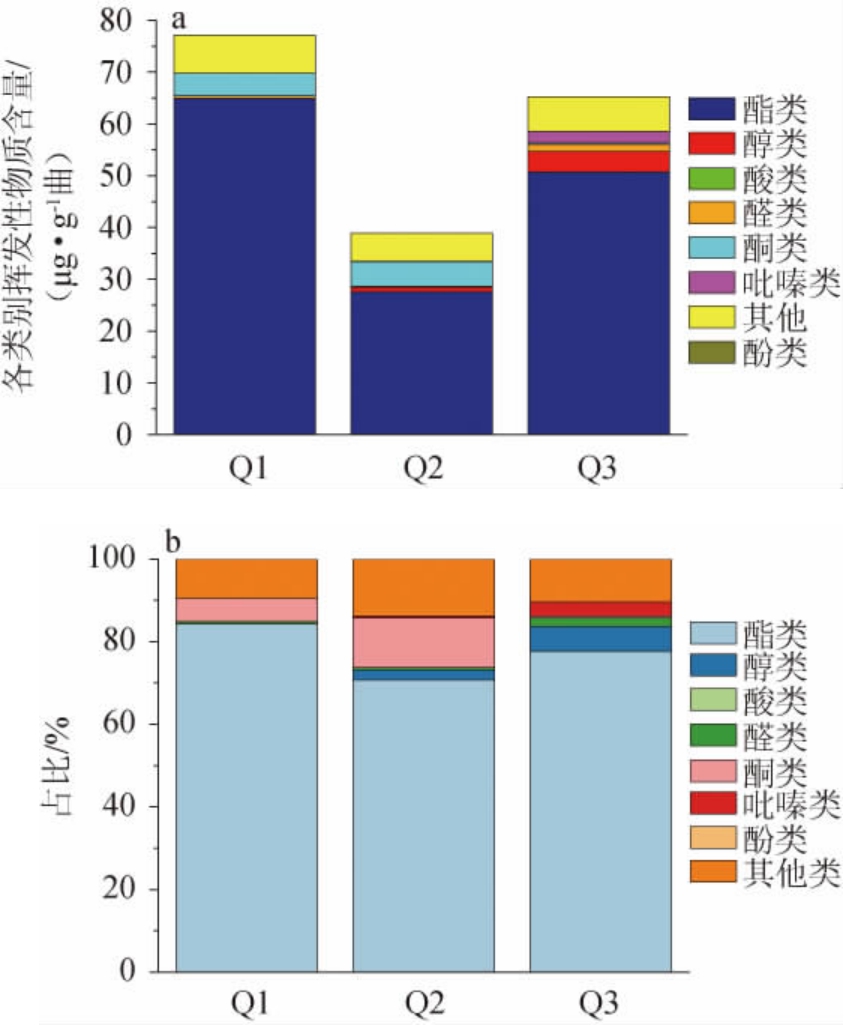
图3 三种大曲各类挥发性风味物质含量及占比
Fig.3 Contents and proportion of various categories volatile flavor compounds of three types of Daqu
表3 三种大曲挥发性风味物质含量
Table 3 Contents of volatile flavor substances in three types of Daqu
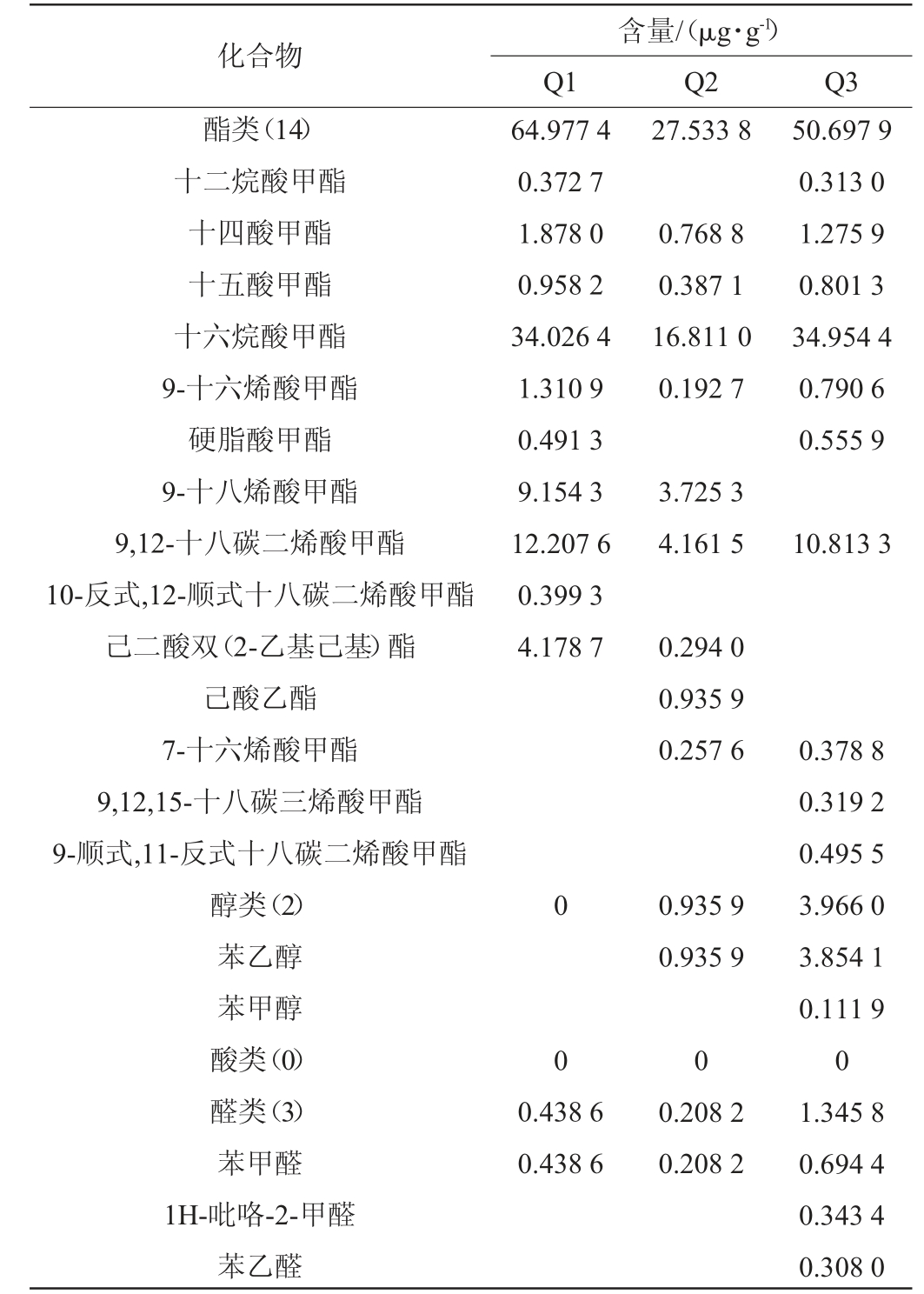
化合物酯类(14)十二烷酸甲酯十四酸甲酯十五酸甲酯十六烷酸甲酯9-十六烯酸甲酯硬脂酸甲酯9-十八烯酸甲酯9,12-十八碳二烯酸甲酯10-反式,12-顺式十八碳二烯酸甲酯己二酸双(2-乙基己基)酯己酸乙酯7-十六烯酸甲酯9,12,15-十八碳三烯酸甲酯9-顺式,11-反式十八碳二烯酸甲酯醇类(2)苯乙醇苯甲醇酸类(0)醛类(3)苯甲醛1H-吡咯-2-甲醛苯乙醛含量/(μg·g-1)Q1Q2Q3 64.977 4 0.372 7 1.878 0 0.958 2 34.026 4 1.310 9 0.491 3 9.154 3 12.207 6 0.399 3 4.178 7 27.533 8 0.768 8 0.387 1 16.811 0 0.192 7 50.697 9 0.313 0 1.275 9 0.801 3 34.954 4 0.790 6 0.555 9 3.725 3 4.161 5 10.813 3 0.294 0 0.935 9 0.257 6 00.935 9 0.935 9 0 0 0.438 6 0.438 6 0.208 2 0.208 2 0.378 8 0.319 2 0.495 5 3.966 0 3.854 1 0.111 9 0 1.345 8 0.694 4 0.343 4 0.308 0
续表

注:标中“()”内为挥发性物质数量,“空白”为未检出。
化合物酮类(1)苯乙酮吡嗪类(5)2,5-二甲基吡嗪2,6-二甲基吡嗪三甲基吡嗪四甲基吡嗪2-乙烯基-6-甲基吡嗪酚类其他(12)苯乙烯十三烷十二甲基环己硅氧十四烷2,6,10-三甲基十二烷艾考烷1,3-双(1,1-二甲基乙基)苯1,2-二甲氧基苯十二烷1-碘十六烷1H-环丙苜蓿1-十五烯挥发物质总含量含量/(μg·g-1)Q1Q2Q3 4.359 5 4.359 5 0 4.672 7 4.672 7 0.170 0 0.170 0 0.287 0 0.286 7 2.285 0 0 0 7.327 9 4.659 4 0.364 2 0.120 4 1.700 5 0.483 5 5.374 9 3.715 3 0.231 7 0.377 6 1.422 3 0.253 5 0 6.764 4 0.200 1 0.766 6 1.466 5 0.197 7 0.354 3 0.140 9 1.024 3 77.103 5 38.895 6 3.022 4 0.345 0 0.265 1 0.641 0 65.346 0
2.2.4 优势微生物菌属与挥发性风味物质及理化性质的相关性分析
以川派浓香型白酒成都、宜宾和泸州三大核心产区大曲的共性为出发点,探究四川地区大曲微生物群落组成与理化指标及代谢产物的相互关系。选择大曲微生物相对丰度排名前十的优势菌属,使用冗余分析(RDA)解析大曲样品中真菌属和细菌属与挥发性风味物质和大曲理化性质的关联性,结果如图4所示。

图4 真菌、细菌与挥发性风味物质(a)和理化指标(b)的相关性分析结果
Fig.4 Correlation analysis results between fungi, bacteria and volatile flavor substances (a) and physicochemical indexes (b)
根毛霉属(Rhizomucor)、泛菌属(Pantoea)、科萨克氏菌(Kosakonia)与糖化力、酯化力呈显著正相关(P<0.05),曲霉属(Aspergillus)和根霉属(Rhizopus)对酯类物质呈正相关,淀粉在霉菌类微生物的作用下转化为糖,供大曲中微生物的生长代谢,进而产生较多的酯类物质[21]。明串珠菌属(Leuconostoc)、乳酸杆菌(Lactobacillus)和魏氏斯菌属(Weissella)与酸度显著正相关(P<0.05),有报道显示这些微生物菌属是白酒酿造中产生酸性物质的重要微生物[23],此结果也与前文中Q3的酸度较高保持一致。大曲的发酵力主要与毕赤酵母属(Pichia)、魏氏斯菌属(Weissella)以及异常威克汉姆酵母属(Wickerhamomyces)显著相关(图4b,P<0.05)。同时,优势酵母类菌属(以Pichia和Wickerhamomyces为主)还与多种挥发性物质(以吡嗪类、苯乙醇、烯类物质等,图4a)密切相关。结合3个大曲样品的挥发性物质差异结果(图3和表3),因此推测,大曲样品富含相对更多的优势酵母类菌属可能使得原料糖利用途径和通路的多样性增加,从而获得了更多类别的前体挥发性风味物质。因此,未来更多的应该关注有益酵母类菌属在川派浓香型白酒其他主产区大曲中的突出贡献。
魏氏斯菌属(Weissella)是大曲Q3样品中的优势细菌属,在大曲Q2和Q1样品中的占比则是较低,仅为11.82%和3.09%,与苯乙醇、苯乙醛、苯甲醛及多种吡嗪类物质呈正相关。因此苯甲醛的含量高低与魏氏斯菌属(Weissella)的相对丰度趋势一致。在微生物菌属与大曲理化性质关联性的分析中,泛菌属(Pantoea)表现出与糖化力、酯化力和液化力三种理化指标的高度正相关。泛菌属(Pantoea)作为大曲样品Q1中的优势细菌属,其占比较高,因此Q1在糖化力、酯化力和液化力三种理化指标上对比Q2和Q3则是更为出色。通过RDA能够较为清晰的观察出不同微生物菌属与大曲的挥发性物质和理化性质的关联性,而不同地区的大曲样品存在着较为明显的微生物群落结构差异(图2),从而导致了大曲的风格和品质不同。因此,川派浓香型白酒成都、宜宾和泸州三大核心产区大曲之间的差异主要是由于微生物群落结构的不同导致的。
3 结论
比较了川派浓香型白酒成都、宜宾和泸州三大核心产区大曲的理化性质、微生物群落结构及挥发性物质。结果显示,成都曲样水分最低而发酵力更高,宜宾曲样的液化力和糖化力最高。嗜热子囊菌属(Thermoascus)是川派浓香白酒大曲的绝对优势真菌属,宜宾曲样优势细菌属为泛菌属(Pantoea),泸州曲样优势细菌属为热放线菌属(Thermoactinomyces)和魏氏斯菌属(Weissella),而魏氏斯菌属(Weissella)和乳酸杆菌属(Lactobacillus)则是成都曲样的优势细菌属。此外,不同产区的大曲均有突出的典型挥发性物质代表,如己酸乙酯、苯乙醛和苯甲醇等,带有明显的“差异与特征”。本研究结果将为初步阐明川派浓香型白酒成都、宜宾和泸州三大核心产区大曲的“密码、特征和共性”提供一定的数据支撑。
[1]XU P,WU Y J,CHEN H,et al.Promoting microbial community succession and improving the content of esters and aromatic compounds in strong-flavor Daqu via bioaugmentation inoculation[J].Food Biosci,2023,56:103299.
[2]ZHANG Q M,DU G C,CHEN J,et al.Systematic analysis of Baobaoqu fermentation starter for Wuliangye Baijiu by the combination of metagenomics and metabolomics[J].Front Microbiol,2022,13:1062547.
[3]ZHENG X W,HAN B Z.Baijiu(白酒),Chinese liquor:History,classification and manufacture[J].Ethnic Foods,2016,3(1):19-25.
[4]PANG Z M,LI W W,HAO J,et al.Correlational analysis of the physicochemical indexes,volatile flavor components,and microbial communities of high-temperature Daqu in the northern region of China[J].Foods,2023,12(2):326.
[5]MU Y,HUANG J,ZHOU R Q,et al.Comprehensive analysis for the bioturbation effect of space mutation and biofortification on strong-flavor Daqu by high-throughput sequencing,volatile analysis and metabolomics[J].Food Chem,2023,403:134440.
[6]GOU M,WANG H Z,YUAN H W,et al.Characterization of the microbial community in three types of fermentation starters used for Chinese liquor production[J].J I Brewing,2015,121(4):620-627.
[7]YANG L, FAN W L, XU Y.GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type Daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol,2021,146:111416.
[8]张良,赖家美.泸型酯化曲在发酵过程中生化性能变化的研究[J].酿酒科技,2009(7):36-39.
[9]ZHU C T,CHENG Y X,SHI Q L,et al.Metagenomic analyses reveal microbial communities and functional differences between Daqu from seven provinces[J].Food Res Int,2023,172:113076.
[10]DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[11]MA S Y,SHANG Z C,CHEN J,et al.Differences in structure,volatile metabolites,and functions of microbial communities in Nongxiangxing daqu from different production areas[J].LWT-Food Sci Technol,2022,166:113784.
[12]任宇婷,乔美灵,乌力吉德布兴,等.不同北方浓香型白酒大曲中微生物组成及理化差异分析[J].中国酿造,2022,41(11):49-55.
[13]王清龙,李海登,刘延波,等.河南不同地区浓香型白酒大曲理化性质和微生物多样性分析[J].中国酿造,2022,41(11):31-38.
[14]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[15]唐慧芳,黄钧,周荣清,等.空间异质性对大曲微生物群落的影响[J].食品科学,2023,44(14):206-215.
[16]JIA Y,NIU C T,LU Z M,et al.A bottom-up approach to develop a synthetic microbial community model:application for efficient reduced-salt broad bean paste fermentation[J].Appl Environ Microbiol, 2020, 86(12):e00306-20.
[17]吴树坤,谢军,程铁辕,等.不同地区浓香型大曲质量指标与细菌群落相关性研究[J].食品研究与开发,2019,40(4):158-164.
[18]王晓丹,班世栋,胥思霞,等.浓香型大曲中酶系与白酒品质的关系研究[J].中国酿造,2014,33(1):44-47.
[19]信春晖,许玲,夏晓波,等.自然环境与白酒酿造关系解析——水质与酿酒微生物的生长代谢[J].酿酒,2020,47(1):68-72.
[20]张会敏,王杰,何宏魁,等.利用非培养技术初步解析古井贡酒大曲真核微生物群落结构[J].食品工业,2014,35(6):158-162.
[21]ZOU W, ZHAO C Q, LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Front Microbiol,2018,9:671.
[22]章克昌.酒精与蒸馏酒工艺学[M].北京:中国轻工业出版社,2004:12-30.
[23]ZHAO Q S,YANG J G,ZHANG K Z,et al.Lactic acid bacteria in the brewing of traditional Daqu liquor[J].J I Brewing,2019,126(1):14-23.
[24]李中华,段雄波,李金钟.魏斯菌属细菌的分类与鉴定新进展[J].国际检验医学杂志,2006,27(8):721-723.
[25]SUN C X,ZHANG B,NING D L,ZHANG Y,et al.Seasonal dynamics of the microbial community in two full-scale wastewater treatment plants:Diversity, composition, phylogenetic group based assembly and co-occurrence pattern[J].Water Res,2021,200:117295.
[26]范文来,徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,38(4):80-84.
[27]WELKE J E, MANFROI V, ZANUS M, et al.Characterization of the volatile profile of Brazilian Merlot wines through comprehensive two dimensional gas chromatography time-of-flight mass spectrometric detection[J].J Chromatogr A,2012,1226:124-139.
[28]吴国火,崔林,王梦馨,等.茶树花香气及茶叶气味对中华蜜蜂的引诱效应[J].生态学报,2020,40(12):4024-4031.
[29]FAN W L,XU Y,ZHANG Y H.Characterization of pyrazines in some chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[30]CHEN L H,REN L X,LI D N,et al.Analysis of microbiomes in three traditional starters and volatile components of the Chinese rice wines[J].Food Sci Biotechnol,2021,30(1):87-96.