啶酰菌胺是一种新型烟酰胺类杀菌剂[1],化学名为2-氯-N-(4'-氯二苯-2-基)烟酰胺,能够防治灰霉病、白粉病、褐腐病、腐烂病、根腐病等[2-3],对其他药剂的抗性菌亦有效,杀菌谱较广,主要用于包括蔬菜、水果,以及粮食作物等病害的防治[4-5]。2004年,该药物在英国、德国等欧洲国家登记[6]。
啶酰菌胺会给人类健康造成严重的危害,因此,GB 2763—2021 食品安全国家标准《食品中农药最大残留限量》规定:生乳中啶酰菌胺的最大残留限量为0.1 mg/kg,蔬菜、水果中啶酰菌胺的最大残留限量范围为0.1~50 mg/kg[7]。我国也制定了相应的国家标准用于检测食品中啶酰菌胺的残留量。GB 23200.68—2016《食品安全国家标准食品中啶酰菌胺残留量的测定气相色谱-质谱法》对菠菜、胡萝卜、草莓、花生、板栗、茶叶、葱、鸡肉、鳕鱼和蜂蜜中啶酰菌胺的定量限为0.01 mg/kg[8];GB/T 22979—2008《牛奶和奶粉中啶酰菌胺残留量的测定气相色谱-质谱法》对牛奶中啶酰菌胺的检出限为0.01 mg/kg,对奶粉中啶酰菌胺的检出限为0.08 mg/kg[9]。
检测啶酰菌胺的方法有液相色谱法、气相色谱法等。王云凤等[10-13]分别利用液相色谱-质谱法、液相色谱-串联质谱法研究了蔬菜、水果中啶酰菌胺残留量的测定。陈莉等[14]使用高效液相色谱法测定了草莓和土壤样本中啶酰菌胺的残留量。郭庆龙等[15-17]利用高效液相色谱串联质谱法分别测定了蔬菜、水果等不同基质中啶酰菌胺的残留量。冯玉洁等[18-20]分别利用超高效液相色谱法、超高效液相色谱-串联质谱对水果、土壤等基质中的啶酰菌胺残留量进行了测定。迟迅等[21]利用气相色谱-质谱/质谱法测定了大米中的啶酰菌胺残留量。上述仪器方法检测药物的优点是准确,缺点是效率低、成本高,在基层实验室普及率较低。免疫化学法能够克服上述缺点。本研究将制备出的啶酰菌胺人工抗原,应用于胶体金试纸条中,操作步骤简便、操作时间短、试纸条成本低,适宜推广使用。
1 材料与方法
1.1 材料与试剂
啶酰菌胺、百菌清、苯醚菌酯、苯醚甲环唑、吡虫啉、吡噻菌胺、苯酰菌胺、吡唑醚菌酯、吡唑萘菌胺、草甘膦、敌菌灵、毒死蜱、对硫磷、多菌灵、氟胺氰菊酯、腐霉利、腈菌唑、三唑磷标准品(纯度≥95%):北京标准物质研究中心;啶酰菌胺人工抗原:北京勤邦科技股份有限公司。
BALB/c小鼠(许可证号:SCXK2019-0010):斯贝福(北京)生物技术有限公司;SP2/0骨髓瘤细胞:美国ATCC细胞库。
1.2 仪器与设备
MK3型酶标仪:上海雷勃分析仪器有限公司;Costar酶标板:北京诺博莱德科技有限公司;TDL-40B离心机:上海安亭科学仪器厂;CTD300数控裁条机:上海金标生物科技有限公司;HM3030 XYZ三维划膜喷金仪:上海金标生物科技有限公司;YAN-80CH 型二氧化碳培养箱:上海玉研科学仪器有限公司;ESJ110-4A电子天平:沈阳龙腾电子有限公司。
1.3 试验方法
1.3.1 多抗血清的制备及效价测定
利用啶酰菌胺人工抗原免疫BALB/c小鼠,即将与磷酸缓冲盐溶液(phosphate buffer saline,PBS)、氟氏完全佐剂(Freund complete adjuvant,FCA)/氟氏不完全佐剂(Freund incomplete adjuvant,FICA)混合的免疫原,在小鼠颈背部皮下进行注射,免疫结束后,取啶酰菌胺抗血清,进行抗血清效价测定[22]。
1.3.2 单克隆抗体的制备和纯化
细胞融合和克隆化:小鼠血清测定结果较高后,取其脾细胞,按8∶1(数量配比)的比例与SP2/0骨髓瘤细胞融合,采用间接竞争酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)测定细胞上清液,筛选阳性孔。利用有限稀释法对阳性孔进行克隆化,直到得到分泌单克隆抗体的杂交瘤细胞株。向BALB/c小鼠腹腔注射杂交瘤细胞,收集并纯化腹水。
细胞冻存和复苏:将单克隆杂交瘤细胞株用冻存液制成1×106个/mL的细胞悬液,在液氮中长期保存。复苏时取出冻存管,立即放入37 ℃水浴中速融,离心去除冻存液后,移入培养瓶内培养。
单克隆抗体的生产与纯化:将Balb/c小鼠腹腔注入灭菌石蜡油0.5 mL/只,7 d后腹腔注射稳定的单克隆杂交瘤细胞株5×105个/只,7 d后采集腹水。用辛酸-饱和硫酸铵法进行腹水纯化,-20 ℃保存。
1.3.3 单克隆抗体的特异性分析
灵敏度测定:采用间接竞争酶联免疫法,测定1.3.2制备的单克隆抗体对啶酰菌胺的50%抑制质量浓度(half maximal inhibitory concentration,IC50)值,以IC50值衡量该单克隆抗体的灵敏度[23];特异性测定:采用交叉反应试验,选择百菌清、苯醚菌酯、苯醚甲环唑、吡虫啉、吡噻菌胺、苯酰菌胺、吡唑醚菌酯、吡唑萘菌胺、草甘膦、敌菌灵、毒死蜱、对硫磷、多菌灵、氟胺氰菊酯、腐霉利、腈菌唑、三唑磷等药物(为蔬菜水果中可能的联合用药)作为抑制物,间接竞争酶联免疫法测定各抑制物的IC50值,以单克隆抗体对啶酰菌胺的IC50值与抑制物的IC50值百分比为其交叉反应率。
1.3.4 胶体金免疫层析试纸条的制备
用体积分数为0.5%的牛血清白蛋白磷酸盐缓冲液处理样品吸收垫,浸泡、烘干后备用。预先将啶酰菌胺人工抗原包被于反应膜上的检测线(T线),将羊抗鼠抗抗体包被于反应膜上的质控线(C线),干燥后备用。将样品吸收垫、结合物释放垫、反应膜、吸水垫依次按顺序粘贴在聚氯乙烯(polyvinyl chloride,PVC)底板上,切成适当宽度的小条,装在相应的塑料制卡中即可。
1.3.5 试纸条对啶酰菌胺检测限的测定
检测前样品应恢复至室温(20~30 ℃),取新鲜样品擦去泥土,剪碎成<1 cm2的碎片;称取(2.00±0.05)g样品至15 mL聚苯乙烯离心管中,再加入6 mL提取液,盖上盖子,涡旋仪涡动或手动上下振荡1 min,静置1 min得待测样品液。
检测时,向试纸条加样孔中滴加100 μL待测样品液,反应10 min,根据T线与C线的颜色深浅,判定检测结果,如果T线深于或等于C线显色,则说明检测结果为阴性,即待测样品中的啶酰菌胺浓度低于本试纸条的检测限;反之,则说明检测结果为阳性,即待测样品中的啶酰菌胺浓度等于或高于本试纸条的检测限。
1.3.6 试纸条准确性测定
采用胶体金试纸条检测待测样本,检测结果具有一定的假阳性率和假阴性率。如果检测一定数量的阳性样本时,未出现了阴性检测结果,即该试纸条的假阴性率为0;同时,检测一定数量的阴性样本时,出现了5%以内的阳性检测结果,即该试纸条的假阳性率<5%;那么,说明该试纸条的准确性较高,符合要求。为测定本试纸条的准确性,选取经过仪器法确证的50份阴性(质量浓度<5 μg/L)和50份阳性(质量浓度>5 μg/L)蔬菜水果样本,进行检测。
1.3.7 试纸条稳定性测定
在4 ℃、25 ℃、30 ℃、37 ℃条件下分别保藏试纸条(包括阴性样本和阳性样本),在不同时间测定,样本数各为20份,最终确定试纸条的最佳保藏温度和保质期。
2 结果与分析
2.1 抗血清效价的测定
根据方法1.3.1测定小鼠抗血清效价,计算抑制率,对应的稀释倍数即为抗血清效价值,结果见表1。由表1可知,3号小鼠产生的抗血清效价最高为360 000,同时,3号小鼠抗血清的抑制率亦最高为44.1%,因此3号小鼠的抗血清为最优选择。
表1 小鼠抗血清效价的测定结果
Table 1 Determination results of antiserum titer in mice
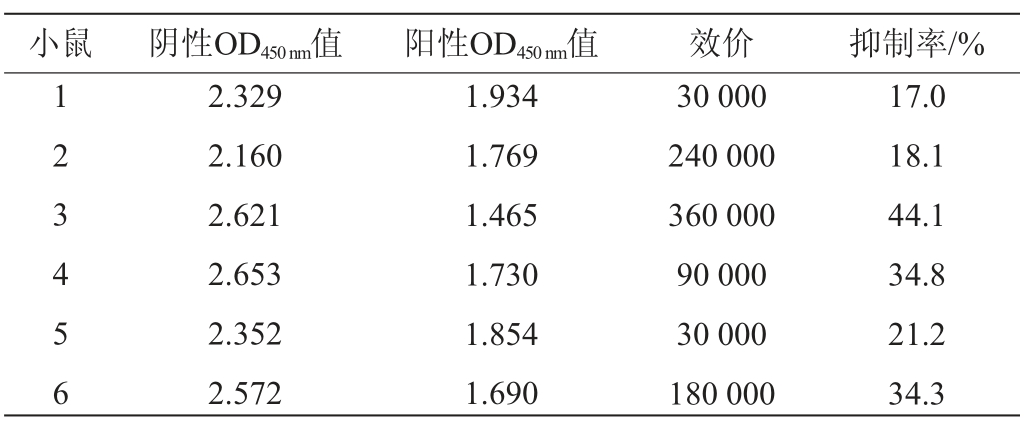
注:抑制率=(阴性OD450nm值-阳性OD450nm值)/阴性OD450nm值×100%。
小鼠阴性OD450 nm值阳性OD450 nm值效价抑制率/%123456 2.329 2.160 2.621 2.653 2.352 2.572 1.934 1.769 1.465 1.730 1.854 1.690 30 000 240 000 360 000 90 000 30 000 180 000 17.0 18.1 44.1 34.8 21.2 34.3
2.2 杂交瘤细胞的筛选
由图1可知,筛选到的3株阳性融合细胞株,随啶酰菌胺竞争浓度的增加,OD450 nm值均下降,其中Bos-102细胞株最为显著,说明其分泌的单克隆抗体对于啶酰菌胺的亲和力最高[24]。因此,选择该细胞株用于小鼠腹水的采集。
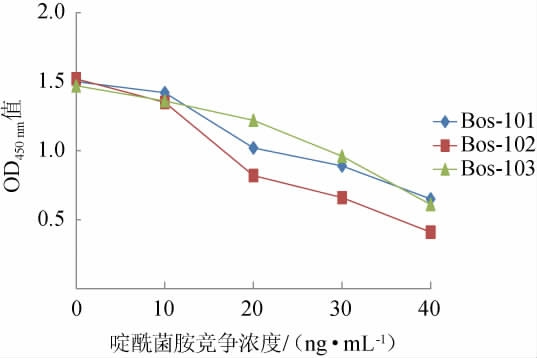
图1 杂交瘤细胞的筛选
Fig.1 Screening of hybridoma cells
2.3 单克隆抗体的特异性分析
抗体特异性用交叉反应率作为评价标准,比较抗体与抗原类似物、特定抗原结合的能力。抗体与抗原类似物的交叉反应率越低,与特定抗原的交叉反应率越高,说明抗体的特异性越好。百菌清、苯醚菌酯、苯醚甲环唑、吡虫啉、吡噻菌胺、苯酰菌胺、吡唑醚菌酯、吡唑萘菌胺、草甘膦、敌菌灵、毒死蜱、对硫磷、多菌灵、氟胺氰菊酯、腐霉利、腈菌唑、三唑磷等药物可能与啶酰菌胺联合用药,因此,选择上述药物比较特异性,结果见表2。由表2可知,单克隆抗体对啶酰菌胺具有特异性,与其结构类似物无交叉反应。
表2 抗啶酰菌胺单克隆抗体的交叉反应率
Table 2 Cross-reactivity rate of monoclonal antibodies against boscalid
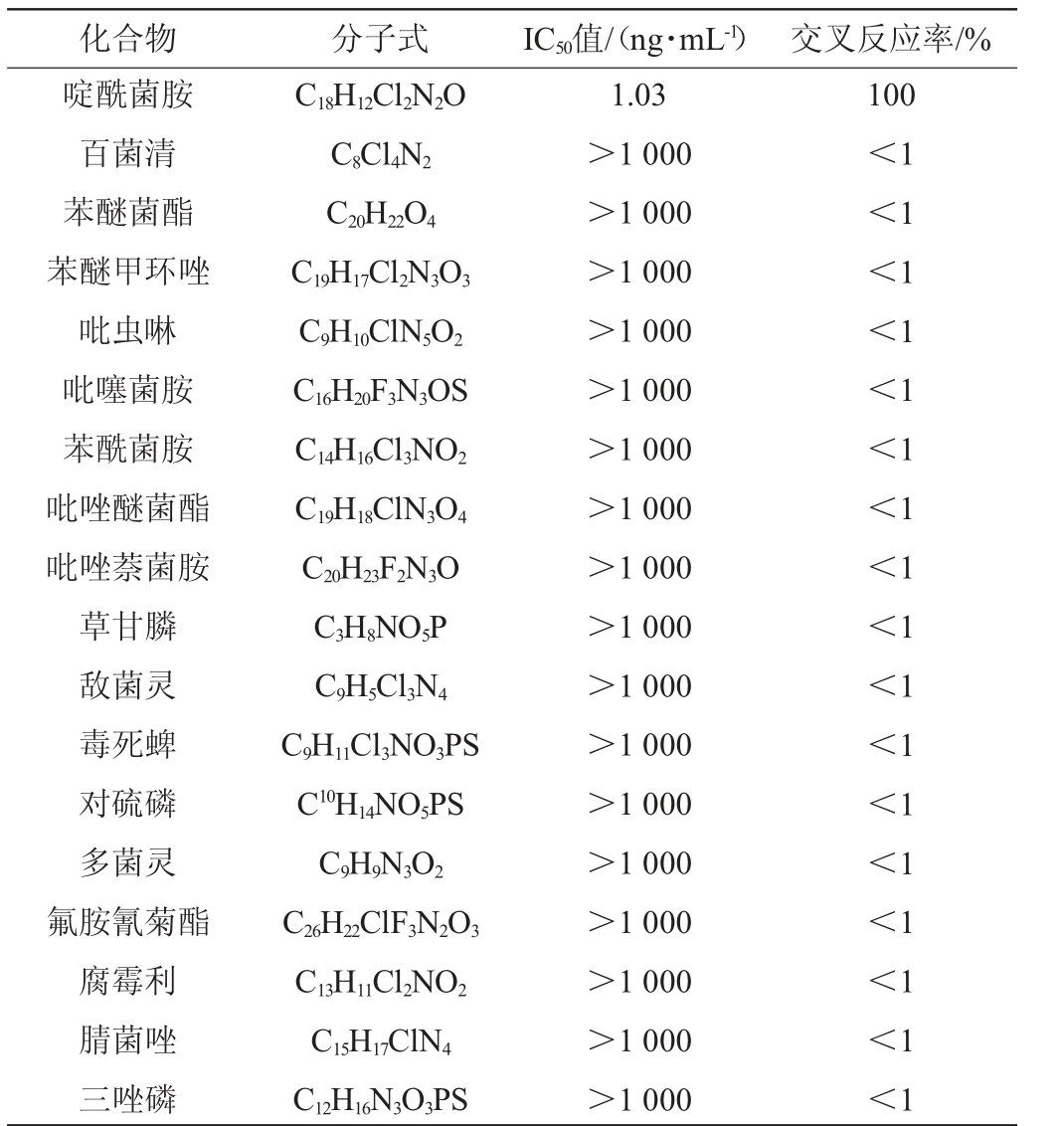
化合物分子式IC50值/(ng·mL-1) 交叉反应率/%啶酰菌胺百菌清苯醚菌酯苯醚甲环唑吡虫啉吡噻菌胺苯酰菌胺吡唑醚菌酯吡唑萘菌胺草甘膦敌菌灵毒死蜱对硫磷多菌灵氟胺氰菊酯腐霉利腈菌唑三唑磷C18H12Cl2N2O C8Cl4N2 C20H22O4 C19H17Cl2N3O3 C9H10ClN5O2 C16H20F3N3OS C14H16Cl3NO2 C19H18ClN3O4 C20H23F2N3O C3H8NO5P C9H5Cl3N4 C9H11Cl3NO3PS C10H14NO5PS C9H9N3O2 C26H22ClF3N2O3 C13H11Cl2NO2 C15H17ClN4 C12H16N3O3PS 1.03>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000>1 000 100<1<1<1<1<1<1<1<1<1<1<1<1<1<1<1<1<1
2.4 试纸条对啶酰菌胺检测限的测定
利用啶酰菌胺标准溶液配制含2.5 μg/L、5 μg/L、10 μg/L啶酰菌胺的蔬菜水果(韭菜、黄瓜、葡萄、杧果)样本,根据方法1.3.5检测上述样本,3次重复,结果见图2。由图2可知,T线显色由强(0 μg/L)到弱,在质量浓度5 μg/L时T线显色弱于C线,检测为阳性。由此确定本试纸条对蔬菜水果样本的检测限为5 μg/L,根据GB 2763—2021《食品安全国家标准食品中农药最大残留限量》规定:蔬菜、水果中啶酰菌胺的最大残留限量范围为0.1~50 mg/kg,本试纸条检测限符合GB 2763—2021《食品安全国家标准食品中农药最大残留限量》规定的最大残留限量要求。


图2 试纸条检测限的确定
Fig.2 Determination of detection limit of strip
2.5 试纸条准确性测定
根据方法1.3.6测定试纸条的假阴性率和假阳性率,检测各50份阳性韭菜、黄瓜、葡萄、杧果样本,假阴性率为0%;检测各50份阴性韭菜、黄瓜、葡萄、杧果样本,出现了不同数量的阳性检测结果,假阳性数量分别为0、2、1、3,即假阳性率分别为0%、4%、2%、6%。
假阳性率和假阴性率是评价试纸条准确性的重要指标。湖北省市场监督管理局发布的DB42/T 1868—2022《食品快速检测产品评价技术规范》、深圳市市场监督管理局发布的DB4403/T 96—2020《食品快速检测产品评价技术规范》[25]中均规定:对没有国家规定食品快速检测方法的,假阳性率应≤15%、假阴性率应≤5%。江西省市场监督管理局发布的DB36/T 1334—2020《食品快速检测产品评价技术规范》[26]中规定:没有国家规定食品快速检测方法的,假阴性率和假阳性率应根据在实际样品的检出情况评估是否符合需求。本试纸条对比上述标准,符合要求,优于规范指标。
2.6 试纸条稳定性测定
根据方法1.3.7测定试纸条的稳定性,结果见表3。由表3可知,试纸条于4 ℃、25 ℃、30 ℃、37 ℃能够保藏12个月、15 d、15 d、7 d,若超过上述保存期限,则试纸条出现个别失效或者假阳性结果,准确性相对下降。因此,市场销售时,建议将试纸条放置于4 ℃、12个月内使用。
表3 试纸条稳定性测定结果
Table 3 Determination results of strip stability
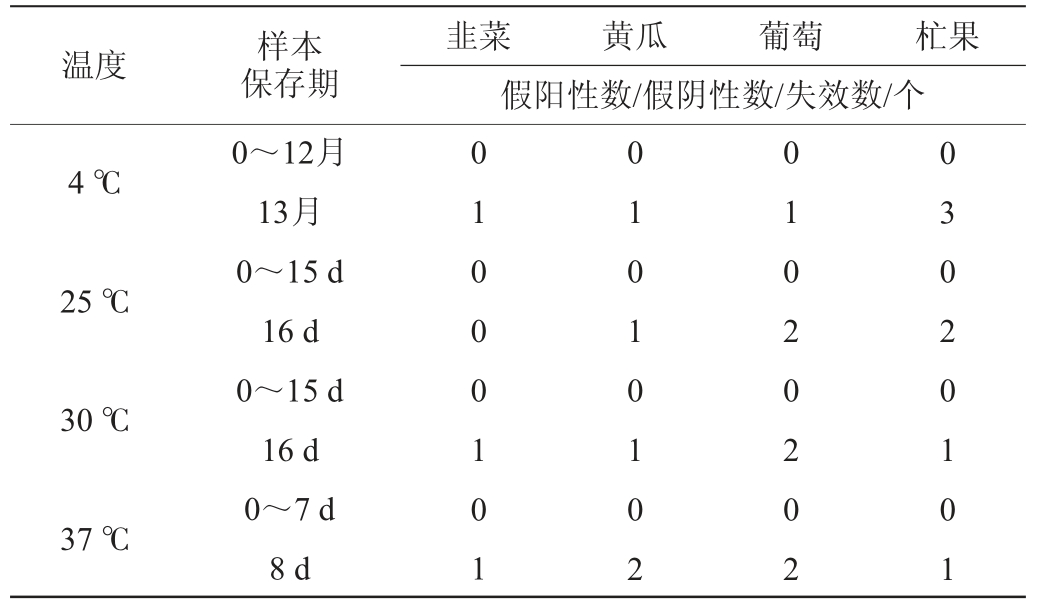
温度样本保存期韭菜黄瓜葡萄杧果假阳性数/假阴性数/失效数/个4 ℃25 ℃30 ℃37 ℃0~12月13月0~15 d 16 d 0~15 d 16 d 0~7 d 8 d 01000101 01010102 01020202 03020101
3 结论
本研究合成了啶酰菌胺半抗原,然后通过羧基与牛血清白蛋白、卵清蛋白进行偶联,进而制备出啶酰菌胺的人工完全抗原。通过免疫小鼠后,成功制备了高特异性和高灵敏度的抗啶酰菌胺单克隆抗体,IC50值为1.03 ng/mL,与百菌清、苯醚菌酯、苯醚甲环唑、吡虫啉、吡噻菌胺、苯酰菌胺、吡唑醚菌酯、吡唑萘菌胺、草甘膦、敌菌灵、毒死蜱、对硫磷、多菌灵、氟胺氰菊酯、腐霉利、腈菌唑、三唑磷等17种药物无交叉反应,特异性强。
将制备的单克隆抗体用于胶体金免疫层析试纸条,建立一种快速检测蔬菜水果中啶酰菌胺残留的方法,检测限为5 μg/L,符合GB 2763—2021《食品安全国家标准食品中农药最大残留限量》规定的最大残留限量要求;可准确检测出阳性样品,但对于阴性样本,由于通过肉眼观察颜色来判断结果,可能出现假阳性等问题,因此通过使用胶体金读数仪进行结果判读,可以提高效率;并且对于阳性样品,还需要用仪器方法进行确证。尽管如此,该方法作为快速筛查手段,能够用于大批量蔬菜水果中啶酰菌胺残留样本的现场筛查,具有重要的经济价值和社会价值。
[1]连少博,王霞,吕莹,等.豆瓣菜中啶酰菌胺残留及膳食摄入风险评估[J].农药学学报,2020,22(3):504-509.
[2]唐俊,汤锋,操海群,等.啶酰菌胺在黄瓜和土壤中残留分析方法研究[J].安徽农业大学学报,2008(4):550-554.
[3]乔广行,黄金宝,周莹,等.北京地区番茄灰霉病菌对啶酰菌胺抗药性检测[C].中国植物病理学会.中国植物病理学会2019年学术年会论文集.中国农业科学技术出版社,2019.
[4]颜范勇,刘冬青,司马利锋,等.新型烟酰胺类杀菌剂—啶酰菌胺[J].农药,2008(2):132-135.
[5]傅强,黄颖婕,付启明,等.啶酰菌胺在马铃薯中残留量的膳食摄入风险评估[J].现代农药,2018,17(1):40-42.
[6]姚福泉,侯禄怀,赵云,等.食用玫瑰和土壤中啶酰菌胺残留量的测定研究[J].食品安全导刊,2022(33):113-116.
[7]国家卫生健康委员会,农业农村部,国家市场监督管理总局.GB 2763—2021 食品安全国家标准食品中农药最大残留限量[S].北京:中国农业出版社有限公司,2021.
[8]国家卫生和计划生育委员会,农业部,国家食品药品监督管理总局.GB 23200.68—2016 食品安全国家标准食品中啶酰菌胺残留量的测定气相色谱-质谱法[S].北京:中国农业出版社有限公司,2016.
[9]国家质量监督检验检疫总局.GB/T 22979—2008 牛奶和奶粉中啶酰菌胺残留量的测定气相色谱-质谱法[S].北京:中国农业出版社有限公司,2008.
[10]王云凤,王伟,秦洪健,等.液相色谱-质谱法测定果蔬中10种酰胺类杀菌剂残留量[J].食品研究与开发,2010,31(1):113-116.
[11]陈小龙,李正翔,曹赵云,等.液相色谱-串联质谱法测定蔬菜和水果中6种新型酰胺类杀菌剂的残留量[J].色谱,2013,31(10):954-960.
[12]陈达捷,张志刚,周昱,等.串联固相萃取-液相色谱-串联质谱法测定食品中嘧啶胺类杀菌剂残留[J].色谱,2012,30(9):896-902.
[13]曹赵云,牟仁祥,应兴华,等.液相色谱-串联质谱法测定蔬菜、水果中80种农药残留[J].分析测试学报,2010,29(10):1030-1035.
[14]陈莉,贾春虹,贺敏,等.草莓和土壤中啶酰菌胺残留量的高效液相色谱分析[J].农药,2009,48(5):360-361,364.
[15]郭庆龙,崔淑华,段浩,等.高效液相色谱串联质谱法测定蔬果中啶酰菌胺和环酰菌胺残留[J].食品科学,2012,33(10):255-259.
[16]张亮,朱勇,赵健,等.高效液相色谱串联质谱法测定杨梅中吡唑醚菌酯和啶酰菌胺残留[J].浙江农业科学,2017,58(9):1556-1558.
[17]王思威,刘艳萍,孙海滨.HPLC-MS/MS测定不同基质中啶酰菌胺和多杀霉素残留量[J].农药,2017,56(12):897-900.
[18]冯玉洁,潘飞,谢圣华,等.超高效液相色谱法测定啶酰菌胺和咯菌腈在番茄与土壤中的残留[J].热带作物学报,2019,40(3):596-600.
[19]刘倩宇,刘颖超,董丰收,等.超高效液相色谱-串联质谱检测桃中吡唑醚菌酯和啶酰菌胺残留和消解[J].现代农药,2020,19(1):40-43,56.
[20]汤永娇,袁宏球,朱珠,等.超高效液相色谱法测定芒果中啶酰菌胺和吡唑醚菌酯[J].食品科学,2014,35(20):175-179.
[21]迟迅,赵韫慧,刘洋,等.气相色谱-质谱/质谱法测定大米中环酰菌胺和啶酰菌胺残留量[J].长春中医药大学学报,2019,35(5):923-928.
[22]李亚琪.二氯喹啉酸和苄嘧磺隆免疫分析方法研究[D].北京:中国农业科学院,2021.
[23]LI P W, ZHOU Q, WANG T, et al.Development of an enzyme-linked immunosorbent assay method specific for the detection of G-group aflatoxins[J].Toxins,2016,8(1):5.
[24]余梅,张智淮,张玉超,等.邻苯二甲酸二戊酯半抗原的合成及酶联免疫分析法的建立[J].食品科技,2022,47(7):296-302.
[25]深圳市市场监督管理局.DB4403/T 96—2020 食品快速检测产品评价技术规范[S].深圳:深圳出版社,2020.
[26]江西省市场监督管理局.DB36/T 1334—2020 食品快速检测产品评价技术规范[S].江西:江西科学技术出版社,2020.