枸杞(Lycium chinense Miller)是药食同源性植物[1],含有枸杞多糖、类胡萝卜素、黄酮、蛋白质、甜菜碱以及钙、磷、铁、硒等生物活性物质[2-5],具有抗氧化、抗衰老、降低血糖、增强免疫力等多种保健作用而被消费者所青睐[6-9]。枸杞食用方法主要有泡茶或煲汤,其大多数有效功能成分集中于水提物中[10]。目前,枸杞活性成分的提取方法主要有水提法、酶解提取法、超声辅助提取法和微波辅助提取法等[11-13]。水提法有提取成本低、安全性高、操作简单等优点,SKENDERIDIS P等[14]研究表明,使用水提法得到枸杞样品的提取物中多酚含量较高,达79.458 mg/g,这可能与枸杞样品中酚类物质的水溶性有关;张君等[15]采用水提法对枸杞中的多糖成分进行提取,其提取量达0.475 g/g。
超高压液相色谱串联四级杆飞行时间质谱(ultra performance liquid chromatography/coupled with quadrupole-time of flight mass spectrometry,UPLC-QTOF-MS)在天然产物的成分分析中具有独特的优点,具有高分辨率、高灵敏度的定性分析能力,可以实现复杂多组分的分析,具有样品需求量少、操作简便、分析周期短等优势[16-17]。GEBRU Y A等[18]运用UPLC-QTOF-MS首次在画眉草中鉴定出61种生物活性化合物,主要成分为酚类化合物和皂苷;LEE M等[19]采用UPLCQTOF-MS/MS在4个作物品种益生菌蔬菜汁中的发酵代谢产物中鉴定出15种化合物。目前,鲜见采用UPLC-QTOF-MS鉴定枸杞提取液中水溶性抗氧化物的研究报道
本研究采用水提法对枸杞中水溶性物质进行提取,在单因素试验的基础上,考察料液比、提取温度和提取时间对清除1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的半抑制浓度(half maximal inhibitory concentration,IC50)值的影响,采用响应面法优化枸杞水溶性抗氧化活性物质的提取工艺,并利用超高压液相色谱串联四级杆飞行时间质谱(UPLC-QTOF-MS)分析枸杞水提液中的抗氧化活性成分,以期为枸杞抗氧化活性评价及开发利用提供理论依据和技术支撑,促进枸杞深加工产品的开发及利用。
1 材料与方法
1.1 材料与试剂
宁夏枸杞(Lycium barbarum L.):于宁夏银川枸杞种质资源圃采摘,冷冻干燥研磨成粉末经80目过筛备用。
抗坏血酸(分析纯):福州飞净生物科技有限公司;无水乙醇(分析纯):天津市大茂化学试剂厂;甲醇、乙腈(均为质谱级):德国默克公司;亮氨酸脑啡肽(色谱纯):美国Waters公司;甲酸(色谱纯):美国ThermoFisher公司;标品:芦丁、山奈酚、水仙苷、异槲皮苷、绿原酸、阿魏酸、α-亚麻酸、甜菜碱、枸杞酸、对香豆酸、DPPH(均为分析纯):上海源叶生物科技有限公司。
1.2 仪器与设备
AB204-S电子天平:梅特勒托利多集团;HWS-26型电热恒温水浴锅:上海科恒实业发展有限公司;722S分光光度计:精科仪器(上海)有限公司;KQ5200DB型数控超声波清洗器:昆山市超声仪器有限公司;台式高速冷冻离心机:上海力申科学仪器有限公司;Xevo G2-S QTof超高效液相色谱串联四级杆飞行时间质谱:美国Waters公司。
1.3 实验方法
1.3.1 枸杞水溶性物质的提取
根据李玲梅等[20]的提取方法,稍作修改。以枸杞冻干粉末为原料,准确称取10.00 g,以料液比1∶120(g∶mL)加入蒸馏水,提取时间为1 h,提取温度为85 ℃,静置冷却后用滤纸过滤,得到枸杞水提液。
1.3.2 提取条件优化
单因素试验:在上述提取条件的基础上,分别考察枸杞与水的料液比(1∶60、1∶90、1∶120、1∶150、1∶180(g∶mL)),提取时间(0.5 h、1.0 h、1.5 h、2.0 h、2.5 h),提取温度(40 ℃、55 ℃、70 ℃、85 ℃、100 ℃)对枸杞水提液清除DPPH自由基的IC50值的影响。
响应面试验:在单因素试验结果的基础上,根据Box-Benhnken的中心组合试验设计原理,以料液比(A)、提取温度(B)、提取时间(C)为自变量,以清除DPPH自由基的IC50值(Y)为响应值,设计3因素3水平的响应面试验优化其提取工艺条件。响应面试验设计因素与水平见表1。
表1 提取条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for extraction conditions optimization

因素A 料液比(g:mL)B 提取温度/℃C 提取时间/h-1水平0 1 1∶120 60 1.0 1∶150 70 1.5 1∶180 80 2.0
1.3.3 DPPH自由基清除能力的测定
按照ERKAYA-KOTAN T[21]的方法,稍作修改,吸取3.0 mL稀释至不同浓度的枸杞水提液,分别加入3.0 mL的0.1 mmol/L的DPPH乙醇溶液,记为As;以等量无水乙醇代替DPPH乙醇溶液,记为Ab;以等量蒸馏水替换枸杞水提液,记为Ac;并用抗坏血酸作阳性对照,混匀后避光于室温下反应30 min,用体积分数50%的无水乙醇调零,于波长517 nm处测定吸光度值,计算DPPH自由基清除率(公式如式(1)),并计算出清除DPPH自由基一半浓度所需样品浓度为IC50值。
1.3.4 超高压液相色谱飞行时间质谱分析
利用UPLC-QTOF-MS分析枸杞水提液与加入DPPH自由基反应后的枸杞水提液中的差异化合物,筛选枸杞水提液中的主要抗氧化成分。
液相色谱条件:色谱柱为ACQUITY UPLC HSS T3(100 mm×2.1 mm,1.8 μm);柱温箱温度为40 ℃,自动进样器温度为4 ℃,进样体积为1.0 μL,流动相A为0.1%甲酸-水溶液,流动相B为0.1%甲酸-乙腈,洗脱梯度:0~2 min,99%A、1%B;2~12 min,93%~90%A、7%~10%B;12~15 min,90%~45% A、10%~55%B;15 ~22 min,45%~1% A、55%~99%B;22~25 min,1%A、99%B。
质谱条件:正离子模式:电喷雾离子(electron spray ionization,ESI)源;毛细管电压3.0 kV;锥孔电压40 V;离子源温度120 ℃;脱溶剂气温度350 ℃;锥孔气流速150 L/h;脱溶剂气流速600 L/h;碰撞能量为6 eV(一级)和20~45 eV(二级);扫描方式:全扫描。负离子模式:电喷雾离子源;毛细管电压2.5 kV;锥孔电压40 V;离子源温度120 ℃;脱溶剂气温度350 ℃;锥孔气流速150 L/h;脱溶剂气流速800 L/h;碰撞能量为6eV(一级)和20~45eV(二级);扫描方式:全扫描。
定性分析:利用Progenesis QI软件对MassLynxV4.1采集的原始数据进行预处理,选取峰度>200,倍数变化(Fold Change)>2条件下对正负离子模式下抗氧化活性的化合物进行筛选,根据公共数据库和自建库对检测的代谢物的相对分子质量、保留时间、分子离子峰进行匹配来对化合物定性。
1.3.5 数据分析
采用Microsoft office excel 2021和Origin 2022进行数据处理和图表制作,响应面采用Design-Expert V8.0.6进行设计和数据分析。
2 结果与分析
2.1 提取条件优化单因素试验结果
2.1.1 料液比的确定
料液比对DPPH自由基清除率的影响见图1。由图1可知,随着提取溶剂体积的增加,IC50值呈明显下降趋势,当料液比为1∶150(g∶mL)时,IC50值为2.05 g/L;继续增加提取溶剂的体积,IC50值趋于平稳。其原因可能是随着提取溶剂继续增加,即使抗氧化物有少量溶出,但由于被溶剂稀释使DPPH自由基清除率增加不明显[22]。因此,确定最佳料液比为1∶150(g∶mL)。
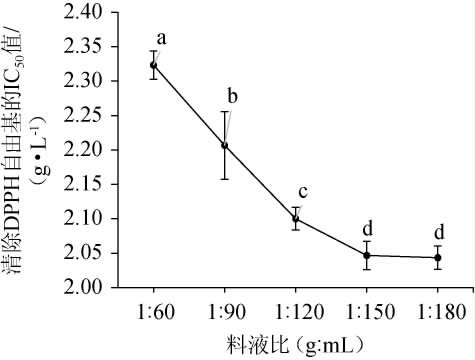
图1 料液比对DPPH自由基清除率的影响
Fig.1 Effect of solid-liquid ratio on DPPH free radical clearing rate
不同小写字母表示差异显著(P<0.05)。下同。
2.1.2 提取时间的确定
提取时间对DPPH自由基清除率的影响见图2。由图2可知,随着提取时间在0.5~2.0 h范围内的增加,IC50值呈下降趋势;当提取时间为2.0 h时,IC50值为1.98 g/L;提取时间>2.0 h,IC50值变化趋于稳定,其原因可能是,枸杞中水溶性抗氧化物质的提取已达到最大限度,此后再增加提取时间对其抗氧化物质的提取并无实际意义。因此,确定最佳提取时间为1.5 h。
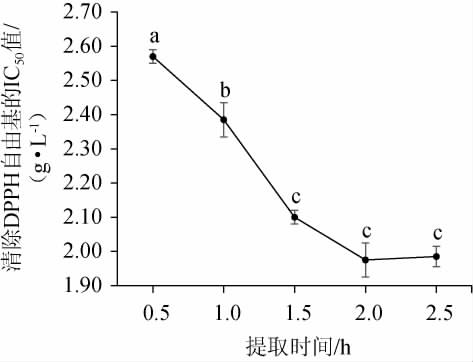
图2 提取时间对DPPH自由基清除率的影响
Fig.2 Effect of extraction time on DPPH free radical clearing rate
2.1.3 提取温度的确定
提取温度对DPPH自由基清除率的影响见图3。由图3可知,随着提取温度在40~70 ℃范围内的增加,IC50值呈逐渐下降的趋势;当提取温度为70 ℃时,IC50值最小,达到了1.83 g/L;当提取温度>70 ℃,IC50值上升。其原因可能是,温度决定溶质的热运动能力[23],温度越低水溶性抗氧化物质的溶解性越小,无法完全溶解,使得提取量较少,当增加提取温度后,枸杞中的水溶性抗氧化物质增加,提取效果明显增强,但由于水溶性抗氧化物质本身易被氧化,当继续增加温度后,水溶性抗氧化物质的氧化程度也随即增加,从而使提取效果减弱,因此,确定最佳提取温度选择为70℃。
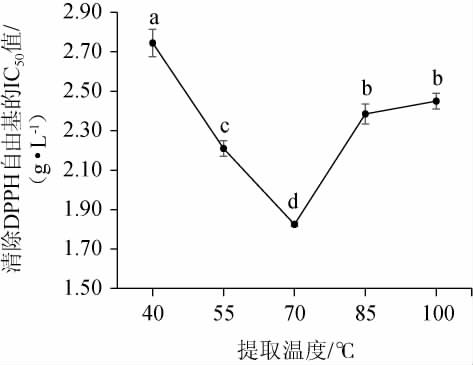
图3 提取温度对DPPH自由基清除率的影响
Fig.3 Effect of extraction temperature on DPPH free radical clearing rate
2.2 提取工艺优化响应面试验
在单因素试验结果的基础上,以液料比(A)、提取温度(B)、提取时间(C)为自变量,以IC50值(Y)为响应值,采用Design-Expert V8.0.6.1软件设计响应面试验,试验设计及结果见表2,方差分析见表3。
表2 提取条件优化响应面试验设计及结果
Table 2 Design and results of response surface tests for extraction conditions optimization
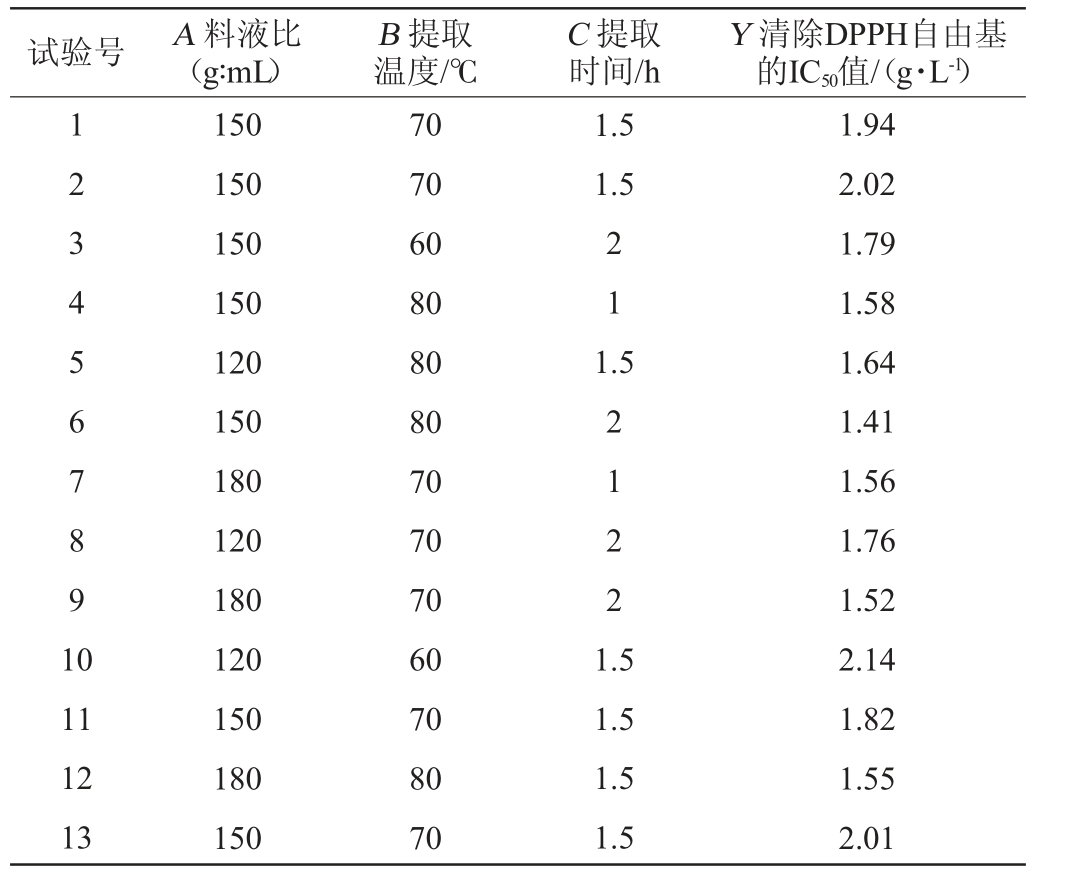
试验号 A 料液比(g∶mL)B 提取温度/℃C 提取时间/h Y 清除DPPH自由基的IC50值/(g·L-1)1234567891 0 1.5 1.5 21 1.5 2122 11 12 13 150 150 150 150 120 150 180 120 180 120 150 180 150 70 70 60 80 80 80 70 70 70 60 70 80 70 1.5 1.5 1.5 1.5 1.94 2.02 1.79 1.58 1.64 1.41 1.56 1.76 1.52 2.14 1.82 1.55 2.01
续表
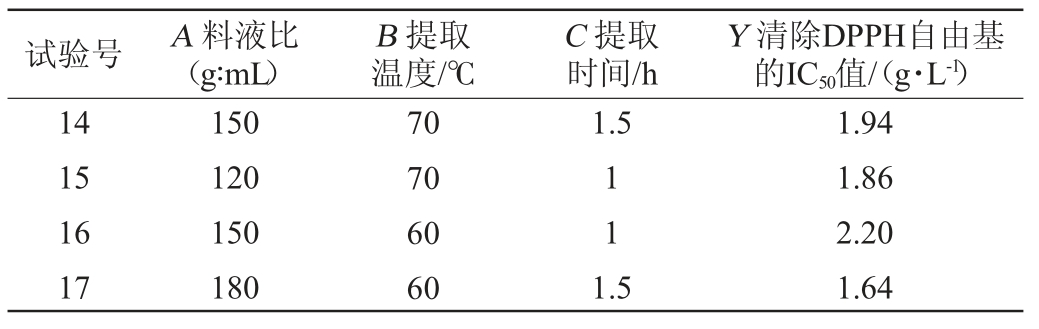
试验号 A 料液比(g∶mL)B 提取温度/℃C 提取时间/h Y 清除DPPH自由基的IC50值/(g·L-1)14 15 16 17 150 120 150 180 70 70 60 60 1.5 11 1.5 1.94 1.86 2.20 1.64
表3 回归模型方差分析
Table 3 Variance analysis of regression model
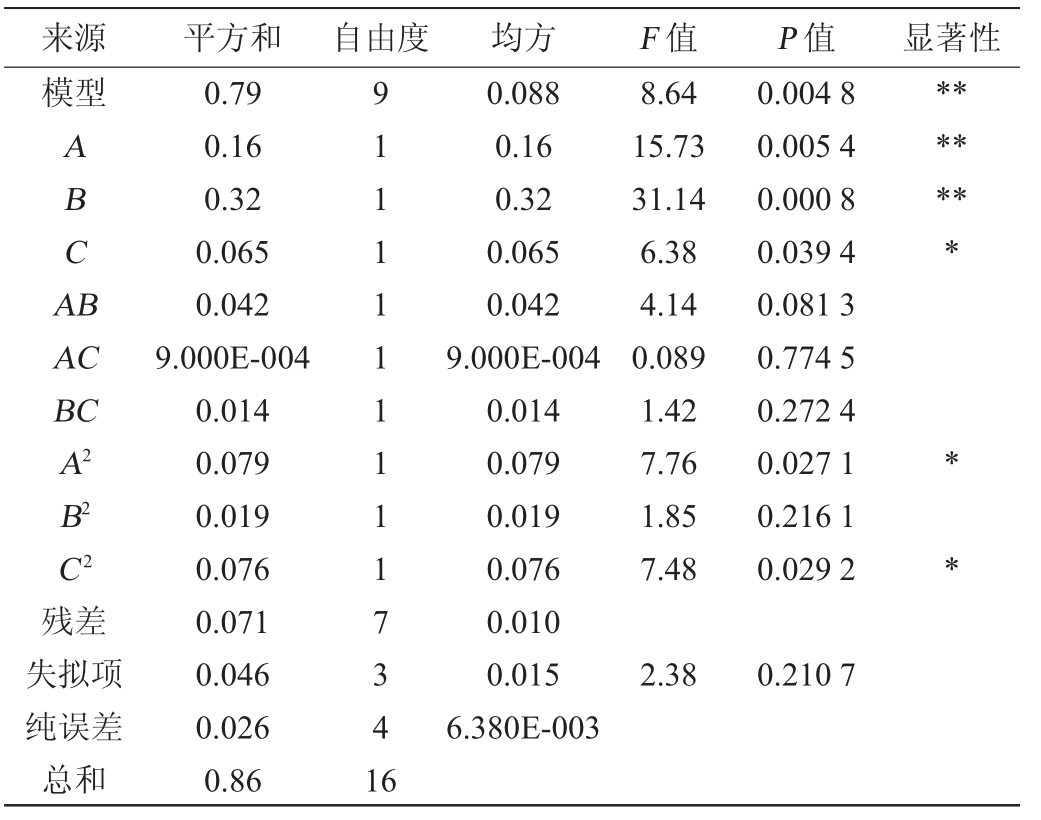
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源平方和 自由度均方F 值模型P 值显著性ABCA B*******AC BC A2 B2 C2 8.64 15.73 31.14 6.38 4.14 0.089 1.42 7.76 1.85 7.48 0.004 8 0.005 4 0.000 8 0.039 4 0.081 3 0.774 5 0.272 4 0.027 1 0.216 1 0.029 2**残差失拟项纯误差总和0.79 0.16 0.32 0.065 0.042 9.000E-004 0.014 0.079 0.019 0.076 0.071 0.046 0.026 0.86 91111111117341 6 0.088 0.16 0.32 0.065 0.042 9.000E-004 0.014 0.079 0.019 0.076 0.010 0.015 6.380E-003 2.38 0.210 7
采用Design-Expert V8.0.6软件对表2试验结果进行多元二次回归拟合分析,得到回归方程:
由表3可知,回归模型极显著(P=0.004 8<0.01),失拟项不显著(P=0.210 7>0.05),说明该回归模型合理。决定系数R2=0.917 4,调整决定系数R2adj=0.904 6,变异系数(coefficient of variation,CV)为5.64%<10%,表明试验的可信度与精确度高,与实际试验拟合程度良好,试验误差小,即该模型能较好地反映枸杞中抗氧化活性物质的DPPH清除能力与料液比、提取时间和提取温度的关系。由P值可知,一次项A、B对结果影响极显著(P<0.01),一次项C、二次项A2、C2对结果影响显著(P<0.05),其他项结果影响均不显著(P>0.05)。由F值可知,对IC50值影响的因素主次顺序为提取温度(B)>液料比(A)>提取时间(C)。各因素间交互作用对结果影响的响应面见图4。
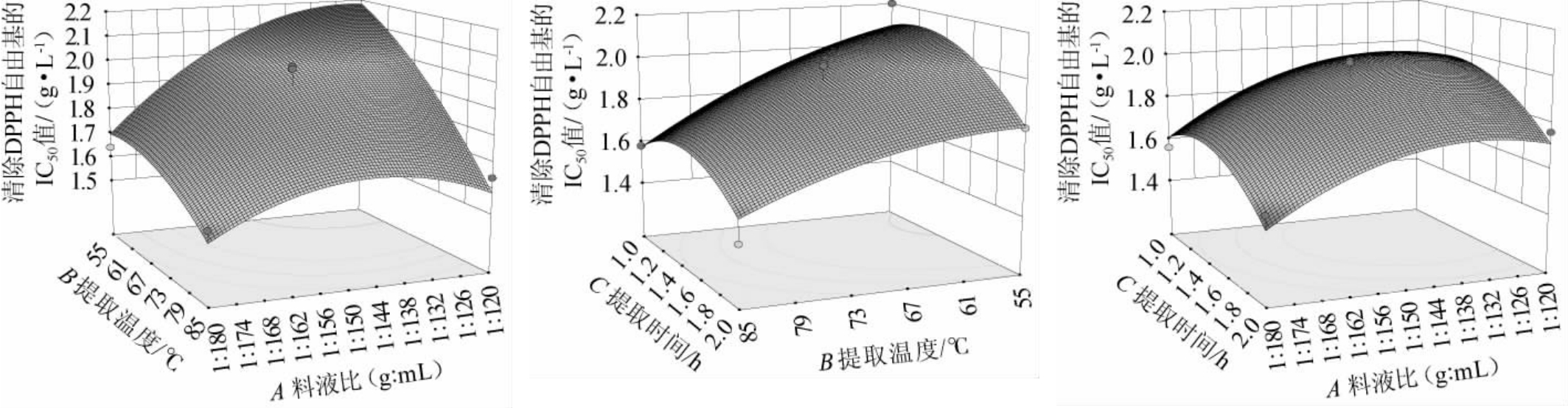
图4 各因素间交互作用对清除DPPH自由基的IC50值影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between various factors on IC50 value of scavenging DPPH radicals
响应面曲线越陡峭,说明对结果影响较大,反之,影响较小。由图4可知,各因素间交互作用响应面曲线平缓,说明对结果影响较小,这与方差分析结果一致。采用Design-Expert V8.0.6对多元二次回归方程求解,得到枸杞水抗氧化活性成分提取的最佳条件为:料液比1∶179.78(g∶mL),提取温度79.89 ℃,提取时间1.98 h,在此条件下,IC50预测值为1.373 g/L。根据实际操作可行性将提取条件修正为料液比为1∶180(g∶mL),提取温度为80 ℃,提取时间为2 h,在此条件下进行3次平行验证试验,IC50实际值为1.34 g/L,与预测结果接近,说明回归方程有较高准确度,响应面法优化枸杞抗氧化活性成分的提取工艺有效可行。
2.3 枸杞水提液中抗氧化物质的UPLC-QTOF-MS分析
枸杞水提液与DPPH溶液反应后,抗氧化成分的峰面积减小甚至峰消失,无抗氧化特性的化合物峰面积变化不大,枸杞水提液中抗氧化成分分析结果见表4。
表4 枸杞水提液中抗氧化成分分析结果
Table 4 Analysis results of antioxidant components in aqueous extracting solution of goji
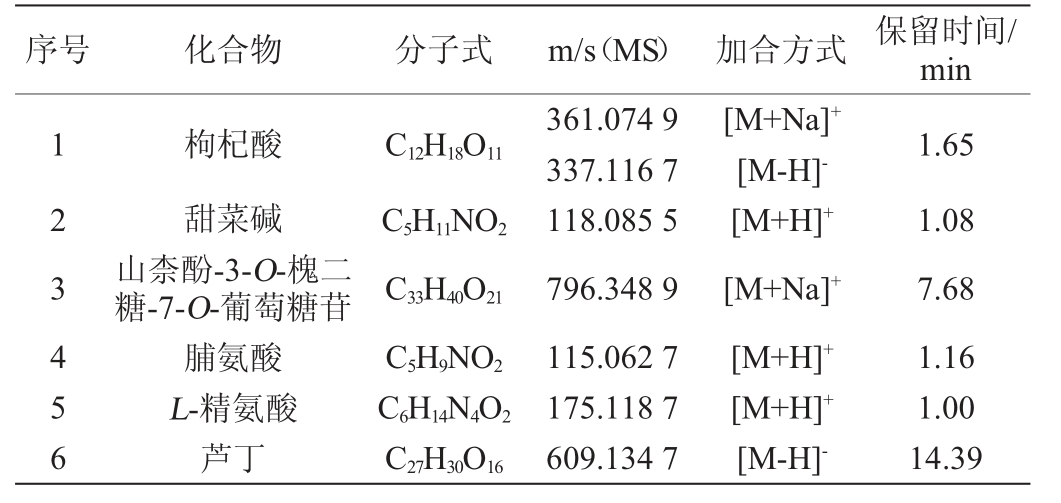
序号化合物分子式m/s(MS) 加合方式 保留时间/min 123456枸杞酸甜菜碱山柰酚-3-O-槐二糖-7-O-葡萄糖苷脯氨酸L-精氨酸芦丁C12H18O11 C5H11NO2 C33H40O21 C5H9NO2 C6H14N4O2 C27H30O16 361.074 9 337.116 7 118.085 5 796.348 9 115.062 7 175.118 7 609.134 7[M+Na]+[M-H]-[M+H]+[M+Na]+[M+H]+[M+H]+[M-H]-1.65 1.08 7.68 1.16 1.00 14.39
由表4可知,枸杞水提液中抗氧化成分共鉴定出6个化合物,分别为枸杞酸、甜菜碱、山柰酚-3-O-槐二糖-7-O-葡萄糖苷、脯氨酸、L-精氨酸和芦丁。其中,枸杞酸是枸杞特有的天然成分,谢若男等[24-25]研究表明,枸杞子中的枸杞酸含量和新鲜柠檬中的维生素C含量相当,且抗氧化能力相比抗坏血酸更持久,能够长时间存在于体内发挥抗氧化活性,具有更高效的清除自由基能力,有效抑制黑色素的生成。甜菜碱又被称为三甲基甘氨酸,是一种氨基酸衍生物,对生物体产生许多有益作用,是枸杞生物碱中含量最多最具代表性的成分,是一种无毒且稳定的天然物质,具有调节渗透压、抗癌、抗Ⅱ-型糖尿病等功效[26-27]。黄酮类化合物是一类重要的天然有机化合物,主要存在于枸杞的果实中,也是枸杞中重要的质量标志物,以芦丁为代表的黄酮类具有保护心血管、清除自由基、抗氧化、抗肿瘤、降血脂、降血糖、促进血管舒张等多种功效[28-29]。氨基酸是枸杞果实的重要营养成分和药效成分,其种类和含量是决定枸杞品质的关键因素,其中天冬酰胺、丙氨酸和脯氨酸是枸杞果实中含量最高的3种氨基酸[30]。
3 结论
通过单因素试验和响应面分析法得到最佳枸杞抗氧化物质提取工艺条件为:料液比1∶180(g∶mL)、提取温度80 ℃、提取时间2 h,在此最佳条件下,枸杞水提物对DPPH自由基清除能力的IC50值为1.34 g/L。通过UPLC-QTOF-MS分析在枸杞水提液中鉴定出6个清除DPPH自由基的物质,分别为枸杞酸、甜菜碱、山柰酚-3-O-槐二糖-7-O-葡萄糖苷、脯氨酸、L-精氨酸、芦丁。综上,该方法可高效提取枸杞水溶性抗氧化活性物质,为枸杞的质量评价及多领域深加工提供技术支撑。
[1]WANG H,LI J,TAO W,et al.Lycium ruthenicum studies:Molecular biology,phytochemistry and pharmacology[J].Food Chem,2018,240:759-766.
[2]WANG Y J,LIANG X J,GUO S J,et al.Evaluation of nutrients and related environmental factors for wolfberry(Lycium barbarum)fruits grown in the different areas of China[J].Biochem Syst Ecol,2019,86:103916.
[3]吉德娟,张得芳,王占林,等.有机栽培下枸杞果实中营养成分的含量特征[J].青海大学学报,2022,40(5):41-46.
[4]王昌禄,王昵霏,李贞景.枸杞多糖的研究与应用[J].食品科学技术学报,2017,35(3):43-49.
[5]逄春梅,李艳萍.枸杞中功能性成分的研究进展[J].食品界,2023(4):116-118.
[6]邵翠翠,邓源喜,杨蓓蓓,等.枸杞的营养保健功能及其应用进展[J].安徽农学通报,2020,26(17):39-41.
[7]郭曼萍,赵俊男,施伟丽,等.枸杞延缓衰老的研究进展[J].中医药导报,2019,25(12):124-128.
[8]项艳曾,李进贵,廖国玲,等.桑叶及枸杞叶多糖的降糖降脂作用研究[J].长治医学院学报,2018,32(6):404-407.
[9]高晓娟,邹慧,张霞,等.枸杞属不同品种枸杞叶总黄酮含量及抗氧化能力的比较研究[J].时珍国医国药,2018,29(2):311-313.
[10]胡馨予,卢文倩,孙晓琪,等.宁夏枸杞水提物对四氧嘧啶诱导糖尿病小鼠的降糖作用[J].食品与生物技术学报,2019,38(3):91-96.
[11]眭静怡,王敏,徐丽萍.黑枸杞活性成分的提取、开发利用研究进展[J].现代食品,2023,29(3):49-51,58.
[12]汪明金,龙玲.枸杞多糖的提取、纯化、结构鉴定及药理作用研究进展[J].食品与发酵科技,2022,58(1):131-135,146.
[13]邢丽杰,王远,刘帅光,等.黑果枸杞中活性成分的研究进展[J].农产品加工,2021(10):66-69,72.
[14]SKENDERIDIS P,MITSAGGA C,GIAVASIS I,et al.The in vitro antimicrobial activity assessment of ultrasound assisted Lycium barbarum fruit extracts and pomegranate fruit peels[J].J Food Meas Ch, 2019,13(3):2017-2031.
[15]张君,段丽爽,常南.枸杞多糖水提法提取条件的研究[J].新农业,2018(23):11-15.
[16]YIN Q C, JI J B, ZHANG R H, et al.Identification and verification of key taste components in wampee using widely targeted metabolomics[J].Food Chem,2022,13:100261.
[17]JIN M M,ZHANG W D,JIANG H H,et al.UPLC-Q-TOF-MS/MS-guided dereplication of Pulsatilla chinensis to identify triterpenoid saponins[J].Phytochem Anal,2018,29(5):516-527.
[18]GEBRU Y A,KIM D W,SBHATU D B,et al.Comparative analysis of total phenol,total flavonoid and in vitro antioxidant capacity of white and brown teff (Eragrostis tef), and identification of individual compounds using UPLC-qTOF-MS[J].J Food Meas Ch,2021,15(6):5392-5407.
[19]LEE M,SONG J H,CHOI E J,et al.UPLC-QTOF-MS/MS and GC-MS characterization of phytochemicals in vegetable juice fermented using lactic acid bacteria from kimchi and their antioxidant potential[J].Antioxidants,2021,10(11):1761.
[20]李玲梅,张娟娟.不同提取方法对枸杞多糖提取率及糖含量的影响[J].生物化工,2020,6(6):65-68.
[21]ERKAYA-KOTAN T. In vitro angiotensin converting enzyme (ACE)-inhibitory and antioxidant activity of probiotic yogurt incorporated with orange fibre during storage[J].J Food Sci Tech Mys,2020,57:2343-2353.
[22]吕凯波,张星雨,乐薇,等.响应面优化超声波辅助酶法提取湖北海棠叶抗氧化物[J].食品工业科技,2023,44(4):218-225.
[23]朱碧芬,闫加桐,程春生,等.响应面法优化南瓜籽中抗氧化物提取工艺[J].海南师范大学学报(自然科学版),2020,33(2):152-159.
[24]谢若男,张正波,裘娟萍.新抗氧化剂2-O-β-D-葡萄糖基-L-抗坏血酸的研究进展[J].科技通报,2010,26(3):362-366.
[25]张自萍,李弘武,廖国玲,等.枸杞子中2-O-β-D-葡萄糖基-L-抗坏血酸抑制黑素合成的研究[J].中国新药杂志,2007(9):689-692.
[26]KATARZYNA S, TOMASZ S.The anti-diabetic potential of betaine.Mechanisms of action in rodent models of type 2 diabetes[J].Biomed Pharmacother,2022,150:112946.
[27]周佳琪,郭盛,李洁,等.不同品系及成熟度宁夏枸杞叶资源化学研究及抗氧化活性评价[J].南京中医药大学学报,2023,39(9):839-848.
[28]李兰柱,胡红莲,管晓轩,等.芦丁的生物活性及其在动物生产中的应用研究进展[J].畜牧与饲料科学,2022,43(5):68-73,86.
[29]朱琪,曾立,张运良.药膳中芦丁的吸收利用与护肝健康功效研究进展[J].食品安全质量检测学报,2022,13(11):3480-3486.
[30]周宜洁,李新,马三梅,等.贮藏温度对鲜枸杞类胡萝卜素和氨基酸的影响及调控机制[J].科学通报,2022,67(Z1):385-395.