藜麦(Chenopodium quinoa),为苋科藜属双子叶假谷物,富含优质蛋白质、不饱和脂肪酸、矿物质、维生素E和多种植物化学物质[1]。藜麦麸皮中膳食纤维含量高达22%,根据溶解性不同分为不溶性膳食纤维(insoluble dietaryfiber,IDF)和可溶性膳食纤维(soluble dietary fiber,SDF)。其中IDF占膳食纤维总量的70%~90%,SDF仅占10%~30%[2]。相比IDF有序的结构,SDF不规则的主链和侧链结构使得SDF溶解性更好,黏性和凝胶性更优,对调节血糖水平,降低胆固醇、减重、促进肠道消化、加速肠道中有毒有害物质排出具有重要作用[3-4]。膳食纤维改性是利用不同的技术对膳食纤维进行处理,使IDF内部的糖苷键发生断裂,将IDF的全部或者部分转化为SDF,提高SDF的含量,同时致密的网状结构变得疏松,具备更高的生理效能[5]。
目前报道的提高膳食纤维中SDF含量的方法有物理法、化学法、酶法和发酵法等,其中,物理改性方法无需添加化学物质,可增加IDF的孔隙度,提高膳食纤维的持水、持油和膨胀力,但改性程度有限,有时无法满足应用需求[6];化学改性方法可提升结晶度增强稳定性,使IDF的持水力(water holding capacity,WHC)、膨胀力(water swelling capacity,WSC)、持油力(oil holding capacity,OHC)和阳离子交换能力(cation exchange capacity,CEC)提高[7],该方法成本低廉、操作简便,但提取率较低且强酸碱排放有污染环境的风险[8];酶法制备膳食纤维专一性强、纯度高、节能环保,所得产品品质优良,但一些酶类价格较高,容易导致成本增加[9]。发酵法充分利用微生物产酶[10],将大分子纤维素降解为较小分子物质,提高SDF含量,生产成本低、操作简单、产率高、易实现工业化生产,是目前膳食纤维改性的有效方法之一。张艳莉等[10]采用复合菌系发酵改性豆渣膳食纤维,SDF质量分数提高11.84%,且理化性质得到显著改善;李红霞等[11]利用黑曲霉(Aspergillus niger)固态发酵花生壳膳食纤维,其壳酶解率可以达到11.03%;王璐瑶等[12]研究表明,藜麦固态发酵后抗氧化活性较高,但鲜见藜麦麸皮膳食纤维发酵改性的相关报道。
本研究以藜麦麸皮为原料,采用黑曲霉(Aspergillus niger)发酵改性藜麦麸皮膳食纤维。以可溶性膳食纤维(SDF)得率为响应值,通过单因素和响应面试验优化其发酵工艺条件,并对其理化特性及结构特征进行分析。以期为藜麦麸皮的深度开发利用提供理论依据和技术支持,提高藜麦麸皮膳食纤维的生物利用率。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
藜麦麸皮:吉林省通榆藜麦种植基地;黑曲霉(Aspergillus niger):上海保藏微生物中心。
1.1.2 试剂
KBr粉末:国药集团化学试剂有限公司;葡萄糖:天津市光复科技发展有限公司;蛋白胨:南京全隆生物技术有限公司;柠檬酸缓冲液、无水乙醇、氯化钠:国药集团化学试剂有限公司,吐温-80:天津市大茂化学试剂厂;碱性蛋白酶(酶活150 000 U/g)、α-淀粉酶(酶活40 000 U/g):上海源叶生物科技有限公司;大豆油:中粮佳悦(天津)有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取200 g马铃薯,去皮、切块(1 cm3),加1 000 mL蒸馏水煮沸20~30 min,四层纱布过滤取其滤液,加水定容至1 000 mL,加入20 g葡萄糖待完全溶化后,加入20 g琼脂使其溶解,分装包扎,121 ℃高压蒸汽灭菌20 min,备用[13]。
种子培养基:葡萄糖10 g/L、蛋白胨1 g/L,加水溶解定容至1 L。每50 mL分装于250 mL锥形瓶中。分别添加营养盐溶液(磷酸二氢钾2.62 g、二水合磷酸氢二钠0.2 g、七水合硫酸镁0.7 g、硝酸铵1.0 g、氯化钠0.005 g、七水合硫酸亚铁0.002 g、七水合硫酸锌0.002 g、一水合硫酸锰0.000 6 g,水1 L。)5 mL、微量元素0.05 mL、1 moL/L柠檬酸缓冲液2.5 mL、吐温-80 0.1 mL,封口包扎,于121 ℃灭菌20 min,备用[14]。
1.2 仪器与设备
BXM-100VE立式压力蒸汽灭菌器:上海博迅医疗生物仪器股份有限公司;JY92-IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;HJ-4A四联数显恒温磁力搅拌器、XH-C漩涡混合器:常州朗越仪器制造有限公司;XB-K-25细胞计数板:上海求精生化试剂仪器有限公司;BSD-YX3200立式智能精密摇床:上海博迅实业有限公司医疗设备厂;L3-5K台式低速离心机:湖南凯达科学仪器有限公司;Nicolet is20傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 黑曲霉种子液的制备
将菌株接种于PDA培养基,25℃培养72h后,用无菌水淋洗斜面,血球计数板计数,制成浓度为108~109CFU/mL的孢子悬液。吸取该孢子悬液1mL,置于装液量为100mL/250mL种子培养基中,25 ℃摇床150 r/min培养72 h活化,采用4层纱布过滤掉菌丝体,将种子液浓度调整为108~109CFU/mL[15]。
1.3.2 黑曲霉发酵改性制备SDF工艺流程及操作要点
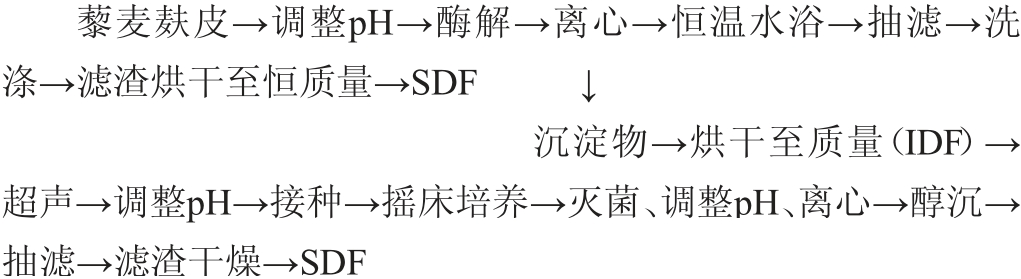
操作要点:
称取预先处理好的藜麦麸皮,按料液比1∶10(g∶mL)加入蒸馏水,搅匀,调节pH至7.0,加入10 mg/g α-淀粉酶,60 ℃恒温水浴酶解45 min。冷却至室温后调节pH至4.5,加入1 mg/g糖化酶,60 ℃恒温水浴酶解60 min。冷却至室温后调节pH 至10.0,加入10 mg/g碱性蛋白酶,40 ℃恒温水浴酶解60 min,沸水浴灭菌5 min,冷却至室温后在3 500 r/min条件下离心10 min,沉淀物于105 ℃烘干至质量恒定,获得IDF;上清液与4倍体积的无水乙醇混合,40 ℃恒温水浴30 min,抽滤,滤渣用无水乙醇洗涤,收集醇沉沉淀物,55 ℃烘干至恒质量,得SDF[16]。
精密称取处理好的藜麦麸皮IDF 2 g,按1∶20(g∶mL)的料液比加入蒸馏水,用磁力搅拌器进行混匀,后置于超声波细胞粉碎机中以400 W粉碎30 min,调节pH值为4.65,密封后放至121 ℃的灭菌锅内灭菌20 min[17],待其冷却至室温后接入10%黑曲霉种子液进行培养,并放置于28℃160 r/min摇床培养箱中培养96 h,沸水浴灭菌15 min、调pH至中性后1 500 r/min离心10 min,再加入4倍体积95%体积分数乙醇溶解,于4 ℃条件下静置24 h后,过滤,弃滤液合并滤渣、干燥、称质量,即得到改性后藜麦麸皮SDF。
1.3.3 黑曲霉发酵改性制备SDF工艺优化
(1)单因素试验
分别考察料液比(1∶16、1∶18、1∶20、1∶22、1∶24(g∶mL))、接种量(6%、8%、10%、12%、14%)、发酵时间(72 h、84 h、96 h、108 h、120 h)对膳食纤维改性SDF得率的影响。
(2)响应面试验设计
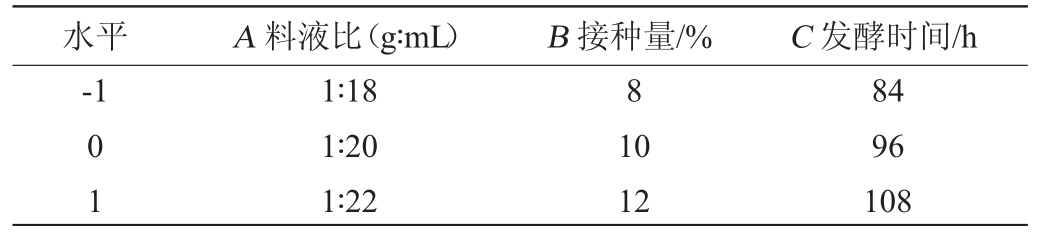
在单因素试验结果的基础上,运用Box-Behnken试验设计原理,以料液比(A)、接种量(B)、发酵时间(C)为自变量,以SDF得率(Y)为响应值,进行3因素3水平试验,Box-Behnken试验因素与水平设计见表1。
表1 发酵条件优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for fermentation conditions optimization
水平A 料液比(g∶mL)B 接种量/%C 发酵时间/h-1 8 01 1∶18 1∶20 1∶22 10 12 84 96 108
1.3.4 SDF得率
SDF得率计算公式如下:
式中:m0为醇沉抽滤干燥后得到的SDF,g;M为经预处理过的藜麦麸皮,g。
1.3.5 分析检测
(1)持水力与持油力的测定
参考ZHANG Y J等[18]的方法稍作修改,取发酵改性前后膳食纤维干燥样品各200 mg,分别与30 mL蒸馏水或大豆油混合,混匀后,在室温条件下静置12 h,以3 500 r/min离心15 min,弃去上清液或油脂,称取离心管中的残留物。计算持水力(water holding capacity,WHC)和持油力(oil holding capacity,OHC),其计算公式如下:
式中:WHC为持水力,g/g;m1为持水后质量,g;m2为持水前质量,g;m3为样品质量,g;OHC为持油力,(g/g);m4为持油后质量,g;m5为持油前质量,g。
(2)吸水膨胀力的测定
参考刘鸿铖等[19]的方法稍作修改,取发酵改性前后膳食纤维干燥样品各250 mg,分别置于15 mL量筒中,并加入去离子水至10 mL,混匀,用保鲜膜封口,在室温条件下静置12 h,记录样品吸附水分前后的体积变化。计算吸水膨胀力(water swelling capacity,WSC),其计算公式如下:
式中:WSC为吸水膨胀力,mL/g;V1为膨胀后的体积,mL;V2为膨胀前的体积,mL;m3为样品质量,g。
(3)阳离子交换能力测定
参考YUAN Z N等[20]的方法稍作修改,取发酵改性前后膳食纤维干燥样品各1.00 g,分别加入250 mL锥形瓶内,迅速移入50 mL 1 mol/L的HCl溶液并均匀搅拌,在室温条件下静置24 h后过滤,并用蒸馏水洗涤残留物,直至氯离子完全去除,将滤渣置于锥形瓶内,加入150 mL的5 g/100 mL氯化钠溶液,充分搅拌30 min,然后添加2滴酚酞溶液,最后用氢氧化钠溶液(0.05 mol/L)滴定直到终点,空白对照试验采用蒸馏水滴定,计算阳离子交换能力(cation exchange capacity,CEC),其计算公式如下:
式中:CEC为阳离子交换能力,mmoL/g;m为干燥样品质量,g;C为滴定所用氢氧化钠溶液的浓度,moL/L;V3为滴定样品所用氢氧化钠溶液的体积,mL;V4为滴定空白样品所用氢氧化钠溶液的体积,mL。
(4)傅里叶红外光谱分析测定
采用傅里叶变换红外光谱仪(FT-IR)分析样品的结构特征。参考YUAN Z N等[20]的方法稍作修改,取发酵改性前后膳食纤维干燥样品2 mg分别和200 mg干燥溴化钾粉末在玛瑙研磨器中研磨均匀,挤压制成薄片,通过Nicolet is20傅里叶红外光谱仪检测,扫描波数范围4 000~400 cm-1。
1.3.6 数据分析
每个样品进行至少3次重复实验,数据结果以“平均值±标准差”表示。数据处理和显著性分析使用SPSS 23.0软件,P<0.05为差异显著。
2 结果与分析
2.1 单因素试验结果
2.1.1 料液比对SDF得率的影响
由图1可知,精确称取藜麦麸皮IDF 2 g加入一定量的蒸馏水,当料液比为1∶16、1∶18、1∶20(g∶mL)时,SDF得率逐渐增加;当料液比为1∶20(g∶mL)时,藜麦麸皮SDF得率达最高值,为24.76%;当料液比为1∶20、1∶22(g∶mL)时,SDF得率逐渐下降;分析原因可能是当含水量过低时,使菌种和原料接触不充分,培养基干燥,物料吸水不足,影响黑曲霉的正常生长和产酶速度[21];同时水含量过高时,透气性差,影响溶氧和CO2的排出,不利于黑曲霉的生长[18]。因此,确定最适料液比为1∶20(g∶mL)。
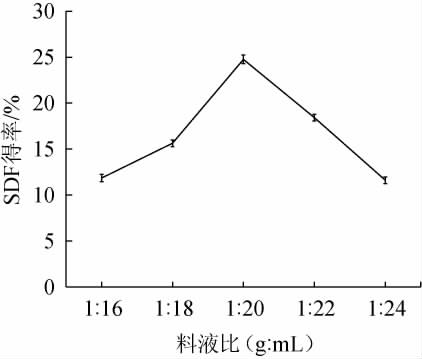
图1 料液比对可溶性膳食纤维得率的影响
Fig.1 Effect of solid and liquid ratio on soluble dietary fiber yield
2.1.2 接种量对SDF得率的影响
由图2可知,随黑曲霉接种量在6%~10%范围内的增加,SDF得率逐渐增加;当接种量为10%时,SDF得率达最高值,为24.35%;当黑曲霉接种量>10%时,SDF得率下降。其原因可能是由于黑曲霉接种量较低时,菌体生长缓慢,导致发酵不彻底,不能充分降解藜麦麸皮细胞壁,使SDF得率降低;而黑曲霉接种量较高时,菌体生长繁殖旺盛,导致培养基物质缺乏,开始逐渐消耗积累的SDF[22]。因此,确定最适的接种量为10%。
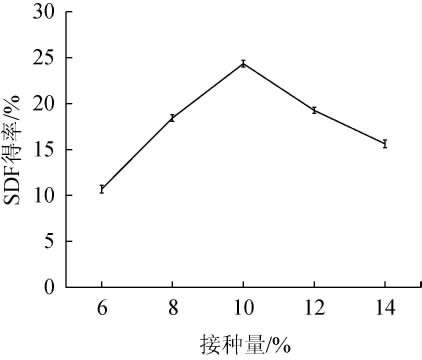
图2 接种量对可溶性膳食纤维得率的影响
Fig.2 Effect of inoculum on soluble dietary fiber yield
2.1.3 发酵时间对SDF得率的影响
由图3可知,随着发酵时间在72~96 h范围内的增加,SDF得率逐渐增加;当培养时间为96 h时,SDF得率达最大值,为23.9%;当发酵时间>96 h,SDF得率逐渐下降。其原因是发酵时间过短,发酵不充分,酶解效果较差;发酵时间过长,培养基中营养缺乏,菌体生长受阻,SDF得率下降[23]。因此,确定最适发酵时间为96 h。
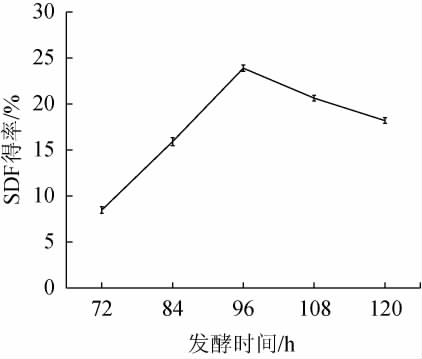
图3 发酵时间对可溶性膳食纤维得率的影响
Fig.3 Effect of fermentation time on soluble dietary fiber yield
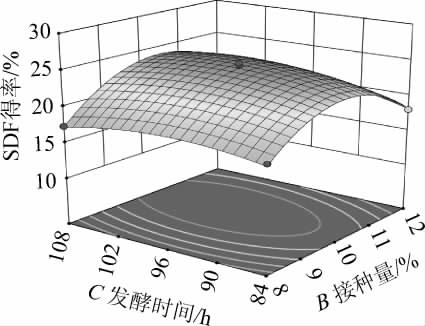
图4 接种量与发酵时间间交互作用对可溶性膳食纤维得率影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effect of interaction between inoculum and fermentation time on soluble dietary fiber yield
2.2 响应面试验结果
2.2.1 回归模型的建立与分析
在单因素试验的基础上,以料液比(A)、接种量(B)、发酵时间(C)为自变量,SDF得率(Y)为响应值,通过Design Expert 11.0软件利用Box-Behnken中心组合试验设计的原理,设计3因素3水平响应面试验,Box-Behnken试验设计及结果见表2,方差分析见表3。
表2 发酵条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for fermentation conditions optimization
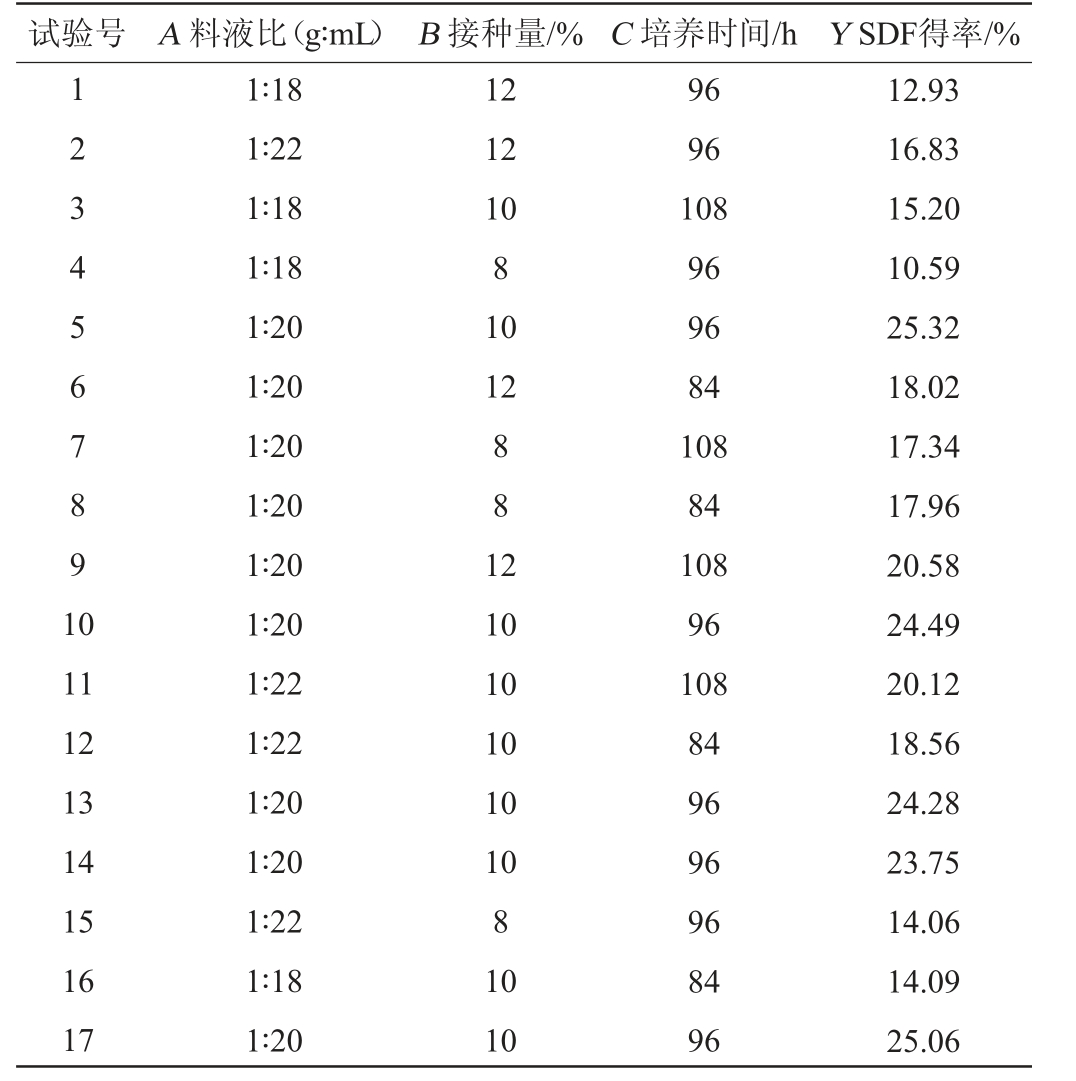
试验号 A 料液比(g∶mL) B 接种量/% C 培养时间/h Y SDF得率/%1234567891 0 12 12 10 8 10 12 881 2 11 12 13 14 15 16 17 1∶18 1∶22 1∶18 1∶18 1∶20 1∶20 1∶20 1∶20 1∶20 1∶20 1∶22 1∶22 1∶20 1∶20 1∶22 1∶18 1∶20 10 10 10 10 10 8 10 10 96 96 108 96 96 84 108 84 108 96 108 84 96 96 96 84 96 12.93 16.83 15.20 10.59 25.32 18.02 17.34 17.96 20.58 24.49 20.12 18.56 24.28 23.75 14.06 14.09 25.06
表3 回归模型方差分析
Table 3Variance analysis of regression model

注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度均方F 值P 值显著性模型ABCA B*******AC BC A2 B2 C2残差失拟项纯误差总和337.81 35.11 8.84 2.66 0.046 2 0.050 6 2.53 163.42 94.90 7.76 2.55 0.986 2 1.75 340.36 91111111117341 6 37.53 35.11 8.84 2.66 0.046 2 0.050 6 2.53 163.42 94.90 7.76 0.364 5 0.328 7 0.391 3 102.99 96.34 24.26 7.29 0.126 8 0.138 9 6.94 448.40 260.39 21.29<0.000 1<0.000 1 0.001 7 0.030 6 0.732 2 0.720 4 0.033 7<0.000 1<0.000 1 0.002 4*******0.840 2 0.538 5
采用Design-Expert 11.0软件对表2的试验结果进行多元二次回归分析,得到SDF得率(Y)与料液比(A)、接种量(B)、培养时间(C)影响因素的二次多项回归方程:
由表3可知,该模型的P值为0.000 1<0.01,具有极显著性,失拟项的P值为0.538 5>0.05,无显著性,模型决定系数R2=0.992 5,调整决定系数R2adj=0.982 9,表明此模型中99%SDF得率变化来自于自变量,变异系数(coefficient of variation,CV)=3.22%,说明模型可信度好,精确度高,与实际状况相吻合[20]。由P值可知,一次项A、B,二次项A2、B2、C2对结果影响极显著(P<0.01);一次项C,交互项BC对结果影响显著(P<0.05);其他项对结果影响不显著(P>0.05)。由F值可知,影响SDF得率的各因素顺序为:料液比(A)>接种量(B)>发酵时间(C)。
2.2.2 响应面试验交互作用分析
通过响应面的陡峭程度及等高线形状可反映因素间交互作用对SDF得率的影响。接种量与培养时间之间交互作用对结果的影响响应面的坡度较陡峭,等高线呈椭圆形,表明其交互作用显著(P<0.05),这与方差分析结果一致。
通过Design-Expert11.0软件分析出SDF的最佳发酵工艺条件为:料液比1∶20.34(g∶mL),接种量10.27%,发酵时间99.10 h。在此优化条件下,藜麦麸皮SDF得率的理论值可达24.90%。考虑实际操作可行性,将发酵工艺条件修正为料液比为1∶20(g∶mL)、接种量为10%、发酵时间96 h。在此优化条件下进行3次平行验证试验,得到改性后藜麦麸皮SDF得率平均实际值为24.8%,实际值接近理论值,说明该模型有较好的拟合性,该模型对于改性后藜麦麸皮SDF提取工艺参数优化合理,具有可靠的实用价值。
2.3 发酵改性前后SDF理化性质变化
由表4可知,与改性前相比,改性后藜麦麸皮可溶性膳食纤维持水力、持油力、吸水膨胀力、阳离子交换能力均显著提高(P<0.05),分别为6.10 g/g、7.50 g/g、7.3 mL/g、2.05 mmoL/g,分别提高了74.29%、47.35%、32.73%、115.8%。高吸水膨胀力和高持水力是优质膳食纤维的良好体现,这是由于黑曲霉发酵产生纤维素酶作用藜麦麸皮IDF,将大分子物质降解为小分子物质,同时形成疏松的结构,使更多的极性基团出现,形成更多的氢键和偶极子,增加了持水力与膨胀力[24]。改性后的膳食纤维更加疏松多孔,更多的非极性基团暴露出来,导致持油力有所增加[25]。膳食纤维可以与阳离子进行可逆交换,这种性质与膳食纤维具有一些羟基与羧基的侧链基团有关[26]。阳离子交换能力提高可能是由于发酵改性过程中,会破坏膳食纤维分子的共价键,暴露出更多的羟基与羧基的侧链基团,更有利于阳离子交换[27]。因此,利用黑曲霉发酵改性藜麦麸皮不可溶性膳食纤维可有效改善其理化特性。
表4 藜麦麸皮膳食纤维改性前后理化性质对比
Table 4 Comparison of physicochemical properties of quinoa bran dietary fiber before and after modification

注:“*”表示与改性前相比,差异显著(P<0.05)。
组别持水力/(g·g-1)阳离子交换能力/(mmol·g-1)改性前改性后持油力/(g·g-1)吸水膨胀力/(mL·g-1)3.50±0.82 6.10±0.83*5.09±0.98 7.50±0.60*5.5±0.66 7.3±0.46*0.95±0.48 2.05±0.41*
2.4 发酵改性前后SDF傅里叶红外光谱分析
由图5可知,波数3 400 cm-1附近出现O-H伸缩振动带,这是由于氢与纤维素和半纤维素的羟基结合而产生的振动;波数2 920.1 cm-1和2 916 cm-1处的峰是由糖类甲基和亚甲基上C-H的伸缩振动引起的,为多糖的特征吸收峰;峰值在波数1 633.1 cm-1和1 640.6 cm-1的吸收峰为醛酸通过C=O键的特征吸收;在波数1 000~1 200 cm-1之间的吸收峰,对应C-O拉伸振动,可能是木质素和半纤维素糖环的C-O-H和C-O-C[27];波数1 000~700 cm-1处的吸收峰是由α-和β-吡喃单糖形成的特征峰[28],在波数824.6和825.8 cm-1处显示出α-吡喃糖的特征吸收峰。结果表明,改性增加了SDF中官能团的数量,未产生新的官能团,但其含量和结合程度不同,导致吸收峰强度不同。
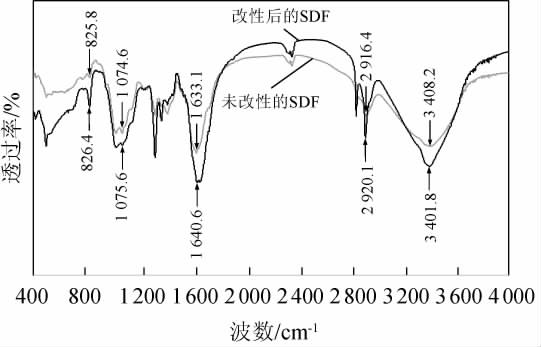
图5 改性前后藜麦麸皮可溶性膳食纤维傅里叶变换红外光谱
Fig.5 Fourier transform infrared spectroscopy of quinoa bran dietary fiber before and after modification
3 结论
本研究以藜麦麸皮为原料,采用黑曲霉发酵改性藜麦麸皮可溶性膳食纤维,通过单因素试验和响应面试验确定其最佳发酵工艺条件为料液比1∶20(g∶mL)、接种量10%、发酵时间96h。在此优化条件下,藜麦麸皮SDF得率为24.8%。此外,经黑曲霉发酵改性后的藜麦麸皮可溶性膳食纤维的膨胀力、持油力、持水力、阳离子交换能力均显著提高(P<0.05)。傅里叶变换红外光谱分析结果显示,改性后官能团数量增加,但未产生新的官能团。本研究为提高藜麦麸皮的利用价值及今后藜麦麸皮的开发利用提供科学依据。
[1]赵雷,李晓娜,史龙龙,等.藜麦麸皮营养成分测定及其油脂的抗氧化活性研究[J].现代食品科技,2019(11):199-205,151.
[2]HE C A, SAMPERS I, RAES K.Dietary fiber concentrates recovered from agro-industrial by-products: Functional properties and application as physical carriers for probiotics[J].Food Hydrocolloid,2021,111(7):106175.
[3]LIM J G,PARK H M,YOON K S.Analysis of saponin composition and comparison of theantioxidant activity of various parts of the quinoa plant(Chenopodium quinoa Willd.)[J].Food Sci Nutr,2019,8(1):694-702.
[4]魏爱春,杨修仕,刘浩,等.藜麦营养功能成分及生物活性研究进展[J].食品科学,2015,36(15):272-276.
[5]吕秉霖,袁尔冬.膳食纤维的改性及应用[J].粮食科技与经济,2019,44(3):78-81.
[6]WANG S K, XIA J, DE PAEPE K, et al.Ultra-high pressure treatment controls in vitro fecal fermentation rate of insoluble dietary fiber from Rosa Roxburghii Tratt pomace and induces butyrogenic shifts in microbiota composition[J].J Agr Food Chem,2021,69(36):10638-10647.
[7]WANG L,TIAN Y P,CHEN Y X,et al.Effects of acid treatment on the physicochemical and functional properties of wheat bran insoluble dietary fiber[J].Cereal Chem,2021,99(2):343-354.
[8]申瑞玲,张文杰,董吉林,等.藜麦的主要营养成分、矿物元素及植物化学物质含量测定[J].郑州轻工业学院学报(自然科学版),2015,30(5):17-21.
[9]JIA M Y,CHEN J J, LIU X Z, et al.Structural characteristics and functional properties of soluble dietary fiber from defatted rice bran obtained through Trichoderma viride fermentation[J].Food Hydrocolloid, 2019,94:468-474.
[10]张艳莉,王颖,王迪,等.复合菌系发酵改性对豆渣膳食纤维结构及物化特性的影响[J].中国粮油学报,2021,36(7):138-144.
[11]李红霞,吕敬军,陆丰升,等.黑曲霉固态发酵花生壳提取水溶性膳食纤维[J].食品科学,2010,31(19):277-282.
[12]王璐瑶,张笃芹,牛猛,等.固态发酵对藜麦成分、酚类物质及抗氧化活性的影响[J].食品工业科技,2022,43(24):130-138.
[13]王晓颖,黄荣冰,谭诗颖,等.黑曲霉发酵法制备柚子皮可溶性膳食纤维的研究[J].轻工科技,2021,37(12):15-17.
[14]孙平,刘杰,郭苗苗,等.发酵法提取小麦麸皮可溶性膳食纤维工艺研究[J].食品科技,2014,39(10):170-174.
[15]闵钟熳,高路,高育哲,等.黑曲霉发酵法制备米糠粕可溶性膳食纤维工艺优化及其理化分析[J].食品科学,2018,39(2):112-118.
[16]孙永杰,冯佳乐,张兴华,等.响应面法优化藜麦麸皮中可溶性膳食纤维提取工艺[J].食品工业,2020,41(12):37-39.
[17]牛希,史乾坤,赵城彬,等.超声改性对燕麦膳食纤维理化性质及结构的影响[J].食品科学,2020,41(23):130-136.
[18]ZHANG Y J, WU L R, ZHANG F S, et al.Sucrose ester alleviates the agglomeration behavior of bamboo shoot dietary fiber treated via high pressure homogenization:Influence on physicochemical,rheological,and structural properties[J].Food Chem,2023,413 135609.
[19]刘鸿铖,樊红秀,赵鑫,等.酶解-挤出复合法改性绿豆皮膳食纤维及其结构表征与理化性能[J].中国粮油学报,2023,38(9):80-88.
[20]YUAN Z N,YAN J T,ZHANG Q,et al.Effects of steam explosion on physicochemical, functional and structural properties of soluble dietary fiber from pomelo peel[J].Int J Food Eng,2023,19(10):457-465.
[21]肖连冬,于海彦,李慧星.灵芝固态发酵麦糟制备可溶性膳食纤维工艺优化[J].中国酿造,2023,42(7):185-189.
[22]裴曾薇.黑曲霉发酵改性香菇柄膳食纤维及其性质研究与应用[D].沈阳:辽宁大学,2021.
[23]何兰兰,马四补,姜特,等.固态发酵刺梨果渣改性膳食纤维工艺优化及结构特性分析[J].食品工业科技,2024,45(2):183-191.
[24]HUANG H R,CHEN J J,CHEN Y,et al.Modification of tea residue dietary fiber by high-temperature cooking assisted enzymatic method:Structural,physicochemical and functional properties[J].LWT-Food Sci Technol,2021,145:111314.
[25]汤洁.高纤维酶活菌株发酵联合电脉冲改性酸橙皮膳食纤维及其理化功能活性研究[D].南昌:南昌大学,2024.
[26]LI Y X,NIU L,GUO Q Q,et al.Effects of fermentation with lactic bacteria on the structural characteristics and physicochemical and functional properties of soluble dietary fiber from prosomillet bran[J].LWT-Food Sci Technol,2022,154:112609.
[27]汪文君,周宁,韩东晶,等.改性对柿子渣不溶性膳食纤维的理化特性和结构的影响[J].食品与发酵工业,2023,49(6):221-226.
[28]张慧娟,靳程茗,吕世豪,等.黑麦麸膳食纤维的结构和功能特性研究[J].中国食品学报,2023,23(8):84-93.