酱油作为一种历史悠久的酿造调味品,可以为食物带来丰富的口味与多样的变化,是中式烹饪的重要组成部分。随着近年来人们对健康饮食的关注增加,低钠、低盐酱油变得更受消费者欢迎。常见的酱油减盐手段主要为酿后脱盐,使用特殊的膜进行钠离子的分离。电渗析法作为一种高效安全的膜分离技术,现已作为成熟的手段应用于酱油的生产。其原理是液体中的离子在电势的驱动下于电场中移动,利用两侧离子交换膜的选择透过性使钠离子在膜的另一侧富集[1],从而达到脱盐的目的。在这个过程中盐分虽为主要的分离对象,但酱油中的营养物质及微量元素也会发生迁移或逃逸,使脱盐副产物为富营养的酱油电渗析液(soy sauce electrodialysis brine,SSEB)[2]。基于处理成本与经济效益的考量,通常采用可持续的生产方式将这些液体进行再利用,如回收食盐、继续用于发酵或腌渍食品等[3]。本研究将尝试拓宽该副产物的利用途径并充分发挥其功能价值,将其应用于酱油的制曲工序。
通常情况下酱油的制曲会避免食盐的带入,因曲料中存在较复杂的微生物生态系统,渗透压在对有害微生物进行抑制的同时,也会对有益发酵微生物的生长产生阻力。但由于驱动发酵并赋予酱油风味的微生物大多对渗透压具有一定耐受性,低盐逆境的存在不会使其种群走向消亡,反而可能有助于维持菌群的优势地位[4]。SSEB中所含有的均为小分子碳氮有机物以及微生物自溶物,通常可以直接被微生物所利用,因此有希望在曲料培养的初期为有益微生物建立菌群优势提供帮助,确保后期发酵微生物能够充分发挥作用,使产品达到预期的风味和品质。
本研究将酱油电渗析脱盐过程中分离得到的酱油电渗析液(SSEB)作为浸润黄豆的介质应用于酱油制曲,测定成曲感官、理化指标及微生物指标,对成曲及酱醪的微生物构成进行分析,并对酱油的理化指标和挥发性风味物质进行测定,多元化酱油电渗析液回收利用途径的同时为微生物发酵体系的精准调控提供新的思路及理论依据。
1 材料与方法
1.1 材料与试剂
黄豆、酱油、种曲:李锦记(新会)食品有限公司;面粉:市售;甲醛溶液、氢氧化钠、盐酸、浓硫酸、乙醇(均为分析纯):广州化学试剂厂。
干酪素、马铃薯葡萄糖琼脂培养基:广州环凯生物科技有限公司;葡萄糖(分析纯)、胰蛋白胨、琼脂(均为生化试剂):北京陆桥生物技术有限责任公司。
1.2 仪器与设备
GCM-E-10电渗析系统:国初科技(厦门)有限公司;7820A-5977B气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)分析系统、DBWA×U2毛细管柱(30 m×0.32 mm,0.25 μm):美国安捷伦公司;794自动电位滴定仪:瑞士万通公司;Blue Star B紫外可见分光光度计:北京莱伯泰科仪器有限公司;HE53快速水分仪:美国梅特勒-托利多公司;SBA-40ES生物传感分析仪:济南延和生物科技有限公司;TL2300 EPA浊度仪:美国哈希公司;KT 200凯氏定氮仪:丹麦福斯公司。
1.3 试验方法
1.3.1 酱油电渗析液的回收
按照低盐酱油的实际生产标准使用电渗析系统对酱油进行脱盐处理,分离得到酱油电渗析液后测定其基础理化指标后置于-25 ℃储存。
1.3.2 酱油曲的制备及酱油发酵
酱油的制备采用高盐稀态发酵工艺,工艺流程如下:
操作要点:室温条件下解冻电渗析液并稀释至盐分含量(以NaCl计)为6 g/100 mL,试验组将黄豆称质量后按料液比1∶1.3(g∶mL)置于酱油电渗析液中40 ℃保温浸泡,控制充分吸水5~6 h后使黄豆中NaCl的质量分数为(3±0.2)%(湿质量),滤出后于115 ℃蒸制10 min,充分冷却进行酱油制曲:以黄豆干质量为基准,设置面粉添加量为1/3,种曲添加量为0.5‰。空白组使用自来水(tap water,TW)泡豆的传统工艺进行制曲,对照组采用与SSEB中食盐浓度相同的盐水(salt water,SW)进行制曲。制曲温度前期为35 ℃培养20 h后调整至30 ℃继续培养至42 h出曲,期间第12 h和26 h进行两次翻曲。培养结束后,试验组成曲按质量比加入2.3倍18°Bé的盐水进行高盐稀态发酵,TW及SW组补加SSEB及调配好浓度的盐水,通过计算使最终各组样品整体发酵体系具有相同的盐分质量分数以及SSEB含量,使最终渗透压保持一致,将各组样品置于室温条件下进行60 d的发酵,发酵期间每周通气搅拌及取样测定。
1.3.3 微生物指标的测定
按照GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》中的方法检测样品中菌落总数[5];按照GB 4789.3—2016《食品安全国家标准食品微生物学检验大肠菌群计数》、GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》中的平板计数法分别检测样品中大肠杆菌以及酵母菌数量[6-7]。
1.3.4 蛋白酶活力的测定
蛋白酶活力按照SB/T10317—1999《蛋白酶活力测定法》中福林法测定[8]。在40 ℃条件下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位(U)。
1.3.5 酱油理化指标的测定
氨基酸态氮(amino acid nitrogen,AAN)、总酸(total acid,TA)、盐分含量(以NaCl计):参照GB/T 18186—2000《酿造酱油》中的方法使用自动电位滴定仪进行测定[9];总氮含量:按照GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法进行测定[10];谷氨酸含量:使用生物传感分析仪进行测定;酱油的浊度:使用TL2300 EPA 浊度仪进行测定。
1.3.6 微生物群落构成分析
细菌的16S rRNA基因测序区域为V3-V4可变区,以引物341F:(5'-CCTACGGGNGGCWGCAG-3')、806R:(5'-GGACTACHVGGGTATCTAAT-3')进行聚合酶链式反应(polymerase chain reaction,PCR)扩增;真菌的ITS基因测序区域为ITS2可变区,以引物ITS3_KYO2:GATGAAGAACGYAGYRAA、ITS4:TCCTCCGCTTATTGATATGC进行PCR扩增。PCR扩增体系(50 μL):5×Q5@Reaction Buffer 10 μL,5×Q5@High GC Enhancer 10 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)1.5 μL;Q5@ High-Fidelity DNA Polymerase 0.2 μL;引物ITS3_KYO2和ITS4各1.5 μL;模板脱氧核糖核酸(deoxyribonucleic acid,DNA)50 ng;补足双蒸水(ddH2O)至50 μL。PCR扩增条件:98 ℃预变性5 min;95 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,共30个循环;72 ℃再次延伸7 min。样品基因的提取、聚合酶链式反应(polymerase chain reaction,PCR)产物的建库与测序由广州基迪奥生物科技有限公司进行,使用的测序平台为Illumina PE250。
1.3.7 酱油中挥发性风味物质的测定
使用GC-MS进行风味分析,将2 mL样品注入顶空样品瓶内,加入NaCl 1 g形成盐的饱和溶液,将样品瓶置于50 ℃的水浴中萃取30 min。
气相色谱条件:以氦气(He)为载气,流速1.0 mL/min,固相微萃取小柱进样时间为2min,不分流,吹扫流量15mL/min,吹扫2 min,色谱柱升温程序为40 ℃保持5 min;2 ℃/min升至150 ℃,保留0 min;再以5 ℃/min升至240 ℃,保留10 min。
质谱条件:采用电子电离(electronic ionization,EI)源,电子能量为70 eV,检测器电压为857 V,扫描速度为2.00 scans/s,扫描范围为20~350 m/z;进样口和离子源温度分别为250 ℃和230 ℃[2]。
定性方法:参照美国国家标准与技术研究院(national institute of standards and technology,NIST)17谱库对风味化合物进行检索,并参考相关的文献报道进行综合分析。
1.3.8 数据处理与分析
使用Microsoft Excel 2021、SPSS 26、Origin 8.0软件进行数据处理与绘图;GC-MS数据使用安捷伦Data Analysis软件分析;微生物扩增子测序分析于广州基迪奥生物科技有限公司云平台完成;各试验组均包含三份以上平行试验,数据结果表示为平均值。
2 结果与分析
2.1 成曲感官与理化指标
在制曲过程中,各组曲料中微生物的生长速度明显不同。12 h翻曲时TW组和SSEB组微生物生长状态较为相似,曲料以白色菌丝覆盖,初步呈现曲香,而SW组菌丝生长较少且无明显气味;26 h翻曲时TW组的米曲霉菌丝丰富度略大于SSEB组,但表观上差异不明显,二者曲料质地松软且温热,SW组米曲霉生长相对缓慢,菌丝覆盖较薄且曲温相对较低;制曲结束后,SSEB组菌丝厚度与TW组相近,但孢子量相对较少,而SW组孢子产生量最少,曲料裹覆的菌丝层相对前两者较薄,表明盐胁迫下米曲霉生物量的积累受到了一定的影响[11]。试验表明SSEB所含有的酸类物质可能为米曲霉的生长创造了适宜的pH环境,少量氨基酸态氮等有机物也可为其生长提供直接的营养物质,这可能在一定程度上弥补了不良渗透压环境对成曲微生物的抑制作用。
对成曲的中性蛋白酶活力及水分含量进行检测,结果见表1。由表1可知,盐分的存在对微生物的生长代谢造成较大影响,SW与SSEB制曲样品的中性蛋白酶活力相对于TW组低30%左右,但仍可接近1 000 U水平;同时SW组成曲的含水量高于其他两组,由于微生物的生长代谢需要水的参与,这侧面表明了其制曲过程中微生物生长与代谢强度低于其他组别。
表1 成曲中性蛋白酶活力及水分测定结果
Table 1 Determination results of neutral proteinase activities and moisture of finished koji

组别中性蛋白酶活力/U成曲水分/%TW SW SSEB 1 302±51 923±42 941±18 31.12±3.17 37.09±2.68 34.84±1.44
2.2 成曲微生物指标
当食盐添加到发酵体系中时,高浓度的离子通过改变渗透压、干扰代谢活动和改变酶活性等机制影响微生物的生长和繁殖[12],不同处理组的成曲微生物指标测定结果见图1。由图1可知,SW组和SSEB组成曲样品的菌落总数相对于TW组大幅下降,且大肠杆菌数减少3个数量级,这表明成曲的质量和安全性得到了改善;三组样品中酵母菌总数相接近,SW与SSEB制曲的两个试验组中酵母菌总数有略微下降,但三组样品酵母总数仍处于相同数量级;这是由于酵母菌是拥有复杂的细胞结构真核生物,外部渗透压增加时会积累更多的溶质,如葡萄糖和甘油以平衡细胞内外的渗透压差异[13-14]。通常这种渗透物质的积累需要酵母菌具备复杂的调节机制,因此那些非耐盐的杂酵母可以在曲料的培养阶段被筛除,使那些具有潜在价值的耐盐酵母在酱油的发酵阶段的种间竞争压力降低。
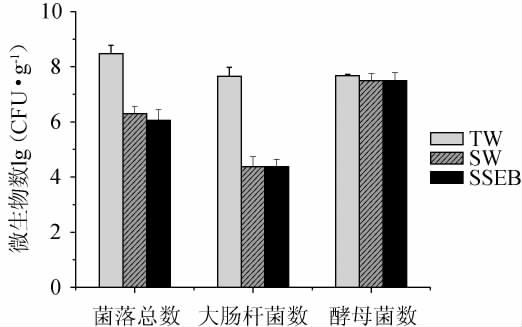
图1 成曲微生物指标测定结果
Fig.1 Determination results of microbiological indexes of finished koji
2.3 成曲微生物构成
2.3.1 成曲微生物的Alpha多样性
Alpha多样性是指特定生境或者生态系统内的物种的丰富程度、多样性情况。由于酱油制曲过程为使用种曲的接种式培养,曲料中真菌群落由米曲霉占据绝对优势,因此仅对成曲中细菌群落进行测序分析,分析结果见表2。由表2可知,各组样本的测序数据充足,操作分类单元(operational taxonomic unit,OTU)的覆盖率均在0.99以上;observed species(sobs)为测序检测到的OTU数量,结果显示SSEB组数值最高,而SW组数值低于TW组;Shannon指数综合体现物种的丰富度和均匀度,在三组样品中,同样是SSEB组数值更高;Chao1指数主要针对样本的物种丰富度信息,结果显示SW组Chao1指数略低于TW组,而SSEB组处在更高的水平。结果显示,盐分的存在不仅降低了曲料的细菌总量也降低了细菌物种的丰度,但以SSEB制曲的样品却显示出了更高的细菌丰富度,这表明SSEB在一定程度上可以缓解渗透压对耐盐微生物的生长抑制,并使各类潜在的发酵有益菌建立菌群。
表2 成曲细菌菌群多样性指数
Table 2 Diversity indexes of bacterial community in finished koji

组别sobsShannon指数Chao1指数覆盖率TW SW SSEB 1 369 1 292 1 596 2.306 2.055 3.337 1 378.604 1 304.692 1 609.139 0.999 0.998 0.998
2.3.2 成曲微生物群落组成
优势物种很大程度决定着微生物群落的生态结构以及功能结构,成品微生物基于属水平的微生物群落组成见图2。由图2可知,在细菌的属水平上,三组成曲微生物构成具有显著差异,其中TW组中葡萄球菌属(Staphylococcus)相对丰度较低(1.46%),而在SW组(88.52%)和SSEB组(61.44%)中却具有较大的菌群优势。葡萄球菌属在各类发酵食品中广泛存在[15],适量的繁殖可以为发酵食品的风味形成做出贡献,是酱油发酵过程中较为核心的微生物[16];在常规TW制曲条件下泛菌属(Pantoea)以65.86%占据了主要优势,这是一种较为常见的植物内生菌[17],可能在制曲过程中由面粉或麸皮携带进入,通常与发酵食品酸味的形成具有一定的相关性[18];克雷伯菌属(Klebsiella)菌在成曲中也被检测到了较高的丰度,它是自然界中广泛存在的肠杆菌科(Enterobacteriaceae)微生物,对人体多为条件致病菌,同时也是生物胺的生产者[19],因此在生产过程中需要进行控制;文献报道中多现于成曲中的魏斯式菌属(Weissella)[20]本次试验的样品中并未检测到较大的菌群丰度,这可能是由实验室与生产场地的环境差异所致。
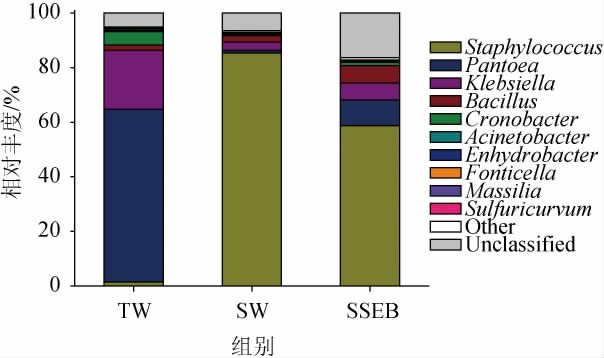
图2 基于属水平的成曲细菌菌群结构
Fig.2 Structure of bacterial community in finished koji based on genus level
2.4 酱醪中总酸及氨基酸态氮的测定结果
在酱油高盐稀态发酵的过程中,酱醪的总酸及氨基酸态氮含量测定结果见图3。通常TA含量反映了制曲及发酵过程中对微生物的控制[20],有利于稳定酱油品质避免成品酸味过重带来的口味不协调。由图3A可知,TA含量的差异较为显著,SW组和SSEB组酱醪中TA含量在发酵前期含量相对TW组低约50%,虽然随着微生物繁殖与发酵的进行快速积累,但在发酵结束后仍相对于TW组低约20%;由图3B可知,成曲初始酶活力的不同使原料中蛋白质的水解速度存在一定的差异,表现为检测到的AAN含量低于TW对照组;但随着发酵时间的延长,SSEB组与TW组的差异从初始的20.69%缩小至发酵结束时的10.07%,但SW组AAN含量始终相对较低;试验观察到,在发酵的后期SSEB组酱醪中AAN含量仍在缓慢上升,而TW组已经处于稳定状态,因此若适当延长发酵时间,有望达到常规制曲发酵条件下相同的AAN含量。
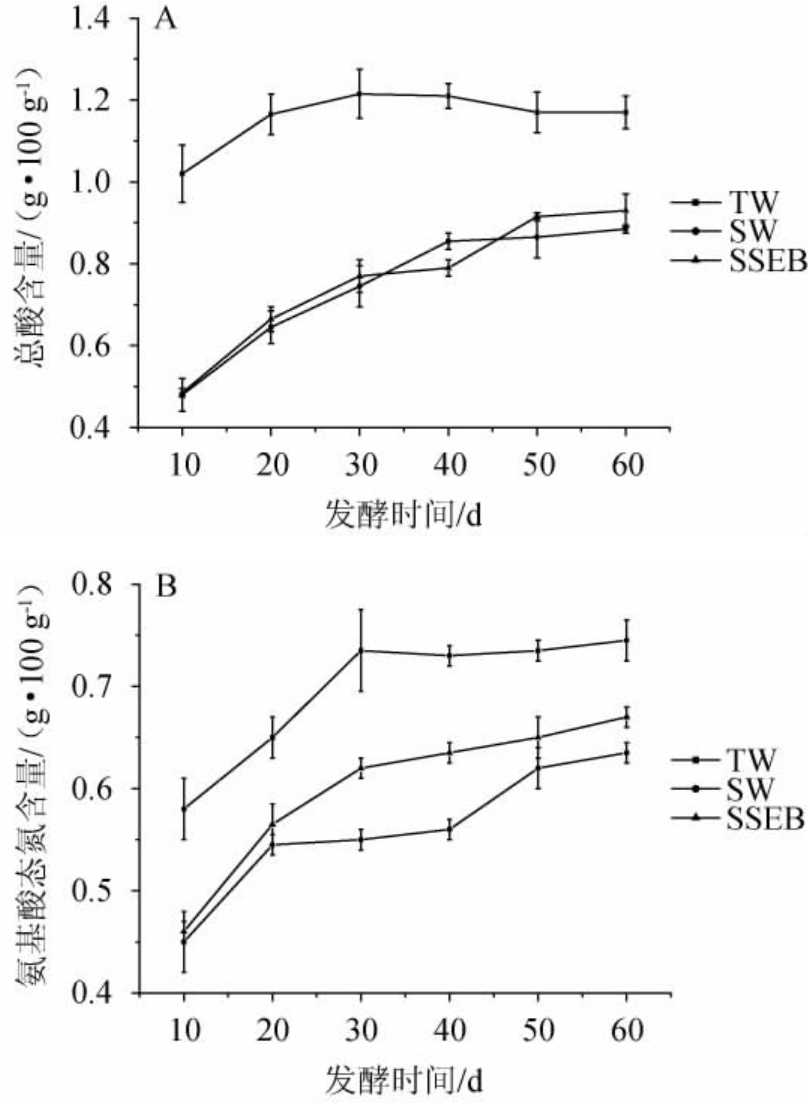
图3 酱醪中总酸(A)及氨基酸态氮(B)含量测定结果
Fig.3 Determination results of total acid (A) and amino acid nitrogen(B) content in soy sauce mash
2.5 酱醪微生物构成
2.5.1 酱醪微生物的Alpha多样性
对发酵60 d的酱醪微生物群落进行测序分析,结果见表3。由表3可知,各组样本的16S及ITS测序数据的OTU的覆盖率均在0.99以上;细菌方面各组样品检测到的OTU数量相接近,Shannon与Chao1指数也无较大差异,这应该是在漫长的发酵过程中,充足的底物资源使得细菌可以得到充分的生长和繁殖;对真菌的测序结果显示酱醪中真菌的丰富度和均匀度低于细菌,这与文献报道的观点一致[21];同时数据显示SSEB组样品的真菌丰富度较高,而SW组的丰富度略低于TW组,这可能意味着使用SSEB制曲过程中对细菌的短时抑制或使营养底物的增加有助于拓宽耐盐真菌的生存空间。
表3 酱醪样品中微生物多样性指数
Table 3 Diversity indexes of microorganism in soy sauce mash

细菌Shannon指数组别 sobs覆盖率 sobs覆盖率Chao1指数真菌Shannon指数Chao1指数TW SW SSEB 335 331 331 3.281 3.313 3.756 372.680 371.226 362.611 0.998 0.997 0.998 20 37 42 1.466 1.442 1.859 56.000 46.429 59.000 1.000 1.000 1.000
2.5.2 酱醪微生物群落组成
随着酿造阶段的开始,浸没在盐水中的米曲霉菌群开始衰退并自溶,耐盐细菌受到的生长抑制逐渐解除并开始繁殖[22],基于属水平酱醪的细菌及真菌菌群结构分析见图4。
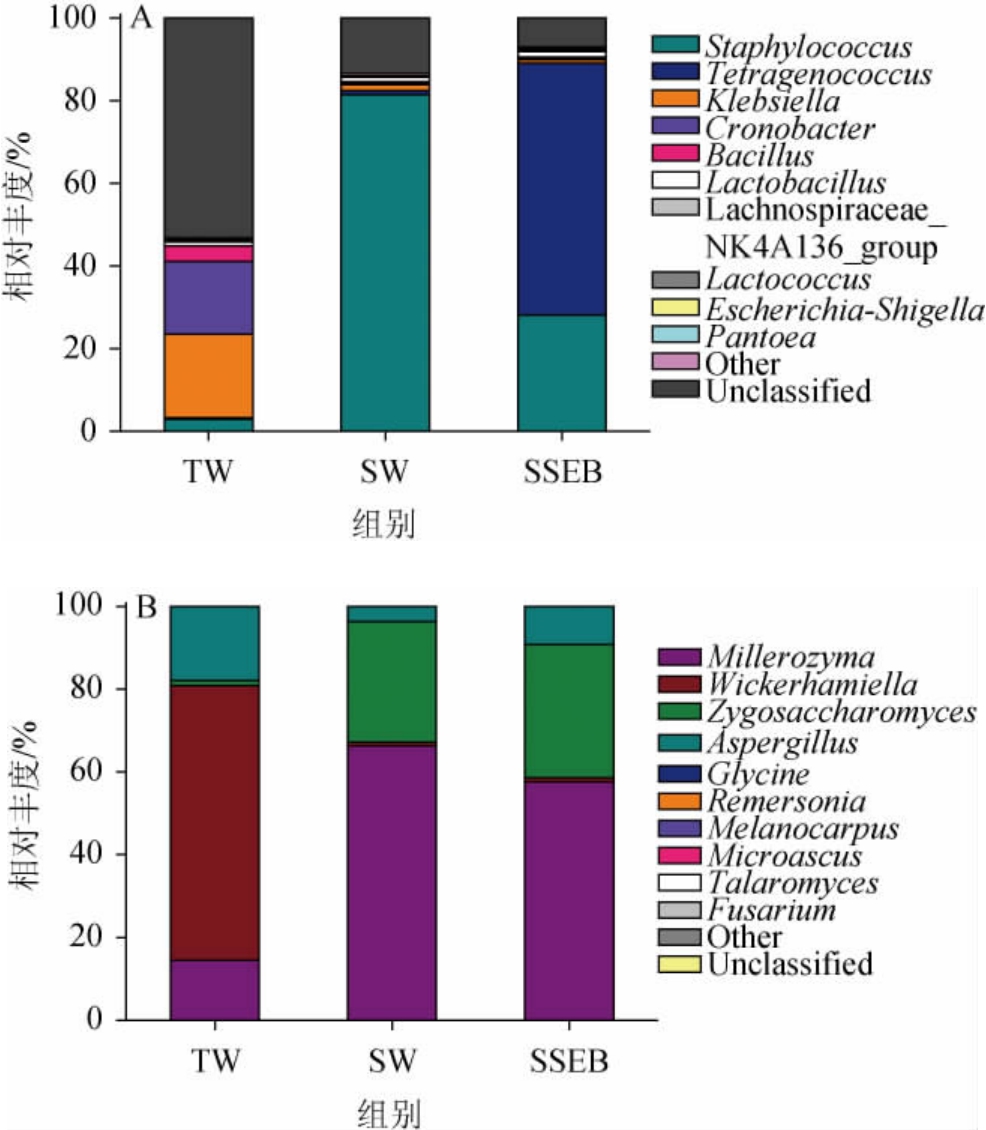
图4 基于属水平的酱醪细菌(A)及真菌(B)菌群结构
Fig.4 Structure of bacterial (A) and fungal (B) community in soy sauce mash based on genus level
由图4A可知,在细菌属水平上,TW组有较多未被注释到的物种,经上级分类确认主要为肠杆菌目(Enterobacterales)的微生物,这表示制曲原料可能在运输或储存过程中受到污染,较多的非发酵有益菌被携带进入发酵体系;SW组酱醪中葡萄球菌属(Staphylococcus)以81.44%的相对丰度占据绝对优势,SSEB组中的优势微生物为四联球菌属(Tetragenococcus)(相对丰度60.89%)、葡萄球菌属(Staphylococcus)(相对丰度28.16%)。葡萄球菌与四联球菌均为酱油酿造过程中的核心微生物[23],葡萄球菌对酱油中氨基酸的形成具有重要作用并可以分解支链氨基酸产生各类风味物质[24],四联球菌在高盐环境下可旺盛繁殖并水解蛋白质,对酱油中鲜味氨基酸、有机酸以及各类挥发性风味物质的含量均有积极影响[25-26],是酱油风味形成的关键微生物。
通常在发酵后期酱醪中的真菌以酵母菌为主[27]。由图4B可知,TW组中拟威克酵母属(Wickerhamiella)占据最高丰度(66.33%),其次为14.54%的米勒酵母属(Millerozyma)以及17.91%的曲霉属(Aspergillus);其余两组中的优势物种主要为米勒酵母属(Millerozyma)与接合酵母属(Zygosaccharomyces),分别占据SW组中物种相对丰度的66.28%与29.15%,占SSEB组的57.65%与32.19%,而曲霉属(Aspergillus)的相对丰度在这两组样品中低于10%。米勒酵母属(Millerozyma)通常为酱醪发酵后期的优势酵母菌[28],是酱油风味物质的重要贡献者,对酱油中酯类物质的积累具有重要作用[29];接合酵母属(Zygosaccharomyces)是发酵食品中常见的酵母菌,是酱油发酵的核心酵母之一,多具有良好的产醇能力,是酱油醇香的主要贡献者[30];拟威克酵母属(Wickerhamiella)在传统的酿造酱油中的报道较少,有研究发现其具有提升酱油醇类、酯类和酚类化合物含量的潜力[31],但其通常情况下非酱油发酵的核心酵母菌。
三组均使用同批次物料于相同工艺及环境下制备,却呈现了截然不同的微生物构成。试验结果展现出了SSEB制曲可对整个酱油酿造过程中的微生物群落构成产生影响,在修正酱油发酵稳态与安全性的同时还具有着带动发酵有益菌建立竞争优势的潜力。
2.6 酱油理化指标
经60 d的高盐稀态发酵,发酵结束后的酱油各项理化指标结果见表4。由表4可知,TW与SSEB组的AAN水平均达到特级酱油标准(>0.8 g/100 mL),其中TW组较SSEB组略高7.78%,而较SW组高14.44%,这是由于发酵前期曲料拥有相对较高的酶活力,原料中蛋白质的水解速度相对较高;SSEB组的TA含量相对于TW降低了22.50%,SW组的TA含量仅为0.85 g/100 mL,远低于各类市售酱油的TA含量[32],结合AAN的指标分析应为SW组酱醪的发酵程度较低所致;同时样品的其他指标也呈现了相似的对应关系,TW组的无盐固形物、总氮和谷氨酸含量相对于SSEB组分别略高6.85%、6.58%和10.68%,而SW组均处于较低水平;同时试验发现,TW组相对于其余试验组拥有较高浊度(31.9 NTU),而SSEB组则为8.77 NTU,结合2.3的微生物测序结果分析可能为TW组的细菌性浑浊所致,因此SSEB制曲工艺还有着使酿造酱油在物理性状方面更加纯净的潜力,而SW组浊度较低的原因应为发酵度较低所致。由于米曲霉分泌的蛋白酶耐盐性较差,SSEB制曲阶段原料中蛋白质的分解程度受到一定的影响。除SW组外,其余两组均达到了较好的发酵程度,表明SSEB中的营养物质在一定程度可以抵消制曲时渗透压对微生物生长的不利影响。
表4 酱油理化指标测定结果
Table 4 Determination results of physicochemical indexes of soy sauce

组别ANN/(g·100 mL-1)TA/(g·100 mL-1)总固形物/(g·100 mL-1)无盐固形物/(g·100 mL-1)总氮/(g·100 mL-1)谷氨酸/(g·100 mL-1)浊度/NTU TW SW SSEB 0.90±0.03 0.77±0.02 0.83±0.03 1.20±0.03 0.85±0.07 0.93±0.06 34.76±0.20 33.89±0.32 34.31±0.56 15.49±0.06 13.61±0.14 14.37±0.31 1.43±0.06 1.30±0.01 1.34±0.07 1.03±0.03 0.83±0.01 0.92±0.04 31.90±1.50 6.79±1.72 8.77±2.93
2.7 酱油风味分析
三组不同制曲方式得到的酱油样品挥发性风味物质的GC-MS分析结果见表5。由表5可知,三种酱油中共检测到40余种不同的挥发性风味物质,构成酱油风味的核心风味物质3-甲基-1-丁醇、苯乙醇、乙酸乙酯、4-乙基愈创木酚等以及多种呋喃类化合物在各样品中均得到检出[33],但三组样品展现出了不同的风味倾向性。其中TW组醛与酯的种类较多,醇类相对较少,这可能是与非发酵有益菌的过度繁殖有关;而SSEB组醇类与挥发性酸类较多于其他试验组,结合2.5.2分析应为不同酱醪酵母菌菌群丰度与代谢的旺盛程度有关;感官上TW组表现为浓郁的酱香与酯香,SSEB组呈现出了令人愉悦的豉香与醇香,而SW组则为较清爽的传统酱油香气,但略带不成熟风味。结果表明,SSEB制曲对酱油的风味可以产生具有较大辨识度的影响,对发酵菌群生态的改善可以有效降低非有益菌发酵所带来的异杂味,同时高级醇类的存在可使酱油的整体风味具有清晰的层次感;并且由于醇类物质的积累也可为酯类合成提供充足的前体物质,使SSEB组还存在较大的酯类物质合成空间。
表5 三种制曲方式制备酱油中的挥发性风味物质测定结果
Table 5 Determination results of volatile flavor compounds in soy sauce prepared by three method of making koji
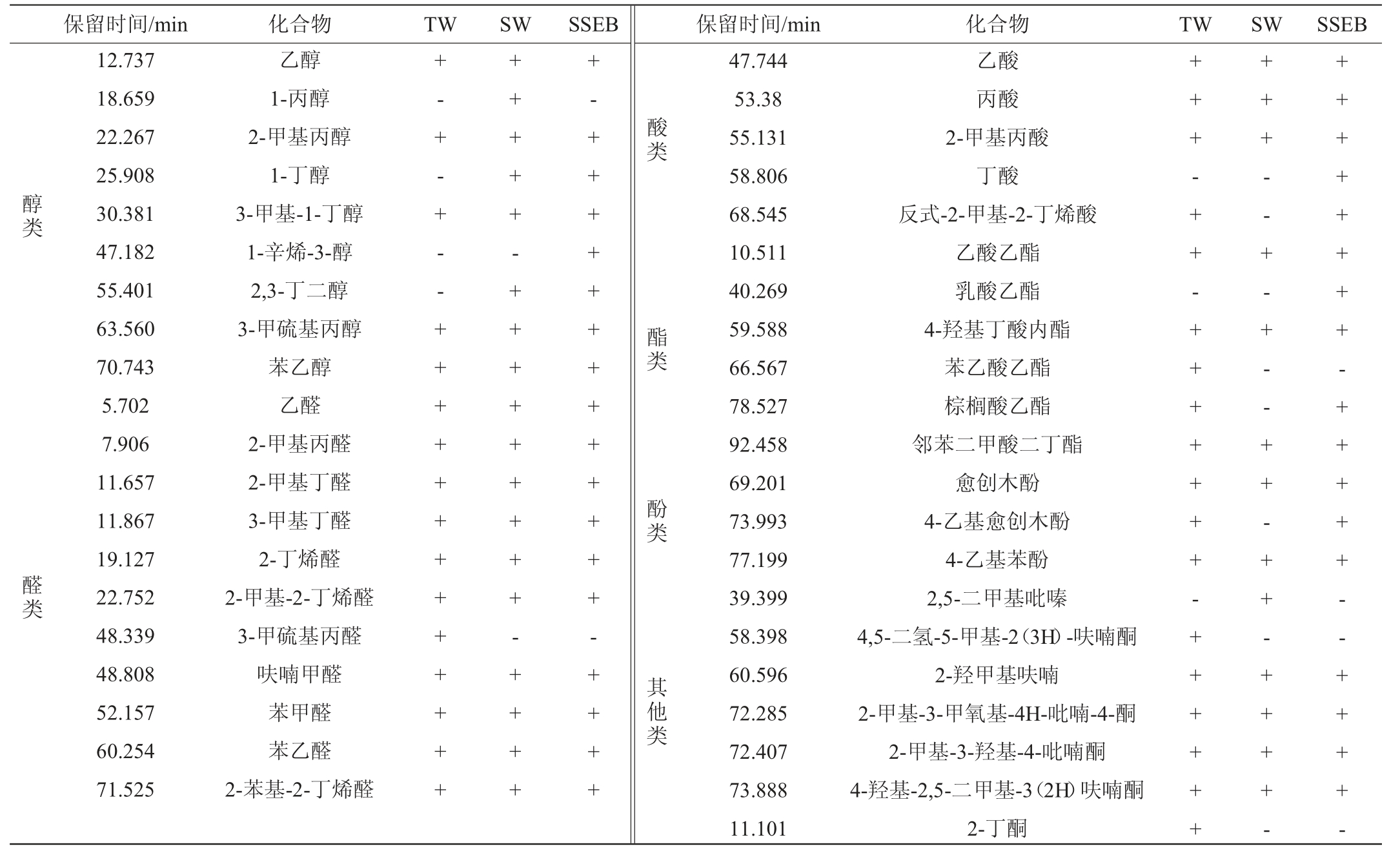
注:检出标记为“+”,未检出标记为“-”。
醇类醛类保留时间/min化合物TWSWSSEB保留时间/min化合物TWSWSSEB 12.737 18.659 22.267 25.908 30.381 47.182 55.401 63.560 70.743 5.702 7.906 11.657 11.867 19.127 22.752 48.339 48.808 52.157 60.254 71.525乙醇1-丙醇2-甲基丙醇1-丁醇3-甲基-1-丁醇1-辛烯-3-醇2,3-丁二醇3-甲硫基丙醇苯乙醇乙醛2-甲基丙醛2-甲基丁醛3-甲基丁醛2-丁烯醛2-甲基-2-丁烯醛3-甲硫基丙醛呋喃甲醛苯甲醛苯乙醛2-苯基-2-丁烯醛+-+-+--++++++++++++++++++-+++++++++-+++++-+++++++++++++-++++酸类酯类酚类其他类47.744 53.38 55.131 58.806 68.545 10.511 40.269 59.588 66.567 78.527 92.458 69.201 73.993 77.199 39.399 58.398 60.596 72.285 72.407 73.888 11.101乙酸丙酸2-甲基丙酸丁酸反式-2-甲基-2-丁烯酸乙酸乙酯乳酸乙酯4-羟基丁酸内酯苯乙酸乙酯棕榈酸乙酯邻苯二甲酸二丁酯愈创木酚4-乙基愈创木酚4-乙基苯酚2,5-二甲基吡嗪4,5-二氢-5-甲基-2(3H)-呋喃酮2-羟甲基呋喃2-甲基-3-甲氧基-4H-吡喃-4-酮2-甲基-3-羟基-4-吡喃酮4-羟基-2,5-二甲基-3(2H)呋喃酮2-丁酮+++-++-+++++++-+++++++++--+-+--++-++-++++-++++++++-+++++--++++-
3 结论
在使用酱油电渗析液进行制曲的研究中发现,其在不影响曲料中酵母菌丰度的情况下可以显著抑制细菌的生长,虽然米曲霉的生物量以及成曲酶活力也造成了一定的影响,但样品中氨基酸态氮含量与自来水组的差距会随着发酵时间的延长逐渐缩小。试验发现,酱油电渗析液在一定程度上可以缓解制曲时微生物的生存压力并促进微生物群落的多样性发展。最终酱油发酵结束后酱油电渗析液组与自来水组的理化指标相接近,且表现出了令人愉悦的不同风味。同时各项指标的检测结果表明,酱油电渗析液组酱油的理化指标以及风味物质构成还存在着较大的提升空间,适当的延长发酵时间或接种对盐胁迫具有耐受性的米曲霉有望进一步提升与强化酱油电渗析液制曲的优势及效果。本文对酱油脱盐副产物的功能价值及应用途径进行了研究,为酱油生产过程中副产物的产业内再利用提供理论基础及实践思路。
[1]GALAMA A H,SAAKES M,BRUNING H,et al.Seawater predesalination with electrodialysis[J].Desalination,2014,342:61-69.
[2]苗春雷,孙启星,李学伟,等.不同电渗析条件下酱油主要风味组分迁移规律研究[J].中国酿造,2022,41(3):125-129.
[3]常杰,向程,刘思雨,等.一种脱盐酱油渣、脱除酱油渣盐分及回收蛋白质的方法:CN201910326771.2[P].2022-06-14.
[4]苗春雷,朱娅媛,黄卓权,等.酵母菌对高盐稀态酱油风味强化研究进展[J].食品与发酵工业,2023,49(17):308-315.
[5]国家卫生健康委员会,国家市场监督管理总局.GB 4789.2—2022 食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2022.
[6]国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.3—2016 食品安全国家标准食品微生物学检验大肠菌群计数[S].北京:中国标准出版社,2016.
[7]国家卫生和计划生育委员会.GB 4789.15—2016 食品安全国家标准食品微生物学检验霉菌和酵母计数[S].北京:中国标准出版社,2016.
[8]国家国内贸易局.SB/T 10317—1999 蛋白酶活力测定法[S].北京:中国标准出版社,1999.
[9]国家卫生和计划生育委员会.GB 5009.235—2016 食品安全国家标准食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[10]国家卫生和计划生育委员会,国家食品药品监督管理总局.GB5009.5—2016 食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[11]李浩然.盐胁迫下米曲霉的应答机制研究[D].南昌:江西科技师范大学,2020.
[12]NA P J.Implications of salt and sodium reduction on microbial food safety[J].Crit Rev Food Sci Nutr,2010,50(3):209-227.
[13]李芬芳.传统发酵食品中耐盐微生物的分离及其耐盐机理初探[D].广州:华南农业大学,2009.
[14]DAKAL T C,SOLIERI L,GIUDICI P.Adaptive response and tolerance to sugar and salt stress in the food yeast Zygosaccharomyces rouxii[J].Int J Food Microbiol,2014,185:140-157.
[15]LIU S P,CHEN Q L,ZOU H J,et al.A metagenomic analysis of the relationship between microorganisms and flavor development in Shaoxing mechanized Huangjiu fermentation mashes[J].Int J Food Microbiol,2019,303(16):9-18.
[16]QI Q,HUANG J,ZHOU R Q,et al.Characterizing microbial community and metabolites of Cantonese soy sauce[J].Food Biosci,2021,40:100872.
[17]KINI K,AGNIMONHAN R,DOSSA R,et al.Genomics-informed multiplex PCR scheme for rapid identification of rice-associated bacteria of the genus Pantoea[J].Plant Dis,2021,105(9):2389-2394.
[18]张天震,孙晓琪,刘丹彤,等.山西老陈醋大曲细菌群落结构及多样性研究[J].中国食品学报,2021,21(5):323-330.
[19]陆静.新疆熏马肠中产生物胺菌株AHLs检测及其对生物胺作用的研究[D].石河子:石河子大学,2021.
[20]赵谋明,陈涛,王靖雯,等.酱油发酵过程中细菌的分离鉴定及其特性与交互作用[J].现代食品科技,2020,36(5):148-154,222.
[21]胡传旺.酱油发酵过程微生物群落解析及功能研究[D].无锡:江南大学,2017.
[22]CAO Z H,GREEN J,JULIA M,et al.Bioactivity of soy-based fermented foods:A review[J].Biotechnol Adv,2019,37(1):223-238.
[23]MONTEL M C, REITZ J, TALON R, et al.Biochemical activities of micrococcaceae and their effects on the aromatic profiles and odours of a dry sausage model[J].Food Microbiol,1996,13(6):489-499.
[24]王阿利,王子谦,魏梓晴,等.酱油酿造中微生物群落演替及其空间异质性研究[J].中国食品学报,2022,22(12):257-266.
[25]UDOMSIL N, RODTONG S, TANASUPAWAT S, et al.Proteinaseproducing halophilic lactic acid bacteria isolated from fish sauce fermentation and their ability to produce volatile compounds[J].Int J Food Microbiol,2010,141(3):186-194.
[26]刘佳乐.酱油发酵过程强化嗜盐四联球菌对酱油品质的影响[D].无锡:江南大学,2021.
[27]SULAIMAN J,GAN H M,YIN W F,et al.Microbial succession and the functional potential during the fermentation of Chinese soy sauce brine[J].Front Microbiol,2014,5:556.
[28]WEI Q,WANG H,CHEN Z,et al.Profiling of dynamic changes in the microbial community during the soy sauce fermentation process[J].Appl Microbiol Biotechnol,2013,97(20):9111-9119.
[29]JIANG X,PENG D,ZHANG W,et al.Effect of aroma-producing yeasts in high-salt liquid-state fermentation soy sauce and the biosynthesis pathways of the dominant esters[J].Food Chem,2020,344(1):128681.
[30]JANSEN M,VEURINK J H,EUVERINK G W,et al.Growth of the salttolerant yeast Zygosaccharomyces rouxii in microtiter plates:Effects of NaCl,pH and temperature on growth and fusel alcohol production from branched-chain amino acids[J].FEMS Yeast Res,2003,3(3):313-318.
[31]王靖雯.高盐稀态酱油风味功能酵母菌的筛选和应用研究[D].广州:华南理工大学,2022.
[32]郭壮,凌霞,王念,等.市售生抽酱油品质评价[J].中国调味品,2017,42(8):90-94.
[33]ZHAO G Z,DING L L,YAO Y P,et al.Extracellular proteome analysis and flavor formation during soy sauce fermentation[J].Front Microbiol,2018,9:1872.