沙棘(Hippophae rharnnoides L.)为胡颓子科(Elaeagnaceae)沙棘属(Hippophae)的灌木或小乔木,在我国主要分布于西北、华北地区,种类包括中国沙棘(Hippophae rhamnoides subsp. sinensis Rousi)、中亚沙棘(Hippophae rhamnoides subsp.turkestanica)、云南沙棘(Hippophae rhamnoides subsp.yunnanensis Rousi)等[1-2]。沙棘属于“药食同源”植物,已有大量研究证实沙棘提取物具有抑菌的功效[3-4]。沙棘果实、叶、籽中均含有多种生物活性物质,包括有机酸、氨基酸、微量元素、三萜类、生物碱、多酚及黄酮等,其中酚类是热点关注的功能因子,具有很强的抗氧化作用,对于沙棘的抑菌功效具有重要影响[5-6]。VERMA H等[7]研究发现,沙棘果和叶的正己烷和氯仿提取物对金黄色葡萄球菌(Staphylococcus aureus)有显著的抗菌活性,且与万古霉素的抗菌活性相当。焦岩等[8]研究发现,0.125~1.000 mg/mL的大果沙棘总黄酮对大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)和金黄色葡萄球菌均有显著抑菌效果,其中对大肠杆菌抑制作用最强,最低抑菌质量浓度为0.5 mg/mL。高语[9]测定了沙棘提取物对14种标准指示菌株的最小抑菌浓度(minimun inhibitory concentration,MIC),并对抗菌增效药物组合进行了筛选,结果表明沙棘对铜绿假单胞菌具有较强的抑制作用,且当沙棘乙醇提取物质量浓度为25 mg/mL,氯霉素对铜绿假单胞菌(Pseudomonas aeruginosa)90%最小抑菌浓度(MIC90)由单用时的16 μg/mL降低至4 μg/mL。张立明等[10]采用醇提法得到的沙棘总黄酮对白色念珠菌(Candida albicans)、热带念珠菌(Candida tropicalis)具有较好的抑制效果,MIC均为0.25 g/L。
食用植物酵素(edible plant Jiaosu)是以可用于食品加工的植物为主要原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分可供人类食用的酵素产品[11]。目前,沙棘主要制作沙棘果汁、果醋、果浆等产品,附加值相对较低,随着沙棘产量的逐年提升及其开发应用的深入,采用酵素加工技术研发沙棘发酵功能性产品,可有效解决因沙棘贮藏性差而导致的资源浪费、品质下降等难题,并实现高值转化,对沙棘产业经济提质增效具有重要意义[5,12]。当前已有国内外学者对沙棘酵素发酵工艺、功能特性及菌群结构等展开了研究。张琪等[13]利用高通量测序技术分析了沙棘酵素自然发酵过程中细菌群落结构变化,在门水平上共发现变形菌门(Proteobacteria)等25个门,其中蓝藻门(Cyanobacteria)为绝对优势菌门,在发酵72 h、624 h、1 584 h 3个阶段的相对丰度分别为93.28%、66.59%和35.40%。范蕊等[14]对沙棘酵素发酵过程中的细菌和真菌群落进行了宏基因组测序,发现发酵20 d、40~60 d时沙棘酵素的优势细菌为乳杆菌属(Lactobacillus sp.)、日本葡糖杆菌(Gluconobacter japonicus),相对丰度分别为33.03%、40.3%~35.71%;发酵20~40 d、60 d时沙棘酵素的优势真菌为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、近平滑假丝酵母(Candida parapsilosis),相对丰度分别为89.06%~71.12%、66.01%;商曰玲等[15]通过自然发酵制备多种沙棘酵素产品,并对其体外降脂性能进行测定,结果显示沙棘玫瑰酵素、纯沙棘酵素与沙棘橙肉酵素的脂肪酶活分别为147 U/mL、67 U/mL和63 U/mL,高于沙棘果汁和市售沙棘原浆中的脂肪酶活性。张海燕等[12]采用响应面法优化酿酒酵母(Saccharomyces cerevisiae)、异常汉逊酵母(Hansenula anomala)和植物乳植杆菌(Lactiplantibacillus plantarum)发酵制备沙棘酵素工艺,结果表明,最佳工艺条件为:酿酒酵母、异常汉逊酵母、植物乳植物杆菌质量比1.0∶1.6∶2.6,接种量10.25%,在此工艺下,沙棘酵素超氧化物歧化酶(superoxide dismutase,SOD)活性达2 206.67 U/mL,总酚含量为18.85 mg/mL,总黄酮含量为12.49 mg/mL。已有研究证实,酵素发酵过程有利于总酚含量的提升,但目前关于沙棘酵素中单体酚及其发酵不同阶段变化规律的报道较少。抑菌作用是酵素的主要功能之一,但目前仅有少数涉及酵素对致病菌抑菌效果的研究报道。
本研究以新鲜沙棘果为主要原料进行传统自然发酵制备酵素,采用高效液相色谱(high performance liquid chromatography,HPLC)法对不同发酵阶段的单体酚组成包括没食子酸、原儿茶酸、儿茶素、绿原酸、表儿茶素、槲皮素等15种酚类进行分析,对结果进行主成分分析(principal component analysis,PCA)和聚类分析(cluster analysis,CA),考察沙棘酵素不同发酵阶段对乙型副伤寒沙门菌(Salmonella paratyphi B)、铜绿假单胞菌、金黄色葡萄球菌和大肠埃希菌4种常见肠道致病菌的抑制作用,并探讨酚类化合物与抑菌活性间的相关性,以期阐明沙棘发酵过程酚类化合物组成对其抑菌活性变化的影响,为沙棘酵素发酵阶段精准调控提供技术依据,并为进一步实现沙棘资源的高值开发利用建立理论基础。
1 材料与方法
1.1 材料与试剂
山西吕梁野生沙棘果(中国沙棘):文水县万家富贡梨专业合作社;低聚果糖(纯度50%~60%):广西南宁纵联科技有限公司;白砂糖:合肥农英食品有限公司;金黄色葡萄球菌(ATCC29213)、大肠杆菌(ATCC25922)、铜绿假单胞菌(ATCC27853)、乙型副伤寒沙门氏菌(CMCC(B)50094):温州市康泰生物科技有限公司;LB营养琼脂培养基:青岛海博生物技术有限公司;酚类化合物标准品(纯度均>98%):美国Sigma公司;甲醇、氯化钠(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
LC-20A高效液相色谱仪:日本岛津公司;AllegraX-12R型冷冻离心机:美国贝克曼库尔特有限公司;YXQ-LS-18SI手提式压力蒸汽灭菌锅:上海博迅实业有限公司;HD-650超净工作台:上海尚道仪器制造有限公司;JA2003分析天平:上海舜宇恒平科学仪器有限公司;YQ-1015电炉:方科仪器常州有限公司;DHP-500电热恒温培养箱:天津市塞得利斯实验分析仪器制造厂;2 200 mL玻璃发酵罐:青岛麦欧力科技有限公司。
1.3 实验方法
1.3.1 沙棘酵素的制备
选取未发霉、未腐败变质的新鲜沙棘果实,使用去离子水冲洗除去表面杂质,晾干后称取800 g沙棘,分别称取400 g白砂糖与低聚果糖,将一定量果实平铺在已灭菌的2 200 mL玻璃发酵罐中,在果实上平铺一层白砂糖,再加入一定量的低聚果糖,按照上述顺序依次加入剩余的沙棘、糖类,室温20 ℃半封闭发酵。在发酵第5、10、15、20、30、40、50、60天取样,分别按T1、T2、T3、T4、T5、T6、T7、T8编号,每组3个平行样,样品在高速离心机8 000 r/min下离心20 min后-20 ℃保存。
1.3.2 体外抑菌活性的测定
体外抑菌活性测定采用牛津杯法[16],以生理盐水为对照,十字交叉法测量有效抑菌圈直径。将沙门氏菌、大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌分别接种于LB营养琼脂培养基中,37 ℃恒温培养24 h。以0.5麦氏比浊管比浊,用生理盐水稀释,使其含菌量为105~106 CFU/mL备用。将LB营养琼脂培养基底部区域4等分,均匀的将菌液涂布在培养基上,加盖放置5 min,分别将灭菌的牛津杯放置在4个区域,轻压牛津杯使之与平板充分接触。吸取100 μL不同发酵时间的沙棘酵素注入对应区域的牛津杯中,37 ℃培养24 h后,用游标卡尺准确测量有效抑菌圈直径。
1.3.3 酚类化合物的测定
酚类化合物含量的测定采用高效液相色谱法[17]。色谱条件:Sunfire-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为甲醇和0.1%的甲酸水溶液,流速0.7 mL/min,柱温25 ℃,检测波长280 nm。取2 mL沙棘酵素上清液,0.22 μm微孔滤膜过滤后,以20 μL进样量直接进样。
配制质量浓度均为16 mg/L没食子酸、原儿茶酸、儿茶素、绿原酸、咖啡酸、表儿茶素、阿魏酸、芦丁、金丝桃苷、鞣花酸、根皮苷、槲皮素、柚皮素、橙皮素、山奈酚等酚类化合物标准品溶液。
1.3.4 数据处理
所有试验均平行进行3次,试验结果表示为“平均值±标准差”形式。采用SPSS 21.0软件进行单因素方差分析及相关性分析,采用Origin 2019b进行主成分分析及聚类分析软件并绘制图表。
2 结果与分析
2.1 沙棘酵素中酚类化合物的分析
酚类化合物标准品及发酵60 d沙棘酵素样品HPLC色谱图见图1。由图1可知,沙棘酵素中酚类化合物组成丰富,共检出7种酚类化合物,包括没食子酸、儿茶素、表儿茶素、阿魏酸、金丝桃苷、根皮苷、槲皮素。
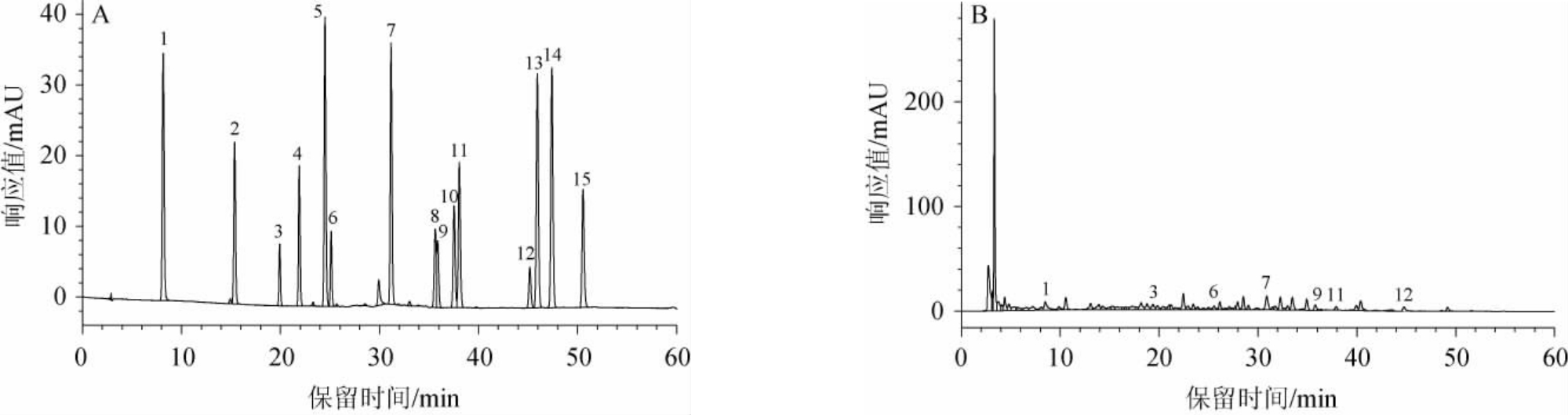
图1 酚类化合物标准品(A)及沙棘酵素样品(B)高效液相色谱图
Fig.1 High performance liquid chromatogram of phenolic compounds standards (A) and sea-buckthorn Jiaosu samples (B)
1-没食子酸;2-原儿茶酸;3-儿茶素;4-绿原酸;5-咖啡酸;6-表儿茶素;7-阿魏酸;8-芦丁;9-金丝桃苷;10-鞣花酸;11-根皮苷;12-槲皮素;13-柚皮素;14-橙皮素;15-山奈酚。
2.2 沙棘发酵过程中酚类化合物的变化
沙棘发酵过程中酚类化合物含量变化结果见表1。由表1可知,沙棘酵素的总酚类物质含量随发酵进行呈显著上升(P<0.05),至发酵T8阶段时达到(46.09±0.43)mg/L,相较T1时增长37.50%。除金丝桃苷外,其他酚类化合物的含量均在T8时达到最高。其中,儿茶素、阿魏酸、根皮苷和槲皮素含量的变化趋势类似,在发酵过程中呈逐步上升趋势,T8时其含量较T1时分别提高96.05%、103.23%、106.14%和142.88%;没食子酸含量呈先升高后降低再升高的变化,T8时其含量较T1时提高174.91%;而表儿茶素含量呈不规则变化。因此,延长发酵时间有利于沙棘酵素中酚类物质的转化与累积。范昊安等[18]从苹果梨酵素发酵过程中检出4种酚类化合物,分别为丁香酚、反式-异丁香酚、2,4-二叔丁基苯酚和对烯丙基苯酚,其中丁香酚含量最高,在发酵过程中呈总体上升的变化趋势。潘梓源等[19]研究发现,桂圆酵素中至少含有20余种酚类化合物,除了绿原酸等5种酚类化合物外,均在发酵后转化,生成16种新的酚类化合物,其中柚皮苷含量达3.32 μg/mL。CURIEL J A等[20]将桃金娘匀浆后利用乳酸菌进行发酵,经高效液相色谱分析表明,发酵后没食子酸、鞣花酸、槲皮素等酚类物质含量显著增加。
表1 沙棘发酵过程中酚类化合物含量变化
Table 1 Changes of phenolic compounds contents during sea-buckthorn fermentation process

注:同列数据不同小写字母表示差异显著(P<0.05);同行数据不同大写字母表示差异显著(P<0.05)。
发酵阶段T1 T2 T3 T4 T5 T6 T7 T8酚类化合物含量/(mg·L-1)没食子酸儿茶素表儿茶素阿魏酸金丝桃苷根皮苷槲皮素0.93±0.02fF 1.29±0.15eE 1.59±0.09dF 1.86±0.10cE 2.37±0.09abF 1.90±0.08cG 2.31±0.13bF 2.56±0.10aF 6.17±0.16fB 7.19±0.09eB 7.49±0.19eB 7.56±0.15eB 9.14±0.30dB 10.42±0.39cB 11.40±0.10bA 12.09±0.36aA 2.43±0.10gD 2.21±0.04fD 3.73±0.08eD 3.43±0.14dD 4.63±0.07cD 4.44±0.06bD 4.92±0.04aD 5.03±0.11aD 4.23±0.09fC 4.09±0.14fC 6.70±0.17eC 6.55±0.05eC 7.31±0.14dC 7.62±0.04cC 8.26±0.13bC 8.59±0.19aC 16.65±0.46aA 15.54±0.26bA 14.47±0.35cA 13.41±0.03dA 12.38±0.09eA 11.51±0.09fA 11.05±0.16fgB 10.76±0.31gB 1.36±0.07eE 1.44±0.12eE 1.67±0.10dF 1.92±0.05cE 2.28±0.14bF 2.35±0.12bF 2.44±0.07bF 2.80±0.12aF 1.76±0.10eE 2.49±0.15dD 3.14±0.11cE 3.40±0.07cD 3.81±0.13bE 4.02±0.15abE 4.15±0.13aE 4.27±0.16aE
由表1亦可知,在发酵5~40 d,沙棘酵素中金丝桃苷的含量显著高于其他酚类(P<0.05),其次为儿茶素;而在发酵50~60 d,儿茶素的含量显著高于其他酚类化合物(P<0.05),其次为金丝桃苷和阿魏酸。发酵60 d 时,儿茶素、金丝桃苷和阿魏酸的含量分别达到(12.09±0.36)mg/L、(10.76±0.31)mg/L和(8.59±0.19)mg/L,占总酚类物质含量的68.21%。沙棘酵素发酵阶段各种酚类化合物含量平均值排序为:金丝桃苷>儿茶素>阿魏酸>表儿茶素>槲皮素>根皮苷>没食子酸。
沙棘发酵过程中的酚类化合物仅金丝桃苷的含量呈持续下降的变化趋势,其他酚类物质如槲皮素和根皮苷等均呈上升变化。发酵过程中可能存在乳酸菌等使酚类物质脱糖基、脱酯。同时,金丝桃苷的苷元是槲皮素,发酵过程中金丝桃苷的含量下降可能是由于部分被代谢为槲皮素。WANG Z L等[21]研究发现,发酵后的诺丽果酚类物质明显增多,而金丝桃苷的含量随发酵进程持续极显著下降(P<0.01)。研究表明[22],沙棘果实中主要活性酚类成分是由槲皮素、山奈素等几种主要苷元物质与糖类组成的糖苷型化合物。这类糖苷型化合物结构稳定、不易降解,而游离的黄酮苷元很少。本研究结果表明,微生物产生的代谢酶可将糖苷型黄酮类化合物转化为苷元型化合物,发酵过程有利于槲皮素等游离黄酮苷元的累积。
2.3 沙棘发酵过程中酚类化合物的主成分分析
对沙棘发酵过程中的酚类化合物进行主成分分析,提取特征值>1的2个成分为主成分,其中第一主成分的方差贡献率为93.1%,第二主成分的方差贡献率为2.6%。由图2可知,基于酚类化合物PCA可以很好地将沙棘发酵过程分为三个阶段:5~10 d、15~20 d、30~60 d,将不同发酵时间的沙棘酵素样品分为发酵前期、发酵中期和发酵后期。发酵5~10 d以及15~20 d的样品距离相近,特征差异较小;而发酵30~60 d的样品排布较为分散,说明样品在该阶段酚类化合物变化比较大,这与沙棘发酵前后期酚类物质含量变化特点相符。根据PCA得分值和载荷值可以看出,酚类物质含量基本呈现向第1主成分正向变化。发酵后期沙棘酵素中酚类物质更为丰富,主要酚类物质有儿茶素、金丝桃苷和阿魏酸等,酚类含量基本达到最高,这与沙棘发酵过程酚类含量变化规律相符。
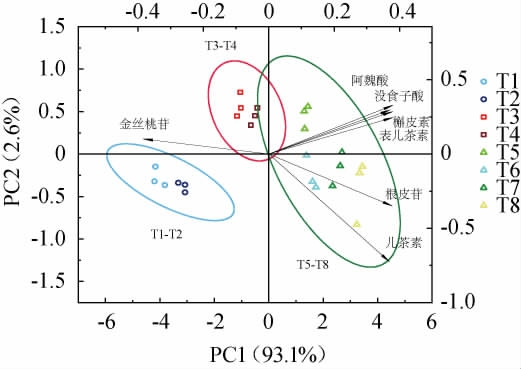
图2 基于酚类化合物不同发酵阶段沙棘酵素主成分分析
Fig.2 Principal component analysis of sea-buckthorn Jiaosu at different fermentation stages based on phenolic compounds
2.4 沙棘发酵过程中酚类化合物的聚类分析
采用层次聚类分析(hierarchicalclusteringanalysis,HCA)中的组平均链锁法(group average linkage)对沙棘发酵过程不同酚类化合物进行聚类分析,结果见图3。由图3可知,7种酚类化合物可以分为2类。第1类由没食子酸、儿茶素、表儿茶素、阿魏酸、根皮苷、槲皮素组成,聚入此类的酚类在发酵过程中总体呈上升趋势;第2类为金丝桃苷,其特点是含量随发酵进行呈下降变化。在第1类6种酚类化合物再分为2类:阿魏酸和儿茶素相较其他酚类含量较高聚为一类,而没食子酸等其余4种酚类为含量较低的一类。
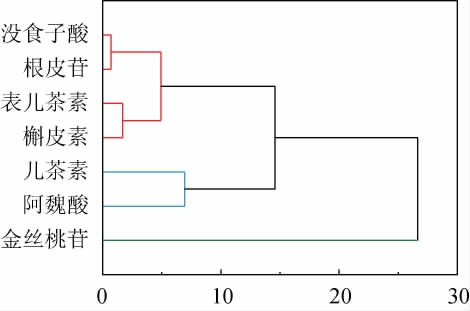
图3 沙棘酵素酚类化合物聚类分析
Fig.3 Cluster analysis of phenolic compounds of sea-buckthorn Jiaosu
2.5 沙棘酵素发酵过程中抑菌活性的变化
沙棘酵素发酵过程体外抑菌活性的变化结果见图4。
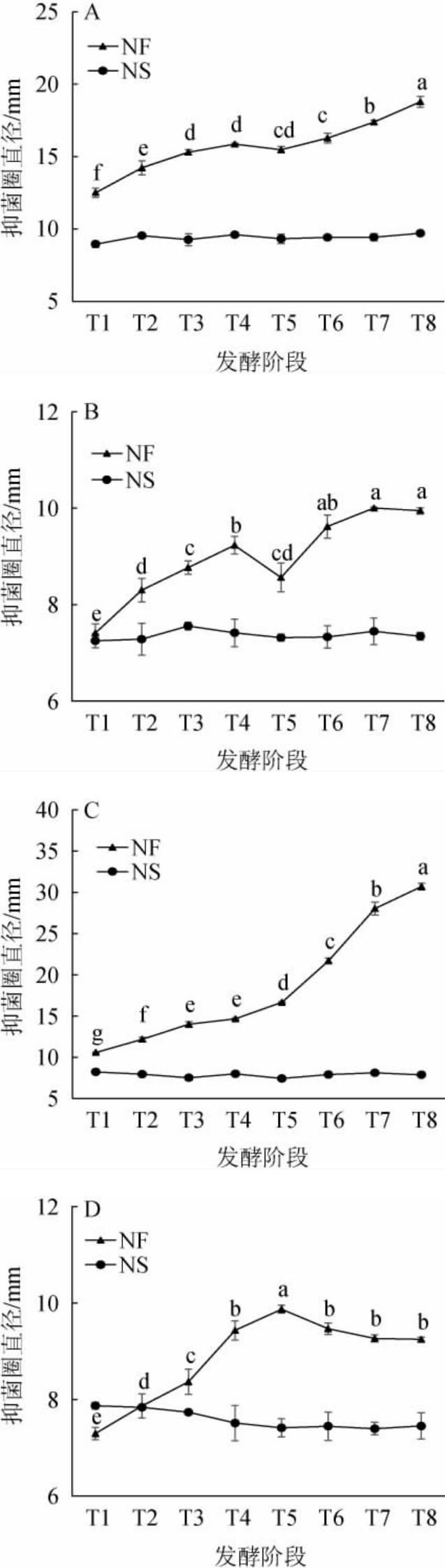
图4 沙棘酵素发酵过程中体外抑菌活性的变化
Fig.4 Changes of in vitro antibacterial activities of sea-buckthorn Jiaosu during fermentation process
A-对乙型副伤寒沙门菌的抑制作用;B-对铜绿假单胞菌的抑制作用;C-对金黄色葡萄球菌的抑制作用;D-对大肠埃希菌的抑制作用;NF-自然发酵;NS-生理盐水;不同字母表示差异显著(P<0.05)。
由图4可知,沙棘酵素对乙型副伤寒沙门菌和金黄色葡萄球菌的抑制作用均随发酵时间延长而提高。在发酵60 d时,抑菌圈直径分别为(18.79±0.37)mm和(30.69±0.40)mm,相较发酵5 d时分别提高了50.21%和189.98%;对铜绿假单胞菌的抑制作用在发酵过程中呈先上升后下降再上升的动态变化,抑菌圈直径在发酵50 d 时达到最高,为(10.00±0.03)mm,相较发酵5 d时提高了35.00%;而对大肠埃希菌的抑制作用呈先上升后下降后趋于稳定的变化趋势。王辉等[23]研究表明,青梅酵素对金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌均有较好的抑菌活性,抑菌圈直径分别为(19.9±0.56)mm、(19.0±0.3)mm、(17.2±0.15)mm。李祎等[24]对龙葵果发酵工艺进行了研究,发现龙葵果发酵后对金黄色葡萄球菌、大肠埃希菌和枯草芽孢菌的抑制作用显著提高,抑菌圈直径分别为(11.0±0.5)mm、(11.5±0.5)mm、(10.5±0.5)mm。张玉梅等[25]研究发现,红茶发酵液对大肠埃希菌和金黄色葡萄球菌有较明显的抑制作用,其抑菌圈直径均>10 mm。
由图4亦可知,在发酵阶段对乙型副伤寒沙门菌、铜绿假单胞菌和金黄色葡萄球菌的抑菌圈直径均显著大于生理盐水对照组(P<0.05),在发酵15 d后对大肠埃希菌的抑制作用也显著强于生理盐水(P<0.05)。其中,发酵60 d后金黄色葡萄球菌的抑菌圈直径>20.00 mm,对沙棘酵素极为敏感;其次为乙型副伤寒沙门菌,对沙棘酵素中度敏感;而大肠埃希菌和铜绿假单胞菌的抑菌圈在发酵过程中均<10.00 mm。刘维兵等[26]研究发现,葡萄海棠果酵素对金黄色葡萄球菌的抑制效果优于对大肠埃希菌及白色念珠菌的抑制效果,在质量浓度为320 mg/mL时,对金黄色葡萄球菌的抑菌圈直径为(16.1±0.44)mm。段晓宇等[27]研究了发酵对草莓菠萝体外抑菌作用的影响,发现酵素对4种病原菌均有较好的抑制作用,抑制能力从大到小分别为金黄色葡萄球菌>大肠杆菌>绿脓杆菌>枯草芽孢杆菌,其抑菌圈直径分别为(29.60±1.41)mm、(29.33±1.66)mm、(27.67±1.34)mm、(14.63±2.11)mm。陈巧红等[28]研究表明,红茶菌发酵液对铜绿假单胞菌的抑菌效果最差,为(12.2±0.7)mm。上述研究与本实验结果相似。
沙棘发酵过程中对乙型副伤寒沙门菌和金黄色葡萄球菌的抑菌作用显著强于对铜绿假单胞菌和金黄色葡萄球菌的抑制,可能是因为沙棘发酵阶段产生的酚类代谢物对乙型副伤寒沙门菌和金黄色葡萄球菌作用靶点产生良好匹配。钱丽红等[29]在茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理研究中发现,茶多酚对金黄色葡萄球菌的抑菌性强于铜绿假单胞菌,在质量浓度为2 g/L茶多酚溶液处理45 min后对金黄色葡萄球菌的抑菌率为45.2%,而对铜绿假单胞菌抑菌率仅为18.0%。乙型副伤寒沙门菌和金黄色葡萄球菌分别为革兰氏阴性菌和阳性菌,研究表明,沙棘对革兰氏阳性菌和阴性菌都有一定的抑制作用,如张立明等[10]研究表明,沙棘总黄酮对白色念珠菌、热带念珠菌、其他念珠菌有较好的抑菌效果,沙棘发酵代谢物的抑菌作用可能是多靶点的,针对不同菌株其抑菌作用机制不同。
2.6 酚类化合物与体外抑菌活性的相关性
酚类化合物与体外抑菌活性的相关性结果见图5。由图5可知,槲皮素对4种常见肠道致病菌抑制作用均呈极显著正相关(P<0.01),并且除对金黄色葡萄球菌外,相关系数均>0.9;沙棘发酵阶段没食子酸、表儿茶素、阿魏酸和根皮苷与酵素对4种常见肠道致病菌抑制作用呈极显著或显著正相关(P<0.01或P<0.05),相关系数为0.809~0.923;儿茶素与酵素对乙型副伤寒沙门菌、铜绿假单胞菌和金黄色葡萄球菌的抑制作用呈极显著正相关(P<0.01),相关系数分别为0.916、0.878、0.979。而金丝桃苷含量变化与酵素对4种致病菌抑制作用变化呈极显著负相关(P<0.01)。
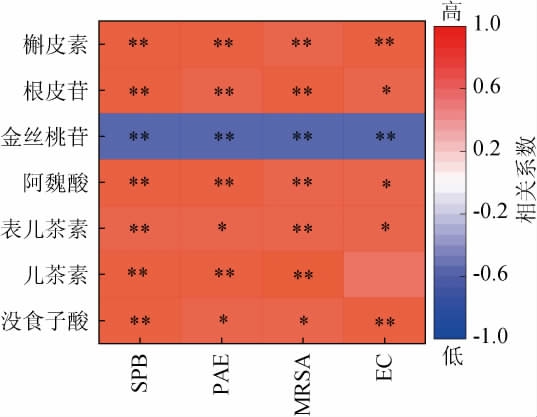
图5 酚类化合物与沙棘酵素体外抑菌活性的相关性
Fig.5 Correlation between phenolic compounds and in vitro antibacterial activities of sea-buckthorn Jiaosu
SPB-对乙型副伤寒沙门菌的抑制作用;PAE-对铜绿假单胞菌的抑制作用;MRSA-对金黄色葡萄球菌的抑制作用;EC-对大肠埃希菌的抑制作用;“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01)。
相对于糖苷型黄酮类来说,槲皮素等苷元型黄酮更利于吸收且功能性更强。根据本试验结果,发酵过程中槲皮素对4种致病菌抑制作用均呈极显著正相关(P<0.01),因此槲皮素被认为是发酵过程中推动沙棘抑菌活性提升的重要酚类成分。赵轶轩等[30]考察了沙棘醇提取物对痤疮丙酸杆菌的抑制作用,并通过网络药理学筛选得到12种黄酮类成分,其中将槲皮素与核心靶点进行分子对接,发现槲皮素与蛋白激酶B抗体(RAC-alpha serine/threonine-protein kinase,AKT1)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、前列腺素内过氧化物合酶2(recombinant prostaglandin endoperoxide synthase 2,PTGS2)结合良好,初步验证槲皮素为沙棘提取物抑菌的关键成分。洪志伟等[31]对金黄色葡萄球菌和大肠杆菌在槲皮素作用前后的菌体蛋白质及碱性磷酸酶变化进行了研究,认为槲皮素所展现抑菌潜力的可能机制是通过损伤细胞壁、改变细菌蛋白的表达谱、作为代谢拮抗物等。
3 结论
本研究对沙棘发酵过程中酚类化合物组成及体外抑菌活性的动态变化进行了分析。结果表明,沙棘酵素中共检出7种酚类化合物,包括没食子酸、儿茶素、表儿茶素、阿魏酸、金丝桃苷、根皮苷、槲皮素。在发酵过程中,除金丝桃苷含量呈持续下降变化外,其他酚类总体均呈上升趋势,并均在发酵60 d时达到最高,其中儿茶素、和阿魏酸的含量分别为(12.09±0.36)mg/L、(8.59±0.19)mg/L。通过主成分分析将沙棘酵素发酵过程分为3个阶段:5~10 d、15~20 d、30~60 d。体外抑菌试验结果表明,沙棘酵素对乙型副伤寒沙门菌和金黄色葡萄球菌的抑菌作用显著强于对铜绿假单胞菌和金黄色葡萄球菌的抑制。在发酵过程中,沙棘对乙型副伤寒沙门菌、金黄色葡萄球菌和铜绿假单胞菌的抑制作用总体均呈上升趋势,而对大肠埃希菌的抑制作用呈先上升后下降的变化。
综上所述,发酵过程有利于推动沙棘酵素中酚类物质的释放与累积以及槲皮素等游离黄酮苷元的生成,同时对沙棘发酵阶段抑菌活性的变化具有显著的影响。沙棘抑菌效果的提升也可能归因于发酵过程中胞外多糖、多元醇或有机酸等代谢物的逐步累积,从而影响细菌体内蛋白质以及酶活,后期可以采用靶向/非靶向代谢组学技术对发酵代谢物进行全面表征,解析关键的差异代谢物,筛选发挥重要作用的代谢通路,探究标志性差异代谢物与抑菌活性的相互关系。
[1]包晓玮,李建瑛,任薇,等.沙棘多糖对D半乳糖致衰老小鼠的抗氧化作用[J].食品工业科技,2020,41(4):293-297,306.
[2]CIESAROVÁ Z,MURKOVIC M,CEJPEK K,et al.Why is seabuckthorn(Hippophae rhamnoides L.) so exceptional? A review[J].Food Res Int,2020(7):109170.
[3]赵轶轩,屈凝伊,王丽娜,等.沙棘醇提取物对痤疮丙酸杆菌抑制作用及机制初探[J].辽宁中医药大学学报,2023,25(10):26-31.
[4]MANSOUR R B,WIDED M K,CLUZET S,et al.LC-MS identification and preparative HPLC isolation of Frankenia pulverulenta phenolics with antioxidant and neuroprotective capacities in PC12 cell line[J].Pharm Biol,2017,55(1):880-887.
[5]宁志雪,牛广财,朱立斌,等.沙棘活性成分、生理功能及开发利用研究进展[J].食品与机械,2021,37(11):221-227,240.
[6]SYTARˇOVÁ I, ORSAVOVÁ J, SNOPEK L, et al.Impact of phenolic compounds and vitamins C and E on antioxidant activity of seabuckthorn(Hippophaë rhamnoides L.) berries and leaves of diverse ripening times[J].Food Chem,2020,310(1):125784.
[7]VERMA H,CHAHOTA R,PALIAL A,et al.Antibacterial properties of seabuckthorn(Hippophae rhamnoides L.)leaf extracts against common skin and wound bacteria[J].Ind J Vet Res,2011,20(1):38-41.
[8]焦岩,常影,余世锋,等.大果沙棘总黄酮体外抗氧化和抑菌作用研究[J].食品研究与开发,2015,36(19):12-15.
[9]高语.35味中草药提取物体外抑菌活性的研究[J].中国民族民间医药,2021,30(9):35-43.
[10]张立明,杨凤琴,袁本香,等.沙棘总黄酮对4种念珠菌的体外抑菌作用[J].中国医院药学杂志,2010,30(16):1355-1357.
[11]中华人民共和国工业和信息化部.QB/T 5323—2018 植物酵素[S].北京:中国标准出版社,2018
[12]张海燕,康三江,曾朝珍,等.响应面法优化沙棘酵素多菌种发酵工艺[J].中国酿造,2023,42(10):207-213.
[13]张琪,朱丹,牛广财,等.高通量测序分析沙棘酵素自然发酵过程中细菌多样性[J].食品科学,2022,43(8):158-165.
[14]范蕊,王文文,魏琳娜,等.基于宏基因组学分析不同发酵时期新疆沙棘酵素微生物群落结构及功能[J/OL].食品工业科技,1-14[2024-09-22].https://doi.org/10.13386/j.issn1002-0306.2024050247.
[15]商曰玲,王清,吴燕铃,等.特种沙棘酵素的制备及其体外降脂性能分析[J].食品研究与开发,2023,44(22):61-67.
[16]董瑷榕,苗建军,郭春华,等.苯甲酸、富马酸及其复合酸对常见致病菌体外抑菌效果的研究[J].西南民族大学学报(自然科学版),2019,45(1):36-41.
[17]TIAN Y, GOU X J, NIU P F, et al.Multivariate data analysis of the physicochemical and phenolic properties of not from concentrate apple juices to explore the alternative cultivars in juice production[J].Food Anal Method,2018,11:1735-1747.
[18]范昊安,沙如意,杜柠,等.苹果梨酵素发酵过程中香气成分的变化[J].食品科学,2021,42(2):177-184.
[19]潘梓源,林佳漫,邓乃铨,等.桂圆酵素的发酵工艺优化及其酚类化合物生物转化分析[J].中国酿造.2019,38(7):95-99.
[20]CURIEL J A,PINTO D,MARZANI B,et al.Lactic acid fermentation as a tool to enhance the antioxidant properties of Myrtus communis berries[J].Microb Cell Fact,2015,14:67.
[21]WANG Z L, DOU R, YANG R L, et al.Changes in phenols, polysaccharides and volatile profiles of Noni(Morinda citrifolia L.)juice during fermentation[J].Molecules,2021,26(9):2604.
[22]郭瑞雪.沙棘酚类物质生物活性、生物利用度及其体内外抑制乳腺癌细胞增殖的机理研究[D].广州:华南理工大学,2019.
[23]王辉,马秀敏,张鹰.青梅酵素的生物活性及体外抑菌作用[J].食品工业科技,2018,39(12):39-43.
[24]李祎,王萍.龙葵果汁发酵工艺优化及其抗炎.抑菌活性评价[J].现代食品科技,2017,33(6):248-254,213.
[25]张玉梅,房卫刚,李波清,等.红茶菌发酵液抑菌作用研究[J].中国病原生物学杂志,2008,3(12):890-891,902.
[26]刘维兵,王舸楠,王犁烨,等.葡萄海棠果酵素发酵工艺优化及体外抑菌与抗氧化活性的研究[J].食品工业科技,2019,40(16):118-125.
[27]段晓宇,曾莉,樊睿,等.草莓菠萝复合酵素成分及其体外生物活性研究[J].天然产物研究与开发,2021,33(10):1635-1642,1706.
[28]陈巧红,李敏,陈瑞云.大豆乳清红茶菌发酵液抑菌性研究[J].山东化工,2021,50(16):41-43.
[29]钱丽红,陶妍,谢晶.茶多酚对金黄色葡萄球菌和铜绿假单胞菌的抑菌机理[J].微生物学通报,2010,37(11):1628-1633.
[30]赵轶轩,王丽娜,屈凝伊.沙棘果研究进展[J].中国民族民间医药,2022,31(3):56-62.
[31]洪志伟,孟令宇,葛雅琨,等.槲皮素对大肠杆菌和金黄色葡萄球菌的体外抑菌作用的研究[J].吉林化工学院学报,2017,34(5):38-41.