花脸香蘑(Lepista sordida)是一种珍稀食药用菌,又名紫晶口蘑、丁香蘑,隶属于担子菌门、伞菌纲、伞菌目、口蘑科、香蘑属,其子实体在幼年期呈现紫色或淡紫色,成熟后多变为乳白色或粉紫色[1]。花脸香蘑不仅营养价值高,富含蛋白质、脂肪、粗纤维、多糖、二萜类等营养物质及人体所必需的微量元素,并且兼具养血、益神和补五脏的功效[2]。多糖作为花脸香蘑的天然活性成分之一,是由各种中性糖或糖醛酸通过糖苷键聚合而成的碳水化合物长链,可以从子实体、菌丝体及发酵液中获,其中胞外多糖可由菌丝发酵液提取[3]。真菌多糖具有一定的免疫调节、抗肿瘤、抗病毒和抗氧化等重要生物活性[4-8]。杨彬[9]在温度25 ℃、pH 6、转速150 r/min及接种量为8%的最佳工艺条件下对银耳菌株进行摇瓶发酵,获取其胞外多糖含量高达(0.72±0.03)g/L,并发现银耳胞外多糖的总还原力和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基清除能力较强,自由基清除率达到(61.62±2.73)%。尽管关于优化不同真菌发酵液的工业条件已受到广泛的关注和研究[10],但针对不同来源、品种的花脸香蘑菌株的研究开发程度具有差异[11-12]。采自达州的野生花脸香蘑“花5”菌株为新品种,其研究相对较少,有待进一步开发利用。
花脸香蘑的人工栽培存在生产周期长、产量低、易碎易虫害等问题,限制了其活性产物的开发利用[13]。液体发酵培养不仅具有可连续化生产、发酵时间短、生产效能高、品质稳定及成本低的优点,并且发酵分泌的胞外多糖产量高于人工栽培及固体发酵[14]。GUO J等[15]利用平板、摇瓶培养优化灵芝的液体发酵条件,发现在最佳工艺条件下,液体灵芝菌种的发酵时间较短,并且菌种具有较高的代谢活力。液态发酵能够有效促进真菌的生产、质量和资源的合理利用,为真菌胞外多糖的产业化提供便捷又高效的生产方法。在研究花脸香蘑产胞外多糖的条件方面,主要集中在优化发酵培养基的营养成分,孟玲等[16]优化了花脸香蘑液体发酵所需的碳源、氮源、无机盐、维生素及pH等营养因子条件,而液体发酵所需的接种量、转速、温度等非营养因子条件的研究相对较少。罗倩等[17-19]均采用正交试验设计方法优化花脸香蘑发酵条件。同时,有研究表明花脸香蘑胞外多糖具有一定的免疫调节、抗肿瘤活性。胡欣蕾[20]研究发现,花脸香蘑胞外多糖不仅能够促进小鼠巨噬细胞(Ana-1)的增殖,还可以抑制人体乳腺癌细胞(BT-549)、宫颈癌细胞(Hela-229)及胃癌细胞(HGC-27)的增殖。但花脸香蘑“花5”菌株的最佳培养条件以及胞外多糖的免疫活性及抗肿瘤活性尚不完善,有待进一步探索。
本研究对从四川省达州市通川区罗江镇柳家坝采集到的一株野生菌株“花5”进行组织分离、纯化并分类鉴定,在单因素试验的基础上,采用响应面法优化菌株产胞外多糖的条件,并探究其胞外多糖的免疫调节活性及抗肿瘤活性,旨在为促进花脸香蘑胞外多糖的液体发酵生产及其在新药研发和功能性食品开发等方面提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株
花脸香蘑子实体:从四川省达州市通川区罗江镇柳家坝地区采集,由本实验室通过组织分离、纯化获得其菌株,编号为“花5”。
1.1.2 试剂
ITS4/ITS5分析引物:成都生工生物工程股份有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DNA纯化回收试剂盒:北京天根生化科技有限公司;无水乙醇(分析纯):成都金山化学试剂有限公司;琼脂(生化试剂):广州赛国生物科技有限公司;葡萄糖、溴化钾(均为分析纯):上海阿拉丁生化科技股份有限公司;RPMI 1640培养基、胎牛血清、双抗、胰酶:美国Gibco公司;截留分子质量7 000 Da透析袋、脂多糖(lipopolysaccharide,LPS):中国Biosharp公司;甘露聚糖肽(mannatide,Man):四川奥邦药业;细胞计数试剂盒-8(cell counting kit-8,CCK-8):上海碧云天生物技术研究所;小鼠巨噬细胞(RAW 264.7)、小鼠胃癌细胞(mouse forestomach carcinoma cells,MFC):中国科学院生物化学与细胞生物学研究所。
1.1.3 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):纯水1 L,去皮马铃薯200 g,琼脂20 g,葡萄糖20 g。121 ℃高压蒸汽灭菌20 min。
马铃薯葡萄糖水培养基(potato dextrose broth,PDB):纯水1 L,去皮马铃薯200 g,葡萄糖20 g。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
Thermal Cycler2720聚合酶链式反应(polymerase chain reaction,PCR)仪、ChemiDoc XRS+化学凝胶成像系统:美国BIO-RAD公司;DYY-6C电泳仪:北京六一有限公司;高压灭菌锅:上海申安医疗器械厂;BPN-80CH UV二氧化碳细胞培养箱、Nicolet 5700傅里叶变换红外光谱仪:美国Thermo公司;318MC酶标仪:上海三科仪器有限公司;DMI 3000倒置显微镜:上海徕卡显微系统有限公司。
1.3 方法
1.3.1 菌株组织分离及纯化保存
切下新鲜菌株中菌盖与菌柄交接处的组织,然后将组织直接放入PDA斜面培养基中,并保存在25 ℃真菌培养箱避光培养。待试管中长出大量菌丝后,进行纯化工作,挑出健旺无污染的菌丝至PDA培养皿上,待菌丝长至2/3时继续纯化,重复3次。将纯净的菌丝保存于-4 ℃冰箱。
1.3.2 菌株鉴定
采取传统形态学的方法,通过观察新鲜子实体的菌盖、菌肉、菌褶、菌柄、形状、颜色及气味等形态特征,进行菌种的初步鉴定。
采取分子生物学的方法获取菌种DNA序列,称取1 g“花5”菌丝体,参照植物基因组DNA提取试剂盒方法提取总DNA,并进行PCR扩增,扩增引物为ITS4(5'-TCCTCCGCTTATTGATATGC-3')及ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')。PCR扩增体系(75 μL):3.75 μL的ITS4,3.75 μL的ITS5,37.5 μL的Q5酶,6 μL的DNA模板,24 μL的双蒸水(ddH2O)。PCR扩增条件:98 ℃预变性30 s;98 ℃变性10 s,58 ℃退火30 s,72 ℃延伸45 s,共34个循环;72 ℃再延伸10 min。将PCR产物进行电泳检测,切取500~750 bp之间明亮清晰的目的条带,依据凝胶回收试剂盒回收纯化,送至生工生物工程股份有限公司进行DNA测序。将测序结果上传至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库并申请登录号,使用MEGA7.0软件采用邻接(neighbor-joining,N-J)法构建系统发育进化树。
1.3.3 菌株“花5”产胞外多糖发酵培养条件优化
(1)胞外多糖含量测定
参照吴思伟等[21-22]的方法测定胞外多糖含量。葡萄糖标准曲线回归方程为y=0.023 5x+0.035 3(R2=0.993 3)。
(2)单因素试验
将“花5”菌丝接种至PDA培养皿上,于25 ℃培养箱中培养,待菌丝长满平面。取100 mL的PDB培养基倒入150 mL三角瓶中并使用高压灭菌锅灭菌。使用直径为2 mm打孔器将活化后的菌丝切成均等大小的菌块并接种于三角瓶中并摇床培养。
接种量的确定:在发酵时间4 d、转速180 r/min及温度25 ℃的条件下,考察接种量(30 mg/100 mL、60 mg/100 mL、90 mg/100 mL、120 mg/100 mL、150 mg/100 mL)对发酵液中胞外多糖含量的影响。
转速的确定:在发酵时间4 d、接种量90 mg/100 mL及温度25 ℃的条件下,考察转速(120 r/min、150 r/min、180 r/min、210 r/min、240 r/min)对发酵液中胞外多糖含量的影响。
发酵温度的确定:在发酵时间4 d、接种量90 mg/100 mL及转速180 r/min的条件下,考察温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃)对发酵液中胞外多糖含量的影响。
(3)响应面试验
基于单因素试验结果,以胞外多糖含量(Y)为响应值,选取接种量(A)、转速(B)、发酵温度(C)为自变量,根据Box-Behnken试验设计原理优化“花5”菌株液体发酵产胞外多糖条件,响应面试验因素与水平见表1。
表1 菌株“花5”发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for fermentation conditions optimization of strain "Hua 5"
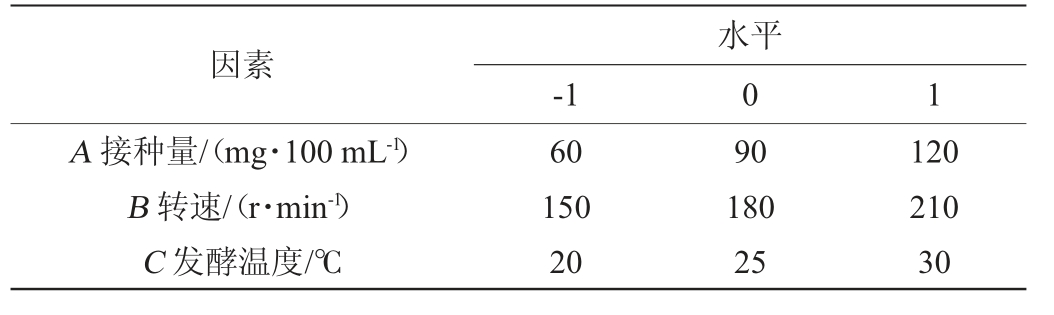
因素A 接种量/(mg·100 mL-1)B 转速/(r·min-1)C 发酵温度/℃-1水平0 1 60 150 20 90 180 25 120 210 30
1.3.4 胞外多糖提取、纯化及结构、活性研究
(1)胞外多糖的提取及纯化
收集各试验组中所产生的“花5”菌丝发酵液,5 000 r/min离心30 min,取上清液经过旋蒸浓缩,在浓缩液中加入4倍等体积的无水乙醇搅拌混匀,静置过夜,取沉淀用纯水复溶并透析、冷冻干燥后得胞外多糖,命名为花脸香蘑胞外多糖(Lepista sordida exopolysaccharides,LS-EPS)。
(2)LS-EPS的傅里叶红外光谱检测
称取2 mg LS-EPS与200 mg溴化钾混匀,经过研磨、压片,使用傅里叶红外光谱仪在4 000~500 cm-1波数范围内扫描。
(3)LS-EPS的药物毒性及抗肿瘤活性检测
取对数期生长、状态良好的RAW 264.7细胞及MFC细胞,消化并稀释至1×105个/mL,将细胞稀释液以每孔100 μL加入96孔板中,并在边缘孔加入200 μL的磷酸缓冲盐溶液(phosphate buffer saline,PBS)缓冲液以避免边缘效应,放入37 ℃、浓度为5%的CO2培养箱中恒温孵育24 h。
药物毒性检测:在空白对照组(CK)加入每孔100 μL的细胞培养液;阳性对照组加入每孔100 μL的脂多糖(LPS)溶液,使其终质量浓度为10 μg/mL;药物试验组加入每孔100 μL不同质量浓度的LS-EPS溶液,使其终质量浓度为5 μg/mL、10 μg/mL及20 μg/mL,每组设置10个重复孔。恒温培养24 h后,使用倒置显微镜拍照记录,并在每孔加入10 μL的CCK-8试剂,在波长450 nm处检测其吸光度值,计算细胞增殖率。
抗肿瘤活性检测:空白对照组及药物试验组方法同上,阳性对照组加入每孔100 μL的甘露聚糖肽(Man)溶液,使其终质量浓度为10 μg/mL。检测方法同上,计算细胞抑制率。
细胞增殖(抑制)率计算公式如下:
式中:p为细胞(增殖)抑制率,%;A0为细胞培养液平均OD450 nm值;A1为空白对照组平均OD450 nm值;A2为药物试验组和阳性对照组的OD450 nm值。
1.3.5 统计学分析
对试验数据均采用SPSS23.0软件进行单因素方差分析,胞外多糖的体外活性数据采用t检验和Tukey检验进行处理。
2 结果与分析
2.1 菌株“花5”的鉴定
2.1.1 形态学鉴定
“花5”菌株子实体的形态结果见图1。

图1 菌株“花5”子实体形态图
Fig.1 Morphological diagram of strain "Hua 5" fruiting bodies
由图1可知,“花5”子实体呈现淡紫色,中等偏小。菌盖直径为2.0~6.5 cm,年幼期呈现半球形,成熟期平展,中部下凹,边缘内卷,呈波状,具不明显的条纹。菌肉淡紫色,较薄,具有浓厚的芳香气味。菌褶直生,中等密,呈淡紫色。菌柄长3.0~5.5 cm,直径0.4~1.1 cm,基部多弯曲,为实心,呈淡紫色。结合《中国大型真菌》[23]以及《中国大型菌物资源图鉴》[24]初步鉴定为花脸香蘑(Lepista sordida)。
2.1.2 分子生物学鉴定
将“花5”菌株的rDNA-ITS基因序列信息上传至NCBI,获得真菌登录号:OR668710。构建菌株“花5”的系统发育树,结果见图2。由图2可知,目标菌株与黑龙江省兴隆县的花脸香蘑(MZ298495.1)同源性达到了99.85%,置信度达到99%,由分子生物学鉴定结果结合形态特征,确定菌株“花5”为花脸香蘑(Lepista sordida)。

图2 基于rDNA-ITS基因序列“花5”菌株的系统发育树
Fig.2 Phylogenetic tree of "Hua 5" strainbased on rDNA-ITS gene sequences
2.2 单因素试验结果分析
2.2.1 接种量对LS-EPS含量的影响
由图3可知,接种量在30~90 mg/100 mL之间,LS-EPS的含量呈现逐渐上升的趋势。当接种量为90 mg/100 mL时,LS-EPS的含量最高达到5.64 g/L,且极显著高于接种量为30 mg/100 mL、150 mg/100 mL时的LS-EPS含量(P<0.01)。当接种量在90~150 mg/100 mL之间,LS-EPS的含量呈现逐渐下降的趋势。分析原因可能是,接种量对花脸香蘑菌丝的生长和繁殖速度能够产生影响,接种量过小会使菌丝的培养时间增加,接种量过大则会导致菌丝生长过快,在有限的培养基中溶解氧及营养供应不足,从而影响其LS-EPS的合成[25]。因此,确定最适接种量为90 mg/100 mL。
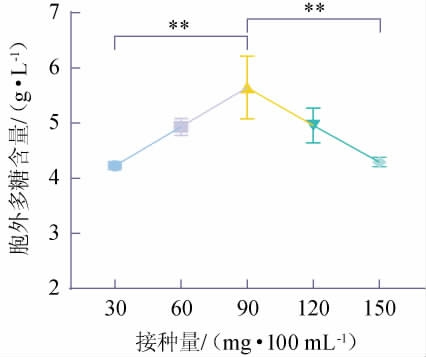
图3 不同接种量对胞外多糖含量的影响
Fig.3 Effect of different inoculum on exopolysaccharide contents
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。下同。
2.2.2 转速对LS-EPS含量的影响
由图4可知,摇床转速在120~180 r/min之间,LS-EPS的含量呈现逐渐上升的趋势。当转速在180 r/min时,LS-EPS的含量最高达到5.59 g/L,且极显著高于转速为120 r/min、240 r/min时的LS-EPS含量(P<0.01),显著高于150 r/min时的LS-EPS含量(P<0.05)。摇床转速在180~240 r/min之间,LS-EPS的含量呈现逐渐下降的趋势。分析原因可能是,过低的摇床转速导致培养基中溶解氧的含量过低,其含氧量不能满足花脸香蘑菌丝的正常生长和新陈代谢;过高的摇床转速虽然能够溶解更多氧,但可能会对菌丝细胞产生一定损伤,从而减少了LS-EPS的合成[26]。因此,确定最佳转速为180 r/min。
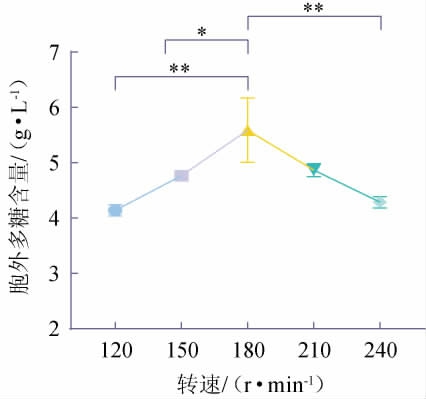
图4 不同转速对胞外多糖含量的影响
Fig.4 Effect of different rotational speed on exopolysaccharide contents
2.2.3 发酵温度对LS-EPS含量的影响
由图5可知,发酵温度在15~25 ℃之间,LS-EPS的含量呈现逐渐上升的趋势。当温度在25 ℃时,胞外多糖的含量最高,且显著高于其他组别(P<0.05),达到5.40 g/L。当温度在25~35 ℃之间,LS-EPS的含量呈现逐渐下降的趋势。分析原因可能是,发酵温度能够影响真菌中产胞外多糖相关酶的活性,进而影响真菌的代谢[27]。因此,确定最佳发酵温度为25 ℃。

图5 不同发酵温度对胞外多糖含量的影响
Fig.5 Effect of different fermentation temperature on exopolysaccharide contents
2.3 响应面试验结果分析
2.3.1 响应面试验结果与方差分析
综合单因素试验结果分析,以接种量(A)、转速(B)及发酵温度(C)3个因素为自变量,胞外多糖含量(Y)为响应值进行响应面优化,设计及结果见表2。采用Design-Expert V8.0.6软件对试验数据进行多元回归拟合分析,结果见表3。
表2 菌株“花5”发酵条件优化响应面试验设计及结果
Table 2 Design and results of response surface experiments for fermentation conditions optimization of strain "Hua 5"
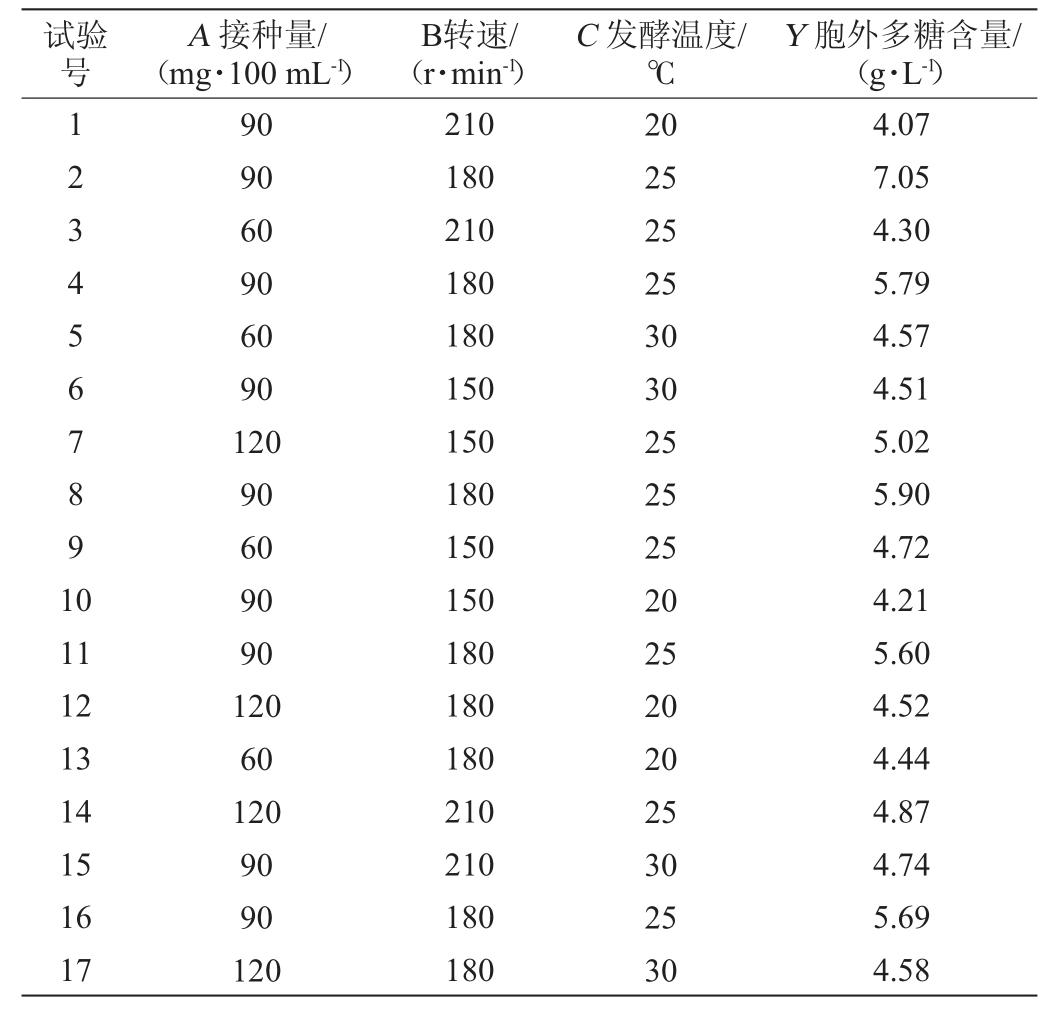
试验号B转速/(r·min-1)A 接种量/(mg·100 mL-1)C 发酵温度/℃Y 胞外多糖含量/(g·L-1)1234567891 0 11 12 13 14 15 16 17 90 90 60 90 60 90 120 90 60 90 90 120 60 120 90 90 120 210 180 210 180 180 150 150 180 150 150 180 180 180 210 210 180 180 20 25 25 25 30 30 25 25 25 20 25 20 20 25 30 25 30 4.07 7.05 4.30 5.79 4.57 4.51 5.02 5.90 4.72 4.21 5.60 4.52 4.44 4.87 4.74 5.69 4.58
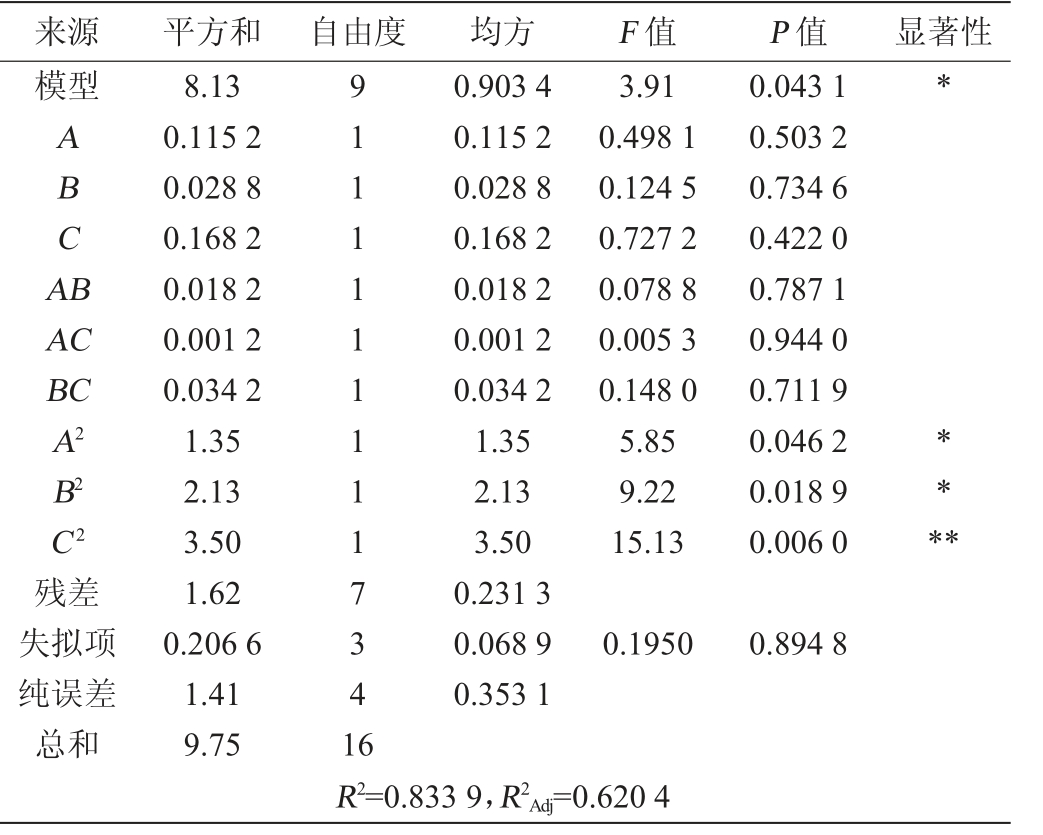
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源平方和 自由度均方F 值P 值显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总和8.13 0.115 2 0.028 8 0.168 2 0.018 2 0.001 2 0.034 2 1.35 2.13 3.50 1.62 0.206 6 1.41 9.75 91111111117341 6 0.903 4 0.115 2 0.028 8 0.168 2 0.018 2 0.001 2 0.034 2 1.35 2.13 3.50 0.231 3 0.068 9 0.353 1 3.91 0.498 1 0.124 5 0.727 2 0.078 8 0.005 3 0.148 0 5.85 9.22 15.13 0.043 1 0.503 2 0.734 6 0.422 0 0.787 1 0.944 0 0.711 9 0.046 2 0.018 9 0.006 0*****0.1950 0.894 8 R2=0.833 9,R2Adj=0.620 4
对表2结果进行多元二次回归拟合,建立的二次回归方程为Y=-44.509 00+0.106 767A+0.260 533B+1.752 00C+0.000075AB-0.000117AC+0.000617BC-0.000630A2-0.000791B2-0.036470C2。
由表3可知,回归模型的F值为3.91,P=0.043 1<0.05,显示该回归模型显著。失拟项P=0.894 8>0.05,显示该回归模型失拟不显著,表明非试验因素的影响小,试验误差小。模型决定系数R2=0.833 9,显示该模型的拟合程度较好,在实际试验中约83.39%的结果可以通过拟合模型进行解释。调整系数R2Adj=0.6204,表明上述方程可以反映接种量、转速、发酵温度与响应值胞外多糖含量的关系。由P值可知,该模型的二次项A2、B2对LS-EPS含量的影响均显著(P<0.05),二次项C2对结果影响极显著(P<0.01)。而该模型的一次项、交互项对LS-EPS含量的影响均不显著(P>0.05)。由F值可知,三因素对LS-EPS含量的影响大小顺序为C>A>B。
2.3.2 不同因素间交互作用分析
响应面及等高线能够直观反映各因素及其交互作用对LS-EPS含量的影响[28],不同因素间交互作用对结果的影响见图6。响应曲面的倾斜度越高,说明自变量对LS-EPS含量的影响越大。等高线越接近椭圆,密度越大,说明两个自变量的交互作用越显著,反之越弱。由图6可知,A(接种量)与B(转速)的交互作用对LS-EPS含量的影响不显著(P>0.05),A(接种量)与C(发酵温度)的交互作用对LS-EPS含量的影响不显著(P>0.05),B(转速)与C(发酵温度)的交互作用对LS-EPS含量的影响不显著(P>0.05)。这与方差分析的结果一致。

图6 各因素间交互作用对胞外多糖含量影响的响应曲面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between various factors on exopolysaccharide contents
2.3.3 模型验证试验
通过回归模型分析得到最佳产糖条件为接种量93.09 mg/100 mL、转速179.02 r/min及发酵温度25.39 ℃,在此最佳优化条件下获得LS-EPS产量的理论预测值为6.02 g/L。结合实际情况,将试验条件修正为接种量90 mg/100 mL、转速180 r/min及发酵温度25 ℃,并在此条件下进行三组验证试验,最终LS-EPS平均产量为6.01 g/L,且与预测值接近。
2.4 LS-EPS的红外光谱
LS-EPS的傅里叶红外光谱结果见图7。由图7可知,波数4 000~500 cm-1范围内有6处明显的信号峰。在3 378.14 cm-1处有一个宽且强烈的信号峰,指定为LS-EPS的-OH伸缩振动峰;2 922.82 cm-1处的信号峰指定为糖环上C-H的伸缩振动峰;1 644.42 cm-1和1 419.83 cm-1的信号峰分别为LS-EPS的C=O非对称伸缩振动峰及C-H面内弯曲振动峰;1 023.68 cm-1处的信号峰归属为LS-EPS的C-O伸缩振动峰;577.82 cm-1处的信号峰归属为LS-EPS的C-H摇摆振动峰[29]。以上信号峰表明LS-EPS具有典型的多糖特征峰,并且含有吡喃糖结构。
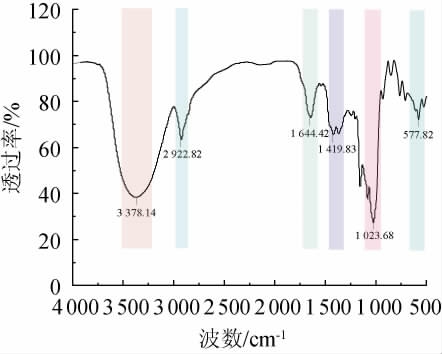
图7 花脸香蘑胞外多糖的傅里叶红外光谱图
Fig.7 Fourier infrared spectra of exopolysaccharides from Lepista sordida
2.5 LS-EPS的体外免疫调节及抗肿瘤活性分析
2.5.1 LS-EPS的免疫调节活性
随着LS-EPS质量浓度的增加,RAW 264.7细胞的数量明显增加,细胞之间的间隙逐渐变小。LS-EPS对巨噬细胞RAW 264.7增殖的影响结果见图8。由图8可知,RAW 264.7细胞的增殖率随着LS-EPS质量浓度的增加而上升,呈现出剂量依赖性增加。与空白组相比,终质量浓度为20 μg/mL的LS-EPS能够显著刺激RAW 264.7细胞增殖(P<0.05),其增殖率最高达到50.16%。ZHANG Y等[30]研究发现,厚质木耳产生的胞外多糖对RAW 264.7细胞无毒性作用,在高浓度的药物刺激下,其细胞活力最高增强了约21%(P<0.05)。韩丽荣等[31]研究发现,灰树花产生的胞外多糖能够极显著地促进RAW 264.7细胞增殖,当药物添加量达到80 μg/mL时,其增殖指数最大为137.5%。结果表明,在质量浓度20 μg/mL的条件下,LS-EPS能够显著刺激RAW 264.7细胞的形态、数量变化,促进其增殖,使细胞呈现出激活状态。
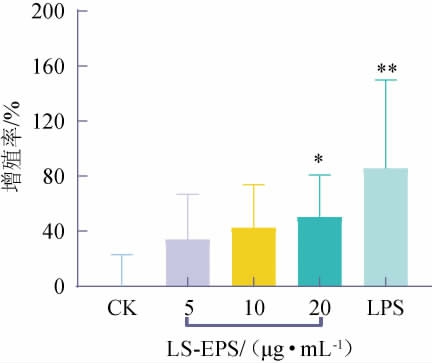
图8 花脸香蘑胞外多糖对巨噬细胞增殖的影响
Fig.8 Effect of exopolysaccharides from Lepista sordida on macrophages proliferation
2.5.2 LS-EPS的抗肿瘤活性
在低浓度的LS-EPS刺激作用下,MFC细胞数量明显减少,并出现细胞间粘附断裂的状况。LS-EPS对胃癌细胞增殖的影响结果见图9。由图9可知,LS-EPS对MFC细胞的增殖具有抑制作用,其抑制率随着LS-EPS浓度的增加而下降,呈现出剂量依赖性减少。与空白组对比,终质量浓度为5 μg/mL的LS-EPS对MFC细胞的生长起到极显著的抑制作用(P<0.01),其抑制率高达53.41%。李璋等[32]研究发现,黑根霉产生的胞外多糖能够抑制MFC细胞增殖,其最高抑制率达到32.22%。结果显示,在低质量浓度5 μg/mL的条件下,LS-EPS能够极显著地抑制胃癌细胞增殖,具有良好的体外抗肿瘤活性。
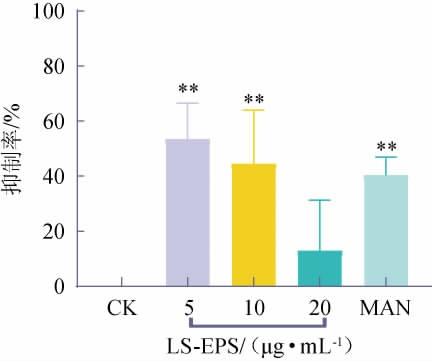
图9 花脸香蘑胞外多糖对胃癌细胞增殖的影响
Fig.9 Effects of exopolysaccharides from Lepista sordida on gastric cancer cells proliferation
3 结论
本研究以野外采集并分离纯化的“花5”菌株为试验材料,结合传统形态学分析和分子生物学技术,鉴定该菌株为花脸香蘑(Lepista sordida),并在单因素试验的基础上通过响应面试验优化“花5”菌株的发酵条件。响应面试验结果显示,LS-EPS的最佳发酵工艺为发酵温度25 ℃,转速180 r/min,接种量90 mg/100 mL。在此条件下,LS-EPS的产量达到6.01 g/L。傅里叶红外光谱显示,LS-EPS具有真菌多糖典型的红外光谱结构特征,并含有吡喃糖结构。体外活性试验结果显示,20 μg/mL的LS-EPS能够促进RAW 264.7细胞增殖,并且没有细胞毒性;5 μg/mL的LS-EPS能够直接抑制MFC细胞的增殖,具有较好的抑瘤作用。本研究优化了花脸香蘑胞外多糖的发酵工艺,为花脸香蘑胞外多糖的工业化生产提供理论基础,具有一定的实际应用价值。另外,初步验证了LS-EPS具有良好的体外活性,表明LS-EPS有望作为一种具有免疫调节、抑瘤作用的多糖食品或药品。
[1]胡欣蕾,田雪梅,李文香,等.花脸香蘑菌丝体多糖提取条件优化及其体外免疫活性[J].食品科学,2017,38(20):185-190.
[2]XU Y Y,LI Y H,LU Y X,et al.Antioxidative and hepatoprotective activities of a novel polysaccharide(LSAP)from Lepista sordida mycelia[J].Food Science and Human Wellness,2021,10:536-544.
[3]SI J,MENG G,WU Y,et al.Medium composition optimization,structural characterization,and antioxidant activity of exopolysaccharides from the medicinal mushroom Ganoderma lingzhi[J].Int J Biol Macromol,2019,124:1186-1196.
[4]LIU G K,LI N,SONG S Y,et al.Three exopolysaccharides from the liquid fermentation of Polyporus umbellatus and their bioactivities[J].Int J Biol Macromol,2019,132:629-640.
[5]ZHAO S, HUANG A S, ZHANG W B, et al.Screening and identifying natural products with SARS-CoV-2 infection inhibitory activity from medicinal fungi[J].Biosaf Health,2024,6(1):12-20.
[6]ZHOU A D, CHENG H Y, LIU H H, et al.Neuroprotection of lowmolecular-weight galactan obtained from Cantharellus cibarius Fr.against Alzheimer's disease[J].Carbohydr Polym,2023,316:121033.
[7]杜萍,何双辉,钱玺,等.落叶松锈迷孔菌产多糖液体培养基的优化及其体外抗氧化活性[J].菌物学报,2019,38(6):951-969.
[8]彭期定,梅小飞,徐茹玉,等.木蹄层孔菌胞外多糖的深层培养工艺优化及体外抗氧化研究[J].食品科技,2017,42(3):26-31.
[9]杨彬.银耳发酵条件优化、胞外多糖分离纯化及其体外抗氧化研究[D].广州:广东药科大学,2021.
[10]魏宝红,刘佳,毕旺华,等.药用真菌桑黄的液态发酵工艺优化及体外抗肿瘤活性研究[J].生物化工,2023,9(4):19-25.
[11]刘法显,于长青,姚笛,等.花脸香蘑菌丝体发酵条件的优化[J].食品研究与开发,2016,37(22):169-172.
[12]张秀伟,鲍菊,蔡甫格,等.4个贵州野生花脸香蘑菌株的菌丝体生物学特性研究[J].食药用菌,2023,31(3):182-186.
[13]赵辉,李彪,徐建俊,等.花脸香蘑栽培可行性分析研究[J].农业科学,2018(6):12-14.
[14]叶树才,侯银臣,杨盛茹,等.长根菇液体深层发酵制备多糖条件优化及体外抗氧化活性研究[J].食品安全质量检测学报,2023,14(3):58-67.
[15]GUO J,LIU Y F,TANG C H,et al.The key technologies of Ganoderma lucidum liquid spawn preparation and scale expansion[J].World J Microbiol Biotechnol,2023,39(6):138.
[16]孟玲,王丽华,王兰英,等.花脸香蘑菌丝体发酵条件的研究[J].食品研究与开发,2011,32(6):121-125.
[17]罗倩,王莹,张林,等.贵州花脸香蘑HL-07液体发酵条件优化研究[J].种子,2015,34(5):88-91.
[18]刘法显.花脸香蘑液体发酵及其多糖的提取和免疫活性初步研究[D].大庆:黑龙江八一农垦大学,2017.
[19]胡先运,江家志.花脸香蘑菌丝体液体发酵研究[J].食品研究与开发,2016,37(15):193-196.
[20]胡欣蕾.固体发酵与液体发酵花脸香蘑多糖提取及活性的研究[D].青岛:青岛农业大学,2017.
[21]吴思伟,李思雨,孙寒,等.一株产胞外多糖微藻的分离鉴定及其多糖抗氧化活性的研究[J].食品与发酵工业,2021,47(24):193-200.
[22]LI Y M, GUO X X, ZHONG R F, et al.Structure characterization and biological activities evaluation of two hetero-polysaccharides from Lepista nuda:Cell antioxidant,anticancer and immune-modulatory activities[J].Int J Biol Macromol,2023,244:125204.
[23]卯晓岚.中国大型真菌[M].郑州:河南科学技术出版社,2000:1-220.
[24]李玉,李泰辉,杨祝良,等.中国大型菌物资源图鉴[M].郑州:中原农民出版社,2015:1-1400.
[25]杨英歌,李荣,宋凯,等.灵芝-黄芪药渣固体双向发酵工艺优化及菌质多糖对肠癌HCT116的抑制作用研究[J].中国食品添加剂,2023,34(11):110-118.
[26]唐睿,林俊芳,郭丽琼,等.银耳芽孢多糖发酵培养基配方、发酵条件的优化及其放大发酵试验[J].食品工业科技,2021,42(20):173-182.
[27]唐少军,雷平,杨祎,等.槐耳WH5的分离鉴定及其液体发酵工艺优化[J].农业生物技术学报,2022,30(11):2236-2245.
[28]PRAJAPATI D,BHATT A,GUPTE A.Production,optimization,partialpurification and pyrolysis kinetic studies of exopolysaccharide from a native brown-rot fungi Fomitopsis meliae AGDP-2[J].Bioresource Technol,2022,17:100948.
[29]TANG Y Y,ZHOU M Y,MAO Z A,et al.Structure of a polysaccharide MDP2-1 from Melastoma dodecandrum Lour.and its anti-inflammatory effects[J].Int J Biol Macromol,2024,265:131015.
[30]ZHANG Y,ZENG Y,MEN Y,et al.Structural characterization and immunomodulatory activity of exopolysaccharides from submerged culture of Auricularia auricula-judae[J].Int J Biol Macromol,2018,115:978-984.
[31]韩丽荣,程代,孟梦,等.灰树花胞外多糖的分离纯化及免疫调节作用[J].天津科技大学学报,2016,31(4):25-29.
[32]李璋,许晅,孟迎,等.不同相对分子质量的黑根霉胞外多糖的生物活性[J].南方医科大学学报,2021,41(10):1540-1546.