微生物在能源、环境卫生、肠道健康、医药、食品研发等领域发挥着重要的作用[1]。早期的研究主要集中在微生物菌株的分离、培养、纯化及改造等方面[2],然而微生物并非单独存在,它们在复杂的群落中相互作用并相互交流,互相影响彼此的行为,从而维持群落的稳定,实现微生物群落的代谢功能,推动微生物群落的进化[3]。
近年来,单一功能菌株发酵的方法已不能满足人们对发酵食品风味的要求,随着食品发酵技术的不断进步,合理利用多种功能微生物来构建稳定高效的合成微生物群落,已经成为发酵食品领域中一个研究热点。1905年,柯赫创造出了固体培养基进行纯种培养微生物之后,单一纯种培养技术得到迅速发展,随后逐渐转向更复杂的微生物群落,WOLFE B E等[4]通过建立一种可处理的干酪皮微生物群落,以确定影响微生物群落组装和功能的机制。贾云[5]通过“自下而上”的方式对传统高盐蚕豆酱的微生物群落结构和功能进行了体外重构,实现了蚕豆酱的低盐发酵。合成微生物群落是由多种遗传背景清晰的微生物构成的人工系统,具有复杂度低、可控性高、稳定性强等优势。发酵是保存食物最古老的方法之一,中国传统发酵食品的发酵是一个典型的涉及多种微生物参与的动态且复杂的过程,构建出功能稳定且高效的发酵微生物对于提高发酵食品的风味品质有重大意义。本文阐述了合成微生物群落的概念、构建原则及构建方法,并且总结概括其近几年在发酵食品的应用,旨在为合成微生物群落在发酵食品领域的工业化生产提供理论参考,揭示核心微生物菌群的组成并构建合成微生物群落,可在发酵食品中实现从天然发酵到可控发酵转化,对发酵食品生产和品质提升具有重要意义。
1 合成微生物群落的概述
合成微生物群落亦称人工合成菌群,是利用人工手段将多种已知遗传背景的微生物在特定条件下共培养成一个可控的微生物群落[6],合成微生物群落的形成方式见图1。合成微生物群落涉及诸多研究领域,其最终目的是通过菌群的相互作用来建立种群间的代谢网络[7],从而实现特定的功能。相对于自然微生物群落,合成微生物群落有诸多优势:①自然界微生物群落的生态学高度复杂,在自然生态系统中开展可重复、可控的扰动实验具有挑战性,在实验室中构建的合成微生物群落具有高度的可控性,帮助解决人类健康和生产中的重要问题;②合成生物群落具有更强的功能稳定性,对发酵过程中面临的干扰因素具有更强的适应力;③群落中的不同微生物通过相互作用实现功能互补,完成复杂且多样的代谢任务,实现代谢功能的放大;④合成微生物群落可以将复杂的代谢过程逐步分解为多个步骤,不同微生物执行不同的代谢功能,从而降低细胞的代谢负担[8];⑤合成微生物群落中微生物物种较少,背景较为清晰,可以将其作为复杂生态系统和数学建模之间的桥梁,结合定量模型和测序技术,系统地研究微生物种群之间的相互作用并预测微生物群落的动态,利于进一步开发和优化更复杂、系统的模型[9]。
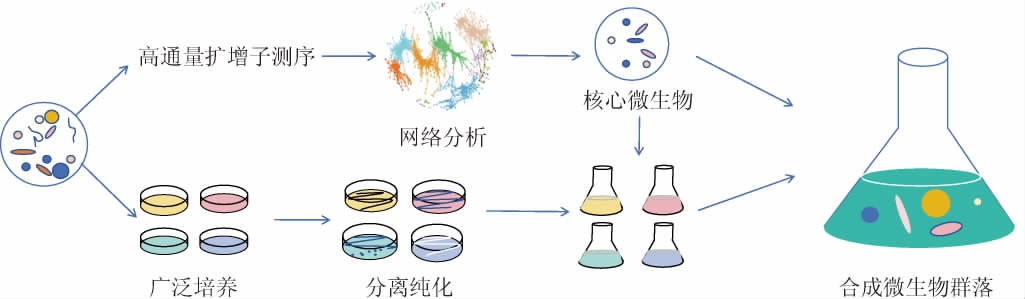
图1 合成微生物群落的形成方式
Fig.1 Formation mode of synthetic microbial community
2 合成微生物群落的构建
2.1 构建原则
人工合成微生物群落在构建时主要考虑两点:①是微生物间的相互作用;②是合成微生物群落的空间协调。微生物之间的相互作用无处不在,根据菌群相互作用的利弊关系,可以分为偏利共生、偏害共生、合作、竞争、寄生、中立6种相互作用关系[10],不同的相互作用情况见图2。

图2 微生物间相互作用模式
Fig.2 Interactive model between microorganisms
菌种间存在复杂的相互作用,使得合成微生物群落的构建需要综合考虑菌的功能及生长环境等多方面的影响,而非随机将多种微生物进行混合[11]。微生物通常通过两种主要机制进行相互作用,即基于接触的相互作用,如微生物之间通过细胞-细胞的接触发生的生物分子和电子的交换;不依赖于接触的相互作用,如微生物之间通过可扩散的化学物质和物理接触进行的代谢物和信息信号的交换。合理利用微生物间的相互作用,从空间结构上协调好散落分布的不同菌落,实现局部的相互作用,产生理想的代谢效果,对于合成微生物群落的构建具有重大意义。
2.1.1 微生物之间不依赖于接触的相互作用
各种各样的微生物,都能够通过某些小分子相互交流,使微生物间许多不同的小分子相互作用,其中最常见的交流方式是基于群感效应的专有信号分子的传递,群落中的微生物产生和分泌小的信号分子,随着细胞群的增长,这些小分子在局部积聚到一定浓度会使微生物基因的表达改变,基因的表达改变细胞的生理和形态。群感效应机制影响和控制微生物的许多生理行为,包括生物发光、脱氧核糖核酸(deoxyribonucleic acid,DNA)的水平转移、生物膜的形成、产孢子、毒力因子的产生、葡萄糖的摄取、抗生素的产生、新核苷酸的生物合成和次生代谢物的产生等[12]。通过抑制或降解这些群感效应信号分子是对抗病原微生物和干扰参与微生物相互作用的基因表达的一种很有前途的策略[13]。ZHANG Y H等[14]通过代谢组学鉴定出了丙氨酰亮氨酸为云南三川火腿中粪肠球菌合成生物胺的群体感应信号分子,为火腿中生物胺含量的控制提供了参考。除群感效应信号分子外,微生物还利用大量不同的代谢物来进行相互作用,包括小分子(如氢、甲烷、甲酸、乳酸、硫化物、二氧化碳和吲哚等)和大分子(如水解酶、蛋白酶等)[15]。微生物间可以通过交换代谢物质,让不同的微生物承担不同的代谢功能,从而实现微生物的分工合作。代谢分工合作由不同微生物将代谢活动分工合作完成,既减轻单菌种的代谢负担,同时也大大提高微生物群落的可操控性,方便研究人员对微生物群落进行人工改造[16]。早期的研究将S型大肠杆菌和L型大肠杆菌培养在含葡萄糖的培养基上,研究发现其中L型大肠杆菌在竞争葡萄糖方面具有优势,但其分泌的代谢物会促进S型大肠杆菌的生长[17]。因此,这种代谢物交换介导的微生物相互作用有助于维持天然微生物群落的多样性和稳定性,维持微生物的生存能力。
2.1.2 微生物之间依赖于接触的相互作用
微生物细胞在物种内部和物种之间广泛地相互作用,这些相互作用除依赖于扩散因子的相互作用还有依赖于细胞间直接接触的相互作用。最近的研究表明,基于直接接触的种间电子转移在甲烷生成中也起着至关重要的作用[18],MINTY J J等[19]研究表明,在一种可以将乙醇转化为甲烷的金属还原菌和甲烷菌的共培养体系中,一种产生异丁醇的工程大肠杆菌金属还原变形菌氧化乙醇,并通过其导电纤毛直接将电子传递给里氏木霉(Trichoderma reesei),里氏木霉反过来接受电子并将二氧化碳还原为甲烷。微生物细胞之间基于直接接触的相互作用也可用于将大分子从供体细胞递送到受体细胞。FURUKAWA S等[20]研究发现,福山壶食醋中的植物乳植杆菌(Lactiplantibacillus plantarum)ML11-11和酿酒酵母(Saccharomyces cerevisiae)通过细胞间的直接接触形成了一个混合菌种的生物膜,产生的无氧环境利于乳酸菌和酵母菌的生长繁殖。也有研究表明[21],细菌也可使用细胞间纳米管来连接邻近细胞,介导细胞间的通讯纳米管可以作为交换细胞质分子的途径,赋予受体细胞不可遗传或可遗传的特性。细胞之间的依赖于接触的相互作用在微生物中广泛存在,可以利用它们之间积极地影响,从而提高总体种群的适应力和稳定性。
2.1.3 基于微生物空间协调的作用机制
自然界中的许多微生物存在于特定的空间结构中,例如表面附着的生物膜,细胞的空间分类创造具有不同可用资源的细胞亚群,从而加强局部相互作用,提高对环境的适应能力[22]。JIANG X等[23]研究发现,土壤中的枯草芽孢杆菌(Bacillus subtilis)会消耗氧气,抑制印度梨形孢菌(Serendipita indica)的生长,将他们分开一定距离,或是在接种印度梨形孢菌后让其萌发一段时间后再与枯草芽孢杆菌共培养,二者才能达到最大生长。MARDANOV A V等[24]研究发现,利用聚合酵母生产雪利酒,细胞聚集产生二氧化碳,形成由酵母和乳酸菌组成的漂浮生物膜,细胞暴露在氧气中,发酵代谢转变为呼吸代谢,导致雪利酒产生如乙醛及其衍生物等特有的挥发性风味物质。人们通过组织物理环境、设计特定的群落结构或设计具有程序化聚集行为的细胞来构建空间定义的微生物群落。微流控和微孔装置已经被用于构建微生物群落,其中单个物种在分离的室中生长,允许代谢物自由交换,但限制细胞之间的物理接触;使用微接触印刷技术的可以使特定微生物以定义的几何图案排列在二维表面上[25],此外,3D打印技术使构建具有更复杂结构的微生物群落成为可能。
2.2 构建方法
微生物群落对人类和动物健康以及农业的发展至关重要,微生物群落已经开始被认为是有前途的生物催化剂,可以用生物基材料取代石化产品[26]。以微生物群落为基础的生物催化剂相对于单一微生物培养的优势日益突出,包括劳动分工、空间组织和对扰动的鲁棒性[27]。然而,需要注意的是微生物群落带来额外的生物复杂性,因此通过自上而下和自下而上的微生物群落构建方法可以更好地理解和设计这种复杂的生物催化剂,并利用它们来开发生物技术。
2.2.1 自上而下
自上而下的微生物群落的构建是基于全基因组组学研究和分子相互作用,需要事先了解群落的功能,通过一定数量的环境变量,合理的计算方法,预测生态系统中微生物群落的动态变化、演替和结构等,从而成功地设计出优质的合成微生物群落。在这种方法中,生物技术中使用的“天然”微生物群落引起人们的兴趣,因为它们是在相对明确的条件下将目标物质的生产或降解作为性能的客观衡量标准。VON CANSTEIN H等[28]将降除汞作为群落功能,并构建具有不同多样性水平的群落,发现随着多样性的增加,功能效率有所提高。GAO J等[29]为提高浓香型白酒上层发酵液中的酯含量,采用自上而下的方法富集产生己酸酯的细菌并使用电镀筛选消除产生异味化合物的细菌,为提升发酵食品中的风味化合物提供了一种新的策略。定义群落功能方法不仅有助于研究群落多样性、功能和稳定性等关键特性之间的关系,而且有助于对群落结构进行机制理解。
2.2.2 自下而上
合成微生物群落的构建方法中,自下而上是基准。在这种自下而上的方法中,强调的是微生物之间共同的相互作用,以微生物群落代谢网络及其产物为核心,通过控制生物类型和组成群落成员的初始丰度来研究复杂性降低的组合,基于微生物群落的代谢特征或社会特征,运用自动化代谢网络设计软件和代谢反应模型重建特定微生物群落的代谢网络,并模拟其稳定性。WANG Y等[30]基于转录组学比较分析,筛选出了工程酿酒酵母(Saccharomyces cerevisiae)VCT2,构建了“生酮基古龙酸杆菌(Ketogulonicigenium vulgare)-工程酿酒酵母VTC2”联合体,高效合成2-酮基-L-古龙酸(2-keto-L-gulonic acid,2-KLG)。酿酒酵母VTC2的上调基因主要参与糖酵解、三羧酸(tricarboxylic acid,TCA)循环、嘌呤代谢、氨基酸、B族维生素和抗氧化蛋白酶的生物合成,促进生酮基古龙酸杆菌生长,同时,酿酒酵母VTC2产生的维生素C可以进一步缓解环境中的氧化应激,增加2-KLG的产生,与单培养生酮基古龙酸杆菌相比,2-KLG的积累量增加了1.49倍。自下而上的合成微生物群落的构建方法是优化处理复杂生物过程的生物技术应用的一种强大策略,优化非线性生物合成途径时也非常有效。
3 合成微生物群落在发酵食品中的应用
随着科技的进步和对菌种研究的不断深入,合成微生物群落在应用在不断扩展,食品发酵中的参与的微生物群落体系总结见表1。合理利用微生物间的相互作用,将理论与生物技术相结合,构建出稳定高效的微生物群落,对于提高包括面包、馒头、食醋、酱油、米酒、豆瓣酱和酸奶在内的发酵食品的品质和产量具有重大意义。
表1 发酵食品中微生物群落体系
Table 1 Microbial community systems in fermented foods

产品原料共培养体系参考文献酸奶牛乳[31]发酵香肠猪肉[32]酸鱼鱼肉[33]面包面粉、食盐、糖和水[34]馒头面粉和水乳酒假丝酵母(Candida kefyr),乳酸乳球菌(Lactobacillus lactis)戊糖片球菌(Pediococcus pentosaceus),沙克乳酸杆菌(Lactobacillus sakei)木糖葡萄球菌(Staphylococcus xylosus),肉葡萄球菌(Staphylococcus carnosus),汉斯德巴氏酵母菌(Dabaryomyces hansenula)植物乳杆菌(Lactobacillus plantarum),木糖葡萄球菌(Staphylococcus xylosus),酿酒酵母(Saccharomyces cerevisiae),戊糖片球菌(Pediococcus pentosaceus)酿酒酵母(Saccharomyces cerevisiae),植物乳杆菌(Lactobacillus plantarum)酿酒酵母(Saccharomyces cerevisiae),约氏乳杆菌(Lactobacillus johnsonii),巴氏醋酸杆菌(Acetobacter pasteurianus)[35]
续表

产品原料共培养体系参考文献益生菌饮料谷类[36]葡萄酒葡萄酒[37]米酒糯米[38]康普茶茶和蔗糖[39]酵素水果和蔬菜[40]酸菜青菜或白菜[41]酱油大豆、小麦或麸皮、食盐和水[42]食醋大米或高粱[43]豆瓣酱黄豆、辣椒、香油和食盐[44]腐乳黄豆、米酒、食盐和糖植物乳杆菌(Lactobacillus plantarum),嗜酸乳杆菌(Lactobacillus acidophilus)酿酒酵母(Saccharomyces cerevisiae),嗜果性非酵母菌属酵母(Starmerella bacillaris)华根霉(Rhizopus chinonsis),黑曲霉(Aspergillus niger),总状毛霉(Mucor racemosus),酿酒酵母(Saccharomyces cerevisiae)接合酵母属(Zygosaccharomyces),酒香酵母属(Brettanomyces),酵母属(Saccharomyces),驹形杆菌属(Komagataeibacter),葡糖醋杆菌属(Gluconacetobaceter),葡糖杆菌属(Gluconobacter),乳杆菌属(Lactobacillus)酵母属(Saccharomyces),植物乳杆菌(Lactobacillus plantarum),干酪乳杆菌(Lactobacillus casei)假单胞菌属(Pseudomonas),植物乳杆菌(Lactobacillus plantarum),弯曲广布乳杆菌(Lactobacillus curvatus)嗜盐四联球菌(Tetragenococcus halophilus),鲁氏接合酵母(Zygosaccharomyces rouxii),假丝酵母菌属(Candida)植物乳植杆菌(Lactiplantibacillus plantarum),酿酒酵母(Saccharomyces cerevisiae)米曲霉(Aspergillus oryzae),地衣芽孢杆菌(Bacillus licheniformis),解淀粉芽孢杆菌(Bacillus amyloliquefaciens),嗜盐四联球菌(Tetragenococcus halophilus),鲁氏接合酵母(Zygosaccharomyces rouxii)毛霉菌(Mucor flavus),卷枝毛霉(Mucor circinelloides)[45]
3.1 馒头和面包
馒头和面包通常以小麦粉为原料、使用酸面团或酵母作为发酵剂制成。与传统的酸面团相比,用商业干酵母制成的食品味道平淡,香气差,整体感官质量低。传统酸面团发酵微生物菌群复杂,易受内源性或外源性因素的影响导致产品质量在批次之间不稳定。FEKRI A等[34]筛选出具有植酸降解能力的优良菌株制作全麦面包,酵母菌和乳酸菌发挥协同作用,使发酵产品具有良好的质地和风味,过程中口感更加醇厚细腻,产品的蛋白质质量和矿物质利用方面得到提高。SHEN J等[35]从传统中式酸面团中分离出酿酒酵母(Saccharomyces cerevisiae)、约氏乳杆菌(Lactobacillus johnsonii)和巴氏醋杆菌(Acetobacter pasteurianus),利用这些菌株混合生产复合发酵剂,发酵制得的全麦馒头的体积增加了12.8%,风味得到改善;此外,复合发酵剂发酵制得的全麦馒头在硬度、咀嚼性和弹性方面均有改善,这对提高全麦馒头的品质有着重要的意义。
3.2 食醋类
醋是一种受欢迎的消费品,距今已有上千年的酿造历史,含有多酚、黄酮、有机酸和维生素等多种健康有益成分[46]。通过对醋中微生物群落深入研究,利用合成多功能菌群来改善食醋中的风味物质已经取得突破,已有报道揭示乳酸菌是醋发酵中重要的发酵菌株,具有较高的丰度和活性。LI Y N等[43]综合研究中国固态发酵谷物醋的微生物群落,并从中国传统谷物醋的酒精发酵阶段分离出植物乳杆菌,将植物乳杆菌和酿酒酵母协同发酵苹果醋。结果表明,使用酿酒酵母和植物乳杆菌的混合培养物对苹果汁进行酒精发酵可以显著改善最终醋的风味和质量,提高醋酸产量和挥发性风味物质的含量,使苹果醋具有更高的果香香气强度,以及更浓郁的鲜味和甜味。
3.3 酱油类
酱油是一种发酵的大豆调味品,固态发酵和醪液发酵是酱油酿造的两个重要基础阶段[47],米曲霉(Aspergillus oryzae)在曲的制作过程中起主导作用,然而单一米曲霉制曲时对所需原料要求相对简单,对微生物的生长所需的参数易控制,但其代谢产物的种类和含量不丰富,导致产品的风味物质不足。研究表明,酱油中与风味形成相关的活性乳酸菌主要有嗜盐四联球菌(Tetragenococcus halophilus)、植物乳杆菌和魏斯氏菌属(Weissella sp.)[48]。乳酸菌和酵母在混合发酵过程中可以相互作用,产生更复杂的香气,有利于提高酱油的风味品质。CUI R Y等[42]研究发现,嗜盐四联球菌、鲁氏接合酵母(Zygosaccharomyces rouxii)和皱状假丝酵母(Candida versatilis)混合制曲,使酱油中挥发性成分的含量提高了216.88%。这对酱油发酵工艺的优化有潜在的贡献,为酱油的工业化生产提供良好借鉴。
3.4 酒类
酒是一种具有新鲜风味的食品,葡萄酒是利用葡萄通过自然发酵将还原糖完全转化为乙醇等代谢物质的果酒,米酒通常由大米与麦曲和酿酒酵母发酵而成。在国内通常会选用商业化的高活性干酵母发酵剂快速启动葡萄酒的酒精发酵,会导致葡萄酒风味不足从而缺乏市场竞争力[49]。邢鑫[50]将戴尔有孢圆酵母(Torulaspora delbrueckii)和酿酒酵母混合发酵蛇龙珠葡萄酒,混菌发酵对蛇龙珠葡萄酒具有增香酿造的应用潜力,且混菌发酵影响酵母的基因表达,使蛇龙珠葡萄酒的香气更加丰富。在米酒的酿造过程中,淀粉糖化和酒精生产是同时进行的,即同时糖化发酵,麦曲的不稳定性不利于优质米酒的生产,也会制约米酒的产业化,随着米酒市场的扩大,如何生产出更高风味的米酒已成为研究热点。LIU S等[51]以华根霉(Rhizopus chinonsis)、黑曲霉(Aspergillus niger)、毛霉菌(Mucor)和酿酒酵母为研究对象,利用这几种菌混菌发酵米酒,结果发现混菌发酵的米酒的感官特性最佳,乙醇、氨基酸氮、鲜味和甜味游离氨基酸的含量均高于以小麦曲发酵的米酒,霉菌和酵母等混合发酵能生产出风味和发酵性能都达到高质量标准的米酒。
3.5 豆瓣酱类
豆瓣酱是以大豆和面粉为主要原料,经霉菌、酵母、乳酸菌等多种微生物共同发酵而成的半固态调味品。AN F Y等[52]应用超转录组测序、顶空固相微萃取、气相色谱-质谱联用和氨基酸分析仪发现,影响豆瓣酱色度和风味的核心微生物属为四联球菌属(Tetragenococcus)和乳杆菌属(Lactobacillus)。有研究表明,在固态发酵阶段,米曲霉、地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和枯草芽孢杆菌(Bacillus subtilis)协同发酵,可以分泌高活性的蛋白酶、淀粉酶等酶,在发酵初期帮助降解原料,水解蛋白质和多糖,增加发酵系统中游离氨基酸、还原糖等小分子营养物质的含量,嗜盐四联球菌、鲁氏接合酵母和马铃薯念珠菌(Candida solani)作用于醪液发酵阶段,会产生大量的醇类和芳香化合物,最终形成豆瓣酱的多感官风味[44]。
3.6 酸奶类
酸奶是发酵乳中最常见的一种,常用保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜热链球菌(Streptococcus thermophilus)作为发酵剂。益生菌具有调节肠道代谢、抗衰老、降胆固醇等有益功能,使用多菌种益生菌生产的发酵乳比使用单菌种益生菌生产的发酵乳具有更好的质地和营养。研究表明,在酸奶发酵剂中加入干酪乳杆菌混合发酵可以提高酸奶的营养价值和感官特性,加入干酪乳杆菌(Lactobacillus casei)发酵的酸奶,酸奶中总酚和类黄酮含量均有所提高,干酪乳杆菌可以促进乳双歧杆菌(Bifidobacterium lactis)V9的生长,分泌更多的短链脂肪酸[53],因此,干酪乳杆菌与其他益生菌共培养可能具有提高益生菌效益和改善酸奶品质的潜力,为开发风味独特、益生菌含量高、抗氧化能力强的酸奶提供指导。
3.7 其他
合成微生物组在发酵香肠、谷物饮料、人造肉等食品中也有应用。WANG J等[54]通过将木糖葡萄球菌(Staphylococcus xylosus)和植物乳杆菌(Lactobacillus plantarum)MSZ2接种于发酵香肠中,发现通过接种木糖葡萄球菌和植物乳杆菌可以有效抑制发酵香肠的有害细菌,游离脂肪酸含量得到增加,从而改善发酵香肠的风味。FERREIRA I等[55]将益生菌酵母和乳酸菌的混合发酵谷类,配制可口谷物饮料。OUMJ等[56]将大豆蛋白与3株胶红酵母菌(Rhodotorula mucilaginosa)、植物乳杆菌和红曲霉菌(Monascus purpureus Went)混合发酵,发现在正常的发酵过程中,胶红酵母菌、植物乳杆菌和红曲霉菌可以共存,并且植物乳杆菌还可以促进粘胶单胞菌的生长,最终研制出的发酵产物可以在一定程度上模仿肉类的色泽、质地和风味,从而为植物性人造肉的发展带来新的思路。
4 小结
合成微生物群落具有可控性高、操作简单、遗传性能稳定等优点,已成为发酵食品领域的研究热点。现阶段想要生产出口感更好、营养更高和贮藏时间更长的发酵食品,需要了解参与发酵过程的各种微生物,通过调节发酵条件和强化菌种功能,从而实现合成微生物群落的代谢目标。与天然微生物群落相比,合成微生物群落多样性较低,导致合成微生物群落发酵的代谢产物多样性受到限制,在未来的研究中,需要研究微生物多样性在发酵过程中对代谢能力的影响,可以结合宏基因组学、转录组学、蛋白质组学和代谢组学进行分析,提高合成微生物组的微生物多样性且避免功能冗余和不良化合物的产生,构建出高效、稳定的食品发酵的微生物群落,以安全、可再生和经济高效的方式推动我国发酵食品的进步。
[1]THOMPSON L R,SANDERS J G,MCDONALD D,et al.A communal catalogue reveals Earth's multiscale microbial diversity[J].Nature,2017,551:457-463.
[2]BARTLEY B A,KIM K,MEDLEY J K,et al.Synthetic biology:engineering living systems from biophysical principles[J].Biophys J,2017,112(6):1050-1058.
[3]WIDDER S,ALLEN R J,PFEIFFER T,et al.Challenges in microbial ecology:building predictive understanding of community function and dynamics[J].ISME J,2016,10(11):2557-2568.
[4]WOLFE B E, BUTTON J E, SANTARELLI M, et al.Cheese rind communities provide tractable systems for in situ and in vitro studies of microbial diversity[J].Cell,2014,158(2):422-433.
[5]贾云.蚕豆酱发酵过程微生物群落结构及其功能分析[D].无锡:江南大学,2021.
[6]DE ROY K,MARZORATI M,VAN DEN ABBEELE P,et al.Synthetic microbial ecosystems:an exciting tool to understand and apply microbial communities[J].Environ Microbiol,2014,16(6):1472-1481.
[7]DOLINŠEK J,GOLDSCHMIDT F,JOHNSON D R.Synthetic microbial ecology and the dynamic interplay between microbial genotypes[J].FEMS Microbiol Rev,2016,40(6):961-979.
[8]DI S H, YANG A D.Analysis of productivity and stability of synthetic microbial communities[J].J R Soc Interface,2019,16(150):20180859.
[9]PEREZ-GARCIA O,LEAR G,SINGHAL N.Metabolic network modeling of microbial interactions in natural and engineered environmental systems[J].Front Microbiol,2016,36(7):673.
[10]曲泽鹏,陈沫先,曹朝辉,等.合成微生物群落研究进展[J].合成生物学,2020,1(6):621-634.
[11]张小龙,王嘉瑞,李青卓,等.合成微生物群落及在发酵食品中应用研究进展[J].中国酿造,2021,40(3):17-21.
[12]WHITELEY M,DIGGLE S P,GREENBERG E P.Corrigendum:Progress in and promise of bacterial quorum sensing research[J].Nature, 2017,551:313-320.
[13]AMARA N,KROM B P,KAUFMANN G F,et al.Macromolecular inhibition of quorum sensing:enzymes,antibodies,and beyond[J].Chem Rev,2011,111(1):195-208.
[14]ZHANG Y H,SHAN B,GONG J S,et al.Mechanism of biogenic amine synthesis of Enterococcus faecium isolated from Sanchun ham[J].Food Sci Nutr,2022,10(6):2036-2049.
[15]PHELAN V V,LIU W T,POGLIANO K,et al.Microbial metabolic exchange--the chemotype-to-phenotype link[J].Nat Chem Biol,2011,8(1):26-35.
[16]TSOI R,DAI Z J,YOU L C.Emerging strategies for engineering microbial communities[J].Biotechnol Adv,2019,37(6):107372.
[17]ROZEN D E, SCHNEIDER D, LENSKI R E.Long-term experimental evolution in Escherichia coli.XIII.Phylogenetic history of a balanced polymorphism[J].J Mol Evol,2005,61(2):171-180.
[18]MALVANKAR N S,LOVLEY D R.Microbial nanowires for bioenergy applications[J].Curr Opin Biotechnol,2014,27(12):88-95.
[19]MINTY J J,SINGER M E,SCHOLZ S A,et al.Design and characterization of synthetic fungal-bacterial consortia for direct production of isobutanol from cellulosic biomass[J].Proc Natl Acad Sci,2013,110(36):14592-14597.
[20]FURUKAWA S, WATANABE T, TOYAMA H, MORINAGA Y.Significance of microbial symbiotic coexistence in traditional fermentation[J].J Biosci Bioeng,2013,116(5):533-539.
[21]DUBEY G P,BEN-YEHUDA S.Intercellular nanotubes mediate bacterial communication[J].Cell,2011,144(4):590-600.
[22]JOHNS N I, BLAZEJEWSKI T, GOMES A L, et al.Principles for designing synthetic microbial communities[J].Curr Opin Microbiol,2016,31(7):146-153.
[23]JIANG X,ZERFASS C,FENG S,et al.Impact of spatial organization on a novel auxotrophic interaction among soil microbes[J].ISME J,2018,12(6):1443-1456.
[24]MARDANOV A V,GRUZDEV E V,BELETSKY A V,et al.Microbial communities of flor velums and the genetic stability of flor yeasts used for a long time for the industrial production of sherry-like wines[J].Fermentation,2023,9(4):367.
[25]WEIBEL D B, DILUZIO W R, WHITESIDES G M.Microfabrication meets microbiology[J].Nat Rev Microbiol,2007,5(3):209-218.
[26]SGOBBA E,WENDISCH V F.Synthetic microbial consortia for small molecule production[J].Curr Opin Biotechnol,2020,62(5):72-79.
[27]RAFIEENIA R,ATKINSON E,LEDESMA-AMARO R.Division of labor for substrate utilization in natural and synthetic microbial communities[J].Curr Opin Biotechnol,2022,75:102706.
[28]VON CANSTEIN H,KELLY S,LI Y,et al.Species diversity improves the efficiency of mercury-reducing biofilms under changing environmental conditions[J].Appl Environ Microbiol,2002,68(6):2829-2837.
[29]GAO J,QIN J,YE F,et al.Constructing simplified microbial consortia to improve the key flavour compounds during strong aroma-type Baijiu fermentation[J].Int J Food Microbiol,2022,369(2):109594.
[30]WANG Y,LI H C,LIU Y,et al.Construction of synthetic microbial consortia for 2-keto-L-gulonic acid biosynthesis[J].Synth Syst Biotechnol,2022,7(1):481-489.
[31]SHORI A B,ALJOHANI G S,AL-ZAHRANI A J,et al.Viability of probiotics and antioxidant activity of cashew milk-based yogurt fermented with selected strains of probiotic Lactobacillus spp.[J].LWT-Food Sci Technol,2022,153(7):112482.
[32]WANG X H,REN H Y,WANG W,et al.Effects of inoculation of commercial starter cultures on the quality and histamine accumulation in fermented sausages[J].J Food Sci,2015,80(2):M377-M383.
[33]ZENG X F,XIA W S,JIANG Q X,et al.Effect of autochthonous starter cultures on microbiological and physico-chemical characteristics of Suan yu,a traditional Chinese low salt fermented fish[J].Food Control,2013,33(2):344-351.
[34]FEKRI A,TORBATI M,KHOSROWSHAHI A Y,et al.Functional effects of phytate-degrading,probiotic lactic acid bacteria and yeast strains isolated from Iranian traditional sourdough on the technological and nutritional properties of whole wheat bread[J].Food Chem,2020,306(10):125620.
[35]SHEN J,SHI K X,DONG H,et al.Screening of sourdough starter strains andimprovementsinthequalityofwholewheatsteamedbread[J].Molecules,2022,27(11):3510.
[36]RATHORE S, SALMERÓN I, PANDIELLA S S.Production of potentially probiotic beverages using single and mixed cereal substrates fermented with lactic acid bacteria cultures[J].Food Microbiol,2012,30(1):239-244.
[37]TOFALO R, PATRIGNANI F, LANCIOTTI R, et al.Aroma profile of Montepulciano d'Abruzzo wine fermented by single and co-culture starters of autochthonous Saccharomyces and non-saccharomyces yeasts[J].Front Microbiol,2016,148(7):610.
[38]YANG Y J,XIA Y J,LIN X N,et al.Improvement of flavor profiles in Chinese rice wine by creating fermenting yeast with superior ethanol tolerance and fermentation activity[J].Food Res Int,2018,108:83-92.
[39]COTON M,PAWTOWSKI A,TAMINIAU B,et al.Unraveling microbial ecology of industrial-scale Kombucha fermentations by metabarcoding and culture-based methods[J].FEMS Microbiol Ecol,2017,93(5):48.
[40]杨彬彦,党娅,黎坤怡.蓝莓酵素复合菌种发酵工艺优化及品质分析[J].中国酿造,2023,42(12):165-169.
[41]贾晶晶,赵虎威,燕平梅.酸菜发酵过程中细菌群落结构变化及驱动机制[J].中国食品学报,2023,23(8):354-368.
[42]CUI R Y, ZHENG J, WU C D, et al.Effect of different halophilic microbial fermentation patterns on the volatile compound profiles and sensory properties of soy sauce moromi[J].Eur Food Res Technol,2014,239(2):321-331.
[43]LI Y N,LUO Y,LU Z M,et al.Metabolomic analysis of the effects of a mixed culture of Saccharomyces cerevisiae and Lactiplantibacillus plantarum on the physicochemical and quality characteristics of apple cider vinegar[J].Front Nutr,2023,10:1142517.
[44]ZHANG X,SHAN T T,JIA H,et al.Comparative evaluation of the effects of natural and artificial inoculation on soybean paste fermentation[J].LWT-Food Sci Technol,2022,155:112936.
[45]陈雨滢,周颖,汪立平,等.黄色毛霉和卷枝毛霉混合发酵腐乳前发酵工艺的优化[J].湖北民族大学学报(自然科学版),2023,41(2):170-177.
[46]RUAN W,LIU J L,LI P L,et al.Flavor production driven by microbial community dynamics and their interactions during two-stage fermentation of Ziziphus jujuba vinegar[J].Food Biosci,2024,57(5):103537.
[47]DEVANTHI P V P,GKATZIONIS K.Soy sauce fermentation:Microorganisms,aroma formation,and process modification[J].Food Res Int,2019,120(3):364-374.
[48]CHUN B H,HAN D M,KIM H M,et al.Metabolic features of Ganjang(a Korean Traditional Soy Sauce) fermentation revealed by genomecentered metatranscriptomics[J].mSystems,2021,6(4):e44121.
[49]COMITINI F,CAPECE A,CIANI M,et al.New insights on the use of wine yeasts[J].Curr Opin Food Sci,2017,13:44-49.
[50]邢鑫.戴尔有孢圆酵母/酿酒酵母混合发酵对蛇龙珠葡萄酒香气品质的影响及互作机制研究[D].烟台:鲁东大学,2023.
[51]LIU S, YANG L, ZHOU Y, et al.Effect of mixed moulds starters on volatile flavor compounds in rice wine[J].LWT-Food Sci Technol,2019,112(6):108215.
[52]AN F Y, LI M, ZHAO Y, et al.Metatranscriptome-based investigation of flavor-producing core microbiota in different fermentation stages of dajiang, a traditional fermented soybean paste of Northeast China[J].Food Chem,2021,343:128509.
[53]PENG C T,YAO G Q,SUN Y R,et al.Comparative effects of the single and binary probiotics of Lacticaseibacillus casei Zhang and Bifidobacterium lactis V9 on the growth and metabolomic profiles in yogurts[J].Food Res Int,2022,152:110603.
[54]WANG J,HOU J N,ZHANG X,et al.Improving the flavor of fermented sausage by increasing its bacterial quality via inoculation with Lactobacillus plantarum MSZ2 and Staphylococcus xylosus YCC3[J].Foods,2022,11(5):736.
[55]FERREIRA I,DE SOUSA MELO D,MENEZES A G T,et al.Evaluation of potentially probiotic yeasts and Lactiplantibacillus plantarum in co-culture for the elaboration of a functional plant-based fermented beverage[J].Food Res Int,2022,160:111697.
[56]OU M J,LOU J M,LAO L F,et al.Plant-based meat analogue of soy proteins by the multi-strain solid-state mixing fermentation[J].Food Chem,2023,414:135671.