酿酒酵母(Saccharomyces cerevisiae)作为果酒发酵的主要菌种,对乙醇耐受性较强,发酵性能较高,能够将果汁原浆中的糖类物质转化成高级醇、酯、醛、酸等化合物等,是赋予果酒香气风格与滋味品质的关键因子[1]。HUA Y等[2]研究发现,接种S.cerevisiae进行发酵,可以使砀山梨酒更澄清透明,风味更加饱满,酒体具有醇厚协调性和果香浓郁的特点。SUN N等[3]对接种不同菌种酵母菌制备的猕猴桃酒品质进行分析发现,相较于异常威克汉姆酵母(Wickerhamomyces anomalus),接种S.cerevisiae制备的猕猴桃酒对糖类物质的利用率更高,乙醇、酯类和萜类的含量更高,风味更佳。S.cerevisiae HBUAS61676分离于四川地区米酒样品,本团队前期对其进行研究发现,该菌株的酸度、糖度、SO2和乙醇的耐受性更好,产酒精能力和絮凝性能更优,因此本研究使用该菌株制备红枣酒。
红枣(Zizyphus jujuba Mill.)原产于中国,距今已有3 000多年的栽培历史。中国作为世界上红枣产量最高的国家,现年产量已达750 万t左右,约占全球总产量的90%以上[4]。虽然我国红枣产量高,但产品形式以干制为主,缺乏深加工技术,使红枣得不到充分利用,造成巨大的损失,严重影响了红枣产业的可持续发展。因此对红枣进行深加工,合理利用产业资源,提高其附加价值尤为迫切。红枣酒作为红枣深加工产品之一,是以红枣为原料,在酵母菌的作用下经糖化发酵酿制而成的发酵酒[5],既保留了红枣的果香又具有入口绵柔的特点而获得广泛关注。目前关于红枣酒的研究主要集中于生产工艺条件优化[6]、抗氧化活性[7]和混菌发酵比例[8]等方面,对于红枣酒发酵过程中品质动态变化的报道尚少。
滋味和挥发性风味品质是红枣酒的重要表征,影响着红枣酒的市场接受度。电子舌和电子鼻技术作为现代仿生学设备,以其快速、高效和准确性高等特点,被广泛应用于果酒滋味和风味品质的检测中。LOZANO J等[9]利用电子鼻技术对不同储藏时间的葡萄酒进行了区分,戢得蓉等[10]研究发现,电子舌技术对不同葡萄品种和不同酒花接种量制备的葡萄酒均有较好的识别效果,李昕沂等[11]运用电子鼻和电子舌技术对不同菌株制备的猕猴桃酒的品质进行了解析,发现葡萄酒活性干酵母BV818发酵的猕猴桃果酒芳香类物质的含量较高,LA FRUITEE发酵的猕猴桃果酒苦味和涩味更低。
本研究以红枣为原料,采用酿酒酵母(Saccharomyces cerevisiae)HBUAS61676发酵制备红枣酒,采用常规分析方法及电子鼻、电子舌技术检测其品质指标,以理化指标、颜色、风味和滋味为评价指标,探究红枣酒发酵过程中品质变化,并对结果进行聚类分析(cluster analysis,CA)。旨在初步揭示S.cerevisiae HBUAS61676菌株发酵红枣酒过程中的品质变化规律,为红枣酒酿造菌株的开发提供一定的数据支撑和理论依据。
1 材料与方法
1.1 材料与试剂
骏枣(干果)、白砂糖:市售;酿酒酵母(Saccharomyces cerevisiae)HBUAS61676:分离于米酒,由湖北文理学院湖北省食品配料工程技术研究中心提供;酵母粉麦芽糖液体培养基:青岛海博生物技术有限公司;偏重亚硫酸钾(分析纯):上海阿拉丁生化科技股份有限公司;果胶酶(酶活5万U/g):湖北糖柜股份有限公司;氢氧化钠、盐酸、酒石酸、葡萄糖(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
250B数显生化培养箱:金坛市精达仪器制造有限公司;CHA-S恒温振荡器:上海力辰仪器科技有限公司;SW-CJ-2D双人单面超净工作台:苏州安泰空气技术有限公司;9231破壁榨汁机:奥克斯集团有限公司;CR21N台式高速冷冻离心机:日本HITACHI公司;Abbemat 350折光仪:德国Anton Paar公司;HUNTERLAB色度仪:上海信联创作电子有限公司;RE52CS旋转蒸发器:上海亚荣生化仪器厂;PEN3电子鼻:德国Airsense公司;SA-402B电子舌:日本INSENT公司。
1.3 方法
1.3.1 S.cerevisiae HBUAS61676种子液培养
将使用甘油管藏法保存于-80 ℃冰箱的S.cerevisiae HBUAS61676菌株冻存管取出,吸取50 μL菌液于装有3 mL酵母粉麦芽糖液体培养基的试管中,28 ℃、180 r/min振荡培养24 h后,重复上述方法活化第二代,吸取50 μL第二代活化后的菌至装液量为50 mL/250 mL酵母粉麦芽糖液体培养基中,28 ℃、180 r/min振荡培养24 h。将活化三代后的菌液于4 ℃、3 000 r/min的条件下离心10 min,弃掉上清液,使用生理盐水将菌体重悬后再次离心取沉淀。
1.3.2 红枣酒的制备及采样
将经挑选、清洗、晾干、去核和对半切开后的骏枣按照质量比1∶5加入去离子水,打浆机破碎30 s后,添加质量比0.006%的偏重亚硫酸钾常温静置30 min,然后添加质量比0.3%的果胶酶45 ℃酶解30 min,酶解后加入白砂糖调可溶性固形物至21°Bx,再用酒石酸调pH值至4.0,将种子液按照5%的比例接入红枣汁中,置于22 ℃恒温培养箱中进行发酵,每天早晚各搅拌一次,当糖浓度在72 h内不发生变化,则终止发酵。
红枣酒发酵过程中每隔24 h跟踪取样一次直至发酵结束,随后将所取得试样使用8 层纱布进行过滤,将滤液在4 ℃条件下8 000 r/min离心10 min,最后将离心得到的上清液装入样品后于-20 ℃保存。
1.3.3 理化指标的测定
可溶性固形物含量测定:使用全自动折光仪;酒精度(20 ℃)测定:根据国标GB/T 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》中的酒精计法[12];总酸含量(以苹果酸计)测定:根据国标GB/T 12456—2008《食品安全国家标准食品中总酸的测定》中的酸碱滴定法[13];总糖含量的测定:根据国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的直接滴定法[14]。
1.3.4 颜色参数的测定
颜色参数测定:使用高精度色度仪,设置为全透射模式,使用10 mm×50 mm的比色皿进行测定,测试结果以L*值、a*值和b*值表示,其中L*值表示明亮度,正值越大表示样品越亮,a*值表示红绿度,正值越大表示样品越红,b*值表示黄蓝度,正值越大表示样品越黄。每个样品测定3个平行,取平均值作为其最终色度值。
1.3.5 挥发性风味的测定
使用德国PEN3电子鼻进行红枣酒样品风味的测定[15],其内部系统主要由7 个金属氧化物半导体型化学传感器组成,包括W1C(对苯类芳香物质灵敏)、W3C(对氨和芳香族物质灵敏)、W5C(对烷烃芳香物质灵敏)、W1W(对有机硫化物和萜烯类物质灵敏)、W2W(对有机硫化物灵敏)、W2S(对醇和部分芳香族化合物灵敏)和W3S(烷烃类)。样品具体测试方法如下,首先量取15 mL装入电子鼻样品专用瓶中,密封后55 ℃水浴10 min,然后将其放置于室温条件下稳定30 min,使用清洁的环境空气作为载体,以300 mL/min的流速将密封玻璃瓶顶部空间的挥发物输送至受控的传感器室,样品测定时间60 s,选取49 s、50 s和51 s的数据平均值作为样品的最终挥发性风味响应值。
1.3.6 滋味的测定
使用日本SA402B电子舌进行红枣酒样品滋味的测定[16],其内部系统主要由味觉传感器阵列、信号采集系统、模式识别系统三部分组成,可以检测样品的酸味、苦味、涩味、咸味、鲜味、后味A(涩味的回味)、后味B(苦味的回味)和丰度(鲜味的回味)共计8 个指标。每次测试开始前需要对传感器进行活化、校正、自检,通过后取红枣酒样品30 mL装入电子舌检测杯中进行测定。
1.3.7 统计学分析
每个试验重复3次,使用Origin 2018绘制折线图和柱形图,使用多元方差分析(multivariate analysis of variance,MANOVA)对红枣酒发酵过程中品质的动态变化进行分析,使用欧氏距离(Euclidean distance)对不同发酵阶段红枣酒样品品质之间的距离进行计算,使用R(v4.1.3)软件绘制冗余分析(redundancy analysis,RDA)双序图和不同发酵阶段各指标差异分析图。
2 结果与分析
2.1 红枣酒发酵过程中理化指标的变化
本研究根据糖浓度在72 h内不发生变化作为发酵终点的标准[17],判定S.cerevisiae HBUAS61676菌株发酵的红枣酒周期为16 d。本研究对红枣酒发酵过程中可溶性固形物、酒精度、总糖和总酸含量的变化进行分析,结果见图1。
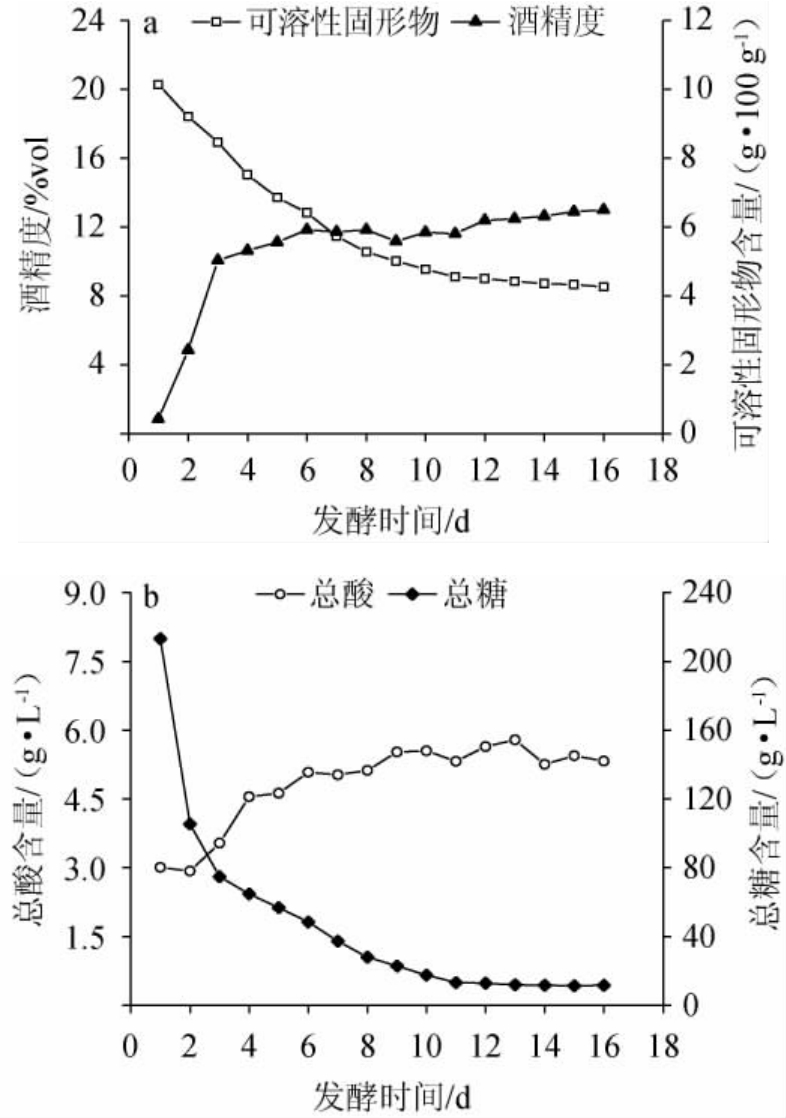
图1 红枣酒发酵过程中理化指标的变化
Fig.1 Changes of physicochemical indexes of jujube wine during fermentation process
由图1可知,随着红枣酒发酵的进行,可溶性固形物和总糖的含量整体呈现下降趋势,酒精度和总酸则整体呈现上升趋势,与王岩等[18]对水蜜桃果酒发酵过程品质变化的结果一致。可溶性固形物和总糖含量由最初的20.28 g/100 g和213.3 g/100 g下降至8.54 g/100 g和11.5 g/100 g,且发酵1~7 d期间大幅度下降,其中发酵1~2 d期间尤其显著,而从第8天开始下降速度逐渐减缓。可溶性固形物主要指可溶解于水的糖类和酸类等化合物,总糖包括葡萄糖和果糖等具有还原性的糖类,而糖类是酒精发酵的重要基质原料[19],说明S.cerevisiae HBUAS61676对发酵环境的适应性较强且活性较高,代谢旺盛,能够快速对碳水化合物进行分解利用,转化为乙醇和有机酸等有效产物[20],从而使发酵醪的酒精度和总酸含量明显升高。发酵7 d后,酒精度和总酸的上升速度放缓且逐步趋于稳定,一方面可能是因为发酵醪内的糖类物质已经基本被消耗完,S.cerevisiae HBUAS61676无法获得充足的发酵底物,另一方面可能是因为随着发酵时间的延长,酸类和乙醇等物质积累达到一定量后,发酵醪的环境不适合微生物的生长,S.cerevisiae HBUAS61676开始沉降和衰亡,从而导致发酵逐渐进入结束期。值得一提的是,在发酵后期总酸含量发生小幅度下降,究其原因一方面可能是微生物活力受到抑制不再产酸,另一方面可能是酒体中的CO2和挥发性酸转移到了空气中[21]。
2.2 基于多元统计学分析对红枣酒发酵过程中颜色、滋味和风味品质变化评价
色泽、滋味和风味是果酒重要的感官指标,会直接对消费者的视觉感受和购买力产生影响,而单一的对红枣酒的某一指标进行评价是不可行的,因此本研究在对红枣酒颜色、滋味和风味品质进行研究的基础上,进一步构建了16行×18列的矩阵,然后使用围绕中心点划分(partitioning around medoid,PAM)和非加权组平均法(unweighted pair group method with arithmetic mean,UPGMA)聚类算法对红枣酒发酵过程中颜色、滋味和风味等品质进行评价,结果见图2。

图2 基于红枣酒发酵过程中样品颜色、滋味和风味检测结果的聚类分析
Fig.2 Cluster analysis based on the color, taste and flavor detection results of jujube wine during fermentation process
a:基于PAM的聚类分析;b:基于UPGMA的聚类分析。
由图2a可知,16个不同发酵时间样品在空间排布上存在一定的聚类趋势,并且可以被划分为3个聚类,发酵1 d的样品单独呈现为第1个聚类,发酵2~7 d的样品形成第2个聚类,发酵8~16 d的样品形成第3个聚类。并且发酵1 d的样品与发酵2 d的样品空间距离较远,因此可以初步推断红枣酒在发酵2 d时其品质整体结构开始形成。本研究进一步使用UPGMA聚类分析对PAM的结果进行验证,由图2b可知,不同发酵时间的红枣酒亦被划分为3个聚类,与PAM分析的结果一致。
综上,根据不同发酵时间红枣色泽、滋味和风味的动态变化,红枣酒的发酵过程大致可以被分为3个阶段,其中0~1 d为第1阶段(发酵初期),此时酵母菌刚接入发酵醪中,对环境正处于一个适应的阶段,因此代谢较为缓慢,红枣酒的品质还未呈现,随着时间的延长,2~7 d被归为第2阶段(发酵中期),酵母菌在此时快速繁殖,红枣酒的品质开始初步形成,8~16 d为第3 阶段(发酵后期),发酵醪已初步具备红枣酒的品质。
进一步以第2阶段和第3阶段为分组依据,使用RDA对红枣酒发酵过程中酒样的颜色、滋味和风味指标进行分析,结果见图3。

图3 发酵中期和后期红枣酒样品颜色、滋味及风味指标冗余分析
Fig.3 Redundancy analysis of color, taste and flavor indexes of jujube wine samples in middle and late fermentation
由图3可知,RDA1和RDA2的累计方差贡献率为84.7%,发酵中期(2~7 d)样品的a*值、涩味和苦味更高,传感器W1C(对苯类芳香物质灵敏)、W3C(对氨和芳香族物质灵敏)和W5C(对烷烃芳香物质灵敏)响应值更大,发酵后期(8~16 d)样品的L*值、咸味和丰度(鲜味的回味)更高,传感器W1W(对有机硫化物和萜烯类物质灵敏)、W2W(对有机硫化物灵敏)、W2S(对醇和部分芳香族化合物灵敏)、W3S(对烷烃类物质灵敏)响应值更大。本研究进一步采用MANOVA对发酵中期和发酵后期样品的差异进行了计算,发现两者差异显著(P<0.05),由此可见,隶属于不同发酵阶段的样品在品质上存在差异。值得注意的是,发酵中期样品的散点在空间排布上更加分散,而发酵后期排布较为紧凑,采用欧式距离对发酵中期和发酵后期组内整体品质的距离进行了计算,结果发现其组内平均距离分别为4.58±2.07和3.55±1.08,可见在红枣酒的发酵过程中发酵中期的个体变异较大。
2.3 发酵中期和后期红枣酒颜色指标的分析
对发酵中期和后期红枣酒样品颜色指标分析结果见图4。
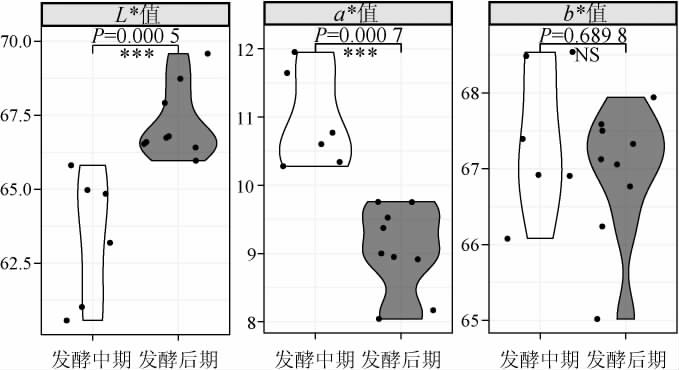
图4 发酵中期和后期红枣酒样品颜色指标分析
Fig.4 Analysis of color indexes of jujube wine samples in middle and late fermentation
“***”表示差异极显著(P<0.001);“NS”表示差异不显著(P>0.05);下同。
由图4可知,随着发酵时间的延长,发酵8~16 d的样品其L*值较之2~7 d时极显著升高(P<0.001),这可能是因为红枣富含过氧化物酶,但是在榨汁阶段红枣被破碎与氧气接触时,红枣中的酚类物质转化为一种呈黑褐色的有机化合物,使其初期颜色较暗,然而过氧化物酶本质是蛋白质,乙醇对其活性具有抑制作用[22],所以随着S.cerevisiae HBUAS61676的繁殖,酒精度增加氧化褐变速率降低,与此同时随着发酵的进行,可溶性固形物含量下降,样品在发酵后期会变得更加透亮,从而导致发酵8~16 d的样品L*值更高。由图4亦可知,发酵8~16 d的样品其a*值较之2~7 d时极显著降低(P<0.001),说明酒体红色色调减少,一方面可能是随着发酵的进行酵母菌的代谢加速了花色苷的降解[23],另一方面可能是S.cerevisiae HBUAS61676的细胞壁会吸附花色苷[24],从而使红色度下降。而不同发酵阶段样品的b*值差异不显著(P>0.05),说明发酵时间对红枣酒色泽黄蓝度的影响不大。综上可知,较之发酵中期,发酵后期的样品明亮度更大,酒体颜色偏绿发酵中期L*值和a*值的变异系数分别为70.69%和17.18%,发酵后期分别为17.18%和58.45%,由此可见,样品明亮度(L*值)在2~7 d的变化较大,红绿度(a*值)在8~16 d期间变化较大。
2.4 发酵中期和后期红枣酒滋味指标的分析
对发酵中期和后期红枣酒样品滋味指标分析结果见图5。
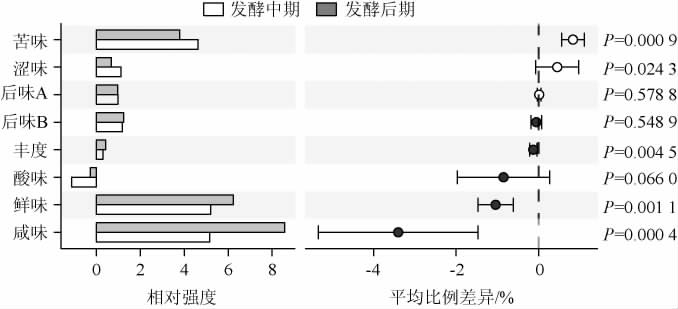
图5 发酵中期和后期红枣酒样品滋味指标分析
Fig.5 Analysis of taste indexes of jujube wine samples in middle and late fermentation
由图5可知,发酵8~16 d的样品其咸味、鲜味和丰度较之2~7 d时非常显著升高(P<0.01),而苦味和涩味则呈现相反趋势。样品的涩味和苦味在发酵后期得到改善,可能是因为在S.cerevisiae HBUAS61676的发酵过程中会产生氧化酶,与多酚类物质发生反应,从而导致酚类物质含量下降,而花色苷、单宁等多酚类物质是红枣酒产生苦涩味的重要原因之一[25],所以在发酵后期涩味和苦味相对含量有所下降,同时在发酵后期有机酸发生累积,而适量的有机酸亦能平衡红枣酒中的苦味与涩味[26]。发酵后期的样品鲜味显著偏高,可能是因为S.cerevisiae HBUAS61676在利用碳水化合物代谢的过程中会产生呈味氨基酸,而林波等[27]研究发现,果酒中呈味氨基酸分布以鲜味为主。当苦味氨基酸如苯丙氨酸、酪氨酸等,其含量低于呈味阈值时,可增强其他氨基酸的鲜味[28],因此在苦味和涩味得到改善的同时红枣酒的鲜味则更突出。发酵中期苦味、涩味、鲜味、丰度和咸味的变异系数分别为15.65%、52.88%、67.27%、54.80%和68.19,发酵后期分别为49.23%、51.16%、20.55%、62.16%和3.76%,由此可见,红枣酒涩味、鲜味和咸味在2~7 d的变化较大,苦味和丰度在8~16 d期间变化较大。
2.5 发酵中期和后期红枣酒风味指标的分析
对发酵中期和后期样品风味指标分析结果见图6。
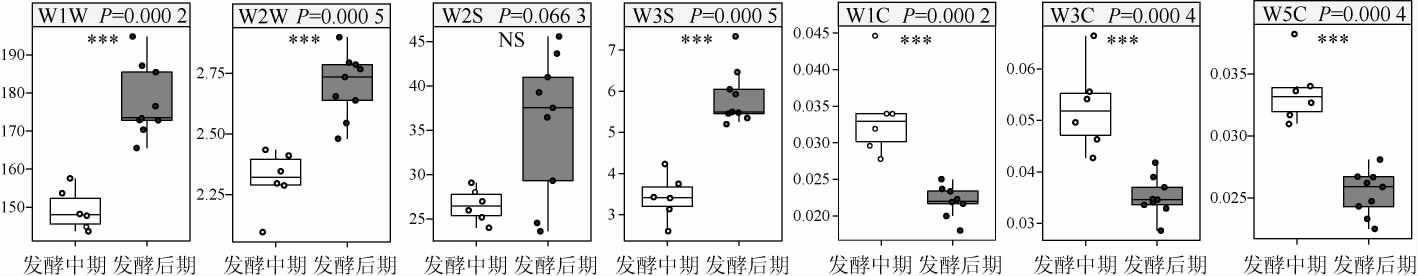
图6 发酵中期和后期红枣酒样品风味指标分析
Fig.6 Analysis of flavor indexes of jujube wine samples in middle and late fermentation
由图6可知,传感器W1W对2个阶段的样品均具有较高的响应值,说明样品中有机硫化物和萜烯类物质含量较高,而一些萜烯类物质感官阈值较低,能赋予红枣酒浓郁的花香和果香味等挥发性风味,使红枣酒的香味更加协调、厚重[29]。由图6亦可知,传感器W1W、W2W和W3S对发酵后期样品的响应值较发酵中期红枣酒的响应值极显著偏高(P<0.001),而传感器W1C、W3C和W5C呈现相反趋势(P<0.001),说明发酵中期,S.cerevisiae HBUAS61676代谢旺盛,快速的利用发酵醪中的碳水化合物,使发酵后期各类产物含量累积,然而在这个过程中红枣的风味成分被破坏,芳香类化合物的含量下降。发酵中期有机硫化物、萜烯类物质和烷烃类(W1W、W2W和W3S)变化较发酵后期大,其在发酵中期和发酵后期变异系数分别为86.66%、1.23%、61.07%和26.18%、20.59%、19.45,而芳香类物质(W1C、W3C和W5C)变化较发酵后期小,其在发酵中期和发酵后期变异系数分别为34.55%、32.00%、20.91%和48.84%、54.74%、58.80%。
3 结论
S.cerevisiae HBUAS61676制备的红枣酒样品整体发酵周期为16 d,按照色泽、滋味和风味指标的变化可将其发酵过程划分为3 个阶段:发酵初期(0~1 d)、发酵中期(2~7 d)和发酵后期(8~16 d)。在发酵初期红枣酒样品品质变化较大,发酵中期红枣酒样品的颜色偏暗偏红,鲜味、丰度和咸味较低,芳香类化合物的含量相对较高,发酵后期的红枣酒样品的颜色偏亮偏绿,酸味、鲜味、咸味、无机硫化物、萜烯类物质、有机硫化物、醇类物质、部分芳香族化合物、烷烃类物质的含量较高,同时涩味和苦味得到改善。通过对S.cerevisiae HBUAS61676菌株制备的红枣酒样品在发酵过程中品质的动态变化进行研究,以期为红枣酒的产业化开发提供数据支撑。
[1]PARAPOULI M,VASILEIADIS A,AFENDRA A S,et al.Saccharomyces cerevisiae and its industrial applications[J].Aims Microbiol,2020,6(1):1-31.
[2]HUA Y,SUN J Y,TIAN T T,et al.Physicochemical characterization and quality of Dangshan pear wines fermented with different Saccharomyces cerevisiae[J].J Food Biochem,2019,43(8):12891.
[3]SUN N,GAO Z Y,LI S Q,et al.Assessment of chemical constitution and aroma properties of kiwi wines obtained from pure and mixed fermentation with Wickerhamomyces anomalus and Saccharomyces cerevisiae[J].J Sci Food Agr,2022,102(1):175-184.
[4]ZHANG Q,WANG L,LIU Z,et al.Transcriptome and metabolome profiling unveil the mechanisms of Ziziphus jujuba Mill.peel coloration[J].Food Chem,2020,312(5):125903.
[5]TANG F X,CAI W C,SHAN C H,et al.Dynamic changes in quality of jujube wine during fermentation[J].J Food Process Pres,2020,44(9):14704.
[6]YUAN L,LI G F,YAN N,et al.Optimization of fermentation conditions for fermented green jujube wine and its quality analysis during winemaking[J].J Food Sci Technol,2022,59(1):288-299.
[7]CAI W C,TANG F X,SHAN C H,et al.Pretreatment methods affecting the color,flavor,bioactive compounds,and antioxidant activity of jujube wine[J].Food Sci Nutr,2020,8(9):4965-4975.
[8]ZHAO X,XUE Y,TANG F X,et al.Quality improvement of jujube wine through mixed fermentation with Saccharomyces cerevisiae and Bacillus licheniformis[J].LWT-Food Sci Technol,2022,164(7):113444.
[9]LOZANO J, ARROYO T, SANTOS J P, et al.Electronic nose for wine ageing detection[J].Sensor Actuators B-Chem,2008,133(1):180-186.
[10]戢得蓉,段丽丽,易宇文,等.采用电子舌对不同品种酒花酿造葡萄酒滋味的分析[J].四川旅游学院学报,2020(2):13-18.
[11]李昕沂,刘丹丹,罗晶晶,等.不同酵母菌发酵对猕猴桃果酒品质的影响[J].中国酿造,2021,40(2):107-110.
[12]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.225—2023 食品安全国家标准酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[13]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB/T 12456—2021 食品中总酸的测定[S].北京:中国标准出版社,2021.
[14]中华人民共和国国家质量监督检验检疫总局,中国国家标准化委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[15]LIU R J,LIU Y R,ZHU Y X,et al.Aromatic characteristics of passion fruit wines measured by E-Nose,GC-Quadrupole MS,GC-Orbitrap-MS and sensory evaluation[J].Foods,2022,11(23):3789.
[16]WANG Y R, XIANG F S, ZHANG Z D, et al.High-throughput sequencing-based analysis of fungal diversity and taste quality evaluation of Douchi,a traditional fermented food[J].Food Sci Nutr,2020,8(12):6612-6620.
[17]刘晓辉,杨雪,田钱丰,等.3种不同酵母发酵黄精酒的抗氧化活性及风味物质分析[J].食品安全质量检测学报,2022,13(16):5153-5161.
[18]王岩,朱会霞,孙金旭,等.水蜜桃果酒发酵过程中主要理化成分动态变化研究[J].农业与技术,2023,43(19):34-37.
[19]NGUYEN T V T,UNPAPROM Y,MANMAI N,et al.Impact and significance of pretreatment on the fermentable sugar production from lowgrade longan fruit wastes for bioethanol production[J].Biomass Convers Bior,2020,6(9):1-13.
[20]NOGUEIRA K M V, MENDES V, CARRARO C B, et al.Sugar transporters from industrial fungi:Key to improving second-generation ethanol production[J].Renew Sust Energ Rev,2020,131(11):109991.
[21]林岚.贵州麻江地区不同品种蓝莓酒发酵过程中真菌菌群动态及抗氧化性的研究[D].扬州:扬州大学,2023.
[22]刘爱龙,赵智慧,董建方,等.白酒浸泡鲜枸杞发酵工艺对枸杞酶促褐变的影响研究[J].酿酒,2023,50(5):72-77.
[23]LI X S,TENG Z,LUO Z,et al.Pyruvic acid stress caused color attenuation by interfering with anthocyanins metabolism during alcoholic fermentation[J].Food Chem,2022,372:131251.
[24]BOŽICˇJ T, BUTINAR L, ALBREHT A, et al.The impact of Saccharomyces and non-Saccharomyces yeasts on wine color:A laboratory study of vinylphenolic pyranoanthocyanin formation and anthocyanin cell wall adsorption[J].LWT-Food Sci Technol,2020,123(4):109072.
[25]YANG F, CHEN C, NI D, et al.Effects of fermentation on bioactivity and the composition of polyphenols contained in polyphenol-rich foods:A review[J].Foods,2023,12(17):3315.
[26]孙慧烨.不同方法降解苹果酒中有机酸的比较和优化[D].杨凌:西北农林科技大学,2015.
[27]林波,郑凤锦,何洁,等.低醇甘蔗果酒发酵菌种的筛选与呈味特征分析[J].食品科技,2022,47(6):16-23.
[28]CASTELLANOS E R,JOFRE V P,FANZONE M L,et al.Effect of different closure types and storage temperatures on the color and sensory characteristics development of Argentinian Torrontes Riojano white wines aged in bottles[J].Food Control,2021,130(12):108343.
[29]WANG L N, WANG Y Q, WANG W Z, et al.Comparison of volatile compositions of 15 different varieties of Chinese jujube(Ziziphus jujuba Mill.)[J].J Food Sci Tech Mys,2019,56(3):1631-1640.