灵芝(Ganoderma lucidum),隶属于担子菌纲、多孔菌科、灵芝属,是一种兼具有药用和食用价值的真菌。灵芝以益中补气、扶正固本、滋补强身的功效而闻名[1-4]。灵芝子实体是灵芝的繁殖器官,呈半圆形或肾形,质地坚韧,最初为黄色,随后逐渐变为红褐色,表面光亮如漆[5-6]。灵芝多糖是灵芝的主要活性成分,具备多种药理活性,如抗肿瘤[7]、抗炎[8]、抗氧化[9]、免疫调节[10]等。子实体的主要成分包括纤维素、半纤维素和木质素等,形成了坚硬且复杂的结构,使得子实体多糖提取较为困难,传统的水提醇沉法在提取多糖时得率通常不高,采用超声波技术、微波技术以及酶解方法能够显著提升多糖的提取率[11-14]。
哮喘多见于儿童和青少年,它是一种慢性炎症性疾病。目前的研究指出,慢性气道炎症构成了哮喘发作的根本原因,而在这一过程中,嗜酸性粒细胞和淋巴细胞等多种炎症细胞以及它们分泌的炎症介质,共同影响着哮喘病程的发生和发展[15]。白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumour necrosis factor,TNF-α)是两种具有广泛免疫调节作用的细胞因子,在气管炎症过程中具有关键作用,它们能够刺激炎症细胞的产生,并促使炎症介质的释放[16]。IL-6可导致呼吸道平滑肌发生痉挛,加剧哮喘病情的发生和发展。TNF-α是重度哮喘的重要生物标志物,它在白细胞招募、白三烯产生以及支气管收缩中具有重要作用[17-18]。
本研究采用单因素及响应面试验对灵芝子实体多糖的提取工艺进行优化,通过卵清蛋白诱导哮喘小鼠模型,以地塞米松(5 mg/kg)为阳性对照,考察低、中、高剂量灵芝多糖(50 mg/kg、100 mg/kg、200 mg/kg)对哮喘小鼠肺组织病理形态、肺泡灌洗液白细胞及细胞分类计数以及白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平的影响,探讨灵芝子实体多糖改善哮喘小鼠的效果,旨在对灵芝子实体多糖的生物活性研究及进一步开发利用提供参考。
1 材料与方法
1.1 材料与试剂
灵芝子实体样品(干品):来自广西南宁种植基地,栽培方式为代料栽培,经广西中医药大学药学院谭勇教授鉴定品种为赤灵芝(Ganoderma lucidum·karst);地塞米松片(每片0.75 mg):广东南国药业有限公司;浓硫酸(分析纯):新疆德瑞生物有限公司;苯酚(分析纯):天津市风船化学世纪科技有限公司;D(+)-无水葡萄糖(分析纯)、卵清蛋白(ovalbumin,OVA):北京索莱宝科技有限公司;瑞氏-姬姆萨复合染色液:上海源叶生物科技有限公司;IL-6、TNF-α、酶联免疫吸附测定(enzyme-linked immuno-sorbent assay,ELISA)试剂盒:上海酶联生物科技有限公司。
1.1.2 实验动物
雄性昆明小鼠,无特定病原体(specific-pathogen free,SPF)级,体质量20~22 g,由辽宁长生生物技术股份有限公司供应,产品许可证编号为SCXK(辽)2020-0001。动物实验经新疆医科大学实验动物伦理委员会批准,伦理审批编号为IACUC-20220728-18。
1.2 仪器与设备
RE-201D型旋转蒸发仪:上海析牛莱伯仪器有限公司;UV-3100紫外可见分光光度计:上海美谱达仪器有限公司;KQ-100DE型数控超声波清洗仪:昆山舒美超声仪器有限公司;Therrno 3001全自动酶标仪:美国Thermo公司;AxioImagerA2型蔡司正置荧光显微镜:北京博瑞斯科技有限公司。
1.3 试验方法
1.3.1 灵芝子实体粗多糖粉末制备
将灵芝子实体水洗处理后,放入60 ℃烘箱内干燥至恒质量,切片和粉碎,并过20目筛。准确称取50 g灵芝子实体,加入10倍量水,超声提取1 h,提取2次,将提取液过滤并浓缩至100 mL,向滤液中加入3倍量的无水乙醇,于4 ℃条件下静置12 h后再次过滤,收集沉淀并在50 ℃烘箱中烘干,得灵芝子实体粗多糖粉末。灵芝子实体粗多糖得率=多糖粉末质量/灵芝子实体质量×100%。
1.3.2 分析检测
(1)多糖含量测定
利用苯酚-硫酸法测定多糖含量[19-20]。准确称取50.0 mg无水葡萄糖,用蒸馏水稀释至50.0 mL,制备1 mg/mL无水葡萄糖标准溶液。分别取0.01 mL、0.02 mL、0.04 mL、0.06 mL、0.08 mL、0.10 mL标准溶液,加蒸馏水至2.0 mL。在每个试管中,加入1.0 mL的5%苯酚溶液,然后迅速加入5.0 mL的浓硫酸,并搅拌均匀,将混合液置于沸水中加热15 min,取出自然冷却至室温,使用紫外-可见分光光度计在波长490 nm处测定样品的吸光度值。以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,回归方程为y=9.95x-0.047 3,相关系数R2=0.998 2。
(2)灵芝子实体多糖提取率测定
准确称取2.0 g灵芝子实体多糖粉末,用蒸馏水配制成100 mL溶液,从中取出1.0 mL的多糖样品,加蒸馏水至2.0mL,向其中加入1.0mL5%的苯酚溶液,然后再加入5.0 mL的浓硫酸,摇匀,将混合液置于沸水中加热15 min,冷却至室温后,采用紫外-可见分光光度计在波长490 nm处测定其吸光度值,依照标准曲线回归方程计算样品中多糖的含量。灵芝子实体多糖提取率=提取液中多糖含量×提取液体积/灵芝子实体多糖质量×100%。
1.3.3 灵芝子实体多糖提取工艺优化
(1)单因素试验
准确称取灵芝子实体粗多糖粉末0.2 g,在每个试验条件下提取多糖。分别考察超声次数(1次、2次、3次、4次、5次)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL)、超声功率(300 W、350 W、400 W、450 W、500 W)、超声时间(20 min、30 min、40 min、50 min、60 min)对灵芝子实体多糖提取率的影响。
(2)响应面试验
在单因素试验的基础上,选定提取次数为1次,以超声时间(A)、超声功率(B)和料液比(C)为自变量,以多糖提取率(Y)为响应值,进行3因素3水平响应面试验。响应面试验因素与水平见表1。
表1 灵芝子实体粗多糖提取工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for extraction process optimization of polysaccharides from Ganoderma lucidum fruit body
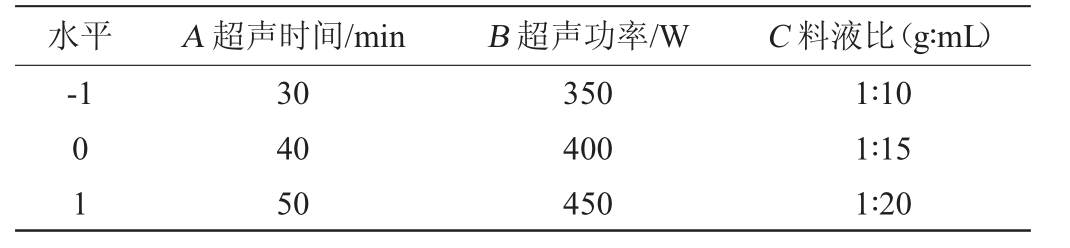
水平A 超声时间/minB 超声功率/WC 料液比(g∶mL)-1 01 30 40 50 350 400 450 1∶10 1∶15 1∶20
1.3.4 灵芝子实体多糖对哮喘小鼠的影响
(1)分组、给药、建模和取样
将昆明小鼠随机分为:空白对照组、模型组、阳性对照组(地塞米松5 mg/kg)[21]和灵芝子实体多糖低、中、高剂量组,每组15只。灵芝子实体多糖低、中、高剂量组小鼠的给药剂量依据本课题组前期预试验结果分别定为50 mg/kg、100 mg/kg、200 mg/kg(以灵芝子实体多糖粉末计)。哮喘小鼠模型的建立,通过在第1天和第14天通过腹腔注射卵清蛋白(0.5 mg/mL,200 mL生理盐水以及100 mg OVA和2 mg氢氧化铝)的混合液引起小鼠致敏,空白对照组小鼠接受等量生理盐水。在致敏后第27~34天,用1%卵清蛋白溶液(卵清蛋白500 mg溶于50 mL生理盐水,现用现配)雾化激发刺激小鼠气道,每天持续30min。而空白对照组小鼠则以100mL生理盐水进行相同处理[22-24]。在实验第21~34天,灵芝子实体多糖和地塞米松组小鼠,每天进行灌胃给药治疗,正常组和模型组组给予生理盐水灌胃。在第35天,结束试验,检测相关指标。
(2)白细胞及白细胞分类计数
吸取1 mL生理盐水进行支气管肺泡灌洗,重复灌洗3次后,收集肺泡灌洗液,将肺泡灌洗液以3 000 r/min离心5 min,分离上清液和沉淀。用100 μL生理盐水悬浮细胞沉淀,并进行细胞计数和瑞氏-吉姆萨染色。
(3)IL-6、TNF-α含量测定
根据ELISA 试剂盒的说明书进行操作,测定支气管肺泡灌洗液IL-6、TNF-α含量[25]。
(4)小鼠肺组织病理形态学检测
取小鼠右肺,将其置于4%浓度的福尔马林溶液中固定24 h,再经梯度乙醇脱水、石蜡包埋并切片,最后采用苏木精-伊红(hematoxylin-eosin,HE)染色法对切片进行染色,以观察肺组织病理形态学改变。
1.3.5 数据处理
试验数据采用SPSS 21.0软件进行统计分析,结果以“平均值±标准差”表示,多组间比较采用单因素方差分析,组间两两比较采用最小显著差异(least significance difference,LSD)-t检验,检验水准α=0.05。
2 结果与分析
2.1 提取工艺优化单因素试验结果
超声次数、料液比、超声功率、超声时间对灵芝子实体多糖提取率的影响结果见图1。由图1A可知,当超声次数为1次时,多糖的提取率最高,增加超声次数,多糖提取率逐渐降低。因此,最适超声次数为1次。由图1B可知,当料液比为1∶5~1∶15(g∶mL)时,多糖提取率随之增高;当料液比为1∶15(g∶mL)时,多糖的提取率最大,为3.23%;当料液比为1∶15~1∶25(g∶mL)时,多糖的提取率逐渐下降。因此,最适料液比为1∶15(g∶mL)。由图1C可知,当超声功率为300~400 W时,多糖提取率随之增高;当超声功率为400 W时,多糖提取率最大,为3.09%;当超声功率>400 W之后,多糖提取率开始下降。因此,最适超声功率为400 W。由图1D可知,当超声时间为20~40 min时,多糖提取率随之增高;当超声时间为40 min时,多糖提取率最大,为3.20%;超声时间>40 min之后,多糖提取率开始呈现下降趋势。因此,最适超声时间为40 min。
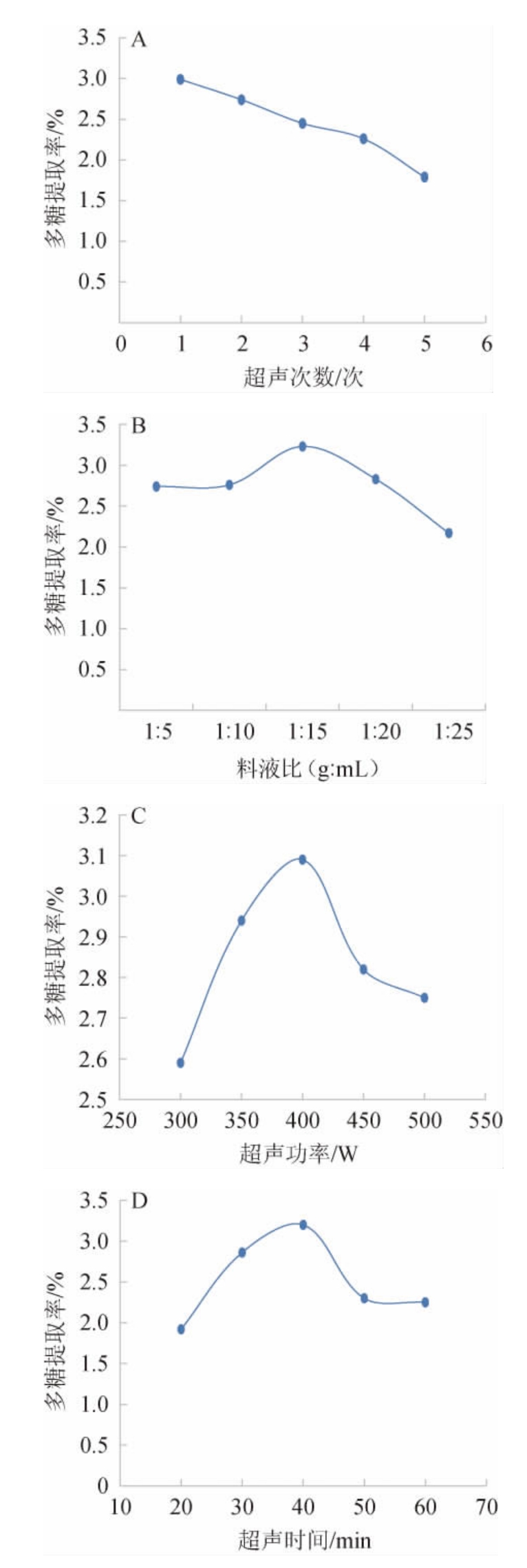
图1 超声次数(A)、料液比(B)、超声功率(C)及超声时间(D)对灵芝子实体多糖提取率的影响
Fig.1 Effects of ultrasound time (A), material to liquid ratio (B),ultrasound power (C) and ultrasound time (D) on the extraction rates of polysaccharides from Ganoderma lucidum fruit body
2.2 提取工艺优化响应面试验
2.2.1 响应面试验结果与分析
在单因素试验的基础上,选定提取次数为1次,以超声时间(A)、超声功率(B)和料液比(C)为自变量,以多糖提取率(Y)为响应值,采用响应面法优化多糖提取工艺,响应面试验设计及结果见表2,方差分析结果见表3。
表2 灵芝子实体粗多糖提取工艺优化响应面试验设计及结果
Table 2 Design and results of response surface experiments for extraction process optimization of polysaccharides from Ganoderma lucidum fruit body
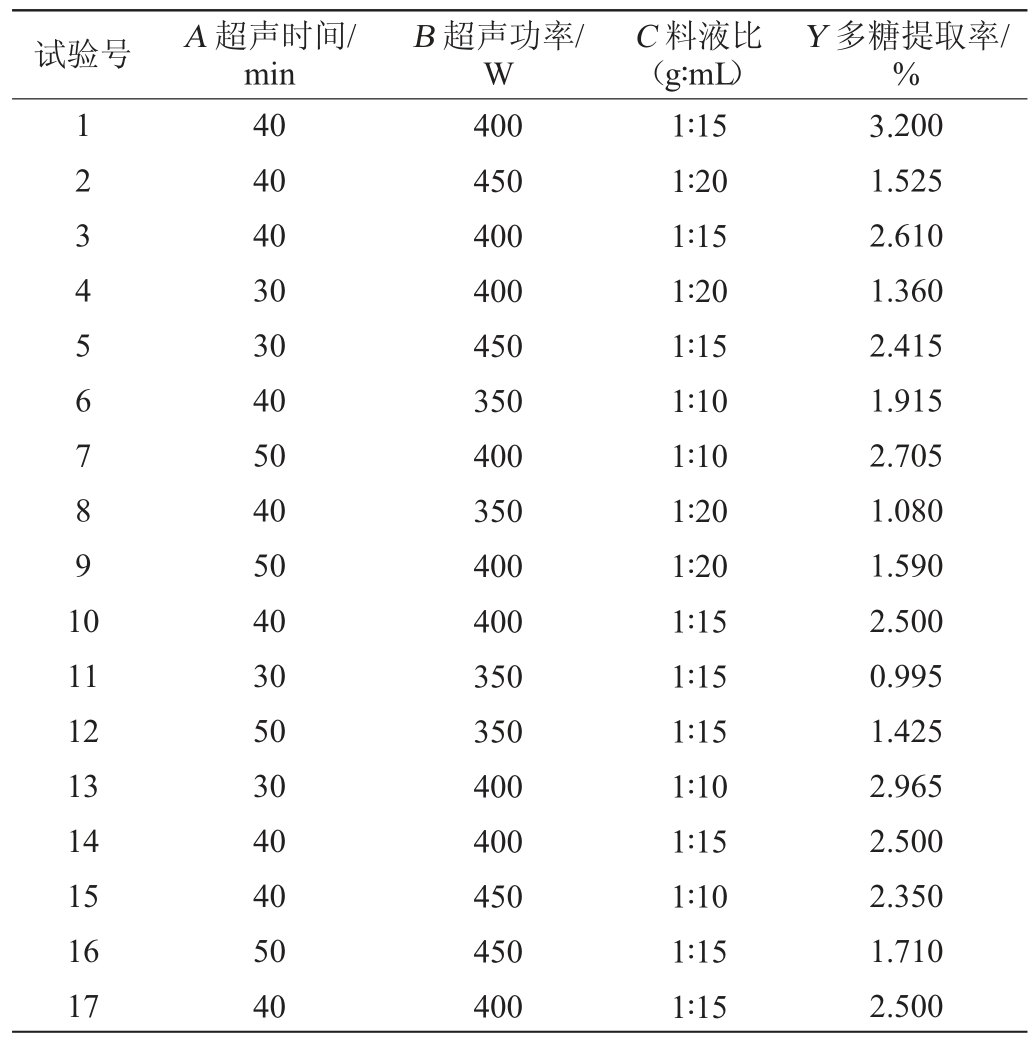
试验号A 超声时间/min B 超声功率/W C 料液比(g∶mL)Y 多糖提取率/%1234567891 0 11 12 13 14 15 16 17 40 40 40 30 30 40 50 40 50 40 30 50 30 40 40 50 40 400 450 400 400 450 350 400 350 400 400 350 350 400 400 450 450 400 1∶15 1∶20 1∶15 1∶20 1∶15 1∶10 1∶10 1∶20 1∶20 1∶15 1∶15 1∶15 1∶10 1∶15 1∶10 1∶15 1∶15 3.200 1.525 2.610 1.360 2.415 1.915 2.705 1.080 1.590 2.500 0.995 1.425 2.965 2.500 2.350 1.710 2.500
表3 回归模型方差分析
Table 3 Variance analysis of regression model
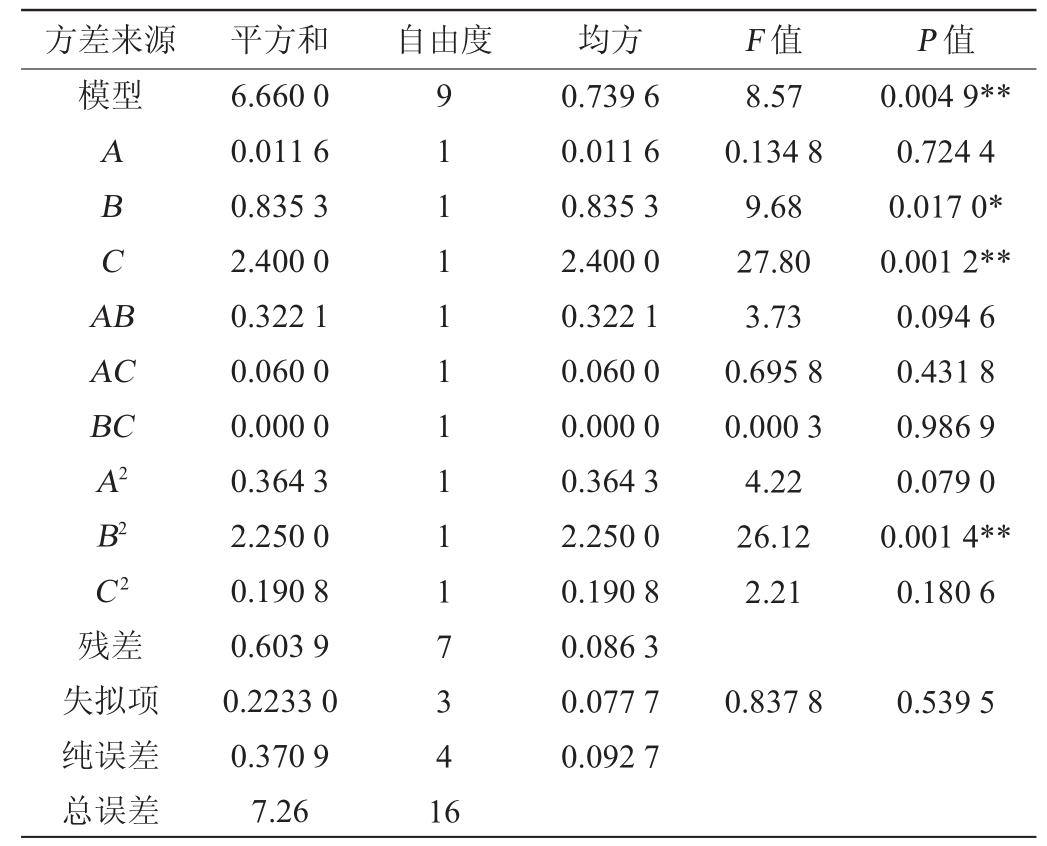
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源平方和自由度均方F 值P 值模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总误差6.660 0 0.011 6 0.835 3 2.400 0 0.322 1 0.060 0 0.000 0 0.364 3 2.250 0 0.190 8 0.603 9 0.2233 0 0.370 9 7.26 91111111117341 6 0.739 6 0.011 6 0.835 3 2.400 0 0.322 1 0.060 0 0.000 0 0.364 3 2.250 0 0.190 8 0.086 3 0.077 7 0.092 7 8.57 0.134 8 9.68 27.80 3.73 0.695 8 0.000 3 4.22 26.12 2.21 0.004 9**0.724 4 0.017 0*0.001 2**0.094 6 0.431 8 0.986 9 0.079 0 0.001 4**0.180 6 0.837 8 0.539 5
使用Design-Expert 12.0软件对表2中的数据进行回归分析,得出二次回归方程:Y=2.66-0.038 1A+0.323 1B-0.5475C-0.2838AB+0.1225AC+0.0025BC-0.2941A2-0.731 6B2-0.2129C2。
由表3可知,模型的F值为8.57,P值=0.004 9<0.05,说明此回归方程具有较好的拟合度;失拟项P>0.05,说明模型是有效的。此外,模型的决定系数R2为0.947 9,表明模型对试验数据的拟合度较高。由P值可知,一次项C,二次项B2对结果影响极显著(P<0.01);一次项B对结果影响显著(P<0.05);其余项对结果影响不显著(P>0.05)。由F值可知,影响结果的因素顺序为超声功率(B)>超声时间(A)>料液比(C)。
2.2.2 各因素交互作用分析
通过实施二次多项式回归分析,成功构建了各影响因素间交互作用对结果影响的响应曲面和等高线,结果见图2。
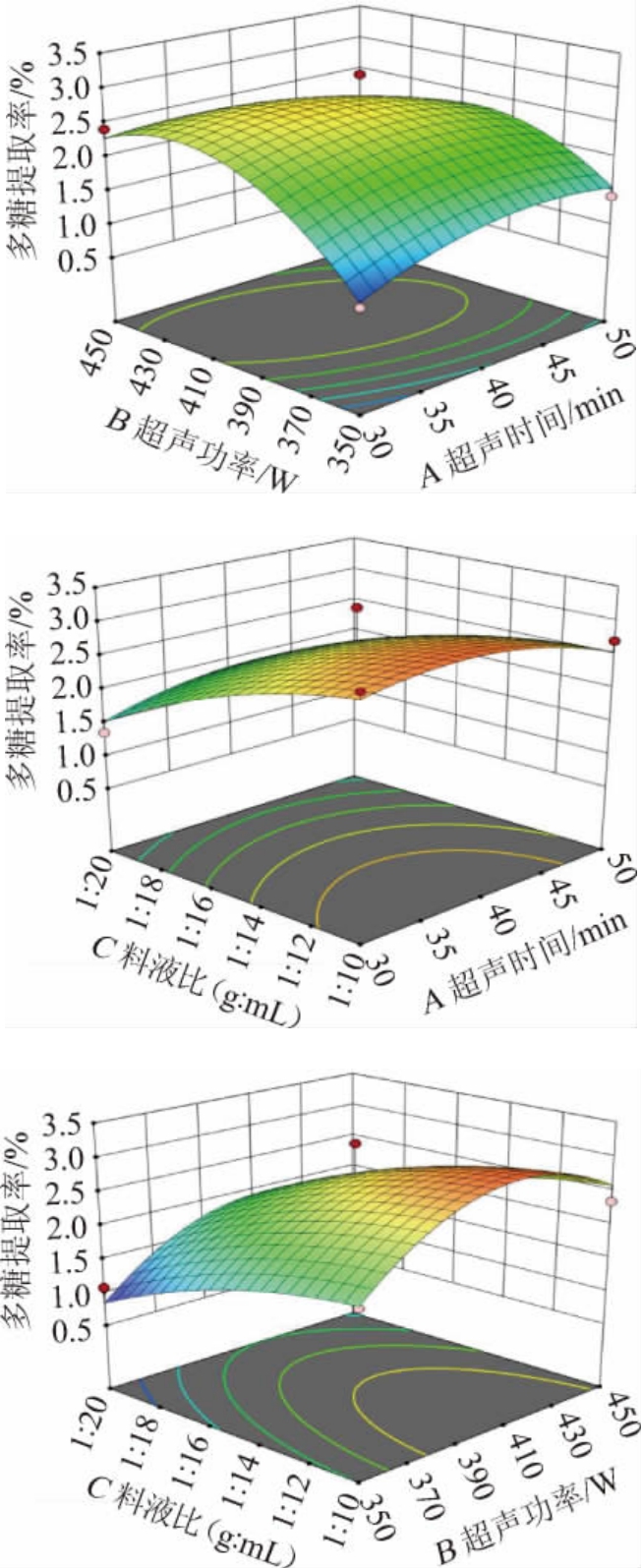
图2 各因素间交互作用对灵芝子实体多糖提取率影响的响应面和等高线
Fig.2 Response surface plots and contour lines of effects of interaction between varions factors on the extraction rates of polysaccharides from Ganoderma lucidum fruit body
响应曲面越陡峭,等高线越趋近于椭圆形,表明二者交互作用越强;反之,响应曲面越平缓,等高线越趋近于圆形,表明二者交互作用越弱。由图2可知,超声时间和超声功率间交互作用对结果影响的响应面,曲面陡峭,等高线为椭圆形,这表明了这两个参数之间交互作用对结果影响显著。反观超声时间和料液比、超声功率和料液比间交互作用对结果影响的响应面曲面平缓,等高线呈圆形,这表明这些参数间的交互作用对结果影响不显著。这与基于回归模型的分析结果是一致的。
2.2.3 验证试验
通过Design-Expert 12.0统计软件对响应面试验数据进行分析,最优提取工艺参数为:超声功率400 W,超声时间40 min,料液比1∶15(g∶mL),超声次数1次。在此条件下,所得灵芝多糖提取率理论值为3.20%。对此优化条件进行3次平行验证试验,多糖提取率实际值为(3.22±0.04)%,与预测值3.20%接近。说明所建立的模型能够有效预测灵芝子实体多糖提取率。
2.3 灵芝子实体多糖对哮喘小鼠的影响
2.3.1 多糖对哮喘小鼠肺泡灌洗液中炎性细胞的影响
多糖对哮喘小鼠肺泡灌洗液中炎性细胞的影响结果见图3。由图3可知,与空白组比较,模型组小鼠支气管肺泡灌洗液中炎性细胞(包括淋巴细胞、中性粒细胞及嗜酸性粒细胞)数量极显著增加(P<0.01);与模型组比较,多糖低、中、高剂量组以及地塞米松治疗组小鼠支气管肺泡灌洗液中淋巴细胞、中性粒细胞、嗜酸性粒细胞的数量均显著或极显著降低(P<0.05,P<0.01),其中高剂量组以及地塞米松治疗组炎性细胞极显著降低(P<0.01)。
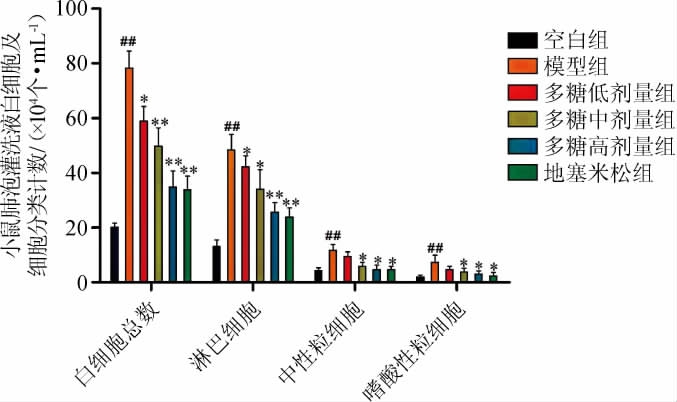
图3 各组小鼠肺泡灌洗液白细胞及细胞分类计数
Fig.3 White blood cells and cell classification count in bronchoalveolar lavage fluid of mice in each group
“##”表示与空白组比较,差异极显著(P<0.01),“*”、“**”分别表示与模型组比较,差异显著(P<0.05)、差异极显著(P<0.01)。下同。
2.3.2 多糖对哮喘小鼠肺泡灌洗液中IL-6及TNF-α水平的影响
多糖对哮喘小鼠肺泡灌洗液中IL-6、TNF-α水平的影响见图4。由图4可知,与空白组比较,模型组小鼠的支气管肺泡灌洗液中IL-6和TNF-α的水平极显著升高(P<0.01);与模型组比较,多糖低、中、高剂量组以及地塞米松治疗组小鼠支气管肺泡灌洗液中IL-6水平均显著或极显著降低(P<0.05,P<0.01),其中,高剂量组以及地塞米松治疗组IL-6水平极显著降低(P<0.01),中、高剂量组以及地塞米松治疗组小鼠支气管肺泡灌洗液中TNF-α水平均显著或极显著降低(P<0.05,P<0.01),其中,高剂量组以及地塞米松治疗组NF-α水平极显著降低(P<0.01)。
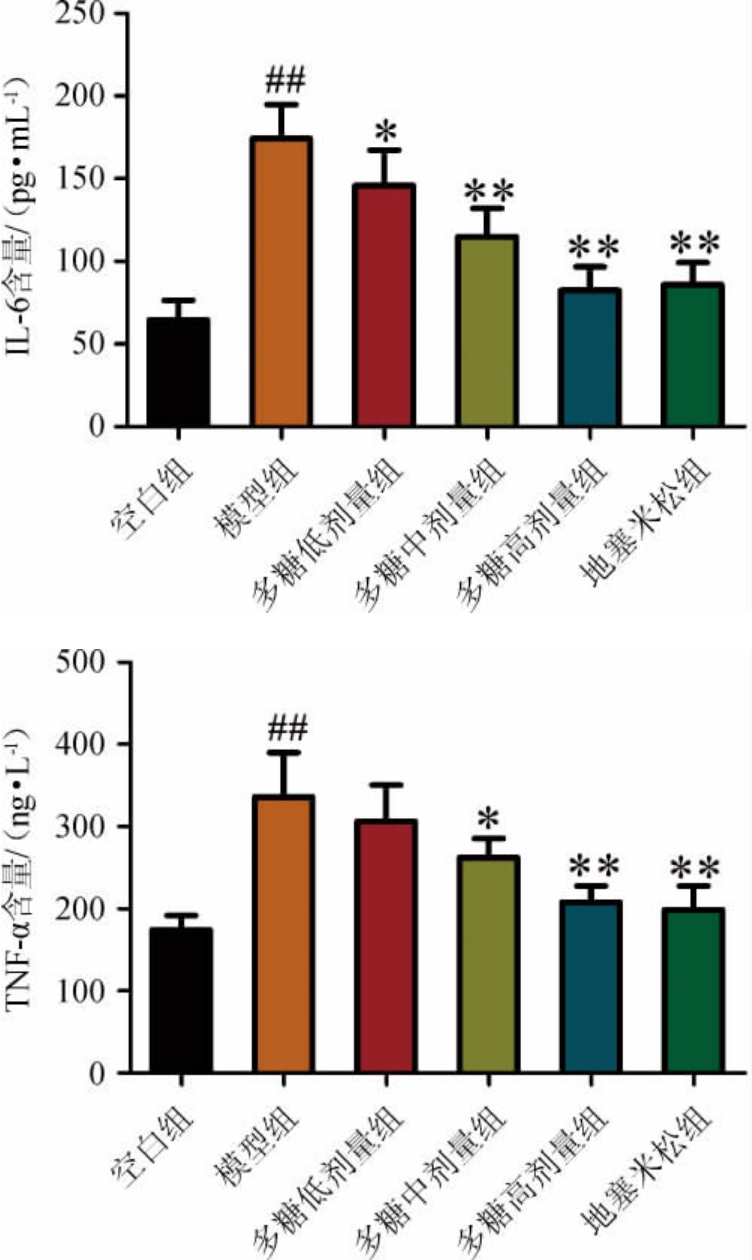
图4 各组小鼠肺泡灌洗液中IL-6及TNF-α水平的检测结果
Fig.4 Detection results of IL-6 and TNF-α levels in bronchoalveolar lavage fluid of mice in each group
2.3.3 多糖对哮喘小鼠肺组织病理形态学的影响
多糖对哮喘小鼠肺组织病理形态学的影响见图5。由图5可知,空白组小鼠肺组织结构完整,未见明显炎性细胞浸润。与空白组比较,模型组小鼠肺组织血管和支气管壁明显增厚,气管黏膜上皮细胞增殖,并伴随大量炎性细胞浸润;与模型组比较,地塞米松给药组小鼠上述病理改变明显改善,多糖低、中、高剂量组小鼠肺组织血管和支气管壁破坏程度逐渐改善,仅见少量炎性细胞浸润,呈现剂量依赖性。
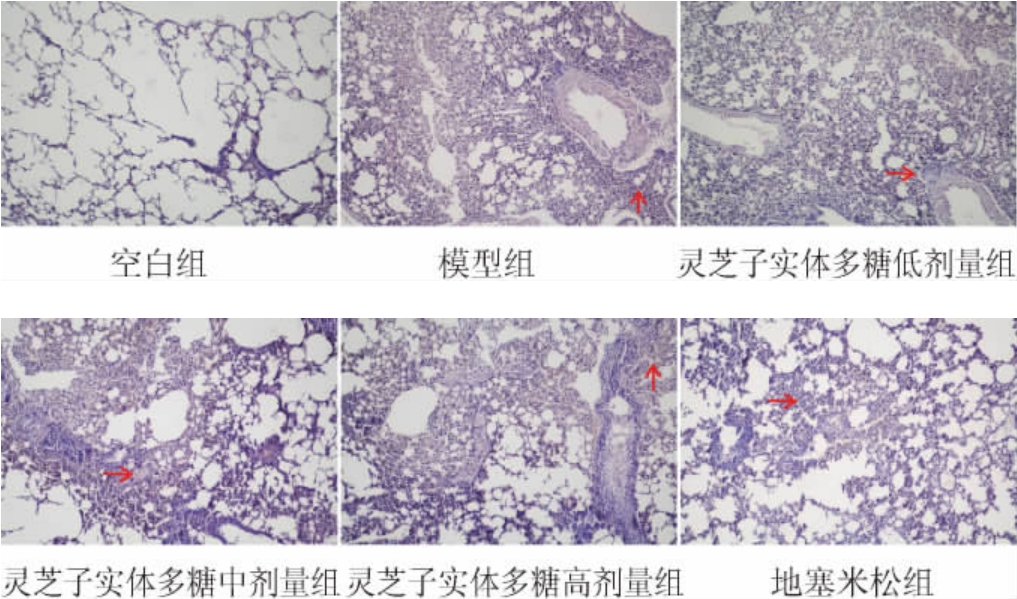
图5 各组小鼠肺组织的苏木精-伊红染色结果
Fig.5 Hematoxylin-eosin staining results of lung tissue of mice in each group
标尺=50 μm,红色箭头:炎性细胞。
3 结论
本研究采用单因素及响应面试验对灵芝子实体的多糖提取工艺进行优化,得出最优提取工艺条件为:超声功率400 W,超声时间40 min,料液比1∶15(g∶mL),超声次数1次。在此优化工艺条件下,多糖提取率可达(3.22±0.04)%,与预测值3.20%接近。灵芝子实体多糖对哮喘小鼠的影响研究结果显示,与空白对照组比较,模型组小鼠肺泡灌洗液中IL-6、TNF-α水平显著升高,同时,肺组织血管和支气管壁明显增厚,并伴随大量炎性细胞浸润等病理改变。与模型组比较,给予灵芝子实体多糖低、中、高剂量和地塞米松治疗的小鼠,其肺泡灌洗液IL-6、TNF-α水平显著降低,并且哮喘相关的病理变化也有所缓解,说明灵芝子实体多糖对哮喘小鼠有改善作用。本研究优化的灵芝子实体多糖的提取工艺稳定可靠,且所得的灵芝子实体多糖提取物可改善哮喘小鼠的炎症反应,机制可能与抑制IL-6、TNF-α的表达有关。
[1]马欣宇,徐蓓蕾,宋辉,等.灵芝化学成分及防治肿瘤的研究进展[J].中国药学杂志,2023,58(16):1437-1446.
[2]谢晓阳,李晓,王伟,等.灵芝子实体多糖发酵工艺条件优化及抗氧化活性[J].食品研究与开发,2023,44(10):107-115.
[3]张汇,聂少平,艾连中,等.灵芝多糖的结构及其表征方法研究进展[J].中国食品学报,2020,20(1):290-301.
[4]祝朋玲,张静,李思雨,等.大孔树脂纯化灵芝子实体和孢子粉中总三萜[J].食品研究与开发,2023,44(4):79-85.
[5]刘静,唐传红,师小凡,等.不同灵芝菌株子实体多糖的特征分析及免疫活性评价[J].食用菌学报,2022,29(5):90-100.
[6]潘少香,赵岑,闫新焕,等.不同品种灵芝子实体及孢子粉元素成分分析及重金属安全性评价[J].现代食品科技,2023,39(2):319-324.
[7]CAMARGO M R D,FRAZON T F,INACIO K K,et al. Ganoderma lucidum polysaccharides inhibit in vitro tumorigenesis, cancer stem cell properties and epithelial-mesenchymal transition in oral squamous cell carcinoma[J].J Ethnopharmacol,2022,286:114891.
[8]LI M,YU L,ZHAI Q,et al.Ganoderma applanatum polysaccharides and ethanol extracts promote the recovery of colitis through intestinal barrier protection and gut microbiota modulations[J].Food Funct,2022,13(2):688-701.
[9]任洪飞,逄梦玉,隋昕怡,等.反复冻融法制备灵芝多糖工艺优化、结构表征及抗氧化活性分析[J].食品工业科技,2024,45(8):11-20.
[10]LI J,GU F F,CAI C,et al.Purification,structural characterization,and immunomodulatory activity of the polysaccharides from Ganoderma lucidum[J].Int J Biol Macromol,2020,143:806-813.
[11]张柳莲,黄清铧,王丽宁,等.响应面优化超声波微波协同提取灵芝子实体多糖工艺[J].食品工业,2023,44(2):45-48.
[12]张博华,张明,范祺,等.蒸汽爆破超声波复合提取灵芝多糖及抗氧化活性[J].食品工业,2021,42(8):125-129.
[13]苗雨欣,刘旭,宁慧娟,等.碱性电解水提取灵芝子实体多糖的工艺优化[J].中国食用菌,2020,39(11):62-67,74.
[14]何红梅,肖上英,吕思敏,等.灵芝粗多糖的提取及临床应用研究[J].广东化工,2023,50(7):47-50.
[15]胡清宇,吕宗立,刘文娟.基于VSIG4/NLRP3炎症复合通路探讨异甘草素对中性粒细胞性哮喘小鼠气道炎症的影响[J].中国临床药理学杂志,2024,40(6):869-873.
[16]余洁,彭哲,谢婷,等.木犀草素对哮喘患儿外周血单核细胞TNF-α和IL-6分泌的影响及机制研究[J].中国免疫学杂志,2019,35(13):1580-1583,1589.
[17]黄柯婷,王志旺,梁可克,等.肿瘤坏死因子-α介导的信号网络调控哮喘气道黏液高分泌的研究现状[J].中国临床药理学杂志,2023,39(9):1344-1348.
[18]时阳.小儿肺热咳喘颗粒联合丙酸氟替卡松治疗小儿支气管哮喘的疗效及对IL-6、IL-8、TNF-α水平的影响探讨[J].中国现代药物应用,2023,17(21):79-81.
[19]刘子菁,从静文,程卓,等.铁皮石斛多糖的提取工艺及对小鼠急性肺损伤改善作用的研究[J].中国药房,2023,34(22):2745-2749.
[20]唐林,赵洪庆,杨蕙,等.百合地黄汤多糖提取工艺优化及抗焦虑抑郁药效评价[J].中国药房,2023,34(8):923-928.
[21]陈牧,白巧云,宋艺兰,等.芒柄花黄素通过DRP1-NLRP3信号通路缓解过敏性哮喘的作用机制[J].中国药理学通报,2024,40(3):529-536.
[22]任佳营,宋桂华,孙萌萌,等.加味小青龙汤影响Treg/Th17细胞失衡改善小鼠哮喘的机制研究[J].时珍国医国药,2024,35(3):532-537.
[23]贾斌,梁思敏.维生素D3对小鼠支气管哮喘气道炎症和氧化应激反应的作用及其分子机制[J].安徽医科大学学报,2024,59(1):58-63.
[24]刘超武,王洁,熊桅,等.疏风通络方对哮喘小鼠模型Eotaxin、CCR3蛋白表达及ERK磷酸化的影响[J].中国实验方剂学杂志,2022,28(14):54-60.
[25]王明月,刘春艳,张宇,等.潞党参对光老化小鼠皮肤中IL-6、TNF-α、IL-15含量及IL-15、IL-15R共表达的影响[J].中华中医药学刊,2020,38(6):143-146,271.