浆水是中国西北部地区一种传统的小吃,芥菜、包菜、芹菜等经温水漂洗干净后,拌以煮沸放凉的面汤水,加入旧浆水作为引子,发酵一周制成[1]。食用浆水可以摄入大量乳酸菌,调节人体肠道菌群,发挥一定的保健作用[2-3]。浆水作为百姓家自制美食,生产没有具体的操作规范和标准。同泡菜一样,浆水发酵底物浓度较低,且在制作保存过程中需要严格控制氧气含量、忌油盐及生水等加入。因此,若当地居民在生产储存过程中操作不当,经常出现浆水乳酸发酵缓慢、蔬菜软化、保藏涨袋的情况[4-5],严重影响浆水的品质及货架期。
区别于常见发酵食品,浆水发酵时不添加或者极少量添加食盐,因此浆水生产和贮藏过程中更容易被杂菌污染[4,6]。杂菌过量分泌各类消化酶,发酵底物中糖类等大分子被急速消耗,蔬菜组织失去Ca2+、Mg2+等金属离子结合[7-8],脆度降低,严重影响浆水口感和食用价值。此外,异常微生物发酵会影响香气物质和乳酸含量导致浆水风味变差[9]。研究表明,梭状芽孢杆菌属(Clostridium)异常发酵会导致浆水产生酪酸臭,青霉菌属(Penicillium)、假单胞菌属(Pseudomonas)等杂菌污染会使泡菜中蔬菜软化,芽孢杆菌属(Bacillus)和酵母菌属(Saccharomyces)异常发酵会引起泡菜包装涨袋[10]。目前对浆水风味物质、营养成分、菌群变化的研究集中在发酵生产阶段[11],鲜有关于浆水保藏品质分析的研究报道。
本研究以贮藏正常浆水(CK)、蔬菜软化浆水(CM)、包装袋膨胀浆水(ZD)为研究对象,分别对其基本理化指标、蔬菜组织结构及细菌菌群多样性进行分析,比较其在理化指标、组织结构及细菌菌群的差异,以期解决浆水贮藏易变质的问题,为浆水的贮藏提供理论依据及技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 浆水
贮藏正常浆水(CK)、蔬菜软化浆水(CM)、包装袋膨胀浆水(ZD)样品各5份:收集自甘肃天水同一厂家不同批次。
1.1.2 试剂
UPLC-W-B300酸性蛋白酶活性检测试剂盒、UPLC-MS-6005 β-淀粉酶活性检测试剂盒、UPLC-W-B402脂肪酶活性检测试剂盒、UPLC-W-B610纤维素酶活性检测试剂盒、UPLC-C-A806食品中亚硝酸盐含量检测试剂盒:上海液质检测技术有限公司;DP302-02 细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技有限公司。K2SO4:天津市风船化学试剂科技有限公司;NaOH:天津市凯通化学试剂有限公司;硫酸、硝酸、盐酸、硼酸:天津市富宇精细化工有限公司;乙醇、甲苯:天津市富宇精细化工有限公司;CuSO4·5H2O、无水乙醚、石油醚:天津市大茂化学试剂厂;甲基红指示剂、溴甲酚绿指示剂、亚甲基蓝指示剂:北京索莱宝科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
K1100自动凯氏定氮仪、SH220F石墨消解仪:济南海能仪器股份有限公司;H2050R离心机:湘仪离心机仪器有限公司;SQP电子天平:赛多利斯科学仪器(北京)有限公司;SHH.W21.420恒温水浴锅:北京科伟永兴仪器有限公司;A3AFG-12原子吸收分光光度计、TU-1950紫外可见分光光度计:北京普析通用仪器有限责任公司;Waters2690液相色谱(liquid chromatography,LC)仪:美国沃特世公司;气相色谱-火焰离子检测器(gaschromatography-flameiondetection,GC-FID)仪:日本岛津公司;SU8100扫描电子显微镜:日本日立公司;T100 Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司。
1.3 分析检测
1.3.1 理化指标检测
粗蛋白的测定:参考GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》[12];粗脂肪的测定:参考GB5009.6—2016《食品安全国家标准食品中脂肪的测定》[13];钙含量的测定:参考GB 5009.92—2016《食品安全国家标准食品中钙的测定》[14];镁含量的测定:参考GB 5009.241—2017《食品安全国家标准食品中镁的测定》[15];亚硝酸盐含量的测定:采用UPLC-C-A806 食品中亚硝酸盐含量检测试剂盒。
1.3.2 消化酶活力的测定
酸性蛋白酶活力的测定:采用酸性蛋白酶活性检测试剂盒;淀粉酶活力的测定:采用β-淀粉酶活性检测试剂盒;脂肪酶活力的测定:采用脂肪酶活性检测试剂盒;纤维素酶活力的测定:采用纤维素酶活性检测试剂盒。
1.3.3 有机酸含量的测定
(1)乳酸含量的测定
乳酸含量采用液相色谱法检测。
标准溶液的配制:精确称量KH2PO4 1.36 g,于1 L双蒸水中溶解,用0.1%磷酸调pH至2.7,用于稀释样品和配制标准溶液。
样品预处理:取3mL适量浆水样品,匀浆后于10000r/min离心10 min,取上清液,适当稀释后过0.22 μm的微孔滤膜,用于乳酸分析。
色谱条件:Xbridge C18色谱柱(4.6 mm×150 mm,5 μm);流动相为0.1%磷酸水溶液(A)∶甲醇(B)=88∶12(V/V);流速0.5 mL/min;柱温30 ℃;检测波长210 nm;进样量10 μL。
定性分析:根据保留时间定性;定量分析:以乳酸的质量浓度(x)为横坐标,峰面积(y)为纵坐标绘制标准曲线,获得标准曲线回归方程,计算浆水样本中乳酸含量。
(2)乙酸、丙酸、丁酸含量的测定
乙酸、丙酸、丁酸含量采用气相色谱法检测。
样品预处理:取浆水样品1 mL,加入200 μL 50%硫酸,再加1 000 mg/L的内标(环己酮)溶液100 μL和乙醚2 mL匀浆1 min,于4 ℃条件下离心(12 000 r/min 10 min),取上清液上机。
色谱条件:KB-FFAP毛细管色谱柱(60.0 m×0.32 mm×0.25 μm),最高温度250.0 ℃;分流模式进样,分流比为5∶1;升温程序为起始温度80℃保持4 min,以10℃/min升至180℃,保持16.00 min;载气为高纯氮气(N2)(纯度>99%);总程序时间为30.00 min;进样体积1 μL。
定性分析:根据保留时间定性;定量分析:根据外标法定量,以乙酸、丙酸、丁酸质量浓度(x)为横坐标,以峰面积(y)为纵坐标绘制标准曲线,获得标准曲线回归方程,计算浆水样本中乙酸、丙酸、丁酸含量。
1.3.4 扫描电镜
参考张文举[16]方法,取浆水中蔬菜,固定液选用2.5%的戊二醛和1%的锇酸,漂洗液选用0.1 mol/L的磷酸缓冲液(pH 7.0),采用不同体积分数乙醇(50%、70%、80%、90%、95%)脱水,用纯醋酸异戊酯置换脱水剂,后临界点干燥,喷镀金属,处理好的样品在扫描电子显微镜中观察蔬菜组织结构。
1.3.5 DNA提取及高通量测序
采集新鲜浆水样本,采用DNA提取试剂盒提取样本DNA,采用细菌16S rDNA V3-V4可变区通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')进行PCR扩增。PCR扩增体系(20 μL):5×TransStart FastPfu缓冲液4 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(2.5 mmol/L)2 μL,上、下游引物(10 μmol/L)各0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,加双蒸水(ddH2O)至20 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃终延伸10 min[17-18]。PCR扩增产物经2%琼脂糖凝胶电泳检测后送往武汉贝纳科技有限公司进行完成可变区序列测序。
1.3.6 序列分析
通过barcode对混样文库进行识别,得到单样本序列数据;采用Trimmomatic v0.39软件进行低质量过滤[19],设置窗口大小为20 bp,窗口内平均质量值>20;采用cutadapt v3.5软件进行引物序列的识别与去除,得到不包含引物的Clean序列。使用DADA2法进行质量过滤,去噪,拼接和去嵌合体等得到扩增子序列变体(amplicon sequence variant,ASVs)[20],得到特征ASV后使用QIIME2(version 2022.3)软件过滤低丰度ASVs,将所有样本以最小序列条数抽平;划分操作分类单元(operational taxonomic units,OTUs)/ASV进行物种注释和丰度分析。
1.3.7 数据处理与统计分析
采用Alpha多样性分析样本物种多样性,Shannon指数和Simpson指数越大代表微生物多样性越高[21]。使用基于weighted unifrac算法的主成分分析(principal component analysis,PCA)和主坐标分析(principal co-ordinates analysis,PCoA)样本的β多样性,比较不同样本微生物菌群结构的差异[22-24]。采用Excel 2013软件处理数据,再用SPSS26.0软件进行单因素方差分析的Duncan检验。用GraphPad Prism 8.0软件绘图。
2 结果与分析
2.1 不同浆水理化指标检测结果
由图1A可知,CM组和ZD组浆水液体中粗蛋白含量分别为0.11%和0.10%,显著高于CK组样品(0.05%)(P<0.05),浆水发酵原液中仅有少量蔬菜及淀粉,同青贮饲料、泡菜制作一样,浆水发酵增加了粗蛋白含量[25]。贮藏过程中异常的浆水粗蛋白含量增加,可能原因是灌装后浆水中微生物菌群处于活跃状态,在包装袋中持续发酵导致[26]。

图1 浆水理化指标检测结果
Fig.1 Detection results of physicochemical indexes of Jiangshui
不同小写字母表示差异显著(P<0.05)。下同。
当食品处于腐败阶段脂肪会出现异常变化[27-28],由图1B可知,CK组、CM组和ZD组浆水中粗脂肪含量分别为0.15%、0.16%、0.14%,各处理组浆水中粗脂肪含量没有显著性差异(P>0.05),其原因可能是浆水发酵料中脂肪含量低。
由图1C可知,CM组浆水和ZD组浆水液体中亚硝酸盐含量均较低,显著低于CK组浆水(P<0.05)。浆水生产是兼性厌氧发酵,且发酵周期短,水中有较多氧气溶解,因此一些硝酸还原菌生长较活跃,导致亚硝酸盐生成[29]。但是随着浆水贮藏时间延长,乳酸菌产生的乳酸可以和亚硝酸盐反应生成亚硝酸分解,另外浆水中微生物能产生亚硝酸盐还原酶,降低亚硝酸含量[30-31]。
由图1D可知,各组浆水样品中Ca2+、Mg2+含量分别为0.076%~0.078%、0.001 9%~0.002 0%,各组之间没有显著性差异(P>0.05),徐萌萌[32]研究表明,益生菌发酵胡萝卜汁后,Ca2+、K+、Na+等微量元素显著增加,可能原因是浆水中蔬菜含量较低,微量元素含量较低,导致差异不明显。微量元素与果胶酸反应生成果胶酸盐可以保持蔬菜脆度,因此,浆水贮藏期间粗蛋白含量会增加,而亚硝酸盐含量会降低,不会影响粗脂肪和金属阳离子含量。
2.2 不同浆水中消化酶酶活力检测结果
由图2A可知,相比CK组浆水,CM组浆水和ZD组浆水液体中酸性蛋白酶、脂肪酶、纤维素酶活力均显著增加(P<0.05)。酸性蛋白酶活力由0.06 U/mL分别上升至0.35 U/mL、0.32 U/mL;脂肪酶活力由10.9 U/mL分别上升至15.0 U/mL、14.3 U/mL;纤维素酶活力由8.5 U/mL分别上升至13.8 U/mL和12.6 U/mL。由图2B可知,相比CK组,CM组、ZD组浆水液体中淀粉酶活力、α-淀粉酶活力均显著增加(P<0.05),淀粉酶活力由10.4 U/mL分别上升至12.4 U/mL、11.7 U/mL,α-淀粉酶活力由8.5 U/mL分别上升至9.8 U/mL、9.7 U/mL;但是β-淀粉酶活力各组之间没有显著性差异(P>0.05)。其原因可能是,贮藏异常的浆水中微生物过量分泌了蛋白酶、脂肪酶和纤维素酶,从而增加溶液中的酶活力[33]。另外浆水发酵过程中微生物产生了水解消化酶[34],浆水原液中的淀粉、纤维等大分子糖类被降解为便于细菌吸收利用的小分子物质。因此,变质浆水中微生物是处于活跃阶段,大量分泌各类消化酶。
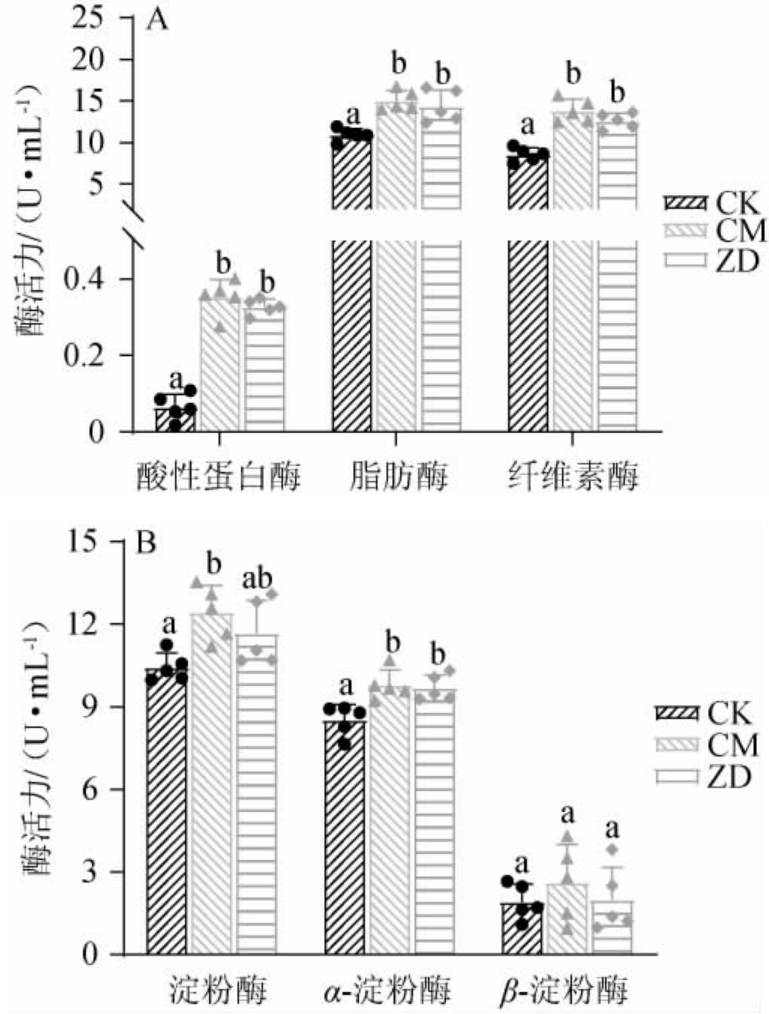
图2 浆水中消化酶酶活力检测结果
Fig.2 Detection results of digestive enzyme activities in Jiangshui
2.3 不同浆水中有机酸检测结果
由图3可知,相比CK组,CM组浆水和ZD组浆水乳酸含量显著降低(P<0.05),由114.7 mg/mL分别下降至25.7 mg/mL和24.2 mg/mL,液体中丙酸含量显著增加(P<0.05),由1.4 μg/mL分别上升至7.2 μg/mL、3.9 μg/mL,乙酸、丁酸含量分别为5.9~8.9 μg/mL、2.7~3.1 μg/mL,各组之间没有显著性差异(P>0.05)。李宏珍等[11]研究表明,发酵阶段浆水中的乳酸含量会逐渐上升,72 h后相对含量在16%以上,研究表明,腌渍产品贮藏不当或长期贮藏其中乳酸浓度会降低[35]。因此,变质浆水中乳酸含量显著降低,不利于浆水防腐[36-38]。
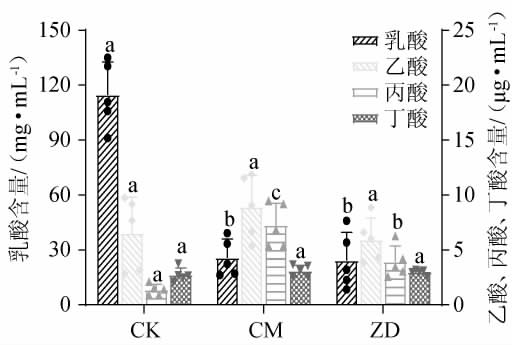
图3 浆水中有机酸含量检测结果
Fig.3 Detection results of organic acid contents in Jiangshui
2.4 不同浆水中蔬菜电镜分析
由图4可知,正常贮藏的浆水中蔬菜组织结构完整,植物细胞壁基本没有破损。CM组浆水蔬菜组织结构出现明显破损,植物细胞壁大量降解损失。ZD组浆水蔬菜组织明显皱缩,整体组织结构失去支撑。泡菜发酵过程中植物细胞壁中果胶通过一系列酶促反应转化为果胶酸,同金属阳离子结合为不溶性盐可保持泡菜脆度。但当发酵液中菌群结构异常会增加果胶酸酶的产生,果胶酸盐被催化为还原糖,植物组织架构破损,表现为蔬菜软化腐烂[7-8]。

图4 浆水中蔬菜扫描电镜检测结果
Fig.4 Detection results of vegetables in Jiangshui by scanning electron microscope
2.5 不同浆水中细菌菌群分析
2.5.1 细菌菌群Alpha多样性分析
由表1可知,3组浆水样本中细菌的Coverage值均>99.9%,因此该测序结果可以解释浆水样品中细菌群落信息。由表1可知,CK组样品Shannon指数均高于CM组、ZD组,CK组样品Simpson指数和ZD组一致,但高于CM组,但是各组没有显著性差异(P>0.05)。贮藏异常浆水中微生物多样性呈下降趋势,和前人所研究变质发酵蔬菜微生物多样性会下降的结果一致[39-40]。
表1 浆水中细菌菌群Alpha多样性分析结果
Table 1 Analysis results of Alpha diversity of bacterial community in Jiangshui

样品编号Shannon指数Simpson指数Coverage值CK CM ZD 4.06±0.43a 3.57±0.62a 3.91±0.40a 0.89±0.03a 0.83±0.07a 0.89±0.02a 0.999 3a 0.999 2a 0.999 3a
2.5.2 细菌菌群Beta多样性分析
由图5A可知,细菌菌群PC1和PC2的方差贡献率分别为61.24%和23.29%,累计方差贡献率为84.53%;由图5B可知,细菌菌群PC1和PC2的方差贡献率分别为69.12%和20.41%,累计方差贡献率为89.53%;说明两种分析的细菌菌群的两个主成分均能解释不同浆水细菌菌群的绝大部分信息[41]。PCA及PCoA结果均表明,CM组、ZD组浆水样品的分布较为集中,且远离CK组浆水,这表明CM组、ZD组浆水样品之间细菌组成较相似,与CK组有较大差异。研究表明,由于杂菌污染会导致泡菜异常发酵[42],微生物的菌群结构会发生改变。细菌β多样性分析表明,涨袋浆水、蔬菜软化浆水菌群结构类似,PCA及PCoA可以将正常浆水及变质浆水区分开。

图5 基于主成分分析(A)和主坐标分析(B)的浆水中细菌菌群Beta多样性分析结果
Fig.5 Analysis results of Beta diversity of bacterial community in Jiangshui based on principal component analysis (A) and principal coordinates analysis (B)
2.5.3 基于门、属水平浆水中细菌菌群结构分析
基于门、属水平不同浆水样品细菌群落组成见图6。由图6A可知,不同浆水样品中相对丰度>0.1%的细菌门有4个,分别为厚壁菌门(Firmicutes)(相对丰度73.04%~89.44%)、变形菌门(Proteobacteria)(相对丰度9.23~25.70%)、拟杆菌门(Bacteroidota)(相对丰度0.23~0.83%)、蓝菌门(Cyanobacteria)(相对丰度0.03~0.39%)。与CK组浆水样品相比,CM、ZD组浆水中厚壁菌门相对丰度显著降低(P<0.05),从89.44%分别下降至73.04%、79.77%,变形菌门相对丰度显著增加(P<0.05),从9.23%分别上升至25.70%、19.83%。拟杆菌门、蓝菌门变化不显著(P>0.05)。厚壁菌门主要细菌为乳杆菌属(Lactobacillus),在浆水发酵中后期,浆水中乳酸大量积累,耐酸性较好的乳酸菌成为优势微生物菌群[7]。变形菌门中醋酸杆菌属(Acetobacter)等具有较强呼和发酵代谢作用,在浆水发酵前期占优势,将葡萄糖等碳水化合物代谢产酸[43]。因此,贮藏异常的浆水中微生物结构发生变化,表现在厚壁菌门细菌相对丰度降低,变形菌门相对丰度增加。

图6 基于门(A)和属(B)水平不同浆水样品细菌群落组成
Fig.6 Composition of bacterial community in different Jiangshui samples based on phylum (A) and genus (B) levels
相对丰度<0.1%归为Others。
由图6B可知,不同浆水样品中相对丰度>0.1%的细菌属有4个,分别为乳杆菌属(Lactobacillus)(相对丰度72.88%~89.21%)、醋酸杆菌属(Acetobacter)(相对丰度7.43%~23.33%)、假单胞菌属(Pseduomonas)(相对丰度0.37%~1.05%)、不动杆菌属(Acinetobacter)(相对丰度0.05%~0.56%)。与CK组浆水相比,CM、ZD组浆水中乳杆菌属相对丰度显著降低(P<0.05),从89.44%分别下降至72.88%、79.69%,醋酸杆菌属相对丰度显著增加(P<0.05),从9.23%分别上升至23.33%、18.67%。假单胞菌属和不动杆菌属相对丰度有增加的趋势,但是没有显著差异(P>0.05)。浆水发酵结束后,发酵液中富含微生物代谢产生的乳酸等有机酸,因此只有可以耐受低pH的微生物可以保留下来[44],研究表明,醋酸杆菌属能引起食品的腐烂[45],因此在贮藏异常的浆水中醋酸杆菌属微生物相对丰度显著增加。变质浆水中假单胞菌属和不动杆菌属比例增加,假单胞菌属和不动杆菌属是重要的腐败菌,同时也是致病菌,表明食用该类浆水有诱发疾病的风险[46]。
3 结论
本研究分析了贮藏正常浆水与变质浆水在理化指标、消化酶活力、组织结构及细菌多样性方面的差异。结果表明,与贮藏正常浆水相比,变质浆水中粗蛋白、丙酸含量及酸性蛋白酶、脂肪酶、纤维素酶、总淀粉酶活力显著增加(P<0.05),亚硝酸盐、乳酸含量显著降低(P<0.05),粗脂肪、Ca2+、Mg2+、乙酸、丁酸含量差异不显著(P>0.05)。扫描电镜结果表明,贮藏浆水中蔬菜细胞壁大量降解损失,整体组织结构失去支撑。多样性分析表明,与贮藏正常浆水相比,变质浆水CM、DZ中的细菌多样性下降,其厚壁菌门(Firmicutes)相对丰度由89.44%下降至73.04%、79.77%,变形菌门(Proteobacteria)相对丰度由9.23%增加至25.70%、19.83%,乳杆菌属(Lactobacillus)相对丰度由89.44%下降至72.88%、79.69%,醋酸杆菌属(Acetobacter)相对丰度由9.23%增加至23.33%、18.67%。本研究可为浆水的贮藏提供理论依据与技术支持。
[1]李慧玲,王彦儒,刘亚平.浆水菜制作及深加工研究进展[J].农产品加工,2020(22):82-86.
[2]赵佳,赵飞燕,沈馨,等.乳酸菌抗氧化活性及其应用研究进展[J].生物技术通报,2023,39(11):182-190.
[3]XU X, QIAO Y, PENG Q, et al.Antioxidant and immunomodulatory properties of partially purified exopolysaccharide from Lactobacillus casei isolated from Chinese northeast sauerkraut[J].Immunol Invest,2022,51(4):748-765.
[4]王丽萍,李珊妮,柴春蓉,等.传统发酵食品浆水工艺对其品质影响研究进展[J].湖北农业科学,2019,58(S1):7-9.
[5]赵勇,刘毕琴,陈骏飞,等.明串珠菌与乳植杆菌复合发酵对低盐泡萝卜品质的影响[J].食品工业科技,2024,45(11):102-109.
[6]孙庆申,王钰涵,韩德权,等.酸菜腌制及保藏方法的研究进展[J].食品安全质量检测学报,2020,11(23):8849-8856.
[7]杜小琴.泡菜软化控制措施研究[D].成都:西华大学,2008.
[8]闫凯.泡菜发酵工艺及保藏性的研究[D].武汉:华中农业大学,2013.
[9]郎鑫崧.酸菜发酵过程中菌群多样性与生物胺演变规律相关性的研究[D].长春:吉林大学,2022.
[10]何玲.浆水芹菜营养功能成分与亚硝酸盐变化规律及加工机理研究[D].杨凌:西北农林科技大学,2007.
[11]李宏珍,贠建民,贾亚莉,等.浆水传统酿制过程中挥发性物质的动态变化[J].食品与机械,2016,32(6):29-33.
[12]王金灿.GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》之5.1凯氏定氮法具体操作疑难解析[J].食品安全导刊,2018(30):54-55.
[13]郑慧.关于缩短GB 5009.6—2016脂肪测定时间的探究[J].食品安全导刊,2018(24):79.
[14]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.92—2016 食品安全国家标准食品中钙的测定[S].北京:中国标准出版社,2016.
[15]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.241—2017 食品安全国家标准食品中镁的测定[S].北京:中国标准出版社,2017.
[16]张文举.高效降解棉酚菌种的选育及棉籽饼粕生物发酵的研究[D].杭州:浙江大学,2006.
[17]金曼芹,罗丹,薛文通.豆酱的风味物质及微生物多样性的研究进展[J].中国酿造,2023,42(11):1-8.
[18]YUAN W,XIAO X,YU X,et al.Probiotic therapy(BIO-THREE)mitigates intestinal microbial imbalance and intestinal damage caused by oxaliplatin[J].Probiotics Antimicrob Proteins,2021,14(1):60-71.
[19]BOLGER A M,LOHSE M,USADEL B.Trimmomatic:a flexible trimmer for Illumina sequence data[J].Bioinformatics,2014,30(15):2114-2120.
[20]CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al.DADA2:Highresolution sample inference from Illumina amplicon data[J].Nat Methods,2016,13(7):581-583.
[21]唐艳平,高秀兵,倪婕,等.白酒发酵副产物黄水原核微生物组成及理化特性研究[J].中国酿造,2024,43(3):72-78.
[22]尹爽,王修俊,田多,等.保脆剂对腌制大头菜质构特性的影响研究[J].中国酿造,2016,35(6):118-121.
[23]邹恬杏,苏伟,母应春,等.洞酿酱香酒第四轮次酒醅发酵过程中微生物群落与挥发性代谢物分析[J].中国酿造,2023,42(6):64-71.
[24]ZHANG Y,SHEN Y,CHENG W,et al.Understanding the shifts of microbial community and metabolite profile from wheat to mature Daqu[J].Front Microbiol,2021,12:714726.
[25]董柯,李霞,魏臻武,等.自然青贮饲草和发酵蔬菜中产乳酸菌的分离鉴定及其特性研究[J].湖北农业科学,2022,61(14):92-101.
[26]朱莉莉,罗惠波,黄治国,等.大头菜等蔬菜腌制工艺研究现状与展望[J].中国酿造,2018,37(7):11-16.
[27]周选围,吴三桥,熊焱,等.腌制蔬菜营养成分的测定[J].氨基酸和生物资源,2000(4):56-58.
[28]赵颖.不同腌制方法对沙葱营养成分的影响[D].呼和浩特:内蒙古农业大学,2015.
[29]赵玉娟,刘才子,高岩松,等.东北酸菜发酵乳酸菌的筛选及评价[J].2024,40(3):121-130.
[30]唐先谱,褚新月,王实玉,等.乳酸菌在泡菜发酵中的研究进展[J].中国食品添加剂,2023,34(12):285-290.
[31]喻凤香,陈煦,林继华,等.蔬菜及其腌制品亚硝酸钠含量变化及阻断技术研究[J].农产品质量与安全,2023(6):69-74.
[32]徐萌萌.益生菌发酵胡萝卜饮料营养特性及其储藏稳定性研究[D].南昌:南昌大学,2016.
[33]AKMAL U,GHORI I,ELASBALI A M.et al.Probiotic and antioxidant potential of the Lactobacillus spp.isolated from artisanal fermented pickles[J].Fermentation,2022,8:328.
[34]饶箐,尼海峰,涂雪令,等.四川泡菜的产品特点及产业技术发展浅析[J].食品与发酵科技,2011,47(4):1-4,9.
[35]谷文荣.萝卜腌渍产品加工关键技术及机理研究[D].郑州:河南农业大学,2015.
[36]JI Q Y, WANG W, YAN H, et al.The effect of different organic acids and their combination on the cell barrier and biofilm of Escherichia coli[J].Foods,2023,12(16):3011.
[37]CAMPOS F M,COUTO J A,FIGUEIREDO A R,et al.Cell membrane damage induced by phenolic acids on wine lactic acid bacteria[J].Int J Food Microbiol,2009,135(2):144-151.
[38]LIU Z, XU C, TIAN R, et al.Screening beneficial bacteriostatic lactic acid bacteria in the intestine and studies of bacteriostatic substances[J].J Zhejiang Univ Sci B,2021,22(7):533-547.
[39]刘鑫,王家旺,隋雨萌,等.中国传统发酵蔬菜中微生物多样性及其对品质形成影响研究进展[J].食品科学,2024,45(10):290-297.
[40]侯新磊,赵楠,葛黎红,等.低温等离子体对低盐泡菜生花腐败的抑制及贮藏期品质的影响[J].食品科学,2022,43(21):282-290.
[41]RIVAS M N,BURTON O T,WISE P,et al.A microbiota signature associated with experimental food allergy promotes allergic sensitizationand anaphylaxis[J].J Allergy Clin Immun,2013,131(1):201-212.
[42]陈露,杜科黎,朱文优,等.苦竹叶提取物对萝卜泡菜品质的影响[J].中国酿造,2023,42(8):186-190.
[43]胡小霞,黄永光,涂华彬,等.酱香型白酒1轮次酿造细菌的菌群结构[J].食品科学,2020,41(14):175-182.
[44]黎蓓蓓,冯书珍,李德军,等.果菜类蔬菜混合发酵菌种筛选及其发酵特性研究[J/OL].食品与发酵工业,2024:1-12[2024-05-31].https://doi.org/10.13995/j.cnki.11-1802/ts.038385.
[45]付咪.腌制蔬菜的脱盐过程、腐败菌菌相分析及基于ε-聚赖氨酸的防腐研究[D].杭州:浙江工商大学,2019.
[46]石金明,王晓明,李凌云,等.黄羽肉鸡屠宰过程中胴体表面腐败菌的变化[J].食品工业科技,2024,45(6):142-149.