食用果蔬酵素是以一种或多种蔬菜、水果以及一些药食同源性植物为原料,通过单一或复合菌种发酵而成的功能性产品[1]。原料在发酵过程中,由于微生物酶作用使组织分解,致使原料细胞中的功能性成分充分释放出来,增强其功效,并有发生分子降解或转化的可能[2],成为人体易于吸收的有效成分。药食两用植物酵素富含有益菌与活性成分,既具有一定的药效作用,又具有营养保健作用,因此,原料细胞中的功能性成分成为酵素产品近几年新的研究热点[1]。
生姜(Zingiber officinale),为姜科姜属多年生植物的新鲜根状茎,是亚洲传统的药食两用植物。生姜富含姜精油、姜辣素、多糖及黄酮类化合物等化学成分[3],具有抗氧化[4]、抗癌[5]、降血脂血压[6]、抗肿瘤[7]、改善心脑血管系统等功效,具有较高的抗氧化活性和多种风味物质。
传统的生姜加工多为腌渍,如糖渍生姜、醋姜、糟姜、蜜汁姜丝等[8]。现今国内外生姜加工产品研究丰富,如桂皮姜糖饮料[9]、姜风味微胶囊[10]、高良姜露酒与姜黄露酒[11]等。与强烈的理化处理方式不同,在温和的微生物发酵作用下转化功能性成分,可以有效地保留营养成分,发酵产物也可以更好地被人体吸收利用[12]。生姜发酵成为酵素的过程中其本身营养得以保留,同时也产生了一些新的活性成分和风味物质。杨艳等[13]鉴定出生姜酵素中的42种风味物质,并对生姜酵素的抗氧化活性进行了检测;周颖等[14]研究发现,姜辣素含量在发酵过程中变化不大,而黄酮类物质呈下降趋势,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率在理想范围内,与总酚含量变化大体相当。国内果蔬酵素饮料的开发逐渐起步,但品种较少,质量不稳定且对其生产工艺的研究还不够深入,因此需要工艺优化并检测其品质,如陈青青[15]研究的复合酵素红参、玉竹、马齿苋、枸杞、柚子、南瓜、生姜、芹菜和山药为原料,制备工艺简单,发酵周期短,具有良好的体内外调节血糖特性;崔国庭等[16]通过响应面法优化并获得了草莓酵素的最佳发酵工艺,研究贮藏过程中草莓酵素体外抗氧化性能的变化规律,为草莓酵素的开发利用和相关研究提供参考。而国外如日韩等国对果蔬酵素的研发已有较长历史,ADEMOSUN M T等[17]评估了生姜果汁饮料的抗氧化性能、血糖指数和碳水化合物水解酶活性。
本研究以生姜为原料,利用乳酸菌和酵母菌复合发酵制备生姜酵素,通过单因素和响应面试验优化生姜酵素发酵工艺条件,并采用1,1-二苯基-2-三硝基苯肼(DPPH)、超氧阴离子自由基清除试验测定生姜酵素的抗氧化能力,探究其生物活性物质与DPPH、超氧阴离子自由基、超氧化物歧化酶(superoxide dismutase,SOD)的Pearson相关性,旨在提高生姜酵素食用和药用价值,为生姜的精深加工提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
小黄姜:购于湖南省永州市商业城果蔬批发市场;乳酸菌(安琪果蔬酵素发酵剂)、安琪果酒专用酵母RW:安琪酵母股份有限公司。
1.1.2 化学试剂
三羟甲基氨基甲烷(trismetyl aminomethane,Tris):天津市大茂化学试剂厂;乙二胺四乙酸二钠(ethylene diamine tetraacetic acid-2Na,EDTA-2Na)、没食子酸标准品(纯度>98%):福晨(天津)化学试剂有限公司;邻苯三酚:合肥巴斯夫生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):福州飞净生物科技有限公司;碳酸钠:湖南汇虹试剂有限公司。试验所用试剂均为分析纯。
1.2 仪器与设备
UV-5500紫外可见分光光度计:上海元析仪器有限公司;YTP388B-28消毒柜:广东科荣电器有限公司;HH-2恒温水浴锅:天津赛得利斯实验分析仪器制造厂;LE104E/02电子分析天平:梅特勒-托利多仪器(上海)有限公司;AXTD4医用离心机:盐城市安信实验仪器有限公司。
1.3 方法
1.3.1 生姜酵素的制备[16]
挑选生长期约200 d,无机械损伤、无腐朽、无病虫害的生姜,用无菌水洗净沥干,按照生姜与无菌水料液比1∶3(g∶mL)去皮打浆,放入灭菌的玻璃坛中,添加一定量的白砂糖,摇匀,然后放入70 ℃水浴锅中巴氏灭菌20 min。冷却后,按照不同接种时序加入0.15%酵母菌和0.15%乳酸菌,放入一定温度的恒温箱中,密封发酵一段时间,每天搅拌1次,1 min/次,即得生姜酵素。将获得的生姜酵素以800 r/min离心5 min,取上清液待测。
1.3.2 生姜酵素发酵工艺优化
(1)单因素试验
选择接种时序(乳酸菌和酵母菌同时添加、间隔24 h变换两种菌剂先后添加顺序),发酵温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃),白砂糖添加量(16%、18%、20%、22%、24%),发酵时间(36 h、60 h、84 h、108 h、132 h)作为自变量,以超氧化物歧化酶(SOD)活性为评价指标进行单因素试验。
(2)响应面试验
在单因素试验结果的基础上,以发酵温度(A)、白砂糖添加量(B)、发酵时间(C)为自变量,以生姜酵素SOD酶活力(Y)为响应值,Box-Behnken试验设计因素与水平见表1。
表1 发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for fermentation process optimization
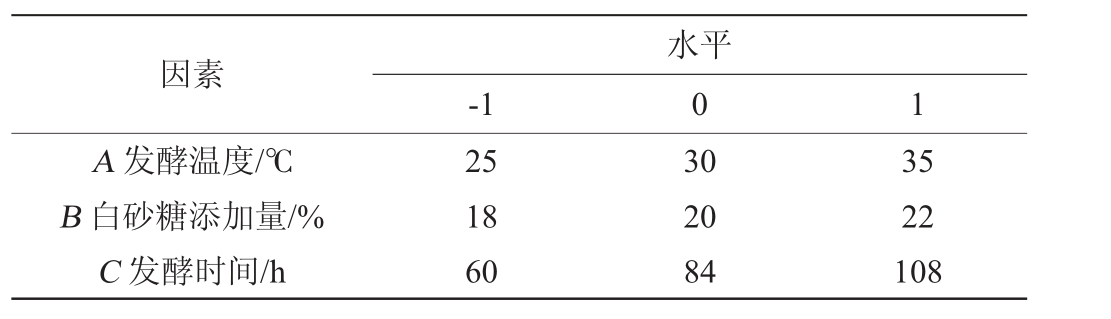
因素A 发酵温度/℃B 白砂糖添加量/%C 发酵时间/h-1水平0 1 25 18 60 30 20 84 35 22 108
1.3.3 分析检测
SOD酶活定义:在25 ℃恒温条件下,每毫升反应液中,每分钟抑制邻苯酚自氧化率50%所需酶量为一个酶活单位(U/mL)。SOD酶活性测定:采用邻苯三酚自氧化法[18];DPPH自由基、超氧阴离子自由基清除率测定:按照参考文献[19-20]方法进行;总酚含量(以没食子酸当量计)的测定:采用福林酚法[21]。
1.3.4 数据处理
试验均进行3次重复操作,采用Origin 8.0绘图,Design-Expert 13.0进行响应面试验数据处理和统计分析,并用SPSS 25.0进行Pearson相关性及显著性分析。
2 结果与分析
2.1 生姜酵素的发酵工艺优化单因素试验结果
2.1.1 接种时序对生姜酵素品质的影响
与单菌种发酵相比,混合菌种发酵更有益于提升酵素的抗氧化能力和活菌数量,而且不同菌种的接种时序对酵素的SOD酶活力也有影响[22]。菌种不同接种时序对生姜酵素SOD酶活力的影响见表2。由表2可知,两种菌同时各接种0.15%,SOD酶活力最小,为55.94 U/mL;先接种0.15%酵母菌、24 h后接种0.15%乳酸菌,SOD酶活力为64.65 U/mL;先接种0.15%乳酸菌、24 h后接种0.15%酵母菌,SOD酶活力最大,为71.83 U/mL;先接种0.15%酵母菌、24 h后接种0.15%乳酸菌,SOD酶活力为64.65 U/mL。这可能是因为乳酸菌对营养物质的利用率较高,酵母菌发酵产生的乙醇可能抑制乳酸菌发酵,乳酸菌与酵母菌是共生关系[23],可以使生姜酵素形成稳定的平衡系统。因此选择先添加0.15%乳酸菌、24 h后添加0.15%酵母菌为发酵的最佳菌种接种时序。
表2 不同接种时序对生姜酵素超氧化物歧化酶酶活力的影响
Table 2 Effects of different inoculation sequences on superoxide dismutase activities of ginger Jiaosu
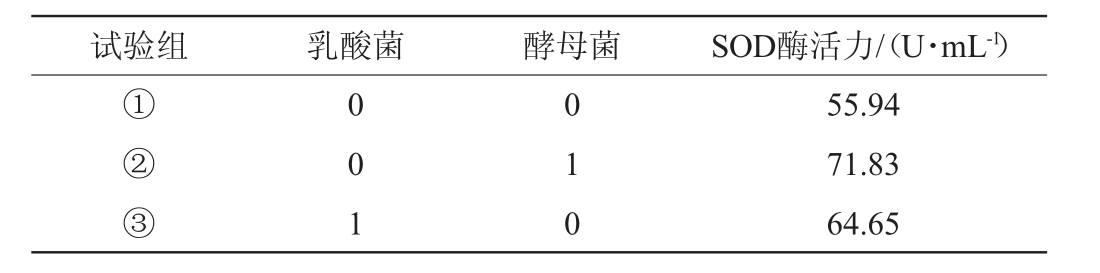
注:0代表0 h接种;1代表24 h后接种。
试验组 乳酸菌 酵母菌 SOD酶活力/(U·mL-1)①②③0 0 1 0 1 0 55.94 71.83 64.65
2.1.2 发酵温度对生姜酵素品质的影响
不同发酵温度对SOD酶活力的影响见图1。由图1可知,随着发酵温度在20~40 ℃范围内上升,生姜酵素的SOD酶活力呈先上升后下降趋势。当发酵温度为20~30 ℃时,生姜酵素的SOD酶活力随之升高;当发酵温度为30 ℃时,生姜酵素的SOD酶活力最高,为72.52 U/mL;当发酵温度>30 ℃之后,生姜酵素的SOD酶活力有所下降。发酵温度过低,抑制了乳酸菌细胞内的生物酶等活性物质,减缓其生长代谢,导致发酵不完全;发酵温度过高,超过了酵母菌的最适宜发酵温度,导致酵母菌发酵能力降低,从而减缓其新陈代谢,降低SOD酶活力[17],且温度过高也会破坏一些不稳定的活性成分,导致释放有机酸,抑制乳酸菌的生长发酵,降低SOD酶活性[23]。因此,选择最佳发酵温度为30 ℃。
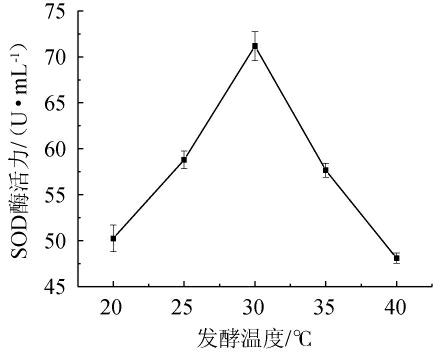
图1 发酵温度对超氧化物歧化酶酶活力的影响
Fig.1 Effect of fermentation temperature on superoxide dismutase activities
2.1.3 白砂糖添加量对生姜酵素品质的影响
不同白砂糖添加量对SOD酶活力的影响见图2。由图2可知,随着白砂糖添加量在16%~24%范围内的升高,生姜酵素的SOD酶活力先上升后下降。当白砂糖添加量为16%~20%时,生姜酵素的SOD酶活力随之升高;当白砂糖添加量为20%时,SOD酶活力最高,为71.97 U/mL;当白砂糖添加量>20%之后,SOD酶活力有所下降。糖度过低,导致微生物生长代谢速率降低,抑制了菌种的繁殖,无法提供足够的碳源给微生物生长;糖度过高,造成了微生物易老化、生长环境渗透压过高等问题,使SOD酶活力下降[24]。因此,选择最佳白砂糖添加量为20%。
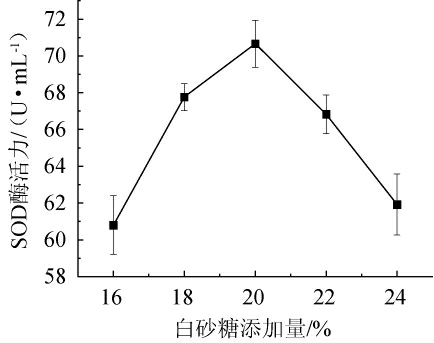
图2 白砂糖添加量对超氧化物歧化酶酶活力的影响
Fig.2 Effect of sugar addition on superoxide dismutase activities
2.1.4 发酵时间对生姜酵素品质的影响
不同发酵时间对SOD酶活力的影响见图3。由图3可知,随着发酵时间在36~132 h内的升高,生姜酵素的SOD酶活力呈先上升后下降趋势。当发酵时间为36~84 h,乳酸菌和酵母菌处于生长代谢旺盛期,SOD酶活力随之逐渐上升;当发酵温度为84 h时,SOD酶活力达到最高,为72.67 U/mL;发酵时间为84~132 h,SOD酶活力在发酵后期显著下降。这可能是在84 h内,乳酸菌和酵母菌处于生长代谢旺盛期,84 h后,乳酸菌和酵母菌不断增加和老化,消耗了营养产物,减少了微生物繁殖,减少次级代谢产物[25],SOD酶活力降低。因此,选择最佳发酵时间为84 h。
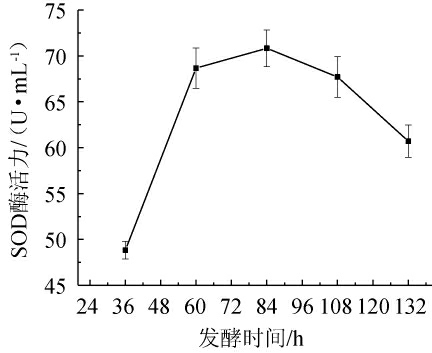
图3 发酵时间对超氧化物歧化酶酶活力的影响
Fig.3 Effect of fermentation time on superoxide dismutase activities
2.2 生姜酵素的发酵工艺优化响应面试验结果
2.2.1 Box-Behnken试验设计和模型拟合
在单因素试验结果的基础上,以发酵温度(A)、白砂糖添加量(B)、发酵时间(C)为自变量,以SOD酶活性(Y)为响应值,采用响应面法优化生姜酵素的发酵工艺,Box-Behnken试验设计及结果见表3,方差分析结果见表4。
表3 发酵工艺优化Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken experiments for fermentation process optimization
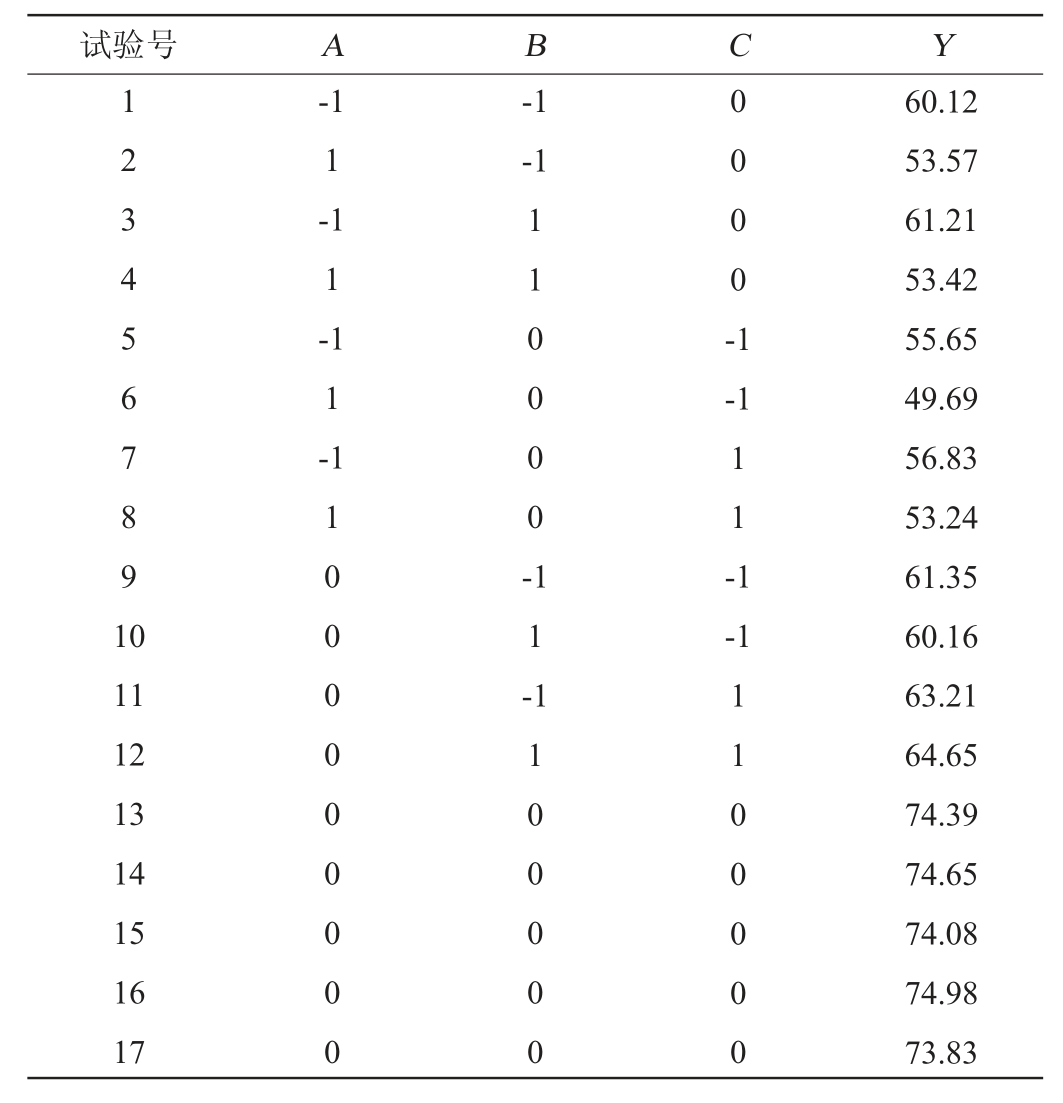
试验号 A B C Y 1 2 3 4 5 6 7 8 9 1 0-1 1-1 1-1 1-1-1-1 0 0 0 0 -1 1 1 0 0 0 0 --1 1 0 0 0 0 0 0 0 0 0 1 1 -1 1 -1-1 11 12 13 14 15 16 17 1 1 0 0 0 0 0 1 1 0 0 0 0 0 60.12 53.57 61.21 53.42 55.65 49.69 56.83 53.24 61.35 60.16 63.21 64.65 74.39 74.65 74.08 74.98 73.83
表4 回归模型方差分析
Table 4 Variance analysis of regression model
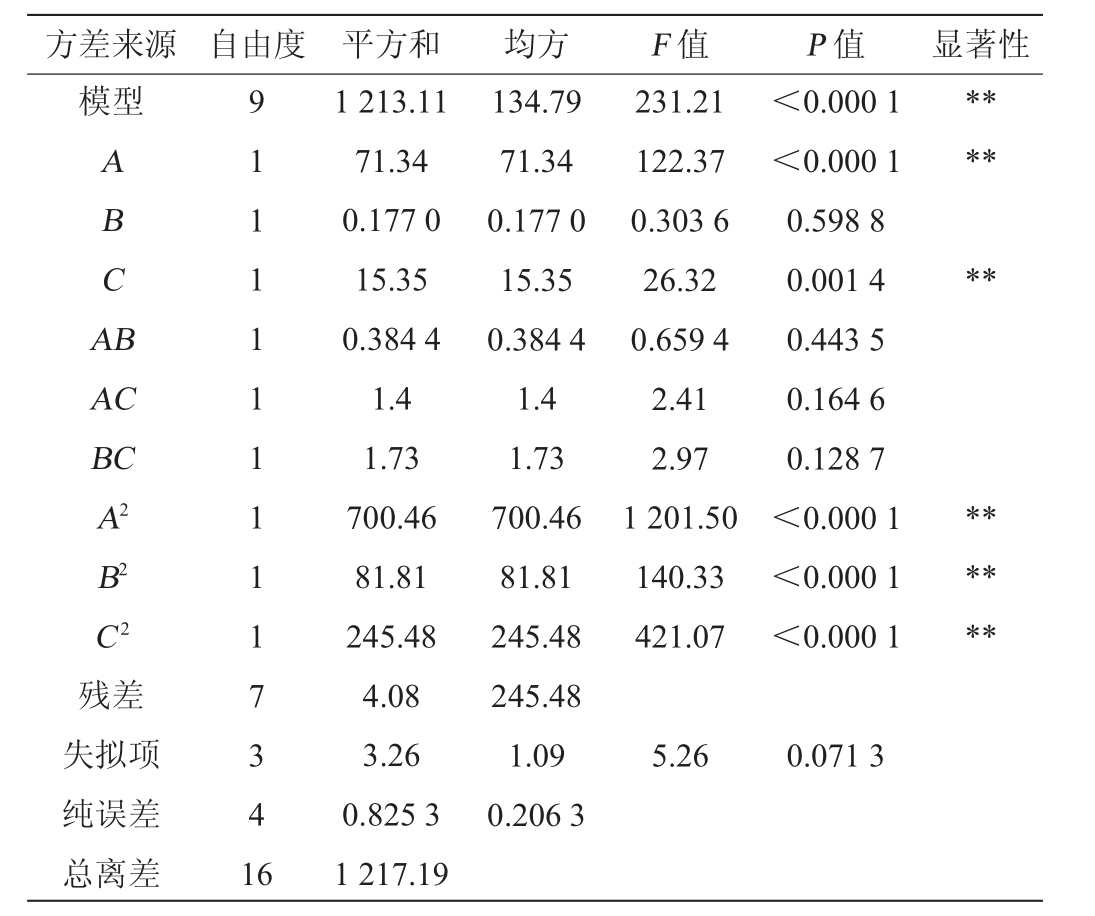
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 自由度 平方和 均方 F 值 P 值 显著性模型******ABCA B AC BC A2 B2 C2残差失拟项纯误差总离差9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 1 213.11 71.34 0.177 0 15.35 0.384 4 1.4 1.73 700.46 81.81 245.48 4.08 3.26 0.825 3 1 217.19 134.79 71.34 0.177 0 15.35 0.384 4 1.4 1.73 700.46 81.81 245.48 245.48 1.09 0.206 3 231.21 122.37 0.303 6 26.32 0.659 4 2.41 2.97 1 201.50 140.33 421.07<0.000 1<0.000 1 0.598 8 0.001 4 0.443 5 0.164 6 0.128 7<0.000 1<0.000 1<0.000 1******5.26 0.071 3
使用Design Expert 13.0对表3数据建立二次回归模型,获得的回归方程式如下:
由表4可知,模型的P值<0.000 1,显示出该模型极显著;失拟项P值=0.071 3>0.05,表明试验结果与回归模型之间具有良好的拟合度;决定系数R2=0.996 6,表示预测值与试验测定数值的拟合度较好;调整决定系数R2adj=0.992 3,说明该回归模型可以反映响应值99.23%的变化。F值越大,说明各因素对生姜酵素SOD酶活性的影响越强,由F值可知,各因素对生姜酵素SOD酶活性的影响程度为:发酵温度(A)>发酵时间(C)>白砂糖添加量(B)。由P值可知,回归模型中一次项A、C,二次项A2、B2、C2对结果影响极显著(P<0.01),一次项B,交互项AB、AC和BC对结果影响均不显著(P>0.05)。
2.2.2 交互作用分析
使用Design-Expert 13.0软件进行分析,得到各因素间交互作用对SOD酶活力影响的等高线和响应面,结果见图4。发酵温度(A)和发酵时间(C),发酵温度(A)和白砂糖添加量(B),白砂糖添加量(B)和发酵时间(C)的交互作用响应曲面坡度平缓,等高线呈圆形,表明二者交互作用对SOD酶活力影响不显著。这与方差分析结果一致。
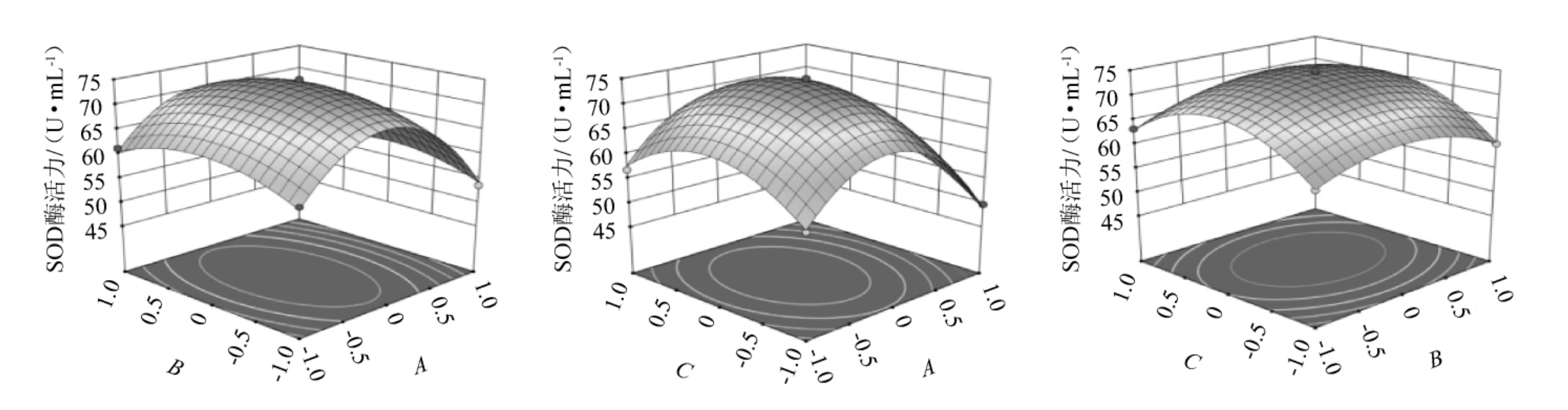
图4 各因素交互作用对超氧化物歧化酶酶活力影响的响应面和等高线
Fig.4 Response surface plots and contour lines of effects of interaction between various factors on superoxide dismutase activities
2.2.3 验证试验
通过Design-Expert 13.0软件分析后,获得最佳发酵工艺条件:先添加乳酸菌0.15%、发酵24 h后添加酵母菌0.15%,发酵温度29.430 ℃,白砂糖添加量20.054%,发酵时间86.085 h。在此条件下,SOD酶活性预测值为74.619 U/mL。考虑实际操作可行性,将发酵工艺参数修正为发酵温度29.5 ℃、白砂糖添加量20%、发酵时间86 h。在此优化条件下进行3次平行验证试验,生姜酵素中SOD酶活性实际值为75.33 U/mL,与预测值偏差较小,表明利用该模型可以预测生姜酵素发酵工艺。
2.3 生姜酵素抗氧化活性测定结果
生姜酵素对DPPH自由基、超氧阴离子自由基清除率测定结果见图5。
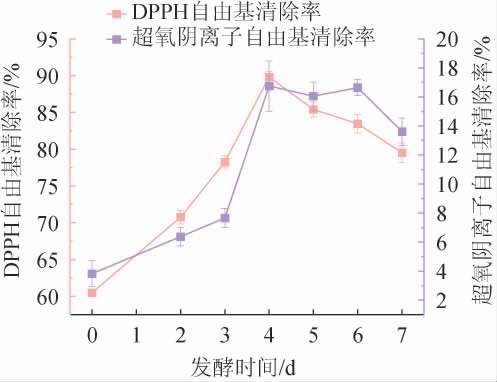
图5 生姜酵素对DPPH自由基和超氧阴离子自由基的清除率
Fig.5 Scavenging rates of ginger Jiaosu on DPPH and superoxide anion free radical
DPPH具有单一电子,可接受电子或氢离子,因此可用于检测供氢能力[26]。由图5 可知,随着发酵时间的增加,生姜酵素对DPPH自由基清除能力先上升后下降。发酵时间为0~4 d时,由于多酚的增加,DPPH自由基清除能力呈上升趋势[27];发酵时间为4 d时,DPPH自由基清除率达到最高,为90.64%。发酵时间为4~7 d时,DPPH自由基清除能力逐渐下降,周颖等[14]研究显示,生姜酵素发酵终期黄酮类物质含量比初期减少了31.87%,可能是总黄酮类物质浓度降低,导致DPPH自由基清除能力减弱。
由图5亦可知,随着发酵时间的增加,生姜酵素对超氧阴离子自由基清除能力先上升后下降。发酵时间为0~4 d时,清除率逐渐上升,可能是由于该生姜酵素黄酮类化合物和SOD的增加,也可能是由于黄酮类化合物分子A环或B环上的多羟基替代和自由的3-羟基替代基都可以呈现出超氧自由基清除率的上升[28]。发酵时间为4 d时,清除率达到最高,为18.69%;发酵时间为4~7 d时,随着发酵过程中黄酮类化合物和SOD逐渐减少,超氧阴离子自由基清除能力逐渐下降。可能是超氧阴离子与黄酮和SOD酶具有浓度依赖性。
2.4 生姜酵素总酚含量测定结果
生姜本身含有大量酚类物质,是一种天然生物活性物质,抗氧化作用明显,自由基清除能力强。本实验考察了最佳发酵条件下生姜酵素中酚类物质的含量,结果见图6。由图6可知,随着发酵时间的延长,总酚含量呈现先上升后下降的趋势。发酵时间为0~4 d时,总酚含量不断上升,分析其原因,一是微生物发酵破坏细胞壁,释放更多酚类物质;二是微生物分泌的酶将一些酚类前体物质转化成酚类物质持续释放出来;三是微生物消耗原料中一些成分合成酚类化合物[29]。发酵时间为4 d时,总酚含量达到最大值0.073 mg/g,而发酵前总酚含量为0.023 mg/g,总酚含量在发酵后增加了3.26倍。发酵时间为4~7 d时,总酚含量下降。一方面是因为一定浓度的酚类化合物有抑菌作用[30],而乳酸菌会为了维持自身生长而降解酚类物质[31],另一方面是由于酚类化合物通过氢键和疏水键与蛋白质、多糖等生物大分子物质结合[32]。
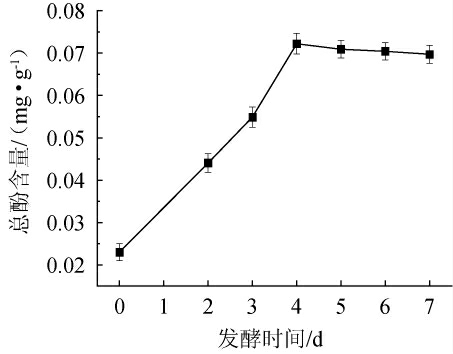
图6 生姜酵素发酵过程中总酚含量变化
Fig.6 Changes of total phenols contents in ginger Jiaosu during fermentation process
2.5 相关性分析
Pearson相关性分析是衡量两个变量之间线性关系强度的一种方法。将总酚含量、DPPH自由基、超氧阴离子自由基清除率、SOD酶活性四个因素进行Pearson相关性分析,结果见表5。
表5 活性成分与抗氧化活性相关性分析
Table 5 Correlation analysis between active ingredients and antioxidant activities
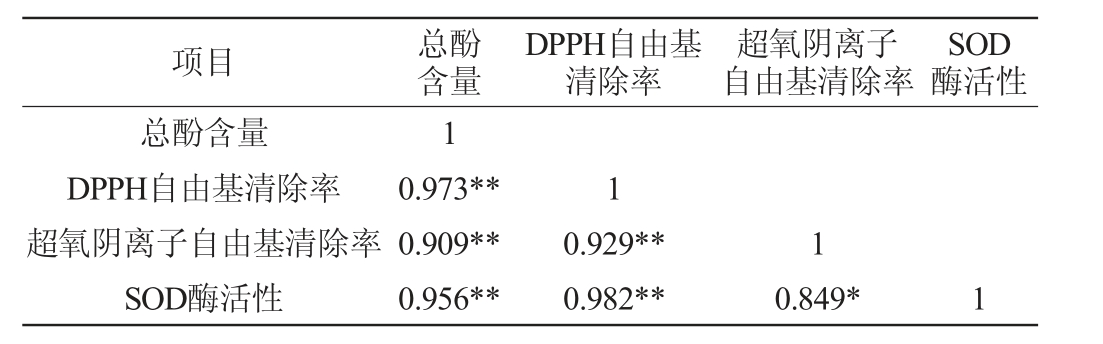
注:“**”表示极显著相关(P<0.01);“*”表示显著相关(P<0.05)。
项目 总酚含量DPPH自由基清除率超氧阴离子自由基清除率SOD酶活性总酚含量DPPH自由基清除率超氧阴离子自由基清除率SOD酶活性1 0.973**0.909**0.956**1 0.929**0.982**1 0.849* 1
由表5可知,总酚含量与DPPH自由基清除率、超氧阴离子自由基清除率、SOD酶活之间极显著正相关(P<0.01);DPPH自由基清除率与超氧阴离子自由基清除率、SOD酶活之间呈极显著正相关(P<0.01);超氧阴离子自由基清除率与SOD酶活之间呈显著正相关(P<0.05)。结果表明,生姜酵素的抗氧化能力与其活性成分密切相关。
3 结论
本研究采用单因素试验和Box-Behnken响应面试验对生姜酵素的发酵工艺进行优化,同时探究生姜酵素的抗氧化活性。优化得到的生姜酵素的最佳发酵工艺条件为:菌种接种时序为先添加乳酸菌0.15%、24 h后添加酵母菌0.15%、发酵温度为29.5 ℃、白砂糖添加量为20%、发酵时间为86 h。在该优化条件下,生姜酵素SOD酶活性为75.33 U/mL。此外,当发酵时间为4 d时,DPPH自由基清除率为90.64%、超氧阴离子自由基清除率为18.69%,总酚含量为0.073 mg/g。相关性分析表明,总酚含量与DPPH自由基清除率、超氧阴离子清除率、SOD酶活性之间存在着极显著的正相关关系(P<0.01);DPPH自由基清除率与超氧阴离子自由基清除率、SOD酶活性之间存在极显著的正相关关系(P<0.01);超氧阴离子自由基清除率与SOD酶活性之间有显著正相关关系(P<0.05)。生姜酵素的抗氧化能力明显高于发酵前,且生姜酵素的抗氧化能力与其活性成分密切相关。本研究为生姜酵素的产业化开发制备提供了参考,此外还需进一步研究在发酵过程中生物活性物质的转化和关系。
[1]饶智,陈彦坤,刘斌,等.“药食同源”植物酵素研究进展[J].食品与发酵工业,2020,46(9):290-294.
[2]胡学智,王薇.漫谈酶营养和酶的养生保健功能[J].工业微生物,2017,47(4):2-78.
[3]吴嘉斓,王笑园,王坤立,等.生姜营养价值及药理作用研究进展[J].食品工业,2019,40(2):237-240.
[4]SI W,CHEN Y P,ZHANG J,et al.Antioxidant activities of ginger extract and its constituents toward lipids[J].Food Chem,2018,239:1117-1125.
[5]REN K W,ZHANG W Z,WU G,et al.Synergistic anti-cancer effects of galangin and berberine through apoptosis induction and proliferation inhibition in oesop hageal carcinoma cells[J].Biomed Pharmacother,2016,84:1748-1759.
[6]SANGHAL A,PANT K K,NATU S M,et al.An experimental study to evaluate the preventive effect of Zingiber officinale(ginger)on hypertension and hyperlipidaemia and its comparison with Allium sativum(garlic)in rats[J].J Med Plants Res,2012,6(25):4231-4238.
[7]DE LIMA R M T,DOS REIS A C,DE MENEZES A P M,et al.Protective and therapeutic potential of ginger (Zingiber officinale) extract and
[6]-gingerol in cancer:A comprehensive review[J].Phytother Res,2018,32(10):1885-1907.
[8]陈艳,杜红霞.生姜营养价值及加工应用研究进展[J].中国果菜,2018,38(12):36-38.
[9]陈致羽,管昭巍,王家镔,等.桂皮姜糖饮的开发及对小鼠免疫调节作用的研究[J].食品工业科技,2020,41(18):135-142.
[10]金旭冉,张剑,王文亮,等.姜风味微胶囊制备与性质研究[J].食品与发酵工业,2024,50(15):112-118.
[11]叶小红,谈文诗,李理.高良姜露酒与姜黄露酒的研制及感官品质分析[J].食品与机械,2018,34(7):183-185,220.
[12]杨雷鹏.微生物发酵对鲜姜汁抗氧化活性影响及混菌发酵生姜黄酒的条件优化[D].太原:山西师范大学,2021.
[13]杨艳,邹诗毅,邱大东,等.生姜酵素理化成分、风味物质及抗氧化性分析[J].食品科技,2022,47(1):132-137.
[14]周颖,韦仕静,葛亚中,等.生姜酵素发酵过程中生物活性成分含量及其抗氧化活性的变化[J].食品工业科技,2018,39(18):39-44.
[15]陈青青.具有血糖调节功效的复合植物酵素的研究[D].沈阳:沈阳农业大学,2023.
[16]崔国庭,王缎,刘向丽,等.响应面法优化草莓酵素的发酵工艺及其生物活性初探[J].食品工业科技,2018,39(9):143-148.
[17]ADEMOSUN M T, OLUFUNMILAYO O, OMOBA S, et al.Antioxidant properties,glycemic indices,and carbohydrate hydrolyzing enzymes activities of formulated ginger-based fruit drinks[J].J Food Biochem,2021,45(3):1-10.
[18]史竞艳,罗辛茹,鲍江鸿,等.超氧化物歧化酶活性的测定[J].湖北大学学报(自然科学版),2012,34(4):373-377.
[19]吴林生,徐德聪.蓝莓酵素加工工艺及其优化研究[J].安徽农业科学,2021,49(7):184-187,202.
[20]杨洋.双菌种发酵山楂酵素及其功能性研究[D].天津:天津农学院,2021.
[21]颜小捷,谷陟欣,卢凤来,等.FOLIN-酚比色法测定裸花紫珠中总酚含量[J].中国实验方剂学杂志,2013,19(18):74-78.
[22]孙嘉蔚,张恩泽,代瀚哲,等.银耳酵素发酵及体外消化对活性物质影响[J].食品工业,2023,44(9):16-22.
[23]刘秀娟,李庆鹏,崔龙,等.混菌发酵苹果酵素工艺研究[J].食品安全质量检测学报,2022,13(1):190-198.
[24]赵敏,王瑜,杨娟,等.天麻酵素的发酵工艺优化与品质评价[J].中国酿造,2022,41(10):177-182.
[25]夏国灯,严成,李林柯,等.采用Box-Behnken设计优化玫瑰花酵素发酵工艺及其抗氧化活性的测定[J].食品工业科技,2021,42(13):193-201.
[26]SIRIVIBULKOVIT K, NOUANTHAVONG S, SAMEENOI Y.Paperbased DPPH assay for antioxidant activity analysis[J].Anal Sci, 2018,34(7):795-800.
[27]LAN Y L,WU J,WANG X J,et al.Evaluation of antioxidant capacity and flavor profile change of pomegranate wine during fermentation and aging process[J].Food Chem,2017,232:777-787.
[28]NAGENDRA PRASAD K,YANG B,DONG X H,et al.Flavonoid contents and antioxidant activities from Cinnamomum species[J].Innov Food Sci Emerg Technol,2009,10(4):627-623.
[29]HUR S J,LEE S Y,KIM Y-C,et al.Effect of fermentation on the antioxidant activity in plant-based foods[J].Food Chem,2014,160:346-356.
[30]CAGNO R D,CODA R,ANGELIS M D,et al.Exploitation of vegetable and fruits through lactic acid fermentation[J].Food Microbiol, 2013,33(1):1-10.
[31]曾莉,赵治巧,樊睿,等.酵母菌和乳酸菌复合发酵木瓜酵素生物活性分析[J].基因组学与应用生物学,2021,40(3):1122-1129.
[32]李江,顾逸菲,王珍珍,等.霍山石斛酵素发酵过程中抗氧化性能的变化[J].中国食品学报,2023,23(3):80-89.