中国传统发酵食醋又称谷物醋,是我国人民日常生活中重要的调味品和功能食品[1]。食醋因地域、酿造原料及酿造技术的不同,分类复杂。食醋依据地域差别可分为东方食醋和西方食醋,在中国、日本、韩国等亚洲地区,主要以淀粉含量较高的高粱、玉米、糯米等谷物为原料,并在醋酸发酵阶段添加谷糠、麸皮、稻壳等辅料,采用固态的、多菌种协同发酵的方式进行酿造;而在欧洲、美洲和东南亚等地区,主要以苹果、葡萄等水果和酒精为原料,通过深层液态发酵工艺进行酿造[2]。我国既是生产食醋的大国,同时也是食醋消费的主力军,根据2018年中国调味品协会数据显示,目前我国食醋年产量接近500万t,而山西食醋年产量约80万t,占比食醋市场的16%[3-4]。山西老陈醋以高粱为原料,麸皮、稻壳等为辅料,经过“蒸、酵、熏、淋、陈”5大工艺酿造而成,其中熏醅和陈酿工艺赋予了山西老陈醋特有的风味[5],使其色泽紫黑明亮,酸味醇厚,具有“酸、香、甜、绵、鲜”的风味[6-7]。
食醋传统发酵工艺造就复杂的微生物群落结构,而微生物群落的多样性和演替是食醋独特风味形成的关键点[8]。山西老陈醋从制作大曲到酒精发酵(alcoholic fermentation,AF)和醋酸发酵(acetic acid fermentation,AAF)过程均为多菌种混合发酵体系,且优势菌群会随着发酵阶段的不同而演替、变化,伴随着微生物与环境相互选择、微生物与微生物之间复杂的相互作用、共同代谢,最终形成多种生物活性物质,赋予了老陈醋独特的风味,深受消费者的青睐[9]。山西老陈醋固态开放式、天然发酵、原料多样(酒醪、稻壳、麸皮)的酿造工艺使得酿造过程中微生物种类繁多,且经过长期适应与驯化,部分微生物在具有较高生产性能的同时,耐受性强、致病性低,分离筛选的菌株可以进一步丰富我国的酿醋菌种资源[10-12]。
本研究采用纯培养技术探究山西老陈醋发酵过程中微生物菌群结构的多样性和演替规律,并从中分离微生物,通过形态学观察及分子生物学技术对分离菌株进行鉴定,以期能够全面解析参与发酵的功能微生物,并为后期人工菌剂的合成提供优良的菌株来源,旨在保留传统老陈醋特色风味的前提下,构建简化而稳定的“人工菌群”,从而为传统发酵食品酿造工艺的转变提供理论依据和借鉴作用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醪、醋醅样品:山西老陈醋集团有限公司。
1.1.2 化学试剂
Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、Ezup柱式酵母基因组DNA抽提试剂盒、DNA Ladder Marker、SanPrep柱式DNA胶回收试剂盒、SanPrep柱式聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒:生工生物工程(上海)股份有限公司;琼脂糖(分析纯)、Fast Pfu聚合酶(5 U/μL)、50×三羟甲基氨基甲烷-乙酸-乙二胺四乙酸(Tris base-acetic acidethylene diamine tetraacetic acid,TAE)缓冲液、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs):索莱宝生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
孟加拉红培养基、MRS培养基:北京索莱宝科技有限公司M8330。
葡萄糖酵母膏碳酸钙(glucose yeast extract calcium carbonate,GYC)培养基[13]:葡萄糖10 g,酵母膏10 g,碳酸钙20 g,琼脂20 g,蒸馏水1 000 mL,pH 4.5。121 ℃高压蒸汽灭菌20 min后加入30 mL的无水乙醇。
营养琼脂培养基[13]:蛋白胨10 g,牛肉膏粉3 g,氯化钠5 g,琼脂15 g,蒸馏水1 000 mL,调整pH为7.3±0.2。121 ℃高压蒸汽灭菌20 min。
以上培养基中不添加琼脂即为液体培养基。
1.2 仪器与设备
FA224电子天平:上海舜宇恒平科学仪器有限公司;STARER3100型酸度计:上海奥豪斯仪器有限公司;BPX-272型电热恒温培养箱:上海博迅实业有限公司医疗设备厂;LS-35LJ型立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;ZQPL-200型立式恒温振荡培养箱:天津莱玻特瑞设备有限公司;DL-CJ-1ND型无菌超净工作台:北京东联哈尔滨仪器设备有限公司;DYY-6C型琼脂糖凝胶电泳仪、DYCP-31DN型电泳槽:北京六一仪器厂;Dy NA Quant 200浓度测定仪:美国Pharmacia Biotech;Chemidoc-It 810凝胶成像系统:英国UVP公司;MINI-smart centrifuge小型离心机:北京昊诺斯生物科技有限公司;5424高速冷冻离心机、7500实时荧光定量PCR仪:美国ABI公司。
1.3 方法
1.3.1 样品采集
山西老陈醋的生产过程大致可以分成三个阶段,即酒精发酵阶段、醋酸发酵阶段和陈酿阶段。其中,酒精发酵阶段为液态发酵,发酵周期为18 d,前2 d进行有氧发酵,后16 d进行无氧发酵;醋酸发酵阶段为固态发酵,发酵周期为9 d,从发酵第2天开始每天上午进行“翻醅”工作,直至发酵结束。随机跟踪3个山西老陈醋正常发酵批次,酒精发酵阶段,每隔1 d搅拌均匀后取300 g左右的酒醪于已灭菌的自封袋中;醋酸发酵阶段,每隔1 d采集距离发酵缸表面20 cm处的醋醅(四个顶点及中心位置)并充分混匀,通过四分法舍去多余的醋醅,最终将300~500 g醋醅样品收集于已灭菌的自封袋中。以上样品均冷藏带回实验室后。
1.3.2 酒醪及醋醅样品基础理化指标的测定
取酒醪或醋醅样品,准确称取10 g,加入90 mL蒸馏水,稀释10倍,静置0.5 h,用纱布过滤后的滤液用于测定各项基础理化指标[13]。pH值的测定:将酸度计直接插入滤液中检测样品的pH值;总酸含量的测定:参照GB/T 5009.41—2003《食醋卫生标准的分析方法》;总酯、还原糖含量的测定:参照GB 19777—2013《原产地产品山西老陈醋》;氨基酸态氮含量的测定:参照GB/T 5009.39—1996《酱油卫生标准的分析方法》;不挥发酸含量的测定:参照GB 18187—2000《酿造食醋》;酒精度的测定:采用蒸馏法。
1.3.3 主要微生物的计数方法[13]
霉菌、酵母菌的计数:采用孟加拉红培养基及平板稀释涂布法;乳酸菌的计数:采用MRS培养基及双层平板浸注法;醋酸菌的计数:采用GYC培养基及碳酸钙溶钙圈法;芽孢杆菌的计数:采用营养琼脂培养基及热致死法。
1.3.4 山西老陈醋发酵过程中主要微生物的分离及纯化
取10 g混匀样品放入装有玻璃珠和已灭菌的90 mL无菌生理盐水的250 mL三角瓶中,120 r/min振荡20 min,即得到样品10-1稀释液,取5支已灭菌装有9 mL无菌生理盐水的试管,依次制成10-2~10-6稀释液,取稀释度为10-3、10-4、10-5、10-6的稀释液0.1~0.2 mL,涂布于不同种类的筛选培养基上(MRS、GYC、营养琼脂、孟加拉红培养基等),每个稀释度做3个重复。真菌平板倒置于30 ℃(细菌37 ℃)恒温培养箱培养2~3 d,挑取长势良好、分布密度大但形态不同的单菌落进行纯化。将经过2~3次纯化后的菌株接种于斜面培养基中,30 ℃恒温培养18~24 h,置于4 ℃冰箱中保存。对于需要长期保藏的菌株,细菌和酵母菌可以采用甘油管冷冻保藏法,霉菌用沙土管保藏法。
1.3.5 菌种鉴定
形态学鉴定:将菌种进行革兰氏染色,用显微镜观察菌种的个体形态;观察菌落形态,记录各菌株的形态特征。
分子生物学鉴定:按照SK8255 Ezup柱式细菌基因组DNA抽提试剂盒及SK8257 Ezup柱式酵母基因组DNA抽提试剂盒说明书提取分离菌株的基因组DNA,以其为模板,采用引物27F(5'-AGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增细菌的16S rDNA基因序列;采用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')PCR扩增酵母菌的26S rDNA D1/D2区基因序列。PCR扩增体系:基因组DNA 2 μL、上下游引物(10 μmol/L)各1 μL、2×Tap PCR Master Mix 25 μL,添加无菌双蒸水(ddH2O)定容至50 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,循环30次;72 ℃最终延伸7 min,4 ℃保存。将PCR扩增产物委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,对分离菌株进行鉴定。
1.3.6 数据处理与统计分析
每个试验重复3次,采用Excel 2013软件和SPSS19.0软件进行数据分析。
2 结果与分析
2.1 山西老陈醋发酵过程中理化指标及温度的变化
2.1.1 酒精发酵过程中理化指标及温度的变化
山西老陈醋酒精发酵阶段酒醪样品理化指标的动态变化见图1。由图1可知,在酒精发酵过程中,酒精发酵前2 d属于有氧发酵,此时酒醪中的营养物质(主要来自于高粱和大曲)充足,好氧微生物的增殖及代谢非常旺盛,发酵1 d后,酒醪的温度迅速由25.9 ℃(室温)上升至33.5 ℃,同时还原糖含量和pH迅速下降。酵母菌在酒精发酵阶段占主导优势,通过代谢产生大量乙醇,因此发酵液中的乙醇含量上升较快[14]。酒精发酵前期,酒醪中的乙醇含量快速积累,并在发酵第13天时达到峰值,酒精度达到8.65%vol,稳定一段时间后,从发酵16 d开始下降,预示着酒精发酵结束。酒醪中的高酒精度对产酸微生物的代谢具有一定的抑制作用,因而其总酸含量呈现缓慢增加趋势,由发酵第1天的0.726 g/100 mL增长至发酵第18天的1.831 g/100 mL。酒醪pH呈缓慢下降趋势,基本稳定在3.22~3.95之间。
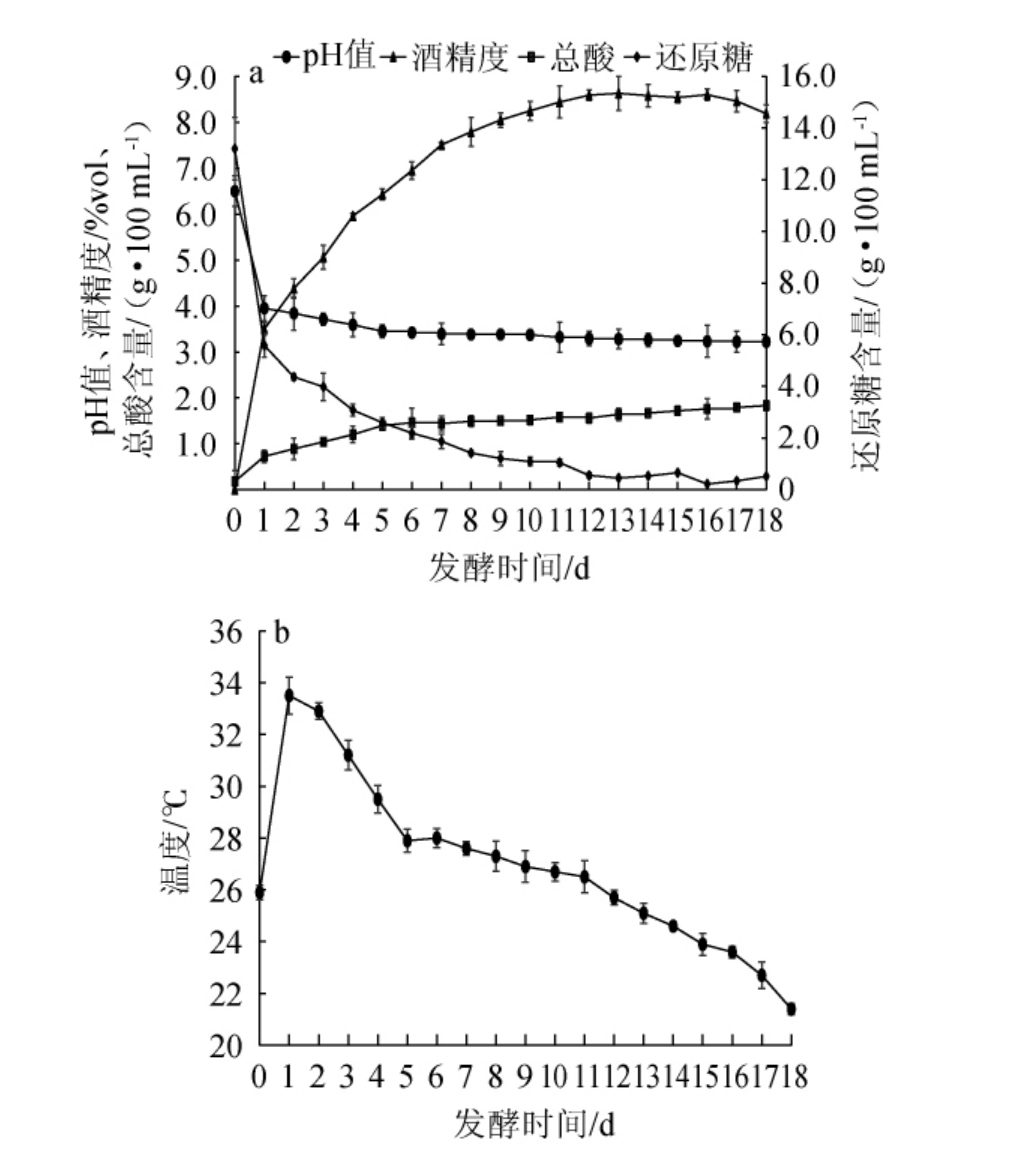
图1 山西老陈醋酒精发酵阶段酒醪样品理化指标(a)及温度(b)的动态变化
Fig.1 Dynamic change of physicochemical indexes (a) and temperature (b) of Jiulao samples during alcoholic fermentation process of Shanxi aged vinegar
2.1.2 醋酸发酵过程中理化指标及温度的变化
为了解山西老陈醋醋酸发酵的表型特征,对醋酸发酵过程中醋醅的基本理化指标进行测定,结果见图2。醋醅的含水量会影响醋醅空气含量和醋醅水分活度,从而影响微生物的分布与活动[15]。由图2可知,整个醋酸发酵过程中,醋醅的含水量基本稳定在60%~63%,变动幅度不大,这是由于麸皮和稻壳吸水性和持水性都很强,可保证醋醅的持水量,有益于微生物的生长代谢以及风味物质的生成[15]。总酸和pH是醋酸味的重要影响因素。总酸可以反映醋中有机酸的总量,有机酸电离后,阴离子影响酸味的类别;pH所反映的H+浓度决定着酸味的强弱[12]。由图2可知,在醋酸发酵阶段,总酸含量呈现增长趋势,总酸含量从发酵第1天的1.28 g/100 mL增长发酵结束时的6.07 g/100 mL;虽然醋醅的总酸含量在上升,但其pH却较稳定,基本维持在3.62~3.96范围内,微生物的代谢和繁殖基本处于一个平衡的状态。究其原因可能是乳酸、柠檬酸、酒石酸等不挥发酸和氨基酸等物质对乙酸具有明显的缓冲作用,因而造成总酸上升,pH较稳定的结果。
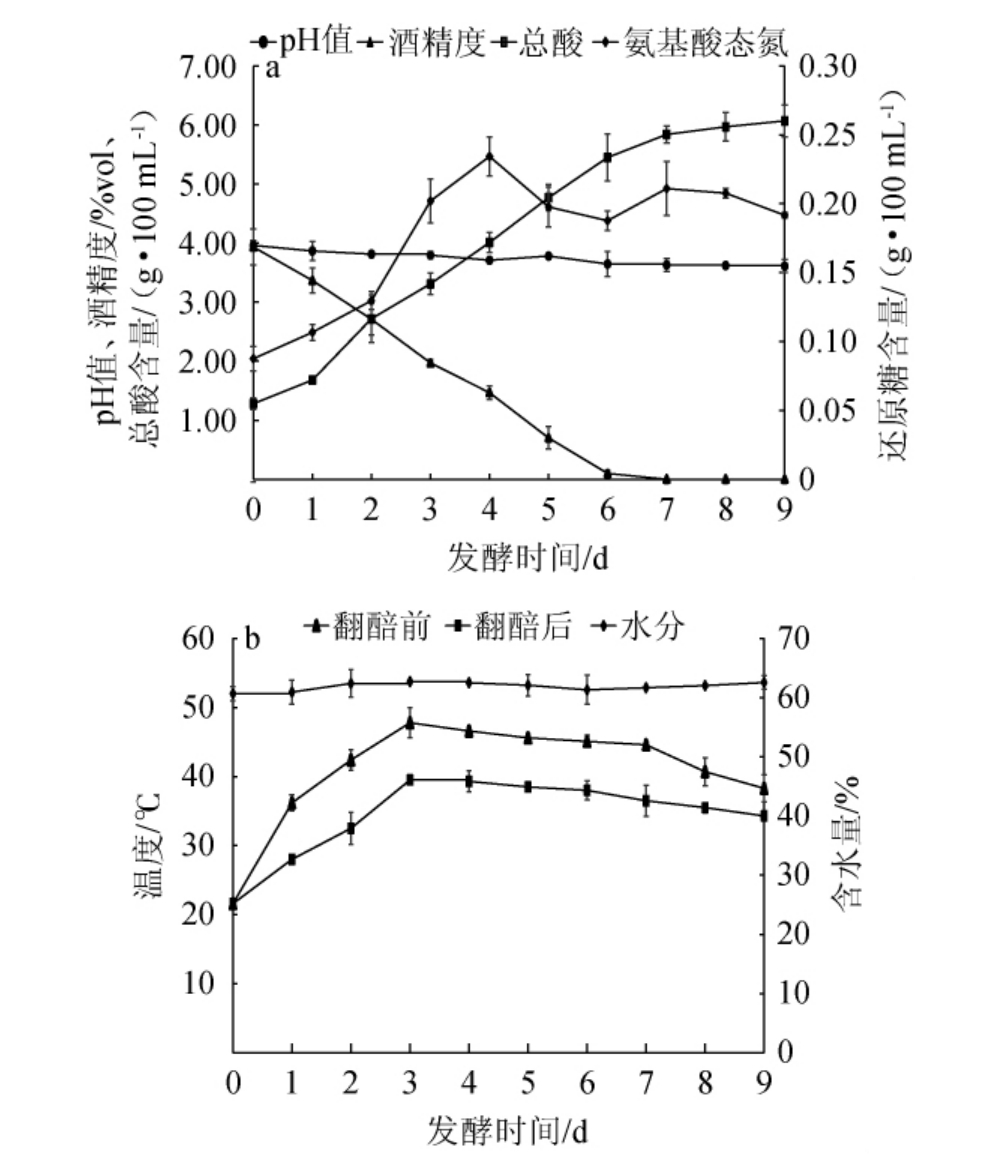
图2 山西老陈醋醋酸发酵阶段醋醅样品理化指标(a)及温度(b)的动态变化
Fig.2 Dynamic change of physicochemical indexes (a) and temperature (b) of Cupei samples during acetic acid fermentation process of Shanxi aged vinegar
由图2亦可知,醋酸发酵第6天时,醋醅的酒精度已趋近为0。翻醅前后醋醅温度的变动趋势一致,均呈先上升后下降趋势,并在发酵第3天达到峰值(翻醅前47.8 ℃)。山西老陈醋采用发酵第2天或第3天的醋醅进行接种,由于种醅中的醋酸菌、乳酸菌处于生长旺盛期,主要通过增加乙酸离子浓度和降低细胞质pH值,破坏跨膜质子梯度,产生代谢解偶联,能有效抑制杂菌的生长[16-17]。接种后,醋醅总酸含量呈现增加趋势,并在第9天达到最大值(6.07 g/100 mL)。随着发酵时间的延长氨基酸态氮含量呈缓慢上升趋势,其增长来源于微生物对原料中蛋白质的水解[18]。由于氨基酸是两性物质,是很好的天然缓冲盐,氨基酸态氮含量的增加,可以增强固态发酵醋醅发酵体系的缓冲能力,利于稳定体系pH值使发酵顺利进行。
2.2 山西老陈醋发酵过程中主要微生物数量的变化
2.2.1 酒精发酵过程中主要微生物数量的变化
采用不同培养基对山西老陈醋酒精发酵过程中的微生物进行培养计数,结果见表1。由表1可知,酒精发酵阶段,霉菌数量略微增长后呈下降趋势,发酵1 d时最高,达5.03×105 CFU/g。在食醋的酿造过程中,霉菌的主要功能是分泌蛋白酶、淀粉酶、糖化酶等,将淀粉、蛋白质等大分子物质降解成葡萄糖、多肽、氨基酸等小分子物质,为其他微生物提供营养和发酵底物[19]。霉菌仅存在于酒精发酵的前期,从发酵第9天开始至发酵结束,酒醪中未分离到霉菌。分析原因可能是,从第3天开始进行封口发酵,酵母菌在缺氧条件下主要进行无氧发酵,将单糖转化为乙醇,同时生成CO2,随着酒精发酵的进行,酒醪中酒精度逐渐升高加上低氧的环境,不再适合霉菌的生长,故而其数量逐渐减少并最终消亡。
表1 山西老陈醋酒精发酵过程中主要微生物数量的变化
Table 1 Changes of main microorganisms number of Shanxi aged vinegar during alcoholic fermentation process
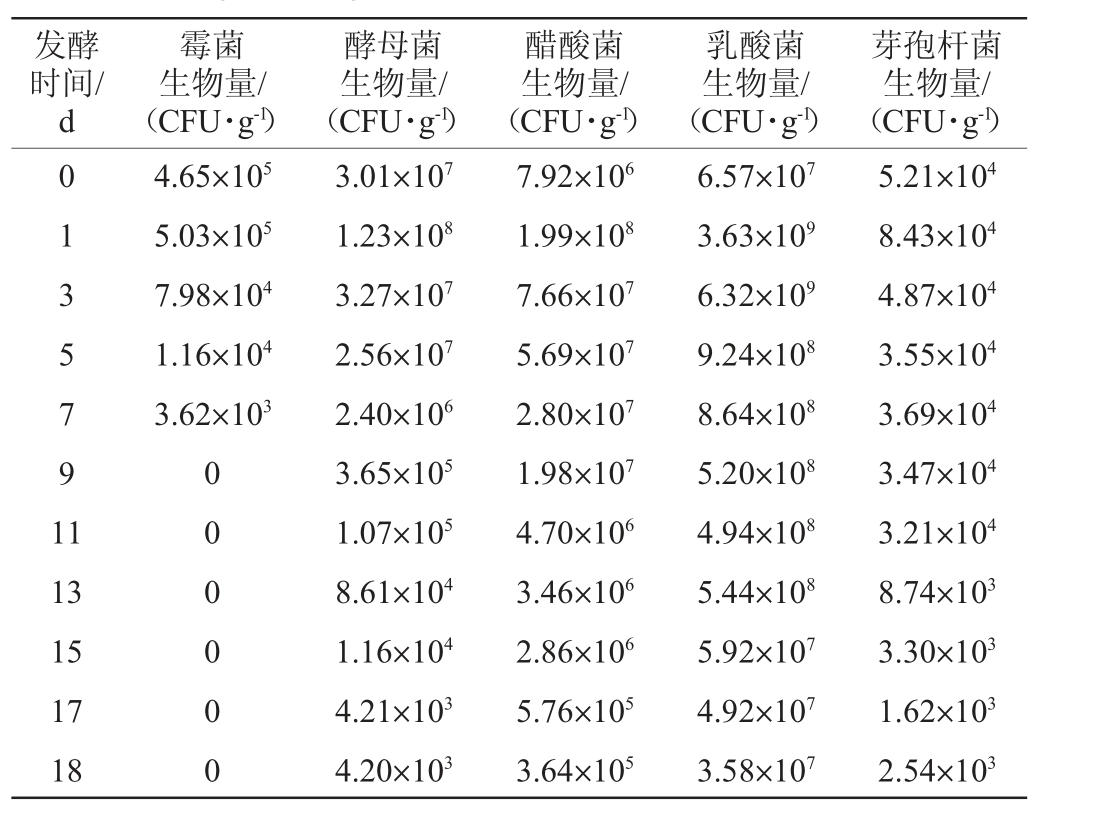
发酵时间/d霉菌生物量/(CFU·g-1)酵母菌生物量/(CFU·g-1)醋酸菌生物量/(CFU·g-1)乳酸菌生物量/(CFU·g-1)芽孢杆菌生物量/(CFU·g-1)0 1 3 5 7 9 1 1 4.65×105 5.03×105 7.98×104 1.16×104 3.62×103 13 15 17 18 0 0 0 0 0 0 3.01×107 1.23×108 3.27×107 2.56×107 2.40×106 3.65×105 1.07×105 8.61×104 1.16×104 4.21×103 4.20×103 7.92×106 1.99×108 7.66×107 5.69×107 2.80×107 1.98×107 4.70×106 3.46×106 2.86×106 5.76×105 3.64×105 6.57×107 3.63×109 6.32×109 9.24×108 8.64×108 5.20×108 4.94×108 5.44×108 5.92×107 4.92×107 3.58×107 5.21×104 8.43×104 4.87×104 3.55×104 3.69×104 3.47×104 3.21×104 8.74×103 3.30×103 1.62×103 2.54×103
酵母菌、醋酸菌及乳酸菌在酒精发酵初始阶段快速增长,发酵1 d时,酵母菌和醋酸菌的生物量均达到最大值,分别为1.23×108 CFU/g、1.99×108 CFU/g,发酵3 d时,乳酸菌数量达到最大值,为6.32×109;之后随着酒醪中酒精的积累以及发酵底物的消耗,微生物数量呈缓慢下降趋势,至发酵结束时,生物量分别为4.20×103 CFU/g、3.64×105 CFU/g和3.58×107 CFU/g。芽孢杆菌(Bacillus)在酒精发酵阶段的生物量变化不明显,其生物量基本维持在1.62×103~8.43×104 CFU/g之间。
酵母菌的培养温度应控制在28~30 ℃,发酵温度则控制在30~33 ℃[20]。结合图1可知,酒醪的初始温度为25.9 ℃,适宜酵母菌的繁殖,在酒精发酵阶段,最高发酵温度为33.5 ℃(第2天),这时需要采取冷水降温,从而保障酵母菌正常代谢,生成酒精。因此,掌握发酵过程中微生物的主要种类很关键,研究它们的生长代谢特性也是非常有必要的,这样才能指导生产实践,促使酿醋生产工艺由人工化向机械化转变。酵母菌在酒精发酵阶段前中期大量存在,其代谢产物乙醇不仅可以作为醋酸发酵阶段的前体物质,同时还能抑制发酵体系中的杂菌,维持正常发酵。
2.2.2 醋酸发酵过程中主要微生物数量的变化
由表2可知,在醋酸发酵过程中,未检测到霉菌;酵母菌的生物量呈下降趋势并逐渐消亡,至发酵结束时醋醅中未分离到酵母菌;细菌(醋酸菌、乳酸菌、芽孢杆菌)生物量呈先上升后下降的趋势,发酵第3天时其生物量达到最大。醋酸菌利用乙醇转化成乙酸时,会释放生物热,温度是反映醋醅微生物代谢是否旺盛的一个重要指标[21],当细菌生物量达到最大时,醋醅的中心温度也到达峰值47.8 ℃(图2)。在醋酸发酵阶段,醋醅环境逐渐变得适合产酸菌而抑制霉菌和酵母菌的生长,细菌是此阶段的优势菌群。山西老陈醋将上一批次微生物代谢最为旺盛的优良醋醅,以10%的量接种至新鲜入缸/池的醋醅中,期间不再接种任何外源的微生物,这种独特的“接种”工艺,使得不同批次醋醅中的微生物群落结构都较为稳定,也是食醋品质保持稳定性的内在因素之一[22]。本试验也从微生物层面验证了生产中为什么要选取发酵第2天或第3天的醋醅作为种醅来进行接种,此时醋醅中的微生物增殖、代谢最为旺盛,且微生物数量基本达到峰值。将其作为发酵剂接种后更有利于醋酸发酵高效、平稳启动,同时还可以减少杂菌滋生,促使发酵顺利进行。
表2 山西老陈醋醋酸发酵过程中主要微生物数量的变化
Table 2 Changes of main microorganisms number of Shanxi aged vinegar during acetic fermentation process
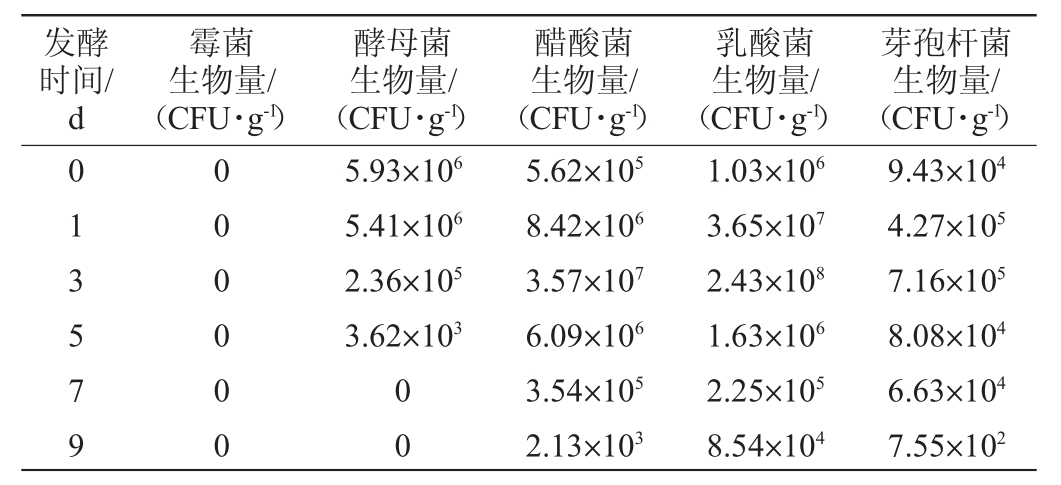
发酵时间/d霉菌生物量/(CFU·g-1)酵母菌生物量/(CFU·g-1)醋酸菌生物量/(CFU·g-1)乳酸菌生物量/(CFU·g-1)芽孢杆菌生物量/(CFU·g-1)013579 000000 5.93×106 5.41×106 2.36×105 3.62×103 00 5.62×105 8.42×106 3.57×107 6.09×106 3.54×105 2.13×103 1.03×106 3.65×107 2.43×108 1.63×106 2.25×105 8.54×104 9.43×104 4.27×105 7.16×105 8.08×104 6.63×104 7.55×102
醋酸发酵过程中的主要微生物中,乳酸菌的含量远高于醋酸菌,说明乳酸菌也同样是醋酸发酵阶段中的不可或缺微生物之一。乳酸菌对于山西老陈醋的重要作用主要表现为乳酸菌发酵葡萄糖生成的乳酸、琥珀酸、柠檬酸等有机酸对乙酸刺激性气味具有一定的缓冲作用,使食醋的口感变得醇香、柔和[23];乳酸菌代谢的中间产物丙酮可作为其他众多风味物质的前体物质,乳酸和醇类经酯化反应形成酯类物质,共同赋予食醋浓郁的香味;乳酸及其他产酸菌生成的酸类物质能够降低酿造过程中酒醅及醋醅的pH,有效的抑制杂菌生长[24],保证食醋酿造过程顺利、有序的进行。
2.3 山西老陈醋发酵过程中主要微生物的分离鉴定
2.3.1 菌株分离及形态学观察
山西老陈醋的整个发酵过程依赖于不同种类的微生物及其代谢产生的各种酶系的作用才得以进行。通过纯培养技术从山西老陈醋的酒醪和醋醅样品中共分离出83株真菌和158株细菌。典型的微生物菌落及细胞形态分别见图3和图4。

图3 部分分离菌株的菌落形态
Fig.3 Colony morphology of some isolated strains
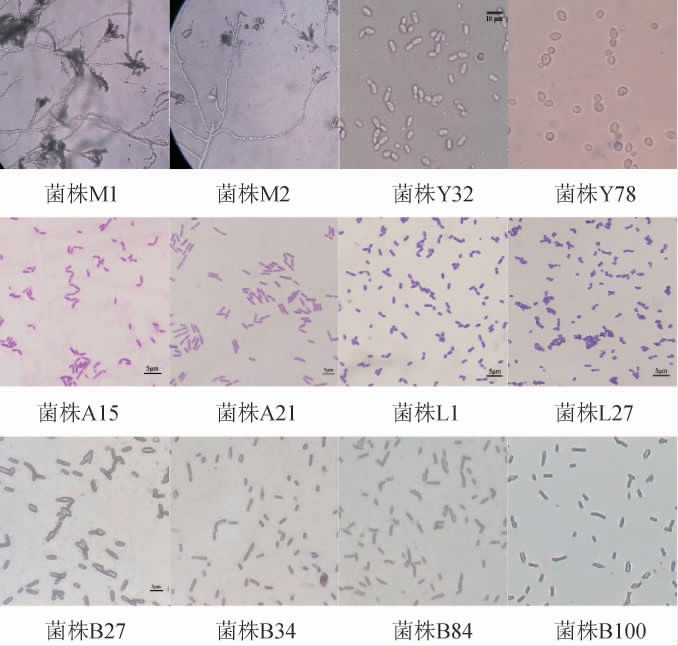
图4 部分分离菌株的细胞形态
Fig.4 Cell morphology of some isolated strains
由图3可知,霉菌(菌株M1和M2)菌落呈青色或白色,圆形,中间有凸起,质地绒状,菌落直径为32~40 mm,产孢结构大量形成,孢子面呈深灰绿色或白色,菌落背面浅褐色,无水溶性色素;酵母菌(菌株Y32和Y78)菌落呈红色或白色,圆形,中间有凸起,表面湿润有光泽,菌落直径为1.1~3.0 mm;醋酸菌(菌株A15和A21)菌落呈白色,圆形,中间有凸起,菌落直径为0.32~1.02 mm,周围有明显的透明圈;乳酸菌(菌株L1和L27)菌落呈白色,圆形,菌落直径为0.58~3.07 mm,中间有凸起,表面有光泽;芽孢杆菌(菌株B27、B34、B84、B100)菌落呈浅黄色,菌落直径为0.8~6.61 mm,边缘锯齿状,中间有凸起,表面有光泽。
由图4可知,霉菌(菌株M1和M2)分生孢子梗特化不明显,壁光滑,帚状枝3~4轮生,松散,瓶梗,分生孢子近球形、宽椭圆形,表面光滑;酵母菌(菌株Y32和Y78)的细胞形态为球形、卵形、腊肠形,明显大于细菌个体;醋酸菌(菌株A15和A21)经革兰氏染色后均呈红色,阴性,细胞形态呈杆形,周边无芽孢,以单个或成对方式排列;乳酸菌(菌株L1和L27)革兰氏染色后呈紫色,阳性,细胞形态呈杆状或球状,单生、对生或成链状排列,周边无芽孢;芽孢杆菌的细胞形态为杆形或球形,产芽孢。
综上,通过微生物菌落形态、显微形态观察及细菌革兰氏染色实验,初步确定158株细菌中包括醋酸菌22株、乳酸菌32株和芽孢杆菌104株。
2.3.2 分子生物学鉴定
将分离菌株的测序结果提交到NCBI的GenBank数据库中进行BLAST同源比对检索,对菌株进行鉴定,具体结果见表3。
表3 分离菌株的分子生物学鉴定结果
Table 3 Molecular biological identification results of isolated strains

菌株编号 菌株数量/株 鉴定结果 GenBank登录号 相似度/% 菌株来源M1 M2 Y1~Y25、Y27~Y31、Y33~Y67、Y69、Y71、Y73~Y77、Y79~Y80 Y26 Y32、Y68 Y70 Y72 Y78 L1、L29 L31 L4、L27 L5、L12、L15 L7 L14 L10 L6、L8、L11 L13、L16~L19、L23 L9 L2、L20~L22、L32 L3、L24、L26、L30 L25、L28 B1~B9、B46~B48、B88、B96、B100 B10、B15~B20、B52、B74~B76、B82、B102 B11、B35、B40、B55~B62、B63、B65、B85、B91~B95、B99 B12、B27、B41~B45、B73、B77~B79、B81、B86、B87、B101、B104 B13、B34、B36~B39 B14、B49~B51、B72、B80、B89、B98 B21、B26、B33 B22、B53、B64、B71、B83 B23、B32、B28-B31 B24、B66~B70、B84、B90、B97 B25、B54、B103 A1~A22 1 2 7 4 12 1 1 1 2 1 23 1 11 3 6 1 5 4 21 5 13 20产黄青霉(Penicillium chrysogenum)小孢根霉(Rhizopus microsporus)酿酒酵母(Saccharomyces cerevisiae)毕赤酵母(Pichia scaptomyzae)乙醇假丝酵母(Candida ethanol)扁平云假丝酵母(Candida humilis)膜醭毕赤酵母(Pichia membranifaciens)粘红酵母(Rhodotorula glutinis)发酵乳杆菌(Lactobacillus fermentum)植物乳杆菌(Lactobacillus plantarum)乳酸片球菌(Pediococcus acidilactici)戊糖片球菌(Pediococcus pentosaceus)德氏乳酸杆菌(Lactobacillus delbrueckii)弯曲乳杆菌(Lactobacillus curvatus)短乳杆菌(Lactobacillus brevis)类食品乳杆菌(Lactobacillus aralimentarius)面包乳杆菌(Lactobacillus crustorum)类布氏乳杆菌(Lactobacillus parabuchneri)香肠乳杆菌(Lactobacillus farciminis)干酪乳杆菌(Lactobacillus casei)副干酪乳杆菌(Lactobacillus paracasei)解淀粉芽孢杆菌(Bacillus amyloliquefaciens)暹罗芽胞杆菌(Bacillus siamensis)贝莱斯芽孢杆菌(Bacillus velezensis)MN604092.1 MF157307.1 KT933338.1 KY108790.1 KU726274.1 KM521821.1 FJ770511.1 KY109038.1 MF582846.1 KY435703.1 MF424772.1 JN039348.1 HE793100.1 KY435704.1 KM495909.1 MF942368.1 KC755094.1 MF611799.1 KX139194.1 MF108641.1 MG953248.1 KY129662.1 MG788345.1 KU356159.1 100 100 99 100 99 99 99 99 100 100 100 100 100 100 99 99 99 100 99 100 100 99 100 100酒醪酒醪酒醪/醋醅酒醪/醋醅酒醪/醋醅醋醅醋醅醋醅酒醪/醋醅酒醪酒醪酒醪/醋醅酒醪酒醪酒醪/醋醅醋醅醋醅醋醅醋醅醋醅醋醅酒醪/醋醅酒醪/醋醅酒醪/醋醅16 6 83 5 69 3 2 2枯草芽孢杆菌(Bacillus subtilis)蜡样芽胞杆菌(Bacillus cereus)甲基营养型芽孢杆菌(Bacillus methylotrophicus)特基拉芽孢杆菌(Bacillus tequilensis)短小芽孢杆菌(Bacillus pumilus)沙福芽孢杆菌(Bacillus safensis)地衣芽孢杆菌(Bacillus licheniformis)高地芽孢杆菌(Bacillus altitudinis)巴氏醋杆菌(Acetobacter pasteurianus)MF187639.1 MG738303.1 KM659225.1 KT831436.1 KU323615.1 MG937597.1 JX036281.1 KU663665.1 CP021922.1 100 100 100 100 100 100 100 100 99酒醪/醋醅酒醪/醋醅酒醪/醋醅醋醅醋醅醋醅醋醅醋醅酒醪/醋醅
由表3可知,从山西老陈醋发酵过程中分离到的细菌、真菌微生物经鉴定、合并后,分属于33个种,其中有2种霉菌、6种酵母菌、13种乳酸菌、11种芽孢杆菌和1种醋酸菌。纯培养分离到的醋酸菌菌株经鉴定后均为巴氏醋杆菌,并未分离到其他种类的醋酸菌。醋酸发酵阶段微生物的种类要远高于酒精发酵阶段,推测可能是因为山西老陈醋醋酸发酵阶段采用的是固态有氧发酵,不同位置的醋醅含氧量不同。如此一来,不仅醋醅上层的好氧微生物可以快速繁殖、代谢,同时醋醅中下部的低含氧量也适宜痕氧、厌氧微生物的生长,故而醋醅微生物群落多样性较酒醪中丰富[25]。
山西老陈醋发酵阶段共分离出3株霉菌,1株产黄青霉(Penicillium chrysogenum),2株小孢根霉(Rhizopus microsporus)。霉菌主要是在制曲和酒精发酵阶段将大分子物质降解为其他微生物可以利用的小分子物质(如葡萄糖、氨基酸、多肽等),随着酒精发酵的进行而逐渐消亡,在醋醅中并未分离到。本次共分离到80株酵母菌,其中有74株是酿酒酵母(Saccharomyces cerevisiae),另外6株分属于乙醇假丝酵母(Candida ethanol)、扁平云假丝酵母(Candida humilis)、膜醭毕赤酵母(Pichia membranifaciens)、粘红酵母(Rhodotorula glutinis)和毕赤酵母(Pichia scaptomyzae)。酿酒酵母生物量占可培养酵母总数的90%,是酒精发酵阶段的优势菌之一,能快速代谢产生乙醇,具有较强的乙醇耐受能力。假丝酵母、毕赤酵母、汉逊酵母和球拟酵母是常见的几种生香酵母,具有较强的产酯能力,主要产乙酸乙酯[26-28]。另外,从山西老陈醋的醋醅中还分离到了粘红酵母,其最明显的特点是能代谢产生类胡萝卜素,类胡萝卜素具有增强人体的免疫机能、在酶的催化下生成维生素A等作用[29-30]。
WU J J等[31]对中国传统谷物醋(山西老陈醋、镇江香醋、天津独流老醋)醋酸发酵阶段的醋酸菌进行分离,共获得21株醋酸菌,对其中的12株进行16S rRNA鉴定后,结果显示有11株A. pasteurianus和1株Gluconacetobacter europaeus,G.europaeus常被用于生产高酸(10%~14%醋酸)的葡萄醋工业中,具有明显不同于A.pasteurianus的表型特征,如G.europaeus对于乙酸的绝对需求性、低生物量和醋外环境的短暂生存力等。
本试验分离获得的芽孢菌目和红螺菌目的细菌种类与吕艳歌等[32]的研究结果具有部分相似性,如枯草芽孢杆菌(Bacillus subtilis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、沙福芽孢杆菌(Bacillus safensis)、高地芽孢杆菌和巴氏醋酸杆菌(A.pasteurianus),且解淀粉芽孢杆菌和巴氏醋杆菌所占比例在第3天达到峰值,与本研究结果一致。但其对于乳酸菌的含量和物种鉴定结果与本试验有较大差异,吕艳歌等[32]的研究结果显示,仅在醋酸发酵第2天和第3天的醋醅样品中检测到酸乳杆菌、布氏乳杆菌、类布氏乳杆菌和副干酪乳杆菌亚种4种乳酸菌,而本研究共分离鉴定出13种乳酸菌,且发酵末期样本中也检测到乳酸菌的存在。
3 结论
山西老陈醋酒精发酵阶段共持续18 d,酒醪中的酒精度和总酸含量随发酵时间延长逐渐累积,还原糖含量呈持续下降趋势。酒醪的温度在发酵1 d后由25.9 ℃升至33.5 ℃,此时酒醪中的各类微生物含量也达到峰值,随后其品温逐渐下降至室温。成熟酒醪的酒精度为8.65%vol,总酸含量为1.83 g/100 mL。醋酸发酵阶段周期为9 d,随着醋酸发酵的进行,醋醅中的酒精含量逐渐降低为0,总酸含量从初始的1.28 g/100 mL增至6.07 g/100 mL。醋醅的最高品温为47.8 ℃,pH和含水量变幅不大。成熟的醋醅的总酸含量为6.07 g/100 mL。老陈醋酿造过程中微生物含量的变化规律为:在酒精发酵阶段,酵母菌和细菌是主要菌群,发酵1 d后所有微生物的生物量均达到最大,之后随着发酵的进行其生物量开始缓慢下降,霉菌主要存在于酒精发酵阶段前期,中期全部消亡;在醋酸发酵阶段,酵母菌生物量呈逐渐下降趋势,细菌是此发酵阶段的优势菌群,其生物量先升高后降低,在醋酸发酵3 d时生物量达最高,之后随着发酵过程的进行逐渐进入残留期,此阶段未检测到霉菌。基于此,采用纯培养技术从山西老陈醋的酒醪和醋醅中共分离出83株真菌和158株细菌,经菌落形态、显微形态观察和分子生物学鉴定后,共检测到33个种,其中霉菌有Penicillium chrysogenum和Rhizopus microsporus两个种,酵母菌有Saccharomyces cerevisiae、Pichia scaptomyzae、Candida ethanol、Pichia membranifaciens、Candida humilis和Rhodotorula glutinis 6个种,乳酸菌有Lactobacillus fermentum、Pediococcus acidilactici、Lactobacillus plantarum等13个种,芽孢杆菌有Bacillus amyloliquefaciens、Bacillus cereus、Bacillus licheniformis等11个种。本试验分离到的醋酸菌经鉴定后均为巴氏醋杆菌(Acetobacter pasteurianus)。
[1]XU Y,WANG D,FAN W L,et al.Traditional Chinese biotechnology[J].Adv Biochem Eng Biotechnol,2010,122:189-233.
[2]王宗敏,白桦,王辛禹,等.食醋中功能物质及其研究进展[J].食品科学,2023,44(11):196-204.
[3]王醴弘.基于SWOT分析的山西老陈醋发展战略探究[J].中国食品工业,2022(11):99-101.
[4]冯宇杰,魏瑶丽,李虹瑶,等.醋糟与剩余污泥共发酵体系中底物配比对挥发性脂肪酸产量的影响[J].科学技术与工程,2020,20(34):14332-14337.
[5]王宏霞,闫裕峰,郎繁繁,等.山西老陈醋不同熏醅工艺对风味物质的影响[J].中国酿造,2021,40(7):38-42.
[6]马玉敏,郎繁繁,闫裕峰.山西老陈醋熏醅工艺研究及发展现状[J].中国酿造,2020,39(1):17-20.
[7]范梦蝶,王天泽,杜文斌,等.山西老陈醋晾晒前、后挥发性香味物质比较分析[J].中国食品学报,2019,19(12):229-242.
[8]张雅琳,刘廷锐,朱文优,等.基于Illumina MiSeq高通量测序技术解析四川麸醋发酵过程中微生物菌群结构[J].中国食品学报,2022,22(6):299-306.
[9]韩凯,杜将,纪薇.山西老陈醋熏醅过程中吡嗪类生成规律分析[J].中国酿造,2023,42(8):84-89.
[10]XING X Y,WANG Y H,HUO N R,et al.Candida ethanolica strain Y18 enhances aroma of Shanxi aged-vinegar[J].Food Sci Technol Res,2018,24(6):1069-1081.
[11]许女,贾瑞娟,李雅茹,等.老陈醋来源乳酸菌的益生特性筛选及安全评价[J].中国食品学报,2020,20(10):23-33.
[12]邢晓莹,刘毅,张怀敏,等.山西老陈醋醋酸发酵过程中优良产酸菌株的筛选及鉴定[J].食品与发酵工业,2021,47(6):201-207.
[13]李江涌.山西老陈醋主要工艺参数的分析研究[D].晋中:山西农业大学,2017.
[14]宋勇强,李素岳,胡先望,等.响应面法优化食醋酿造过程中酒精发酵工艺条件[J].中国酿造,2018,37(2):85-90.
[15]许伟.镇江香醋醋酸发酵过程微生物群落及其功能分析[D].无锡:江南大学,2011.
[16]YASAWONG M,AREEKIT S,PAKPITCHAREON A,et al.Characterization of thermophilic halotolerant Aeribacillus pallidus TD1 from Tao dam hot spring,Thailand[J].Int J Mol Sci,2011,12(8):5294-5303.
[17]RADCHENKOVA N,VASSILEV S,PANCHEV I,esuox t al.Production and properties of two novel exopolysaccharides synthesized by a thermophilic bacterium Aeribacillus pallidus 418[J].Appl Biochem Biotech,2013,171(1):31-43.
[18]刘海坡,阚涛,刘彩霞.食醋酒精发酵阶段非挥发性风味物质及微生物群落结构解析[J].食品与发酵工业,2022,48(19):65-69.
[19]韩冰玙,陈辉太,李宗军.酱、浓、清香型白酒酿造过程中真菌及其功能特性研究进展[J].中国酿造,2024,43(3):27-32.
[20]袁英豪,何梦娇,唐春麟,等.醋源生香酵母的筛选及其特性研究[J].食品与发酵工业,2024,50(15):63-71.
[21]黄婷.镇江香醋酿造微生物功能解析及酿醋人工菌群构建[D].无锡:江南大学,2022.
[22]邢晓莹,孟卫凯,张慧妍,等.基于高通量测序分析山西老陈醋醋酸发酵过程中细菌群落的演替规律[J].食品工业科技,2024,45(17):147-154.
[23]郑宇,程程,刘静,等.中国传统固态发酵食醋主要特征风味物质组成分析[J].中国食品学报,2020,20(8):237-247.
[24]孙晓琪,朱丹,张慧如,等.不同地区山西老陈醋酿造细菌群落结构及多样性[J].中国酿造,2023,42(6):116-121.
[25]张驰,王超,沙宏举,等.室温条件下电场缓解高氮负荷抑制厌氧氨氧化性能的研究[J].环境污染与防治,2023,45(9):1202-1207.
[26]邢爽,王亚平,郭学武,等.发酵条件对5种产酯酵母酒精发酵和产酯的影响[J].中国酿造,2018,37(2):24-28.
[27]陈嘉,邢晓莹,冯志宏,等.山西老陈醋酿造过程中产酯酵母的筛选及产香特性分析(英文)[J].食品科学,2019,40(16):144-151.
[28]ZHANG Q,HUO N R,WANG Y H,et al.Aroma-enhancing role of pichia manshurica isolated from daqu in the brewing of Shanxi aged vinegar[J].Int J Food Prop,2017,20(9):2169-2179.
[29]梁晓华,杨莺莺,杨铿,等.海洋红酵母Y2发酵产类胡萝卜素条件的研究[J].中国微生态学杂志,2011,23(12):1068-1073.
[30]钮亭亭,孙茜萍,吴涛.酵母生产类胡萝卜素的研究进展[J].发酵科技通讯,2017,46(1):50-53.
[31]WU J J,GULLO M,CHEN F S,et al.Diversity of Acetobacter pasteurianus strains isolated from solid-state fermentation of cereal vinegars[J].Curr Microbiol,2010,60(4):280-286.
[32]吕艳歌,马海乐,李云亮,等.山西老陈醋产酸菌的分离鉴定及系统学分析[J].中国食品学报,2013,13(12):163-171.