四甲基吡嗪(tetramethylpyrazine,TTMP)又名川芎嗪,属于生物体单碱,白色针状晶体,具有活血化瘀[1]、疏风止痛[2]、理气、治疗心脑血管疾病[3-4]等多种药理作用。2006年,吴建峰[5]率先提出TTMP是白酒中的主要功能性成分之一。2007年,TTMP被证实是中国白酒中的重要香气化合物,在白酒中呈现甜香、坚果香及花香等香气,对其他香味物质有显著的叠加效应,进而起到了丰满白酒香气的作用[6]。因此,如何提高中国白酒中TTMP含量是一个备受关注的研究领域,研究发现要想提高白酒中TTMP含量,必须先探索白酒中TTMP是如何形成的[7]。由于TTMP在酱香、芝麻香等采用高温曲发酵的白酒中普遍存在,所以认为中国白酒中的TTMP主要由美拉德反应产生[8-9]。吴建峰[10]研究发现,固态发酵白酒中TTMP形成机理是酶催化(即微生物代谢)与热动力联合作用的结果,而非美拉德反应,为研究中国白酒中TTMP奠定了理论基础。
关于微生物发酵产TTMP,最早报道是1962年,KOSUGE T等[11]在日本的发酵豆制品“纳豆”中分离得到TTMP,并首次发现其中的枯草芽孢杆菌通过生物合成获得TTMP。ZHU B F 等[12]首次从酱香型白酒高温大曲中筛选获得了高产乙偶姻及TTMP的芽孢杆菌,并建立了产TTMP功能芽孢杆菌库。据文献报道,许多真菌和细菌都有产生TTMP,包括酿酒酵母[13]、嗜热放线菌[14]、谷氨酸棒状杆菌突变菌株[15]、芽孢杆菌[16]和乳酸杆菌[17]等。酱香型白酒采用开放式的固态酿造工艺,其发酵过程微生物种类繁多,一直是研究的热点与难点[18]。高温堆积发酵是酱香型白酒酿造过程中最为重要的工艺之一,在开放式的环境下,酒醅不断网罗环境中的微生物[19]。ZHANG W Q等[20]提出中国白酒中四甲基吡嗪形成主要存在于温度较高的制曲、高温堆积、蒸馏等阶段。下沙、造沙轮次是酱香型白酒生产初始投粮阶段,其工艺操作关系到后期轮次发酵过程中微生物的生长繁殖[21-22]。
本研究拟以酱香型白酒堆积发酵酒醅为研究对象,采用宏全基因测序技术对酒醅样品中所有微生物基因进行测序分析,研究下沙、造沙堆积发酵全过程中合成TTMP主要功能微生物,通过构建代谢网络解析TTMP前体合成的主要代谢途径,揭示酱香型白酒下沙、造沙堆积发酵过程中TTMP的微生物合成机制。旨在为建立酱香型白酒行业急需的生产调控技术提供理论依据和技术支撑,从而有效控制酱香型白酒功能性指标TTMP并保障产品质量。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅样品:贵州省仁怀市某酒厂制酒车间。
取样方法[23]:取酱香型白酒堆积发酵过程中样品,完全收堆时记为发酵0 h,每24 h采集样品一次,分别取堆积发酵第1天,第2天,第3天……酒醅取样点如图1所示,自堆积酒醅上、中、下外层酒醅往内深入20 cm,上、中、下层酒醅分别记1、2、3,每个点采集质量约500 g,下沙阶段堆积发酵过程中上层酒醅样品记为XSF-1,代表下沙堆积(XS)第1天位置1的样品,其他样品依次编号XSF-2,XSF3……,分别取1、2、3点样品各100 g混合后作为混合样品,记为4,下沙、造沙堆积发酵阶段共取得样品20个。
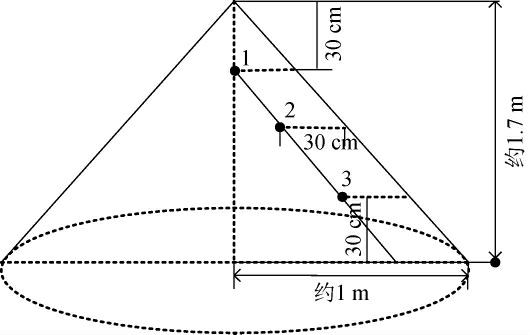
图1 堆积发酵酒醅取样点位
Fig.1 Sampling points of stacked fermented grains
1.1.2 化学试剂
基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒:美国Omega BioTek公司;双链DNA(dsDNA)荧光定量检测试剂盒:美国ThermoFisher公司;全能型DNA建库试剂盒:美国OmegaBioTek公司;DNA分选磁珠:Yeasen生物科技(香港)有限公司;Qubit dsDNA HS Assay Kit:美国ThermoFisher公司。
1.2 仪器与设备
超声波DNA破碎仪:美国Covaris公司;Thermo Qubit 4.0荧光定量仪:美国Thermo Fisher公司;Agilent 2100 Bioanalyzer:上海复日科技有限公司;WH-3微型漩涡混合仪:上海沪西分析仪器厂有限公司;TT100TM Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国伯乐BIO-RAD公司;可调式微量移液器:德国艾本Eppendorf公司;DYY-11电泳仪:北京市六一仪器厂;S220超声波DNA破碎仪:美国Covaris公司。
1.3 数据处理
1.3.1 宏全基因组测序
DNA提取:使用E.Z.N.ATM Mag-Bind Soil DNA Kit对样本进行DNA抽提。
基因组DNA片段化:利用QubitTMdsDNA HSAssayKit精确测量基因组浓度,从而准确确定加入的DNA总量;制备插入片段长度为500 bp左右的文库,初始DNA总量约为500 ng,使用Elution Buffer将DNA稀释至130 μL,并装入0.5mL的DNA破碎管中;利用Covaris高性能样品处理系统,根据S220操作参数片段化;使用1倍的DNA分选磁珠将破碎后的DNA片段浓缩回收,纯化后,利用Qubit 4.0检测。
文库构建:DNA片段的末端修复(即末端补平和3'端加A尾)、接头的连接、磁珠分选纯化连接产物、文库扩增及产物纯化。
文库质控及混样:利用2%琼脂糖凝胶电泳来检测文库的大小,借助Qubit4.0荧光定量仪测定文库的浓度,所有样本均按照1∶1的比例进行等量混合。
1.3.2 宏基因组测序数据处理
二代测序得到的原始图像数据文件经碱基识别(Base Calling)分析转化为原始测序序列(Sequenced Reads),称之为Raw Data或Raw Reads,结果以FASTQ(简称为fq)文件格式存储。对测序的原始数据通过Fastp进行质量评估,得到Clean数据。
基于优化后的Clean数据,使用拼接软件megahit对clean reads进行多样本混合拼接;之后将各样本的clean reads使用bowtie2比对至组装后的contigs上,获取unmapped PE reads;继续使用SPAdes对未比对reads进行混合拼接;对于两次拼接组装生成的contig,过滤小于500 bp的序列。使用Prodigal对拼接的contigs进行ORF预测,选择长度≥100 bp的基因,作为候选基因集。将所有样品预测出来的基因序列,用CD-HIT软件进行聚类(参数为:95% identity、90%coverage),每个类取最长的基因作为代表序列,构建非冗余基因集。
采用Bowtie2将各样本Clean reads比对到非冗余基因集序列上,利用SAMtools获得比对上的reads,再考虑到基因长度,计算基因在各样本的丰度信息。将基因集与非冗余(non-redundant,NR)、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)、直系同源蛋白分组比对(evolutionary genealogy of genes:Non-supervised Orthologous Groups,eggNOG)、抗性基因数据库(Antibiotic Resistance Genes Database,ARDB)、碳水化合物活性酶(Carbohydrate-Active enZymes,CAZy)、SEED等数据库进行比对,获得基因的物种注释信息和功能注释信息,并根据基因集丰度得到功能丰度和物种丰度。
2 结果与分析
2.1 酱香型白酒下沙、造沙堆积发酵过程中的微生物群落多样性及变化规律
2.1.1 酱香型白酒下沙、造沙堆积发酵过程中酒醅的微生物群落多样性
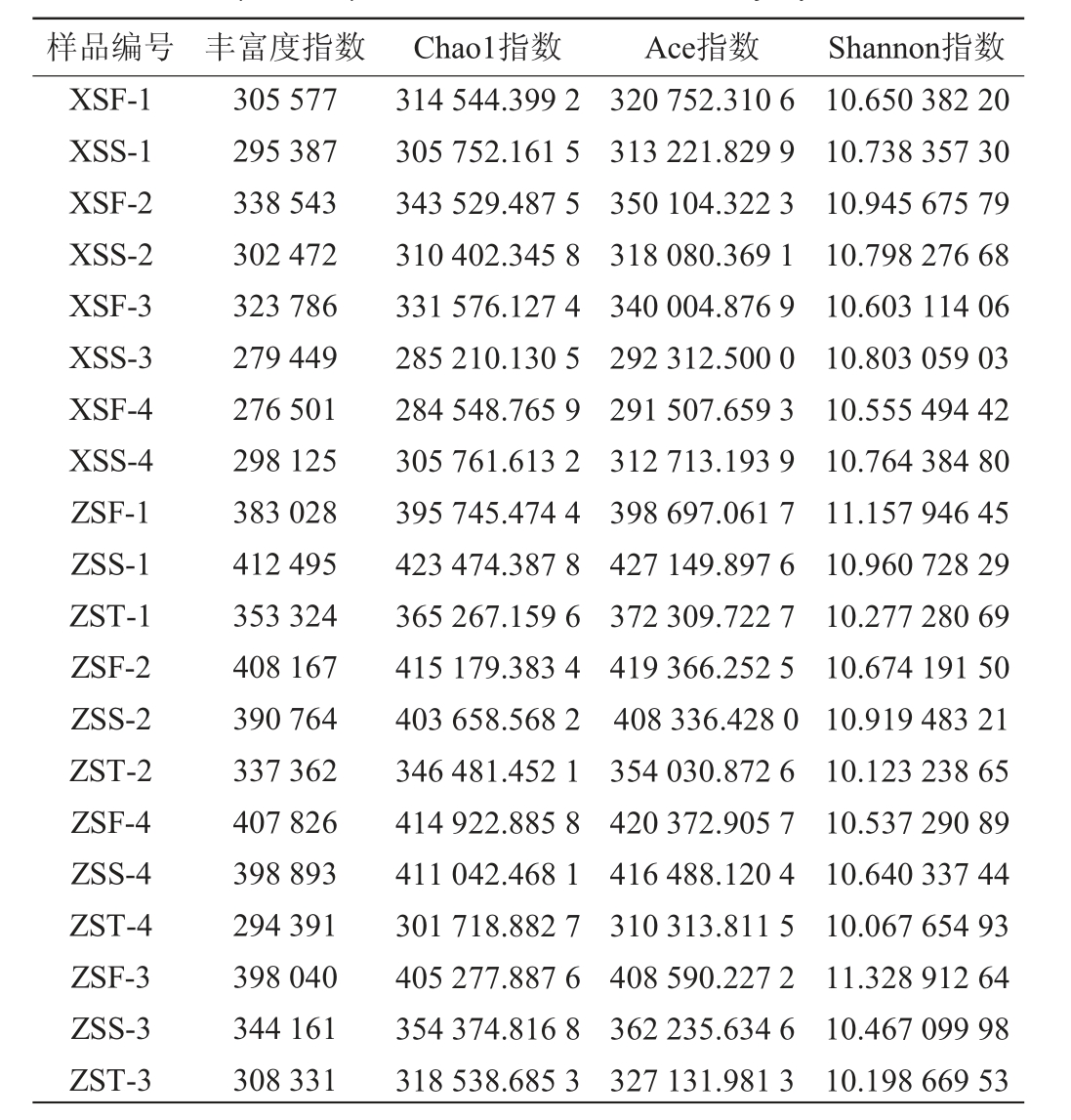
通过不同酒醅样品的微生物群落多样性分析(Alpha多样性)可以反映微生物的丰富度和多样性,酱香型白酒下沙、造沙堆积发酵过程中酒醅的微生物群落Alpha多样性分析结果见表1。
表1 酱香型白酒下沙、造沙阶段堆积发酵过程中酒醅的微生物群落Alpha多样性
Table 1 Alpha diversity of microbial community in fermented grains during stacking fermentation in the 1st (Xiasha) and the 2nd (Zaosha) rounds of sauce-flavor Baijiu production
注:括号前内容表示基因在PDB数据库中的ID;“Ser”等代表氨基酸残基缩写,后面的数字表示该氨基酸残基在蛋白质中位置。
样品编号 丰富度指数 Chao1指数 Ace指数 Shannon指数XSF-1 XSS-1 XSF-2 XSS-2 XSF-3 XSS-3 XSF-4 XSS-4 ZSF-1 ZSS-1 ZST-1 ZSF-2 ZSS-2 ZST-2 ZSF-4 ZSS-4 ZST-4 ZSF-3 ZSS-3 ZST-3 305 577 295 387 338 543 302 472 323 786 279 449 276 501 298 125 383 028 412 495 353 324 408 167 390 764 337 362 407 826 398 893 294 391 398 040 344 161 308 331 314 544.399 2 305 752.161 5 343 529.487 5 310 402.345 8 331 576.127 4 285 210.130 5 284 548.765 9 305 761.613 2 395 745.474 4 423 474.387 8 365 267.159 6 415 179.383 4 403 658.568 2 346 481.452 1 414 922.885 8 411 042.468 1 301 718.882 7 405 277.887 6 354 374.816 8 318 538.685 3 320 752.310 6 313 221.829 9 350 104.322 3 318 080.369 1 340 004.876 9 292 312.500 0 291 507.659 3 312 713.193 9 398 697.061 7 427 149.897 6 372 309.722 7 419 366.252 5 408 336.428 0 354 030.872 6 420 372.905 7 416 488.120 4 310 313.811 5 408 590.227 2 362 235.634 6 327 131.981 3 10.650 382 20 10.738 357 30 10.945 675 79 10.798 276 68 10.603 114 06 10.803 059 03 10.555 494 42 10.764 384 80 11.157 946 45 10.960 728 29 10.277 280 69 10.674 191 50 10.919 483 21 10.123 238 65 10.537 290 89 10.640 337 44 10.067 654 93 11.328 912 64 10.467 099 98 10.198 669 53
计算堆积发酵过程中酒醅不同时间节点的多样性指数,得到堆积发酵过程中微生物群落多样性的变化规律,其中丰富度指数为微生物群落中丰度>0的物种数之和;Chao1指数用来估计物种总数,其值越大,多样性越高;Ace用来估计群落中OTU数目的指数,其值越大,多样性越高;Shannon指数体现物种的丰富度,其值越大,说明群落多样性越高[24]。
由表1可知,根据Chaol指数,在下沙阶段第1天XSF-1为314 544.399 2,大于第2天XSS-1为305 752.161 5,其他类推,在下沙堆积发酵过程中酒醅中微生物的物种总数逐渐下降;根据Shannon指数,XSF-1为10.650 382 2,小于第2天XSS-1为10.738 35 73,其他类推,整体上微生物多样性逐渐上升;相同分析方式发现,在造沙堆积发酵过程中酒醅中微生物的总数在第1天和第2天较为稳定,在第3天逐渐下降,微生物多样性先上升后下降。
2.1.2 下沙、造沙阶段酱香堆积发酵过程中微生物群落的变化
酱香型白酒下沙、造沙堆积发酵过程中酒醅样品微生物在门、属、种水平分布如图2所示,排名前八的门微生物有子囊菌门(Ascomycota)、芽孢杆菌门(Bacillota)、假单胞菌门(Pseudomonadota)、放线菌门(Actinomycetota)、担子菌门(Basidiomycota)、拟杆菌门(Bacteroidota)、毛霉门(Mucoromycota)、尾噬菌体门(Uroviricota)。

图2 酱香白酒下沙、造沙堆积发酵过程中微生物群落组成
Fig.2 Compositions of microbial community during stacking fermentation in the 1st (Xiasha) and the 2nd (Zaosha) of sauce-flavor Baijiu production
对酱香型白酒下沙、造沙堆积发酵酒醅样品进行微生物群落结构进行分析,所检测到的所有微生物种类,可注释到属水平微生物有明串珠菌属(Leuconostoc),芽孢杆菌属(Bacillus),片球菌属(Pediococcus),慢生芽孢杆菌属(Lentibacillus),大洋芽孢杆菌属(Oceanobacillus),魏斯氏菌属(Weissella),乳植杆菌属(Lactiplantibacillus),腐败乳杆菌属(Loigolactobacillus),乳杆菌属(Lactobacillus),粘液乳杆菌属(Limosilactobacillus),迟缓乳杆菌属(Lentilactobacillus),链孢子菌属(Desmospora),变形杆菌属(Proteus),埃希氏菌属(Escherichia),克雷伯氏菌属(Klebsiella),糖多孢菌属(Saccharopolyspora),干酪乳杆菌属(Lacticaseibacillus),unclassified Lactobacillaceae genus,酵母属(Saccharomyces),毕赤酵母属(Pichia),威克汉姆酵母属(Wickerhamomyces),塞伯林德纳氏酵母属(Cyberlindnera),促生乳杆菌属(Levilactobacillus),洛德酵母菌属(Lodderomyces),有孢圆酵母属(Torulaspora),拟青霉属(Paecilomyces),克罗彭施泰特氏菌属(Kroppenstedtia),Rasamsonia。其中丰度占比前5的优势菌群分别为乳植杆菌属(Lactiplantibacillus),魏斯氏菌属(Weissella),促生乳杆菌属(Levilactobacillus),酵母属(Saccharomyces),毕赤酵母属(Pichia)。
对酱香型白酒下沙、造沙堆积发酵酒醅微生物在种水平分类,可注释到种水平微生物有索诺拉沙漠芽孢杆菌(Bacillus sonorensis),贝莱斯芽孢杆菌(Bacillus velezensis),unclassified Bacillus species,类肠膜魏斯氏菌(Weissella paramesenteroides),泰国魏斯氏杆菌(Weissella thailandensis),希腊魏斯氏菌(Weissella hellenica),食窦魏斯氏菌(Weissella cibaria),Weissella jogaejeotgal,融合魏斯氏菌(Weissella confusa),unclassified Weissella species,植物乳植物杆菌(Lactiplantibacillus plantarum),戊糖乳植物杆菌(Lactiplantibacillus pentosus),unclassified Lactiplantibacillus species,短促生乳杆菌(Levilactobacillus brevis),布氏迟缓乳杆菌(Lentilactobacillus buchneri),戊糖片球菌(Pediococcus pentosaceus),乳酸片球菌(Pediococcus acidilactici),unclassified Pediococcus species,副干酪乳杆菌(Lacticaseibacillus paracasei),棒状腐败乳杆菌(Loigolactobacillus coryniformis),unclassified Lactobacillaceae species,肠膜明串珠菌(Leuconostoc mesenteroides),Leuconostoc suionicum,unclassified Leuconostoc species,发酵粘液乳杆菌(Limosilactobacillus fermentum),桥粘液乳杆菌(Limosilactobacillus pontis),德尔布有孢圆酵母(Torulaspora delbrueckii),球形有孢圆酵母(Torulaspora globosa),库德里阿兹威毕赤酵母(Pichia kudriavzevii),膜醭毕赤酵母(Pichia membranifaciens),酿酒酵母菌(Saccharomyces cerevisiae),异常威克汉姆酵母(Wickerhamomyces anomalus),西弗威克汉姆酵母(Wickerhamomyces ciferrii),费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii),长孢洛德酵母菌(Lodderomyces elongisporus),多变拟青霉菌(Paecilomyces variotii),象牙色克罗彭施泰特氏菌(Kroppenstedtia eburnea),广州克罗彭施泰特氏菌(Kroppenstedtia guangzhouensis),链孢子菌(Desmospora),奇异变形杆菌(Proteus mirabilis),大肠杆菌(Escherichia coli),肺炎克雷伯菌(Klebsiella pneumoniae),多孢嗜热多孢菌(Saccharopolyspora rectivirgula)。其中相对丰度占比前6的优势菌有多变拟青霉菌(Paecilomyces variotii)、异常威克汉姆酵母(Wickerhamomyces anomalus)、德尔布有孢圆酵母(Torulaspora delbrueckii)、植物乳植物杆菌(Lactiplantibacillus plantarum)、类肠膜魏斯氏菌(Weissella paramesenteroides)和酿酒酵母(Saccharomyces cerevisiae)。
2.1.3 下沙堆积发酵过程中微生物群落变化规律
酱香型白酒下沙堆积发酵过程中相对丰度前8名的主要微生物属分布见图3。
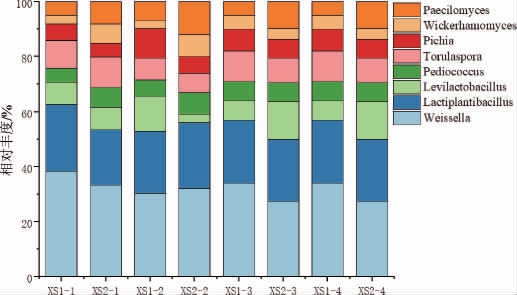
图3 酱香型白酒下沙堆积发酵过程中主要微生物群落在属水平的相对丰度
Fig.3 Relative abundance of major microbial communities during stacking fermentation in the 1st round of sauce-flavor Baijiu production at genus level
下沙堆积发酵过程中微生物生长代谢造成酒醅温度不断上升,其中由内向外的微生物发酵方式,造成酒醅内层的升温速度高于外层,上层的温度与中层的温度升温速度高于下层,下层的酒醅溶氧量低,微生物代谢活动缓慢,并且接触地面,散热更好[25]。由图3可知,在下沙堆积发酵过程中,优势细菌有魏斯氏菌属(Weissella)、乳植杆菌属(Lactiplantibacillus)、促乳生杆菌属(Levilactobacillus)、片球菌属(Pediococcus);优势真菌有拟青霉菌属(Paecilomyces)、威克汉姆酵母属(Wickerhamomyces)、毕赤酵母属(Pichia)、有孢圆酵母属(Torulaspora)。其中魏斯氏菌属(Weissella)和乳植杆菌属(Lactiplantibacillus)是主要微生物,总占比超过50%。魏斯氏菌属(Weissella)在上层酒醅微生物占比随着堆积发酵过程逐渐下降,在中层酒醅微生物占比保持稳定,在下层酒醅微生物占比增加,总体占比随着堆积发酵过程逐渐减少,这可能是因为魏斯氏菌属(Weissella)为兼性厌氧菌,耐酸,随着酵母菌属微生物逐渐生长繁殖,酒醅的温度逐渐上升,pH逐渐下降,占比逐渐下降[26]。
2.1.4 造沙堆积发酵过程中微生物变化规律
酱香型白酒造沙堆积发酵过程中相对丰度前9名的主要微生物属分布见图4。
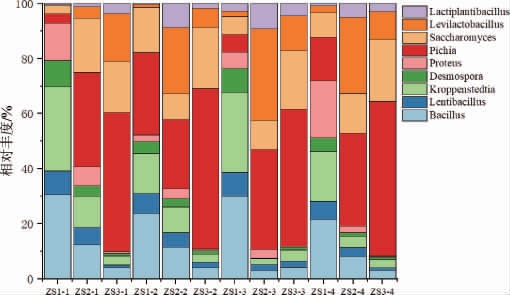
图4 酱香型白酒造沙堆积发酵过程中主要微生物群落在属水平的相对丰度
Fig.4 Relative abundance of major microbial communities during stacking fermentation in the 2nd round of sauce-flavor Baijiu production at genus level
造沙堆积发酵过程酒醅温度变化规律同下沙一样,在下沙窖内发酵过程中,酵母菌通过无氧代谢产生酒精和二氧化碳,pH逐渐降低,产香细菌微生物生长受到抑制[27],酒醅中的微生物生长情况也发生了变化。由图4可知,在造沙堆积发酵过程中,优势细菌属有芽孢杆菌属(Bacillus)、慢生芽孢杆菌属(Lentibacillus)、促生乳杆菌属(Levilactobacillus)、乳植杆菌属(Lactiplantibacillus)、克罗彭施泰特氏菌属(Kroppenstedtia)、链孢子菌属(Desmospora)、变形杆菌属(Proteus);优势真菌属有毕赤酵母属(Pichia)、酵母属(Saccharomyces);其中芽孢杆菌属(Bacillus)、毕赤酵母属(Pichia)、酵母属(Saccharomyces)是主要微生物,总占比>50%,随着造沙堆积发酵时间进行芽孢杆菌属(Bacillus)相对丰度逐渐减少,毕赤酵母属(Pichia)相对丰度逐渐增加,酵母属(Saccharomyces)相对丰度先增加再减少。
2.2 下沙、造沙堆积发酵过程中产四甲基吡嗪功能微生物
2.2.1 下沙、造沙堆积发酵过程中微生物的功能分布
KEGG数据库在一级分类中将生物代谢通路划分为6类,基因在不同分类中的占比分别有细胞处理(cellular processing)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病(human diseases)、新陈代谢(metabolism)、生物体系统(organismal systems),下沙、造沙堆积发酵微生物基因在KEGG生物代谢通路中的分布见图5。由图5可知,一级分类中各生物代谢通路上基因的数目占比,新陈代谢一级分类中基因数目占比最大,这可能与微生物代谢在堆积发酵过程中的关键作用有关。
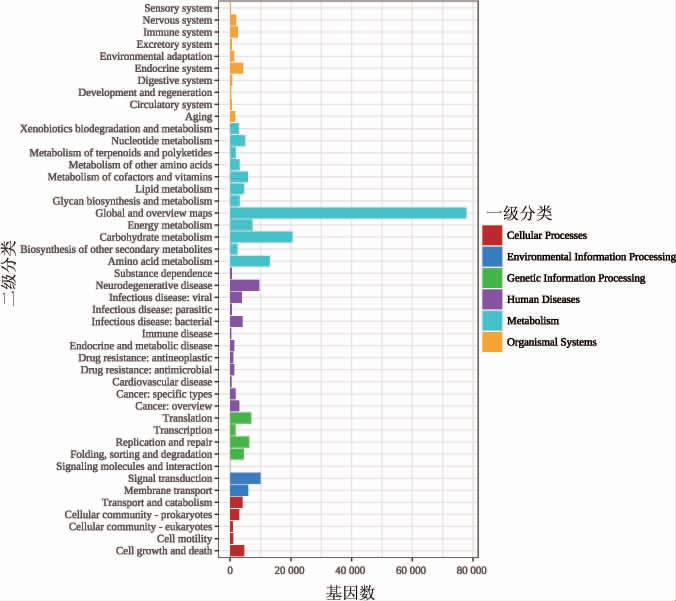
图5 酱香型白酒下沙、造沙堆积发酵微生物基因在KEGG生物代谢通路中的分布
Fig.5 Distribution of microbial genes during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production in KEGG biological metabolic pathway
KEGG一级分类的每一类又被系统分为二级分类,由图5亦可知,在新陈代谢二级分类中,包括碳水化合物代谢(carbohydrate metabolism)、全局总览途径(global and overview maps)、核酸代谢(nucleotide metabolism)、氨基酸代谢(amino acid metabolism)、辅助因子和维生素的代谢(metabolism of cofactors and vitamins)、聚糖的生物合成与代谢(glycan biosynthesis and metabolism)、能量代谢(energy metabolism)、脂质代谢(lipid metabolism)、萜类和聚酮化合物的代谢(metabolism of terpenoids and polyketides)、其他氨基酸的代谢(metabolism of other amino acids)、异生物的生物降解与代谢(xenobiotics biodegradation and metabolism)和其他次生代谢产物的生物合成(biosynthesis of other secondary metabolites)。其中,全局总览途径、碳水化合物代谢、氨基酸代谢基因数目所占比例最大,可能是最主要的代谢途径,这可能与微生物生长以及酒醅堆积发酵过程中如有机酸、氨基酸等风味物质作为代谢物的生物合成有关。
2.2.2 下沙、造沙堆积发酵过程中产四甲基吡嗪功能微生物解析
(1)下沙、造沙堆积发酵过程中微生物代谢通路
徐岩等[28]通过对芽孢杆菌产四甲基吡嗪的发酵过程进行追踪,发现提高芽孢杆菌合成乙偶姻和氨的代谢能力,代谢产物中的四甲基吡嗪含量有显著提高,从而确定了乙偶姻和氨是四甲基吡嗪的前体物质。对下沙、造沙酒醅堆积发酵过程微生物基因进行三级分类,以揭示堆积发酵过程中乙偶姻和铵合成途径。通过将酒醅微生物基因映射到KEGG参考代谢通路中,再映射到的所有微生物代谢通路中,其中乙偶姻的代谢通路有四种,氨合成的代谢通路有五种,再确定代谢通路中产乙偶姻和氨的关键酶,从而确定产四甲基吡嗪功能微生物。
如图6所示,颜色越深,则代表相应微生物在该代谢途径上的代谢活动频繁,对该途径上的相关酶含量贡献大,酶路径共有23条,参与微生物共有55种。根据样品中微生物产关键酶的丰度得到了堆积发酵酒醅中微生物产乙偶姻和氨的主要代谢途径,下沙、造沙堆积发酵过程中微生物产乙偶姻的主要合成路径有3条:①丙酮酸由α-乙酰乳酸合成酶催化形成α-乙酰乳酸,再在α-乙酰乳酸脱羧酶作用下合成乙偶姻;②丙酮酸被α-乙酰乳酸合成酶催化形成的α-乙酰乳酸非酶促反应生成双乙酰,再在双乙酰还原酶作用下生成乙偶姻;③2,3丁二醇在乙偶姻还原酶作用下生成乙偶姻。
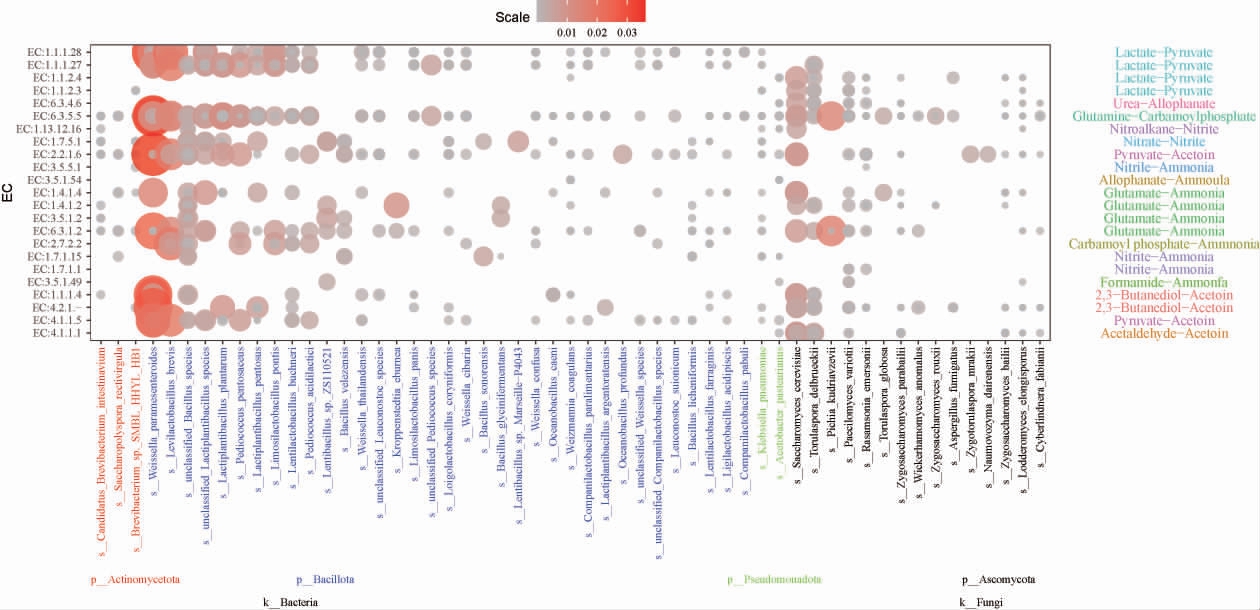
图6 酱香型白酒下沙、造沙堆积发酵微生物代谢产乙偶姻和氨的途径和关键酶
Fig.6 Metabolic pathways and key enzymes for microorganisms producing acetoin and ammonia during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production
因此双乙酰还原酶(diacetyl reductase,DR)、2,3-丁二醇脱氢酶(2,3-butanediol dehydrogenase,BDH)、α-乙酰乳酸合成酶(alpha-acetyllactate synthase,ALS)、α-乙酰乳酸脱羧酶(Alpha-acetyllactate decarboxylase,ALDC)是乙偶姻生成的关键酶。堆积发酵过程中微生物产氨的主要合成路径有3条:①氨基甲酸转化为铵;②亚硝酸盐转化为铵;③谷氨酸转化为铵。因此氰酸酯水解酶、亚硝酸盐还原酶、谷氨酸脱氢酶是氨生成的关键酶[29]。
(2)下沙、造沙堆积发酵过程中氨合成功能微生物解析
氰酸酯水解酶是利用亚硝酸转化为氨的关键酶,找到含氰酸酯水解酶微生物,结果见图7。由图7可知,下沙、造沙堆积发酵酒醅微生物可利用亚硝酸转氨的微生物,相对丰度>3%的有6种,分别是索诺拉芽孢杆菌(38.5%),贝莱斯芽孢杆菌(19.8%),unclassified Bacillus species(19.9%),多孢嗜热多孢菌(5.2%),棒状腐败乳杆菌(4.6%),地衣芽孢杆菌(3.5%)。其中索诺拉芽孢杆菌是亚硝酸转化为铵路径中主要的微生物。
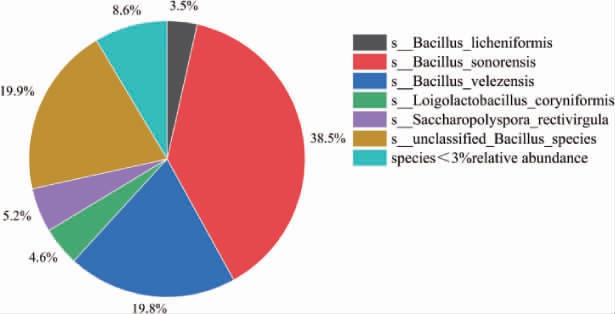
图7 酱香型白酒下沙、造沙堆积发酵过程中利用亚硝酸转氨微生物在种水平占比
Fig.7 Proportion of microorganisms using nitrite to convert ammonia during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
亚硝酸盐还原酶是利用氨基甲酸合成氨的关键酶,找到含亚硝酸盐还原酶的微生物,结果见图8。由图8可知,堆积发酵酒醅微生物可以利用氨基甲酸转氨的微生物,相关丰度>3%的有6种,分别是短促生乳杆菌(30.5%),乳酸片球菌(15.8%),桥粘液乳杆菌(13.7%),戊糖片球菌(12.6%),布氏迟缓乳杆菌(8.3%),unclassified Bacillus species(7.9%)。其中短促生乳杆菌是氨基甲酸转化为氨路径中的主要的微生物。
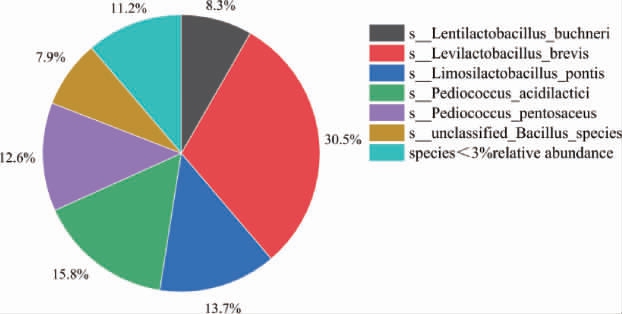
图8 酱香型白酒下沙、造沙堆积发酵过程中利用氨基甲酸转氨微生物在种水平占比
Fig.8 Proportion of microorganisms using carbamic acid to convert ammonia during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
根据谷氨酸脱氢酶是利用谷氨酸合成氨的关键酶,找到含谷氨酸脱氢酶的微生物,结果见图9。由图9可知,堆积发酵酒醅微生物可以利用谷氨酸转氨的微生物,相对丰度>3%的有9种,分别是类肠膜魏斯氏菌(17.2%),象牙色克罗彭施泰特氏菌(12.2%),unclassified Lactiplantibacillus species(10.9%),酿酒酵母菌(8.2%),戊糖乳植物杆菌(6%),迟缓芽孢杆菌(5.8%),甘氨酸芽孢杆菌(4.6%),有孢圆酵母菌(4.2%),unclassified Bacillus species(3.2%)。其中类肠膜魏斯氏菌、象牙色克罗彭施泰特氏菌是谷氨酸转化氨路径中的主要的微生物。
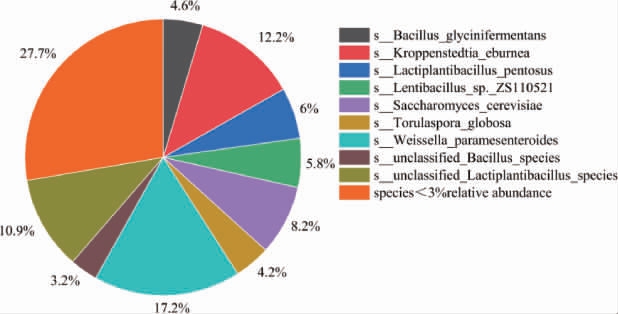
图9 酱香型白酒下沙、造沙堆积发酵过程中利用谷氨酸产氨微生物在种水平占比
Fig.9 Proportion of microorganisms using glutamic acid to produce ammonia during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
(3)下沙、造沙堆积发酵过程中乙偶姻合成功能微生物解析
双乙酰还原酶是合成乙偶姻的关键酶,因此找到含双乙酰还原酶微生物,结果见图10。
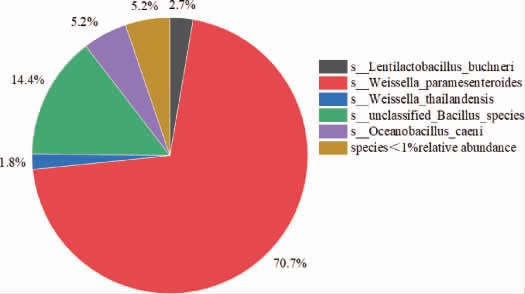
图10 酱香型白酒下沙、造沙堆积发酵过程中产双乙酰还原酶微生物在种水平占比
Fig.10 Proportion of diacetyl reductase-producing microorganisms during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
由图10可知,含有双乙酰还原酶(DR)基因的微生物,相对丰度>1%的有5种,分别是类肠膜魏斯氏菌(70.7%),unclassified Bacillus species(14.4%),淤泥大洋芽孢杆菌(5.2%),布氏迟缓乳杆菌(2.7%),泰国魏斯氏杆菌(1.8%)。其中类肠膜魏斯氏菌是利用双乙酰转化乙偶姻的主要微生物。
2,3-丁二醇脱氢酶是合成乙偶姻的关键酶,因此找到含2,3-丁二醇脱氢酶微生物,结果见图11。
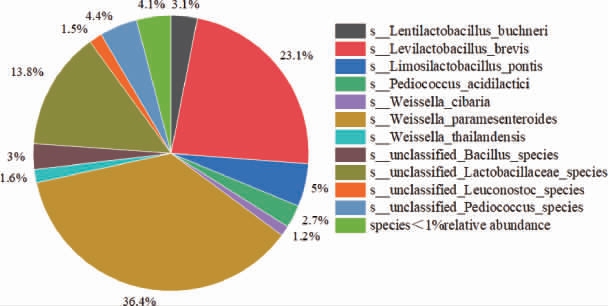
图11 酱香型白酒下沙、造沙堆积发酵过程中产2,3-丁二醇脱氢酶微生物在种水平占比
Fig.11 Proportion of 2,3-butanediol dehydrogenase-producing microorganisms during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
由图11可知,含有2,3-丁二醇脱氢酶(BDH)基因的微生物,相对丰度>1%的有11种,分别是类肠膜魏斯氏菌(36.4%),短促生乳杆菌(23.1%),unclassified Lactobacillaceae species(13.8%),桥粘液乳杆菌(5%),unclassified Pediococcus species(4.4%),布氏迟缓乳杆菌(3.1%),unclassified Bacillus species(3%),乳酸片球菌(2.7%),泰国魏斯氏杆菌(1.6%),unclassified Leuconostoc species(1.5%),食窦魏斯氏菌(1.2%)。其中通过2,3-丁二醇转乙偶姻的主要微生物有类肠膜魏斯氏菌和短促生乳杆菌。
α-乙酰乳酸合成酶是合成乙偶姻的关键酶,因此找到含α-乙酰乳酸合成酶微生物,结果见图12。由图12可知,含有α-乙酰乳酸合成酶(ALS)基因的微生物,相对丰度>1%的有15种,分别是类肠膜魏斯氏菌(24.8%)、短促生乳杆菌(15.8%)和unclassified Bacillus species(13.1%)、植物乳植物杆菌(6.9%)、戊糖片球菌(5.9%)、贝莱斯芽孢杆菌(4.4%)、unclassified Lactiplantibacillus species(4.4%)、乳酸片球菌(3.3%)等,其中类肠膜魏斯氏菌(24.8%)是α-乙酰乳酸转化为乙偶姻的主要微生物。
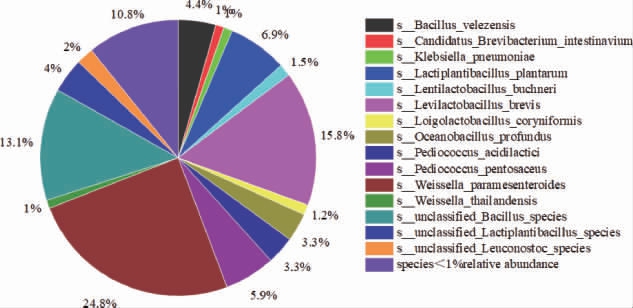
图12 酱香型白酒下沙、造沙堆积发酵过程中产α-乙酰乳酸合成酶微生物在种水平占比
Fig.12 Proportion of α-acetyllactate synthase-producing microorganisms during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
α-乙酰乳酸脱羧酶是合成乙偶姻的关键酶,因此找到含α-乙酰乳酸脱羧酶微生物,结果见图13。由图13可知,含有α-乙酰乳酸脱羧酶(ALDC)基因的微生物,其中相对丰度>1%的有9种,其中类肠膜魏斯氏菌(28.4%)、短促生乳杆菌(25%)和unclassified Lactiplantibacillus species(10.9%)是丙酮酸经α-乙酰乳酸合成乙偶姻的主要微生物。
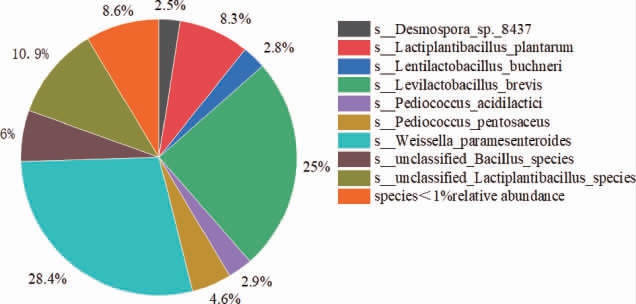
图13 酱香型白酒下沙、造沙堆积发酵过程中产α-乙酰乳酸脱羧酶微生物在种水平占比
Fig.13 Proportion of α-acetyllactate decarboxylase-producing microorganisms during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
综上所述,在下沙、造沙堆积发酵过程中产四甲基吡嗪功能微生物丰度占比较高的是,类肠膜魏斯氏菌(Weissella paramesenteroides)、短促生乳杆菌(Levilactobacillus brevis)、乳酸片球菌(Pediococcus acidilactici)、戊糖片球菌(Pediococcus pentosaceus)、索诺拉沙漠芽孢杆菌(Bacillus sonorensis)、象牙色克罗彭施泰特氏菌(Kroppenstedtia eburnean)、酿酒酵母菌(Saccharomyces cerevisiae)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)、unclassified Bacillus species、unclassified Lactiplantibacillus species。这些微生物通过产氨和乙偶姻的关键酶来提高四甲基吡嗪在酒醅中的含量。
2.2.3 下沙、造沙堆积发酵过程中产四甲基吡嗪功能微生物变化规律
在酱香型白酒下沙、造沙堆积发酵过程中,产四甲基吡嗪功能微生物丰度会随堆积发酵时间的进行发生变化,结果见图14。
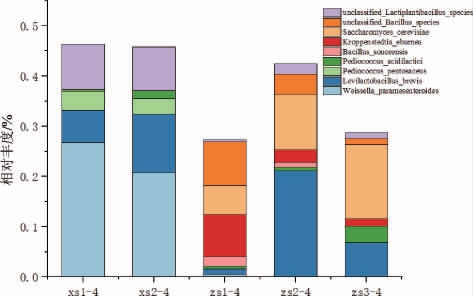
图14 酱香型白酒下沙、造沙酱香堆积发酵过程中产四甲基吡嗪功能微生物在种水平变化
Fig.14 Changes of tetramethylpyrazine-producing functional microorganisms during stacking fermentation in the 1st and the 2nd rounds of sauce-flavor Baijiu production at species level
在酱香白酒下沙、造沙堆积发酵过程中,堆积发酵酒醅中产四甲基吡嗪功能微生物主要为细菌,这也是所谓的白酒酿造过程中细菌产香的原因。其中下沙堆积发酵过程中产四甲基吡嗪功能微生物丰度较高的为类肠膜魏斯氏菌(Weissella paramesenteroides)、短促生乳杆菌(Levilactobacillus brevis)、戊糖片球菌(Pediococcus pentosaceus)、乳酸片球菌(Pediococcus acidilactici)和unclassified Lactiplantibacillus species;造沙堆积发酵过程中产四甲基吡嗪功能微生物丰度较高的为短促生乳杆菌(Levilactobacillus brevis)、乳酸片球菌(Pediococcus acidilactici)、索诺拉沙漠芽孢杆菌(Bacillus sonorensis)、象牙色克罗彭施泰特氏菌(Kroppenstedtia eburnea)、酿酒酵母菌(Saccharomyces cerevisiae)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)和unclassified Bacillus species。下沙堆积发酵过程产四甲基吡嗪功能微生物的丰度高于造沙,造沙堆积发酵初期产四甲基吡嗪功能微生物丰度降低原因可能是在下沙堆积发酵完成后,酒醅进行入窖发酵,入窖发酵期间,窖泥封窖造成窖内含氧量低,热量不易挥发,产酒微生物进行无氧代谢产生酒精,pH不断下降,造成芽孢杆菌等产四甲基吡嗪功能微生物生长繁殖受到抑制[30],在起窖之后,随着堆积发酵进行,酒醅中的产四甲基吡嗪微生物多样性上升,微生物种类多于下沙堆积发酵过程,多种微生物的共同作用下酒醅中的四甲基吡嗪含量可能会有明显提高。
3 结论
本研究以酱香白酒下沙、造沙堆积发酵酒醅为研究对象,利用宏全基因组测序技术对酒醅进行解析,在下沙、造沙堆积发酵过程中产四甲基吡嗪功能微生物相对丰度占比较高是类肠膜魏斯氏菌(Weissella paramesenteroides)、短促生乳杆菌(Levilactobacillus brevis)、乳酸片球菌(Pediococcus acidilactici)、戊糖片球菌(Pediococcus pentosaceus)、索诺拉沙漠芽孢杆菌(Bacillus sonorensis)、象牙色克罗彭施泰特氏菌(Kroppenstedtia eburnea)、酿酒酵母菌(Saccharomyces cerevisiae)、库德里阿兹威毕赤酵母(Pichia kudriavzevii)、unclassified Bacillus species、unclassified Lactiplantibacillus species。下沙阶段除乳酸片球菌略有增加外,其余功能微生物均减少;造沙阶段酿酒酵母菌逐渐增多,短促生乳杆菌在第二天最多,其余微生物占比较少。
酱香型白酒发酵过程是一个复杂的微生态系统,在产品形成过程中,酒醅微生物与代谢产物、酿造环境之间存在着复杂的生态学关系[31]。白酒生产过程中酿造环境参数的变化对微生物代谢产生重要影响,这些主要的经典参数有环境因素(如温度等)、理化因素(如总酸、氨基态氮、还原糖等)、化学因素(如乙醇、乙酸、乳酸等)[14]。在酱香型白酒发酵过程中,酿造环境影响因子对TTMP合成的影响可以进一步研究。
[1]GUO S,CHEN K,QIAN Z,et al.Tetramethylpyrazine in the treatment of cardiovascular and cerebrovascular diseases[J].Planta Med,1983,47(2):89-90.
[2]CHANG F,CHEN K,LIN J,et al.Effects of tetramethylpyrazine on portal hypertensive rats[J].J Pharm Pharmacol,1998,50(8):881-884.
[3]GUO M,LIU Y,SHI D.Cardiovascular actions and therapeutic potential of tetramethylpyrazine(active component isolated from rhizoma chuanxiong):roles and mechanisms[J].J Biomed Biotech,2016,24(8):1-9.
[4]CHYAU C,KO P,CHANG C,et al.Free and glycosidically bound aroma compounds in lychee(Litchi chinensis Sonn.)[J].Food Chem,2003,80(3):387-392.
[5]吴建峰.中国白酒中健康功能性成份四甲基吡嗪的研究综述[J].酿酒,2006,33(6):13-16.
[6]FAN W L, XU Y, ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[7]徐岩,范文来,王海燕,等.风味分析定向中国白酒技术研究的进展[J].酿酒科技,2010(11):73-78.
[8]WANG Q, ZHANG H X, LIU X.Microbial community composition as sociated with Maotai liquor fermentation[J].J Food Sci, 2016, 81(6):M1485-M1494.
[9]WANG H,HUANG Y G,HUANG Y L.Microbiome diversity and evolution in stacking fermentation during different rounds of Jiang-flavoured Baijiu brewing[J].LWT-Food Sci Technol,2021,143:111-119.
[10]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[11]KOSUGE T,ADACHI T,KAMIYA H.Isolation of tetramethylpyrazine from culture of Bacillus natto, and biosynthetic pathways of tetramethylpyrazine[J].Nature,2001,15(5):860-921.
[12]ZHU B F, XU Y, FAN W L.High-yield fermentative preparation of ramethylpyrazine by Bacillus sp.using an endogenous precursor approach[J].Microbiol Biotechnol,2010,37(10):179-186.
[13]CUI D Y,WEI Y N,LIN L C,et al.Increasing yield of 2,3,5,6-tetramethylpyrazine in Baijiu through Saccharomyces cerevisiae metabolic engineering[J].Front Microbiol,2020,11(13):596306.
[14]李豆南,黄魏,王晓丹,等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学,2018,39(6):171-176.
[15]DEMAIN A L,JACKSON M,TRENNER N R.Thiamine-dependent accumulation of tetramethylpyrazine accompanying a mutation in isoleucinevaline pathway[J].J Bacteriol,1967,2(1):323-326.
[16]BESSON I,CREULY C,GROS J B,et al.Pyrazine production by Bacillus subtilis in solid-state fermentation on soybeans[J].Appl Microbiol Biotechnol,1997,47(3):489-495.
[17]KIM K S,LEE H J,SHON D H,et al.Optimum conditions for the production of tetramethylpyrazine flavor compound by aerobic fedbatch culture of Lactococcus lactis subsp.lactis biovar.diacetilactis FC1[J].J Microbiol Biotechnol,1994,4(4):327-332.
[18]DENG Z S,ZHAO L F,KONG Z Y,et al.Diversity of endophytic bacteria within nodules of the Sphaerophysa salsula in different regions of Loess Plateau in China[J].Fems Microbiol Ecol,2011,76(3):463-475.
[19]戴奕杰,李宗军,田志强,等.酱香型白酒酿造过程中微生物及其代谢产物研究进展[J].酿酒科技,2018(11):85-96.
[20]ZHANG W Q, SI G R, LI J L, et al.Tetramethylpyrazine in Chinese sesame flavour liquor and changes during the production process[J].J I Brewing,2019,125(1):155-161.
[21]郎召伟.泸型酒酿造过程中风味物质变化分析[D].无锡:江南大学,2015.
[22]吕锡斌,吴耀领,郝飞,等.高通量测序技术分析酱香型白酒下造沙轮次的微生物多样性[J].酿酒科技,2019(3):52-58.
[23]张春林,杨亮,李喆,等.酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J].食品科技,2022,47(4):111-118.
[24]麻颖垚.宏基因组学对酱香型白酒第四轮次窖内发酵微生物代谢通路的研究[D].贵阳:贵州大学,2021.
[25]涂昌华,郝飞,汪地强,等.酱香型白酒下沙、造沙轮次堆积发酵过程中酒醅温度与微生物的变化规律分析[J].酿酒科技,2020(2):60-64.
[26]胡梓晴,刘晓艳,白卫东,等.高通量测序技术在白酒微生物多样性中的研究进展[J].中国酿造,2023,42(5):15-21.
[27]周恒刚.酱香型白酒生产工艺的堆积[J].酿酒科技,1999(1):5-7.
[28]徐岩,吴群,范文来,等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技,2011(7):37-40.
[29]谢三款.山西老陈醋四甲基吡嗪形成机制及代谢调控[D].天津:天津科技大学,2021.
[30]吴徐建.酱香型白酒固态发酵过程中酵母与细菌群落结构变化规律的研究[D].无锡:江南大学,2013.
[31]戴奕杰,李宗军,田志强,等.酱香型白酒酿造过程中微生物及其代谢产物研究进展[J].酿酒科技,2018(11):85-96.